借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法及系统与流程
本申请涉及借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法及系统。
背景技术:
:外泌体(exosome)作为血液、尿液、唾液等体液内大量存在的胞外囊泡(extracellularvesicles),是由所有细胞分泌并与细胞间相互作用、癌转移等多样生物学机制相关的物质。外泌体大小为30~200nm,由于细胞的内吞作用而在细胞内部形成多泡小体后,他们借助于胞吐作用而排出,从而生成,因而包含蛋白质和mirna等能够代表母细胞特性的物质。因此,外泌体可以以具有疾病细胞特性的状态存在于体液内,基于这种特性,可以用作癌诊断所需的生物标志物。另一方面,在光线照射于分子的情况下,在分子内发生能够显示出结合键的振动模式(vibrationalmode)特性的非弹性散射(inelasticscattering),将其称为拉曼散射(ramanscattering)。分子的振动模式根据分子内结合键的特性而出现,因而分子中出现的拉曼散射信号可以用作分子的指纹信息。但是,拉曼散射的频度是在100万个光子中只出现1个的程度,存在信号灵敏度非常低的缺点。表面增强拉曼光谱法(sers:surfaceenhancedramanspectroscopy)作为解决了普通拉曼光谱法的信号强度弱问题的方法,可以基于在等离子纳米结构体之间的纳米间隙出现的强电磁场,将分子的拉曼信号放大约107-108倍以上。在技术上,据悉该方法可以在毫微微克分子浓度水平的分子中实现单一分子水平的检测。如上所述,外泌体富含母细胞信息,在诊断医学领域用作液体活检所需的生物标志物而倍受瞩目。迄今正在进行应用多样生物物质检测技术来检测体液内存在的疾病外泌体的信息从而及早诊断或监控疾病的研究。特别是有望可以通过基于外泌体的液体活检方法,解决原有癌诊断方法具有的介入式诊断、高假阳性(falsepositive)、过度暴露于辐射线等问题。sers是一种能够以超高灵敏度获得外泌体表面表现的拉曼光谱信号的技术,因而对检测疾病特异性外泌体的特性有效。另外,sers是非标志式检测方法,因而可以省略用于只捕集目标标志的预处理过程,即使在低浓度试料中,也具有高信号灵敏度。但是,外泌体的sers信号由于单一外泌体间的异质成分构成、与作为探针的等离子纳米粒子的相互作用、附着面的物质分布等原因,检测到异质的信号,存在信号复杂的局限。为了解决这种局限,应用了主成分分析法(pca)、偏最小二乘法(pls-da)等方法,但患者体液内存在的癌外泌体处于与正常细胞来源外泌体混合存在的状态,因而不容易分析。技术实现要素:技术问题因此,相应
技术领域:
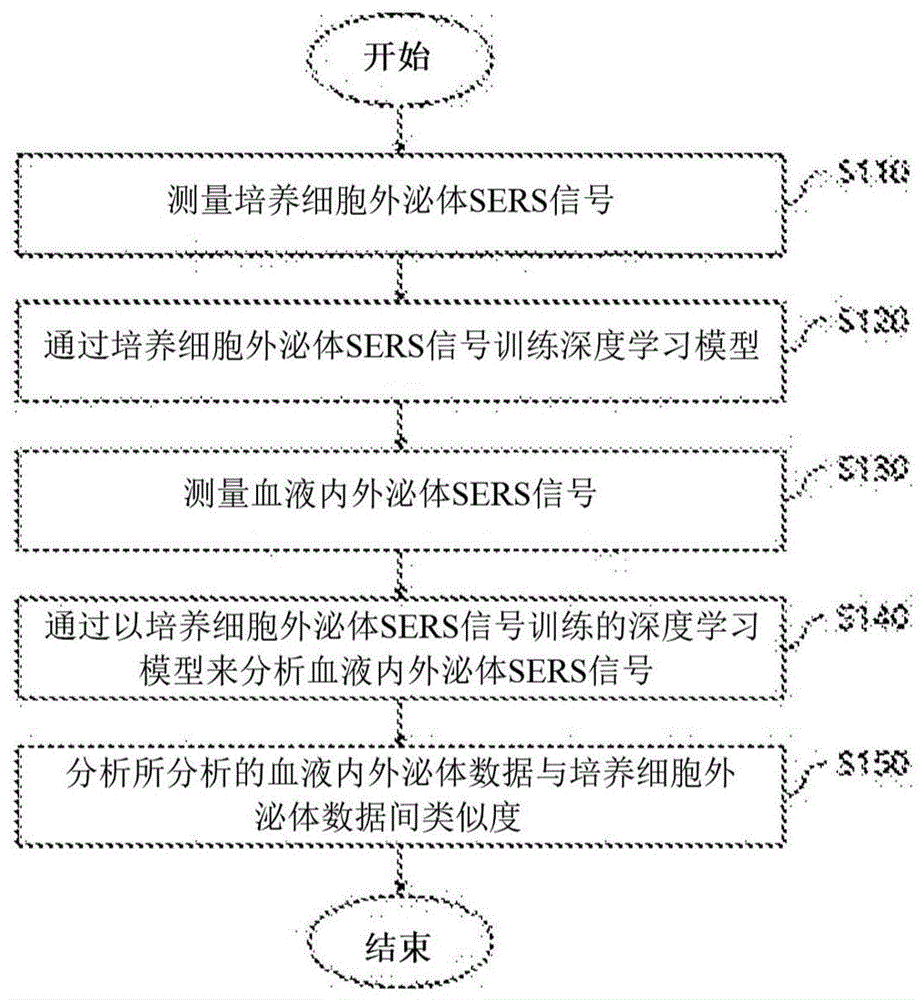
要求一种用于利用外泌体的sers信号来更准确地提供癌诊断信息的方案。技术方案为了解决所述课题,本发明的一个实施例提供一种借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法。所述借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法可以包括:测量培养细胞外泌体sers(surfaceenhancedramanspectroscopy)信号的步骤;通过所述培养细胞外泌体sers信号来训练深度学习模型的步骤;测量血液内外泌体sers信号的步骤;通过以所述培养细胞外泌体sers信号训练的深度学习模型来分析所述血液内外泌体sers信号的步骤;及分析通过所述深度学习模型而分析的血液内外泌体数据与培养细胞外泌体数据间类似度的步骤。另外,本发明的另一实施例提供一种借助于外泌体的基于人工智能的利用液体活检的癌诊断信息提供系统。所述借助于外泌体的基于人工智能的利用液体活检的癌诊断信息提供系统可以包括:学习数据输入部,所述学习数据输入部接受输入为了深度学习模型的训练而使用的培养细胞外泌体sers(surfaceenhancedramanspectroscopy)信号;患者数据输入部,所述患者数据输入部接受输入患者的血液内外泌体sers信号数据;深度学习模型,所述深度学习模型利用通过所述学习数据输入部而输入的培养细胞外泌体sers信号进行训练,分析通过所述患者数据输入部输入的血液内外泌体sers信号数据;及类似度分析部,所述类似度分析部分析通过所述深度学习模型而分析的血液内外泌体数据与培养细胞外泌体数据间类似度。另外,上述的技术方案并非罗列了本发明的全部特征。本发明的多种特征和由此带来的优点及效果,可以参照以下具体实施方式进行更详细的理解。技术效果根据本发明的一个实施例,通过人工智能分析复杂的外泌体的sers信号,从而可以克服以往的信号异质性局限。由此可以实现借助于外泌体的癌非介入式液体活检。另外,像x-ray、ct等一样存在辐射线暴露危险,或无需无介入式组织活检,仅以血液便能够实现癌诊断,不仅是癌的诊断,也可以用于患者的治疗监控。附图说明图1是本发明一个实施例的借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法的流程图。图2是用于说明本发明一个实施例的深度学习模型的图。图3是用于说明本发明一个实施例的数据分析步骤的图。图4是用于说明本发明一个实施例的类似度分析步骤的图。图5是图示根据本发明一个实施例而获得的正常细胞及肺癌细胞外泌体拉曼信号的图。图6是图示根据本发明一个实施例通过深度学习模型来对正常细胞及肺癌细胞外泌体拉曼信号进行分类的结果的图。图7是图示本发明一个实施例的数据训练后的准确度的图。图8是图示根据本发明一个实施例而获得的正常人及肺癌患者血液内外泌体拉曼信号的图。图9是根据本发明一个实施例而图示分析正常人及肺癌患者血液内外泌体拉曼信号的结果的图。图10是图示本发明一个实施例的借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法的roc曲线的图。图11是图示本发明一个实施例的借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法的灵敏度及特异度的图。图12是图示本发明一个实施例的利用借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法进行肺癌基数诊断的结果的图。图13是本发明另一实施例的借助于外泌体的基于人工智能的利用液体活检的癌诊断信息提供系统的构成框图。具体实施方式下面参照附图,详细说明优选实施例,以便本发明所属
技术领域:
的技术人员能够容易地实施本发明。不过,在详细说明本发明的优选实施例方面,在判断认为对相关公知功能或构成的具体说明可能不必要地混淆本发明的要旨时,省略其详细说明。另外,对于发挥类似功能及作用的部分,在全体附图中使用的相同的符号。而且,在本申请通篇说明书中,当说某种部分与其它部分“连接”时,这不仅是“直接连接”的情形,还包括在其中间,把其它元件置于其间而“间接连接”的情形。另外,所谓“包括”某构成要素,只要没有特别反对的记载,并非排除其它构成要素,意味着可以还包括其它构成要素。图1是本发明一个实施例的借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法的流程图。如果参照图1,本发明一个实施例的借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法可以包括:测量培养细胞外泌体sers信号的步骤s110;通过培养细胞外泌体sers信号训练深度学习模型的步骤s120;测量血液内外泌体sers信号的步骤s130;通过以培养细胞外泌体sers信号训练的深度学习模型来分析血液内外泌体sers信号的步骤s140;及分析通过深度学习模型分析的血液内外泌体数据与培养细胞外泌体数据间类似度的步骤s150。首先,在测量培养细胞外泌体sers信号的步骤s110中,可以测量来源于培养细胞的外泌体的sers信号。其中,培养细胞可以包括培养的正常细胞及癌细胞。根据一个实施例,为了外泌体的sers信号测量,可以使用利用盐而使80nm的球形金纳米粒子彼此凝集的结构。其中,相应结构可以在清洗的盖玻片上撒下浓缩的金纳米粒子,加入cuso4基的盐溶液,引起金纳米粒子凝集后进行干燥而制备。可以在如此制备的基板上涂覆107~109(粒子/ml)浓度的外泌体溶液,完全干燥后进行sers信号测量。在通过培养细胞外泌体sers信号训练深度学习模型的步骤s120中,可以利用测量的培养细胞外泌体sers信号,即利用分别来源于培养的正常细胞和癌细胞的正常细胞外泌体的sers信号及癌细胞外泌体的sers信号,训练深度学习模型。根据一个实施例,作为深度学习模型,可以使用应用残差网络(resnet)模型的模型。图2作为用于说明本发明一个实施例的深度学习模型的图,图2的(a)图示了残差网络模型,(b)图示了本发明实施例的应用残差网络模型的模型。图2的(a)所示的残差网络模型于2015年提出(he,kaiming,etal."deepresiduallearningforimagerecognition."proceedingsoftheieeeconferenceoncomputervisionandpatternrecognition.2016.),基本上是为了二维图像分析而开发的。根据本发明的实施例,将如图2的(a)所示的残差网络模型如图2的(b)所示进行修订,用于分析作为一维数据的sers信号数据。如果具体考查,图2的(a)所示的残差网络模型作为34层的残差网络模型,包括供数据输入的第一卷积层(conv、64、/2)、依次连接于第一卷积层的多个第二卷积层(conv、64)、第三卷积层(conv、128)、第四卷积层(conv、256)、第五卷积层(conv、512)、以及1个全连接层(flc:fullyconnectedlayer),第二至第五卷积层构成得每2个卷积层(convolutionallayer)添加跳跃连接(skipconnection),执行残差学习(residuallearning)。与之相比,图2的(b)所示的本发明实施例的深度学习模型对卷积层进行简化,包括供数据输入的第一卷积层(conv、64)、依次连接于第一卷积层的4个第二卷积层(conv、64)、4个第三卷积层(conv、128)、4个第四卷积层(conv、256)、4个第五卷积层(conv、512)、以及2个全连接层(fcl4096、fcl10),第二至第五卷积层每2个卷积层(convolutionallayer)添加跳跃连接(skipconnection)。其中,第二卷积层至第五卷积层包括的卷积层的个数不限于此,可以根据需要而变更。另外,位于深度学习模型末端的全连接层(fcl)包括具有4096个值的第一全连接层(fcl4096)和具有10个值的第二全连接层(fcl10),构成得具有所述第二全连接层(fcl10)连接于第一全连接层(fcl4096)的输出端的结构,最终可以将数据分类为正常外泌体与肺癌外泌体。在后述实施例中,在训练深度学习模型之前,sers信号数据例如通过最小最大标准化(min-maxnormalization)进行预处理,将475~2000cm-1范围的拉曼光谱用作数据。于是,在本发明实施例中,利用培养细胞,即利用正常细胞与癌细胞外泌体sers信号来训练深度学习模型,从而可以更准确地分类正常细胞与癌细胞的特性。在测量血液内外泌体sers信号的步骤s130中,可以测量患者的血液内存在的外泌体的sers信号。此时,可以利用在测量培养细胞外泌体sers信号的步骤s110中详细叙述内容相同的方式,测量血液内外泌体sers信号,关于此的重复说明省略。在通过以培养细胞外泌体sers信号训练的深度学习模型来分析血液内外泌体sers信号的步骤s140中,可以利用上述s120步骤中训练的深度学习模型来分析血液内外泌体sers信号。患者的血液内存在的外泌体由于是正常细胞来源外泌体与癌细胞来源外泌体混合存在的状态,因此难以象对培养细胞外泌体进行分类一样分类为二元分类(binaryclassification)。因此,根据本发明的实施例,提出一种如后所述不是利用最终二进制输出层而是利用作为此前一层的第二全连接层(fcl10)的信息的方法。图3是用于说明本发明一个实施例的数据分析步骤的图。如图3所示,fcl10作为全部经过前端的层(layer)后导出的值,具有10个数字值,如果利用训练的深度学习模型对血液内外泌体sers信号进行分类,则可以从fcl10导出10个值。在对所分析的血液内外泌体数据与培养细胞外泌体数据间类似度进行分析的步骤s150中,将对血液内外泌体sers信号进行分类而导出的fcl10值,与对培养细胞,即对正常细胞及癌细胞外泌体sers信号进行分类而导出的fcl10值分别进行比较,可以分析患者血液内外泌体数据与正常细胞和癌细胞外泌体数据中某数据是否类似。图4是用于说明本发明一个实施例的类似度分析步骤的图,为了便利,将从fcl10导出的10个值在二维上显示为模式图。根据一个实施例,血液内外泌体数据与培养细胞外泌体数据间类似度可以通过马哈拉诺比斯距离(mahalanobisdistance)计算。但是,本发明的类似度计算方法并非必须限定于此,可以应用用于对数据间的类似度进行定量的多样方法。具体而言,在图4的左侧所示的图中,如果计算血液内外泌体数据(humanexosomedata)与正常细胞外泌体数据(meanofnormalexosomes)及癌细胞外泌体数据(meanofcancerexosomes)之间的马哈拉诺比斯距离,则这可以显示出各数据间的不类似性(de-similarity)。其中,计算马哈拉诺比斯距离的方法是普通技术人员公知的事项,因而省略关于此的具体说明。根据本发明的实施例,可以根据下式算出血液内外泌体数据与癌细胞外泌体数据的相对类似性尺度(relativesimilaritytocancerexosome)。相对类似性尺度=血液内外泌体数据与正常细胞外泌体数据的马哈拉诺比斯距离dnormal/血液内外泌体数据与癌细胞外泌体数据的马哈拉诺比斯距离dcancer因此,根据本发明的实施例,提出经过上述过程导出的血液内外泌体数据与癌细胞外泌体数据的相对类似性尺度,从而可以将其用于癌诊断。下面,以将本发明应用于肺癌患者的实施例为中心进行说明。但是,并非本发明必须限定于此,例如,除肺癌之外,也可以同样应用于胰腺癌、乳腺癌、血癌患者等。图5是图示根据本发明一个实施例而获得的正常细胞及肺癌细胞外泌体拉曼信号的图,图示了从正常肺细胞(hpaec:humanpulmonaryalveolarepithelialcells)及3种肺癌细胞(pc9、h522、h1299)来源外泌体分别获得340个sers信号的情形。图6是根据本发明一个实施例图示通过深度学习模型来对正常细胞及肺癌细胞外泌体拉曼信号进行分类的结果的图。如果通过本发明实施例的深度学习模型来对正常细胞及肺癌细胞外泌体拉曼信号进行分类,则如图6所示,可以确认分类为正常细胞外泌体(normalexosome)及肺癌细胞外泌体(lungcancerexosome)。下表1显示出通过10-cv(10crossvalidation:10交叉验证)方式来验证本发明实施例的深度学习模型的结果。【表1】cv训练准确度(%)测试准确度(%)195642988339885495885958369677798518967099594109591平均9680验证结果,可以确认本发明实施例的深度学习模型以平均96%的准确度对训练的外泌体进行了分类,未训练的外泌体数据以平均80%的准确度进行了分类。图7是图示本发明一个实施例的数据训练后的准确度的图,在将全部数据均用于训练的情况下,可以确认表现出98%的分类准确度。图8是图示根据本发明一个实施例而获得的正常人及肺癌患者血液内外泌体拉曼信号的图,图示了从24名正常人(healthycontrol)和18名肺癌患者(nsclspatients)获得的外泌体sers信号数据的平均。以各单一数据为对象,如上所述经过基于深度学习模型的分析,可以分析与培养细胞外泌体数据的类似度。图9是根据本发明一个实施例而图示分析正常人及肺癌患者血液内外泌体拉曼信号的结果的图。图9的(a)及(b)分别将以24名正常人与18名肺癌患者为对象的每人50个外泌体数据的分析结果显示为热图(heatmap),越靠近红色,代表与肺癌细胞外泌体的相对类似性越大。如果参照图9的(a)及(b),可以确认,由于在肺癌患者的血液内也大量存在来源于正常细胞的外泌体,因而大多数外泌体数据表现得与肺癌细胞外泌体不同,但相比正常人,在肺癌患者外泌体数据中更多比率的外泌体表现得与肺癌细胞外泌体类似。图9的(c)是求出从一个人获得的50个外泌体数据的平均,以统计方式显示出该平均数据。可知相比正常人,肺癌患者中与肺癌细胞外泌体的类似度表现得更高,p值为0.000036,统计学差异非常显著。图10是图示本发明一个实施例的借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法的roc曲线的图。为了验证本发明上述实施例的深度学习模型的效果,显示出受试者判断特性曲线(roccurve:receiveroperationcharacteristiccurve)。roc曲线下的面积(auc:areaundercurv)越接近1,则代表有用性越大,本发明实施例的深度学习模型显示出0.89值。下表2显示出本发明实施例的深度学习模型与其他研究结果的auc值比较结果。【表2】作者方法auca.hulbert,et.al.基于pcr的dna甲基化检测0.77~0.89m.aslam,et.al.基于rcr的ctdna检测0.81y.ni,et.al.基于elisa的apelin检测0.81w.wang,et.al.循环mirna检测0.71~0.87本发明-0.89参照表2可知,根据本发明的实施例,在基于液体活检的肺癌诊断方法中,具有最高的有用性。结果,根据本发明的实施例,可以实现非常准确水平的诊断。图11是图示本发明一个实施例的借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法的灵敏度及特异度的图。基于从上述roc曲线导出的值,将诊断闭合点(cutoffline)设置为0.85时,灵敏度与特异度分别显示为约89%及88%。即,可知根据本发明的实施例,正常人与肺癌患者可以明确区分。图12是图示本发明一个实施例的利用借助外泌体的基于人工智能的利用液体活检的癌诊断信息提供方法进行肺癌基数诊断的结果的图,在图表中,越向右侧,基数越高。参照图12可知,随着癌基数的升高,与癌细胞外泌体的类似度越高,由此可以确认,上述本发明实施例也可以用于诊断癌基数。例如,可以以如下方式使用,即,按照癌基数,确定各阶段类似度基准值,参照图1,按照根据上述过程而导出的类似度所属区域,提供癌的基数信息。图13是本发明另一实施例的借助于外泌体的基于人工智能的利用液体活检的癌诊断信息提供系统的构成框图。如果参照图13,本发明另一实施例的借助于外泌体的基于人工智能的利用液体活检的癌诊断信息提供系统1000可以包括学习数据输入部1100、患者数据输入部1200、深度学习模型1300及类似度分析部1400而构成。学习数据输入部1100可以接受输入为了深度学习模型1300的训练而使用的外泌体sers信号数据。根据一个实施例,学习数据输入部1100可以接受输入分别来源于作为培养细胞的正常细胞及癌细胞的外泌体的sers信号。患者数据输入部1200可以接受输入要提供癌诊断信息的患者的血液内外泌体sers信号。深度学习模型1300可以首先利用通过学习数据输入部1100而输入的正常细胞及癌细胞外泌体sers信号来执行训练。另外,通过培养细胞外泌体sers信号而执行深度学习模型1300的训练后,深度学习模型1300可以分析通过患者数据输入部1200输入的血液内外泌体sers信号。类似度分析部1400可以分析通过深度学习模型1300而分析的血液内外泌体数据与培养细胞外泌体数据间的类似度。其中,上述各构成要素的具体构成及/或运转方法与上述内容相同,因而省略对此的重复说明。图13所示的癌诊断信息提供系统可以以可实现深度学习运算的计算设备体现。本发明并非限定于前述实施例及附图。在不超出本发明技术思想的范围内,可以置换、变形及变更本发明的构成要素,这对本发明所属
技术领域:
的普通技术人员而言是不言而喻的。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1