含有磷酸二酯酶抑制剂的调释片剂配制品的制作方法
1.本发明涉及用于磷酸二酯酶抑制剂口服施用的调释(modified release)片剂配制品。这些配制品可用于治疗、预防或缓解皮肤疾病或病症。
背景技术:
2.药物释放以及原料药的化学和物理特性等因素会影响获得最佳治疗的成功程度。
3.使用调释片剂配制品可以控制治疗剂的释放,从而控制药物从胃肠道的吸收。然而,通常很难预测特定的调释配制品是否会提供所需的释放曲线,并且通常发现有必要进行大量实验以获得具有所希望的效果的调释配制品。
4.磷酸二酯酶(pde)是催化细胞中的环amp和/或环gmp分别水解为5
‑
amp和5
‑
gmp的酶,因此它们对于camp或cgmp水平的细胞调控至关重要。磷酸二酯酶4(pde4)选择性针对camp。pde4是在免疫和炎症细胞例如中性粒细胞、巨噬细胞和t淋巴细胞中表达的camp的最重要的调节物。由于camp是调节炎性反应的关键第二信使,已发现pde4通过调节促炎细胞因子(例如,tnf
‑
α、il
‑
2、ifn
‑
γ、gm
‑
csf和ltb4)来调控炎症细胞的炎性反应。因此,抑制pde4已成为治疗例如哮喘、慢性阻塞性肺病、类风湿性关节炎、特应性皮炎、银屑病、炎症性肠病等炎性疾病的有吸引力的靶标(m.d.houslay等人,drug discovery today[今日药物发现]10(22),2005,第1503
‑
1519页)。
[0005]
pde4抑制剂与向患者施用时发现的不良反应有关,主要是胃肠道副作用,例如,恶心、腹泻和呕吐。
[0006]
在给予患者含有本发明的具有式(i)的pde4抑制剂的立即释放片剂的临床试验中,结果表明pde4抑制剂对中度至重度寻常型银屑病患者有效,但所经历的胃肠道相关不良事件的程度是不可接受的。
[0007]
因此,需要一种用于口服施用pde抑制剂的药物配制品,其可以维持全身性暴露并减少胃肠道不良事件。
[0008]
已发现,通过将pde4抑制剂配制于调释片剂配制品中,已经实现了如下有益效果,该效果是关于对胃肠道不良事件的改善的耐受性和维持不变的全身性暴露,其中体外释放与典型的调节释放曲线相比是快的,但还没有立即释放片剂(其中可见严重的耐受性问题)那么快。图1中的溶解目标区域说明了最佳区域。
技术实现要素:
[0009]
本发明的一个目的是提供用于口服施用pde抑制剂的调释片剂配制品,这些配制品可用于治疗、预防或缓解皮肤疾病或病症。
[0010]
本发明的另一个目的是提供一种用于口服施用pde抑制剂的调释片剂配制品,其示出如下有益效果,该效果是关于维持不变的全身性暴露和对减少的胃肠道不良事件的改善的耐受性。
[0011]
据推测,胃肠道不良事件的一个重要动因可能与肠道中pde4抑制剂的局部浓度有
关,并且pde4抑制剂的局部浓度较高可能导致胃肠道不良事件的水平上升。
[0012]
进入胃肠道后,如果pde4抑制剂能够缓慢释放和溶解,则可以防止在肠液中出现局部高浓度的pde4抑制剂。
[0013]
已经发现,当口服给予pde4抑制剂时,胃肠道上部存在非常窄的吸收窗。因此,为了维持全身性暴露,原料药从调释片剂配制品中的释放和溶解必须发生在胃肠道的上部。
[0014]
在一方面,本发明涉及一种用于口服施用pde抑制剂的调释片剂配制品,该配制品包含:
[0015]
(i)pde抑制剂;
[0016]
(ii)一种或多种药学上可接受的亲水性基质形成剂;
[0017]
(iii)一种或多种药学上可接受的赋形剂,该赋形剂选自由填充剂、助流剂和润滑剂组成的组;以及
[0018]
(iv)任选地,药学上可接受的包衣系统。
[0019]
在另一方面,本发明涉及一种调释片剂配制品,其中该pde抑制剂是pde4抑制剂。
[0020]
在另一方面,本发明涉及一种用于口服施用的调释片剂配制品,其中该pde4抑制剂是具有式(i)的化合物
[0021][0022]
或其药学上可接受的盐或多晶型形式。
[0023]
具有式(i)的化合物,2
‑
(3,5
‑
二氯
‑1‑
氧化
‑
吡啶
‑4‑
基)
‑1‑
(7
‑
二氟甲氧基
‑2′
,3
′
,5
′
,6
′‑
四氢
‑
螺[1,3
‑
苯并二氧杂环戊烯
‑
2,4
′‑
(4h)
‑
噻喃
‑1′
,1
′‑
二氧化物]
‑4‑
基)乙酮(以下称为化合物a),披露于wo 2011/160632,其涉及用作pde4抑制剂的苯并二氧杂环戊烯和苯并二氧杂环庚烯(benzodioxepene)杂环化合物,用于治疗、预防或缓解多种疾病,例如皮肤疾病或病症,例如增生性和炎性皮肤障碍、皮炎、银屑病、寻常型银屑病、特应性皮炎、脂溢性皮炎、接触性皮炎、癌症、表皮炎症、脱发、斑秃、皮肤萎缩、类固醇诱导的皮肤萎缩、皮肤老化、皮肤光老化、痤疮、荨麻疹、瘙痒和湿疹。
[0024]
化合物a应理解为包括该化合物的任何药学上可接受的形式和盐。化合物a可以以结晶形式或无定形形式存在。化合物a被认为是一种难溶性的化合物。化合物a及其盐以及合成该化合物的方法披露于wo 2011/160632、wo 2015/197534、wo 2017/103058和wo 2018/234299。
[0025]
在另一方面,本发明涉及一种用于口服施用pde4抑制剂的调释片剂配制品,以治疗、预防或缓解选自下组的皮肤疾病或病症,该组由以下各项组成:增生性和炎性皮肤障
碍、皮炎、银屑病、寻常型银屑病(斑块型银屑病)、特应性皮炎、脂溢性皮炎、接触性皮炎、癌症、表皮炎症、脱发、斑秃、皮肤萎缩、类固醇诱导的皮肤萎缩、皮肤老化、皮肤光老化、痤疮、荨麻疹、瘙痒和湿疹。
[0026]
在另一方面,本发明涉及一种用于口服施用pde4抑制剂的调释片剂配制品,以治疗、预防或缓解寻常型银屑病。
[0027]
在另一方面,本发明涉及一种用于口服施用pde4抑制剂的调释片剂配制品,以治疗、预防或缓解中度至重度寻常型银屑病。
[0028]
在另一方面,本发明涉及一种调释片剂配制品,其中体外释放与典型的调节释放曲线相比是快的,但还没有立即释放片剂那么快,如本技术的背景技术部分所说明。
[0029]
溶解速率将由几个因素决定,例如亲水性基质形成剂、赋形剂(填充剂和包衣)的类型和量以及原料药的粒径。
[0030]
在下面的描述中阐述了本发明的一个或多个实施例的细节。根据本说明书和权利要求书,本发明的其他特征、目的和优点将是显而易见的。
附图说明
[0031]
图1.说明溶解目标区域的图表;溶解方法:桨75rpm,900ml 0.1n hcl+0.5%sds,37℃hplc检测。
[0032]
图2和3中示出的曲线分别描述了,当通过第11页上所述的溶解方法参数进行测试时,化合物a从配制品f1和f2中的释放。
[0033]
图2.f1的溶解曲线。
[0034]
图3.f2的溶解曲线。
[0035]
图4.说明在受试者中存在胃肠道不良事件的图表,当每天两次,以调释片剂的形式,给予10mg、20mg或30mg本发明的具有式(i)的pde4抑制剂时发作;每个点代表一个胃肠道相关的不良事件,而条形代表不良事件的持续时间。
[0036]
图5.说明在受试者中存在胃肠道不良事件的图表,当每天两次,以立即释放片剂的形式,给予10mg、20mg或30mg本发明的具有式(i)的pde4抑制剂时发作;每个点代表一个胃肠道相关的不良事件,而条形代表不良事件的持续时间。
具体实施方式
[0037]
定义
[0038]
如在本说明书和所附权利要求中所使用的,下列术语具有指定的含义。
[0039]
如本文所用,短语“磷酸二酯酶”是指磷酸二酯酶(pde)中的一种或多种,其中pde4、pde7和pde8选择性针对camp。pde4是camp最重要的调节物。
[0040]
如本文所用,短语“pde抑制剂”可以是抑制pde的任何物质。优选地,pde抑制剂是人pde抑制剂。优选地,pde抑制剂是pde4抑制剂。例如,pde4抑制剂可以是化合物a或其药学上可接受的盐或多晶型形式,优选地是化合物a,而更优选地是化合物a的多晶型形式e。
[0041]
如本文所用,术语“治疗”包括改善症状、预防病情加重、维持减轻的病情、预防急性发作和预防复发。术语“预防”是指抑制症状的出现。
[0042]
术语“治疗”还可包括延迟疾病、障碍或病症的进展,改善、缓解或减轻症状和并发
症,和/或治愈或消除疾病、障碍或病症。
[0043]
如本文所用,术语“疾病”、“障碍”和“病症”可互换使用以指示不是人类正常生理状态的患者状态。
[0044]
本文使用的术语“亲水性基质形成剂”包括羟丙基甲基纤维素(hpmc)或羟丙基纤维素(hpc)。例如,该亲水性基质形成剂可以是羟丙基甲基纤维素或其混合物。
[0045]
如本文所用,术语“填充剂”包括乳糖,例如乳糖一水合物、含水或无水乳糖、微晶纤维素、甘露醇、异麦芽酮糖醇(isomalt)等。例如,该填充剂可以是乳糖一水合物、微晶纤维素或其混合物。
[0046]
如本文所用,术语“填充剂”也可用作粘合剂。
[0047]
如本文所用,术语“助流剂”包括胶态二氧化硅、滑石等。例如,该助流剂可以是胶态二氧化硅。
[0048]
如本文所用,术语“润滑剂”包括硬脂酸镁、硬脂富马酸钠、滑石粉等。例如,该润滑剂可以是硬脂酸镁。
[0049]
如本文所用,术语“包衣系统”包括基于hpmc的包衣系统、基于pva的包衣系统(聚乙烯醇)、基于pva
‑
peg的包衣系统(聚乙二醇)或基于乙基纤维素的功能性屏障膜包衣系统。例如,该包衣系统可以是基于pva的包衣系统。
[0050]
术语“约”在本文中用于表示大约、在该范围内、大致或大概。
[0051]
实施例
[0052]
调释片剂配制品的实施例可包括以下特征中的一种或多种。
[0053]
在调释片剂配制品的一个实施例中,pde抑制剂是pde4抑制剂。
[0054]
在另一个实施例中,pde4抑制剂是均匀分布的。
[0055]
在另一个实施例中,pde4抑制剂是微粉化的。
[0056]
在另一个实施例中,pde4抑制剂是结晶的和微粉化的。
[0057]
在调释片剂配制品的另一个实施例中,pde4抑制剂是化合物a。
[0058]
在另一个实施例中,pde4抑制剂是化合物a,而优选地,是化合物a的多晶型形式e。
[0059]
在另一个实施例中,化合物a是微粉化的。在另一个实施例中,化合物a的多晶型形式e是微粉化的。
[0060]
在另一个实施例中,化合物a是均匀分布的。在另一个实施例中,化合物a的多晶型形式e是均匀分布的。
[0061]
在另一个实施例中,化合物a是结晶的和微粉化的。
[0062]
在另一个实施例中,化合物a的多晶型形式e是结晶的和微粉化的。
[0063]
在另一个实施例中,调释片剂配制品可包含亲水性基质形成剂或其混合物。例如,该亲水性基质形成剂可以是羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)或其混合物。例如,该亲水性基质形成剂可以是羟丙基甲基纤维素和其混合物。
[0064]
亲水性基质形成剂可以以约10%w/w至约30%w/w的hpmc的各种浓度和组合存在,例如约15%w/w至约25%w/w hpmc,以及特别地,17.5%w/w hmpc。
[0065]
在另一个实施例中,调释片剂配制品可包含一种或多种选自乳糖一水合物、含水或无水乳糖、微晶纤维素及其混合物的填充剂/粘合剂。例如,该填充剂可以是乳糖一水合物。
[0066]
填充剂可以以约30%w/w至约78%w/w的乳糖一水合物和约0至约40%w/w的微晶纤维素的各种浓度存在。例如,该填充剂可以是71%w/w的乳糖一水合物。
[0067]
在另一个实施例中,调释片剂配制品可包含一种或多种助流剂。例如,该助流剂可以是胶态二氧化硅。
[0068]
助流剂可以以约0.1%w/w至约2%w/w的胶态二氧化硅的各种浓度存在,例如约0.2%w/w至约1%w/w,以及特别地,0.5%w/w。
[0069]
在另一个实施例中,调释片剂配制品可包含一种或多种润滑剂。例如,该润滑剂可以是硬脂酸镁。
[0070]
润滑剂可以以约0.1%w/w至约2%w/w的硬脂酸镁的各种浓度存在,例如约0.5%w/w至约1.5%w/w,以及特别地,1.0%w/w。
[0071]
在另一个实施例中,调释片剂配制品可包含片芯的薄膜包衣。
[0072]
在另一个实施例中,包衣系统可以是基于pva的包衣系统。例如,该包衣系统可以是ii。例如,该包衣系统可以以片剂配制品的约3%至约5%重量增加的量存在,以及特别地,4%重量增加。
[0073]
在本发明的另一个实施例中,pde抑制剂的粒径分布可以为:d
50
≤25μm,例如d
50
≤20μm、d
50
≤10μm、d
50
≤5μm或d
50
≤3μm。
[0074]
在另一个方面,pde抑制剂的量可以在约5mg至约60mg的范围内。该pde抑制剂的量可以例如,在10mg至50mg、20mg至45mg和30mg至40mg的范围内。
[0075]
在另一个方面,本发明涉及一种治疗寻常型银屑病的方法。该方法包括向有需要的患者施用含有pde抑制剂的调释片剂配制品。
[0076]
在另一个方面,本发明涉及在有需要的患者中治疗寻常型银屑病的方法,该方法包括施用含有浓度为10mg的化合物a的调释片剂配制品。
[0077]
在另一个方面,本发明涉及在有需要的患者中治疗寻常型银屑病的方法,该方法包括施用含有浓度为30mg的化合物a的调释片剂配制品。
[0078]
在另一个方面,本发明涉及在有需要的患者中治疗寻常型银屑病的方法,该方法包括每天两次施用含有浓度为30mg的化合物a的调释片剂配制品。
[0079]
在本发明的另一个方面,提供了一种制备该调释片剂配制品的方法,其中该制造方法包括原料药和赋形剂的混合和筛分步骤,然后直接压制或碾压然后压制,以及最后任选地进行包衣。
[0080]
在另一个方面,本发明可涉及一种颗粒状混合配制品,该配制品包含本发明的pde抑制剂;一种或多种药学上可接受的亲水性基质形成剂;一种或多种药学上可接受的赋形剂,其选自由填充剂、粘合剂、助流剂和润滑剂组成的组;以及硬胶囊壳材料。
[0081]
亲水性基质形成剂可以是羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)或其混合物。亲水性基质形成剂可以以约10%w/w至约20%w/w hpmc的各种浓度和组合存在。
[0082]
填充剂/粘合剂可以选自乳糖一水合物、含水乳糖或微晶纤维素及其混合物。填充剂/粘合剂可以以约20%w/w至约75%w/w的乳糖一水合物和0至约50%w/w的微晶纤维素的各种浓度存在。
[0083]
助流剂可以是胶态二氧化硅,其可以以约0.1%w/w至约2%w/w的各种浓度存在。
[0084]
润滑剂可以是硬脂酸镁,其可以以约0.1%w/w至约2%w/w的各种浓度存在。
[0085]
混合配制品可以分配在硬胶囊中。硬胶囊的胶囊壳材料可由若干种材料制成,例如,明胶(猪、牛、鱼等),可以应用羟丙基甲基纤维素(hpmc)、聚乙烯醇、淀粉和短梗霉聚糖(pullulan)。
[0086]
颗粒状混合配制品的制造方法可以包括原料药和赋形剂的混合和筛分步骤,然后是造粒(例如,碾压),和封装。
[0087]
实例
[0088]
实例1
[0089]
调释片剂配制品
[0090]
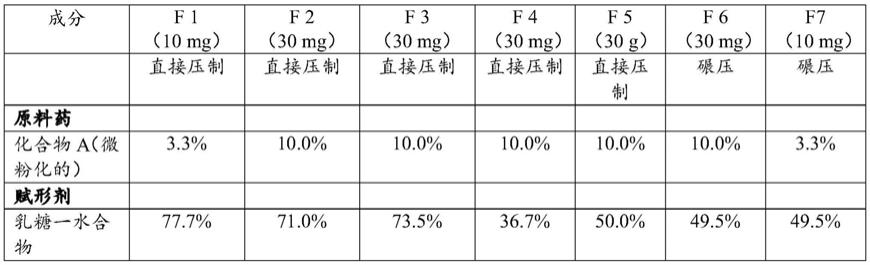
表1. 10mg和30mg剂量强度的调释片剂配制品(f)(以%w/w表示)。
[0091][0092][0093]
实例2
[0094]
配制品f1和f2的溶解曲线
[0095]
通过体外溶解方法研究化合物a从调释片剂的释放,见下文。
[0096]
溶解方法:
[0097]
溶解装置:usp/ph.eur.app.ii(桨)
[0098]
75rpm,900ml 0.1n hcl+0.5%sds,37℃,hplc检测。
[0099]
调释配制品f1
[0100]
溶解:声明量的百分比
[0101][0102]
图2示出了f1的溶解曲线
[0103]
调释配制品f2
[0104]
溶解:声明量的百分比
[0105][0106]
图3示出了f2的溶解曲线
[0107]
实例3
[0108]
在口服剂量临床试验中,以本发明的调释片剂配制品的形式,给予健康受试者具有式(i)的pde4抑制剂。受试者每天两次接受以下剂量:在第1
‑
2天10mg具有式(i)的化合物,在第3
‑
4天20mg具有式(i)的化合物,在第5
‑
6天30mg具有式(i)的化合物,在第7
‑
8天40mg具有式(i)的化合物,在第9
‑
10天50mg具有式(i)的化合物,以及在第11
‑
17天60mg具有式(i)的化合物。
[0109]
如图4所示,在受试者中收集,与当给予10mg、20mg或30mg具有式(i)的pde4抑制剂时发作相关的胃肠道不良事件。
[0110]
将此调释片剂配制品研究的结果(图4)与之前完成的具可比性的口服剂量临床试验的结果进行比较,在后者中,以立即释放片剂配制品的形式,给予健康受试者本发明的具有式(i)的pde4抑制剂。
[0111]
在立即释放片剂配制品研究中,受试者每天两次接受以下剂量:在第1
‑
3天10mg本发明的具有式(i)的pde4抑制剂,在第4
‑
6天20mg具有式(i)的化合物,以及在第7
‑
13天30mg具有式(i)的化合物。在受试者中收集,与当给予10mg、20mg或30mg具有式(i)的pde4抑制剂时发作相关的胃肠道不良事件。图5示出的结果证明,立即释放片剂配制品的耐受性很差。
[0112]
当将图4中示出的结果(当给予含有具有式(i)的pde4抑制剂的调释片剂时受试者中存在胃肠道相关不良事件)与图5中示出的结果(当给予含有具有式(i)的pde4抑制剂的立即释放片剂时受试者中存在胃肠道相关不良事件)进行比较时,调释片剂配制品研究表明,与立即释放片剂相比,胃肠道不良事件的总数在临床上显著降低。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1