含有通过酯键固定药物的配体的利用超声波造影剂的超声波引导药物传输体的制作方法
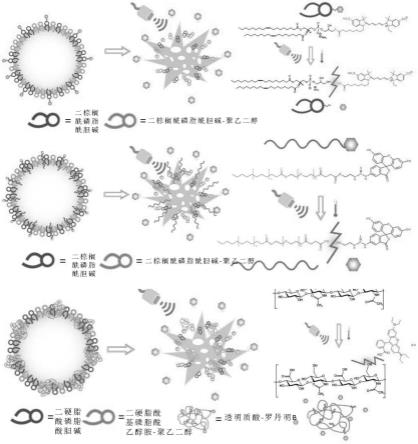
1.本发明涉及一种包含通过酯键与药物结合的配体、磷脂以及聚乙二醇化(pegylation)磷脂的超声波引导药物传输体;包含上述药物传输体的药物传输用组合物;包括将上述组合物向除人类之外的对象进行给药的步骤以及通过向上述组合物的给药部位照射超声波而对药物进行释放的步骤的疾病预防或治疗方法。
背景技术:
2.药物传输系统(drug delivery system)的目的在于通过将药物选择性地传输到标靶部位并根据疾病长时间地对有效血中浓度进行优化而将治疗效能以及效果极大化并将药物副作用最小化。为了提升如上所述的药物传输系统的标靶传递效率,目前正在多个方面开展如与多种不同的标靶配体结合、通过照射近红外线而控制药物释放速度、借助于超声波提升渗透能力等旨在将药物传递极大化的相关研究,但是仍然需要开发出一种可以在目标部位通过调节释放出适量药物的优秀的药物传输技术。
3.为此,本发明的发明人为了开发出一种可以通过高效率地释放出适量的药物而将药物的效果极大化的药物传输系统,经过不懈的努力,确认了包含通过酯键与药物结合的配体(磷脂、生物材料或两性材料)、磷脂以及聚乙二醇化(pegylation)磷脂的超声波引导药物传输体可以形成微/纳米气泡,而且在照射超声波时通过气泡的崩塌以及酯键的水解促进而加速药物释放,从而完成了本发明。
4.专利内容
5.本发明的目的在于提供一种解决如上所述的问题以及与其相关的其他问题。
6.本发明的一示例性目的在于提供一种包含通过酯键与药物结合的配体、磷脂以及聚乙二醇化(pegylation)磷脂的超声波引导药物传输体。
7.本发明的另一示例性目的在于提供一种包含上述药物传输体的药物传输用组合物。
8.本发明的又一示例性目的在于提供一种疾病预防或治疗方法,包括:将上述组合物向除人类之外的对象进行给药的步骤;以及,通过向上述组合物的给药部位照射超声波而对药物进行释放的步骤。
9.本说明书中所公开的发明之技术思想拟达成的技术课题并不限定于用于解决在上述内容中提及的问题的技术课题,一般的技术人员将可以通过下述记载进一步明确理解未被提及的其他技术课题。
10.接下来,将对本发明进行具体说明。其中,在本技术中所公开的各个说明以及实施形态也可以适用于其他各个说明以及实施形态。即,本技术中所公开的各种要素的所有组合均包含于本技术的范畴之内。此外,并不能理解为本发明的范畴限定于在下述内容中记述的具体的说明。
11.为了达成如上所述的目的,本发明的一方面提供一种包含通过酯键与药物结合的
配体、磷脂以及聚乙二醇化(pegylation)磷脂的超声波引导药物传输体。上述配体可以是磷脂、生物材料或两性材料,在本发明中上述通过酯键与药物结合的配体可以在制造之后与磷脂一起选择性地附着在微/纳米气泡的界面上。
12.在本发明中,术语“生物材料(biomaterial)”包括与生物系统进行相互作用的所有材料、表面以及结构体,本发明的生物材料可以包括如羟基(hydroxy group)或羧基(carboxy group)等可通过酯键与药物或荧光染料结合的化学结构,可以是适合于形成微/纳米气泡形态的药物传输体的结构。具体来讲,上述生物材料可以是蛋白质或生物相容性聚合物,例如,上述蛋白质可以是明胶(gelatin)、胶原蛋白(collagen)、纤维蛋白(fibrin)、谷蛋白(gluten)、弹性蛋白(elastin)或白蛋白(牛血清白蛋白(bovine serum albumin,bsa),人血清白蛋白(human serum albumin,hsa)),具体来讲,可以是白蛋白,但是并不限定于此。此外,上述生物相容性聚合物可以是海藻酸(alginic acid)、果胶(pectin)、甲壳素(chitin)、角叉菜胶(carrageenin)、结冷胶(gellan gum)、羧甲基纤维素(carboxymethyl cellulose)、右旋糖酐(dextran)、聚(己内酯)(poly(caprolactone),pcl)、聚(乳酸)(poly(lactic acid),pla)、聚(乙醇酸)(poly(glycolic acid),pga)、聚(乙烯醇)(poly(vinyl alcohol),pva)、聚(丙烯酸)(poly(acrylic acid),paa)或透明质酸(hyaluronic acid)等,具体来讲,可以是透明质酸,但是并不限定于此。
13.在本发明中,尤其是通过酯键连接到透明质酸的药物在生理条件(ph 7.1至7.4)下的水解反应进行的非常缓慢,因此所释放出的药物无法呈现出效果,但是在对药物传输体进行给药之后向给药部位照射超声波时,可以借助于物理性刺激以及所上升的高温/高压而对水解反应进行加速并使得药物释放速度达到10-100倍以上,从而可以释放出足以在目标部位呈现出明显效果的足够程度的药物。
14.在本发明中,术语“两性材料”是指在一个物质或化合物内同时包含亲水性(hydrophilic)部分以及疏水性(hydrophobic)部分的物质或化合物,具体来讲,可以是疏水性部分即烷基和亲水性部分即聚乙二醇(peg,polyethylene glycol)通过酯键结合的产物。具体来讲,上述疏水性烷基可以是碳原子数为5至30的链状烷基,而上述聚乙二醇(peg)的化学式结构可以是(x=6至50)。此外,本发明的两性材料包括如羟基(hydroxy group)或羧基(carboxy group)等可通过酯键与药物或荧光染料结合的化学结构,可以是适合于形成微/纳米气泡形态的药物传输体的结构。
15.在本发明中,尤其是通过酯键连接到两性材料的药物在生理条件(ph 7.1至7.4)下的水解反应进行的非常缓慢,因此所释放出的药物无法呈现出效果,但是在对药物传输体进行给药之后向给药部位照射超声波时,可以借助于物理性刺激以及所上升的高温/高压而对水解反应进行加速并使得药物释放速度达到10-100倍以上,从而可以释放出足以在目标部位呈现出明显效果的足够程度的药物。
16.在本发明中,“磷脂(phospholipid)”是作为生物膜的主要成分包含磷的脂质的一种,具有在甘油中结合两个脂肪酸以及一个磷酸基的结构。根据结合到磷酸基的有机物的类型,其类型也将发生变化,结合脂肪酸的方向可以呈现出疏水性而结合磷酸基的方向可以呈现出亲水性。
17.具体来讲,在本发明中上述磷脂可以是从由二棕榈酰磷脂酰胆碱(dppc)、二油酰
基磷脂酰胆碱(dopc)、二硬脂酰磷脂酰胆碱(dspc)、二肉豆蔻酰磷脂酰胆碱(dmpc)、双癸酰磷脂酰胆碱(ddpc)、二月桂酰磷脂酰胆碱(dlpc)、二肉豆蔻酰基磷脂酰乙醇胺(dmpe)、二棕榈酰基磷脂酰乙醇胺(dppe)、二硬脂酰基磷脂酰乙醇胺(dspe)、二油基磷脂酰乙醇胺(dope)、二花生酰基磷脂酰乙醇胺(dape)、二亚油基磷脂酰乙醇胺(dlpe)、二棕榈酰磷脂酰甘油(dppg)、二月桂酰磷脂酰甘油(dlpg)、二硬脂酰磷脂酰甘油(dspg)、二油酰磷脂酰甘油(dopg)、磷脂酰胆碱(pc)以及鸡蛋磷脂酰胆碱(epc)构成的组中选择的一个以上,具体来讲,可以是二棕榈酰磷脂酰胆碱(dppc)或二硬脂酰基磷脂酰乙醇胺(dspe),但是并不限定于此。
18.在本发明中,尤其是通过酯键连接到磷脂的药物在生理条件(ph7.1至7.4)下的水解反应进行的非常缓慢,因此所释放出的药物无法呈现出效果,但是在对药物传输体进行给药之后向给药部位照射超声波时,可以借助于物理性刺激以及所上升的高温/高压而对水解反应进行加速并使得药物释放速度达到10-100倍以上,从而可以释放出足以在目标部位呈现出明显效果的足够程度的药物。
19.在本发明中,术语“超声波”是指频率超过20khz的声波,在本发明的目的上,只要可以在照射到微/纳米气泡药物传输体时可以使气泡崩塌并形成物理性刺激以及高温/高压而轻易地释放出药物或荧光染料就不受到特殊的限定,例如,可以是指聚焦超音波。
20.此外,本发明的药物传输体的特征在于,包含通过酯键与药物结合的配体、磷脂以及聚乙二醇化(pegylation)磷脂,可以形成直径为0.2至10μm的微气泡或纳米气泡(microbubbles or nanobubbles),而在向上述药物传输体照射超声波的情况下,通过物理性刺激和因为气泡的崩塌而形成的高温/高压以及因此而诱发的配体-药物之间的酯键水解的促进,可以对药物的释放进行加速。
21.在本发明中,“药物”可以包含化合物、蛋白质医药品、肽医药品、基因治疗用核酸分子、纳米粒子、功能性化妆品有效成分或以美容目的使用的有效成分,在本发明的目的上,只要可以通过酯键与上述配体结合就不受到特殊的限定。具体来讲,本发明的药物可以通过酯键与构成上述药物传输体的配体的羟基(hydroxy group)或羧基(carboxy group)直接结合,或者通过导入一般的技术人员用于实现配体以及药物之间的酯键的本行业的适当的连接(linker)化合物结合。
22.在本发明的药物为疏水性药物的情况下,也可以通过基于磷脂方向的亲水性/疏水性性质差异在药物传输体的内部担载药物,本发明的药物传输体的特征在于,可以稳定地对大多数的疏水性药物进行担载和传输。
23.具体来讲,上述药物包含如抗癌剂、抗炎剂、镇痛剂、抗关节炎剂、抗痉挛剂、抗抑郁剂、抗精神病药物、神经稳定剂、抗焦虑剂、麻醉药拮抗剂、抗帕金森病药物、胆碱能激动剂、抗血管生成抑制剂、免疫抑制剂、抗病毒剂、抗生剂、食欲抑制剂、抗胆碱剂、抗组胺剂、抗偏头痛剂、激素剂、冠状血管或脑血管或末梢血管扩张剂、避孕药、抗血栓剂、利尿剂、抗高血压剂、心血管疾病治疗剂、美容成分(例如皱纹改善剂、皮肤老化抑制剂以及皮肤美白剂)等,但是并不限定于此。例如,上述药物可以是如阿霉素(doxorubicin)、紫杉醇(paclitaxel)、长春新碱、柔红霉素(daunorubicin)、长春碱(vinblastine)、放线菌素-d(actinomycin-d)、多西他赛(docetaxel)、依托泊苷(etoposide)、替尼泊苷(teniposide)、比生群(bisantrene)、高三尖杉酯碱(homoharringtonine)、格列卫(gleevec;sti-571)、顺
铂(cisplatin)、5-氟尿嘧啶(5-fluorouracil)、阿霉素(adriamycin)、甲氨蝶呤(methotrexate)、白消安(busulfan)、苯丁酸氮芥(chlorambucil)、环磷酰胺(cyclophosphamide)、美法仑(melphalan)、氮芥(nitrogen mustard)、亚硝基脲(nitrosourea)或喜树碱(camptothecin)等药物,但是并不限定于此。
24.此外,上述药物传输体还可以向配体或磷脂表面追加导入靶向剂(靶向物质),并借此进一步提升在照射超声波时的药物释放效率。在本发明中,上述“靶向剂”是对标靶特异性的分子,可以是对特定标靶特异性的抗体或抗体片段或适体。上述靶向剂被设计成与包括器官、组织、细胞以及受体在内的标靶特异性结合。借此,通过使上述靶向剂特异性地结合到与特定疾病相关的表达受体,可以使本发明的药物传导体与标靶特异性结合,从而释放出通过酯键结合的药物并将其传递到标靶内部。
25.为了达成如上所述的目的,本发明的另一方面提供一种包含上述药物传输体的药物传输用组合物。上述术语即生物材料、两性材料、磷脂、超声波以及药物的含义如上所述。
26.为了达成如上所述的目的,本发明的又一方面提供一种疾病预防或治疗方法,包括:将上述组合物向除人类之外的对象进行给药的步骤;以及,通过向上述组合物的给药部位照射超声波而对药物进行释放的步骤。
27.在本发明中,术语“对象”是指为了疾病的预防或治疗而将本发明的药物传输体或药物传输体组合物进行给药的包括人类在内的所有动物,具体来讲,可以是包括人类在内的所有哺乳动物,但是并不限定于此。
28.在本发明中,术语“给药”是指将上述药物传输体或药物传输用组合物以适当的方法导入到对象,作为给药路径,只要可以到达目标部位,就可以通过任意一般的路径进行给药。具体来讲,可以采用腹腔内给药、静脉内给药、肌内给药、皮下给药、皮内给药、经口给药、局部给药、鼻内给药、肺内给药、直肠内给药,但是并不限定于此。
29.在本发明中,术语“疾病”可以是指包括脑肿瘤在内的多种脑部疾病以及人体内的所有恶性肿瘤(癌症),但是并不限定于此。
30.具体来讲,上述癌症可以是假性粘液瘤、肝内胆道癌、肝母细胞瘤、肝癌、甲状腺癌、结肠癌、睾丸癌、骨髓增生异常综合症、胶质母细胞瘤、口腔癌、唇癌、蕈样肉芽肿、急性骨髓白血病、急性淋巴细胞白血病、基底细胞癌、卵巢癌、卵巢生殖细胞癌、男性乳腺癌、脑肿瘤、垂体腺瘤、多发性骨髓瘤、胆囊癌、胆道癌、大肠癌、慢性粒细胞白血病、慢性淋巴细胞白血病、视网膜母细胞瘤、脉络膜黑色素瘤、弥漫性巨b细胞淋巴瘤、壶腹癌、膀胱癌、腹膜癌、甲状旁腺癌、肾上腺癌、副鼻窦癌、非小细胞肺癌、非霍奇金淋巴瘤、舌癌、星形细胞瘤、小细胞肺癌、小儿脑癌、小儿淋巴瘤、小儿白血病、小肠癌、脑膜瘤、食道癌、神经胶质瘤、神经母细胞瘤、肾盂癌、肾癌、心脏癌、十二指肠癌、恶性软组织癌、恶性骨癌、恶性淋巴瘤、恶性间皮细胞瘤、恶性黑素瘤、眼癌、外阴癌、输尿管癌、尿道癌、原发部位不明癌、胃淋巴瘤、胃癌、胃类癌瘤、胃肠道间质癌、维尔姆斯癌、乳腺癌、肉瘤、阴茎癌、咽癌、妊娠绒毛病、宫颈癌、子宫内膜癌、子宫肉瘤、前列腺癌、转移性骨癌、转移性脑癌、纵膈癌、直肠癌、直肠类癌瘤、阴道癌、脊髓癌、前庭神经鞘瘤、胰腺癌、涎腺癌、卡波西肉瘤、派杰氏病、扁桃体癌、鳞状细胞癌、肺腺癌、肺癌、肺鳞状细胞癌、皮肤癌、肛门癌、横纹肌肉瘤、喉癌、胸膜癌或胸腺癌,但是并不限定于此。
31.在本发明中,包含通过酯键与药物结合的配体、磷脂以及聚乙二醇化
(pegylation)磷脂的超声波引导药物传输体可以形成微/纳米气泡,而且在照射超声波时可以通过气泡的崩塌以及酯键的水解促进而加速药物释放,从而将药物高效率地传递到目标部位。
32.但是,适用本说明书中所公开技术之一实施例的效果并不限定于在上述内容中提及的效果,一般的技术人员将可以通过下述记载进一步明确理解未被提及的其他效果。
附图说明
33.图1是对在向本发明的各个药物传输体照射超声波时因为高温以及高压的形成而促进磷脂以及药物之间的酯键的水解并借此加速药物释放的过程进行图示的模式图。
34.图2是对在本发明的药物传输体中磷脂与药物(紫杉醇,paclitaxel)或模型药物(荧光素,fluorescein、青色素5,cyanine5、罗丹明b,rhodamine b)通过酯键连接的化学结构进行图示的示意图。
35.图3是对在本发明中通过酯键与药物(紫杉醇,pacilitaxel)结合的磷脂的合成方法进行概要性图示的示意图。
36.图4是对在本发明中通过酯键与模型药物(罗丹明b,rhodamine b)结合的磷脂的合成方法进行概要性图示的示意图。
37.图5是对在本发明中通过酯键与药物(甲氨蝶呤,methotrexate)结合的两性材料(疏水性烷基-聚乙二醇(peg))的合成方法进行概要性图示的示意图。
38.图6是对在本发明中通过酯键与模型药物(荧光素,fluorescein)结合的两性材料(疏水性烷基-聚乙二醇(peg))的合成方法进行概要性图示的示意图。
39.图7是对在本发明的药物传输体中生物材料(透明质酸,ha)与药物(甲氨蝶呤,methotrexate、紫杉醇,pacilitaxel、阿霉素,doxorubicin)或模型药物(罗丹明b,rhodamine b)通过酯键连接的化学结构进行图示的示意图。
40.图8是对在本发明的药物传输体中蛋白质(白蛋白)的3维结构与药物(阿霉素,doxorubicin或甲氨蝶呤,methotrexate)通过酯键连接的结构进行图示的示意图。
41.图9中的a是对在本发明中通过酯键与药物(甲氨蝶呤,methotrexate)结合的生物材料(透明质酸,ha)的合成方法进行概要性图示的示意图,图9中的b是合成前/后的生物材料的核磁共振(nmr)以及紫外-可见(uv-vis)分析数据。
42.图10中的a是对在本发明中通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料(透明质酸,ha)的合成方法进行概要性图示的示意图,图10中的b是合成前/后的生物材料的核磁共振(nmr)以及紫外-可见(uv-vis)分析数据。
43.图11是对包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的磷脂的药物传输体(试验组,mb-erpl)以及包含通过酰胺键与模型药物(荧光素,fluorescein)结合的磷脂的药物传输体(对照组,mb-afpl)的光学显微镜以及共聚焦显微镜(confocal microscopy)照片进行图示的示意图。
44.图12是对包含通过酯键与模型药物(荧光素,fluorescein)结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(试验组,mb-efpa)以及包含通过酰胺键与模型药物(罗丹明b,rhodamine b)结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(对照组,mb-arpa)的光学显微镜以及共聚焦显微镜(confocal microscopy)照片进行图示的
示意图。
45.图13是对包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料(透明质酸)的药物传输体(试验组,mb-erha)以及包含通过酰胺键与模型药物(荧光素,fluorescein)结合的生物材料和不包含透明质酸只包含模型要(尼罗红,nile red)的药物传输体(对照组)的光学显微镜以及共聚焦显微镜(confocal microscopy)照片进行图示的示意图。
46.图14是对利用动态光散射(dls)粒度分析器对包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的磷脂的药物传输体(试验组,mb-erpl)、包含通过酰胺键与模型药物(荧光素,fluorescein)结合的磷脂的药物传输体(对照组1,mb-afpl)、只包含磷脂以及聚乙二醇化(pegylation)的磷脂的药物传输体(对照组2,mb)的基于微气泡的造影剂大小进行分析的结果进行图示的示意图。
47.图15是对利用动态光散射(dls)粒度分析器对包含通过酯键与模型药物(荧光素,fluorescein)结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(试验组,mb-efpa)、包含通过酰胺键与模型药物(罗丹明b,rhodamine b)结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(对照组,mb-arpa)、只包含磷脂以及聚乙二醇化(pegylation)的磷脂的药物传输体(对照组2,mb)的基于微气泡的造影剂大小进行分析的结果进行图示的示意图。
48.图16是对利用动态光散射(dls)粒度分析器对包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料(透明质酸)的药物传输体(试验组,mb-erha)、包含通过酰胺键与模型药物(荧光素,fluorescein)结合的生物材料的药物传输体(对照组1,mb-afha)、不包含透明质酸只包含模型药物(尼罗红,nile red)的药物传输体(对照组2,mb-nr)的基于微气泡的造影剂大小进行分析的结果进行图示的示意图。
49.图17是对利用紫外-可见(uv-vis)分析对在向仅溶解有通过酯键与模型药物(罗丹明b,rhodamine b)结合的磷脂(对照组,erpl)的溶液以及通过酯键与模型药物(罗丹明b,rhodamine b)结合的磷脂与微气泡一起制造的药物传输体(试验组,mb-erpl)照射超声波时的模型药物的释放量进行比较的结果进行图示的示意图。
50.图18是对利用紫外-可见(uv-vis)分析对在向仅溶解有通过酯键与模型药物(荧光素,fluorescein)结合的两性材料(对照组,efpa)的溶液以及通过酯键与模型药物(荧光素,fluorescein)结合的两性材料与微气泡一起制造的药物传输体(试验组,mb-efpa)照射超声波时的模型药物的释放量进行比较的结果进行图示的示意图。
51.图19是对利用紫外-可见(uv-vis)分析对在向仅溶解有通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料(对照组,erha)的溶液以及通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料与微气泡一起制造的药物传输体(试验组,mb-erha)照射超声波时的模型药物的释放量进行比较的结果进行图示的示意图。
52.图20是对在琼脂糖胶中向包含通过酯键与药物结合的配体(磷脂、两性材料或生物材料)的药物传输体(试验组)以及包含通过酰胺键与药物结合的配体的药物传输体(对照组)照射超声波时的药物扩散与否试验进行图示的模式图。
53.图21是对利用共聚焦显微镜(confocal microscopy)对在向包含通过酯键与药物结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(试验组,mb-efpa)以及包含
通过酰胺键与药物结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(对照组,mb-empa)照射超声波时的药物的扩散程度进行确认的结果进行图示的示意图。
54.图22是对利用共聚焦显微镜(confocal microscopy)对在向包含通过酯键与药物结合的生物材料(透明质酸)的药物传输体(试验组)以及包含通过酰胺键与药物结合的生物材料的药物传输体(对照组)照射超声波时的药物的扩散程度进行确认的结果进行图示的示意图。
55.图23是对通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料以及模型药物的体外(in-vitro)生物毒性试验结果进行图示的示意图。
56.图24是对在向包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的磷脂的药物传输体(试验组,mb-erpl)以及包含通过酰胺键与模型药物(荧光素,fluorescein)结合的磷脂的药物传输体(对照组,mb-afpl)照射/未照射超声波时的体外(in-vitro)细胞吸收比较结果进行图示的示意图。
57.图25是对在向包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料的药物传输体(试验组,mb-erha)以及包含通过酰胺键与模型药物(荧光素,fluorescein)结合的生物材料的药物传输体(对照组,mb-afha)照射/未照射超声波时的体外(in-vitro)细胞吸收比较结果进行图示的示意图。
具体实施方式
58.接下来,将通过下述实施例对本发明进行更为详细的说明。但是,下述实施例只是为了对本发明进行示例性说明,本发明的范围并不因为下述实施例而受到限定。
59.实施例1:微气泡药物传输体的制造
60.1-1:包含通过酯键与模型药物结合的磷脂的药物传输体的制造
61.将与聚乙二醇(peg)结合的磷脂即二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000))1-10mg和磷脂(二硬酯酰磷脂酰胆碱,dspc)5-30mg的适当比例的混合物与通过酯键与药物结合的磷脂1-10mg分散并溶解到盛放在30ml玻璃小瓶中的氯仿(chloroform)2-5ml中。通过利用旋转浓缩机从盛放有混合溶液的玻璃小瓶去除有机溶剂而制成涂布有不透明的磷脂膜的玻璃小瓶。向涂布有膜的玻璃小瓶投入氯化钠(0.9%)水溶液3-5ml以及液态气体(2h,3h-十氟戊烷,2h,3h-decafluoropentane)1ml并利用尖端超声波发生器(tip sonicator)施加0.5-2分钟的超声波而制造出微气泡药物传输体。在将所制造出的水溶液环环冷却之后去除包含残留物的上层部的溶液并对发生沉淀的微气泡药物传输体进行回收。通过纳米颗粒跟踪分析(nta)、动态光散热(dls)、共聚焦(confocal)、扫描电子显微镜(sem)对通过如上所述的方式制造出的微气泡溶液进行确认。
62.其结果表明,包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的磷脂的药物传输体(试验组,mb-erpl)可以形成直径为1-3μm的微气泡,而且借助于包含负电荷的二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000)),其表面电荷呈现出了负值(-20.1mv)。
63.此外,包含通过酰胺键与模型药物(荧光素,fluorescein)结合的磷脂的药物传输体(对照组,mb-afpl)可以形成1-3μm的微气泡,而且同样借助于包含负电荷的二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000)),其表面电荷呈现出了约-20.4mv。
64.此外,只包含磷脂以及聚乙二醇化(pegylation)的磷脂的微气泡(mb)可以形成直径为1-5μm的微气泡,其表面电荷呈现出了相对较小的约-23mv。
65.1-2:包含通过酯键与模型药物结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体的制造
66.将与聚乙二醇(peg)结合的磷脂即二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000))1-10mg和磷脂(二硬酯酰磷脂酰胆碱,dspc)5-30mg的适当比例的混合物与通过酯键与药物结合的两性材料(疏水性烷基-聚乙二醇(peg))1-10mg分散并溶解到盛放在30ml玻璃小瓶中的氯仿(chloroform)2-5ml中。通过利用旋转浓缩机从盛放有混合溶液的玻璃小瓶去除有机溶剂而制成涂布有不透明的磷脂膜的玻璃小瓶。向涂布有膜的玻璃小瓶投入氯化钠(0.9%)水溶液3-5ml以及液态气体(2h,3h-十氟戊烷,2h,3h-decafluoropentane)1ml并利用尖端超声波发生器(tip sonicator)施加0.5-2分钟的超声波而制造出微气泡药物传输体。在将所制造出的水溶液环环冷却之后去除包含残留物的上层部的溶液并对发生沉淀的微气泡药物传输体进行回收。通过纳米颗粒跟踪分析(nta)、动态光散热(dls)、共聚焦(confocal)、扫描电子显微镜(sem)对通过如上所述的方式制造出的微气泡溶液进行确认。
67.其结果表明,包含通过酯键与模型药物(荧光素,fluorescein)结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(试验组,mb-efpa)可以形成直径为1-3μm的微气泡且两性材料(草绿色)选择性地在气泡的表面构成,而且借助于包含负电荷的二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000)),其表面电荷呈现出了负值(-19.8mv)。
68.此外,包含通过酰胺键与模型药物(罗丹明b,rhodamine b)结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体(对照组,mb-arpa)可以形成1-3μm的微气泡且两性材料(红色)选择性地在气泡的表面构成,而且同样借助于包含负电荷的二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000)),其表面电荷呈现出了约-19.5mv。
69.此外,只包含磷脂以及聚乙二醇化(pegylation)的磷脂的微气泡(mb)可以形成直径为1-5μm的微气泡,其表面电荷呈现出了相对较小的约-23mv。
70.1-3:包含通过酯键与模型药物结合的生物材料(透明质酸)的药物传输体的制造
71.将与聚乙二醇(peg)结合的磷脂即二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000))1-10mg和磷脂(二硬酯酰磷脂酰胆碱,dspc)5-30mg的适当比例的混合物分散并溶解到盛放在30ml玻璃小瓶中的氯仿(chloroform)2-5ml中。将通过酯键与药物结合的生物材料(透明质酸,ha)1-10μg分散并溶解到40%乙醇水溶液1-3ml之后,混合到所制造出的磷脂溶液中。通过利用旋转浓缩机从盛放有混合溶液的玻璃小瓶去除有机溶剂以及水而制成涂布有不透明的磷脂膜的玻璃小瓶。向涂布有膜的玻璃小瓶投入氯化钠(0.9%)水溶液3-5ml以及液态气体(2h,3h-十氟戊烷,2h,3h-decafluoropentane)1ml并利用尖端超声波发生器(tip sonicator)施加0.5-2分钟的超声波而制造出微气泡药物传输体。在将所制造出的水溶液环环冷却之后去除包含残留物的上层部的溶液并对发生沉淀的微气泡药物传输体进行回收。通过纳米颗粒跟踪分析(nta)、动态光散热(dls)、共聚焦(confocal)、扫描电子显微镜(sem)对通过如上所述的方式制造出的微气泡溶液进行确认。
72.其结果表明,包含通过酯键与模型药物(罗丹明b,rhodamine b)结合的生物材料(透明质酸)的药物传输体(试验组,mb-erha)可以形成直径为1-3μm的微气泡且包含负电荷
的透明质酸(ha-rhb,红色)选择性地在气泡的表面构成,而且借助于包含负电荷的二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000))以及透明质酸,其表面电荷呈现出了负值(-28mv)。
73.此外,包含通过酰胺键与模型药物(荧光素,fluorescein)结合的生物材料的药物传输体(对照组,mb-afha)可以形成1-3μm的微气泡且包含负电荷的透明质酸(ha-fluorescine,草绿色)选择性地在气泡的表面构成,而且同样借助于包含负电荷的二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000(dspe-peg(2000))以及透明质酸,其表面电荷呈现出了约-29mv。
74.此外,可以确认没有透明质酸只添加荧光染料(尼罗红,nile red)的微气泡可以形成直径为1-5μm的微气泡,而且因为有疏水性的尼罗红(nile red)存在,其气泡的均匀度有所下降。此外,虽然呈现出环状(ring)形态的气泡在气泡的表面有尼罗红(nile red)存在,但是因为尼罗红(nile red)可以溶解到液态气体中,因此大部分呈现出了球状形态,而且虽然因为二硬脂酰基磷脂酰乙醇胺-聚乙二醇(dspe-peg)包含负电荷而造成其表面电荷呈现出负值,但是因为没有透明质酸而呈现出了相对较小的约-23mv。
75.实施例2:利用造影剂的微气泡药物传输体的制造
76.向氯化钠(0.9%)水溶液5ml溶解通过酯键与药物结合的磷脂、两性材料(疏水性烷基-聚乙二醇(peg))或生物材料(透明质酸,ha)1-10mg。将溶解有药物的氯化钠溶液装入注射器并通过橡胶瓶盖注入到盛放有声诺维(sonovue)粉末的容器中之后,利用涡旋搅拌及激烈搅拌20秒以上进行混合(声诺维(sonovue)粉末:六氟化硫,sulphur hexafluoride、聚乙二醇-4000,macrogol 4000、二硬脂酰磷脂酰胆碱,distearoylphosphatidylcholine、二棕榈酰磷脂酰甘油钠盐,dipalmitoylphosphatidylglycerol sodium、棕榈酸,palmitic acid)。
77.实施例3:超声波照射下的药物释放试验
78.在两个渗析膜(dialysis membrane)袋内,分别担载被分散到磷酸盐缓冲液(pbs)中的试验组(包含通过酯键与红色模型药物结合的磷脂、两性材料或生物材料的药物传输体)以及对照组(包含以没有微气泡的状态分散的磷脂、两性材料或生物材料)溶液。将担载各个物质的渗析膜袋投入到盛放有磷酸盐缓冲液(pbs)溶液的烧杯之后照射超声波。试验组在分别照射10、30或60秒之后对释放到烧杯内的药物浓度进行了分析,而对照组在充分照射60秒之后对释放出的药物的浓度进行了分析。
79.3-1:包含通过酯键与模型药物结合的磷脂的药物传输体
80.其结果,没有微气泡的对照组通过照射超声波时放出了少量的药物,而在与微气泡一起制造的试验组中观察到了与对照组相比3倍以上的药物释放(图17)。
81.3-2:包含通过酯键与模型药物结合的两性材料(疏水性烷基-聚乙二醇(peg))的药物传输体
82.没有微气泡的对照组通过照射超声波时放出了少量的药物,而在与微气泡一起制造的试验组中观察到了与对照组相比5倍以上的药物释放(图18)。
83.3-3:包含通过酯键与模型药物结合的生物材料(透明质酸)的药物传输体
84.没有微气泡的对照组通过照射超声波时放出了少量的药物,而在与微气泡一起制造的试验组中观察到了与对照组相比10倍以上的药物释放,而且观测到了上述释放速度依
赖于超声波的照射时间(图19)。
85.实施例4:超声波照射下的药物扩散试验
86.向利用亲水性琼脂糖胶构成的通道内注入了分散到磷酸盐缓冲液(pbs)中的试验组(包含通过酯键与模型药物结合的两性材料或生物材料的药物传输体)以及对照组(包含通过酰胺键与模型药物结合的两性材料或生物材料的药物传输体)溶液。接下来,通过向注入溶液的通道上侧照射超声波而使微气泡崩塌,并对各个模型药物在亲水性琼脂糖胶中的扩散与否以及程度进行了确认。
87.4-1:包含通过酯键与模型药物结合的两性材料的药物传输体
88.其结果,利用共聚焦分析仪确认了通过在照射超声波时的物理性刺激以及微气泡的崩塌所诱发的局部的高温/高压,可以对药物传输体内的酯键的水解反应进行加速并借此快速地释放出结合到试验组中的草绿色模型药物(荧光素,fluorescein),而且所释放出的模型药物可以渗透并分散到亲水性的琼脂糖胶内部。
89.而与此相反,可以确认对照组中的通过酰胺键固定的红色模型药物(罗丹明b,rhodamine b),即使是在通过照射超声波而诱发高温/高压的情况下,酰胺键也几乎不会发生分解,因此无法释放出药物并以附着在两性材料(疏水性烷基-聚乙二醇(peg))的状态保持巨分子形态,向亲水性琼脂糖胶内的渗透性较弱(图21)。
90.4-2:包含通过酯键与模型药物结合的生物材料的药物传输体
91.其结果,利用共聚焦分析仪确认了通过在照射超声波时的物理性刺激以及微气泡的崩塌所诱发的局部的高温/高压,可以对药物传输体内的酯键的水解反应进行加速并借此快速地释放出结合到试验组中的红色模型药物(罗丹明b,rhodamine b),而且所释放出的模型药物可以渗透并分散到亲水性的琼脂糖胶内部。
92.而与此相反,可以确认对照组中的通过酰胺键固定的草绿色模型药物(荧光素,fluorescein),即使是在通过照射超声波而诱发高温/高压的情况下,酰胺键也几乎不会发生分解,因此无法释放出药物并以附着在生物材料(透明质酸)的状态保持巨分子形态,向亲水性琼脂糖胶内的渗透性较弱(图22)。
93.实施例5:体外(in-vitro)细胞试验
94.5-1:对通过酯键与模型药物(rhodamine b)结合的生物材料的细胞毒性试验
95.将通过酯键与模型药物(rhodamine b)结合的生物材料(ha-rhb)和模型药物添加到u-251mg细胞中并将最终浓度分别调节至1nm、0.01μm、0.1μm、1μm、10μm、100μm之后培养细胞24小时。接下来添加由细胞培养液以及四唑盐衍生物构成的溶液并对细胞的生存率进行测定,从而对各个物质的体外(in-vitro)细胞毒性进行了确认。其结果,在游离罗丹明b(freerhodamine b)中在较低的浓度下几乎没有观察到毒性,而在1μm以上的浓度下可以观察到毒性。而与此相反,通过酯键与模型药物结合的生物材料(ha-rhb)从极高浓度的100μm开始才可以观察到毒性。这表明,借助于生物相容性优秀的透明质酸平台的特性,所制造出的药物传输体呈现出了优秀的生物相容性(图23)。
96.5-2:超声波照射下的细胞内吸收程度分析
97.使用试验组(包含通过酯键与红色模型药物(罗丹明b,rhodamine b)结合的磷脂或生物材料的药物传输体)以及对照组(包含通过酰胺键与草绿色模型药物(荧光素,fluorescein)结合的磷脂或生物材料的药物传输体)溶液,对照射/未照射超声波时的体外
(in-vitro)细胞内吸收程度进行了分析。试验组以及对照组被一起添加到u-251mg细胞中,而且为了去除没有被细胞吸收的物质,在观察之前更换新的细胞培养液并利用共聚焦显微镜进行了观察。
98.5-2-1:包含通过酯键与红色模型药物结合的磷脂的药物传输体
99.其结果,利用共聚焦分析仪确认了因为在照射超声波之前试验组以及对照组均呈现出缓慢的细胞吸收,因此几乎没有观察到红色以及草绿色的荧光色,但是伴随着在照射超声波时的物理性刺激以及微气泡的崩塌所有发的局部的高温/高压,可以在试验组药物传输体内的酯键的水解反应进行加速并借此快速地释放出所结合的红色模型药物(罗丹明b,rhodamine b)并被细胞吸收。
100.而与此相反,利用共聚焦分析仪确认了对照组中的通过酰胺键固定的草绿色模型药物(荧光素,fluorescein),即使是在通过照射超声波的气泡崩塌所诱发高温/高压的情况下,酰胺键也几乎不会发生分解,因此无法释放出药物并以附着在磷脂的状态保持巨分子形态,其细胞吸收进展仍然缓慢(图24)。
101.5-2-2:包含通过酯键与红色模型药物结合的生物材料的药物传输体
102.利用共聚焦分析仪确认了在照射超声波之前因为高分子透明质酸微气泡平台的影像,试验组以及对照组均呈现出缓慢的细胞吸收,因此几乎没有观察到红色以及草绿色的荧光色,但是伴随着在照射超声波时的物理性刺激以及微气泡的崩塌所有发的局部的高温/高压,可以在试验组药物传输体内的酯键的水解反应进行加速并借此快速地释放出所结合的红色模型药物(罗丹明b,rhodamine b)并被细胞吸收。
103.而与此相反,利用共聚焦分析仪确认了对照组中的通过酰胺键固定的草绿色模型药物(荧光素,fluorescein),即使是在通过照射超声波的气泡崩塌所诱发高温/高压的情况下,酰胺键也几乎不会发生分解,因此无法释放出药物并以附着在生物材料(透明质酸)的状态保持巨分子形态,其细胞吸收进展仍然缓慢(图25)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1