膜联蛋白涂覆的颗粒的制作方法
1.本发明涉及一种膜联蛋白涂覆的颗粒,其包含带负电荷的磷脂和与其非共价偶联的膜联蛋白。本发明进一步涉及一种包含膜联蛋白涂覆的颗粒的组合物。此外,本发明涉及一种用于预防或治疗选自慢性炎症性疾病、自身免疫性疾病、过敏和癌症的疾病的方法的产品,所述产品包含膜联蛋白涂覆的颗粒和/或组合物。本发明进一步涉及一种制备膜联蛋白涂覆的颗粒的方法。
背景技术:
2.凋亡细胞(ac)的清除与免疫自耐受的诱导密切相关。每天,数十亿个ac被树突状细胞(dc)等抗原提呈细胞吞噬,并主动调节免疫反应。吞噬 ac之后,dc 获得了一种致耐受性表型,其特征是共刺激表面分子和炎性细胞因子的低表达以及对激活的抵抗力
1.。这种致耐受性dc处理并将ac 衍生的自身抗原呈递给初始 t 细胞,并诱导 t 细胞的耐受性 2.。
3.早期ac在其表面暴露了膜联蛋白家族的几个成员,这作为dc的抑制信号,促进了外周耐受的发展
[3], [4]
。膜联蛋白是一个胞质蛋白家族,它们以钙依赖性方式与带负电荷的磷脂(例如磷脂酰丝氨酸)结合。脂质结合由所有膜联蛋白家族成员中高度保守的 c 末端核心结构域介导,与anxa1 n端对应的肽已显示与 n
‑
甲酰肽受体(fpr)家族成员结合,导致在几种急性和慢性炎症模型中,中性粒细胞的迁移减少
[5]
。
[0004]
从结构说,膜联蛋白由进化上高度保守的膜联蛋白核心结构域和独特的n端组成。胞质蛋白膜联蛋白 a1(anxa1)的早期暴露被确认为 ac表面的致耐受信号
3.。膜联蛋白a1的细胞外免疫调节功能被进行了最为突出的描述,并归因于其n末端与n
‑
甲酰肽受体(fpr)家族的结合。然而,由保守的膜联蛋白核心结构域介导的致耐受功能独立于 fpr [4]
。
[0005]
此外,膜联蛋白与dc和其他免疫细胞上表达的c型凝集素受体(clr)超家族中的dectin
‑
1(也称为 clec7a)结合
[6]
。它作为模式识别受体,对存在于真菌和细菌物种细胞壁中的β
‑
1,3 连接葡聚糖(β
‑
葡聚糖)具有高亲和力。dectin
‑
1参与微生物和真菌感染后免疫反应的激活。dectin
‑
1的信号传导主要依赖于其细胞质区域的半itam,通过脾酪氨酸激酶(syk)、raf
‑
1 和 card
‑
9 激活信号通路。此外,β
‑
葡聚糖对 dectin
‑
1 的刺激通过激活 nadph 氧化酶
‑
2 (nox
‑
2) 导致活性氧(ros)的产生。dectin
‑
1的刺激可以启动抗炎和致耐受反应,限制了 1 型糖尿病和过敏性免疫反应的诱发。
[0006]
目前正在进行膜联蛋白和膜联蛋白制剂在慢性炎症、自身免疫性疾病、过敏、癌症疫苗接种(therannex, dkfz; trio medicines ltd, uk)以及心血管疾病(annexin pharmaceuticals,sweden)等疾病中的治疗潜力的研究。大多数这些治疗性膜联蛋白应用的共同点是使用可溶性膜联蛋白制剂。然而,除了与特定受体的期望结合之外,已知可溶性膜联蛋白可以与带负电荷的磷脂(如磷脂酰丝氨酸(ps)结合。因此,由于各种细胞和血管表面的ps表达,可溶性膜联蛋白制剂在体内给药时经常观察到高背景结合和脱靶效应
[7], [8]
。可溶性膜联蛋白通常随机结合包含带负电荷的磷脂的膜,并且不会选择性地与靶细胞上的
靶受体结合。这些脱靶效应显着降低有效膜联蛋白的浓度,促使给药极高的膜联蛋白剂量。此外,高膜联蛋白剂量通常会导致不良的副作用,例如减少凝血而诱导的血管渗漏。
[0007]
wo 2007/069895涉及通过使用新型膜联蛋白、膜联蛋白变体及其衍生物将化合物递送至特定靶标来治疗和诊断受试者的组合物和方法。
[0008]
wo 2016/113022 描述了膜联蛋白与特定受体相关,可以通过膜联蛋白或其片段之一的结合或针对该受体的抗体来刺激或阻断膜联蛋白。因此,膜联蛋白和/或其功能片段和/或包含膜联蛋白或其功能片段的融合蛋白被认为可用于调节免疫系统。wo2016/113022 没有提及任何减少膜联蛋白制剂脱靶结合的方法。
[0009]
wo 2005/027965公开了膜联蛋白和抗膜联蛋白抗体及其用途,例如用于检测细胞凋亡和用于生产药物组合物,该药物组合物用于诊断和/或治疗癌症、自身免疫疾病、心血管和/或血管疾病。wo 2005/027965 不涉及减少膜联蛋白的脱靶结合。
[0010]
wo 2001/072277公开了一种用于产生免疫应答的磷脂囊泡,该磷脂囊泡中含有抗原或编码抗原的多核酸。wo 2001/072277 不涉及具有降低的脱靶结合特性的膜联蛋白涂覆的颗粒。
[0011]
garnier等人
[9]
公开了聚乙二醇化脂质功能化的脂质体,其作为细胞靶向元件与膜联蛋白 a5 蛋白共价连接。garnier等人不涉及一种减少膜联蛋白脱靶结合的方法。
[0012]
因此,需要提供一种膜联蛋白制剂,其表现出较低的脱靶结合并因此具有比可溶性膜联蛋白更高的结合至靶细胞的有效膜联蛋白浓度。
[0013]
因此,本发明的目的是提供一种膜联蛋白制剂和/或产品,其具有膜联蛋白的治疗效果并且与其他膜联蛋白制剂(例如可溶性膜联蛋白制剂)相比具有较少的副作用。因此,本发明旨在提供一种表现为较低脱靶结合的改良膜联蛋白制剂,以及制备所述膜联蛋白制剂的方法。此外,本发明的目的是将这些制剂和/或产品用于开发创新且有效的疗法,特别是用于治疗慢性炎性疾病、自身免疫性疾病、过敏和癌症。此外,本发明的目的是提供一种在靶细胞(如树突细胞)中诱导致耐受反应的方法。通过阅读本发明的以下描述,本发明的其他目的和方面对本领域技术人员将变得显而易见。
技术实现要素:
[0014]
以下将描述本发明的要素。这些要素与特定实施例一起列出,然而,应当理解,它们可以以任何方式和以任何数量组合创建附加实施例。示例和优选实施例的不同描述不应被解释为将本发明仅限于明确描述的实施例。该描述应当被理解为支持和包含将两个或更多个明确描述的实施例组合,或将一个或多个明确描述的实施例与任何数量的公开和/或优选要素的实施例组合。此外,除非上下文另有说明,否则本技术中所有描述的要素的任何排列和组合都应被认为是本技术的描述所公开的。
[0015]
在第一方面,本发明涉及一种膜联蛋白涂覆的颗粒,其包含带负电荷的磷脂和与其非共价偶联的膜联蛋白。
[0016]
在一个实施方案中,所述膜联蛋白是膜联蛋白组的任何成员,优选膜联蛋白a1、膜联蛋白a5和膜联蛋白a13中的任一个,更优选膜联蛋白a1或膜联蛋白a5和/或是受体结合膜联蛋白核心结构域或其片段,优选膜联蛋白a1、a5和a13核心结构域中的任一个或其片段,更优选人膜联蛋白a1或a5核心结构域或其片段。
[0017]
在一个实施方案中,所述带负电荷的磷脂是磷脂酰丝氨酸(phosphatidylserine)、磷脂酰甘油(phosphatidylglycerol)、磷脂酸(phosphatidic acid)、磷脂酰肌醇(phosphatidylinositol)、磷脂酰肌醇磷酸酯(phosphatidylinositol phosphate)、磷脂酰肌醇二磷酸酯(phosphatidylinositol biphosphate)、磷脂酰肌醇三磷酸酯(phosphatidylinositol triphosphate)、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸甘油酯钠盐(dmpg)、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸
ꢀ‑
l
‑
丝氨酸钠盐(1,2
‑
dimyristoyl
‑
sn
‑
glycero
‑3‑
phopho
‑
l
‑
serine sodium salt,dmps)和1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸单钠盐。
[0018]
在一个实施方案中,所述颗粒进一步包含选自磷脂酰胆碱(phosphatidylcholine)、磷脂酰乙醇胺(phosphatidylethanolamine)、鞘磷脂(sphingomyelin)及其组合的任何磷脂。
[0019]
在一个实施方案中,所述颗粒包含磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺。
[0020]
在一个实施方案中,所述颗粒包含0.5%至100%范围内的磷脂酰丝氨酸、0%至99.5%范围内的磷脂酰胆碱和0%至20%范围内的磷脂酰乙醇胺,其中所述百分比为相对于总磷脂含量的摩尔百分比,其中磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺的摩尔百分比之和不超过100%。
[0021]
在一个实施方案中,所述颗粒将所述带负电荷的磷脂掺入到颗粒主体中和/或被所述带负电荷的磷脂包覆。
[0022]
在一个实施方案中,所述颗粒进一步包含胆固醇、peg、膜联蛋白以外的治疗剂和/或抗原。
[0023]
在一个实施方案中,所述颗粒是纳米颗粒或微米颗粒。
[0024]
在一个实施方案中,所述颗粒的平均直径在20 nm至1000 nm的范围内,优选≤400 nm。
[0025]
在一个实施方案中,所述颗粒选自脂质囊泡、胶束、固体脂质颗粒、聚合物颗粒、多糖颗粒例如琼脂糖珠、氧化铁颗粒、树枝状聚合物、病毒基颗粒、dna基颗粒、修饰细胞、人造细胞和碳纳米管。
[0026]
在一个实施方案中,所述颗粒是脂质囊泡,优选单层或多层脂质囊泡。
[0027]
在一个实施方案中,所述颗粒能够结合靶细胞上的受体,优选结合dectin
‑
1、dc
‑
sign、lrp1、补体受体3(itgam、cd11b)、甲酰肽受体(fpr)和脂氧素受体中的任一个。
[0028]
在一个实施方案中,所述颗粒能够通过与所述dectin
‑
1的β
‑
葡聚糖结合位点不同的结合位点与dectin
‑
1结合。
[0029]
在一个实施方案中,所述结合通过介导依赖于nox
‑
2的ros产生而对所述靶细胞具有致耐受作用。
[0030]
在另一方面,本发明涉及一种包含如上定义的膜联蛋白涂覆的颗粒的组合物。
[0031]
在一个实施方案中,所述组合物进一步包含药学上可接受的载体和/或赋形剂。
[0032]
在另一方面,本发明涉及一种用于预防或治疗选自慢性炎性疾病、自身免疫性疾病、过敏和癌症的疾病的方法的产品,所述产品包含如上定义的膜联蛋白涂覆的颗粒和/或如上定义的组合物。
[0033]
在一个实施方案中,所述膜联蛋白涂覆的颗粒的所述膜联蛋白是药物活性剂。
[0034]
在另一方面,本发明涉及一种制备膜联蛋白涂覆的颗粒的方法,颗粒优选如上所定义的,其中所述方法包括用膜联蛋白涂覆包含带负电荷的磷脂的颗粒。
[0035]
在一个实施方案中,所述膜联蛋白是膜联蛋白组的任何成员,优选膜联蛋白a1、膜联蛋白a5和膜联蛋白a13中的任一个,更优选膜联蛋白a1或膜联蛋白a5和/或是受体结合膜联蛋白核心结构域或其片段,优选膜联蛋白a1、a5和a13核心结构域中的任一个或其片段,更优选人膜联蛋白a1或a5核心结构域或其片段。
[0036]
在一个实施方案中,所述带负电荷的磷脂是磷脂酰丝氨酸、磷脂酰甘油、磷脂酸、磷脂酰肌醇、磷脂酰肌醇磷酸酯、磷脂酰肌醇二磷酸酯、磷脂酰肌醇三磷酸酯、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸甘油酯钠盐(smpg)、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸
‑
l
‑
丝氨酸钠盐(dmps)和1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸单钠盐。
[0037]
在一个实施方案中,所述颗粒还包含选自磷脂酰胆碱、磷脂酰乙醇胺、鞘磷脂及其组合的任何磷脂。
[0038]
在一个实施方案中,所述颗粒包含磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺,优选包含0.5%至100%范围内的磷脂酰丝氨酸、0%至99.5%范围内的磷脂酰胆碱和0%至0%乙醇胺磷脂20%,其中所述百分比为相对于总磷脂含量的摩尔百分比,其中磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺的摩尔百分比之和不超过100%。
[0039]
在一个实施方案中,所述颗粒将所述带负电荷的磷脂掺入到颗粒主体中和/或被所述带负电荷的磷脂包覆。
[0040]
在一个实施方案中,所述颗粒还包含胆固醇、peg、膜联蛋白以外的治疗剂和/或抗原。
[0041]
在一个实施方案中,所述颗粒是纳米颗粒或微米颗粒,优选具有20 nm至1000 nm范围内的平均直径,优选≤400 nm。
[0042]
在一个实施方案中,所述颗粒选自脂质囊泡、胶束、固体脂质颗粒、聚合物颗粒、多糖颗粒例如琼脂糖珠、氧化铁颗粒、树枝状聚合物、病毒基颗粒、dna基颗粒、修饰细胞、人造细胞和碳纳米管,其中所述颗粒优选为脂质囊泡,更优选为单层或多层脂质囊泡。
[0043]
在一个实施方案中,所述方法包括以下步骤:a)提供至少包含所述带负电荷的磷脂的磷脂制剂,并干燥所述磷脂制剂,b)将步骤 a)中获得的干燥磷脂制剂溶解在水溶液中,c)任选地,使步骤 b) 中获得的包含磷脂的溶液经受至少一个冷冻/解冻循环,d)使用挤出机挤出在步骤b)中获得的,或任选地在步骤c)中获得的包含磷脂的溶液,从而获得颗粒,e)用膜联蛋白和任选的钙补充在步骤 d)中获得的颗粒,使所述膜联蛋白与所述颗粒非共价偶联,从而获得膜联蛋白涂覆的颗粒,其中所述方法任选地包括添加抗原和/或治疗剂的步骤。
[0044]
例如,在一些实施方案中,抗原和/或治疗剂可以在包封过程中加入到颗粒介质中,使得抗原和/或治疗剂在颗粒形成期间被包封。或者,可以稍后添加抗原和/或治疗剂。
[0045]
在一个实施方案中,所述挤出机装配有孔径为400 nm的膜。
[0046]
在一个实施方案中,所述钙以1 nm至1000 mm范围内的浓度补充,更优选0.9 mm至1 mm范围内的浓度补充。
[0047]
在另一方面,本发明涉及一种预防或治疗患者中的选自慢性炎性疾病、自身免疫疾病、过敏和癌症的疾病的方法,包括向所述患者给药有效量的如上定义的膜联蛋白涂覆的颗粒、如上定义的组合物和/或如上定义的产品。
[0048]
在另一方面,本发明涉及膜联蛋白涂覆的颗粒在制备用于预防或治疗选自慢性炎性疾病、自身免疫性疾病、过敏和癌症的疾病的方法的药物中的用途,所述膜联蛋白涂覆的颗粒优选如上所定义。
[0049]
详细说明本发明人提供了一种有效阻断膜联蛋白制剂的脱靶结合的方法(图1)。该方法包括将膜联蛋白制剂预吸附至包含带负电荷的磷脂(例如磷脂酰丝氨酸)的颗粒(例如脂质囊泡)上。如本发明所公开的,囊泡结合膜联蛋白制剂与可溶性膜联蛋白相比保留了结合和激活特定膜联蛋白受体的能力,但显示与缺乏特异性受体的细胞表面(在图1和图2中的膜联蛋白受体阳性和ko细胞)没有主要相互作用。
[0050]
本发明的膜联蛋白涂覆的颗粒的巨大优势在于预吸附到包含带负电荷的磷脂颗粒上,增加了治疗性膜联蛋白制剂的有效浓度并允许减少剂量,从而减少副作用。由于一些公司目前正在开发基于膜联蛋白的疗法用于医疗用途,因此存在通过防止脱靶结合来更有效地实施此类疗法的商业需求。
[0051]
为了防止膜联蛋白与膜上带负电荷的磷脂的背景结合,制备包含带负电荷的磷脂颗粒并装载膜联蛋白。当脂质结合位点被占据时,膜联蛋白与靶受体的结合界面仍然可用于相互作用。因此,由于脂质结合位点被占据,本发明的膜联蛋白涂覆的颗粒减少了与细胞膜的脱靶结合,并允许选择性结合靶细胞上的受体。
[0052]
此外,本发明人证实了保守的膜联蛋白核心结构域在不同的结合位点上与靶受体(即dectin
‑
1)相互作用。这种相互作用通过激活 nox
‑
2 诱导了 syk 的磷酸化和 ros的产生。令人惊讶的是,与
ꢀß‑
葡聚糖相反,膜联蛋白核心结构域不会诱导 nfkb 的活化,也不会诱导促炎分子的分泌。因此,膜联蛋白核心结构域选择性地参与了dectin
‑
1信号通路的抗炎分支,而不参与在 β
‑
葡聚糖刺激下观察到的经典促炎信号传导
[10]
。
[0053]
本发明人公开了一种受体
‑
配体相互作用,其通过引发致耐受性表型(例如致耐受性dc表型),促成外周免疫耐受的基本机制。此外,膜联蛋白核心域对nox
‑
2的激活突出了依赖于nox
‑
2的ros 的产生的重要性,以避免生理组织更新和体内平衡过程中的自身炎症过程。
[0054]
本文公开的膜联蛋白刺激 dectin
‑
1并通过 nox
‑
2 衍生的 ros 诱导 dc的细胞抑制的分子通路,代表了调节外周免疫耐受的新靶点。因此,使用本发明的膜联蛋白涂覆的颗粒对膜联蛋白/dectin
‑
1/nox
‑
2 信号轴的治疗操作可用于治疗自身免疫疾病和控制免疫逃避性肿瘤。通过使用膜联蛋白涂覆的颗粒代替可溶性膜联蛋白,可以防止膜联蛋白与带负电荷的磷脂脱靶结合产生副作用。本发明提供了通过使用磷脂预先吸附膜联蛋白的磷脂结合位点,来实现膜联蛋白介导治疗效果并防止膜联蛋白脱靶结合的方法。
[0055]
如本文所用,术语“颗粒”涉及包含带负电荷的磷脂的结构,该结构是通过将所述磷脂掺入其颗粒主体或通过具有包含所述磷脂的涂层来实现。包含带负电荷的磷脂的所述颗粒能够与膜联蛋白或其片段相互作用。在一个实施方案中,膜联蛋白的脂质结合位点被包含在所述颗粒中的带负电荷的磷脂结合。在一个实施方案中,所述膜联蛋白的脂质结合
位点通过与包含带负电荷的磷脂的所述颗粒的所述结合而被预吸附,并且所述预吸附减少膜联蛋白的脱靶结合。在一个实施方案中,所述预吸附降低膜联蛋白与细胞膜的脱靶结合,并且所述膜联蛋白的受体结合位点仍可用于与靶细胞上的受体结合。在一个实施方案中,颗粒是脂质囊泡、胶束、固体脂质颗粒、聚合物颗粒、多糖颗粒例如琼脂糖珠、氧化铁颗粒、树枝状聚合物、病毒基颗粒、dna基颗粒、修饰细胞、人造细胞和碳纳米管,其中所述颗粒优选为脂质囊泡,更优选为单层或多层脂质囊泡。在一个实施方案中,诸如脂质囊泡、胶束、固体脂质颗粒、琼脂糖珠、修饰细胞和人造细胞的颗粒可以将所述带负电荷的磷脂掺入到它们的颗粒主体中。在一个实施方案中,诸如聚合物颗粒、氧化铁颗粒、病毒基颗粒或碳纳米管的颗粒可以被带负电荷的磷脂覆盖。在一个实施方案中,颗粒在其颗粒主体中掺入所述磷脂和/或被所述磷脂覆盖。在一个实施方案中,颗粒是球形颗粒。在一个实施方案中,包含膜联蛋白的颗粒对靶细胞具有致耐受作用,优选通过与所述靶细胞上的受体结合,该受体优选为 dectin
‑
1、dc
‑
sign、lrp1、补体受体 3(itgam、cd11b)、甲酰肽受体(fpr)和脂氧素受体中的任一个。在一个实施方案中,包含膜联蛋白的颗粒通过与所述dectin
‑
1的β
‑
葡聚糖结合位点不同的结合位点与所述靶细胞表面的dectin
‑
1结合,从而对靶细胞具有致耐受作用。在一个实施方案中,所述膜联蛋白与dectin
‑
1的结合通过经由nox
‑
2的激活诱导ros而对所述靶细胞具有致耐受作用。
[0056]
如本文所用,术语“颗粒主体”涉及颗粒的主要支撑结构。例如,颗粒主体可以涉及脂质体的脂质双层、胶束的脂质层或聚合物的核心结构、固体脂质颗粒、铁颗粒和/或纳米管。
[0057]
如本文所用,术语“囊泡”或“脂质囊泡”涉及由脂质双层包围的液体组成的结构。囊泡在细胞质膜内物质的分泌(胞吐作用)、摄取(胞吞作用)和运输过程中自然形成。或者,它们可以人工制备,在这种情况下它们也可以称为脂质体。脂质体可用作给药营养物和药物的载体。脂质体可以通过破坏生物膜(例如通过超声处理)来制备。脂质体通常由磷脂组成,例如磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺。脂质体设计可以使用表面配体来靶向某些靶组织。脂质体有几种类型,例如多层囊泡(具有多个脂质双层的mlv)、小单层脂质体囊泡(具有一个脂质双层的suv)、大单层囊泡(luv)、耳蜗囊泡和其中一个囊泡包含一个或多个较小的囊泡的多囊脂质体。在许多实施方案中,术语“脂质囊泡”和“脂质体”可互换使用。在一个实施方案中,脂质囊泡涉及单层或多层脂质囊泡。
[0058]
如本文所用,术语“膜联蛋白”涉及钙和磷脂结合蛋白家族。除真菌外,在所有真核生物界以及植物和动物中都发现了膜联蛋白家族的 20 多个成员。膜联蛋白的分子量在 30 到 40 kda 之间(只有膜联蛋白vi 是66 kda)并且具有显著的结构特征。每个膜联蛋白成员的膜联蛋白氨基末端结构域在序列和长度(范围从 11 到 196 之间)上是不同的。相比之下,由大约 70 个氨基酸残基组成的四个(对于膜联蛋白 vi 仅八个)α
‑
螺旋结构域组成的羧基末端区域在膜联蛋白中非常保守。钙和磷脂结合位点位于羧基末端结构域。在所有膜联蛋白中,ca
2+
的结合相似性是由于它们共同的一级结构、独特的 n 端结构域(“尾”)和保守的 c 端结构域(“核心”)。除膜联蛋白 vi 外,保守的 c 端结构域始终由4个重复(膜联蛋白 vi 有8个)的
ꢀ‑
70 个氨基酸组成,其中包含称为“内联蛋白折叠”的同源区域增加。除了 c 端核心之外,膜联蛋白还包含显著更可变的 n 端头。正是这个域赋予每个膜联蛋白在多种细胞过程中具有独特的功能,包括:胞吞和胞吐作用、细胞骨架调节及膜传导和
组织。膜联蛋白脂质结合由在所有膜联蛋白家族成员中高度保守的 c 末端核心结构域介导。如本文所用,术语“膜联蛋白组的成员”涉及膜联蛋白家族的任何成员,包括来自任何物种的膜联蛋白。钙离子通常结合在膜联蛋白分子的凸面,特别是与连接膜联蛋白 a 和 b 螺旋的环中的羰基氧以及来自位于环连接螺旋d和e中的谷氨酸残基或天冬氨酸残基的双齿羧基结合。当钙与膜联蛋白结合时,疏水侧链暴露在原本主要是亲水的凸面中。通常认为这些疏水残基通过与磷脂的疏水酰基链建立范德华力来促进与双层的相互作用。在一个实施方案中,制备膜联蛋白涂覆的颗粒的方法优选包括使用钙来增强膜联蛋白与磷脂的相互作用。在一个实施方案中,制备膜联蛋白涂覆的颗粒的方法包括用膜联蛋白和优选钙补充颗粒,所述钙优选浓度范围为1 nm至1000 mm,更优选范围为0.9 mm至1 mm。
[0059]
此外,在一些优选实施方案中,本发明上下文中的术语“膜联蛋白”应包括具有至少80%、优选85%、90%、95%、96%、97%、98%或99%与优选人膜联蛋白a1、膜联蛋白a5和/或膜联蛋白a13的氨基酸序列的序列同一性。膜联蛋白的氨基酸序列可以从 2019 年 2 月版本的 uniprot 数据库中获得,数据库条目如下:p04083(人膜联蛋白 a1)、p08758(人膜联蛋白 a5)和 p27216(膜联蛋白 a13)(http://www.uniprot.org/; 另见 nucleic acids research, volume 45, issue d1, 4 january 2017, pages d158
–
d169)。
[0060]
在本发明的上下文中,术语“膜联蛋白核心结构域”和“受体结合膜联蛋白核心结构域”应理解为指示/代表膜联蛋白(或其同源物)的多肽的最小片段,这对于结合至受体(例如c型凝集素受体和/或lrp
‑
1,或其功能片段)是必要且足够的。可以通过多种本领域已知的方法来测试这种能力(生物功能)。此外,该术语应特别包括脊椎动物(特别是哺乳动物(特别是人))的本文所述的膜联蛋白基因和/或蛋白质和/或mrna和/或片段(核心结构域)。该术语还涵盖不同制剂中的膜联蛋白核心结构域,例如在细胞环境中,重组表达所述核心结构域的细胞,从细胞中纯化,以及其级分,特别是生物活性级分。可用于根据本发明的方法中的膜联蛋白核心结构域可源自任何已知的膜联蛋白或其功能片段(即能够结合本文所述的受体),并且优选选自人或鼠膜联蛋白1、5和13核心域。在一个实施方案中,所述膜联蛋白核心结构域优选涉及wo 2017/211964 a1的seq id no.1至3和6至8中的任一个,通过该引用并入本文。
[0061]
在一个实施方案中,膜联蛋白靶向的“靶受体”可以涉及选自dectin
‑
1、dc
‑
sign及其鼠同源物、lrp1、补体受体3(itgam、cd11b)、甲酰肽受体(fpr)的受体家族,例如 fpr1、fpr2 和 fpr3和脂氧素受体,以及来自其他物种的同源物。在一个实施方案中,术语“靶标受体”和“膜联蛋白受体”可互换使用。在一个实施方案中,膜联蛋白结合的受体也可以与之前未知的膜联蛋白特异性结合的受体相关。在一个实施方案中,所述受体结合膜联蛋白核心结构域结合选自dectin
‑
1、dc
‑
sign及其鼠同源物、lrp1、补体受体3(itgam、cd11b)、甲酰肽受体(fpr)家族的受体(如 fpr1、fpr2 和 fpr3)以及脂氧素受体。
[0062]
如本文所用,术语“其片段”涉及膜联蛋白(或其同源物)的多肽的最小片段,其对于结合靶细胞上的受体(例如dectin
‑
1)是必要且足够的。在替代实施例中,术语“其片段”涉及受体的最小片段,其对于结合膜联蛋白的核心结构域是必要且足够的。
[0063]
在本发明的上下文中,术语“c
‑
型凝集素受体”、“dectin
‑
1”、“dc
‑
sign”、“lrp
‑
1”、“fpr”应理解为指示/代表受体的最小片段,这是与膜联蛋白核心域结合所必需且足够的。可以采用如相关文献中描述的许多本领域已知方法中进一步测试这种能力。此外,该术语
应包括如本文所述的人受体基因和/或蛋白质和/或mrna和/或片段(结合部分、片段或结构域)的哺乳动物(特别是小鼠)同源物。该术语还涵盖不同制剂中的受体和/或受体的最小片段,例如在细胞环境中,表达所述受体的细胞(重组)和/或受体的最小片段从细胞中纯化的受体及其片段。
[0064]
本发明人在文中公开了模式识别受体dectin
‑
1在与膜联蛋白(例如细胞(例如凋亡细胞)上的外化膜联蛋白)结合后的致耐受作用。凋亡细胞在树突细胞(dc)中诱导致耐受表型,导致外周耐受,例如抗凋亡细胞来源的自身抗原。在细胞凋亡过程中,细胞溶质膜联蛋白作为对吞噬 dc的免疫抑制信号,细胞表面通过暴露带负电荷的磷脂以及细胞溶质膜联蛋白的外化而迅速重新排列。如本文所公开的,dectin
‑
1通过与所述dectin
‑
1的β
‑
葡聚糖结合位点不同的结合位点识别膜联蛋白。因此,膜联蛋白(例如与磷脂结合的膜联蛋白)与 dectin
‑
1 的不同结合位点结合,不会干扰病原体来源的
ꢀß‑
葡聚糖的结合。因此,膜联蛋白核心结构域诱导脾酪氨酸激酶(syk)的磷酸化,进而激活 nadph 氧化酶
‑
2(nox
‑
2)。与病原体衍生的β
‑
葡聚糖相比,膜联蛋白诱导的 dectin
‑
1 信号传导的特征是中等ros水平的依赖于nox
‑
2的产生,并且不会激活 nf
‑
κb。在一个实施方案中,膜联蛋白涂层颗粒通过膜联蛋白与靶细胞上的受体(例如dectin
‑
1)的结合在所述靶细胞中诱导致耐受表型,即所述结合对所述靶细胞具有致耐受作用。在一个实施方案中,所述结合导致外周耐受性的发展。
[0065]
如本文所用,术语“靶细胞”涉及具有结合膜联蛋白的能力的细胞,例如具有能够结合膜联蛋白的受体的细胞。在一个实施方案中,所述受体是dectin
‑
1、dc
‑
sign及其鼠同源物、lrp1、补体受体3(itgam、cd11b)、甲酰肽受体(fpr)家族的受体(例如fpr1、fpr2和fpr3中的任一种)和脂氧素受体中的任一种。本发明所述的靶细胞可以选自任何类型的哺乳动物细胞,特别是人类细胞。在实施例中,靶细胞涉及选自树突细胞、巨噬细胞、单核细胞、小胶质细胞、内皮细胞、上皮细胞、中性粒细胞和表达靶受体的任何其他细胞中的任一种。在一个实施方案中,靶细胞可以涉及癌细胞。
[0066]
如本文所用,术语“磷脂”涉及作为所有细胞膜的主要成分的一类脂质。由于其两亲性,磷脂可以形成脂质双层。磷脂分子的结构通常包含两个疏水性脂肪酸“尾部”和一个由磷酸基团组成的亲水性“头部”。这两种成分通常通过甘油分子连接在一起。磷酸基团可以用简单的有机分子(如胆碱、乙醇胺或丝氨酸)进行修饰。当置于水溶液中时,磷脂受疏水相互作用驱动,导致脂肪酸尾部聚集,以最大限度地减少与水分子的相互作用。基于二酰基甘氨酰的磷脂有,例如磷脂酸、磷脂酰乙醇胺、磷脂酰胆碱、磷脂酰丝氨酸、磷脂酰肌醇、磷脂酰肌醇磷酸酯、磷脂酰肌醇二磷酸酯、磷脂酰肌醇三磷酸酯和鞘磷脂。在一个实施方案中,磷脂还可以涉及磷脂衍生物,例如合成的磷脂衍生物,包括磷脂酸衍生物(dpma、dppa、dspa)、磷脂酰胆碱衍生物(ddpc、dlpc、dmpc、dppc、dspc、dopc、popc、depc)、磷脂酰甘油衍生物(dmpg、dppg、dspg、popg)、磷脂酰乙醇胺衍生物(dmpe、dppe、dspe dope)和磷脂酰丝氨酸衍生物(dops)。
[0067]
如本文所用,术语“带负电荷的磷脂”涉及在生理ph下具有负电荷的磷脂。与此相反,还存在中性磷脂,其中所述中性磷脂头部基团包含磷酸的负电荷和例如胺基中的正电荷,因此在生理ph下产生净中性电荷。带负电荷的磷脂可包括但不限于磷脂酰丝氨酸、磷脂酰甘油、磷脂酸、磷脂酰肌醇、磷脂酰肌醇磷酸酯、磷脂酰肌醇二磷酸酯、磷脂酰肌醇三磷酸
酯、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸甘油钠盐(dmpg)、1,2
‑
二肉豆蔻酰
‑ꢀ
sn
‑
甘油
‑3‑
磷酸
‑
l
‑
丝氨酸钠盐(dmps)及1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸单钠盐。在一个实施方案中,带负电荷的磷脂的结构元件使其与膜联蛋白发生最佳相互作用,例如羧基中的氧原子和稳定h桥的α
‑
氨基。
[0068]
如本文所用,术语“掺入”涉及颗粒的特征,其中所述颗粒在其主体中包含组分,例如磷脂。所述掺入可以涉及例如包含所述磷脂作为脂质
‑
固体复合材料的一部分。在一个实施方案中,所述掺入涉及在脂质层(优选脂质体中的脂质双层)中包含所述磷脂。在一个实施方案中,颗粒既可掺入磷脂又可被磷脂包覆。
[0069]
如本文所用,术语“被包覆的”涉及颗粒的特征,其中所述颗粒在其表面包含诸如磷脂的组分。在一个实施方案中,所述磷脂是颗粒表面的一部分,例如脂质体的表面和/或涂覆颗粒的表面,例如包覆氧化铁颗粒的脂质层。
[0070]
如本文所用,术语“纳米颗粒或微米颗粒”分别涉及尺寸在1至100 nm之间的颗粒,或尺寸在0.1至100 μm之间的颗粒。纳米颗粒或微米颗粒可由多种材料制成,例如陶瓷、玻璃、聚合物、生物分子和金属。
[0071]
如本文所用,术语“人造细胞”涉及模拟生物细胞的一种或多种功能的工程化粒子。该术语不是指特定的物理实体,而是指生物细胞的某些功能或结构可以用合成实体代替或补充的想法。通常,人造细胞是包含生物活性材料的生物膜或聚合物膜。因此,纳米颗粒、脂质体、聚合物小体、微胶囊和许多其他颗粒可用于制备人造细胞。人造细胞的膜可以由简单的聚合物、交联蛋白、脂质膜或聚合物
‑
脂质复合物制成。此外,可以将膜设计成包含带负电荷的磷脂和/或膜联蛋白。
[0072]
如本文所用,术语“经修饰的细胞”涉及已被修饰的细胞,例如通过遗传修饰所述细胞,以包含/产生带负电荷的磷脂和/或膜联蛋白。在一个实施方案中,未修饰的细胞也包含/产生带负电荷的磷脂和/或膜联蛋白,但与所述未修饰的细胞相比,所述细胞的修饰导致所述经修饰的细胞中所述带负电荷的磷脂和/或所述膜联蛋白的水平增加。
[0073]
如本文所用,术语“直径”涉及穿过球形颗粒中心且其端点位于球形颗粒上的任何直线段。在非球形颗粒的情况下,直径与穿过所述非球形颗粒中心且其端点位于颗粒上的最长线段有关。在一个实施方案中,平均直径涉及包含在一批颗粒中的颗粒直径的平均值。
[0074]
如本文所用,术语“组合物”涉及包含至少本发明的膜联蛋白涂覆的颗粒的组合物。本发明所述的膜联蛋白涂覆的颗粒可以与合适的辅助物质和/或添加剂混合以获得本发明的药学上可接受的组合物和/或产品。此类物质包括药理学上可接受的物质,该物质增加了相互作用的膜联蛋白涂覆的颗粒,或包含该颗粒的物质或材料的稳定性、溶解性、生物相容性或生物半衰期,该物质必须包括某些应用途径,例如静脉注射液、喷雾剂、创可贴或药丸。用于配制药物组合物和/或药物产品的载体、赋形剂和策略,例如通过任何常规途径全身或局部给药,特别是肠内(例如口服,例如以片剂或胶囊的形式)、肠胃外(例如以可注射溶液或悬浮液的形式)、局部(例如以洗剂、凝胶、软膏或霜剂的形式或经鼻腔或栓剂的形式)均为本领域技术人员所熟知并在相应文献中进行了描述。
[0075]
在一个实施方案中,本发明的组合物进一步包含一种或多种免疫刺激化合物,例如佐剂。“佐剂”是以非特异性方式增强免疫应答产生的试剂。常见的佐剂包括吸附有本发明融合蛋白的矿物质(明矾、氢氧化铝、磷酸铝)悬浮液;乳剂,包括油包水和水包油(及其变
体,包括双重乳剂和可逆乳剂)、脂糖、脂多糖、免疫刺激核酸(例如 cpg 寡核苷酸)、脂质体、toll 样受体激动剂(特别是 tlr2、tlr4、tlr7/8 和 tlr9 激动剂),以及这些成分的各种组合。
[0076]
在一个实施方案中,本发明的组合物和/或膜联蛋白涂层的颗粒进一步包含除膜联蛋白和/或抗原之外的治疗剂。除了膜联蛋白和/或抗原之外的所述治疗剂可以被所述颗粒包封和/或可以偶联到颗粒的表面。在一个实施方案中,除膜联蛋白以外的所述治疗剂是化疗物质。在一个实施方案中,所述包封除膜联蛋白以外的治疗剂的膜联蛋白涂覆的颗粒,用于药物递送。在一个实施方案中,优选地膜联蛋白涂层颗粒还包含抗原,用于肿瘤疫苗接种。在一个实施方案中,所述抗原是自身抗原、过敏原和/或癌抗原。在一个实施方案中,膜联蛋白涂覆的颗粒任选地进一步包含用于靶向靶细胞的治疗剂,例如表达dectin
‑
1、dc
‑
sign及其鼠同源物、lrp1、补体受体3(itgam、cd11b)、甲酰肽受体(fpr)家族的受体(如 fpr1、fpr2 和 fpr3)以及脂氧素受体中的任一种的细胞。在一个实施方案中,制备本发明颗粒的方法包括添加抗原和/或治疗剂的步骤。将抗原和/或治疗剂添加到颗粒中的技术,例如通过并入所述颗粒和/或通过偶联到所述颗粒的表面的技术,是本领域技术人员已知的。在一个实施方案中,向颗粒添加抗原和/或治疗剂可能涉及在制备所述颗粒之前、期间或之后添加。
[0077]
如本文所用,术语“产品”涉及任何本发明的颗粒、化合物和组合物,并且特别涉及本发明的膜联蛋白涂覆的颗粒的药学上可接受的制剂。在一个实施方案中,本发明的产品进一步包含用于治疗或预防自身免疫疾病、慢性炎性疾病、过敏或癌症的额外药物活性成分,即化学治疗剂。在一个实施方案中,术语“组合物”和“产品”可互换使用。在多个实施方案中,所述产品用于医药。在一个实施方案中,所述产品是药物。本发明的产品特别用于预防和治疗自身免疫疾病、慢性炎症疾病、过敏和癌症。在一个实施方案中,本发明的产品用于癌症疫苗接种。
[0078]
如本文所用,术语“药物活性剂”涉及起到治疗效果的试剂。在一个实施方案中,膜联蛋白与靶细胞上的受体结合并引起对所述靶细胞的致耐受作用。
[0079]
如本文所用,术语“非共价偶联”涉及膜联蛋白与颗粒的结合,该结合不是由膜联蛋白与所述颗粒的组分之间的共价键介导的。非共价偶联可以涉及静电相互作用、п效应、范德华力和/或疏水效应。在一个实施方案中,术语“非共价偶联”不涉及通过flag标签介导的偶联。在一个实施方案中,膜联蛋白或其片段通过膜联蛋白的脂质结合结构域与包含在所述颗粒中的带负电荷的磷脂的相互作用与所述颗粒偶联。在一个实施方案中,将所述膜联蛋白与包含带负电荷的磷脂的颗粒偶联,导致膜联蛋白的脂质结合域被占据,使得所述被占据的脂质结合域不可用于与细胞膜的脱靶结合。在一个实施方案,所述被占据的脂质结合结构域的膜联蛋白通过膜联蛋白的受体结合结构域与靶细胞上的受体特异性结合。在一个实施方案中,非共价偶联需要钙离子。在许多实施方案中,膜联蛋白与颗粒表面偶联。在一个实施方案中,膜联蛋白与包含在颗粒内部空间内的磷脂偶联和/或与颗粒表面上的磷脂偶联。在一个实施方案中,膜联蛋白未共价偶联至接头分子,例如peg,其并未共价偶联至所述颗粒。
[0080]
本发明人公开了与颗粒偶联的膜联蛋白与靶细胞上的受体结合,并且不表现出与不包含膜联蛋白受体的细胞的脱靶结合。与此相反,不与颗粒结合的可溶性膜联蛋白与不
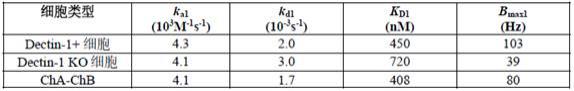
表达膜联蛋白受体的细胞表现出脱靶结合。在一个实施方案中,通过将膜联蛋白预吸附到颗粒上来减少脱靶结合在图3b和表1
‑
3中得到证实。在一个实施方案中,通过将膜联蛋白非共价偶联到颗粒上预先占据膜联蛋白脂质结合位点,减少了由脱靶结合引起的膜联蛋白副作用。
[0081]
如本文所用,术语“补充”涉及混合和/或培养颗粒、包含囊泡的制剂和/或用于制备囊泡的磷脂制剂与其他组分,例如膜联蛋白、膜联蛋白核心结构域、钙和/或抗原。在一个实施方案中,补充涉及将囊泡制剂与膜联蛋白和任选的钙在 1℃ 至 25℃ 的温度下培养 1
‑
48 小时,优选在 4℃ 至 8℃的温度下培养过夜。在一个实施方案中,包含囊泡的制剂和/或用于制备囊泡的磷脂制剂优选用钙补充。在一个实施方案中,所述培养还包括使用振荡器、滚筒或其他搅拌装置来搅拌所述补充的囊泡制剂和/或磷脂制剂。在一个实施方案中,所述补充包括补充浓度至少为0.001mm,优选浓度为0.9
‑
1mm的钙。在一个实施方案中,补充包括补充比磷脂制剂和/或囊泡制剂的带负电荷的磷脂摩尔过量的膜联蛋白、受体结合膜联蛋白核心结构域和/或其片段。在一个实施方案中,补充包括补充膜联蛋白、受体结合膜联蛋白核心结构域和/或其片段和钙。补充可进一步包括补充抗原和/或治疗剂,其中所述抗原和/或治疗剂可被所述颗粒包封,或可偶联至所述颗粒,例如作为膜联蛋白融合蛋白、作为脂质锚定蛋白或通过聚乙二醇化。
[0082]
如本文所用,术语“给药/施用”涉及药剂的给药,例如本发明的膜联蛋白涂覆的颗粒、组合物和/或产品,其可以通过允许试剂到达靶细胞的任何方法来实现。这些方法包括,例如注射、沉积、植入、栓剂、口服摄入、吸入、局部给药或任何可以使制得的所述药剂接近靶细胞的其他给药方法。注射可以是例如静脉内、皮内、皮下、肌肉内或腹膜内。植入包括插入可植入的药物递送系统,例如微球、涂覆的微米颗粒、水凝胶、聚合物储库(polymeric reservoirs)、胆固醇基质(cholesterol matrices)、聚合物系统(polymeric systems)(例如基质侵蚀(matrix erosion)和/或扩散系统和非聚合物系统(例如压缩、融合或部分融合的药丸))。栓剂包括甘油栓剂。口服摄入剂可以是肠溶包衣。吸入包括在吸入器中将药剂与气雾剂一起给药,单独给药或连接可吸收的载体给药。药剂可以悬浮在水溶液中,例如以溶解或胶体形式。水溶液可以是溶剂、部分溶剂或非溶剂。在许多情况下,可以使用水或有机溶液。
[0083]“有效量”是如本文所述的膜联蛋白涂覆的颗粒、药物组合物或产品的缓解疾病和/或病症所发现的症状的量。
[0084]
如本文所用,术语“患者”涉及人或动物,优选哺乳动物。患者的治疗意在包括例如,预防、治疗、缓解疾病或病症的症状或治愈疾病或病症,即免疫疾病(例如免疫缺陷、传染病或癌症)。本发明还包括用于治疗有传染病或癌症风险的对象的方法中使用的膜联蛋白涂覆的颗粒,其中提供了治疗有效量的膜联蛋白涂覆的颗粒。患病风险可能来自例如该疾病的家族史、易患该疾病的基因型或易患该疾病的表型症状。
[0085]
如本文所用,术语“癌症”优选涉及实体瘤,例如选自乳腺癌、骨癌、卵巢癌、肝癌、肾癌和肺癌。
[0086]
在一些特别优选的实施例中,本发明涉及以下项目的主题:第1项:膜联蛋白涂覆的颗粒,包含带负电荷的磷脂和与其非共价偶联的膜联蛋白。
[0087]
第2项:根据第1项所述的膜联蛋白涂覆的颗粒,其中所述膜联蛋白是膜联蛋白组中的任何成员,优选膜联蛋白a1、膜联蛋白a5和膜联蛋白a13中的任一种,更优选膜联蛋白a1或膜联蛋白a5和/或是受体结合膜联蛋白核心结构域或其片段,优选膜联蛋白a1、a5和a13核心结构域中的任一个或其片段,更优选人膜联蛋白a1或a5核心结构域或其片段。
[0088]
第3项:根据第1项或第2项所述的膜联蛋白涂层颗粒,其中所述带负电荷的磷脂是磷脂酰丝氨酸、磷脂酰甘油、磷脂酸、磷脂酰肌醇、磷脂酰肌醇磷酸酯、磷脂酰肌醇二磷酸酯、磷脂酰肌醇三磷酸酯、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸甘油钠盐(dmpg)、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸
ꢀ‑
l
‑
丝氨酸钠盐(dmps)和1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸单钠盐中的任一种。
[0089]
第4项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒进一步包含选自磷脂酰胆碱、磷脂酰乙醇胺、鞘磷脂及其组合的任意磷脂。
[0090]
第5项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒包含磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺。
[0091]
第6项:根据第5项所述的膜联蛋白涂覆的颗粒,其中所述颗粒包含0.5%至100%范围内的磷脂酰丝氨酸、0%至99.5%范围内的磷脂酰胆碱和0%至20%范围内的磷脂酰乙醇胺,其中所述百分比为相对于总磷脂含量的摩尔百分比,其中磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺的摩尔百分比之和不超过100%。
[0092]
项7:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒在颗粒主体中包含所述带负电荷的磷脂和/或被所述带负电荷的磷脂包覆。
[0093]
第8项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒还包含胆固醇、peg、除膜联蛋白以外的治疗剂和/或抗原。
[0094]
第9项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒是纳米颗粒或微米颗粒。
[0095]
第10项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒的平均直径在20 nm至1000 nm的范围内,优选≤400 nm。
[0096]
第11项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒选自脂质囊泡、胶束、固体脂质颗粒、聚合物颗粒、多糖颗粒(例如琼脂糖珠)、氧化铁颗粒、树枝状聚合物、病毒基颗粒、dna基颗粒、修饰细胞、人造细胞和碳纳米管。
[0097]
第12项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒为脂质囊泡,优选为单层或多层脂质囊泡。
[0098]
第13项:根据前述项中任一项所述的膜联蛋白涂覆的颗粒,其中所述颗粒能够与靶细胞上的受体结合,优选与dectin
‑
1、dc
‑
sign、lrp1、补体受体3(itgam、cd11b)、甲酰肽受体 (fpr)和脂氧素受体中的任一种结合。
[0099]
第14项:根据第13项所述的膜联蛋白涂覆的颗粒,其中所述颗粒能够通过与所述dectin
‑
1的β
‑
葡聚糖结合位点不同的结合位点与dectin
‑
1结合。
[0100]
第15项:根据第13或第14项所述的膜联蛋白涂覆的颗粒,其中所述结合通过介导nox
‑
2依赖性的ros产生而对所述靶细胞具有致耐受性作用。
[0101]
第16项:包含如第1
‑
15项中任一项所定义的膜联蛋白涂覆的颗粒的组合物。
[0102]
第17项:根据第16项所述的组合物,其中所述组合物进一步包含药学上可接受的
载体和/或赋形剂。
[0103]
第 18 项:一种用于预防或治疗选自慢性炎症性疾病、自身免疫性疾病、过敏和癌症的疾病的方法的产品,所述产品包含如第 1
‑
15项中任一项所定义的膜联蛋白涂覆的颗粒和/或如第16
‑
17项中任一项所定义的组合物。
[0104]
第19项:根据第18项中所述的特定用途的产品,其中所述膜联蛋白涂覆的颗粒的所述膜联蛋白是药物活性剂。
[0105]
第20项:一种制备膜联蛋白涂层颗粒的方法,所述颗粒优选如第1
‑
15项中任一项所定义,其中所述方法包括用膜联蛋白涂覆的包含带负电荷的磷脂颗粒。
[0106]
第21项:根据第20项所述的方法,其中所述膜联蛋白是膜联蛋白组的任何成员,优选膜联蛋白a1、膜联蛋白a5和膜联蛋白a13中的任一项,更优选膜联蛋白a1或膜联蛋白a5和/或是受体结合膜联蛋白核心结构域或其片段,优选膜联蛋白a1、a5和a13核心结构域中的任一个或其片段,更优选人膜联蛋白a1或a5核心结构域或其片段。
[0107]
第22项:根据第20
‑
21项中任一项所述的方法,其中所述带负电荷的磷脂是磷脂酰丝氨酸、磷脂酰甘油、磷脂酸、磷脂酰肌醇、磷脂酰肌醇磷酸酯、磷脂酰肌醇二磷酸酯、磷脂酰肌醇三磷酸酯、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸甘油钠盐(dmpg)、1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸
‑
l
‑
丝氨酸钠盐(dmps)和1,2
‑
二肉豆蔻酰
‑
sn
‑
甘油
‑3‑
磷酸单钠盐中的任一种。
[0108]
第23项:根据第20
‑
22项中任一项所述的方法,其中所述颗粒进一步包含选自磷脂酰胆碱、磷脂酰乙醇胺、鞘磷脂及其组合中的任何磷脂。
[0109]
第24项:根据第20
‑
23项中任一项所述的方法,其中所述颗粒包含磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺,优选包含0.5%至100%范围内的磷脂酰丝氨酸、95%至95%范围内的磷脂酰胆碱、0%至20%范围内的磷脂酰乙醇胺,其中所述百分比为相对于总磷脂含量的摩尔百分比,其中磷脂酰丝氨酸、磷脂酰胆碱和磷脂酰乙醇胺的摩尔百分比之和不超过100%。
[0110]
第25项:根据第20
‑
24项中任一项的方法,其中所述颗粒将所述带负电荷的磷脂掺入到颗粒主体中和/或被所述带负电荷的磷脂包覆。
[0111]
第26项:根据第20
‑
25项中任一项所述的方法,其中所述颗粒进一步包含胆固醇、peg、除膜联蛋白以外的治疗剂和/或抗原。
[0112]
第27项:根据第20
‑
26项中任一项所述的方法,其中所述颗粒是纳米颗粒或微米颗粒,优选具有20 nm至1000 nm范围内的平均直径的颗粒,优选≤400 nm。
[0113]
第 28 项:根据第 20
‑
27 项中任一项所述的方法,其中所述颗粒选自脂质囊泡、胶束、固体脂质颗粒、聚合物颗粒、多糖颗粒例如琼脂糖珠、氧化铁颗粒、树枝状聚合物、病毒基颗粒、dna基颗粒、修饰细胞、人造细胞和碳纳米管,其中所述颗粒优选为脂质囊泡,更优选为单层或多层脂质囊泡。
[0114]
第29项:根据第20
‑
28项中任一项所述的方法,其中所述方法包括以下步骤:a)提供至少包含所述带负电荷的磷脂的磷脂制剂,并干燥所述磷脂制剂,b)将步骤 a)中获得的干燥磷脂制剂溶解在水溶液中,c)任选地,使步骤 b)中获得的包含磷脂的溶液经受至少一个冷冻/解冻循环,d)使用挤出机挤出在步骤b)中获得的,或任选地在步骤c)中获得的包含磷脂的溶
液,从而获得颗粒,e)用膜联蛋白和任选的钙补充在步骤 d)中获得的颗粒,使所述膜联蛋白与所述颗粒非共价偶联,从而获得膜联蛋白涂覆的颗粒,其中所述方法任选地包括添加抗原和/或治疗剂的步骤。
[0115]
第30项:根据第29项所述的方法,其中所述挤出机装配有孔径为400 nm的膜。
[0116]
第 31 项:一种预防或治疗患者中的选自慢性炎性疾病、自身免疫疾病、过敏症和癌症的疾病的方法,包括向所述患者给药有效量的第1
‑
15 项中任一项所定义的膜联蛋白涂覆的颗粒、第16
‑
17项中任一项所定义的组合物和/或第18
‑
19 项中任一项所定义的产品。
[0117]
第32项:膜联蛋白涂覆的颗粒在制备用于预防或治疗选自慢性炎性疾病、自身免疫病、过敏和癌症的疾病的方法的药物中的用途,优选所述膜联蛋白涂覆的颗粒为第 1
‑
15 项中的任何一项所定义。
附图说明
[0118]
现在参照以下附图进一步描述本发明。
[0119]
下图描述中提及的所有方法均如实施例中详细描述的那样进行。
[0120]
图1显示了一种优化的膜联蛋白(anx)制剂,该制剂是一种膜联蛋白涂覆的脂质囊泡,可与细胞表面的蛋白质靶点 anx 受体特异性结合。
[0121]
图2显示了由 fitc 平均荧光强度(mfi)的增加表示可溶性膜联蛋白(sol. anx)和 anx 涂覆的囊泡诱导第二信使的 anx 受体依赖性诱导。 *p<0.5,**p<0.01(非配对, t检验)。
[0122]
图3显示了保守的膜联蛋白核心结构域在不同于β
‑
葡聚糖结合位点的位点被 dectin
‑
1 识别。
[0123]
(a)将小鼠(m)膜联蛋白(anx)a1 和 manxa5 固定并与指定的 c 型凝集素受体(clr)人(h)fc 融合蛋白(clr
‑
hfc)一起培养。使用碱性磷酸酶(ap)偶联的抗 hfc 抗体进行融合蛋白检测。
[0124]
(b)使用qcm 技术将耗尽的酵母聚糖(dz)或hanxa1δn 涂覆的囊泡与表达 hdectin
‑
1 和dectin
‑
1 ko mm6 细胞相互作用。使用捕捉分子 cona将两种细胞类型固定在attana 传感器表面。使用 attana cell 200
™ꢀ
生物传感器评估分析物与细胞表面的相互作用。信号输出以频率(hz)形式给出且与传感器表面的质量变化直接相关。
[0125]
(c) 过滤后的dz(≤400nm)和hanxa1δn涂覆的囊泡对表达hdectin
‑
1的mm6细胞的特征性结合反应。b
max
值表示完全饱和的细胞表面结合的配体特异性频率(dz≈7hz,hanxa1δn涂覆的囊泡≈14hz)。
[0126]
(d)首先,将 dz 应用于固定化细胞数次(实线箭头)直到获得 dz(≈7hz)与细胞表面的完全结合反应。接下来,将 dz 和hanxa1δn涂覆的囊泡混合物施加数次(虚线箭头)以研究其他结合反应的发生。
[0127]
(e)以如(d)中所述的竞争实验但相反的顺序应用分析物(虚线箭头:注射hanxa1δn涂覆的囊泡,实线箭头:注射 dz 和hanxa1δn涂覆的囊泡)。结果至少代表两个独立实验。
[0128]
图 4 显示了膜联蛋白诱导dectin
‑
1 依赖性的 syk 磷酸化和活性氧(ros)的产生。
[0129]
在37℃或 4℃培养 3 小时后作为对照(a
‑
c)进行吞噬作用实验分析,通过流式细胞术分析骨髓衍生树突细胞(bmdc)或mm6细胞中的脾酪氨酸激酶(syk)
‑
磷酸化。在存在磷酸酶抑制剂钒酸钠 (1mm)(a和b)或没有磷酸酶抑制剂 (c)的情况下如图所示处理细胞,并通过抗p
‑
syk抗体在细胞内染色。(d
‑
g)2 小时后由 h2dcfda确定细胞内 ros 水平。细胞用指定的配体处理1.5小时,然后进一步用h2dcfda培养30分钟。佛波醇12
‑
肉豆蔻酸盐13
‑
醋酸盐(phorbol 12
‑
myristate 13
‑
acetate,pma)和dectin
‑
1配体耗尽酵母聚糖(dz)用作阳性对照。膜联蛋白(anx)a1δn与ros清除剂6
‑
羟基
‑
2,5,7,8
‑
四甲基色烷
‑2‑
羧酸(6
‑
hydroxy
‑
2,5,7,8
‑
tetramethylchroman
‑2‑
carbons
ä
ure,trolox)以及热灭活的(h.i.)anxa1δn的共处理作为阴性对照。异硫氰酸荧光素(fitc)、中值荧光强度(mfi)、含磷脂酰丝氨酸(ps)的囊泡(psv)。结果代表两个(c、f、g)或平均值
±
s.d、或三个(manxa5,h.i. manxa1δn,dz),四个(manxa1δn+trolox),八个(msanxa1δn [500nm],pma)或九个(msanxa1[1000nm])(d和e)独立实验中的一个代表性实验。 *** p<0.001,** p<0.01,* p<0.05,n.s.=不显著,n.d. = 未检测到fitc
‑
mfi增加(非配对,双侧 t 检验)。
[0130]
图 5 显示了 dectin
‑
1 介导的凋亡细胞和膜联蛋白的免疫抑制作用。
[0131]
总共 10
5 个 bmdc与panxa1δn(1000nm)、凋亡 jurkat t 细胞(aj:比例为 0.5:1 或 0.1:1)或凋亡 rma 细胞(arma:比例为 4:1)共培养8小时。预培养后,用tlr激动剂 cpg(15
‑
40nm)刺激 bmdc 过夜。刺激后16
‑
24小时通过elisa分析上清液中的细胞因子浓度。
[0132]
(a)用 wt(左)和 dectin
‑
1 ko(右)bmdc 进行的代表性抑制实验。在wt细胞中,与没有用膜联蛋白预培养的cpg处理细胞相比,panxa1δn阻止了il
‑
6的分泌。相比之下,dectin
‑
1 ko bmdc中膜联蛋白的抑制能力降低。
[0133]
(b
‑
g)三到五个独立实验的量化数据。细胞因子分泌的抑制归一化为仅有cpg 刺激((100 处理 / 仅有 cpg)*100)。
[0134]
(h
‑
i)在 cpg 刺激后 2
‑
3 天通过流式细胞术分析 cd80 表面染色结果。(h)wt(左)和dectin
‑
1 ko bmdc(右)中在特定处理下cd80表达的代表性直方图。(i)cd80表面标记物表达的五个独立实验的量化数据。cd80表达的抑制被归一化为仅cpg刺激减去未处理 (100
ꢀ‑
((处理
‑
未处理) / (仅cpg
ꢀ‑
未处理))*100)。结果代表来自至少三个独立实验的平均值。*** p<0.001,** p<0.01,* p<0.05(配对,双侧 t 检验)。原核表达的anxa1核心域(panxa1δn),真核表达的 anxa1 核心域(eanxa1δn)。
[0135]
图 6 显示了表现出自身免疫症状的老年 dectin
‑
1 ko 小鼠。
[0136]
(a)wt和dectin
‑
1 ko小鼠的脾脏重量。
[0137]
(b
‑
f)分离脾细胞的dc(cd11c+和mhcii+)和巨噬细胞(f4/80+和 mhcii+)与活化标记物cd80和cd86以及抗炎 m2
‑
巨噬细胞标记物 cd206 结合染色,并通过流式细胞术进行分析。
[0138]
(g
‑
i)来源于心脏穿刺术的经肝素处理的血液样本在 4℃以 18000xg 离心 10分钟。收集上清液并通过elisa分析指示抗dsdna的自身抗体。虚线代表阴性对照仅酪蛋白的吸光度。结果代表每组 4
‑
8 只小鼠的平均值
±
标准差(s.d.)。*** p<0.01** p<0.01, * p
<0.05, n.s.=不显著(非配对,双侧t检验)。体重(bw)、平均荧光强度 (mfi)。
[0139]
图 7 显示了人和小鼠 dectin
‑
1 都识别的膜联蛋白核心域。
[0140]
(a)manxa1δn或(b)hanxa1δn(10μg/ml)在5 mm的cacl
2 环境下涂覆在 96 孔板上过夜。使用补充有5 mm cacl
2 的pbs/5% bsa封闭板1小时。通过 hrp 偶联的小鼠抗 hfc 抗体检测(a)mdectin
‑
1 和(b)hdectin
‑
1 与板结合的anxa1δn的结合。用邻苯二胺二盐酸盐(o
‑
phenylenediamine dihydrochloride)显示其发育。结果代表至少两个独立实验。
[0141]
(c
‑
h)anx/mdectin
‑
1 hfc 相互作用的 spr 传感图。所示的anx 固定在 cm5 传感器芯片上。 mdectin
‑
1 hfc(红色)和对照组 fc(绿色)用作流动中的配体。传感图仅展示活动的流通池。
[0142]
图8显示了包含磷脂酰丝氨酸的膜联蛋白涂覆的囊泡的传代。
[0143]
(a)hanxa1δn涂覆的ps 囊泡生成的图示。
[0144]
(b)ps 囊泡上 anx 表达的代表性流式细胞术分析。
[0145]
(c)图示的示例性膜联蛋白涂覆的 ps 囊泡进一步包含抗原。
[0146]
图 9 显示了 dz 和与囊泡结合的hanxa1δn结合 到 mm6 细胞的 qcm 结合状态分析。
[0147]
(a 和 b)使用捕捉分子 cona 将过度表达类(h)dectin
‑
1 (hdectin
‑
1)和dectin
‑
1 ko mm6 细胞(c 和 d)固定在attana传感器表面上。使用attana cell 200
™ꢀ
生物传感器评估分析物与细胞表面的相互作用。信号输出与传感器表面的质量变化直接相关并以频率(hz)形式给出。(a)基于qcm的不同比例的囊泡结合膜联蛋白a1δn的分析如图所示。(b)基于 qcm 对过滤的耗尽酵母聚糖(dz)(≤ 400 nm)的分析如图所示。图中展示的代表性结果是由两个独立实验得出的。
[0148]
图 10 显示了囊泡结合的 anxa1δn 和 acs 诱导dectin
‑
1依赖性的syk的磷酸化。
[0149]
(a和b)在(a)骨髓衍生树突细胞(bmdc)和(b)mono mac 6(mm6)中作为 dectin
‑
1独立配体的β
‑
葡聚糖或葡聚糖(dextran)的dectin
‑
1依赖性吞噬作用的对照实验细胞。37℃ 或 4℃下培养 3 小时后分析吞噬作用实验作为对照。
[0150]
(c 和 d)通过流式细胞术分析 bmdc 中的 syk 磷酸化。细胞在磷酸酶抑制剂钒酸钠(1mm)环境下如图所示进行处理,并在冰上用抗 p
‑
syk 的细胞内抗体染色。
[0151]
**** p<0.0001, *** p<0.001, * p<0.05, n.s. = 不显著(非配对,双侧 t 检验)。结果显示平均值
±
标准差。两到三个中的一个代表性实验。
[0152]
图 11 显示了 dectin
‑
1 介导的凋亡细胞和重组 anxa1δn 的免疫抑制作用。
[0153]
总共 10
5 个mm6细胞(a)或bmdc(b和c)与真核表达的小鼠(m)膜联蛋白(anx)a1δn(eanxa1δn)(1000nm)或凋亡jurkat t 细胞(aj)以指定比例共培养8小时。预培养后,用 tlr 激动剂 r848 和 100μg/ml pma(a)或 20
‑
30 nm cpg(b 和 c)刺激细胞过夜。刺激后24小时通过elisa分析上清液中的细胞因子浓度。细胞因子分泌的抑制归一化为仅cpg 刺激((100 处理 / 仅 cpg)*100)。
[0154]
结果代表平均值
±
标准差(a)或六到八个独立实验(a)中唯一的平均值(b和c)。*** p<0.001,** p<0.01,* p<0.05(非配对(a)或配对(b和c),双侧t检验)。
[0155]
)显示了凋亡细胞和重组 anxa1δn不激活 nf
‑
κb。用指示的配体处理表达
technologies)进行瞬时转染。使用 hitrap protein g hp 柱(ge healthcare)从细胞上清液中纯化clr
‑
fc融合蛋白。每个clr
‑
fc融合蛋白的纯度通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds
‑
page)和随后的考马斯亮蓝染色(coomassie staining)、使用抗人 igg
‑
hrp 抗体(dianova)的蛋白质印迹以及质谱法进行确认。将manxa1(0.5
ꢀµ
g/孔)和 manxa5(0.5
ꢀµ
g/孔)涂覆在 96 孔高结合板(greiner)上过夜。用 pbs 中的 1% bsa 封闭后,将20 μg/ml 的每种 clr
‑
fc 融合蛋白在凝集素结合缓冲液(50 mm hepes,5 mm mgcl
2 ,5 mm cacl
2 ,ph 7.4)中室温孵育 2 小时。 clr
‑
fc 融合蛋白的结合通过碱性磷酸酶偶联的山羊抗 hfc 抗体(dianova)检测。使用对硝基苯酯磷酸酯(p
‑
nitrophenyl phosphate)(thermo scientific)进行展示。
[0169]
在所有测试的 clr中,仅检测到 dectin
‑
1 与两种膜联蛋白的特异性结合(图 3a)。由于所有膜联蛋白家族成员共享膜联蛋白核心结构域,这些数据表明 dectin
‑
1与保守的膜联蛋白核心结构域结合。dectin
‑
1 与膜联蛋白 a1 核心结构域的特异性结合通过使用缺乏 n 末端的膜联蛋白 a1(膜联蛋白a1δn)的截断版本得到证实(图 7a 和 b)。
[0170]
此外,还进行了基于 fc 受体的表面等离子体共振实验。在biacore t100仪器(ge healthcare)上进行表面等离子体共振(spr)结合分析。根据厂商建议,使用胺偶联试剂盒(amine coupling kit)(ge healthcare)使用约10000 rus 的 anxa1 对 cm5 传感器芯片进行功能化。使用 biacore t100 control 软件的“动力学”功能进行动力学测量。含有 cacl2(1 mm)、mgcl2(1 mm)、0.005% tween ph 7.4 的 hepes(10 mm)用作运行缓冲液,所有测量均在 25 ℃和 30 μl min
‑
1 的流速下进行。使用结合和解离时间的标准参数,捕获了约 500 rus 的融合蛋白,并通过了指定的浓度。流动池用 10 mm 甘氨酸
‑
hcl 于ph 1.7 条件下再生 30秒。使用 biacore t100 评估软件进行结合反应的动力学评估。表面等离子体共振实验表明,dectin
‑
1 与所有测试的膜联蛋白(膜联蛋白 a1、膜联蛋白 a1δn、膜联蛋白 a5 和膜联蛋白 a13)在纳摩尔范围内具有高亲和力结合(图 7c
‑
h)。
[0171]
为了在更贴近生理的环境下研究 dectin
‑
1/膜联蛋白的相互作用,使用石英晶体微量天平(qcm)技术进行了基于细胞的结合亲和力测量。与传统系统相比,基于细胞的 qcm 技术允许研究生理细胞表面环境中的相互作用,并将质量变化与传感器的频率变化结合起来。简而言之,使用捕获方法将dectin
‑
1 表达和dectin
‑
1 ko mm6 细胞固定在 attana 传感器表面。洗涤细胞沉淀物并以 2x10
6 个细胞/ml的最终密度重悬于pbs中。使用attana胺偶联试剂盒(3501
‑
3001)将捕获分子伴刀豆球蛋白 a(concanavalin a)(cona) 固定在 lnb 羧基表面(3623
‑
3001)上。 150 hz 的 cona 稳定地固定在表面上。通过室温下在 pbs 中孵育 10
5 个细胞 30 分钟,在表面上捕获细胞。孵育后,细胞在室温下用 0.7 ml pbs 冲洗 3 次,并在 4℃下用新鲜的 4%(v/v)无甲醇甲醛(thermo fisher scientific)中稳定15分钟。通过使用 3
ꢀµ
m dapi(merck)染色细胞并在荧光显微镜下观察来确定细胞覆盖率。使用 attana cell 200
™ꢀ
生物传感器评估分析物与细胞表面的相互作用。初始结合实验在 22℃下以 20
ꢀµ
l/分钟的流速进行。从随后的分析物进样中减去空白进样以校正基线漂移。一次将一种分析物注入细胞表面 105 秒。对于动力学实验,将每种分析物的四倍稀释液注入细胞表面。使用10 mm甘氨酸 (ph 2.2)注射30 秒进行表面再生。重复注射相同浓度的分析物会产生相同的结合曲线,表明再生不会改变表面的结合能力。对于将细胞涂层在传感器表面上的竞争性结合分析如上所述。该实验在在 22℃下以 20
ꢀµ
l/min 的流速且
在 pbs 连续流动的条件下进行。进行单循环动力学实验以确定给定表面的每种分析物的饱和水平(bmax 值)。在表达 dectin
‑
1 的 mm6 细胞上,将 hanxa1δn 涂覆的囊泡注入流动池中直至饱和(bmax)。将 hanxa1δn 涂覆的囊泡和 dz(1:1)的混合物进一步注入饱和表面。实验也以相反的顺序进行,即在注入混合物之前注入 dz。使用 attester 软件(attana ab)记录结合实验期间传感器表面共振的频率变化(δf),并利用评估(attana ab)和tracedrawer软件(ridgeview instruments)以 1:1 或1:2的结合模型来分析数据,进而计算动力学参数包括速率常数(ka、kd)、解离平衡常数(kd)和最大结合容量 (bmax)。
[0172]
使用稳定转染的表达 dectin
‑
1 的人单核细胞 mono mac 6 (mm6)细胞和 crispr
‑
cas9 介导的 dectin
‑
1 敲除(ko)mm6 细胞进行测试,可溶性重组膜联蛋白 a1δn 和膜联蛋白 a5 作为配体,dectin
‑
1 特异性抗体和特异性 dectin
‑
1 配体耗尽酵母聚糖(dz)作为阳性对照。与 dectin
‑
1 ko mm6 细胞相比,观察到膜联蛋白与表达 mm6 的 dectin
‑
1 的结合更强(表 1 和 2)。然而,对 dectin
‑
1 的亲和力只能通过推断与 dectin
‑
1 ko 细胞的背景结合来计算。在 dectin
‑
1 ko 细胞中观察到膜联蛋白与负电荷磷脂(例如磷脂酰丝氨酸(ps)) 的背景结合,这些磷脂在活吞噬细胞的细胞表面以低水平表达(表 1 和 2,图 3)。
[0173]
表 1:使用基于细胞的石英晶体微量天平(qcm)技术将 annexina1
∆
n 与 dectin
‑
1+ 和 dectin
‑
1 ko mm6 细胞结合。
[0174]
表 2:使用基于细胞的石英晶体微量天平(qcm)技术将 annexina5 与 dectin
‑
1+ 和 dectin
‑
1 ko mm6 细胞结合。
[0175]
表 3:使用基于细胞的石英晶体微量天平(qcm)技术将 αdectin
‑
1 mab 与 dectin
‑
1+ 和 dectin
‑
1 ko mm6 细胞结合。
[0176]
本文公开的数据将clr dectin
‑
1鉴定为靶细胞(例如早期acs)表面上的免疫抑制信号受体,其被膜联蛋白结合,即本发明的可溶性膜联蛋白和/或膜联蛋白涂覆的颗粒。本发明公开的膜联蛋白 a1δn 在dectin
‑
1上的识别位点与其β
‑
葡聚糖结合位点不同,且即使膜联蛋白的磷脂结合位点与磷脂结合,仍可用于 dectin
‑
1 结合。检测到了囊泡结合膜联蛋白 a1δn对 dectin
‑
1 的纳摩尔亲和力,这与抑制性 dectin
‑
1 配体海带多糖的亲和力相似。
[0177]
实施例 5:通过预吸附膜联蛋白减少背景结合
为了防止膜联蛋白与带负电荷的磷脂的背景结合,制备了含有 ps 的脂质囊泡并加载了膜联蛋白a1δn(图 8a和b)。如此,膜联蛋白的假定受体结合界面
ꢀ‑ꢀ
如存在,例如在凋亡细胞上
ꢀ‑ꢀ
在 ps 结合位点被占据时仍可用于相互作用。本发明人证明了使用膜联蛋白涂覆的脂质囊泡与表达 dectin
‑
1 的 mm6 细胞的明显结合,其k
d
值为4.3e
‑4,与抗 dectin
‑
1 单克隆抗体(acris)相当(图 3b 和表 3)。最后,dectin
‑
1是膜联蛋白 a1 和其他膜联蛋白家族成员的 ps 结合核心域的特异性受体。
[0178]
此外,还进行了竞争性 qcm 实验以研究膜联蛋白是否与经典病原体衍生的 dectin
‑
1 配体(例如 dz)共享相同的结合位点。在这些实验中,与 dectin
‑
1 ko mm6 细胞相比,观察到与表达 dectin
‑
1的 mm6 细胞的排他性结合(图 9a和 b)。确定了两种配体饱和频率的特定变化(膜联蛋白 a1δn 为 14 hz,dz 在表达 dectin
‑
1的mm6 细胞上为 7hz,图 3c)。对于竞争实验,dz 使表达 dectin
‑
1 的 mm6 细胞饱和,并测量了随后注射囊泡结合膜联蛋白 a1δn 后频率的任何额外变化。图 3d 中显示的数据表明,囊泡结合的膜联蛋白 a1δn 仍然能够结合 dz 饱和细胞,其动力学与单独的囊泡结合膜联蛋白 a1δn 相同(图 3c)。通过以相反的顺序注射配体来重现这些结果(图 3e)。总之,数据显示脂质结合膜联蛋白 a1 核心结构域与 dectin
‑
1 的不同结合位点结合,不会干扰病原体衍生的
ꢀß‑
葡聚糖的结合。
[0179]
实施例 6:膜联蛋白诱导dectin
‑
1依赖性的 syk 磷酸化和活性氧(ros)的产生dectin
‑
1 是一种众所周知的受体,通过暴露细胞壁 β
‑
葡聚糖用于真菌内化。为了测试 dectin
‑
1 参与凋亡细胞的摄取或胞吞作用,使用来源于骨髓的树突细胞(bmdc)和mm6细胞进行了吞噬作用实验。为了诱导细胞凋亡,在 stratalinker 1800(stratagene/agilent technologies)中用 75 mj/cm2(jurkat t 细胞)或 500mj/cm2(rma
‑
ova 细胞)uv
‑
c 照射细胞,并在 2
‑
2.5 小时后使用在 rpmi / 10% fcs 中 37℃培养。令人惊讶的是,dectin
‑
1 缺陷细胞中的胞吞作用仅略微降低(图 10a 和 b)。
[0180]
本发明人公开了dectin
‑
1上膜联蛋白的识别位点与dectin的β
‑
葡聚糖结合位点不同。根据独特的结合位点并且与β
‑
葡聚糖的dectin
‑
1依赖性吞噬作用相反,本发明人没有检测到decin
‑1‑
膜联蛋白的相互作用在吞噬作用或胞吞作用中起显著作用。
[0181]
本发明人得出除dectin
‑
1 以外的受体足以进行有效的胞吞作用的结论。
[0182]
dectin
‑
1 激活后最早的信号事件之一是 src 家族激酶对 syk 的磷酸化。为了测试膜联蛋白核心结构域是否也启动了dectin
‑
1 依赖性的 syk 磷酸化,使用了一种抗体来识别 tyr348 上的细胞内 syk 磷酸化,表明 syk 完全激活。在 mm6 和原代 bmdc中,可溶性膜联蛋白 a1δn 根据 dectin
‑
1 的表达诱导 syk 磷酸化(图 4a)。在用囊泡结合膜联蛋白 a1δn 和凋亡细胞 (ac)处理后,也观察到 syk 的磷酸化(图 10)。令人惊讶的是,膜联蛋白 a1δn 和
ꢀß‑
葡聚糖的 syk 磷酸化动力学不同。虽然 dz 诱导了持久的 syk 磷酸化(≥ 30 分钟),但膜联蛋白介导的 syk 磷酸化的特征是 15 分钟后出现短峰,并迅速下降至基线水平(图 4b)。
[0183]
dectin
‑
1 参与和 syk 磷酸化后的一个主要信号事件是 ros 的产生。因此,确定了用膜联蛋白 a1δn刺激后的细胞ros水平。使用ros敏感的 h2dcfda(sigma
‑
aldrich)测定 bmdc、mm6 和 jurkat t 细胞中 ros 的细胞内量。1x10
5 个细胞/孔接种在 rpmi/fcs 中,并补充以 50 μg/ml 的多粘菌素 b(pmxb;abcam)以排除 lps 介导的效应。1 小时后增
加处理,并将细胞在 37℃下培养 0 至 2.5 小时。处理后,添加 5
ꢀµ
m h2dcfda 培养0.5 小时。通过添加 25μm 羟基自由基清除剂 trolox 或 20mm 抗氧化剂 n
‑
乙酰
‑
l
‑
半胱氨酸(nac;sigma
‑
aldrich) 10
‑
15 分钟以停止反应。之后,将细胞保持在冷冻黑暗环境下并用冷冻的 rpmi/fcs 洗涤以减缓细胞代谢,并在测量过程中补充 100
ꢀµ
m trolox 或 20mm nac 以排除非特异性 ros 信号。 ros 的产生通过 fitc 通道内的流式细胞术进行量化。将所示的平均荧光强度(mfi)的增加归一化为未处理的细胞((mfi 处理
ꢀ‑ꢀ
mfi 未处理)/mfi 未处理 * 100)。
[0184]
检测到 2 小时后 ros 产生的时间依赖性增加达到其最大值。本发明人分别用可溶性和囊泡结合膜联蛋白 a1δn 或膜联蛋白 a5 处理后观察(图4c、d和e ),使用bmdc和 mm6细胞证明膜联蛋白介导的 ros 产生显然是一种 dectin
‑
1 依赖性效应。通过使用热灭活的膜联蛋白以及特定的 ros 清除剂 trolox,进一步测试了这些测定的特异性(图 4c)。一致地,dectin
‑
1 ko mm6 细胞中dectin
‑
1 表达的重建能够挽救膜联蛋白介导的ros 产生表型。使用 dectin
‑
1 或 dc
‑
sign 稳定转染的固有 dectin
‑
1 缺陷 jurkat t 细胞作为对照,验证了膜联蛋白介导的 ros 产生的 dectin
‑
1 依赖性。同样在该系统中,用膜联蛋白 a1δn 处理以 dectin
‑
1 特异性方式诱导显著的 ros 增加。佛波醇
‑
12
‑
肉豆蔻酸
‑
13
‑
醋酸盐(pma)诱导的 dectin
‑
1 独立 ros 在所有细胞系统中均未改变。syk 磷酸化的抑制消除了膜联蛋白 a1δn 介导的 ros 增加,表明膜联蛋白 a1δn 诱导了 syk 依赖性 ros 信号(图 4f)。最后,这些数据表明膜联蛋白 a1 核心域和膜联蛋白 a5 作为 c 型凝集素受体(clr)dectin
‑
1 的内源性配体,导致 syk 磷酸化和 ros 产生。与 bmdc中 pma 引起的氧化爆发相比,膜联蛋白处理诱导了中等 ros 水平,表明在信号级联中起到了作用(图 4c 和 d)。
[0185]
dectin
‑
1 对膜联蛋白 a1δn的识别导致 syk 磷酸化并诱导依赖于nox
‑
2 的ros释放。然而,膜联蛋白 a1δn 诱导的细胞内 ros 水平大大低于氧化爆发所特有的 ros 水平。因此,数据表明膜联蛋白 a1δn 诱导的 ros 水平确实主要用于抑制细胞内信号通路并用于防止 dc 激活。
[0186]
实施例 7:膜联蛋白诱导的 ros 依赖于 nadph 氧化酶 2在细胞内,ros 由位于细胞质、过氧化物酶体、线粒体膜和质膜中的不同细胞来源产生。吞噬细胞中 ros 的主要来源是质膜结合酶复合物 nadph 氧化酶
‑
2 (nox
‑
2),它将 ros 释放到细胞外环境中。在表征膜联蛋白诱导的来源于ros第一次尝试中,本发明人旨在通过使用膜不可渗透的过氧化氢酶清除细胞外ros。事实上,向培养基中添加过氧化氢酶消除了膜联蛋白介导的 ros 产生。因此,本发明人认为膜结合的nox酶是膜联蛋白介导的来源于ros的可能候选物。为了进一步阐明nox的参与,本发明人另外使用了nox抑制剂二亚苯基碘鎓(dpi)。正如对过氧化氢酶所观察到的那样,用 dpi 预处理可阻断膜联蛋白诱导的 ros。
[0187]
为了特异性靶向nox
‑
2,本发明人使用竞争性抑制nox
‑
2组装但不抑制其他nox酶的活化的肽抑制剂gp91
‑
tat。根据 nox
‑
2 在膜联蛋白信号传导中的作用,与对照肽 scr
‑
tat 相比,gp91
‑
tat 显着降低了膜联蛋白诱导的 ros 产生。最后,本发明人在缺乏 nox
‑
2 复合物的主要亚基 gp91(gp91
phox(
‑
/
‑
) 小鼠)的 bmdc 中进行了 ros 实验,并将它们与来自 wt 同窝的 bmdc 进行了比较。膜联蛋白的 ros 信号在 gp91
phox(
‑
/
‑
) bmdcs 中被消除。
apoptotic cells is mediated by the annexin core domain. j immunol. 194(11), 5233
‑
42. [5] walther, a., k. riehemann, and v. gerke. 2000. a novel ligand of the formyl peptide receptor: annexin i regulates neutrophil extravasation by interacting with the fpr. mol cell 5: 831
‑
840.[6] brown g. d., willment j. a. and whitehead l. (2018) c
‑
type lectins in immunity and homeostasis. nat rev immunol. 18(6):374
‑
389.[7] dillon s.r. (2000) annexin v binds to viable b cells and colocalizes with a marker of lipid rafts upon b cell receptor activation. j immunol 164: 1322
‑
1332.[8] ran s. et al. (2002) phosphatidylserine is a marker of tumor vasculature and a potential target for cancer imaging and therapy. int j radiat oncol biol phys. 54(5):1479
‑
84.[9] garnier b. et al (2009) annexin a5
‑
functionalized liposomes for targeting phosphatidylserine
‑
exposing membranes. bioconjug chem. 20(11):2114
‑
22. doi: 10.1021/bc9002579.[10] plato, a. willment, j. a. and brown g. d. (2013) c
‑
type lectin
‑
like receptors of the dectin
‑
1 cluster: ligands and signaling pathways. international reviews of immunology. 32, 134
‑
156.[11] temmerman k. and nickel w. (2009) a novel flow cytometric assay to quantify interactions between proteins and membrane lipids. journal of lipid research. 50(6), 1245
–
1254. doi: 10.1194/jlr.d800043
‑
jlr200。
[0197]
在说明书、权利要求和/或附图中公开的本发明的特征可以单独地或以其任意组合的方式作为以各种形式实现本发明的材料。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1