治疗囊性纤维化的方法与流程
治疗囊性纤维化的方法
1.相关申请的交叉引用
2.根据35u.s.c.
§
119(e),本技术要求美国临时专利申请no.62/789,797(2019年1月8日提交)、no.62/865,731(2019年6月24日提交)和no.62/870,358(2019年7月3日提交)的权益,通过引用将它们各自的内容整体并入本文。
技术领域
3.本发明涉及使用支气管动脉递送来向肺给予治疗性载体,包括但不限于用于治疗囊性纤维化的腺相关病毒(aav)颗粒、病毒粒子和载体。
背景技术:
4.基因疗法已被证明不仅具有治愈遗传紊乱的潜力,而且还有助于使用病毒(例如腺相关病毒(aav))对获得性和退行性疾病进行长期非侵入性治疗。aav本身是需要辅助病毒以有效复制的非致病性依赖性细小病毒。由于其安全性和简便性,aav已被用作基因治疗的病毒载体。aav具有广泛的宿主和细胞类型趋向性(tropism),能够转导分裂细胞和非分裂细胞。迄今为止,已鉴定出12种aav血清型和超过100种变体。已经表明不同aav血清型在体内或体外对感染不同组织的细胞可具有不同能力,并且这些感染力的差异可能与位于每种aav血清型衣壳表面上的特定受体和共受体(co
‑
receptor)有关,或可能与细胞内运输途径本身有关。
5.因此,作为酶疗法的替代或补充,已对利用基因疗法来治疗疾病(例如血友病)的可行性进行了研究(high k.a.等,(2016)hum.mol.genet.apr 15;25(r1):r36
‑
41;samelson
‑
jones b.j.等,(2018)mol ther methods clin dev.2018dec 31;12:184
‑
201)。
6.囊性纤维化(cf)是一种以逐渐破坏肺的气道感染、炎症、重塑和阻塞为特征的疾病,并且是最常见的致命性遗传性肺病。cf是一种常染色体隐性紊乱,其特征在于水和电解质运输异常,导致胰腺和肺功能不全。它是最常见的严重常染色体隐性紊乱之一,在北美携带频率(carrier frequency)为5%且每2500名活产婴儿中就有1人受到影响。
7.cf是由囊性纤维化跨膜传导调节蛋白(cftr)基因突变引起的隐性疾病,cftr基因编码受atp水解和磷酸化调节的阴离子通道。cf是基因疗法的引人注目的候选者,因为杂合子在表型上是正常的,而肺内气道内衬的靶细胞有潜力通过气溶胶、局部策略或血管策略进行载体递送。
8.囊性纤维化没有已知的治愈方法。发达国家的平均预期寿命为42至50岁。肺问题是导致80%囊性纤维化患者死亡的原因。
9.以下cf疾病特异性疗法包括供口服使用的(伊伐卡托)片剂。美国最初批准:2012年针对仍会在上皮细胞表面产生cftr蛋白的更温和(和更罕见)突变;供口服使用的(鲁玛卡托/伊伐卡托)片剂。美国批准:2015年用于治疗具有两个拷贝的f508del突变(f508del/f508del)的cf患者,针对最常见的严重突变;供口服使用的symdeko
tm
(tezacaftor/伊伐卡托)片剂。美国最初批准:2018年针对单个f508del杂合子和
kalydeco未涵盖的其它一些突变的治疗。
10.对症治疗包括:雾化高渗盐水、阿法链道酶(dornase alfa)和甘露醇干粉,以降低气道粘液的粘度;抗生素(通常雾化),以治疗地方性铜绿假单胞菌(pseudomonas aeruginosa)感染;支气管扩张剂,以改善气道通畅;类固醇、日常胸部按摩、振动和冲击以使分泌物松动。
11.因此,特别是对于最常见的严重突变而言,存在显著未满足的医疗需求。向cf的靶细胞群递送治疗剂仍然是重大挑战。因此,本领域需要使用安全且有效的载体系统方法的用于治疗cf的方法,所述方法通过将野生型cftr基因递送至肺组织来靶向cf气道中的基本离子转运缺陷。
技术实现要素:
12.本文描述的技术总体上涉及使用支气管动脉递送来给予载体的基因治疗方法,所述载体包括但不限于用于治疗cf的腺相关病毒(aav)颗粒、病毒粒子和载体。
13.相应地,本文描述的是用于给予病毒载体(例如,使用raav载体作为示例性实例)的导管,所述病毒载体包含用于治疗囊性纤维化的含有反向末端重复(itr)、启动子、异源基因、poly
‑
a尾和潜在的其它调节元件的核苷酸序列。
14.cf是一种以逐渐破坏肺的气道感染、炎症、重塑和阻塞为特征的疾病。肺部的物理屏障和宿主免疫屏障对成功将基因转移到呼吸道提出了挑战。cf以常染色体隐性方式遗传。它是由囊性纤维化跨膜传导调节蛋白(cftr)的基因的两个拷贝中都存在突变而引起的。cftr是脊椎动物中的膜蛋白和氯离子通道,由cftr基因编码。仅有单个cftr工作拷贝的人是携带者,其它大多是正常的。cftr参与汗液、消化液和粘液的产生。当cftr不具有功能时,通常稀薄且流动的分泌物反而变得厚重且粘稠。该状况是通过汗液测试和基因测试来诊断的。婴儿出生时的筛查在世界某些地区进行。
15.cftr基因是基因疗法的引人注目的候选者,因为杂合子在表型上是正常的,而肺内气道内衬的靶细胞有潜力通过气溶胶或其它局部策略进行载体递送。自1989年首次克隆cftr基因以来,已经研究了若干种用于矫正cf肺病的基因疗法策略。然而,安全且有效的载体系统的开发仍然是重大挑战。这在部分程度上是由于已进化的多重复杂的肺屏障会清除或阻止外来颗粒的摄取。cf肺中厚重的分泌物以及慢性感染和炎症的继发效应为基因转移带来了额外的障碍。
16.如本文所述的是用于通过将囊性纤维化跨膜传导调节蛋白(cftr)基因直接递送至肺来治疗cf的方法。本发明的方面教导了在构造和使用中产生以下描述的示例性优点的某些益处。
17.在一些实施方式中,本文公开的是包含靶向病毒载体的药物制剂,例如治疗性构建体可包含(1)12种天然存在的aav衣壳中的任何aav衣壳、其工程化变体中的任何变体或任何相关的依赖病毒(例如禽或犬aav);(2)cftr的cdna转基因或其变体;(3)为最佳表达而定制的启动子和增强子元件;以及(4)药学上可接受的载体或赋形剂。
18.在一些实施方式中,还涉及病毒载体(例如raav载体)、编码如本文公开的病毒载体基因组的核酸在治疗囊性纤维化中的用途。
19.此处概述了本文所述技术的方面,其中,病毒载体在5'至3'方向上包含:
20.5'itr;
21.启动子序列;
22.内含子序列;
23.治疗性转基因(例如野生型cftr基因);
24.poly a序列;和
25.3'itr。
26.因此,在某些方面,本文提供了一种用于治疗囊性纤维化(cf)的方法,所述方法包括:向受试者中的多个靶位点给予载体群,其中,所述载体含有治疗性核酸,并且其中,所述载体通过支气管动脉导管插入递送来给予,所述支气管动脉导管插入递送包括将导管放入第一支气管动脉并将第一剂量的载体给予所述导管中,以靶向第一细支气管族(family)中的第一基底层(basal lamina)靶位点;以及将相同或不同的导管放入第二支气管动脉,以靶向对着(subtending)所述第二支气管动脉的细支气管族中的第二组基底层细胞。如有必要,向第三或第四不同(variant)支气管动脉中进行第三次或甚至第四次注射,以完成对所有基底层细胞的治疗性递送。
27.在这些方法和本文描述的所有此类方法的一些实施方式中,第一剂量与第一支气管动脉容积(支气管血管血流量,包括血管分支)成比例,并且第二、第三或第四剂量与总支气管动脉容积成比例。
28.在这些方法和本文描述的所有此类方法的一些实施方式中,通过递送至第一支气管动脉,将第一剂量的载体给予导管中,以靶向对着的所有细支气管中的基底细胞/祖细胞、棒状细胞(club cell)或纤毛细胞(ciliated cell)的基底层靶位点。
29.在这些方法和本文描述的所有此类方法的一些实施方式中,治疗性核酸为治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因。
30.在这些方法和本文描述的所有此类方法的一些实施方式中,治疗性核酸为截短的治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因。
31.在这些方法和本文描述的所有此类方法的一些实施方式中,截短的治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因为cftr的n
‑
尾加工突变体。
32.在这些方法和本文描述的所有此类方法的一些实施方式中,截短的治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因可以特异性挽救δf508
‑
cftr的加工。
33.在这些方法和本文描述的所有此类方法的一些实施方式中,载体为dna或rna核酸载体。
34.在这些方法和本文描述的所有此类方法的一些实施方式中,载体为病毒载体。
35.在这些方法和本文描述的所有此类方法的一些实施方式中,病毒载体选自于如下病毒载体中的任何病毒载体:腺相关病毒(aav)、腺病毒、慢病毒载体或单纯疱疹病毒(hsv)。
36.在这些方法和本文描述的所有此类方法的一些实施方式中,病毒载体为重组aav(raav)。
37.在这些方法和本文描述的所有此类方法的一些实施方式中,治疗性核酸为基因编辑分子。
38.在这些方法和本文描述的所有此类方法的一些实施方式中,基因编辑分子选自于
核酸酶、引导rna(grna)、引导dna(gdna)和激活子rna。
39.在这些方法和本文描述的所有此类方法的一些实施方式中,至少一种基因编辑分子为grna或gdna。
40.在这些方法和本文描述的所有此类方法的一些实施方式中,引导rna靶向致病cftr基因。
41.在这些方法和本文描述的所有此类方法的一些实施方式中,引导rna选自于表4。
42.在这些方法和本文描述的所有此类方法的一些实施方式中,序列特异性核酸酶选自于核酸引导的核酸酶、锌指核酸酶(zfn)、大范围核酸酶、转录激活因子样效应核酸酶(talen)或megatal。
43.在这些方法和本文描述的所有此类方法的一些实施方式中,序列特异性核酸酶是选自于单碱基编辑器、rna引导的核酸酶和dna引导的核酸酶中的核酸引导的核酸酶。
44.在这些方法和本文描述的所有此类方法的一些实施方式中,至少一种基因编辑分子为激活子rna。
45.在这些方法和本文描述的所有此类方法的一些实施方式中,核酸引导的核酸酶为crispr核酸酶。
46.在这些方法和本文描述的所有此类方法的一些实施方式中,crispr核酸酶为cas核酸酶。
47.在这些方法和本文描述的所有这些方法的一些实施方式中,支气管动脉递送伴随有单独的肺动脉导管插入以获得楔压测量。
48.在这些方法和本文描述的所有此类方法的一些实施方式中,病毒载体群通过1
‑
5分钟的缓慢输注来给予。
49.在这些方法和本文描述的所有此类方法的一些实施方式中,在输注期间以周期间隔或脉冲间隔向呼气气流(expiratory airflow)施加压力。
50.在这些方法和本文描述的所有此类方法的一些实施方式中,每2次至5次呼吸供应长达15秒的压力。
51.在这些方法和本文描述的所有此类方法的一些实施方式中,压力为2
‑
15mmhg。
52.在这些方法和本文描述的所有此类方法的一些实施方式中,携带载体的支气管动脉毛细血管与靶细胞的接近度(proximity)为5
‑
10微米。
53.在这些方法和本文描述的所有此类方法的一些实施方式中,衣壳蛋白的aav和itr可为任何天然或人工血清型或它们的修饰物。所述蛋白和itr可为相同或不同的血清型。在一个实施方式中,衣壳蛋白的aav中的至少一种是aav血清型9。
54.在任何这些方面的另一实施方式中,所有衣壳蛋白都来自aav9。
55.在这些方法和本文描述的所有此类方法的一些实施方式中,进一步包括给予透化剂。
56.在任何这些方面的一些实施方式中,所述衣壳蛋白中的至少一种为aav血清型9。
57.在任何这些方面的一些实施方式中,所有衣壳蛋白均为aav血清型9。
58.在任何这些方面的一些实施方式中,其它衣壳蛋白之一来自不同血清型。
59.在任何这些方面的一些实施方式中,aav itr来自与至少一种衣壳蛋白不同的血清型。
60.在任何这些方面的一些实施方式中,aav itr来自与衣壳蛋白相同的血清型中的至少一种。
61.从以下更详细的描述中,结合附图,本发明各方面的其它特征和优点将变得显而易见,其以示例的方式示出了本发明各方面的原理。
具体实施方式
62.本文描述了使用导管来给予病毒载体群以治疗囊性纤维化(cf)的方法,其中,所述病毒载体含有通过支气管动脉导管插入递送到受试者中的多个靶位点的治疗性转基因,将导管靠近地放入第一支气管动脉,其中,靶位点是所述支气管动脉对着的细支气管族中的基底细胞/祖细胞,然后将导管移入第二支气管动脉以将第二剂量的病毒载体递送至所述第二支气管动脉对着的第二细支气管族中的第二基底细胞/祖细胞群。根据个体解剖学的需要,向第三或第四支气管动脉或它们的分支中进行第三次或第四次注射将完成载体递送。
63.本文描述的技术的一个方面涉及用于治疗囊性纤维化的raav载体,所述raav载体包含含有反向末端重复(itr)、启动子、异源基因、poly
‑
a尾和潜在的其它调节元件的核苷酸序列。核酸通常封装在aav衣壳中。在一些实施方式中,衣壳可为经修饰的衣壳。衣壳蛋白可以来自于与任一itr不同的任何aav血清型。本文描述的技术总体上涉及使用支气管动脉递送来给予载体的基因治疗方法,所述载体包括但不限于用于治疗cf的腺相关病毒(aav)颗粒、病毒粒子和载体。
64.相应地,本文描述的是用于给予病毒载体(例如,使用raav载体作为示例性实例)的导管,所述病毒载体包含用于治疗囊性纤维化的含有反向末端重复(itr)、启动子、异源基因、poly
‑
a尾和潜在的其它调节元件的核苷酸序列。
65.cf是一种以逐渐破坏肺的气道感染、炎症、重塑和阻塞为特征的疾病。肺部的物理屏障和宿主免疫屏障对成功将基因转移到呼吸道提出了挑战。cf以常染色体隐性方式遗传。它是由囊性纤维化跨膜传导调节蛋白(cftr)的基因的两个拷贝中都存在突变而引起的。囊性纤维化跨膜传导调节蛋白(cftr)是脊椎动物中的膜蛋白和氯离子通道,由cftr基因编码。仅有单个cftr工作拷贝的人是携带者,其它大多是正常的。cftr参与汗液、消化液和粘液的产生。当cftr不具有功能时,通常稀薄的分泌物反而变得厚重。该状况是通过汗液测试和基因测试来诊断的。婴儿出生时的筛查在世界某些地区进行。
66.cftr基因是基因疗法的引人注目的候选者,因为杂合子在表型上是正常的,而肺内气道内衬的靶细胞有潜力通过气溶胶或其它局部策略进行载体递送。自1989年首次克隆cftr基因以来,已经研究了若干种用于矫正cf肺病的基因疗法策略。然而,安全且有效的载体系统的开发仍然是重大挑战。这在部分程度上是由于已进化的多重复杂的肺气道屏障会清除或阻止外来颗粒的摄取。cf肺中厚重的分泌物以及慢性感染和炎症的继发效应为基因转移带来了额外的障碍。
67.如本文所述的是用于通过将囊性纤维化跨膜传导调节蛋白(cftr)基因直接递送至肺来治疗cf的方法。本发明的方面教导了在构造和使用中产生以下描述的示例性优点的某些益处。
68.在一些实施方式中,本文公开的是包含靶向病毒载体(例如raav载体)、编码如本
文公开的raav的核酸和药学上可接受的载体的药物制剂。此外,在一些实施方式中,还涉及病毒载体(例如raav载体)、编码如本文公开的病毒载体基因组的核酸在治疗囊性纤维化中的用途。
69.此处概述了本文所述技术的方面,其中,raav基因组在5'到3'方向上包含:5'itr、启动子序列、内含子序列、治疗性转基因(例如野生型cftr基因)、poly a序列和3'itr。
70.在一个实施方式中,raav载体包含病毒衣壳和在衣壳内的含有核苷酸序列的盒,本文称为“raav载体”。raav基因组包含多个元件,包括但不限于两个反向末端重复(itr,例如5'
‑
itr和3'
‑
itr),以及位于itr之间的额外的元件,包括启动子、异源基因和poly
‑
a尾。在另外的实施方式中,itr之间可以有额外的元件,包括用于结合mirna或shrna序列的种子区序列。由于大小限制,用于包装的raav载体在基因组中不包含酶基因(例如rep蛋白)或结构基因(例如vp1、2或3)。衣壳通常是反式制备的。类似地,合适的rep蛋白以反式表达。
71.i.定义
72.除非本文另有定义,与本技术相关使用的科学术语和技术术语应具有本公开所属领域的普通技术人员所通常理解的含义。应理解的是,本发明不限于本文所述的特定方法学、方案和试剂等,并且这些可能会变化。本文所使用的术语仅用于描述具体实施方式的目的,并不打算限制本发明的范围,本发明的范围仅由权利要求书所定义。免疫学和分子生物学中的常用术语的定义可以参见the merck manual of diagnosis and therapy,第20版,merck sharp&dohme corp.出版,2018(isbn 0911910190,978
‑
0911910421);robert s.porter等(编),the encyclopedia of molecular cell biology and molecular medicine,blackwell science ltd.出版,1999
‑
2012(isbn 9783527600908);以及robert a.meyers(编),molecular biology and biotechnology:a comprehensive desk reference,vch publishers,inc.出版,1995(isbn 1
‑
56081
‑
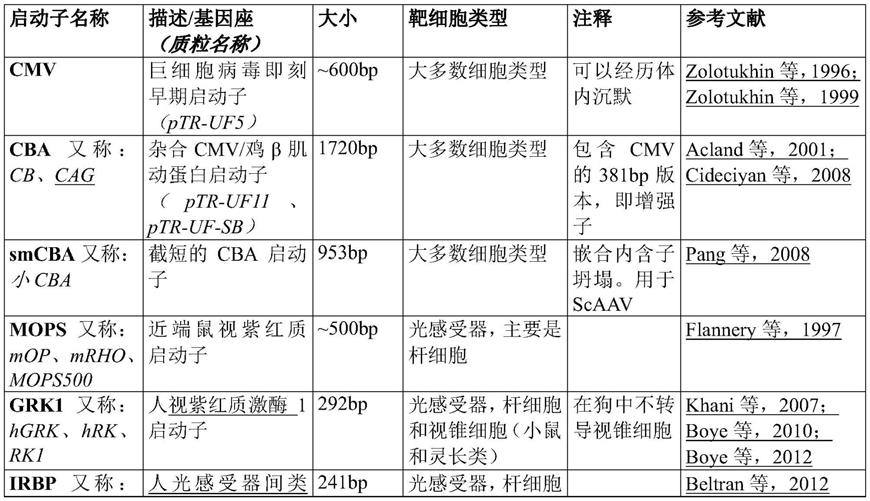
569
‑
8);immunology by werner luttmann,elsevier出版,2006;janeway's immunobiology,kenneth murphy,allan mowat,casey weaver(编),w.w.norton&company,2016(isbn 0815345054,978
‑
0815345053);lewin's genes xi,jones&bartlett publishers出版,2014(isbn
‑
1449659055);michael richard green和joseph sambrook,molecular cloning:a laboratory manual,第4版,cold spring harbor laboratory press,cold spring harbor,n.y.,usa(2012)(isbn 1936113414);davis等,basic methods in molecular biology,elsevier science publishing inc.,new york,usa(2012)(isbn 044460149x);laboratory methods in enzymology:dna,jon lorsch(编),elsevier,2013(isbn 0124199542);current protocols in molecular biology(cpmb),frederick m.ausubel(编),john wiley and sons,2014(isbn 047150338x,9780471503385);current protocols in protein science(cpps),john e.coligan(编),john wiley and sons,inc.,2005;以及current protocols in immunology(cpi)(john e.coligan,ada m kruisbeek,david h margulies,ethan m shevach,warren strobe(编),john wiley and sons,inc.,2003(isbn 0471142735,9780471142737),以引用的方式将它们的内容全部整体并入本文。
73.在本文的说明书和所附权利要求书中使用以下术语:
74.除非本文另有说明或与上下文明显矛盾,否则在描述本发明的上下文中(特别是
在如下权利要求的上下文中)使用的术语“一个/一种(a/an)”、“该/所述(the)”和类似的提法应解释为涵盖单数和复数两者。此外,除非另外特别说明,用于标识元件的顺序指示符(例如“第一”、“第二”、“第三”等)用于区分元件,而不指出或暗示此类元件的所需的数量或受限的数量,并且不指出此类元件的特定位置或顺序。除非本文另有说明或与上下文明显矛盾,否则本文描述的所有方法均可以以任何合适的顺序施行。本文提供的任意和所有实例或示例性语言(例如“如/诸如(such as)”)的使用仅旨在更好地阐明本发明,而不对以其它方式请求保护的本发明的范围构成限制。本说明书中的任何语言都不应被解释为指出任何未请求保护的要素对实施本发明必不可少。
75.此外,当提及可测量值(例如多核苷酸或多肽序列的长度、剂量、时间、温度等的量)时,如本文所使用的术语“约(about)”意在涵盖指定量的
±
20%、
±
10%、
±
5%、
±
1%、
±
0.5%或甚至
±
0.1%的变化。
76.同样如本文所使用的,“和/或(and/or)”是指并涵盖所列出的相关项目中的一个或多个的任何和所有可能的组合以及当以替代方式(“或”)解释时组合的缺乏。
77.如本文所使用的过渡性短语“基本上由
……
组成”意味着权利要求的范围将被解释为涵盖权利要求中所述的指明的材料或步骤以及“对所请求保护的发明的基本特性和新颖性特性没有实质影响的那些材料或步骤”。参见in re herz,537f.2d 549,551
‑
52,190uspq 461,463(ccpa 1976)(原文中强调);还参见mpep
§
2111.03。因此,当在本发明的权利要求中使用时,术语“基本上由
……
组成”不旨在被解释为等同于“包括/包含(comprising)”。除非上下文另有说明,否则特别意指可以以任意组合使用本文所述发明的各种特征。
78.此外,本发明还考虑的是在本发明的一些实施方式中,可以排除或省略本文所述的任何特征或特征的组合。
79.为了进一步说明,例如,如果说明书指出特定的氨基酸可以选自于a、g、i、l和/或v,则该语言还指出该氨基酸可以选自于这些氨基酸的任何子集:例如a、g、i或l;a、g、i或v;a或g;仅l;等,视如每个此类子组合均在此处明确提出。此外,此类语言还指出可以放弃一个或多个指明的氨基酸(例如通过否定的但书)。例如,在具体的实施方式中,氨基酸不是a、g或i;不是a;不是g或v;等,视如每个此类可能的放弃均在此处明确提出。
80.如本文所使用的术语“细小病毒”涵盖细小病毒科(parvoviridae),包括自主复制细小病毒和依赖病毒。自主细小病毒包括细小病毒属(parvovirus)、红细胞病毒属(erythrovirus)、浓核病毒属(densovirus)、艾特拉病毒属(iteravirus)和contravirus属的成员。示例性自主细小病毒包括但不限于小鼠微小病毒、牛细小病毒、犬细小病毒、鸡细小病毒、猫泛白细胞减少症病毒、猫细小病毒、鹅细小病毒、h1细小病毒、番鸭细小病毒、b19病毒和目前已知或今后发现的任何其它自主细小病毒。其它自主细小病毒是本领域技术人员已知的。参见例如bernard n.fields等,virology,第2卷,第69章(第4版,lippincott
‑
raven publishers)。
81.如本文所使用的术语“腺相关病毒”(aav)包括但不限于aav 1型、aav 2型、aav 3型(包括3a型和3b型)、aav 4型、aav 5型、aav 6型、aav 7型、aav 8型、aav 9型、aav 10型、aav 11型、aav 12型、aav 13型、禽aav、牛aav、犬aav、马aav、羊aav和目前已知或今后发现的任何其它aav。参见例如bernard n.fields等,virology,第2卷,第69章(第4版,
lippincott
‑
raven publishers)。已经鉴定出许多相对新的aav血清型和进化枝(参见例如gao等,(2004)j.virology 78:6381
‑
6388;moris等,(2004)virology 33
‑
:375
‑
383)。还可以使用嵌合的(chimeric)、杂合的、镶嵌的(mosaic)或者理性的(rational)单倍体(其包括血清型的混合物)。
82.本领域已知自主细小病毒和aav的多种血清型的基因组序列以及天然反向末端重复(itr)、rep蛋白和衣壳亚基的序列。此类序列可见于文献或公共数据库(如genbank)中。参见例如genbank登录号nc_002077、nc_001401、nc_001729、nc_001863、nc_001829、nc_001862、nc_000883、nc_001701、nc_001510、nc_006152、nc_006261、af063497、u89790、af043303、af028705、af028704、j02275、j01901、j02275、x01457、af288061、ah009962、ay028226、ay028223、nc_001358、nc_001540、af513851、af513852、ay530579;通过引用将它们的公开内容并入本文,以教导细小病毒和aav核酸和氨基酸序列。还参见例如srivistava等,(1983)j virology 45:555;chiarini等,(1998)j.virology 71:6823;chiarini等,(1999)j.virology 73:1309;bantel
‑
schaal等,(1999)j.virology 73:939;xiao等,(1999)j.virology 73:3994;muramatsu等,(1996)virology 221:208;shade等,(1986)j.viral.58:921;gao等,(2002)proc.nat.acad.sci.usa 99:11854;morris等,(2004)virology 33
‑
:375
‑
383;国际专利公开wo 00/28061、wo 99/61601、wo 98/11244;以及美国专利no.6,156,303;通过引用将它们的公开内容并入本文,以教导细小病毒和aav核酸和氨基酸序列。
83.自主细小病毒和aav的衣壳结构更详细地描述于bernard n.fields等,virology,第2卷,第69&70章(第4版,lippincott
‑
raven publishers)中。还参见aav2(xie等,(2002)proc.nat.acad.sci.99:10405
‑
10)、aav4(padron等,(2005)j.viral.79:5047
‑
58)、aav5(walters等,(2004)j.viral.78:3361
‑
71)以及cpv(xie等,(1996)j.mal.biol.6:497
‑
520和tsao等,(1991)science 251:1456
‑
64)的晶体结构的描述。
84.如本文所使用的术语“趋向性”是指病毒优先进入某些细胞或组织,随后任选地在细胞中表达(例如转录和任选地翻译)病毒基因组所携带的序列,例如,对于重组病毒,表达感兴趣的异源核酸。
85.如本文所使用的“系统性趋向性”和“系统性转导”(和等同的术语)表明本发明的病毒衣壳或病毒载体对整个身体的组织(例如脑、肺、骨骼肌、心脏、肝、肾和/或胰)表现出趋向性和/或进行转导。在本发明的实施方式中,观察到对中枢神经系统(例如脑、神经元细胞等)的系统性转导。在其它实施方式中,实现了对心肌组织的系统性转导。
86.如本文所使用的,“选择性趋向性”或“特异性趋向性”是指将病毒载体递送至某些靶细胞和/或某些组织,和/或对某些靶细胞和/或某些组织的特异性转导。
87.在本发明的一些实施方式中,本发明的包含衣壳的aav颗粒可表现出多重表型:对30种特定组织/细胞的有效转导;以及对某些组织/细胞(对其的转导不期望)的极低水平的转导(例如降低的转导)。
88.除非另有指出,如本文所使用的术语“多肽”涵盖肽和蛋白质二者。
89.如本文所使用的术语“支气管动脉递送”是指将导管插入支气管动脉。支气管动脉是气道(和气道上皮)向下至呼吸系统细支气管的唯一血管供应。
[0090]“多核苷酸”为核苷酸碱基的序列,可以是rna、dna或dna
‑
rna杂合序列(包括天然
存在和非天然存在的核苷酸两者),但在代表性的实施方式中为单链或双链dna序列。
[0091]“嵌合核酸”包含共价连接在一起来编码融合多肽的两个以上的核酸序列。核酸可以是dna、rna或它们的杂合体。
[0092]
术语“融合多肽”包含通常通过肽键共价连接在一起的两个以上的多肽。
[0093]
如本文所使用的“分离的”多核苷酸(例如“分离的dna”或“分离的rna”)是指至少部分地与天然存在的有机体或病毒的至少一些其它组分相分离的多核苷酸,所述其它组分例如为通常被发现与所述多核苷酸相关联的细胞或病毒结构组分或其它多肽或核酸。在代表性的实施方式中,与起始材料相比,“分离的”核苷酸富集了至少约10倍、100倍、1000倍、10,000倍或更多倍。
[0094]
同样地,“分离的”多肽是指至少部分地与天然存在的有机体或病毒的至少一些其它组分相分离的多肽,所述其它组分例如为通常被发现与所述多肽相关联的细胞或病毒结构组分或其它多肽或核酸。在代表性的实施方式中,与起始材料相比,“分离的”多肽富集了至少约10倍、100倍、1000倍、10,000倍或更多倍。
[0095]“分离的细胞”指与其它组分相分离的细胞,分离的细胞在其天然状态下通常与所述其它组分相关联。例如,分离的细胞可为培养基中的细胞和/或本发明的药学上可接受的载体中的细胞。因此,分离的细胞可被递送至和/或引入受试者中。在一些实施方式中,分离的细胞可以是从受试者中移出并如本文所述进行离体操作、然后返回所述受试者的细胞。
[0096]
如本文所使用的“分离”或“纯化”(或语法等同物)病毒载体或病毒颗粒或病毒颗粒群意味着将该病毒载体或病毒颗粒或病毒颗粒群至少部分地与起始材料中的至少一些其它组分相分离。在代表性的实施方式中,与起始材料相比,“分离的”或“纯化的”病毒载体或病毒颗粒或病毒颗粒群富集了至少约10倍、100倍、1000倍、10,000倍或更多倍。
[0097]
除非另有说明,否则可以通过参考合适的对照来确定“有效转导”或“有效趋向性”或类似术语(例如分别为对照的转导或趋向性的至少约10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、125%、150%、175%、200%、250%、300%、350%、400%、500%或更多)。在具体的实施方式中,病毒载体有效转导神经元细胞和心肌细胞或对它们具有有效趋向性。合适的对照将取决于多种因素,包括期望的趋向性和/或转导谱。
[0098]“治疗性多肽”是能够缓解、减少、预防、延迟和/或稳定由细胞或受试者中蛋白质缺乏或缺陷引起的症状的多肽,和/或是以其它方式赋予受试者益处的多肽,所述益处例如为酶替代以减少或消除疾病症状,或移植存活率的改善或免疫应答的诱导。
[0099]
术语“治疗(treat/treating/treatment of)”(及其语法变体)是指受试者病症的严重程度降低、至少部分改善或稳定;和/或实现了至少一种临床症状的一些缓解、减轻、减少或稳定;和/或疾病或紊乱的进展延迟。
[0100]
术语“预防(prevent/preventing/prevention)”(及其语法变体)是指相对于在没有本发明的方法时将会发生的情况,预防和/或延迟受试者中疾病、紊乱和/或临床症状的发作;和/或降低疾病、紊乱和/或临床症状发作的严重程度。预防可以是完全的,例如,完全不存在疾病、紊乱和/或临床症状。预防也可以是部分的,使得受试者中疾病、紊乱和/或临床症状的发生和/或发作的严重程度实质上少于/小于在没有本发明时将会发生的情况。
[0101]
如本文所使用的“治疗有效”量是足以向受试者提供一些改善或益处的量。或者
说,“治疗有效”量是将在受试者中的至少一种临床症状中提供一些缓解、减轻、减少或稳定的量。本领域技术人员将理解,只要向受试者提供了一些益处,治疗效果不必是完全的或治愈性的。
[0102]
如本文所使用的“预防有效”量是相对于在没有本发明的方法时将会发生的情况,足以预防和/或延迟受试者中疾病、紊乱和/或临床症状的发作;和/或足以降低和/或延迟受试者中疾病、紊乱和/或临床症状的发作的严重程度的量。本领域技术人员将理解,只要向受试者提供了一些预防益处,预防水平不必是完全的。
[0103]
术语“异源核苷酸序列”和“异源核酸分子”在本文中可互换使用,是指非天然存在于病毒中的核酸序列。通常,异源核酸分子或异源核苷酸序列包含开放读码框,所述开放读码框编码感兴趣的多肽和/或非翻译rna(例如,用于递送至细胞和/或受试者),例如cftr。
[0104]
如本文所使用的术语“病毒载体”、“病毒性载体”、“载体”或“基因递送载体”是指包含用作核酸递送媒介的病毒衣壳(例如aav)的加工构建体,包含表达效应dna所必需的元件(例如itr、启动子、内含子、cdna、poly a尾等)的包装盒,并包括载体。或者,在一些情况下,术语“载体”可用于指代单独的载体基因组/vdna。
[0105]“raav载体基因组”或“raav基因组”是包含一个或多个异源核酸序列的aav基因组(即vdna)。raav载体通常仅需要处于顺式的反向末端重复(tr)以产生病毒。所有其它病毒序列都是非必需的,并且可以以反式提供(muzyczka,(1992)curr.topics microbiol.immunol.158:97)。通常,raav载体基因组将仅保留一个或多个tr序列,以使能够被载体有效包装的转基因的大小最大化。结构蛋白和非结构蛋白编码序列可以以反式提供(例如来自载体(例如质粒);或通过将序列稳定整合到包装细胞中)。在本发明的实施方式中,raav载体基因组包含至少一个itr序列(例如aav tr序列),任选地为两个itr(例如两个aav tr),其通常将位于载体基因组的5'和3'端并且侧翼为异源核酸,但不必与其邻接。tr可以彼此相同或不同。
[0106]
术语“末端重复”或“tr”包括任何病毒末端重复或形成发夹结构并起到反向末端重复作用的合成序列(即介导期望功能(例如复制、病毒包装、整合和/或原病毒挽救等)的itr)。tr可以是aav tr或非aav tr。例如,非aav tr序列(例如其它细小病毒(例如犬细小病毒(cpv)、小鼠细小病毒(mvm)、人细小病毒b
‑
19)的非aav tr序列)或任何其它合适的病毒序列(例如充当sv40复制起点的sv40发夹)可以用作tr,它们可以通过截短、置换、缺失、插入和/或添加而进行进一步修饰。此外,tr可以是部分合成或完全合成的,例如samulski等的美国专利no.5,478,745中所述的“双d序列”。
[0107]“aav末端重复”或“aav tr”(包括“aav反向末端重复”或“aav itr”)可以来自任何aav,包括但不限于血清型1、2、3、4、5、6、7、8、9、10、11或12或目前已知或今后发现的任何其它aav。两个itr可以来自相同或不同的血清型。aav末端重复不必具有天然的末端重复序列(例如,可以通过插入、缺失、截短和/或错义突变来改变天然的aav tr或aav itr序列),只要该末端重复介导期望的功能(例如复制、病毒包装、整合和/或原病毒挽救等)即可。
[0108]
aav蛋白vp1、vp2和vp3是一起相互作用而形成二十面体对称的aav衣壳的衣壳蛋白。vp1.5是美国公开no.2014/0037585中描述的aav衣壳蛋白。然而,衣壳蛋白可被修饰并且可来自任何aav血清型。在一个实施方式中,衣壳蛋白来自与至少一个aav itr相同的血清型。在另一个实施方式中,至少一个itr和衣壳蛋白来自不同的血清型。
[0109]
本发明的病毒载体还可为如国际专利公开wo 00/28004和chao等,(2000)molecular therapy 2:619中所述的“靶向”病毒载体(例如具有定向的趋向性)和/或“杂合”细小病毒(即,其中病毒tr和病毒衣壳来自不同的细小病毒)。
[0110]
本发明的病毒载体还可为如国际专利公开wo 01/92551(通过引用将其公开内容整体并入本文)中所述的双链体细小病毒颗粒。因此,在一些实施方式中,可以将双链(双链体)基因组包装到本发明的病毒衣壳中。
[0111]
此外,病毒衣壳或基因组元件可包含其它修饰,包括插入、缺失和/或置换。
[0112]
如本文所使用的“嵌合”衣壳蛋白意味着相对于野生型而言通过衣壳蛋白的氨基酸序列中的一个或多个(例如2个、3个、4个、5个、6个、7个、8个、9个、10个等)氨基酸残基的置换以及相对于野生型而言通过氨基酸序列中的一个或多个(例如2个、3个、4个、5个、6个、7个、8个、9个、10个等)氨基酸残基的插入和/或缺失进行修饰的aav衣壳蛋白。在一些实施方式中,来自一种aav血清型的完整或部分的结构域、功能区域、表位等可以以任何组合替代不同aav血清型的相应的野生型结构域、功能区域、表位等,以产生本发明的嵌合衣壳蛋白。嵌合衣壳蛋白的产生可以根据本领域公知的方案进行,并且文献以及本文中已经描述了可被包括在本发明的衣壳中的大量嵌合衣壳蛋白。
[0113]
如本文所使用的术语“单倍体aav”应意味着如pct/us18/22725(将其并入本文)中描述的aav。
[0114]
术语“杂合”aav载体或细小病毒是指其中病毒tr或itr和病毒衣壳来自不同细小病毒的raav载体。杂合载体描述于国际专利公开wo 00/28004和chao等,(2000)molecular therapy 2:619中。例如,杂合aav载体通常包含足以进行腺病毒复制和包装的腺病毒5'和3'顺式itr序列(即腺病毒末端重复和pac序列)。
[0115]
术语“多倍体aav”是指由来自两种以上的aav血清型的衣壳所组成的aav载体,例如可以受益于各个血清型来进行更强的转导,而不会在某些实施方式中消除来自亲本的趋向性。
[0116]
如本文所使用的术语“氨基酸”涵盖任何天然存在的氨基酸、其修饰形式以及合成氨基酸。
[0117]
并入本文以供参考的涉及、公开或描述aav或aav的方面(包括含有待表达的感兴趣的基因的dna载体)的额外专利有:美国专利no.6,491,907;7,229,823;7,790,154;7,201898;7,071,172;7,892,809;7,867,484;8,889,641;9,169,494;9,169,492;9,441,206;9,409,953;以及9,447,433;9,592,247;以及9,737,618。
[0118]
ii.raav基因组元件
[0119]
如本文所公开的,所述技术的一个方面涉及一种raav载体,所述raav载体包含衣壳和在其衣壳内的称为“raav载体基因组”的核苷酸序列。raav载体基因组(也称为“raav基因组”)包含多个元件,包括但不限于两个反向末端重复(itr,例如5'
‑
itr和3'
‑
itr),以及位于itr之间的额外的元件,包括启动子、异源基因和poly
‑
a尾。
[0120]
在一些实施方式中,本文公开的raav基因组包含5'itr和3'itr序列以及位于5'itr和3'itr之间的启动子(例如肺特异性启动子)序列,所述序列可操作地连接至编码治疗性蛋白的异源核酸,其中,所述异源核酸序列可进一步包含以下元件中的一个或多个:内含子序列、编码分泌信号肽的核酸和poly a序列。
[0121]
f.启动子
[0122]
在一些实施方式中,为了获得合适水平的治疗性蛋白,raav基因型包含启动子。合适的启动子可以选自于本领域技术人员已知的众多启动子中的任何启动子。在一些实施方式中,启动子是细胞类型特异性启动子。在另外的实施方式中,启动子是诱导型启动子。在实施方式中,启动子位于5'端的上游并且可操作地连接至异源核酸序列。在一些实施方式中,启动子是肝细胞类型特异性启动子、心肌细胞类型特异性启动子、神经元细胞类型特异性启动子、神经细胞类型特异性启动子、肌肉细胞类型特异性启动子或肺特异性启动子或其它细胞类型特异性启动子。
[0123]
在一些实施方式中,组成型启动子可以选自于具有不同强度和组织特异性的组成型启动子的组。这些启动子的一些实例在表6中列出。病毒载体(例如raav载体基因组)可以包含一个或多个组成型启动子,例如病毒启动子或来自通常在促进转录中有活性的哺乳动物基因的启动子。组成型病毒启动子的实例为:单纯疱疹病毒(hsv)启动子、胸苷激酶(tk)启动子、劳氏肉瘤病毒(rsv)启动子、猿猴病毒40(sv40)启动子、小鼠乳腺瘤病毒(mmtv)启动子、ad eia启动子和巨细胞病毒(cmv)启动子。组成型哺乳动物启动子的实例包括各种看家基因启动子,以β
‑
肌动蛋白启动子和鸡β
‑
肌动蛋白(cb)启动子为例,其中,已证明cb启动子是对于表达cftr而言特别有用的组成型启动子。
[0124]
在一个实施方式中,启动子为诸如肺特异性启动子的组织特异性启动子,其包括但不限于包括如在degiulio jv等,gene ther.2010apr;17(4):541
‑
549.id中描述的介导强烈的肺特异性转基因表达的肺特异性sp
‑
c启动子在内的启动子序列。
[0125]
在一个实施方式中,启动子是诱导型启动子。合适的诱导型启动子的实例包括来自诸如如下基因的启动子:细胞色素p450基因、热休克蛋白基因、金属硫蛋白基因和激素诱导型基因,包括雌激素基因启动子。诱导型启动子的另一实例是响应于四环素的tetvp16启动子。
[0126]
根据本文公开内容的raav基因组中的启动子包括但不限于神经元特异性启动子(例如突触蛋白1(syn)启动子)、肌肉肌酸激酶(mck)启动子和结蛋白(desmin,des)启动子。在一个实施方式中,aav介导的异源核酸(例如人cftr)的表达可以通过突触蛋白启动子在神经元中来实现或通过mck启动子在骨骼肌中来实现。可以使用的其它启动子包括ef、b19p6、cag、神经元特异性烯醇化酶基因启动子、鸡β
‑
肌动蛋白/cmv杂合启动子、血小板衍生生长因子基因启动子、bgh、ef1a、camkiia、gfap、rpe、alb、tbg、mbp、mck、tnt、amhc、gfp、rfp、mcherry、cfp和yfp启动子。
[0127]
表1
‑
示例性启动子。
[0128][0129][0130]
h.poly
‑
a
[0131]
在一些实施方式中,病毒载体基因组(例如raav载体基因组)包含至少一个poly
‑
a尾,所述poly
‑
a尾位于3'端并在一个实施方式中位于编码cftr融合多肽的异源核酸基因的下游。在一些实施方式中,polya信号是如本文所定义的稳定性序列或cs序列的3'端。可以使用任何polya序列,包括但不限于hgh polya、synpa polya等。在一些实施方式中,polya是合成型polya序列。在一些实施方式中,raav载体基因组包含两个polya尾,例如hgh polya序列和另一个polya序列,其中间隔区核酸序列位于两个polya序列之间。在一些实施方式中,第一poly a序列是hgh poly a序列,且第二poly a序列是合成型序列,反之亦然——也就是说,在替代实施方式中,第一poly a序列是合成型poly a序列,且第二poly a序列是hgh polya序列。示例性的poly a序列为例如hgh poly a序列或至少具有与hgh poly a序列具有至少80%、85%、90%、95%、96%、97%、98%或99%的核苷酸序列同一性的序列的poly a核酸序列。在一些实施方式中,所涵盖的可使用的hghpoly序列描述于anderson等,j.biol.chem 264(14);8222
‑
8229,1989(参见例如第8223页,第2栏,第1段),
通过引用将其整体并入本文。
[0132]
在一些实施方式中,可以将poly
‑
a尾工程化以稳定从raav载体基因组转录的rna转录物,包括异源基因的转录物;并且在替代实施方式中,可以将poly
‑
a尾工程化以包含去稳定元件。
[0133]
在一个实施方式中,可以通过改变poly
‑
a尾的长度将poly
‑
a尾工程化为去稳定元件。在一个实施方式中,可以延长或缩短poly
‑
a尾。在另外的实施方式中,可以延长或缩短位于异源基因(在一个实施方式中为cftr基因)与poly
‑
a尾之间的3'非翻译区,以改变异源基因的表达水平或改变产生的最终多肽。在一些实施方式中,3
′
非翻译区包含cftr 3
′
utr。
[0134]
在另一实施方式中,去稳定元件是微小rna(mirna),其具有沉默(阻抑翻译和促进降解)rna转录物的能力,mirna结合至编码异源基因的rna转录物。可以通过修饰、添加或删除mirna所结合的poly
‑
a尾内的种子区来进行异源基因(例如igf2(v43m)
‑
cftr融合多肽)的表达的调节。在一个实施方式中,poly
‑
a尾内种子区的添加或删除可以增加或减少raav载体基因组中的异源基因所编码的蛋白质(例如igf2(v43m)
‑
cftr融合多肽)的表达。在另外的实施方式中,由种子区的添加或删除引起的此类表达的增加或减少取决于包含raav载体基因组的aav所转导的细胞类型。
[0135]
在另一个实施方式中,也可以将种子区工程化到位于异源基因和poly
‑
a尾之间的3'非翻译区中。在另外的实施方式中,去稳定剂可以是sirna。sirna的编码区可以包含在raav载体基因组中,并通常位于下游,poly
‑
a尾的3'端。
[0136]
i.末端重复
[0137]
本文公开的raav基因组包含具有期望特征的aav itr,并且可以设计为调节并入有itr的载体的活性和对该载体的细胞应答。在另一个实施方式中,aav itr是具有期望特征的合成型aav itr,并且可以设计为操纵包含一个或两个合成型itr的载体的活性和对该载体的细胞应答,包括如在美国专利no.9,447,433中阐明的,通过引用将其并入本文。慢病毒具有还有助于包装的长末端重复ltr。
[0138]
位于如本文公开的转基因基因组侧翼的用于raav的aav itr和用于与慢病毒(如hiv)一起使用的ltr可以是适合于特定应用的任何血清型。在一些实施方式中,aav载体基因组的侧翼为aav itr。在一些实施方式中,raav载体基因组的侧翼为aav itr,其中,itr包括全长itr序列、具有去除cpg岛的序列的itr、具有包含添加的cpg序列的序列的itr、截短的itr序列、itr内具有一个或多个缺失的itr序列、itr内具有一个或多个添加的itr序列,或者包含前述itr的任意部分的组合并连接在一起以形成杂合itr。
[0139]
为了促进长期表达,在一个实施方式中,将编码cftr的多核苷酸插入aav反向末端重复(itr)(例如第一或5'和第二3'aav itr)或ltr(例如hiv ltr)之间。aav itr见于wt raav载体基因组的两端,并充当dna复制的起点和引物。itr需要处于顺式以用于aav dna复制以及用于从原核质粒中挽救或切除。在一个实施方式中,包含在raav基因组的核酸内的aav itr序列可以衍生自任意aav血清型(例如1、2、3、3b、4、5、6、7、8、9和10)或可以衍生自多于一种血清型,包括组合两种以上aav血清型的部分以构建itr。在一个实施方式中,为用于包含raav载体基因组的raav载体中,第一itr和第二itr应至少包含包装和复制所必需的wt itr或工程化itr的最小部分。在一些实施方式中,raav载体基因组的侧翼为aav itr。
[0140]
在一些实施方式中,raav载体基因组包含至少一个aav itr,其中,所述itr包含以
下、基本上由以下组成或由以下组成:(a)aav rep结合元件;(b)aav末端拆解序列(resolution sequence);以及(c)aav rbe(rep结合元件);其中,所述itr不包含任何其它aav itr序列。在另一实施方式中,元件(a)、(b)和(c)来自aav9 itr,并且itr不包含任何其它aav9 itr序列。在另外的实施方式中,元件(a)、(b)和(c)来自任何aav itr,包括但不限于aav2、aav8和aav9。在一些实施方式中,多核苷酸包含可以相同或不同的两个合成型itr。
[0141]
在一些实施方式中,包含raav载体基因组的raav载体中的多核苷酸包含可以相同或不同的两个itr。已确定itr中的三个元件对于itr功能而言是足够的。这种最小功能性itr可用于aav载体生产和转导的所有方面。额外的缺失可能定义甚至更小的最小功能性itr。更短的长度有利地允许较大的转基因盒的包装和转导。
[0142]
在另一实施方式中,存在于合成型itr中的每个元件可以是天然存在的aav itr中存在的确切序列(wt序列),或者可以稍有不同(例如通过添加、删除和/或置换1个、2个、3个、4个、5个或更多个核苷酸而不同),只要aav itr元件的功能继续以足够与在天然存在的aav itr中存在的元件相同的元件的功能没有实质性差异的水平起作用。
[0143]
在另外的实施方式中,包含raav载体基因组的raav载体可以在itr之间包含一个或多个额外的非aav顺式元件,例如启动转录、介导增强子功能、允许有丝分裂时的复制和对称分布、或改变经转导的基因组的持久性和加工的元件。此类元件在本领域中是公知的,并且包括但不限于启动子、增强子、染色质附着序列、端粒序列、顺式作用微小rna(mirna)及它们的组合。
[0144]
在另一实施方式中,itr相对于天然存在的itr(例如来自aav9的itr9)表现出修饰的转录活性。已知itr9序列固有地具有启动子活性。它也固有地具有与poly(a)序列相似的终止活性。尽管相对于itr2处于降低的水平,本发明的最小功能性itr表现出如实施例中所示的转录活性。因此,在一些实施方式中,itr对于转录而言是有功能的。在其它实施方式中,itr对于转录而言是缺陷的。在某些实施方式中,itr可以充当转录绝缘子,例如,当载体整合到宿主染色体中时,阻止载体中存在的转基因盒的转录。
[0145]
本发明的一个方面涉及包含至少一个合成型aav itr的raav载体基因组,其中,相对于天然存在的aav itr(例如itr2)的序列而言,itr中的一个或多个转录因子结合位点的核苷酸序列被删除和/或置换。在一些实施方式中,其中一个或多个转录因子结合位点被删除和/或置换的是最小功能性itr。在一些实施方式中,至少一个转录因子结合位点被删除和/或置换,例如至少5个或更多个或者10个或更多个转录因子结合位点,例如至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或21个转录因子结合位点。
[0146]
在另一实施方式中,本文所述的包含raav载体基因组的raav载体包含含有至少一个合成型aav itr的多核苷酸,其中,通常出现在itr中的转录起始位点处或其附近的一个或多个cpg岛(胞嘧啶碱基后紧随着鸟嘌呤碱基(cpg),其中这样排列的胞嘧啶倾向于被甲基化)被删除和/或置换。在一个实施方式中,cpg岛数量的缺失或减少可降低raav载体的免疫原性。这是由于tlr
‑
9结合raav载体dna序列(发生在cpg岛处)的减少或完全抑制。还公知cpg基序的甲基化导致转录沉默。预期itr中cpg基序的去除导致tlr
‑
9识别的降低和/或甲基化的降低以及因此而来的转基因沉默的降低。在一些实施方式中,其中一个或多个cpg岛被删除和/或置换的是最小功能性itr。在一个实施方式中,已知aav itr2包含16个cpg岛,
其中一个或多个或全部16个可以被删除。
[0147]
在一些实施方式中,至少1个cpg基序被删除和/或置换,例如至少4个或更多个或者8个或更多个cpg基序,例如至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个或16个cpg基序。如本文所使用的短语“删除和/或置换”意味着cpg基序中的一个或两个核苷酸被删除、被不同的核苷酸置换、或删除和置换的任意组合。
[0148]
在另一实施方式中,所述合成型itr包含以下所列核苷酸序列之一,基本上由以下所列核苷酸序列之一组成或者由以下所列核苷酸序列之一组成。在其它实施方式中,所述合成型itr包含如下核苷酸序列,基本上由如下核苷酸序列组成或者由如下核苷酸序列组成:所述核苷酸序列与以下所列核苷酸序列之一至少80%相同(例如至少85%、90%、95%、96%、97%、98%或99%相同)。
[0149]
mh
‑
257
[0150][0151]
mh
‑
258
[0152][0153]
mh delta 258
[0154][0155]
mh端粒
‑
1itr
[0156][0157]
mh端粒
‑
2itr
[0158][0159]
mh polii 258itr
[0160][0161]
mh 258delta d(保守的)
[0162]
[0163]
在某些实施方式中,本文所述的raav载体基因组包含能够产生可转导宿主细胞的aav病毒颗粒的合成型itr。此类itr可以用于例如异源核酸的病毒递送。此类itr的实例包括上面列出的mh
‑
257、mh
‑
258和mh delta 258。
[0164]
在其它实施方式中,本文所述的包含合成型itr的raav载体基因组不能产生aav病毒颗粒。此类itr可以用于例如异源核酸的非病毒转移。此类itr的实例包括上面列出的mh端粒
‑
1、mh端粒
‑
2和mh pol ii 258。
[0165]
在另外的实施方式中,本文所述的包含本发明的合成型itr的raav载体基因组进一步包含可以与第一itr相同或不同的第二itr。在一个实施方式中,raav载体基因组进一步包含异源核酸,例如编码蛋白质或功能性rna的序列。在另外的实施方式中,第二itr不能被rep蛋白拆解,即产生双链病毒dna。
[0166]
在一个实施方式中,raav载体基因组包含含有本发明的合成型itr的多核苷酸。在另外的实施方式中,病毒载体可以是细小病毒载体,例如aav载体。在另一实施方式中,重组细小病毒颗粒(例如重组aav颗粒)包含具有至少一个合成型itr的载体基因组。
[0167]
本发明的另一实施方式涉及增加aav衣壳的转基因dna包装能力的方法,所述方法包括生成包含至少一个合成型aav itr的raav载体基因组,其中,所述itr包含:(a)aav rep结合元件;(b)aav末端拆解序列;以及(c)aav rbe元件,其中,所述itr不包含任何其它aav itr序列。
[0168]
本发明进一步的实施方式涉及通过raav载体基因组改变对感染的细胞应答的方法,所述方法包括生成包含至少一个合成型itr的raav载体基因组,其中,所述itr中的一个或多个转录因子结合位点的核苷酸序列被删除和/或置换,并且进一步地,其中,raav载体基因组包含至少一个合成型itr,其产生对感染的改变的细胞应答。
[0169]
本发明另外的实施方式涉及通过raav载体基因组改变对感染的细胞应答的方法,所述方法包括生成包含至少一个合成型itr的raav载体基因组,其中,所述itr中的一个或多个cpg基序被删除和/或置换,其中,包含至少一个合成型itr的载体产生对感染的改变的细胞应答。
[0170]
iii.载体和病毒粒子
[0171]
靶向病毒载体可以是用于基因疗法的任何病毒载体,例如包括但不限于慢病毒、腺病毒(ad)、腺相关病毒(aav)、hsv等。
[0172]
递送载体的选择可基于本领域已知的许多因素来进行,包括靶宿主的年龄和物种、体外相对于体内递送、所需的表达水平和持久性、预期目的(例如用于治疗或多肽生产)、靶细胞或器官、递送途径、分离的核酸的大小、安全性问题等。
[0173]
合适的载体包括病毒载体(例如逆转录病毒、甲病毒;痘苗病毒;腺病毒、腺相关病毒或单纯疱疹病毒)、脂质载体、聚赖氨酸载体、与核酸分子一起使用的合成聚氨基聚合物载体(例如质粒)等。
[0174]
本领域已知的任何病毒载体均可用于本发明。此类病毒载体的实例包括但不限于源自以下病毒的载体:腺病毒科(adenoviridae);双rna病毒科(birnaviridae);布尼亚病毒科(bunyaviridae);杯状病毒科(caliciviridae);毛状病毒组(capillovirus group);香石竹潜病毒组(carlavirus group);香石竹斑驳病毒组(carmovirus virus group);花椰菜花叶病毒组(group caulimovirus);长线形病毒组(closterovirus group);鸭跖草黄
斑驳病毒组(commelina yellow mottle virus group);豇豆花叶病毒组(comovirus virus group);冠状病毒科(coronaviridae);pm2噬菌体组;corcicoviridae;隐潜病毒组(group cryptic virus);隐病毒组(group cryptovirus);黄瓜花叶病毒组家族(cucumovirus virus group family);[phgr]6噬菌体组;cysioviridae;康乃馨环斑病组;香石竹病毒组(dianthovirus virus group);蚕豆萎蔫病组(group broad bean wilt);豆科病毒组(fabavirus virus group);丝状病毒科(filoviridae);黄病毒科(flaviviridae);真菌传杆状病毒组(furovirus group);双生病毒组(group germinivirus);贾第虫病毒组(group giardiavirus);嗜肝dna病毒科(hepadnaviridae);疱疹病毒科(herpesviridae);大麦病毒组(hordeivirus virus group);illarvirus病毒组;丝杆状病毒科(lnoviridae);虹彩病毒科(iridoviridae);光滑病毒科(leviviridae);脂毛噬菌体科(lipothrixviridae);黄矮病毒组(luteovirus group);marafivirus病毒组;玉米褪绿矮缩病毒组(maize chlorotic dwarf virus group);icroviridae;肌病毒科(myoviridae);坏死病毒组(necrovirus group);线虫传多面体病毒组(nepovirus virus group);野田村病毒科(nodaviridae);正粘病毒科(orthomyxoviridae);乳多空病毒科(papovaviridae);副粘病毒科(paramyxoviridae);欧防风黄点病毒组(parsnip yellow fleck virus group);双分体病毒科(partitiviridae);细小病毒科(parvoviridae);豌豆耳突花叶病毒组(pea enation mosaic virus group);藻类dna病毒科(phycodnaviridae);微小rna病毒科(picomaviridae);plasmaviridae;prodoviridae;多分dna病毒科(polydnaviridae);马铃薯x病毒组(potexvirus group);马铃薯y病毒组(potyvirus);痘病毒科(poxviridae);呼肠孤病毒科(reoviridae);逆转录病毒科(retroviridae);弹状病毒科(rhabdoviridae);根前毛壶菌病毒组(group rhizidiovirus);长尾病毒科(siphoviridae);南方菜豆花叶病毒组(sobemovirus group);ssv 1型噬菌体;复层病毒科(tectiviridae);纤细病毒属(tenuivirus);四病毒科(tetraviridae);烟草花叶病毒组(group tobamovirus);烟草脆裂病毒组(group tobravirus);披膜病毒科(togaviridae);番茄丛矮病毒组(group tombusvirus);group tobovirus;整体病毒科(totiviridae);芜菁黄花叶病毒组(group tymovirus);和植物病毒卫星(plant virus satellites)。
[0175]
用于生产重组病毒载体和用于使用病毒载体进行核酸递送的方案可以见于:bouard,d.等,br j.pharmacol 2009may,157(2)153
‑
165“viral vectors:from virology to transgene expression”;current protocols in molecular biology,ausubel,f.m.等(编),greene publishing associates,(1989);以及其它标准实验室手册(例如vectors for gene therapy.in:current protocols in human genetics.john wiley and sons,inc.:1997)。
[0176]
用于递送核酸的病毒载体的具体实例包括例如逆转录病毒、慢病毒、腺病毒、aav和其它细小病毒、疱疹病毒和痘病毒载体。慢病毒是一种逆转录病毒,可以感染分裂细胞和非分裂细胞。它们包括人类免疫缺陷病毒(hiv)、猿猴免疫缺陷病毒(siv)、猫免疫缺陷病毒(fiv)、牛免疫缺陷病毒(biv)。转基因的侧翼为ltr,ltr可以是相同或不同的、合成的、嵌合的等。此外,像tat和rev这样的元件可以增强转基因的表达。
[0177]
逆转录病毒还包括γ
‑
逆转录病毒载体,例如鼠白血病病毒(mlv),其中,转基因两
侧的侧翼也均为ltr。
[0178]
如本文所使用的术语“细小病毒”涵盖细小病毒科,包括自主复制细小病毒和依赖病毒。自主细小病毒包括细小病毒属、红细胞病毒属、浓核病毒属、艾特拉病毒属和contravirus属的成员。示例性自主细小病毒包括但不限于小鼠微小病毒、牛细小病毒、犬细小病毒、鸡细小病毒、猫泛白细胞减少症病毒、猫细小病毒、鹅细小病毒、h1细小病毒、番鸭细小病毒和b19病毒以及被国际病毒分类委员会(ictv)归类为细小病毒的任何其它病毒。
[0179]
其它自主细小病毒是本领域技术人员已知的。参见例如bernard n.fields等,virology,第2卷,第69章(第4版,lippincott
‑
raven publishers)。
[0180]
依赖病毒属包含腺相关病毒(aav),包括但不限于aav 1型、aav 2型、aav 3型、aav 4型、aav 5型、aav 6型、aav 7型、aav 8型、aav 9型、aav 10型、aav 11型、aav 12型、aav 13型、禽aav、牛aav、犬aav、马aav和羊aav以及被国际病毒分类委员会(ictv)归类为依赖病毒的任何其它病毒(例如aav)。参见例如bernard n.fields等,virology,第2卷,第69章(第4版,lippincott
‑
raven publishers)。
[0181]
在特定实施方式中,递送载体包含aav衣壳,所述aav衣壳包括但不限于来自aav 1型、aav 2型、aav 3型、aav 4型、aav 5型、aav 6型、aav 7型或aav 8型、aav 9型、aav 10型、aav 11型、aav 12型、aav 13型的衣壳。衣壳蛋白可以来自相同或不同的血清型。
[0182]
表2描述了示例性aav血清型和可以在本文所述的raav载体中用作aav衣壳的示例性的已公开的相应衣壳序列,或者与目前已知或今后鉴定的野生型衣壳蛋白和/或其它嵌合或变体衣壳蛋白的任意组合,并且将它们各自并入本文。
[0183]
表2:aav血清型和示例性的已公开的相应衣壳序列
[0184]
该表中列出的序列是本领域已知的,仅通过引用将它们整体并入本文。
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191]
[0192]
[0193]
[0194]
[0195][0196]
本领域已知自主细小病毒和aav的多种血清型的基因组序列以及末端重复(tr)、rep蛋白和衣壳亚基的序列。此类序列可见于文献或公共数据库(如genbank)中。参见例如genbank登录号nc 002077、nc 001401、nc 001729、nc 001863、nc 001829、nc 001862、nc 000883、nc 001701、nc 001510、af063497、u89790、af043303、af028705、af028704、j02275、j01901、j02275、x01457、af288061、ah009962、ay028226、ay028223、nc 001358、nc 001540、af513851、af513852;将它们的公开内容整体并入本文。还参见例如srivistava等,(1983)j.virology 45:555;chiorini等,(1998)j.virology 71:6823;chiorini等,(1999)j.virology 73:1309;bantel
‑
schaal等,(1999)j.virology 73:939;xiao等,(1999)j.virology 73:3994;muramatsu等,(1996)virology 221:208;shade等,(1986)j.virol.58:921;gao等,(2002)proc.nat.acad.sci.usa 99:11854;国际专利公开wo 00/28061、wo 99/61601、wo 98/11244;美国专利no.6,156,303;将它们的公开内容整体并入本文。对aav1、aav2和aav3末端重复序列的早期描述由xiao,x.(1996),“characterization of adeno
‑
associated virus(aav)dna replication and integration”,博士论文,university of pittsburgh,pittsburgh,pa.(将其整体并入本文)提供。
[0197]
本发明的细小病毒aav颗粒可为“杂合”细小病毒或aav颗粒,其中,病毒末端重复和病毒衣壳分别来自不同的细小病毒或aav。杂合细小病毒在国际专利公开wo 00/28004;chao等,(2000)molecular therapy 2:619;以及chao等,(2001)mol.ther.4:217(将它们的公开内容整体并入本文)中有更详细的描述。在代表性实施方式中,病毒末端重复和衣壳来自不同的aav血清型(即“杂合aav颗粒”)。
[0198]
细小病毒或aav衣壳还可为如国际专利公开wo 00/28004中所描述的“嵌合”衣壳(例如含有来自不同细小病毒,优选不同aav血清型的序列)或“靶向”衣壳(例如具有定向趋向性)。
[0199]
此外,细小病毒或aav载体可为如国际专利公开wo 01/92551中所描述的双链体细小病毒颗粒或双链体aav颗粒。
[0200]
腺相关病毒(aav)已被用作核酸递送载体。对于综述参见muzyczka等,curr.topics in micro.and immunol(1992)158:97
‑
129。aav为细小病毒并具有小二十面体病毒粒子,直径为18
‑
26纳米并包含大小为4
‑
5千碱基的单链基因组dna分子。该病毒包含dna分子的正义链或反义链,其中任一条链并入病毒粒子中。两个开放读码框编码一系列rep和cap多肽。rep多肽(rep50、rep52、rep68和rep78)参与aav基因组的复制、挽救和整合,尽管在所有四种rep多肽都不存在的情况下可以观察到显著活性。cap蛋白(vp1、vp2、vp3)形成病毒粒子衣壳。位于基因组5'和3'端的rep和cap开放读码框的侧翼为145个碱基对的反向末端重复(itr),其中的前125个碱基对能够形成y形或t形双链体结构。已经表明itr代表aav基因组复制、挽救、包装和整合所需的最小顺式序列。所有其它病毒序列都是非必要的,并且可以以反式提供(muzyczka,(1992)curr.topics microbiol.immunol.158:97)。
[0201]
aav是少数能够将其dna整合到非分裂细胞中的病毒,并且表现出稳定整合到人类19号染色体中的高频率(参见例如flotte等,(1992)am.j.respir.cell.mol.biol.7:349
‑
356;samulski等,(1989)j virol.63:3822
‑
3828;以及mclaughlin等(1989)j.virol.62:1963
‑
1973)。已使用aav载体将多种核酸引入不同的细胞类型(参见例如hermonat等,(1984)proc.nat.acad.sci.usa 81:6466
‑
6470;tratschin等,(1985)mol.cell.biol.4:2072
‑
2081;wondisford等,(1988)mol.endocrinol.2:32
‑
39;tratschin等,(1984)j.virol.51:611
‑
619;和flotte等,(1993)j.biol.chem.268:3781
‑
3790)。
[0202]
通常,raav载体基因组将仅保留末端重复(tr)序列,以使能够被载体有效包装的转基因的大小最大化。结构蛋白和非结构蛋白编码序列可以以反式提供(例如来自载体(例如质粒);或通过将序列稳定整合到包装细胞中)。通常,raav载体基因组包含至少一个aav末端重复,更通常为两个aav末端重复,其通常位于异源核苷酸序列的5'和3'端。
[0203]
表3描述了可以在本文所述的raav载体中用作aav衣壳的示例性嵌合或变体衣壳蛋白,或者与目前已知或今后鉴定的野生型衣壳蛋白和/或其它嵌合或变体衣壳蛋白的任意组合,并且将它们各自并入本文。在一些实施方式中,所涵盖的可使用的raav载体是嵌合载体,例如在9,012,224和us 7,892,809中公开的,通过引用将它们整体并入本文。
[0204]
在一些实施方式中,raav载体是单倍体raav载体,如pct/us18/22725中公开的;或多倍体raav载体,例如,如2018年7月31日提交的pct/us2018/044632和美国申请16/151,110中公开的,通过引用将它们各自整体并入本文。在一些实施方式中,raav载体是raav3载体,如9,012,224和wo 2017/106236中公开的,通过引用将它们整体并入本文。
[0205]
表3:可以在本文所述的raav载体中用作aav衣壳的示例性嵌合或变体衣壳蛋白。
[0206][0207][0208]
在一个实施方式中,本文公开的raav载体包含衣壳蛋白,所述衣壳蛋白与uspto的
授权专利和公开申请的文档集中列出的以下生物序列文件中的任何序列文件相关,所述文件描述了能够以与野生型衣壳蛋白和/或目前已知或今后鉴定的其它嵌合或变体衣壳蛋白的任意组合并入本发明的aav衣壳中的嵌合或变体衣壳蛋白(出于说明目的,11486254对应于美国专利申请no.11/486,254,并且其它生物序列文件将以类似方式解读):11486254.raw、11932017.raw、12172121.raw、12302206.raw、12308959.raw、12679144.raw、13036343.raw、13121532.raw、13172915.raw、13583920.raw、13668120.raw、13673351.raw、13679684.raw、14006954.raw、14149953.raw、14192101.raw、14194538.raw、14225821.raw、14468108.raw、14516544.raw、14603469.raw、14680836.raw、14695644.raw、14878703.raw、14956934.raw、15191357.raw、15284164.raw、15368570.raw、15371188.raw、15493744.raw、15503120.raw、15660906.raw和15675677.raw。在一个实施方式中,本发明的aav衣壳蛋白和病毒衣壳可以是嵌合的,其中它们可包含来自另一病毒(任选地为另一细小病毒或aav)的衣壳亚基的全部或部分,例如,如国际专利公开wo 00/28004中描述的,通过引用将其并入。
[0209]
在一些实施方式中,raav载体基因组是单链的或单体的双链体,如美国专利no.8,784,799中描述的,将其并入本文。
[0210]
作为另外的实施方式,本发明的aav衣壳蛋白和病毒衣壳可以是多倍体(也可以是单倍体),其中它们可以在单个aav衣壳中包含vp1、vp2和vp3 aav血清型的不同组合,如pct/us18/22725中描述的,通过引用将其并入。
[0211]
在一个实施方式中,在如本文公开的cf的治疗中有用的raav载体是aav3b衣壳。所涵盖的可使用的aav3b衣壳描述于2017/106236以及9,012,224和7,892,809中,通过引用将它们整体并入本文。
[0212]
在一个实施方式中,可用于治疗cf的aav衣壳可为整体地或部分地衍生自所阐明的aav衣壳的经修饰的aav衣壳。在一些实施方式中,来自aav3b衣壳的氨基酸可以是来自不同aav血清型的另一衣壳的氨基酸,或者可以被来自不同aav血清型的另一衣壳的氨基酸置换,其中,置换和/或插入的氨基酸可以来自任何aav血清型,并且可以包含天然存在的氨基酸或者部分或完全合成的氨基酸。
[0213]
治疗方法
[0214]
囊性纤维化(cf)
[0215]
该疾病是由囊性纤维化跨膜传导调节蛋白(cftr)基因中的突变引起的,其导致缺陷型cftr蛋白的产生,这破坏氯离子转运,导致跨各种上皮层的水通量(water fluxes)显著受损。这引发“粘性”粘液分泌物,其阻塞肺、消化道和其它器官的分泌腺。
[0216]
囊性纤维化跨膜传导调节蛋白(cftr)基因。
[0217]
在一些实施方式中,所述治疗性转基因是囊性纤维化跨膜传导调节蛋白(cftr)基因。
[0218]
如本文所使用的“囊性纤维化跨膜传导调节蛋白”或“cftr”是指调节盐和体液稳态的氯离子和碳酸氢根离子通道。许多物种的cftr核酸和多肽的序列是已知的,包括例如人cftr(ncbi基因id:1080)mrna(例如ncbi ref seq:1.nm_000492.3)和多肽(例如np_000483.3)。cftr糖蛋白具有多个膜整合亚基,其形成两个跨膜结构域(msd)、两个细胞内核
苷酸结合结构域(nbd)和一个调节性(r)结构域(其作为磷酸化位点)。msd1和msd2形成通道孔壁。孔的打开和关闭是通过atp与细胞质nbd结构域的相互作用,这导致msd1和msd2的构象变化。门控和传导通过蛋白激酶a(pka)进行的r结构域磷酸化来调节。cftr的复杂区域需要加工和成熟才能进行精确折叠。cftr结构必须满足严格的质量标准才能从内质网输出并随后运输到细胞表面。不满足这些标准的cftr则注定会发生内质网相关蛋白降解(erad)。这种复杂的质量控制系统以损害效率的方式运行,甚至将野生型cftr的输出产量降低到类似家族细胞转运蛋白的33%。囊性纤维化是改变这些结构域中的cftr或改变这些结构域彼此相互作用的方式的突变所引起的。
[0219]
人类(homo sapiens)的cftr基因产物的序列如下(np_000483.3):
[0220][0221]
在一些实施方式中,治疗性转基因为截短的囊性纤维化跨膜传导调节蛋白(cftr)基因,包括但不限于在例如cebotaru l等,(2013)j biol chem.apr 12;288(15):10505
‑
12中描述的人cftr的n
‑
尾加工突变体(例如e60a;a264或a27
‑
264)(np_000483.3)。本文描述的截短的cftr突变体可以特异性挽救δf508
‑
cftr的加工,在体外在细胞表面产生功能性cftr氯离子通道。
[0222]
如本文所使用的,cftr基因中的突变导致分泌上皮细胞(主要在气道、胰腺和肝的胆管系统中)中cftr蛋白的水平降低或缺失。已报道了cftr基因中超过1900种不同的突变。具有调节蛋白活性的突变体包括但不限于af508 cftr和g551d cftr(对于cftr突变,参见
例如http://www.gen
‑
et.sickkids.on.ca/cfni)。
[0223]
表4:10种最常见的cftr突变的发生率
[0224]
cftr突变等位基因频率(%)δf50867.9394deltt7.13659delc6.4s945l1.2r117c1.0r117h0.55t338i0.55g551d0.55r553x0.55i506l0.41
[0225]
cftr的功能受损降低从上皮细胞逃逸到上覆粘液层(overlying mucous layer)中的氯离子(cl
‑
)水平。分泌到粘液中的cl
‑
离子减少导致na
+
:cl
‑
失衡,这转而减少吸收到粘液层中的水量。结果,粘液变得厚重、粘稠并且难以通过粘液纤毛提升器(mucociliary elevator)移动。肺中滞留的粘液成为细菌感染(尤其是铜绿假单胞菌)的有利介质,促进>95%的cf患者反复发生肺炎、肺损伤并最终导致肺衰竭。胰腺、肠和肝胆道系统的其它导管系统中滞留的粘液导致阻塞、器官功能障碍,并在某些情况下会导致器官衰竭。
[0226]
基因编辑分子
[0227]
在一些实施方式中,治疗性核酸为基因编辑分子。
[0228]
此处概述了本文所述技术的方面,其中,raav基因组在5'至3'方向上包含:
[0229]
5'itr;
[0230]
启动子序列;
[0231]
内含子序列;
[0232]
治疗性核酸(例如基因编辑分子);
[0233]
poly a序列;和
[0234]
3'itr。
[0235]
如本文所述,治疗性核酸分子可为载体、表达载体、抑制性核酸、适体、模板分子或盒(例如用于基因编辑)或靶向分子(例如用于crispr
‑
cas技术)或期望将其递送到细胞的任何其它核酸分子。核酸分子可为rna、dna或它们的合成或修饰形式。
[0236]
在本文提供的所有方面,基因编辑核酸序列编码选自于由以下基因编辑分子组成的组中的基因编辑分子:序列特异性核酸酶、一种或多种引导rna、crispr/cas、核糖核蛋白(rnp)、或用于crispri或crispra系统的去活化cas,或它们的任意组合。
[0237]
在一些实施方式中,基因编辑分子选自于核酸酶、引导rna(grna)、引导dna(gdna)和激活子rna。
[0238]
一般而言,引导序列是与靶多核苷酸序列具有足够互补性以与靶序列杂交并引导rna引导的核酸内切酶复合体对所选基因组靶序列的序列特异性靶向的任何多核苷酸序列。在一些实施方式中,引导rna结合,并且例如cas蛋白可以形成核糖核蛋白(rnp),例如
crispr/cas复合体。
[0239]
在一些实施方式中,引导rna(grna)序列包含将grna序列引导至基因组中期望位点的靶向序列,其融合至允许引导序列与rna引导的核酸内切酶缔合的crrna和/或tracrrna序列。在一些实施方式中,当使用合适的比对算法进行最佳比对时,引导序列与其对应的靶序列之间的互补程度为至少50%、60%、75%、80%、85%、90%、95%、97.5%、99%或更高。可以使用任何合适的序列比对算法来确定最佳比对,例如smith
‑
waterman算法、needleman
‑
wunsch算法、基于burrows
‑
wheeler变换的算法(例如burrows wheeler aligner)、clustalw、clustal x、blat、novoalign(novocraft technologies,eland(illumina,san diego,calif.)、soap和maq。在一些实施方式中,引导序列长度为5个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、35个、40个、45个、50个、75个或更多个核苷酸。本文考虑在内的是引导rna的靶向序列和靶核酸分子上的靶序列可包含1个、2个、3个、4个、5个、6个、7个、8个、9个或10个错配。在一些实施方式中,引导rna序列包含回文结构序列,例如,自靶向序列包含回文结构。引导rna的靶向序列的长度通常为19
‑
21个碱基对并且直接在发夹之前,其使整个引导rna(靶向序列+发夹)结合至cas(例如cas9)。当使用回文结构序列作为引导rna的自靶向序列时,反向重复元件的长度可为例如9个、10个、11个、12个或更多个核苷酸。在引导rna的靶向序列最常为19
‑
21bp的情况下,9个或10个核苷酸的回文结构反向重复元件提供期望长度的靶向序列。然后,cas9
‑
引导rna发夹复合体可以识别和切割任何核苷酸序列(dna或rna),例如,匹配该19
‑
21个碱基对序列并后跟“pam”序列(例如ngg或nga,或其它pam)的dna序列。
[0240]
可以通过任何合适的测定法来评估引导序列指导rna引导的核酸内切酶复合体与靶序列的序列特异性结合的能力。例如,可以向具有相应靶序列的宿主细胞提供足以形成rna引导的核酸内切酶复合体的rna引导的核酸内切酶系统的组分,例如通过用编码rna引导的核酸内切酶序列的组分的载体转染,然后评估靶序列内的优先切割(例如通过surveyor测定法(transgenomic
tm
,new haven,ct))。类似地,可以通过提供靶序列、rna引导的核酸内切酶复合体的组分(包括待测试的引导序列和不同于测试引导序列的对照引导序列)并比较测试和对照引导序列反应之间靶序列处的切割率或结合,在试管中评估靶多核苷酸序列的切割。本领域普通技术人员将理解,也可以使用其它测定法来测试grna序列。
[0241]
可以选择引导序列以靶向任何靶序列。在一些实施方式中,靶序列是细胞基因组内的序列。在一些实施方式中,如本文所述,靶序列是在自克隆质粒中编码第一引导rna的序列。通常,基因组中的靶序列将包含用于rna引导的核酸内切酶的结合的原型间隔区邻近(pam)序列。本领域技术人员将理解,pam序列和rna引导的核酸内切酶应选自相同(细菌)物种,以允许核酸内切酶与靶向序列的适当缔合。例如,cas9的pam序列不同于cpf1的pam序列。设计基于适当的pam序列。为防止引导rna降解,引导rna的序列不应包含pam序列。在一些实施方式中,引导rna中靶向序列的长度为12个核苷酸;在其它实施方式中,引导rna中靶向序列的长度为13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、35个或40个核苷酸。引导rna可以与所靶向的dna序列的任一链互补。在一些实施方式中,当修饰基因组以包含插入或缺失时,可以使grna更近地靶向蛋白编码区的n末端。
[0242]
本领域技术人员将理解,为了通过rna引导的核酸内切酶进行靶向切割,基因组中的独特靶序列优于在基因组中出现不止一次的靶序列。生物信息学软件可用于预测和最小化引导rna的脱靶效应(参见例如naito等“crisprdirect:software for designing crispr/cas guide rna with reduced off
‑
target sites”bioinformatics(2014),epub;heigwer,f.等,“e
‑
crisp:fast crispr target site identification”nat.methods 11,122
‑
123(2014);bae等,“cas
‑
offinder:a fast and versatile algorithm that searches for potential off
‑
target sites of cas9 rna
‑
guided endonucleases”bioinformatics 30(10):1473
‑
1475(2014);aach等,“casfinder:flexible algorithm for identifying specific cas9 targets in genomes”biorxiv(2014)等)。
[0243]
对于酿脓链球菌(s.pyogenes)cas9,基因组中的独特靶序列可以包含形式为mmmmmmmmnnnnnnnnnnnnxgg(seq id no:308)的cas9靶位点,其中nnnnnnnnnnnnxgg(seq id no:309)(n为a、g、t或c;x可为任何核苷酸)在基因组中仅出现一次。基因组中的独特靶序列可以包含形式为mmmmmmmmmnnnnnnnnnnnxgg(seq id no:310)的酿脓链球菌cas9靶位点,其中nnnnnnnnnnnxgg(seq id no:311)(n为a、g、t或c;x可为任何核苷酸)在基因组中仅出现一次。对于嗜热链球菌(s.thermophilus)crisp r1 cas9,基因组中的独特靶序列可以包含形式为mmmmmmmmnnnnnnnnnnnnxxagaaw(seq id no:312)的cas9靶位点,其中nnnnnnnnnnnnxxagaaw(seq id no:313)(n为a、g、t或c;x可为任何核苷酸;w为a或t)在基因组中仅出现一次。基因组中的独特靶序列可以包含形式为mmmmmmmmmnnnnnnnnnnnxxagaaw(seq id no:314)的嗜热链球菌crispr1 cas9靶位点,其中nnnnnnnnnnnxxagaaw(seq id no:315)(n为a、g、t或c;x可为任何核苷酸;w为a或t)在基因组中仅出现一次。对于酿脓链球菌cas9,基因组中的独特靶序列可以包含形式为mmmmmmmmnnnnnnnnnnnnxggxg(seq id no:316)的cas9靶位点,其中nnnnnnnnnnnnxggxg(seq id no:317)(n为a、g、t或c;x可为任何核苷酸)在基因组中仅出现一次。基因组中的独特靶序列可以包含形式为mmmmmmmmmnnnnnnnnnnnxggxg(seq id no:318)的酿脓链球菌cas9靶位点,其中nnnnnnnnnnnxggxg(seq id no:319)(n为a、g、t或c;x可为任何核苷酸)在基因组中仅出现一次。在这些序列中的每一个中,“m”可为a、g、t或c,并且在将序列识别为独特时无需加以考虑。
[0244]
一般而言,如在本文中所使用的术语“crrna/tracrrna融合序列”是指融合至独特靶向序列并发挥允许形成包含引导rna和rna引导的核酸内切酶的复合体的功能的核酸序列。此类序列可以仿照原核生物中的crispr rna(crrna)序列建模,其包含(i)称为“原型间隔区”的可变序列,其对应于本文所述的靶序列;以及(ii)crispr重复序列。类似地,融合体的tracrrna(“反式激活crispr rna”)部分可以设计为包含二级结构,类似于原核生物中的tracrrna序列(例如发夹),以允许核酸内切酶复合体的形成。在一些实施方式中,融合体与tracrrna序列具有足够的互补性以促进以下中的一项或多项:(1)在含有相应tracr序列的细胞中切除侧翼为tracrrna序列的引导序列;以及(2)在靶序列处形成核酸内切酶复合体,其中,该复合体包含与tracrrna序列杂交的crrna序列。一般而言,互补程度沿crrna序列和tracrrna序列中较短者的长度来参考两个序列的最佳比对。最佳比对可以通过任何合适的比对算法确定并且可以进一步对二级结构做出解释,例如tracrrna序列或crrna序列内的自互补。在一些实施方式中,当最佳比对时,tracr rna序列和crrna序列沿两者中较短者的
长度的互补程度为约25%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%或更高,或大于约25%、30%、40%、50%、60%、70%、80%、90%、95%、97.5%、99%或更高。在一些实施方式中,tracrrna序列的长度为至少5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、25个、30个、40个、50个、60个、70个、80个、90个、100个或更多个核苷酸(例如长度为70
‑
80个、70
‑
75个、75
‑
80个核苷酸)。在一个实施方式中,crrna的长度小于60个、小于50个、小于40个、小于30个或小于20个核苷酸。在其它实施方式中,crrna的长度为30
‑
50个核苷酸;在其它实施方式中,crrna的长度为30
‑
50个、35
‑
50个、40
‑
50个、40
‑
45个、45
‑
50个或50
‑
55个核苷酸。在一些实施方式中,crrna序列和tracrrna序列包含在单个转录物中,使得两者之间的杂交产生具有二级结构(例如发夹)的转录物。在一些实施方式中,用于发夹结构中的成环序列的长度为四个核苷酸,例如序列gaaa。然而,可以使用更长或更短的环序列,也可以使用替代序列。该序列优选地包含核苷酸三联体(例如aaa)和额外的核苷酸(例如c或g)。成环序列的实例包括caaa和aaag。在一个实施方式中,转录物或转录的grna序列包含至少一个发夹。在一个实施方式中,转录物或转录的多核苷酸序列具有至少两个或更多个发夹。在其它实施方式中,转录物具有两个、三个、四个或五个发夹。在另外的实施方式中,转录物具有至多五个发夹。在一些实施方式中,单个转录物进一步包含转录终止序列,例如polyt序列(例如六个t核苷酸)。包含引导序列、crrna序列和tracr序列的单个多核苷酸的非限制性实例如下(从5'至3'列出),其中“n”代表引导序列的碱基,第一块小写字母代表crrna序列且第二块小写字母代表tracr序列,最后的poly
‑
t序列代表转录终止子:(i)
[0245][0246]
(seq id no:325)。在一些实施方式中,将序列(i)至序列(iii)与来自嗜热链球菌crispr1的cas9组合使用。在一些实施方式中,将序列(iv)至序列(vi)与来自酿脓链球菌的cas9组合使用。在一些实施方式中,tracrrna序列是与包含crrna序列的转录物不同的转录物。
[0247]
在一些实施方式中,引导rna可包含两个rna分子并且在本文中被称为“双引导rna”或“dgrna”。在一些实施方式中,dgrna可包含含有crrna的第一rna分子和含有tracrrna的第二rna分子。第一和第二rna分子可以通过tracrrna和crrna上的旗杆(flagpole)之间的碱基配对形成rna双链体。使用dgrna时,旗杆无需有长度上限。
[0248]
在其它实施方式中,引导rna可以包含单个rna分子并且在本文中被称为“单引导rna”或“sgrna”。在一些实施方式中,sgrna可包含与tracrrna共价连接的crrna。在一些实施方式中,crrna和tracrrna可以通过接头共价连接。在一些实施方式中,sgrna可以通过tracrrna和crrna上的旗杆之间的碱基配对而包含茎环结构。在一些实施方式中,单引导rna的长度为至少50个、至少60个、至少70个、至少80个、至少90个、至少100个、至少110个、至少120个或更多个核苷酸(例如长度为75
‑
120个、75
‑
110个、75
‑
100个、75
‑
90个、75
‑
80个、80
‑
120个、80
‑
110个、80
‑
100个、80
‑
90个、85
‑
120个、85
‑
110个、85
‑
100个、85
‑
90个、90
‑
120个、90
‑
110个、90
‑
100个、100
‑
120个、100
‑
120个核苷酸)。在一些实施方式中,载体或其组合物包含编码至少1种grna的核酸。例如,第二多核苷酸序列可以编码至少1种grna、至少2种grna、至少3种grna、至少4种grna、至少5种grna、至少6种grna、至少7种grna、至少8种grna、至少9种grna、至少10种grna、至少11种grna、至少12种grna、至少13种grna、至少14种grna、至少15种grna、至少16种grna、至少17种grna、至少18种grna、至少19种grna、至少20种grna、至少25种grna、至少30种grna、至少35种grna、至少40种grna、至少45种grna或至少50种grna。第二多核苷酸序列可以编码1种grna至50种grna、1种grna至45种grna、1种grna至40种grna、1种grna至35种grna、1种grna至30种grna、1种grna至25种不同grna、1种grna至20种grna、1种grna至16种grna、1种grna至8种不同grna、4种不同grna至50种不同grna、4种不同grna至45种不同grna、4种不同grna至40种不同grna、4种不同grna至35种不同grna、4种不同grna至30种不同grna、4种不同grna至25种不同grna、4种不同grna至20种不同grna、4种不同grna至16种不同grna、4种不同grna至8种不同grna、8种不同grna至50种不同grna、8种不同grna至45种不同grna、8种不同grna至40种不同grna、8种不同grna至35种不同grna、8种不同grna至30种不同grna、8种不同grna至25种不同grna、8种不同grna至20种不同grna、8种不同grna至16种不同grna、16种不同grna至50种不同grna、16种不同grna至45种不同grna、16种不同grna至40种不同grna、16种不同grna至35种不同grna、16种不同grna至30种不同grna、16种不同grna至25种不同grna或16种不同grna至20种不同grna。编码不同grna的多核苷酸序列中的每一个可以可操作地连接至启动子。可操作地连接至不同grna的启动子可为相同的启动子。可操作地连接至不同grna的启动子可为不同的启动子。启动子可为组成型启动子、诱导型启动子、阻抑型启动子或调控型启动子。
[0249]
在一些实验中,引导rna将靶向cftr序列靶区域,成功敲入或敲除缺失或校正有缺陷的基因。已经设计了多个结合已知cftr靶区域的grna序列。表3中列出了靶向cftr的grna序列的非限制性实例。
[0250]
在一些实施方式中,治疗性核酸是靶向cftr的基因编辑分子。
[0251]
在一些实施方式中,grna靶向最常见的cftr突变,即外显子11中第508位苯丙氨酸的缺失(cftr f508 del),其导致cftr蛋白的错误折叠、内质网滞留和早期降解。
[0252]
在一些实施方式中,grna靶向cftr,包括但不限于靶向cftr外显子11或内含子11的grna以及编码野生型cftr序列的供体质粒。
[0253]
在一些实施方式中,grna靶向cftr突变,包括但不限于靶向cftr外显子11或内含子11的grna。
[0254]
在一些实施方式中,grna靶向cftr,包括但不限于靶向cftr外显子11或内含子11的grna以及编码野生型cftr序列的供体质粒。
[0255]
在一些实施方式中,grna靶向cftr突变,包括但不限于靶向cftr外显子11或内含子11的grna以及编码野生型cftr序列的供体质粒。
[0256]
表4中列出的grna序列独特地靶向人类基因组内的cftr基因。这些grna序列与wt spcas9一起使用,或作为crrna与wt spcas9蛋白一起使用,以引入用于基因组编辑的dsb。这些sgrna序列在sanjana n.e.,shalem o.,zhang f.improved vectors and genome
‑
wide libraries for crispr screening.nat methods.2014aug;11(8):783
‑
4中得到验证。
[0257]
表5:靶向cftr基因的引导rna(参见例如https://www.genscrip t.com/grna
‑
detail/1080/cftr
‑
crispr
‑
guide
‑
rna.html)
[0258][0259]
在一些实施方式中,至少一种基因编辑分子为grna或gdna。
[0260]
在一些实施方式中,至少一种基因编辑分子是与sam一起进行转录激活的grna。
[0261]
在一些实施方式中,至少一种基因编辑分子是激活子rna。
[0262]
当与crispr/cas9协同激活调控子(sam)复合体一起使用时,表5中列出的以下grna序列独特且稳健地激活人类基因组内的内源性cftr基因的转录。这些grna特异性靶向转录起始位点(tss)上游最开始的200bp。这些经验证的sgrna序列公开于konermann s等,genome
‑
scale transcriptional activation by an engineered crispr
‑
cas9 complex.nature,2015jan 29;517(7536):583
‑
8中。
[0263]
表6:与sam一起进行转录激活的grna
[0264]
sam grna名称sam grna序列cftr sam引导rna 1cgctagagcaaatttggggc(seq id no:330)cftr sam引导rna 2gggcggcgagggagcgaagg(seq id no:331)cftr sam引导rna 3tggcgggggtgcgtagtggg(seq id no:332)
[0265]
在一些实施方式中,所述序列特异性核酸酶选自于核酸引导的核酸酶、锌指核酸酶(zfn)、大范围核酸酶、转录激活因子样效应物核酸酶(talen)或megatal。
[0266]
在一些实施方式中,所述序列特异性核酸酶是选自于单碱基编辑器、rna引导的核酸酶和dna引导的核酸酶中的核酸引导的核酸酶。
[0267]
可以改变本文所述的核酸酶,例如将其工程化以设计序列特异性核酸酶(参见例如美国专利8,021,867)。可以使用例如certo,mt等,nature methods(2012)9:073
‑
975;美国专利no.8,304,222、8,021,867、8,119,381、8,124,369、8,129,134、8,133,697、8,143,015、8,143,016、8,148,098或8,163,514(通过引用将它们的内容各自整体并入本文)中描
述的方法设计核酸酶。或者,可以使用市售技术(例如precision biosciences的directed nuclease editor
tm
基因组编辑技术)获得具有位点特异性切割特征的核酸酶。
[0268]
在某些实施方式中,包含同源定向修复模板、引导rna和/或cas酶或任何其它核酸酶的载体构建体以反式递送,例如通过给予i)编码引导rna的核酸;ii)或编码期望核酸酶(例如cas酶或其它核酸酶)的mrna;iii)或通过给予包含cas酶和引导rna的核糖核苷酸蛋白(rnp)复合体;或iv)例如通过载体(例如病毒载体、质粒载体或其它载体)递送重组核酸酶蛋白。
[0269]
在一些实施方式中,核酸引导的核酸酶是crispr核酸酶。
[0270]
在一个实施方式中,载体可以包含由诱导型启动子进行转录调控的核酸内切酶(例如cas9)。在一些实施方式中,核酸内切酶在单独的载体上,其可以与包含同源臂和供体序列的载体(其还可以任选地包含引导rna(sgrna))一起给予受试者。
[0271]
在一些实施方式中,crispr核酸酶是cas核酸酶。
[0272]
在一个实施方式中,可以给予载体混合物(cocktail)。例如,不同基因编辑分子的组合。
[0273]
在另一个实施方式中,可以给予基因编辑分子和含有治疗性cftr基因(例如截短的cftr基因)的第二载体。
[0274]
免疫屏障
[0275]
先天性和适应性免疫应答是成功基因转移的主要障碍。肺具有多层、复杂的防御机制,可保护宿主免受病原体侵害。这种应答的重要参与者包括巨噬细胞、树突状细胞、中性粒细胞和淋巴细胞。病原体识别受体通过检测病原体相关分子模式触发急性和瞬时的先天免疫应答。toll样受体、抗病毒细胞质解旋酶(rig
‑
i和mda5)和核苷酸寡聚化结构域样受体属于在气道上皮中表达的病原体识别受体。病原体分子以及一些基因转移载体的识别导致炎性细胞因子的分泌和抗原呈递细胞的成熟。
[0276]
物理屏障
[0277]
自1989年首次克隆cftr基因以来,已经研究了若干种用于矫正cf肺病的基因疗法策略。然而,载体系统的递送一直很困难。这在部分程度上是由于已进化的多重复杂的肺气道屏障会清除或阻止外来颗粒(包括但不限于粘稠的分泌物)的摄取,并且cf肺中的慢性感染和炎症的继发效应为基因转移带来了额外的障碍。
[0278]
肺已经进化出多重屏障以防止外来颗粒和病原体靠近气道细胞。传导气道(conducting airway)表面衬有纤毛上皮。纤毛沐浴在纤毛周围流体层(periciliary fluid layer)中。粘液层是另一个重要物理屏障,其覆盖纤毛周围流体层。由表面气道杯状细胞和粘膜下腺分泌的粘蛋白是粘液的主要成分。粘液层捕获吸入的颗粒并通过粘液纤毛清除将其移除。由碳水化合物、糖蛋白和多糖组成的顶端表面糖萼(apical surface glycocalyx)是另一个屏障。它结合吸入的颗粒并防止它们到达细胞表面受体。
[0279]
本文描述了一种用于治疗囊性纤维化(cf)的方法,所述方法包括通过支气管动脉导管插入递送向受试者给予病毒载体,其中,所述病毒载体是在衣壳中含有治疗性转基因的腺相关病毒(aav)载体。
[0280]
如本文所使用的术语“调制(modulating)”是指以可测量的量提高或降低例如活性。通过提高cftr阴离子通道的活性来调制cftr活性的化合物称为激动剂。通过降低cftr
阴离子通道的活性来调制cftr活性的化合物称为拮抗剂。
[0281]
短语“治疗或降低cftr介导的疾病的严重性”是指对由cftr活性直接引起的疾病的治疗和对不是由cftr阴离子通道活性直接引起的疾病的症状的缓解这二者。症状可能受到cftr活性影响的疾病的实例包括但不限于囊性纤维化、遗传性肺气肿、遗传性血色素沉着症、凝血
‑
纤维蛋白溶解缺陷(例如蛋白c缺陷)、1型遗传性血管性水肿、脂质加工缺陷(例如家族性高胆固醇血症)、1型乳糜微粒血症、无β脂蛋白血症、溶酶体贮积病(例如i细胞病/假hurler)、粘多糖贮积症、sandhof/tay
‑
sachs、crigler
‑
najjar ii型、多内分泌病/高胰岛素血症、糖尿病、laron侏儒症、髓过氧化物酶缺乏症、原发性甲状旁腺功能减退症、黑色素瘤、glycanosis cdg 1型、遗传性肺气肿、先天性甲状腺功能亢进症、成骨不全症、遗传性低纤维蛋白原血症、act缺乏症、尿崩症(di)、neurophyseal di、肾源性di、charcot
‑
marie tooth综合征、perlizaeus
‑
merzbacher病、神经退行性疾病(例如阿尔茨海默病、帕金森病、肌萎缩性脊髓侧索硬化症、进行性核上性麻痹、pick病)、几种多聚谷氨酰胺神经系统紊乱(例如亨廷顿病、脊髓小脑共济失调i型、脊髓延髓肌肉萎缩症、齿状核红核苍白球路易体萎缩症(dentatorubal pallidoluysian)和肌强直性营养不良)以及海绵状脑病(例如遗传性creutzfeldt
‑
jakob病、fabry病、straussler
‑
scheinker综合征、copd、干眼病和sjogren病)。
[0282]
cf疾病特异性疗法
[0283]
以下疾病特异性疗法包括供口服使用的(伊伐卡托)片剂。美国最初批准:2012年针对仍会在上皮细胞表面产生cftr蛋白的更温和(和更罕见)突变;供口服使用的(鲁玛卡托/伊伐卡托)片剂。美国批准:2015年用于治疗具有两个拷贝的f508del突变(f508del/f508del)的cf患者,针对最常见的严重突变;供口服使用的symdeko
tm
(tezacaftor/伊伐卡托)片剂。美国最初批准:2018年针对单个f508del杂合子和kalydeco未涵盖的其它一些突变的治疗。
[0284]
对症治疗
[0285]
对症治疗包括:雾化高渗盐水、阿法链道酶和甘露醇干粉,以降低气道粘液的粘度;抗生素(通常雾化),以治疗地方性铜绿假单胞菌感染;支气管扩张剂,以改善气道通畅;类固醇、日常胸部按摩、振动和冲击以使分泌物松动。
[0286]
因此,特别是对于最常见的严重突变,存在显著未满足的医疗需求。
[0287]
cftr基因的静脉内递送
[0288]
考虑到非气道研究,已经在小鼠中研究了静脉内载体递送,但主要引起肺泡基因转移,并且仅引起低水平的基因递送至支气管树的上皮。
[0289]
通过支气管动脉递送cftr基因
[0290]
如本文所述,经由支气管动脉将靶向全身动脉途径的aav载体递送至产生粘液的支气管气道将克服基因治疗载体的当前限制。
[0291]
本文描述了一种用于治疗囊性纤维化(cf)的方法,所述方法包括通过支气管动脉导管插入递送向受试者给予病毒载体,其中,所述病毒载体是在衣壳中含有治疗性转基因的腺相关病毒(aav)载体。
[0292]
尽管描述了多种异常起源,支气管动脉向肺供应动脉血并且最常见地来自降主动脉。支气管动脉与支气管血管鞘内的气道平行,其中小分支向结构气道、粘膜、气道平滑肌
和外膜供应毛细血管网络。最大直径的支气管动脉可见于气道外膜。从这些分支产生的粘膜下毛细血管几乎察觉不到。在静脉侧支气管毛细血管与肺静脉毛细血管和小静脉、奇静脉和在近端气道(proximal airway)中与有限的支气管静脉复合体形成复杂的吻合模式。大多数(但不是全部)静脉血流向肺静脉并返回左心房。
[0293]
在可能的动物模型中,绵羊的肺与人类解剖学和生理学最接近,并且已广泛用于支气管循环生理学的研究,在有经验的人手中可以很好地耐受血管研究。在绵羊中,支气管动脉作为单个大隆突状血管产生,为双肺提供80%的全身血流。该动脉的开口直径从1
‑
6毫米不等,可以接受5french引导导管来进行载体递送。动脉下行进入肺,通过主支气管和小支气管的分支供血,直至远端细支气管,提供丰富的细血管(直径5
‑
20μm)的支气管周围毛细血管丛,其位于粘液分泌腺周围的粘膜下层中的呼吸上皮的正下方。在微观水平上,支气管动脉分支在组织学上不同于其肺动脉对应物(counterpart),因为它们没有明确定义的外弹性膜。由这些小动脉产生的毛细血管的内皮是有孔型的,增强流体进入支气管粘膜的通道以及中性粒细胞通过内皮细胞连接经由主动转运穿过毛细血管的通道。这些解剖学因素凸显了通过支气管动脉递送的aav载体应该有极好的机会到达所有支气管的粘膜下层并由此到达所有靶细胞的理由。
[0294]
人类中的支气管动脉方法
[0295]
如本文所使用的术语“支气管动脉”是指为肺的结构元件供应营养成分和含氧血液的动脉。人类的支气管动脉供应某些程度上可变。通常有两根支气管动脉通向左肺,一根通向右肺。左支气管动脉(上和下)直接来自胸主动脉。单根右支气管动脉通常来自以下之一:1)与右侧第3肋间后动脉共干的胸主动脉;2)左侧上支气管动脉;3)任意数量的右侧肋间动脉,主要是右侧第3后动脉。支气管动脉为肺的结缔组织和支气管供血。它们随支气管移动和分支,通常在呼吸性细支气管水平结束。在向支气管和细支气管供应营养成分和氧气后,支气管毛细血管与肺小静脉的分支吻合,从而返回肺静脉循环。支气管血管系统还供应肺的脏层胸膜。由于支气管动脉供应的大部分血液通过肺静脉返回,而不是到达右侧循环,返回左心的血液比肺毛细血管床水平的血液含氧量略低。
[0296]
支气管动脉导管插入
[0297]
通过经皮方法在人类中进行支气管动脉导管插入已经实施了33年,最初用于支气管恶性肿瘤的直接化学疗法治疗,后来用于严重咯血患者的栓塞。支气管动脉导管插入是血管介入医师的成熟技术。它定期在经历咯血发作的囊性纤维化患者中进行,对于治疗性递送是可行的,特别是因为他们的支气管动脉明显扩张(burke tc.和mauro ma.(2004)bronchial artery embolization.semin intervent radiol.2004mar;21(1):43
‑
8)。
[0298]
在一个实施方式中,本发明提供了一种导管,所述导管在其远端具有药物递送单元以有效地缩短治疗剂必须经由导管移动而到达靶位点的距离。
[0299]
支气管动脉系统
[0300]
如本文所使用的术语“细支气管”是指空气通过鼻子或嘴到达肺的肺泡(air sacs)的通道,在其中分支在其粘膜下层中不再包含软骨或腺体。它们是支气管的分支,并且是呼吸系统传导区的一部分。细支气管进一步分为仍处于传导区中的更小的终末细支气管,然后这些终末细支气管再分为标志着呼吸区开始的更小的呼吸性细支气管。
[0301]
如本文所述,“细支气管”包括终末细支气管和呼吸性细支气管。
[0302]
各肺中的初级支气管(即左右支气管)产生次级支气管。这些支气管转而产生三级支气管。三级支气管细分为细支气管。这些细支气管在组织学上与三级支气管不同,因为它们的壁没有透明软骨并且它们在其上皮内衬中具有棒状细胞。上皮开始时是简单的具纤毛的柱状上皮,随着细支气管尺寸减小而变成简单的具纤毛的立方上皮。通常认为细支气管的直径小于1mm,但该值的范围可以为5mm
‑
0.3mm。如前所述,这些细支气管没有透明软骨来维持它们的通畅。相反,它们依靠附着在周围肺组织上的弹性纤维来进行支撑。这些细支气管的内衬(固有层)较薄而没有腺体,并被平滑肌层包围。随着细支气管变小,它们分为终末细支气管。这些细支气管标志着传导区的末端,传导区覆盖呼吸道的第1部分(division)到第16部分。肺泡仅在传导区变为呼吸区时出现,从呼吸道的第16部分到第23部分。
[0303]
终末细支气管
[0304]
终末细支气管是传导区的最远端部分。它从较少的细支气管分岔出来。各终末细支气管分岔形成含有少量肺泡的呼吸性细支气管。终末细支气管内衬有含有棒状细胞的简单立方上皮。终末细支气管含有数量有限的纤毛细胞而没有杯状细胞。棒状细胞是无纤毛的圆形蛋白质分泌细胞。它们的分泌物是一种非粘性的蛋白质性化合物,可维持最小细支气管中的气道。这种称为表面活性物质的分泌物降低了表面张力,允许细支气管在吸气时扩张并在呼气时防止细支气管塌陷。棒状细胞是呼吸系统的一种干细胞,它产生使溶解在呼吸液中的物质解毒的酶。
[0305]
呼吸性细支气管
[0306]
呼吸性细支气管是肺中最窄的气道,五十分之一英寸宽。支气管在演变成细支气管之前多次分支。细支气管将空气递送到肺的交换表面。它们被作为薄壁外翻的肺泡中断。肺泡管是呼吸性细支气管的远端延续。
[0307]
肺
[0308]
肺是人类和许多其它动物(包括一些鱼类和一些蜗牛)的呼吸系统的主要器官。在哺乳动物和大多数其它脊椎动物中,双肺位于心脏任一侧的脊柱附近。它们在呼吸系统中的功能是从大气中提取氧气并将其转移到血液中以及在气体交换过程中将二氧化碳从血流释放到大气中。呼吸在不同物种中由不同肌肉系统驱动。哺乳动物、爬行动物和鸟类使用它们不同的肌肉来支持和促进呼吸。在早期的四足动物中,空气由咽部肌肉通过口腔泵送而驱动进入肺,这种机制仍然存在于两栖动物中。在人类中,驱动呼吸的主要呼吸肌肉是横膈膜。肺还提供气流,使包括人类言语在内的人声(vocal sound)成为可能。
[0309]
肺位于胸腔中心脏任一侧的胸部中。它们呈圆锥形,在顶部具有狭窄的圆形尖部并具有位于横隔膜凸面上的宽阔的凹型基部。肺尖部延伸到颈根中,到达略高于第一肋骨的胸骨端的水平。肺从靠近胸腔中的脊柱处伸展到胸部的前部,并从气管下部向下伸展到横膈膜。左肺与心脏共享空间,并在其边界具有称为左肺心脏切迹的凹痕以适应这种情况。肺的前部和外侧面向肋骨,肋骨在其表面上形成轻微凹痕。肺的内侧面(medial surface)面向胸部中央,紧靠心脏、大血管和隆突,气管在此处分为两个主要支气管。心脏压迹是在肺表面形成的凹痕,肺在此处靠在心脏上。
[0310]
双肺在肺根部具有称为肺门的中央凹陷,血管和气道在此处进入肺。肺门处也有支气管肺淋巴结。
[0311]
肺被肺胸膜包围。胸膜是两层浆膜:外壁胸膜与胸腔内壁相连,内脏胸膜则直接与
肺表面相连。胸膜之间是称为胸膜腔的潜在空间,胸膜腔含有润滑性胸膜液薄层。各肺被作为裂隙(fissures)的胸膜的内褶分成叶(lobes)。裂隙是胸膜的双皱襞,其对肺进行划分并帮助其扩张。
[0312]
主支气管或初级支气管在肺门处进入肺并最初分支成次级支气管,也称为叶支气管,其向肺的各叶供应空气。叶支气管分支成三级支气管,也称为段支气管,这些段支气管向称为支气管肺段的肺叶的进一步分支供应空气。各支气管肺段都有自己的(段)支气管和动脉供应。左肺和右肺的段(segments)示于表中。段解剖学在临床上可用于定位肺中的疾病过程。段是一种离散单元,可以通过手术切除而不会严重影响周围组织。
[0313]
肺是下呼吸道的一部分,当它们从气管分支时容纳支气管气道。肺包含终止于肺泡的支气管气道、其间的肺组织以及静脉、动脉、神经和淋巴管。气管和支气管在它们的粘膜和粘膜下层中具有毛细淋巴管丛。较小的支气管具有单层,并且它们不存在于肺泡中。
[0314]
包括气管、支气管和细支气管在内的所有下呼吸道都衬有呼吸上皮。这是一种纤毛上皮,散布着产生粘液的杯状细胞和具有类似于巨噬细胞作用的棒状细胞。气管中不完整的软骨环和支气管中较小的软骨板使这些气道保持开放。细支气管太窄而无法支撑软骨,它们的壁由平滑肌构成,而这在主要仅由上皮构成的较窄的呼吸性细支气管中在很大程度上是不存在的。呼吸道结束于小叶。各小叶由呼吸性细支气管组成,其分支成肺泡管和肺泡囊,这转而又分为肺泡。
[0315]
整个呼吸道的上皮细胞分泌上皮内衬液(elf),其组成受到严格调控,并决定了粘液纤毛清除的效果。
[0316]
肺泡由两种类型的肺泡细胞和肺泡巨噬细胞组成。这两种类型的细胞被称为i型和ii型肺泡细胞(也称为肺泡细胞)。i型和ii型构成壁和肺泡隔。i型细胞提供各肺泡表面积的95%并且是扁平的(“鳞状”),而ii型细胞通常聚集在肺泡的角落并呈立方体样形状。
[0317]
i型是构成肺泡壁结构的鳞状上皮细胞。它们具有极薄的壁,可以轻松进行气体交换。这些i型细胞还构成分隔各肺泡的肺泡隔。肺泡隔由上皮内衬和相关联的基底膜组成。i型细胞不能分裂,因此依赖于来自ii型细胞的分化。ii型较大,它们排列在肺泡内并产生和分泌上皮内衬液和肺表面活性物质。ii型细胞能够分裂并分化为i型细胞。
[0318]
肺泡巨噬细胞具有重要的免疫学作用。它们去除沉积在肺泡中的物质,包括从血管中挤出的松散的血红细胞。肺被脏胸膜的浆膜包围,该浆膜具有附接至肺实质的疏松结缔组织的底层。
[0319]
下呼吸道是呼吸系统的一部分,并由气管和气管下方的结构组成,包括肺。气管从咽部接收空气并向下行进到一个地方,在那里它分成(隆突)右支气管和左支气管。它们向左右肺供应空气,逐渐分成肺叶的二级支气管和三级支气管,并分成越来越小的细支气管,直到它们成为呼吸性细支气管。它们转而通过肺泡管将空气供应到发生气体交换的肺泡中。吸入的氧气通过肺泡壁扩散到包围毛细血管(enveloping capillaries)中并进入循环系统,而二氧化碳从血液扩散到肺并被呼出。
[0320]
传导区中的支气管利用透明软骨进行强化以保持气道开放。细支气管没有软骨,而是被平滑肌包围。空气被传导区加热到37℃(99℉)、加湿和净化;来自空气的颗粒被捕获在粘液层上,然后被内衬在通道中的呼吸道上皮上的纤毛去除。
[0321]
在用力吸气期间,气道平滑肌中的肺牵张感受器启动一种称为hering
‑
breuer反
射的反射,这防止肺过度充气。
[0322]
支气管循环和肺循环
[0323]
肺具有由支气管循环和肺循环提供的双重血液供应。支气管循环通过源自主动脉的支气管动脉将含氧血液供应到肺部的结构元件和气道。通常有3根动脉,两根到左肺,一根到右肺,它们沿着支气管和细支气管分支。肺循环将脱氧血液从心脏输送到肺,并将含氧血液返回心脏以供应身体的其余部分。肺的血容量平均为约450毫升,约占整个循环系统总血容量的9%。这个量可以容易地在正常容量的一半到两倍之间波动。
[0324]
支气管动脉
[0325]
肺由双血管系统提供服务:(1)低压肺系统(15
‑
30mmhg)包含来自右心室的肺动脉,其将脱氧血液(100%的心输出量)输送至肺泡进行气体交换,然后将含氧血液返回左心房以由左心室进行全身递送;(2)支气管动脉系统是来自胸主动脉上的动脉分支的高压左(全身)循环(110
‑
140mmhg)的一部分。支气管动脉仅占正常人心输出量的约0.5%,是气道结构的唯一营养成分供应,包括从气管到呼吸性细支气管(气道的1
‑
23个分支)的支气管和细支气管上皮。
[0326]
支气管动脉通常在t3至t8水平从胸主动脉产生并且还供应支气管、迷走神经、后纵隔和食道。80%的动脉来自t5至t6水平。描述了许多支气管动脉解剖变异。较为常见的组合包含单条右肋间支气管(icb)干(trunk)与单条左支气管动脉、单条右icb干、从共同的干产生的单条左支气管动脉、以及单条右icb干与两条左支气管动脉。左icb干尚未鉴定,而右支气管动脉经常与肋间动脉共享起源。多达20%的支气管动脉具有主动脉以外的异常起源。异常起源包括锁骨下动脉、甲状腺颈动脉、内乳动脉、无名动脉、心包膈动脉、肋间上动脉、腹主动脉和膈下动脉。支气管肺动脉吻合在慢性炎症或肺动脉高压患者中非常突出。肺实质可以通过肋间动脉、乳腺动脉、膈动脉、甲状腺
‑
颈动脉、腋动脉和锁骨下动脉接受来自附属于支气管循环的经胸腔系统性动脉血液供应。
[0327]
如本文所述,支气管系统的毛细血管床以约5
‑
15μm的距离位于气道假柱状上皮的基底膜正下方,代表该细胞层的可扩散营养成分的主要来源。
[0328]
支气管动脉系统的一个重要特征是没有相应的支气管静脉用于将血液返回到心脏。取而代之的是,支气管毛细血管通过一组复杂的分流血管与全身肺静脉系统的小静脉融合回到左心房——有些还分支到奇静脉中。这提供了在治疗性递送过程中通过在输注过程中使麻醉剂贮气囊过度充气来压缩肺(肺泡)毛细血管,从而阻碍支气管动脉毛细血管床中的流动(并增加载体扩散)的机会。
[0329]
由于气道上皮是假柱状的,所有细胞,无论是基底上皮细胞、推定的祖细胞、克拉拉细胞(产生粘液)、纤毛上皮细胞还是稀有细胞类型(例如离子细胞(推定的cl
‑
离子表达细胞)),都直接附着在基底膜上,以均等的机会到达下面的支气管毛细血管。
[0330]
对各种上皮细胞的更新率知之甚少,特别是在疾病状态(如cf)中。此外,尚不清楚哪种细胞类型提供分泌到上皮表面的大部分cl
‑
离子。最近的工作表明,至少在上呼吸道,新发现的离子细胞可能是主要来源。
[0331]
cf动物模型
[0332]
cf模型已经在多种物种(例如小鼠、大鼠、雪貂、绵羊和猪)中产生。
[0333]
cf猪模型
[0334]
最近,已经开发了新cf动物模型。rogers及其同事生成了cftr
‑
null和cftr
‑
δf508杂合子猪以及随后的cftr
‑
δf508纯合动物。猪作为cf模型的优势包括与人类更相似的肺解剖学、生理学、组织学和生物化学。
[0335]
此外,猪在遗传学方面与人类更同源,具有更大的体型和更长的寿命。cf猪表现出具有cf的人中存在的几种表型。猪中cftr功能的丧失导致外分泌胰腺破坏、胰腺功能不全、局灶性胆汁性肝硬化和微胆囊。胎粪性肠梗阻在cf猪中的外显率为100%。在约15%的具有cf的新生人类中观察到这种形式的肠梗阻。cf猪肺在出生时没有表现出炎症,但有趣的是,与野生型同窝仔猪相比,它们的肺组织无菌的频率较低。
[0336]
当用金黄色葡萄球菌(staphylococcus aureus)进行气管内攻击时,与野生型相比,cf猪表现出细菌根除减少。动物在出生后的第一个月内自发地发展为肺疾病,其特征为细菌感染、炎症、气道损伤和重塑。肺疾病的表现是异质性的,严重程度从轻度到重度不等。
[0337]
雪貂模型
[0338]
另一种新cf动物模型为雪貂。cftr
‑
/
‑
雪貂发展为胎粪性肠梗阻(外显率75%)、胰腺疾病、肝疾病,并且它们的肺通常会在出生后的前4周内自发地定植有包括链球菌和葡萄球菌在内的细菌。在用细菌攻击的新生cf雪貂中也观察到肺疾病的渐进性发展以及细菌清除的缺陷。
[0339]
绵羊模型
[0340]
在可能的动物模型中,绵羊的肺与人类解剖学和生理学最接近,并且已广泛用于支气管循环生理学的研究,在有经验的人手中可以很好地耐受血管研究。已经使用crispr/cas9基因组编辑和体细胞核转移(scnt)技术生成了cf绵羊模型。cftr敲除绵羊发展出与人类cf病理一致的严重疾病。特别相关的是胰腺纤维化、肠梗阻和输精管缺失。此外,严重的肝和胆囊疾病可能反映了人类中明显的cf肝病。
[0341]
在绵羊中,支气管动脉作为单个大隆突状血管产生,为双肺提供80%的全身血流。该动脉的开口直径从1
‑
6毫米不等,可以接受5french引导导管来进行载体递送。动脉下行进入肺,通过主支气管和小支气管的分支供血,直至远端细支气管,提供丰富的细血管的支气管周围毛细血管丛,其位于粘液分泌腺周围的粘膜下层中的呼吸上皮的正下方。在微观水平上,支气管动脉分支在组织学上不同于其肺动脉对应物,因为它们没有明确定义的外弹性膜。它们的毛细血管的内皮是有孔型的,研究人员已经证明了流体进入支气管粘膜的通道以及中性粒细胞通过内皮细胞连接经由主动转运穿过毛细血管的通道。由于绵羊和人类这两个物种在肺解剖和发育方面的相似性,绵羊可能因此是模拟人中cf的特别相关的动物。
[0342]
在一些实施方式中,病毒载体群通过1
‑
5分钟的缓慢输注来给予。
[0343]
在特定实施方式中,重复导管插入将例如需要间隔至少一周,并且在一年内、两年内、三年内、四年内、五年内、十年内进行最多十次手术。例如至少一次、至少两次、至少三次、至少四次、至少五次、至少六次、至少七次、至少八次、至少九次、至少十次等或更多次给予可以用于在各种时间间隔内(例如每小时、每天、每周、每月、每年等)实现期望的基因表达水平。给药可以是单次给药或累积性给药(连续给药),并且可以很容易地由本领域技术人员决定。例如,疾病或紊乱的治疗可包括一次性给予有效剂量的本文公开的药物组合物病毒载体。或者,疾病或紊乱的治疗可包括在一定时间段范围内多次给予有效剂量的病毒
载体,例如每天一次、每天两次、每天三次、每几天一次或每周一次。
[0344]
给药时间点可以因人而异,这取决于诸如个体症状的严重程度等因素。例如,本文公开的有效剂量的病毒载体可以每六个月一次给予个体,持续不确定的时间段,或直到个体不再需要治疗。本领域普通技术人员将认识到,可以在整个治疗过程中监测个体的状况,并且可以相应地调整所给予的本文公开的病毒载体的有效量。
[0345]
在一些实施方式中,本文公开的raav载体和/或raav基因组可以以足以悬浮本文公开的raav载体的量配制在溶剂、乳液或其它稀释剂中。在该实施方式的其它方面,本文公开的raav载体和/或raav基因组可以以如下的量配制在溶剂、乳液或稀释剂中:例如低于约90%(v/v)、低于约80%(v/v)、低于约70%(v/v)、低于约65%(v/v)、低于约60%(v/v)、低于约55%(v/v)、低于约50%(v/v)、低于约45%(v/v)、低于约40%(v/v)、低于约35%(v/v)、低于约30%(v/v)、低于约25%(v/v)、低于约20%(v/v)、低于约15%(v/v)、低于约10%(v/v)、低于约5%(v/v)或低于约1%(v/v)。在其它方面,本文公开的raav载体和/或raav基因组可以以如下范围的量包含溶剂、乳液或其它稀释剂:例如约1%(v/v)至90%(v/v)、约1%(v/v)至70%(v/v)、约1%(v/v)至60%(v/v)、约1%(v/v)至50%(v/v)、约1%(v/v)至40%(v/v)、约1%(v/v)至30%(v/v)、约1%(v/v)至20%(v/v)、约1%(v/v)至10%(v/v)、约2%(v/v)至50%(v/v)、约2%(v/v)至40%(v/v)、约2%(v/v)至30%(v/v)、约2%(v/v)至20%(v/v)、约2%(v/v)至10%(v/v)、约4%(v/v)至50%(v/v)、约4%(v/v)至40%(v/v)、约4%(v/v)至30%(v/v)、约4%(v/v)至20%(v/v)、约4%(v/v)至10%(v/v)、约6%(v/v)至50%(v/v)、约6%(v/v)至40%(v/v)、约6%(v/v)至30%(v/v)、约6%(v/v)至20%(v/v)、约6%(v/v)至10%(v/v)、约8%(v/v)至50%(v/v)、约8%(v/v)至40%(v/v)、约8%(v/v)至30%(v/v)、约8%(v/v)至20%(v/v)、约8%(v/v)至15%(v/v)或约8%(v/v)至12%(v/v)。
[0346]
在一些实施方式中,本文公开的任何血清型的raav载体和/或raav基因组包括但不限于被任何aav2、aav9衣壳封装,其包含治疗有效量的治疗性化合物。在一个实施方式中,如本文所使用的,无限制地,术语“有效量”与“治疗有效量”、“有效剂量”或“治疗有效剂量”同义。在一个实施方式中,本文公开的治疗性化合物治疗囊性纤维化的有效性可以通过基于与cf相关的一种或多种临床症状和/或生理指标观察个体中的改善来确定,但并不限于此。
[0347]
为了促进本文公开的raav载体和/或raav基因组的递送,可将其与载体或赋形剂混合。可以使用的载体和赋形剂包括盐水(尤其是无菌、无热原的盐水)、盐水缓冲液(例如柠檬酸盐缓冲液、磷酸盐缓冲液、醋酸盐缓冲液和碳酸氢盐缓冲液)、氨基酸、尿素、醇、抗坏血酸、磷脂、蛋白(例如血清白蛋白)、edta、氯化钠、脂质体、甘露醇、山梨糖醇和甘油。usp级载体和赋形剂对于向人类受试者递送病毒粒子特别有用。
[0348]
本发明的药物组合物包含溶解在或分散在药学上可接受的载体中的有效量的一种或多种修饰的病毒载体(例如raav载体)或另外的试剂。短语“药学上或药理学上可接受的”是指当根据需要给予动物(诸如例如人)时不会产生不良反应或生物学效应、过敏反应或生物学效应或者其它不期望的反应或生物学效应的分子实体和组合物。
[0349]
根据本公开内容,包含至少一种修饰的raav载体或另外的活性成分的药物组合物的制备将是本领域技术人员已知的,例如由remington's pharmaceutical sciences,第18
版,mack printing company,1990所例示的(以引用的方式将其并入本文)。此外,对于动物(例如人)的给予,将理解的是,制剂应符合美国fda生物标准办公室或其它国家的等效政府法规(如适用)所要求的无菌性、产热原性、一般安全性和纯度标准。
[0350]
如本文所使用的“药学上可接受的载体”包括如本领域普通技术人员所知的任何和所有溶剂、分散介质、包衣、表面活性剂、抗氧化剂、防腐剂(例如抗细菌剂、抗真菌剂)、等渗剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、凝胶、粘结剂、赋形剂、崩解剂、润滑剂、甜味剂、调味剂、染料和类似材料及它们的组合(例如参见remington's pharmaceutical science,第18版,mack printing company,1990,第1289
‑
1329页,以引用的方式将其并入本文)。除非任何常规载体与活性成分不相容,否则均考虑将其用于治疗性组合物或药物组合物中。
[0351]
可以将修饰的载体和/或试剂以游离碱、中性或盐形式配制到药物组合物中。药学上可接受的盐包括酸加成盐,例如与蛋白质组合物的游离氨基形成的酸加成盐,或与无机酸(诸如例如盐酸或磷酸)或有机酸(诸如乙酸、草酸、酒石酸或扁桃酸)形成的酸加成盐。与游离羧基形成的盐也可以由无机碱(例如钠、钾、铵、钙或铁的氢氧化物);或有机碱(诸如异丙胺、三甲胺、组氨酸或普鲁卡因)衍生而来。
[0352]
负责给予的从业者将使用常规程序确定药物组合物中活性成分的浓度和针对个体受试者的合适剂量。在某些实施方式中,药物组合物可包含例如至少约0.1%的活性化合物(例如修饰的病毒载体(例如raav载体)、治疗剂)。在其它实施方式中,活性化合物例如可占单位(unit)重量的约2%至约75%或约25%至约60%,以及可在其中衍生的任何范围。
[0353]
在本发明方法的一方面,例如通过移植或植入组织,将异源核酸体外递送至血管组织或血管系统(vasculature)的细胞中,以用于向受试者给予修饰的细胞。可以根据适当的标准转导方法,以适当的感染复数将病毒颗粒引入细胞。待给予的病毒滴度可以根据靶细胞的类型和数量以及具体的病毒载体而变化,并且可以由本领域技术人员确定而无需过多的实验。在一个实施方式中,将102个感染单位、或至少约103个感染单位、或至少约105个感染单位引入细胞。
[0354]
如本文所使用的“治疗有效”量是足以向受试者提供一些改善或益处的量。或者说,“治疗有效”量是将在受试者中的至少一种临床症状中提供一些缓解、减轻或减少的量。本领域技术人员将理解,只要向受试者提供了一些益处,治疗效果不必是完全的或治愈性的。在某些实施方式中,治疗有效量不是治愈性的。
[0355]
可以通过本领域已知的任何方式向有需要的人受试者或动物给予根据本发明的病毒载体。优选地,以治疗有效剂量在药学上可接受的载体中递送病毒载体。在一个实施方式中,通过涂覆有修饰的载体的支架(stent)或包含修饰的载体的支架来给予载体。在美国专利申请公开20040193137中描述了用于将载体递送至血管系统的递送鞘(delivery sheath),以引用的方式将其并入本文。
[0356]
待给予受试者的病毒载体的剂量取决于给予方式、待治疗的疾病或病症、个体受试者的情况、待递送的具体治疗性核酸,并且可以用常规方式确定。用于实现治疗效果的示例性剂量是递送如下的病毒滴度:至少约105、106、107、108、109、10
10
、10
11
、10
12
、10
13
、10
14
、10
15
个转导单位或更多,以及其中可衍生的任何整数以及其中可衍生的任何范围。在一个实施方式中,给予剂量为约108‑
10
13
个转导单位。在一个实施方式中,给予剂量为约103‑
108个
转导单位。
[0357]
以载体基因组/每千克体重(vg/kg)的剂量单位计,为达到特定治疗效果所需的修饰的病毒粒子的剂量将基于若干因素而变化,包括但不限于:修饰的病毒粒子的给予途径、达到治疗效果所需的核酸(编码非翻译rna或蛋白质)表达水平、所治疗的具体疾病或紊乱、对病毒粒子的宿主免疫应答、对表达产物的宿主免疫应答以及异源核酸产物的稳定性。基于上述因素以及本领域公知的其它因素,本领域技术人员可以容易地确定用于治疗患有特定疾病或紊乱的患者的重组病毒粒子的剂量范围。
[0358]
在具体实施方式中,可以每周、每月、每年等实施多于一次给予(例如两次、三次、四次或更多次给予)。
[0359]
可以以常规形式制备注射剂,所述常规形式可以是液体溶液剂或混悬剂,适于在注射之前在液体中呈溶液剂或混悬剂的固体形式,或者乳剂。载体可以局部递送或系统性递送。在一个实施方式中,在储库(depot)或缓释制剂中给予载体。此外,病毒载体可以粘附在可手术植入的基质上进行递送(例如如美国专利公开no.us
‑
2004
‑
0013645
‑
a1中所述)。
[0360]
本文公开的修饰的细小病毒载体(例如aav载体或其它细小病毒)可以通过支气管动脉导管插入给予。参见例如美国专利no.5,585,362。
[0361]
在一个实施方式中,支气管动脉递送伴随有肺楔压导管插入以确定左心房压力。
[0362]
在一个实施方式中,病毒载体群通过1
‑
5分钟的缓慢输注来给予。
[0363]
在一个实施方式中,在输注期间以周期间隔或脉冲间隔向气道流出物(airway outflow)施加压力。
[0364]
在一个实施方式中,每2次至5次呼吸供应长达15秒的压力。
[0365]
在一个实施方式中,压力为2
‑
15mmhg。
[0366]
在一个实施方式中,携带载体的毛细血管与靶位点的接近度为5
‑
10微米。
[0367]
在一个实施方式中,通过与由微孔膜形成的可充气球囊流体连通的导管给予本发明的修饰的载体,并经由该导管递送含有包含感兴趣的基因的载体的溶液,参见例如美国专利申请公开2003/0100889,以引用的方式将其整体并入本文。
[0368]
在某些实施方式中,为了提高本发明的修饰的重组载体的效力,将本发明的方法与在血管疾病或紊乱的治疗中有效的另一种试剂或其它方法进行组合可能是期望的。例如,在一些实施方式中,在考虑之列的是可以将常规疗法或试剂(包括但不限于药理学治疗剂、外科手术或它们的组合)与载体给予进行组合。在非限制性实例中,治疗益处包括降低血管组织中的高血压,或减少在血管或心血管干预之后的再狭窄(例如在医疗或外科手术过程中发生)。
[0369]
该过程可涉及在同一时间(例如实质上同时)或在一段时间内给予试剂和载体,其中,分别向细胞、组织或受试者给予载体和试剂产生期望的治疗益处。可以利用包含修饰的载体和一种或多种试剂这二者的单一药理学制剂来进行给予;或者通过向受试者给予两种以上不同的制剂来进行给予,其中一种制剂包含载体,而另一种包含一种或多种试剂。在某些实施方式中,所述试剂是降低免疫应答的试剂,例如tlr
‑
9抑制剂、cgas抑制剂或雷帕霉素。
[0370]
修饰的载体的给予可以以数分钟至数周的间隔在其它试剂之前给予、与其它试剂共同给予和/或以数分钟至数周的间隔在其它试剂之后给予。在将载体和其它试剂分别应
用于细胞、组织或受试者的实施方式中,通常将确保在各递送的时间之间没有显著的时间间隔,使得载体和试剂仍将能够对细胞、组织或受试者发挥有利的联合作用。
[0371]
药理学治疗剂的给予以及给予方法、剂量等是本领域技术人员公知的(参见例如“physicians desk reference”、goodman&gilman的“the pharmacological basis of therapeutics”、“remington's pharmaceutical sciences”和“the merck index,第十一版”,以引用的方式将相关部分并入本文),并且可以根据本文的公开内容与本发明组合。取决于进行治疗的受试者的状况,剂量的某些变化必然会发生。负责给予的人在任何情况下都将确定用于个体受试者的合适剂量,而此类个体确定(individual determinations)在本领域普通技术人员的能力范围内。
[0372]
给予
[0373]
待给予受试者的病毒载体(例如本文公开的rhiv、raav载体或raav基因组)的剂量取决于给予方式、待治疗和/或预防的疾病或病症、个体受试者的状况、具体的病毒载体或衣壳和待递送的核酸等,并且可以通过常规方式来确定。用于实现治疗效果的示例性剂量是如下滴度:至少约105、106、107、108、109、10
10
、10
11
、10
12
、10
13
、10
14
、10
15
转导单位,任选地为约108至约10
13
转导单位。
[0374]
在另外的实施方式中,向受试者给予病毒载体(例如本文公开的raav或rhiv载体或raav基因组)导致所述载体的循环半衰期为2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、1天、2天、3天、4天、5天、6天、7天、1周、2周、3周、4周、1个月、2个月、3个月、4个月或更长时间。
[0375]
在一个实施方式中,向受试者给予病毒载体(例如本文公开的raav载体或raav基因组)的时间为1分钟至数小时的输注。
[0376]
在另外的实施方式中,基因表达停止一段时间。例如1天、2天、3天、4天、5天、6天、7天、8天、9天、10天、11天、12天、13天、14天、3周、4周、5周、6周、7周、8周、9周、10周、11周、12周、4个月、5个月、6个月、7个月、8个月、9个月、10个月、11个月、12个月或更长时间。
[0377]
在另一个实施方式中,给予用于治疗cf的病毒载体(例如本文公开的raav载体或raav基因组)引起体重增加例如至少0.5磅、至少1磅、至少1.5磅、至少2磅、至少2.5磅、至少3磅、至少3.5磅、至少4磅、至少4.5磅、至少5磅、至少5.5磅、至少6磅、至少6.5磅、至少7磅、至少7.5磅、至少8磅、至少8.5磅、至少9磅、至少9.5磅、至少10磅、至少10.5磅、至少11磅、至少11.5磅、至少12磅、至少12.5磅、至少13磅、至少13.5磅、至少14磅、至少14.5磅、至少15磅、至少20磅、至少25磅、至少30磅、至少50磅。在另一个实施方式中,本文公开的用于治疗cf的任何血清型的aav cftr引起体重增加例如0.5磅至50磅、0.5磅至30磅、0.5磅至25磅、0.5磅至20磅、0.5磅至15磅、0.5磅至10磅、0.5磅至7.5磅、0.5磅至5磅、1磅至15磅、1磅至10磅、1磅至7.5磅、1磅至5磅、2磅至10磅、2磅至7.5磅。
[0378]
优化的raav载体基因组
[0379]
在一个实施方式中,优化的病毒载体(例如raav载体基因组)是由本文公开的任何元件并且以任何组合产生的,包括itr、启动子、分泌肽、受体配体、截短的转基因、微小rna、poly
‑
a尾、能够增加或减少异源基因表达的元件;在一个实施方式中,治疗性基因和降低免疫原性的元件。这种优化的病毒载体(例如raav载体基因组)可以与对组织和细胞具有趋向
性的任何aav衣壳一起使用,将在所述组织和细胞中转导和表达所述病毒载体(例如raav载体基因组)。
[0380]
仅出于说明性目的提供以下非限制性实施例,以促进对现在所考虑的代表性实施方式的更完善理解。这些实施例仅意在作为可以利用病毒载体(例如aav载体或病毒粒子和raav载体)的所有可能情况的子集。因此,这些实施例不应被解释为限制本技术文件中描述的任何实施方式,包括与aav病毒粒子和raav载体和/或其方法和用途有关的实施方式。最后,aav病毒粒子和载体几乎可以在需要基因递送的任何情况下使用。
[0381]
应当理解的是,上述描述和以下实施例仅是说明性的,不应被视为对本发明范围的限制。在不脱离本发明的精神和范围的情况下,可以对所公开的实施方式进行对本领域技术人员而言显而易见的各种改变和修改。此外,出于描述和公开的目的,将标明的所有专利、专利申请和出版物以引用的方式明确并入本文,例如,在此类出版物中描述的可与本发明联合使用的方法学。这些出版物仅由于它们的公开早于本技术的申请日而提供。在这一方面,任何内容都不应解释为承认本发明人由于在先的发明或任何其它原因而无权将此公开内容提前。关于这些文件的日期的所有声明或关于这些文件的内容的所有描述均基于申请人可获取的信息,而并不构成对这些文件的日期或内容的正确性的任何承认。
[0382]
出于描述和公开的目的,将标明的所有专利和其它出版物以引用的方式明确并入本文,例如,在此类出版物中描述的可与本发明联合使用的方法学。这些出版物仅由于它们的公开早于本技术的申请日而提供。在这一方面,任何内容都不应解释为承认本发明人由于在先的发明或任何其它原因而无权将此公开内容提前。关于这些文件的日期的所有声明或关于这些文件的内容的所有描述均基于申请人可获取的信息,而并不构成对这些文件的日期或内容的正确性的任何承认。
[0383]
本文所述技术的一些实施方式可以根据任何以下编号段落来定义:
[0384]
1.一种用于治疗囊性纤维化(cf)的方法,所述方法包括:
[0385]
向受试者中的多个靶位点给予载体群,其中,所述载体含有治疗性核酸,并且其中,所述载体通过支气管动脉导管插入递送来给予,
[0386]
所述支气管动脉导管插入递送包括:将导管放入第一支气管动脉并将第一剂量的载体给予所述导管中,以靶向所述支气管动脉对着的细支气管族中的基底层靶位点;以及将相同或不同的导管放入至少第二支气管动脉,以靶向包含第二基底层细胞群的第二细支气管族。
[0387]
2.如段落1所述的方法,所述方法进一步包括根据需要将相同或不同的导管放入第三支气管动脉,以靶向包含第三基底层细胞群的第三细支气管族。
[0388]
3.如段落2所述的方法,所述方法进一步包括根据需要将相同或不同的导管放入第四支气管动脉,以靶向包含第四基底层细胞群的第四细支气管族。
[0389]
4.如段落2所述的方法,所述方法进一步包括根据需要将相同或不同的导管放入第五支气管动脉,以靶向包含第五基底层细胞群的第五细支气管族。
[0390]
5.如段落1所述的方法,其中,所述第一剂量与第一支气管动脉容积(支气管血管血流量,包括血管分支)成比例,并且第二剂量与第二支气管动脉容积成比例。
[0391]
6.如段落1
‑
5所述的方法,其中,将第一剂量的载体给予所述导管中,以靶向第一组细支气管中的基底细胞/祖细胞、棒状细胞或纤毛细胞的第一基底层靶位点。
[0392]
7.如段落1所述的方法,其中,所述治疗性核酸为治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因。
[0393]
8.如段落1所述的方法,其中,所述治疗性核酸为截短的治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因。
[0394]
9.如段落8所述的方法,其中,所述截短的治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因为cftr的n
‑
尾加工突变体。
[0395]
10.如段落8所述的方法,其中,所述截短的治疗性囊性纤维化跨膜传导调节蛋白(cftr)基因可以特异性挽救δf508
‑
cftr的加工。
[0396]
11.如段落1所述的方法,其中,所述载体为dna或rna核酸载体。
[0397]
12.如段落1所述的方法,其中,所述载体为病毒载体。
[0398]
13.如段落9所述的方法,其中,所述病毒载体选自于如下病毒载体中的任何病毒载体:腺相关病毒(aav)、腺病毒、慢病毒载体或单纯疱疹病毒(hsv)。
[0399]
14.如段落9所述的方法,其中,所述病毒载体为重组aav(raav)。
[0400]
15.如段落1所述的方法,其中,所述治疗性核酸为基因编辑分子。
[0401]
16.如段落15所述的方法,其中,所述基因编辑分子选自于核酸酶、引导rna(grna)、引导dna(gdna)和激活子rna。
[0402]
17.如段落15所述的基因编辑分子,其中,至少一种基因编辑分子为grna或gdna。
[0403]
18.如段落17所述的方法,其中,所述引导rna靶向致病cftr突变。
[0404]
19.如段落18所述的方法,其中,所述引导rna选自于表4。
[0405]
20.如段落15所述的基因编辑分子,其中,所述序列特异性核酸酶选自于核酸引导的核酸酶、锌指核酸酶(zfn)、大范围核酸酶、转录激活因子样效应核酸酶(talen)或megatal。
[0406]
21.如段落15所述的基因编辑分子,其中,所述序列特异性核酸酶是选自于单碱基编辑器、rna引导的核酸酶和dna引导的核酸酶中的核酸引导的核酸酶。
[0407]
22.如段落15所述的基因编辑分子,其中,至少一种基因编辑分子为激活子rna。
[0408]
23.如段落15所述的基因编辑分子,其中,所述核酸引导的核酸酶为crispr核酸酶。
[0409]
24.如段落15所述的基因编辑分子,其中,所述crispr核酸酶为cas核酸酶。
[0410]
25.如段落1
‑
24所述的方法,其中,所述支气管动脉递送伴随有肺楔压导管插入和测量。
[0411]
26.如段落25所述的方法,其中,所述病毒载体群通过1
‑
30分钟的缓慢输注来给予。
[0412]
27.如段落25所述的方法,其中,在输注期间以周期间隔或脉冲间隔每2次至5次呼吸将压力施加至呼吸储袋,持续长达15秒。
[0413]
28.如段落27所述的方法,其中,每2次至5次呼吸供应长达15秒的压力。
[0414]
29.如段落27所述的方法,其中,所述压力为2
‑
15mmhg。
[0415]
30.如段落1
‑
29所述的方法,其中,与所述靶位点的接近度为5
‑
10微米。
[0416]
31.如段落1
‑
30所述的方法,其中,所述载体为含有核酸序列的aav衣壳,所述核酸序列含有至少一对aav itr,所述aav itr位于可操作地连接至启动子的编码cftk的区段的
侧翼;并且其中,至少一种衣壳蛋白选自于由如下衣壳蛋白所组成的组:来自相同或不同的aav血清型的vp1、vp2和vp3。
[0417]
32.如段落1
‑
30所述的方法,所述方法进一步包括给予透化剂。
[0418]
33.如段落31所述的方法,其中,衣壳蛋白中的至少一种为aav血清型9。
[0419]
34.如段落31所述的方法,其中,所有衣壳蛋白均为aav血清型9。
[0420]
35.如段落31所述的方法,其中,其它衣壳蛋白之一来自不同血清型。
[0421]
36.如段落31
‑
34所述的方法,其中,所述aav itr来自与至少一种衣壳蛋白不同的血清型。
[0422]
37.如段落31
‑
34所述的方法,其中,所述aav itr来自与衣壳蛋白相同的血清型中的至少一种。
[0423]
实施例
[0424]
实施例1:通过支气管动脉导管插入递送将含有cftr基因的重组aav9(raav9)载体给予cftr敲除猪。
[0425]
cf肺是基因疗法的主要靶标,因为它是cf中受影响最严重的器官。如本文所述,将使用缺乏任何cftr功能的cf猪模型。cftr敲除猪模型发展为类似于人类cf患者所经历的自发性肺感染。
[0426]
支气管动脉通常在t3至t8水平从胸主动脉产生并且还供应支气管、迷走神经、后纵隔和食道。80%的动脉来自t5至t6水平。描述了许多支气管动脉解剖变异。较为常见的组合包含单条右肋间支气管(icb)干与单条左支气管动脉、或单条右icb干、以及从共同的干产生的单条左支气管动脉、以及单条右icb干与两条左支气管动脉。两条支气管动脉可见于右侧或左侧。左icb干尚未鉴定,而右支气管动脉经常与肋间动脉共享起源。
[0427]
如本文所述,如brinson gm等,am j respir crit care med.(1998)am j respir crit care med.1998jun;157(6pt 1):1951
‑
8以及burke tc.和mauro ma.(2004)semin intervent radiol.2004mar;21(1):43
‑
8中所述,使用支气管动脉导管插入递送将携带野生型cftr基因拷贝的重组aav9病毒(raav9
‑
wtcftr)递送至cftr敲除猪的肺的依赖叶(dependent lobe)的单个段(segment)。此外,使用重组aav9
‑
lacz病毒(raav9
‑
lacz)以使得能够使用灵敏和特异的组织化学染色评估整个肺中的基因表达分布。
[0428]
重组aav9病毒给予和组织化学评估。
[0429]
通过口腔途径用9mm带套囊的(cuffed)气管内导管对动物进行插管。将苯佐卡因(20%)喷入气管内导管。将奥林巴斯bf 1t20柔性纤维光导支气管镜引入气道。对于raav9
‑
wtcftr的支气管动脉导管插入递送,在荧光镜控制下将导管从主动脉插入第一支气管动脉中。通过导管给予第一剂量的携带野生型cftr基因拷贝的重组aav9病毒(raav9
‑
wtcftr),以靶向由所述第一支气管动脉对着的第一组细支气管中的基底层细胞(基底细胞/祖细胞、棒状细胞和纤毛细胞等)。然后将相同或不同的导管引入第二支气管血管,以使用靶向第二组基底外侧细胞(基底细胞/祖细胞、棒状细胞和纤毛细胞)的第二剂量的病毒载体来靶向第二组细支气管。如有必要,将进行第三次和可能的第四次导管插入以完成手术。所递送的总剂量将与各支气管动脉的估计流量(基于从对比增强荧光镜图像所测量的血管直径)成比例地进行分配。
[0430]
移除导管和内窥镜(scope),并使动物再保持仰卧位10分钟。每周借助胸部x射线
来比较通过支气管动脉导管插入递送用raav9
‑
wtcftr和raav9
‑
lacz进行感染的cftr敲除猪的肺叶,持续6周。
[0431]
尸检在第6周进行。对肺进行固定并使用xgal染色进行染色。组织切片显示主要在传导气道细胞中的重组基因表达。对lacz标志物的生物分布以及气道对wtcftr处理与lac
‑
z载体对照的响应进行比较。
[0432]
实施例2:通过支气管动脉导管插入递送将在衣壳中含有cftr基因的重组aav9(raav9)载体给予野生型和cftr敲除绵羊。
[0433]
cf肺是基因疗法的主要靶标,因为它是cf中受影响最严重的器官。如本文所述,将使用缺乏任何cftr功能的cf绵羊模型。cftr敲除绵羊模型发展为类似于人类cf患者所经历的自发性肺感染。
[0434]
绵羊通常具有在t2
‑
t8水平从主动脉产生的单个支气管动脉。主要血管的分支供应支气管、迷走神经、后纵隔和食道。
[0435]
如本文所述,将携带野生型cftr基因拷贝(raav9
‑
wtcftr)或aav9
‑
lacz标志物的重组aav9病毒递送至个体cftr敲除绵羊,或者组合使用如brinson gm等,am j respir crit care med.(1998)am j respir crit care med.1998jun;157(6pt 1):1951
‑
8以及burke tc.和mauro ma.(2004)semin intervent radiol.2004mar;21(1):43
‑
8中所述的支气管动脉导管插入递送。
[0436]
重组aav9病毒给予和组织化学评估。
[0437]
通过口腔途径用9mm带套囊的气管内导管对动物进行插管。将苯佐卡因(20%)喷入气管内导管。将奥林巴斯bf 1t20柔性纤维光导支气管镜引入气道。对于载体的支气管动脉导管插入递送,将导管从主动脉插入单个支气管动脉。通过导管给予全剂量的携带野生型cftr基因拷贝(raav9
‑
wtcftr)和/或lac
‑
z基因的重组aav9病毒,以靶向整个细支气管群中的基底层靶位点(基底细胞/祖细胞、棒状细胞和纤毛细胞等)。
[0438]
移除导管和内窥镜。使动物再保持仰卧位10分钟。每周借助胸部x射线来评估通过支气管动脉导管插入递送用raav9
‑
wtcftr和raav9
‑
lacz进行感染的cftr敲除绵羊的肺叶,持续6周。
[0439]
尸检在第6周进行。对肺进行固定并使用xgal染色进行染色。组织切片显示主要在肺泡细胞传导气道细胞中的重组基因表达。对lacz标志物的生物分布以及气道对wtcftr处理与lac
‑
z载体对照的响应进行比较。
[0440]
实施例3:通过支气管动脉导管插入递送将含有cftr基因的重组aav9(raav9)载体给予cf患者。
[0441]
如本文所述的是使用含有插入的野生型cftr基因的重组aav9载体进行基因疗法的人类临床试验的方案。
[0442]
患者选择。将各种标准用于评估使用本发明的raav9载体进行基因疗法的囊性纤维化患者。接受临床试验的患者一般应满足以下标准:
[0443]
(1)囊性纤维化的确定诊断。证明将由两份文档组成:通过毛果芸香碱离子电渗法而得的汗液钠或氯化物大于60meq/i;或者囊性纤维化基因型以及囊性纤维化的临床表现。
[0444]
(2)性别。可以使用男性或女性。只有在筛选期间和aav治疗后六个月没有生育机会的患者才能进入研究。超过95%的囊性纤维化男性患有先天性输精管萎缩,因此无法生
育。如果女性在妊娠试验中呈阴性并在研究期间使用经认证的生育控制方法,则她们将符合资格。
[0445]
(3)疾病的严重程度。为了符合资格,患者必须处于足以安全地接受所计划的手术(即主动脉导管插入/支气管镜检)的临床状况。可接受的储备(reserve)被定义为具有使得估计的2年生存率大于50%的临床状况。如果患者表现出以下情况,他们将被排除在临床试验之外:
[0446]
(1)并发症的风险。使得他们将因参与研究而面临并发症风险增加的情况。这些情况包括:a)最近12个月内的气胸;b)胰岛素依赖型糖尿病;c)最近两个月内需要糖皮质激素治疗的哮喘或过敏性支气管肺曲霉病;d)痰培养物生长出对至少两种可给予患者的抗生素不具有体外敏感性的病原体;e)大咯血史:去年在24小时时间段内咳出超过250ml血;以及f)根据研究人员的意见,任何会增加患者出现并发症的风险的医学状况或实验室异常。
[0447]
药物治疗。如果患者在研究开始前两个月内接受过全身性糖皮质激素治疗,则将被排除在外。
[0448]
无法遵守方案。如果在研究人员看来,患者具有使遵守方案变得不太可能的特征(例如药物滥用、酗酒、精神不稳定、动力不足),患者将被排除在外。
[0449]
参与其它研究。如果患者在过去90天内参与了另一项研究性治疗研究,则将被排除在外。
[0450]
患者评估。在整个研究过程的不同时间处进行以下评估:
[0451]
病史和体格检查。获取与囊性纤维化和无关疾病二者的表现相关的病史。获得对系统、药物使用和药物过敏史的全面审查。
[0452]
临床实验室评估:a)血液:血红蛋白、血细胞比容、白细胞计数、白细胞分类计数、血小板计数、westergren沉降率、血清电解质(钠、钾、氯化物、碳酸氢盐)、bun、肌酐、葡萄糖、尿酸、总蛋白、白蛋白、钙、磷酸盐、总胆红素、结合胆红素、ast、alt、碱性磷酸酶、ldh;b)尿液分析:定性蛋白质、血液、葡萄糖、酮类、ph和显微镜检查。
[0453]
肺功能测试。测试将满足美国胸科学会(1987a、1987b)设定的标准:a)使用crapo等(1981)的正常预测值进行的肺活量测定;b)绝对肺容积(总肺容量、胸腔气体容积、残余容积);以及c)扩散容量,单次呼吸。呼吸室内空气时的动脉血气和脉搏血氧饱和度。(5)心电图(12导联)。后前位和侧位胸部x射线。胸部薄切计算机断层扫描。用针对敏感性的抗生素对痰液进行需氧细菌培养。
[0454]
shwachman
‑
kulczycki得分计算。男性的精子计数。如果之前未进行过精子计数并记录结果,则泌尿科将进行精液分析。
[0455]
支气管镜检。在手术前6小时内,患者不得经口进食。他们将在支气管镜检前30分钟用0.2mg格隆溴铵和50mg哌替啶进行静脉内术前给药。持续监测心电图、脉搏率和脉搏血氧饱和度。自动无创系统将每5分钟监测血压。用粘稠的2%利多卡因(30ml)漱口并将其咳出。通过手持雾化器将4%利多卡因喷雾到后咽部和喉部。在没有鼻部阻塞或息肉迹象的患者中,支气管镜将通过鼻部引入。如果不能使用鼻部途径,则经口引入支气管镜。用棉签将0.05%局部涂抹在一个鼻道的粘膜上。将2%的利多卡因胶状物滴入同一鼻道。以6升/分钟的速度在口中通过套管来给予补充氧气。每5分钟在15秒内以1mg大剂量(boluses)静脉内给予咪达唑仑,直至患者放松但仍能被语言刺激唤醒。额外的咪达唑仑将以长达每15分钟
的方式以1mg大剂量给予,以保持这种镇静水平。经鼻引入柔性纤维光导支气管镜。根据需要,通过支气管镜注射2%利多卡因以麻醉喉部和气道。
[0456]
支气管肺泡灌洗。通过已轻轻楔入(wedged into)段支气管的支气管镜注射50ml等份的生理盐水。将灌洗液吸入液体分离器(suction trap)。重复该过程,直到已经给予并回收了三份等分试样。
[0457]
支气管动脉导管插入
[0458]
在支气管动脉导管插入前两周开始,患者将开始强化治疗方案以减少呼吸系统感染并最大限度地提高整体状况。在两周内,患者将接受两种抗假单胞菌抗生素,患者的培养生物体对该抗生素敏感。每天两次进行体位引流和叩诊。患者将继续他们的慢性治疗方案的剩余部分。这个阶段将作为住院病人或门诊病人完成。在随后的研究中,患者将继续他们先前规定的医疗计划。这包括继续使用任何口服抗生素、胰酶、茶碱和维生素补充剂。雾化支气管扩张剂和抗生素也将继续使用。
[0459]
使用胸部x射线和薄层ct扫描来选择这样的解剖肺段:a)具有该患者的平均疾病受累(disease involvement)程度;以及b)处于使得患者可以在支气管镜检中被定位的位置,使得段支气管为重力依赖性的。
[0460]
对于raav9
‑
wtcftr的支气管动脉导管插入递送,在荧光镜控制下将导管从股动脉推进到降主动脉中。在由主动脉造影确定支气管动脉分支模式并估计成比例的剂量后,将导管推进到第一支气管血管中,并给予第一剂量的携带野生型cftr基因拷贝的重组aav9病毒(raav9
‑
wtcftr),以靶向由第一支气管动脉对着的细支气管中的第一基底层靶位点(基底细胞/祖细胞、棒状细胞和纤毛细胞等)。然后将相同或不同的导管推进到第二支气管血管中,以靶向第二组细支气管;如有必要,之后进行第三次、第四次或第五次递送。向各支气管动脉所递送的剂量将与各血管的估计血流量(由血管造影术来判断)成比例。
[0461]
通过猪和绵羊中先前的大动物经验及人cf异种移植的先前经验获知raav
‑
wtcftr的剂量和浓度;englehardt等,nature genetics 4:27
‑
34(1993)。
[0462]
支气管动脉导管插入后
[0463]
在第一个小时内每五分钟测量并记录包括血压、脉搏、体温和呼吸频率在内的生命体征;在接下来的两小时内每15分钟测量;在接下来的六小时内每小时测量;以及在接下来的15小时内每两小时测量;以及在转染后一周的其余时间内每四小时测量。前24小时将测量连续心电图和脉搏血氧饱和度。上面列出的临床实验室血液检查、脉搏血氧饱和度以及pa和侧位胸部x射线在第一周每天进行,第二周每周进行两次,之后的六周每周进行一次。进行薄切ct扫描。
[0464]
给予病毒后,使患者待在具有全面呼吸防护措施的隔离室中。隔离室为负压室,其中的空气被过滤并递送到外部。进入房间的任何人都将穿戴长袍、口罩、护目镜和手套。在开始治疗后,患者将被隔离至少10天。在医院期间,使用本领域已知的pcr测定法分析患者的痰、鼻拭子、尿液和粪便的raav9
‑
野生型cftr重组病毒的脱落。
[0465]
在转染后支气管镜检期间获得以下样品和测量值:a)经转染的段内及对侧肺中其镜像的段支气管内的四个位点处的跨上皮电位差;b)经转染的段及对侧肺中其镜像的支气管肺泡灌洗;c)来自经转染的段的肺泡表面的六次细胞学刷片;以及d)来自经转染的段的六次经支气管活检。
[0466]
疗法的评价。
[0467]
仔细监测患者的如下方面:毒性;对cftr蛋白或腺病毒蛋白的免疫应答;以及基因转移的效率和稳定性。
[0468]
参考文献
[0469]
brinson gm et al.am j respir crit care med.(1998)am j respir crit care med.1998jun;157(6pt 1):1951
‑
8.
[0470]
burke tc.and mauro ma.(2004)semin intervent radiol.2004mar;21(i):43
‑
8.
[0471]
wilson,jm and engelhardt.j.u.s.pat.no.5,585,362
[0472]
oakland m et al.(2012)mol ther.20(6):1108
‑
15.
[0473]
cebotaru l et al.(2013)j biol chem.apr 12;288(15):10505
‑
12.
[0474]
strayer m.et al.(2002)am j physiol lung cell mol physiol 282(3):l394
‑
404.
[0475]
venkatesh vc et al.(1995)am j physiol.1995apr;268(4 pt 1):l674
‑
82.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1