估计透析患者体内物质的生成率的制作方法
1.本发明涉及用于估计透析患者体内的物质(包括但不限于尿素)的生成率的技术。
背景技术:
2.营养不良在透析患者中很常见,并且与高死亡率和发病率相关联。营养不良可能由透析不足、炎症或食欲不振引起。透析患者营养不良的早期迹象很容易被忽视,尤其是在因积液而没有导致体重减轻的情况下。
3.可以通过测量尿素的生成率来评估患者的营养状况,尿素是蛋白质代谢的副产物。因此,患者的蛋白质摄入量与透析阶段(session)过程中产生的废透析液或超滤液中尿素的出现有关,并且如果患者具有残余的肾功能,则与患者尿液中尿素的出现有关。
4.在连续透析治疗(例如,腹膜透析和连续血液透析)中,尿素生成率由透析患者血液中的尿素清除率和尿素浓度的乘积给出。此类计算在连续透析处理中是微不足道的,因为血液尿素浓度随时间是恒定的,并且尿素清除率是可获得的。
5.然而,在间歇透析治疗中,更难以获得用于评估透析患者的营养状况的尿素生成率。
6.一种已知的技术是例如通过透析机中的在线尿素传感器测量废透析液或超滤液中尿素的量。在稳态条件下,在透析阶段过程中去除并由尿素传感器感测到的尿素总量等于患者体内尿素的生成率,并且可以例如通过计算蛋白质分解代谢率(pcr)或相关时间段内每公斤体重生成的尿素克数而被用于评估营养状况。例如,此类技术在以下文献中被公开:wo2011/147425、wo94/08641、us2014/0190886、wo94/09351、wo98/55116,以及stiller等人的文章“on
‑
line urea monitoring during hemodialysis:a review(血液透析阶段间的在线尿素监测:综述)”(其发表于saudi j kidney dis transplant 12(3):364
‑
374(2001))。如上所述,这些技术假定稳态条件并由此需要在多个处理阶段期间测量和聚集尿素的量,这可能是不切实际的。此外,对一个或多个尿素传感器的需要将增加透析机的成本。虽然市场上有具有集成了在线监测设备的透析机,但目前使用的大多数透析机都缺乏这种功能性。利用在线监测功能性改造现有的透析机也太昂贵以至于不是一个现实的选择。
7.另一种适用于所有间歇透析治疗的已知技术是在透析阶段开始和结束时以及在下一次透析阶段开始时采集血液样本,确定三个血液样本中的血液尿素浓度,以及基于血液尿素浓度执行3点尿素动力学模型(ukm)。可以实施ukm以产生相对尿素生成率,即,与透析患者的水容积(volume)相关的透析患者体内的尿素生成率。然而,ukm涉及求解耦合方程的迭代计算,因此相对复杂。此外,3点ukm需要在两次连续的透析阶段中收集三个血液样本。通常,在需要在实验室中通过专业设备采集和分析的每个血液样本的情况下,成本和复杂性都会增加。
8.目前,透析诊所的常见做法是定期(例如,每月一次)对透析患者进行血液检查,以评估白蛋白、尿素、钙、磷酸盐等的血液浓度。通常的做法还有通过在透析阶段开始和结束
时对血液进行采样并例如通过计算尿素减少率(urr)或透析阶段的kt/v(“阶段kt/v”)来比较两个血液样本中的尿素水平来周期性地(通常每月一次)评估间歇透析治疗的透析充分性。
9.尿素生成率仅与饮食蛋白质摄入量(dpi)间接相关,并且如果透析患者处于负氮平衡且处于相对分解代谢中,则可能导致对营养状况的错误判断,这对于营养不良的患者来说是非常可能的。例如,如果尿素是由肌肉分解代谢生成的,那么营养不良患者的尿素生成率可能看起来是正常的。因此,尿素生成率可能需要其他饮食评估工具的补充,包括肌肉质量的评估。肌酐是公知的肌肉质量标志物。像尿素一样,肌酐生成率可以通过分析在两个后续透析阶段中采集的三个血液样本和3点动力学模型来确定。
10.肌酐生成率也可以独立于尿素生成率而被用于评估患者的生理状况。
11.透析患者体内其他物质的生成率也可能是评估生理状况或用于动力学建模所关注的。例如,淀粉样变性是一种透析患者的已知并发症,其中称为淀粉样蛋白的异常蛋白质在患者的组织和器官中积聚。淀粉样蛋白的主要成分是β
‑2‑
微球蛋白(b2m)。透析患者体内b2m的生成率可以是准确评估未来淀粉样变性风险的相关输入,并用于确定如何相应地调整治疗计划。
技术实现要素:
12.本发明的目的是至少部分地克服现有技术的一个或多个局限性。
13.另一个目的是提供一种用于估计透析患者体内物质的生成率的替代技术。
14.另一个目的是提供具有成本效益并可用于所有间歇透析治疗的这类技术。
15.还一个目的是提供允许根据单个透析阶段中的测量结果确定生成率的这类技术。
16.这些目的中的一个或多个以及可以从以下描述中显现的其他目的至少部分地通过根据独立权利要求的方法、计算机可读介质和计算机装置来实现,方法、计算机可读介质和计算机装置的实施例由从属权利要求限定。
17.本发明的第一方面是一种计算透析患者体内物质的生成率的方法。该方法包括:获得在间歇透析治疗的处理阶段开始时透析患者的血液中的该物质的第一浓度值;获得预定义时间段内该物质的标准kt/v值,该预定义时间段包括所述处理阶段;以及根据标准kt/v值、第一浓度值和预定义时间段来计算透析患者体内该物质的生成率。
18.第一方面是基于这样的认识:物质的生成率可以通过使用本领域中称为“标准kt/v”(通常缩写为“stdkt/v”)的参数,通过简单且直接的计算得出。该参数是公知的、既定(established)的透析充分性度量,并且已经被开发为使得能够比较广泛的透析治疗,包括间歇性血液透析治疗、连续性和间歇性超滤治疗、连续性和间歇性腹膜透析以及用于急性肾功能衰竭的连续性血液透析治疗。尽管该参数通常是针对尿素而导出的,但它通常适用于在透析处理中从透析患者的血液中提取的任何物质。根据其基本定义,stdkt/v被给出为其中,g是透析患者体内物质的生成率,t是预定义时间段,是时间段t内透析患者血液中该物质的平均透析前浓度,并且v是该物质在透析患者体内的分布容积。发明人经过深思熟虑,已经认识到如果stdkt/v是已知的,则可以应用stdkt/v的基本定义,直接基于stdkt/v的已知值计算出生成率g或相对生成率g/v,前提是平均透析前浓度是针
对时间段t测量或估计的。
19.已经开发了许多不同的计算算法,将stdkt/v与透析治疗的已知或可测量的参数关联起来。通常,stdkt/v的现有的计算算法要么根据时间段t内物质在相应的处理阶段的阶段kt/v给出,要么根据时间段t内物质在相应的处理阶段开始和结束时的血液浓度给出。stdkt/v的计算算法进一步对相应的处理阶段的持续时间和在时间段t期间通过透析治疗从血液中去除的总流体容积(如果存在的话)进行操作。但是,在预定义时间段包括多于一个处理阶段的程度下,无论是处理阶段开始和结束时的阶段kt/v还是血液浓度,都存在使得能够基于测得的对于单个处理阶段的数据来将stdkt/v近似的计算算法。通常,这种近似在stdkt/v值中引入相对较小的不准确度。因此,根据第一方面的一些实施例,至少基于对于预定义时间段期间的一个处理阶段的测得的数据来估计stdkt/v值,并且还可以(但不是必须)基于对于预定义时间段期间的一个或多个其他处理阶段的对应的测得的数据来估计stdkt/v值。应当理解,透析治疗的设置在预定义时间段期间的处理阶段之间可以不同。此外,不同类型的间歇性透析治疗可以在预定义时间段期间的不同处理阶段中使用,例如,血液透析、血液透析滤过、血液滤过、超滤和腹膜透析的任意组合。
20.上述血液浓度可以从结合处理阶段而得到的血液样本中获得。如本领域已知的,物质在相应的治疗阶段的阶段kt/v可以例如通过正式的动力学建模或使用既定的对于单池kt/v、单池可变容积kt/v、双池kt/v或均衡kt/v的等式而根据血液浓度来计算。除了血液浓度之外,阶段kt/v的此类计算可以对在处理阶段过程中从血液中去除的流体的容积、患者的体重和处理阶段过程中有效的透析时间进行操作。或者,可以基于物质的清除率k、有效透析时间和分布容积v通过直接计算来获得阶段kt/v。已经建立了用于测量或估计物质在处理阶段的体内清除率k的技术。例如,体内清除率k可以通过生成进入透析器的透析液的参数的短期推注并且通过至少在透析器的下游测量该参数来确定,例如,如us5024756、us5100554、ep0658352和us6702774中公开的。市场上有测量透析系统中体内清除率的装置,例如,gambro/baxter的diascan和fresenius的在线清除率监测(ocm)。根据实现方式,这种测量装置可以输出清除率值k或对应的阶段kt/v。
21.第一方面提供了一种用于估计透析患者体内物质的生成率的新颖的替代技术。第一方面可以针对任何间歇透析治疗和此类治疗的任何组合实施。第一方面还可以提供预定义时间段t的平均生成率,而不是通过上述3点动力学模型得出的更短期的生成值。这种平均生成率本质上对可能给出患者生理状况的误导性图片的偶然的短期变化不太敏感。此外,如果stdkt/v和平均透析前浓度两者都由这样的测量数据给出,则第一方面允许根据单个处理阶段的测量数据来确定生成率。这将导致具有成本效益和时间效率的程序。例如,生成率可以基于血液样本给出的浓度值和/或基于阶段kt/v来计算,血液样本是无论如何都要为了定期评估透析充分性而进行采集的(参见背景技术部分),该阶段kt/v可以通过使用市售的标准设备针对处理阶段获得。
22.在下文中,限定了第一方面的各种实施例。这些实施例提供了前述内容中描述的至少一些技术效果和优点,以及技术人员例如鉴于以下详细描述将容易理解到的其他的技术效果和优点。
23.在一个实施例中,该方法还包括:获得在处理阶段结束时透析患者血液中该物质的对于该处理阶段的阶段kt/v值或透析患者血液中该物质的第二浓度值;获得表示在预定
义时间段期间从血液中去除的总流体容积的容积值;以及获得处理阶段的持续时间;其中,所述获得标准kt/v值包括根据容积值、持续时间、和阶段kt/v值以及第一和第二浓度值中的一个来计算标准kt/v值。
24.在一个实施例中,该物质是尿素、肌酐和β
‑2‑
微球蛋白中的一个。
25.在一个实施例中,所述计算生成率包括将标准kt/v值、预定义时间段的倒数和估计的浓度值相乘,该估计的浓度值表示在预定义时间段期间透析患者血液中该物质的平均透析前浓度。
26.在一个实施例中,该方法还包括根据第一浓度值来确定估计的浓度值。在一个示例中,估计的浓度值是相对于第一浓度值设置的。在另一个示例中,估计的浓度值被计算为在预定义时间段期间间歇性透析治疗的一个或多个其他处理阶段开始时透析患者血液中的该物质的第一浓度值和一个或多个其他浓度值的平均值。
27.在一个实施例中,预定义时间段被选择为使得透析患者血液中该物质的浓度在预定义时间段的开始和结束时基本相等。
28.在一个实施例中,预定义时间段是一周。
29.在一个实施例中,预定义时间段包括一个或多个另外的处理阶段,并且标准kt/v值被估计为包括一个或多个另外的处理阶段。
30.在一个实施例中,标准kt/v值是在没有一个或多个另外的处理阶段期间的透析患者血液中的该物质的浓度值并且没有对于一个或多个另外的处理阶段的kt/v值的情况下估计的。例如,处理阶段可以被选择为使得相比于相应的另外的处理阶段开始时透析患者血液中该物质的预期浓度值,处理阶段的第一浓度值最接近预定义时间段期间透析患者血液中该物质的平均透析前浓度。
31.在一个实施例中,该方法还包括以下中的一项或多项:显示生成率,估算生成率以评估透析患者的生理状况,以及显示表示透析患者的生理状况的参数值。
32.在一个实施例中,该方法在所述处理阶段之后执行。
33.本发明的第二方面是包括计算机指令的计算机可读介质,该计算机指令在由处理器执行时使处理器执行第一方面及其任何实施例的方法。
34.第三方面是一种用于计算透析患者体内物质的生成率的计算机系统。该计算机系统被配置为:获得在间歇性透析治疗的处理阶段开始时透析患者血液中该物质的第一浓度值,获得该物质在预定义时间段内的标准kt/v值,该预定义时间段包括处理阶段;以及根据标准kt/v值、第一浓度值和预定义时间段来计算透析患者体内该物质的生成率。
35.第一方面的实施例中的任何一个都可以适用于并实施为第三方面的实施例。
36.本发明的其他目的、特征、实施例、方面和优点可以从以下详细描述、所附权利要求书以及附图中显现。
附图说明
37.现在将参考附图更详细地描述本发明的实施例。
38.图1是用于评估透析患者的营养状况的系统的示意性概况图。
39.图2是在一周的过程期间经历三个透析处理阶段的透析患者的血液尿素浓度的示例图。
adequacy:2015update(kdoqi血液透析充分性临床实践指南:2015年更新),am j kidney dis.2015;66(5),第908
‑
912页:“guideline 3:measurement ofdialysis
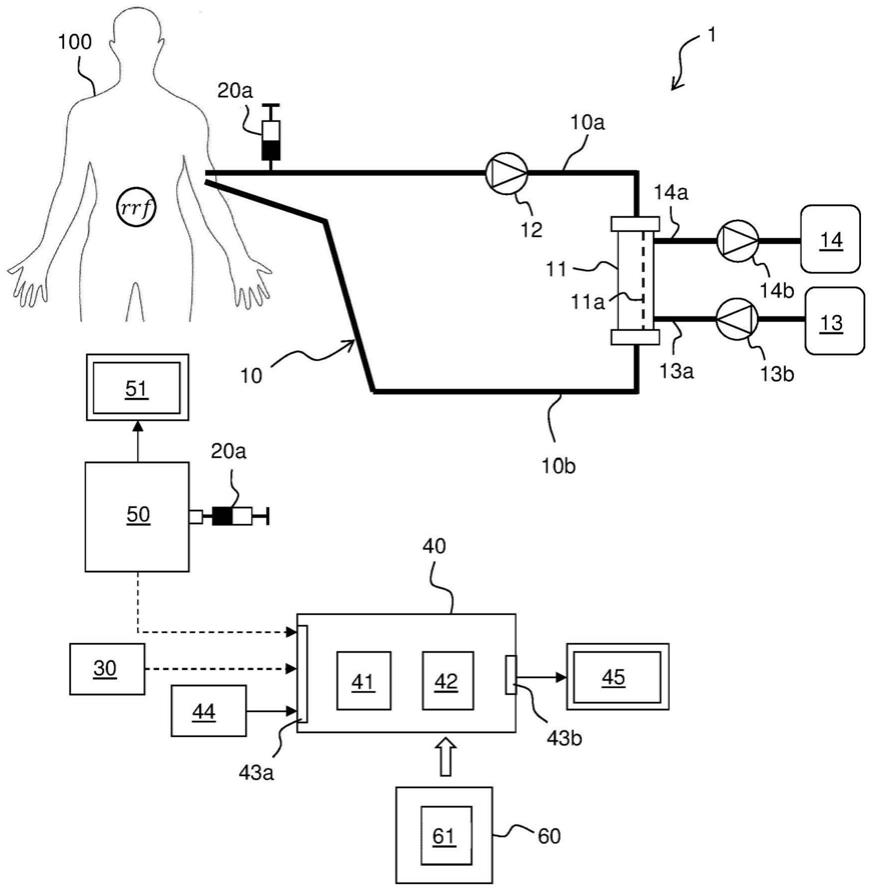
‑
urea kinetics(指南3:透析测量
‑
尿素动力学)”。在以下文献中也讨论了stdkt/v的背后的基本原理和既定用途:参考书“replacement of renal function by dialysis(通过透析替代肾功能)”,第5修订版,2004年,编辑koch、lindsay、ronco和winchester,第22章
‑
血液透析的充分性,第597
‑
638页,以及chin等人发表在seminars in dialysis,30(3),235
‑
240(2017)中的文章“assessing the adequacy of small solute clearance for various dialysis modalities,with inclusion of residual native kidney function(在包括残留的天然肾功能的情况下评估各种透析方式的小溶质清除的充分性)。
48.了解stdkt/v与kt/v不同是重要的,kt/v是描述单个处理阶段的效果(“透析剂量”)的既定度量,并且理论上由透析前和透析后的尿素浓度的比率的对数给出。已经制定了更专业的等式来解释在患者体内尿素的分布,例如产生所谓的单池kt/v(spkt/v)或均衡kt/v(ekt/v)。在下文中,对于单个处理阶段的kt/v表示为“阶段kt/v”,以区别于stdkt/v。
49.在临床情况下,鉴于至少g是未知的,难以基于等式(1)计算stdkt/v。因此,已经开发了用于计算或估计stdkt/v的各种算法。leypold等人在文章“predicting treatment dose for novel therapies using urea standard kt/v(使用尿素标准kt/v预测新型治疗的处理剂量)”中提出了一种计算算法,该文章发表于semin dil 17:142
‑
145(2004)。在这里,在一周内的所有处理阶段是相等的且间隔相等的假设下,stdkt/v是在没有超滤(uf)或残余肾功能(rrf)的情况下根据单个处理阶段的spkt/v的知识计算的。daugirdas等人在文章“standard kt/vurea:a method of calculation that includes effects of fluid removal and residual kidney clearance(standard kt/vurea:一种包括液体去除和残留肾脏清除率的影响的计算的方法)”中提出了另一种计算算法,该文章发表于kidney int 77:637
‑
644(2010)。该算法考虑了uf和rrf,并且在处理阶段相等且在一周内均匀分布的情况下,该算法运行良好。leypold和vonesh在文章“calculating standard kt/v during hemodialysis based on urea mass removed(基于去除的尿素质量计算血液透析过程中的标准kt/v)”中提出了其他计算算法,该文章发表于blood purif.8:1
‑
7(2018)。该算法对处理阶段开始和结束时的血液尿素浓度进行操作,并且也考虑了uf。在处理阶段相等的情况下,该算法运行良好。sternby在文章“mathematical representation of standard kt/v including ultrafiltration and residual renalfunction(包括超滤和残余肾功能的标准kt/v的数学表示)”中提出了又一种计算算法,该文章发表于asaio j.64(5),e88
‑
e93(2018)。该算法能够计算stdkt/v,无论处理阶段的性质、数量和间隔如何,并且该算法考虑了uf和rrf二者。还可以注意到,可以更新不考虑rrf的计算算法以将rrf的贡献的估计值添加到stdkt/v的计算值,例如,如上述kdoqi指南第911
‑
912页所描述的。所有前述出版物通过引用整体并入本文。
50.所有这些计算算法的共同点是,它们能够根据输入数据计算stdkt/v,该输入数据包括均衡期t期间的一个或多个处理阶段的患者血液中的透析前和透析后的尿素浓度或者一个或多个处理阶段的尿素的阶段kt/v,以及相应的处理阶段的持续时间。某些计算算法还对另外的输入数据进行操作以提供更准确的stdkt/v值,所述另外的输入数据例如为相应的处理阶段的开始和结束时间点、均衡期t期间从血液中去除的总超滤量(ufv)和患者的
残余肾功能(rrf)。然而,可能注意到,根据治疗和患者,ufv和rrf可能为零。
51.在上文中,对间歇透析治疗和连续透析治疗进行了区分。如本文所使用的,“连续透析治疗”是指在均衡期t期间对患者进行连续操作的任何肾脏替代治疗,使得尿素(或另一种物质)的浓度在患者血液中基本保持恒定。相比之下,“间歇透析治疗”涉及一个或多个肾脏替代治疗,它们中的每个治疗在均衡期t的相应的子集期间对患者进行操作,导致尿素(或另一种物质)的浓度在均衡期t期间发生变化。此类肾脏替代治疗可以包括血液透析、血液透析滤过、血液滤过、超滤和腹膜透析中的一个或多个。
52.本发明的实施例基于以下见解:如果通过巧妙地使用等式(1)物质的stdkt/v是已知的(例如,通过上述任何一种计算算法进行估计),则可以以简单的方式计算物质的生成率。例如,通过重新排列(re
‑
arrangement),由下式给出相对生成率(g/v):
[0053][0054]
并且由下式给出绝对生成率(g):
[0055][0056]
应当注意,可以关于stdkt/v的计算和/或的计算做出各种假设以简化生成率的计算。例如,即使均衡期t涉及一个或多个附加处理阶段,也可以做出假设以便能够基于在单个处理阶段开始和结束时的物质的血液浓度的测量结果或估计结果来计算生成率。
[0057]
在下文中,将示例性地说明本发明的实施例以用于尿素的测量以及相对或绝对尿素生成率的计算,其联合表示为ugr。参考图1,其示意性地描绘了血液处理系统1,该血液处理系统1在连接到患者100(即,人类受试者)时用于执行血液透析。在该示例中,患者100具有残余肾功能rrf,其是患者肾脏的自体(native)尿素清除率并且可以例如以ml/min给出。
[0058]
系统1包括体外血液回路(“ec回路”)10,其在血液抽取端和血液返回端处连接到患者100的血管系统。连接可以通过任何常规装置(例如,针或导管)进行。血液管线或管道被布置成限定ec回路10的血液抽取路径或分支10a和血液返回路径或分支10b。在本文中表示为“透析器”的血液过滤单元11被连接在抽取路径10a和返回路径10b之间。透析器11包括半透膜11a,其布置成将透析器11分隔成血液隔室和透析液隔室,该血液隔室流体连接到抽取路径10a和返回路径10b。血液泵12被布置在抽取路径10a中并且是可操作的以从患者100抽取血液并且经由透析器11的血液隔室并通过返回路径10b将血液泵送回患者100。系统1还包括透析液源13。透析液路径或管线13a将源13连接到透析器11的透析液隔室。类似地,排出物路径或管线14a将透析器11的透析液隔室连接到用于废透析液(也称为“排出物”)的槽(sink)14。透析液泵13b被布置在透析液路径13a中,并且排出物泵14b被布置在排出物路径14a中。本领域技术人员理解到血液处理系统1可以包括其他组件,例如静脉滴注室、夹具、传感器等。
[0059]
控制装置30被配置为为系统1的操作性组件(例如,泵12、13b、14b)生成控制信号,以使得系统1根据已经例如由看护者或患者100输入到控制装置30中的设置来执行处理阶段。血液透析系统1的操作是本领域技术人员已知的,因此在此不再详述。
[0060]
图1还示出了采样装置20a,其用于从ec回路10的抽取路径10a(如图所示)或直接
从患者100的血管系统采集患者的血液样本。如图所示,采样装置20a然后可以连接到血液分析设备50,该血液分析设备50与系统1分开并且被配置为分析血液样本以确定一个或多个物质(包括尿素)的浓度。设备50可以在显示装置51上向操作者呈现相应的血液样本的分析结果。或者,血液样本可以经受人工实验室分析以产生浓度。如本领域已知的,血液中的尿素浓度可以依据整个尿素分子或其氮含量(通常表示为“血液尿素氮”,bun)给出。
[0061]
图1还描绘了计算装置或计算机系统40,其被配置为执行专用计算以生成允许临床医生评估患者100的营养状况的输出数据。计算机系统40(其可以是透析机的一部分,或者可以不是透析机的一部分)包括处理器41和计算机存储器42。控制程序被存储在存储器42中并且由处理器41执行以执行计算。如所指示的,控制程序61可以在计算机可读介质60上提供给计算机系统40,该计算机可读介质60可以是有形的(非瞬时性的)产品(例如,磁介质、光盘、只读存储器、闪存等)或传播信号。在所示的示例中,计算机系统40包括用于连接到一个或多个输入装置44的输入接口43a以及用于连接到一个或多个输出装置45的输出接口43b,该一个或多个输入装置44使操作者能够提供输入数据,该一个或多个输出装置45用于向操作者提供输出数据。例如,(一个或多个)输入装置44可以包括键盘、小键盘、计算机鼠标、控制按钮、触摸屏等,并且输出装置45可以包括显示装置、指示灯、警报装置、麦克风、打印机等。
[0062]
操作者可以经由输入装置44将例如包括血液浓度值的输入数据输入到计算机系统40中。替代地或附加地,如图1中的虚线箭头所示,血液分析设备50可以通过有线或无线方式连接到输入接口43a以将血液浓度值传送到计算机系统40。替代地或附加地,如图1中的虚线箭头所示,控制装置30可以类似地连接以将输入数据传送到计算机系统40。也可以想到计算机系统40被集成在控制装置30中,反之亦然。
[0063]
图2示出了在一周的时间段期间患者100血液中尿素浓度的示例,其中患者在三个分开的处理阶段中经历间歇透析。在每个处理阶段中,ec回路10连接到患者100的血管系统,如图1所示,接着系统1被操作以执行血液处理程序,在该血液处理程序中,尿毒症溶质和水经由透析器膜11a从患者的血液中去除。此类溶质包括但不限于尿素、肌酐、β
‑2‑
微球蛋白(b2m)、β
‑
微量蛋白、维生素b12等。
[0064]
在图2中,处理阶段分别在时间点t1
‑
t2、t3
‑
t4和t5
‑
t6之间执行,每个处理阶段都引起血液尿素浓度的显著降低,在第一阶段中从c1降低到c2,在第二阶段中从c3降低到c4,且在第三阶段中从c5降低到c6。在各处理阶段之间,由于患者体内的代谢过程,血液尿素浓度升高,在第一阶段和第二阶段之间从c2上升到c3,在第二阶段和第三阶段之间从c4上升到c5,且在第三阶段之后直到时间点t7从c6上升到c7。可以注意到,在该示例中残余肾功能(rrf)为零。图2是每周执行3次(例如,周一、周三和周五)透析治疗的特征。如图所见,血液尿素浓度在一周开始和一周结束时大致相同。事实上,所有透析治疗可以被细分为以大致相同的血液尿素浓度开始和结束的时间段。通常,时间段是一天或多天或者一周或多周。因此,该时间段是stdkt/v的定义中的均衡期t。图2还示出了透析前血液尿素浓度c1、c3、c5在均衡期内从第一阶段到最后阶段单调降低。这是在均衡期期间涉及两个或更多个时间间隔开的处理阶段的透析治疗的特征,在所述两个或更多个时间间隔开的处理阶段之中至少一个时间间隔不同于(一个或多个)其他时间间隔。
[0065]
图3示出了根据实施例的用于确定透析患者中的ugr的方法300。方法300可以由图
1中的计算机系统40来执行并且将参考图2来进行示例性地说明。所示出的实施例基于这样的理解:即使均衡期t包括另外的(一个或多个)处理阶段,例如通过使用上述计算算法也可以为单个选定的处理阶段以足够的准确度估计stdkt/v。选定的阶段优选地是均衡期中的各阶段中的中间阶段,例如,三个阶段中的第二阶段、四个阶段中的第二阶段或第三阶段、或者五个阶段中的第三阶段。
[0066]
从上文可以理解到的是,一些可用的计算算法对阶段kt/v进行操作,阶段kt/v可以由专用测量装置测量或基于透析前浓度和透析后浓度进行计算。例如,上述的spkt/v或ekt/v可以形成阶段kt/v,该阶段kt/v上被输入到计算算法。其他计算算法被配置为对测得的透析前浓度和透析后浓度进行操作而不是对阶段kt/v进行操作。因此,方法300可以根据输入数据的类型而不同。
[0067]
方法300包括获得用于计算步骤306
‑
307的输入数据的步骤301
‑
305,计算步骤306
‑
307之后是可选的评估步骤308。步骤301获得第一测量值,该第一测量值表示选定的阶段开始时的血液尿素浓度。步骤302获得第二测量值或选定的阶段的尿素的阶段kt/v,该第二测量值表示选定的阶段结束时的血液尿素浓度。在图2的示例中,第一测量值和第二测量值可以是第二阶段的时间点t3、t4处的浓度值c3和c4(由实心点指示)。在图1中,第一测量值和第二测量值可以由看护者经由输入装置44输入或从血液分析设备50电子传送。阶段kt/v也可以由看护者通过输入装置44输入并且可以由透析系统1中的任何合适的测量装置(未示出)(包括但不限于在发明内容部分中讨论的装置)给出。或者,看护者可以输入体内尿素清除率k,其例如由此类测量装置给出,接着步骤302以常规方式计算阶段kt/v。或者,阶段kt/v或尿素清除率k可以从测量装置或控制装置30电子传送到计算机系统40。在其他替代方案中,阶段kt/v例如根据任何既定的等式基于透析前浓度和透析后浓度单独计算,然后在步骤32中被输入到计算机系统40。
[0068]
步骤303获得均衡期期间的处理阶段的总超滤量ufv。看护者通常知道总ufv。在图1中,总ufv可以由看护者经由输入装置44输入或从控制装置30以电子传送。总ufv可以作为均衡期的合计值或作为相应阶段的ufv值来输入。如果对于特定治疗已知ufv为零,则可以省略步骤303。
[0069]
步骤304获得所选阶段的持续时间。在图1中,持续时间可以由看护者通过输入设备44输入或从控制设备30电子传输。在图2中,第二阶段的持续时间是d3,4。
[0070]
如果患者具有残余肾功能rrf,则可以包括步骤305以获得表示rrf的数据,其例如被量化为尿素清除率值k
rrf
。rrf数据可以由看护者经由输入装置44输入。
[0071]
步骤306对来自步骤301
‑
305的输入数据进行操作以例如通过使用上述任何一种计算算法来计算尿素的stdkt/v的估计值。在一个示例中,stdkt/v是根据第一测量值和第二测量值、选定的阶段的持续时间、总ufv来计算的。在另一个示例中,stdkt/v是根据阶段kt/v、选定的阶段的持续时间和总ufv来计算的。通常认为,在确定透析后浓度(即,第二测量值)时,通过考虑患者体内的再循环和反弹,可以获得更准确的stdkt/v值。这种类型的值在本领域中被称为“均衡浓度”。均衡浓度可以通过在处理阶段结束后在获得透析后血液样本之前等待30分钟后获得,或者通过数学操作在阶段实际结束时采集的血液样本的浓度值来获得。因此,如果第二测量值是t4处的浓度c4(图2),则步骤306可以将第二测量值转换为均衡尿素浓度,作为stdkt/v计算的一部分。类似地,步骤306可以将通过步骤302获得的阶
段kt/v(例如,spkt/v)转换成均衡阶段kt/v(ekt/v)。在其他实施例中,均衡浓度或ekt/v可以通过步骤302获得并在步骤306中输入。
[0072]
步骤307基于stdkt/v、t和通过使用上面的等式(2)或(3)来计算ugr。这里,t是已知的均衡期的长度。优选地,平均透析前血液尿素浓度可以根据第一测量值来估计。从图2可知,实现了在透析前浓度值c1、c3和c5之中,值c3最接近真实(其是c1、c3和c5的平均值)。因此,的估计值可以由c3给出或关于c3来设置,例如通过乘以预定校正因子和/或与预定校正值(正或负)相加。如果使用等式(3),则可以在前一步骤(未示出)中获得患者100的分布容积v。例如,分布容积v可以是看护者已知的并且由看护者经由输入装置44输入或从控制装置30电子传送。对于尿素(和肌酐),分布容积v可以通过针对患者估计的总身体水分(tbw)进行近似。例如,看护者可以输入患者的干重或体重,以及可能的其他患者数据(例如,性别、年龄、身高等),从而允许方法300例如通过假设tbw是患者体重的给定百分比或通过使用任何既定的公式(例如,watson公式、hume
‑
weyers公式或chertow公式)来估计患者100的tbw。或者,例如通过生物电阻抗分析(bia)在患者身上测量tbw。
[0073]
在步骤307之后,可以输出ugr例如以呈现在显示器45上,和/或与患者100的患者id相关联地存储在存储器42中。如图3所示,方法300还可以涉及步骤308,该步骤308评估ugr以估计患者100的生理状况(例如,营养状况),并显示表示生理状况的参数值。例如,可以通过与先前计算的患者的ugr值进行比较和/或通过将当前的ugr值与阈值进行比较来评估生理状况。还可以想到的是根据ugr来计算净蛋白质分解代谢率(pcr)(也称为氮表现蛋白质当量(pna)),并将其呈现给看护者。
[0074]
在步骤306中使用的计算算法的选择可以是期望的准确度、计算复杂性和输入数据的可用性之间的折衷。如果透析治疗合理地满足计算算法的基本假设,例如,如果在均衡期期间可以认为阶段相等且间隔相等,则可以选择不太复杂的计算算法。然而,作为对多个阶段之中的仅一个阶段的血液尿素浓度或阶段kt/v进行操作的替代方案,可以想到的是步骤306对均衡期内的另外的阶段或所有阶段的对应的数据进行操作。在图2的示例中,方法300可以涉及获得每个阶段的阶段kt/v(或浓度值c1
‑
c7)和对应的时间点t1
‑
t7,并应用已知的计算算法中的一个来获得基本精确的stdkt/v值。此外,可以被计算为c1、c3和c5的任意组合的平均值并且与等式(2)或(3)一起使用。
[0075]
图4是计算模块或单元401
‑
405的装置的框图,计算模块或单元401
‑
405被配置为例如根据方法300基于输入数据联合地计算ugr参数。该装置可以被包括在图1的计算机系统40中,并且相应的模块可以由软件指令和硬件组件(包括处理器41和存储器42)的组合来实现,或者仅由硬件组件来实现。模块401对第一输入数据运行预定义函数f1以生成stdkt/v值。在所示的示例中,第一输入数据包括第一测量值cs和第二测量值ce(即,处理阶段的起始血液尿素浓度和结束血液尿素浓度),或处理阶段的阶段kt/v值,并且还包括处理阶段的持续时间d、均衡期t的总ufv和rrf(如果存在的话)。模块402对包括第一测量值cs的第二输入数据运行预定义函数f2以估计平均透析前血液尿素浓度模块403对stdkt/v值和运行预定义函数f3以计算相对尿素生成率g/v。模块404对包括患者重量w的第三输入数据运行预定义函数f4以估计分布容积v。模块405对g/v值和分布容积v运行预定义函数f5以计算绝对尿素生成率g或pcr值。
[0076]
如上所述,所有前述实施例同样适用于在透析治疗中从患者血液中去除的任何其他物质。因此,通过获得任何此类物质的阶段kt/v,或该物质的第一测量值和第二测量值,上述方法提供了患者体内该物质的绝对或相对生成率。例如,物质可以是肌酐或b2m,如背景技术部分所讨论的。在一个实施例中,计算并联合评估两个或更多个物质的生成率以估计患者的生理状况(参见图3中的步骤308)。例如,可以联合评估尿素和肌酐的生成率以评估营养状况。
[0077]
尽管已经结合当前被认为是最实用和优选的实施例描述了本发明,但是应当理解,本发明不限于公开的实施例,相反,本发明旨在覆盖包含在所附权利要求书的精神和范围内的各种修改和等同布置。
[0078]
此外,尽管在附图中以特定顺序描绘了操作,但这不应理解为要求以所示的特定顺序或次序执行这样的操作或者执行所有图示的操作,以获得期望的结果。在某些情况下,并行处理可能是有利的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1