PRPF31基因表达敲低提高体外分化的人细胞的存活
prpf31基因表达敲低提高体外分化的人细胞的存活
相关申请的交叉引用
1.本技术根据35u.s.c.
§
119(e)要求2019年3月15日提交的美国临时申请第62/818,979号的权益,该美国临时申请的内容通过引用以其整体并入本文。序列表
2.本技术包含已经以ascii格式以电子方式提交并且在此通过引用以其整体并入的序列表。在2020年3月13日创建的所述ascii副本被命名为034186
‑
094370wopt_sl.txt,大小为8,354字节。
技术领域
3.本文所述的技术涉及提高体外分化的人细胞的存活和植入的方法及其用途。背景
4.在千禧年之交,心血管疾病已经被广泛地确定为一种新出现的流行病。尽管对心力衰竭和心肌梗塞的治疗取得了重大进展,但人类细胞治疗方法未能达到修复心脏组织的预期结果。这是由于移植后缺乏干细胞来源的心肌细胞的存活及其在体内缺乏稳定性。因此,需要新的方法来提高体外分化的人细胞的存活,以改善患有心血管疾病、心脏损伤或者依赖干细胞或细胞移植疗法的其它疾病的患者的治疗结果。概述
5.本文所述的方法和组合物部分地涉及以下发现:降低前体mrna加工因子31的水平增强体外分化细胞的存活和/或植入。
6.在一个方面,本文描述了组合物,其包含从干细胞体外分化的人细胞和降低前体mrna加工因子31(prpf31)的水平或活性的试剂。
7.在任何方面的一个实施方案中,所述组合物是移植组合物。
8.在另一个实施方案中,从干细胞体外分化的细胞是心肌细胞。
9.在另一个实施方案中,从干细胞体外分化的细胞是中胚层谱系细胞。
10.在另一个实施方案中,体外分化的细胞是选自以下的细胞类型:心肌细胞、骨骼肌细胞、平滑肌细胞、肾细胞、内皮细胞、皮肤细胞、肾上腺皮质细胞、骨细胞、白细胞和小胶质细胞。
11.在另一个实施方案中,体外分化的人细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。
12.在另一个实施方案中,干细胞来源于健康对象。
13.在另一个实施方案中,所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。
14.在另一个实施方案中,所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。
15.在另一个实施方案中,载体选自质粒和病毒载体。
16.在另一个实施方案中,rnai分子包含seq id no:1的核酸序列。
17.在另一个方面,本文描述了用于移植到接受者的移植组合物,所述组合物包含已经与降低prpf31的水平或活性的试剂接触的体外分化的人中胚层谱系细胞。在任何方面的一个实施方案中,人中胚层谱系细胞是心肌细胞。
18.在另一个实施方案中,所述试剂选自小分子、多肽、核酸分子或包含核酸分子的载体。
19.在另一个实施方案中,所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。
20.在另一个实施方案中,载体选自质粒和病毒载体。
21.在另一个实施方案中,rnai分子包含seq id no:1的核酸序列。
22.在另一个实施方案中,体外分化的人中胚层谱系细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。
23.在另一个实施方案中,中胚层谱系细胞从来源于移植接受者的ipsc分化。
24.在另一个方面,本文描述了移植体外分化的人中胚层谱系细胞的方法,所述方法包括将已经与降低prpf31的水平或活性的试剂接触的体外分化的人中胚层谱系细胞移植到对象的组织或器官中或者移植到对象的组织或器官上。在任何方面的一个实施方案中,细胞是心肌细胞。
25.在另一个实施方案中,接触的细胞比未与试剂接触的细胞在移植后更大程度地存活。
26.在另一个实施方案中,细胞是心肌细胞,并且对象患有心肌梗塞。
27.在另一个实施方案中,所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。
28.在另一个实施方案中,所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。
29.在另一个实施方案中,载体选自质粒和病毒载体。
30.在另一个实施方案中,rnai分子包含seq id no:1的核酸序列。
31.在另一个实施方案中,人心肌细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。
32.在另一个实施方案中,ipsc来源于对象。
33.在另一个实施方案中,所述ipsc来源于健康供体。
34.在另一方面,本文描述了促进移植的人体外分化的心肌细胞的存活和/或植入的方法,所述方法包括使人体外分化的心肌细胞与降低prpf31的水平或活性的试剂接触,以及将所述细胞移植到有需要的人对象的心脏组织中。
35.在一个实施方案中,对象患有心肌梗塞。
36.在另一个实施方案中,所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。
37.在另一个实施方案中,所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。
38.在另一个实施方案中,载体选自质粒和病毒载体。
39.在另一个实施方案中,rnai分子包含seq id no:1的核酸序列。
40.在另一方面,本文描述了促进移植的中胚层谱系细胞的存活和/或植入的方法,所述方法包括:向有需要的对象施用与降低对象中的prpf31的水平或活性的试剂接触或者用其治疗的中胚层谱系细胞。
41.在一个实施方案中,中胚层衍生的细胞是体外分化的中胚层谱系细胞。
42.在另一个实施方案中,中胚层谱系细胞在体外从ips细胞或胚胎干细胞分化。
43.在另一个实施方案中,所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。
44.在另一个实施方案中,所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。
45.在另一个实施方案中,载体选自质粒和病毒载体。
46.在另一个实施方案中,rnai分子包含seq id no:1的核酸序列。
47.在另一个实施方案中,ipsc来源于对象。
48.在另一个实施方案中,所述ipsc来源于健康供体。
49.在另一个实施方案中,移植的中胚层谱系细胞是选自以下的细胞类型:心肌细胞、骨骼肌细胞、平滑肌细胞、肾细胞、内皮细胞、皮肤细胞、肾上腺皮质细胞、骨细胞、白细胞和小胶质细胞。定义
50.为方便起见,下文提供了在说明书、实施例和所附权利要求中使用的一些术语和短语的含义。除非另有说明或者从上下文中暗示,以下术语和短语包括以下提供的含义。提供定义是为了帮助描述特定实施方案,而不是旨在限制所要求保护的技术,因为该技术的范围仅由权利要求限定。除非另有定义,否则本文使用的所有技术和科学术语具有与本技术所属领域的普通技术人员通常理解的相同的含义。如果本领域中术语的用法与其在本文提供的定义之间存在明显的差异,则以说明书内提供的定义为准。
51.细胞和分子生物学及生物化学中常见术语的定义可见于the merck manual of diagnosis and therapy,第20版,由merck sharp&dohme corp.出版,2018(isbn 9780911910421,0911910425);robert s.porter等人(编辑),the encyclopedia of molecular cell biology and molecular medicine,published by blackwell science ltd.,2008(isbn 3527305424,9783527305421);以及robert a.meyers(编辑),molecular biology and biotechnology:a comprehensive desk reference,published by vch publishers,inc.,1995(isbn 1
‑
56081
‑
569
‑
8);werner luttmann的immunology,由elsevier出版,2006;janeway's immunobiology,kenneth murphy,allan mowat,casey weaver(编辑),taylor&francis limited,2016(isbn 9780815345510,0815345518);lewin's genes xi,published by jones&bartlett publishers,2014(isbn
‑
1449659055);michael richard green and joseph sambrook,molecular cloning:a laboratory manual,第4版,cold spring harbor laboratory press,cold spring harbor,n.y.,usa(2012)(isbn 1936113414);davis等人,basic methods in molecular biology,elsevier science publishing,inc.,new york,usa(2012)(isbn 044460149x);laboratory methods in enzymology:dna,jon lorsch(编辑)elsevier,2013(isbn 0124199542);laboratory methods in enzymology:rna,jon lorsch(编辑)elsevier,
2013(isbn:9780124200371,0124200370);current protocols in molecular biology(cpmb),frederick m.ausubel(编辑),john wiley and sons,2014(isbn 047150338x,9780471503385),current protocols in protein science(cpps),john e.coligan(编辑),john wiley and sons,inc.,2005;以及current protocols in immunology(cpi)(john e.coligan,ada m kruisbeek,david h margulies,ethan m shevach,warren strobe,(编辑)john wiley and sons,inc.,2003(isbn 0471142735,9780471142737),immunological methods,ivan lefkovits,benvenuto pernis,(编辑)elsevier science,2014(isbn:9781483269993,148326999x),其内容均通过引用以其整体并入本文。
52.如本文所用,“移植组合物”是指包含体外分化的细胞或其群体的组合物。该组合物可以配制成作为移植物施用至对象。移植组合物将包含药学上可接受的载体,并且可任选地包含用于细胞的基质或支架。可以将移植组合物配制用于通过注射或例如通过手术植入施用。
53.术语“患者”、“对象”和“个体”在本文中可互换使用,并且是指向其提供治疗(包括预防性治疗)的动物,特别是人。本文所用的术语“对象”是指人和非人动物。术语“非人动物”和“非人哺乳动物”在本文中可互换使用,包括所有脊椎动物,例如哺乳动物,如非人灵长类(特别是高级灵长类)、绵羊、狗、啮齿动物(例如小鼠或大鼠)、豚鼠、山羊、猪、猫、兔、牛以及非哺乳动物,如鸡、两栖动物、爬行动物等。在任何方面的一个实施方案中,对象是哺乳动物。在任何方面的另一个实施方案中,对象是人。在任何方面的另一个实施方案中,对象是作为疾病模型的实验动物或动物替代物。在任何方面的另一个实施方案中,对象是家养动物,包括伴侣动物(例如狗、猫、大鼠、猪、豚鼠、仓鼠等)。对象可以先前已经接受了疾病的治疗,或从未接受过疾病的治疗。对象可以先前已经被诊断患有疾病,或者从未被诊断患有疾病。
54.本文所用的术语“健康对象”是指至少缺乏待治疗的疾病或病症的标志物或症状的对象。
55.如本文所用,术语“人干细胞”是指可以自我更新并分化为至少一种不同细胞类型的人细胞。术语“人干细胞”涵盖人干细胞系、人源性诱导的多能干(ips)细胞、人胚胎干细胞、人多能干细胞、人专能干细胞、羊膜干细胞、胎盘干细胞或人成体干细胞。在任何方面的一个实施方案中,人干细胞不来源于人胚胎。
56.提及干细胞中使用的术语“来源于”意指通过将分化细胞重编程为干细胞表型来产生干细胞。提及分化细胞使用的术语“来源于”意指该细胞是干细胞分化(例如,体外分化)的结果。作为一个实例,“ipsc
‑
cm”或“诱导的多能干细胞衍生的心肌细胞”可互换使用以指代通过干细胞的体外分化而来源于诱导的多能干细胞的心肌细胞。
57.如本文所用,“体外分化的细胞”是指通常经由从前体细胞如人胚胎干细胞、诱导的多能干细胞、早期中胚层、外胚层或内胚层细胞或者祖细胞逐步分化而在培养中产生的细胞。因此,例如,“体外分化的心肌细胞”是通常经由从前体细胞如人胚胎干细胞、诱导的多能干细胞、早期中胚层细胞、侧板中胚层细胞或心脏祖细胞逐步分化而在培养中产生的心肌细胞。
58.术语“试剂”是指施用至细胞、组织、器官或对象或者与细胞、组织、器官或对象接触的任何实体,其通常不存在或者不以施用至细胞、组织、器官或对象的水平存在。试剂可
以选自:化学物质;小分子;核酸;核酸类似物;蛋白质;肽;肽模拟物;肽衍生物;肽类似物;适配体;抗体;内抗体(intrabodies);生物大分子;或其功能片段。核酸可以是rna或dna,可以是单链或双链的,并且可以包括,例如,编码目的蛋白的核酸以及抑制基因表达或蛋白功能的核酸,如rna干扰或小干扰rna分子、反义rna分子或适配体。核酸可以包括寡核苷酸以及核酸类似物,例如肽核酸(pna)、假互补pna(pc
‑
pna)和锁核酸(lna)等。
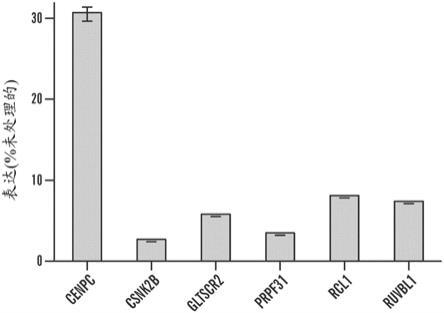
59.核酸可以包括编码例如,作为转录阻抑物的蛋白质的序列以及编码反义分子、核酶、小抑制核酸的序列,例如,但不限于rnai、shrnai、sirna、微rnai(mrnai)、反义寡核苷酸等。蛋白质和/或肽或其片段可以是任何目的蛋白,例如但不限于:突变蛋白、治疗性蛋白或截短蛋白,包括例如显性负性突变蛋白,其中所述蛋白在细胞中通常不存在或以较低水平表达。蛋白质还可以包括突变蛋白、基因工程化蛋白、重组蛋白、嵌合蛋白、抗体、midibodies、三链抗体、人源化蛋白、人源化抗体、嵌合抗体、修饰的蛋白及其片段。可以将试剂施加或引入到细胞培养基中,在细胞培养基中,试剂与细胞接触并诱导其作用。可选地,由于将编码试剂的核酸引入细胞及其转录导致核酸和/或蛋白试剂在细胞内产生,试剂可以是细胞内的。在一些实施方案中,试剂是任何化学实体或部分,包括但不限于合成的和天然存在的非蛋白质实体。在某些实施方案中,试剂是小分子。小分子可以包括化学部分,其包括未取代或取代的烷基、芳香族或杂环基部分,包括大环内酯类、来普霉素(leptomycins)和相关的天然产物或其类似物。在一些实施方案中,试剂可以是由生物材料如细菌、植物、真菌或者动物细胞或组织制成的提取物。在一些实施方案中,试剂可以是天然存在的或合成的组合物或者其功能片段。可以已知试剂具有期望的活性和/或特性,或者可以选自多种化合物的库。
60.短语“药学上可接受的”在本文中用于指代在合理的医学判断内适合用于与人类和动物的组织接触而没有过度的毒性、刺激、过敏反应或者其它问题或并发症,与合理的益处/风险比相称的那些试剂、化合物、材料、组合物和/或剂型。
61.如本文所用,“基底”是指包含生物相容性材料的结构,所述生物相容性材料提供适合于细胞粘附和增殖的表面。纳米图案化的基底可以进一步提供机械稳定性和支持,并且可以例如促进体外分化的细胞如体外分化的肌细胞或体外分化的心肌细胞的成熟。包括但不一定限于纳米图案化基底的基底可以是特定的形状或形式,以便影响或界定增殖细胞群体所呈现的三维形状或形式。此类形状或形式包括但不限于膜(例如具有基本上大于第三维的二维形式)、带、线、片、平盘、圆柱体、球体、三维无定形形状等。
62.如本文所用,“施用”用于通过导致本文所述的试剂在期望部位(例如体外分化细胞、心脏、肾、血液、皮肤或其区域)至少部分定位的方法或途径将所述的试剂(例如小分子)置于细胞、组织、器官或对象之上或之中的上下文中,从而产生期望的效果(例如,降低的prpf31水平或活性)。本文所述的试剂可以通过任何适当的途径施用,该途径导致递送至对象中的期望位置。施用至对象后试剂的半衰期可以短至数分钟、数小时或数天,例如24小时至数天,至长达数年,即长期。“施用”还可以指将用如本文所述的试剂处理的体外分化细胞置于组织、器官或对象中。在该上下文中,“施用”等同于“移植”。
63.如本文所用,术语“移植”用于通过导致所引入的细胞在期望部位(如损伤或修复部位)至少部分定位的方法或途径将细胞(例如本文所述的体外分化细胞)置于对象中的上下文中,从而产生期望的效果。在一些实施方案中,细胞,例如心肌细胞,可以直接植入或注
射到器官中或器官上,或者可选地可以通过任何适当的途径施用,该途径导致递送到对象中期望的位置,在该位置,至少一部分植入的细胞或细胞的组分保持存活。施用至对象后细胞活力的时间可以短至数小时,例如24小时至数天,至长达数年或更长,即长期植入。如本领域技术人员将理解的,期望长期植入体外分化的细胞,因为许多成熟的成体细胞(例如,心肌细胞)不会增殖到器官(例如,心脏)可以从涉及细胞死亡的急性损伤中治愈的程度。
64.如本文所提及的病症或疾病(例如,心血管疾病)的“治疗”是指治疗干预,其增强细胞、组织或器官的功能,和/或增强植入,和/或增强治疗区域中的移植或植入血管化,从而改善组织或器官(作为非限制性实例,心脏)的功能。也就是说,“治疗”是针对被治疗的组织或器官的功能(例如,在心脏的梗塞区域内增强的功能),和/或用本文所述的组合物治疗的其它部位。有效的治疗不需要治愈或直接影响被认为是有效治疗的疾病或病症的潜在原因。例如,例如在收缩强度或节律方面改善心脏功能的治疗方法可以是有效的治疗,而不必治疗梗塞或心律失常的原因。
65.如本文所用,术语“疾病”或“病症”是指由对象的基因组、生理、行为或健康中的一种或多种异常而部分地或完全地、直接地或间接地引起的疾病、综合征或病症。
66.所述疾病或病症可以是心脏疾病或病症。心脏疾病的非限制性实例包括心肌病、心律失常、心力衰竭、致心律失常性右心室发育不良(arvd)、长qt综合征、儿茶酚胺敏感性多形性室性心动过速(cpvt)、巴斯综合征(barth syndrome)和在杜氏肌营养不良中的心脏受累。
67.如本文所用,“预防(prevention)”或“预防(preventing)”当用于提及疾病、病症或其症状时,是指个体将发展疾病或病症(例如,心肌梗塞后的心力衰竭仅作为一个实例)的可能性降低。例如,当具有疾病或病症的一个或多个风险因素的个体未能发展病症,或者在以后的时间发展此类疾病或病症,或者与具有相同风险因素且未接受如本文所述的治疗的人群相比,从统计学上来讲,以较少的严重性发展此类疾病或病症,发展疾病或病症的可能性降低。未发展疾病的症状或发展减少的症状(例如,在该疾病或病症的临床接受的量表上至少减少10%)或延迟的症状(例如,数天、数周、数月或数年)被认为是有效的预防。
68.术语“减少(decrease)”、“降低(reduced)”、“降低(reduction)”“在较小程度上”或“抑制”在本文中均用于意指特性、水平或其它参数以统计学显著的量减少或降低。在一些实施方案中,“降低(reduced)”、“降低(reduction)”、“减少(decrease)”或“抑制”通常意指与参考水平(例如,不存在给定的治疗)相比降低至少10%,并且可以包括例如降低至少约10%、至少约20%、至少约25%、至少约30%、至少约35%。至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约98%、至少约99%、或更多。如本文所用,“降低”或“抑制”不涵盖与参考水平相比的完全抑制或降低。“完全抑制”是与参考水平相比100%的抑制。对于没有给定病症的个体,降低可以优选地降至在正常范围内所接受的水平。
69.术语“增加的(increased)”、“增加(increase)”、“增加(increases)”或“增强”或“活化”或“在更大程度上”在本文中均用于通常意指特性、水平或其它参数增加统计学上显著的量;为了避免任何疑问,术语“增加的”、“增加”、“在更大程度上”、“增强”或“活化”可以指与参考水平相比增加至少10%,例如增加至少约20%、或至少约30%、或至少约40%、或至少约50%。或至少约60%、或至少约70%、或至少约80%、或至少约90%或多达并包括
100%增加或者与参考水平相比10
‑
100%的任何增加,或者与参考水平相比,至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍或至少约10倍增加、至少约20倍增加、至少约50倍增加、至少约100倍增加、至少约1000倍增加或更多。
70.如本文所用,“参考水平”是指正常的在其它方面不受影响的细胞群体或组织(例如,从健康对象获得的细胞、组织或生物样品,或者在先前时间点从对象获得的生物样品,例如,在诊断患有疾病之前从患者获得的细胞、组织或生物样品,或者未与本文公开的试剂或组合物接触的生物样品)。可选地,参考水平还可以指在施用治疗之前,例如用试剂或经由施用移植组合物,对象、器官、组织或细胞中给定标志物或参数的水平。
71.如本文所用,“适当的对照”是指相对于接触给定处理或用给定处理而处理的细胞、组织、生物样品或群体,未处理的在其它方面相同的细胞、对象、有机体或群体(例如,未与本文所述的试剂或组合物接触的细胞、组织或生物样品)。例如,适当的对照可以是未与如本文所述的试剂接触或未施用如本文所述的细胞的细胞、组织、器官或对象。
72.术语“统计学上显著的”或“显著地”是指统计显著性,并且通常意指两个标准偏差(2sd)或更大的差异。
73.如本文所用,术语“包含”意指除了所呈现的限定要素之外,还可存在其它要素。“包含”的使用表示包括而非限制。
74.术语“由
……
组成”是指如本文所述的组合物、方法及其各自的组分,其排除了在实施方案的描述中未陈述的任何要素。
75.如本文所用,术语“基本上由
……
组成”是指给定实施方案所需的那些要素。该术语允许存在不会实质上影响本发明的该实施方案的基本和新颖或功能特性的另外的要素。
76.单数术语“一个/一种(a)”、“一个/一种(an)”和“所述”包括复数指示物,除非上下文另外清楚地说明。类似地,词语“或”旨在包括“和”,除非上下文另外清楚地说明。尽管与本文所述的方法和材料类似或等同的方法和材料可用于本公开内容的实践或测试,但下文描述了合适的方法和材料。缩写“例如(e.g.)”来源于拉丁语“例如(exempli gratia)”,并且在本文中用于表示非限制性实例。因此,缩写“例如(e.g.)”与术语“例如(for example)”同义。
77.此外,除非上下文另有要求,否则单数术语应包括复数并且复数术语应包括单数。
78.除了在操作实例中,或者在另外表明的情况下,本文使用的表示成分的量或反应条件的所有数字应理解为在所有情况下由术语“约”修饰。当与百分比结合使用时,术语“约”可以意指
±
1%。附图简述
79.图1显示了来源于rues2胚胎干细胞系的hpsc
‑
cm中的基因敲低。使用脂质体rnaimax(thermo fisher)温育48小时,用5nm sirna转染hpsc
‑
cm。对照是未处理的或用阴性对照杂乱的sirna(scrambled sirna)转染的。通过定量rtpcr证实敲低的效率。将所得细胞冷冻保存用于移植。
80.图2显示了与未处理的和对照sirna处理的hpsc
‑
cm相比,具有prpf31敲低的hpsc
‑
cm的存活增加(分别为p=0.008和p=0.007;未配对t检验)。详述
81.本文所述的组合物和方法部分地涉及这样的发现:当移植到组织、器官或对象时,
经处理以降低前体mrna加工因子(prpf31)的水平或活性的中胚层谱系的人多能干细胞的衍生细胞比未经处理的细胞更好地存活。特别地,发现人多能干细胞衍生的心肌细胞(hpsc
‑
cm)在移植到心脏组织后以增加的效率在此类组织中存活和/或移植。
82.因此,本文描述了促进移植的中胚层谱系细胞的存活和/或植入的方法,所述方法包括:向有需要的对象施用已经用降低prpf31的水平或活性的试剂处理的中胚层谱系细胞。
83.在某些实施方案中,细胞是体外分化的细胞,包括但不限于体外分化的心肌细胞等。除了用于移植细胞和用于促进此类细胞存活的方法之外,本文所述的技术还包括组合物,其包含用降低prpf31的水平或活性的试剂处理的细胞和与此类试剂混合的细胞。
84.以下描述与所述技术的实践相关的考虑。细胞制备:
85.在某些实施方案中,本文所述的组合物和方法使用体外分化的细胞。此类细胞可以从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。
86.以下描述了可用于制备用于移植或植入对象的细胞的各种来源和干细胞。
87.干细胞是保留通过细胞有丝分裂自我更新的能力并且可以分化成更特化的细胞类型的细胞。三种广泛类型的哺乳动物干细胞包括:在胚泡中发现的胚胎干(es)细胞、从体细胞重编程的诱导的多能干细胞(ipsc)和在成体组织中发现的成体干细胞。干细胞的其它来源可以包括,例如,羊膜来源的干细胞或胎盘来源的干细胞。多能干细胞可以分化成来源于三个胚层中任何一个的细胞。
88.可用于本文所述的组合物和方法中的细胞可以从胚胎干细胞和诱导的多能干细胞等中分化。
89.在一个实施方案中,本文提供的组合物和方法使用中胚层谱系细胞,包括但不限于从胚胎干细胞分化的人心肌细胞。可选地,在一些实施方案中,本文提供的组合物和方法不涵盖来源于取自活人胚胎的细胞的分化的人细胞的产生或使用。
90.胚胎干细胞:胚胎干细胞及其获取方法描述于,例如,trounson a.o.reprod.fertil.dev.(2001)13:523,roach m l methods mol.biol.(2002)185:1以及smith a.g.annu rev cell dev biol(2001)17:435中。术语“胚胎干细胞”用于指胚胎胚泡的内细胞团的多能干细胞(参见例如美国专利第5,843,780号、第6,200,806号)。此类细胞可以类似地从来源于体细胞核转移的胚泡的内细胞团获得(参见,例如,美国专利第5,945,577号、第5,994,619号、第6,235,970号)。胚胎干细胞的标志物包括,例如,oct3、nanog、sox2、ssea1、ssea4和tra
‑1‑
60中的任一种或任意组合。
91.来源于胚胎来源的细胞可以包括从干细胞库或其它公认的保藏机构获得的胚胎干细胞或干细胞系。产生干细胞系的其它手段包括包含在胚泡形成之前(在大约8细胞阶段)使用来自早期胚胎的卵裂球细胞的方法。此类技术使用,例如,在辅助生殖门诊中常规实施的植入前遗传诊断技术中移除的单细胞。将单个卵裂球细胞与建立的es细胞系共培养,然后与它们分离以形成完全感受态的es细胞系。
92.未分化的胚胎干(es)细胞是本领域技术人员容易识别的,并且通常以具有高的核/细胞质比和突出的核仁的细胞集落出现在显微镜视图的两个维度上。胚胎干细胞的标志物包括,例如,oct3、nanog、sox2、ssea1、ssea4和tra
‑1‑
60中的任一种或任意组合。在一
些实施方案中,用于本文所述的方法和组合物中的分化的人细胞并非来源于胚胎干细胞或胚胎来源的任何其它细胞。
93.诱导的多能干细胞(ipsc):在一些实施方案中,本文所述的组合物和方法利用在体外从诱导的多能干细胞分化的人心肌细胞或其它人中胚层谱系细胞。使用ipsc产生用于本文所述的组合物和方法的细胞的优点在于,如果需要的话,所述细胞可以来源于待施用分化细胞的相同对象。也就是说,可以从对象获得体细胞,将其重编程为诱导的多能干细胞,然后再分化为人心肌细胞或其它中胚层谱系细胞以施用至所述对象(即,自体细胞)。由于细胞和它们的分化后代基本上来源于自体来源,因此与使用来自另一名对象或对象组别的细胞相比,植入排斥或变态反应的风险降低。尽管这是ips细胞的优点,但在替代实施方案中,可用于本文所述的方法和组合物的心肌细胞和其它人中胚层谱系细胞来源于非自体来源(即,同种异体细胞)。此外,使用ipsc不需要从胚胎来源获得的细胞。
94.尽管在生理环境下分化通常是不可逆的,但近年来已经开发了几种方法来重编程体细胞以诱导多能干细胞。示例性方法是本领域技术人员已知的,并且在下文简要描述。
95.重编程是改变或逆转分化细胞(例如,体细胞)的分化状态的过程。换言之,重编程是将细胞的分化驱动回更未分化或更原始类型的细胞的过程。应注意,将许多原代细胞置于培养物中可导致完全分化特征的一些丧失。然而,简单地培养包括在术语分化细胞中的此类细胞不能使这些细胞成为未分化细胞或多能细胞。分化细胞向多能性的转变需要超过以下刺激的重编程刺激:当分化细胞置于培养物中时,该刺激导致分化特征的部分丧失。相对于原代细胞亲本,重编程细胞还具有延长传代而不丧失生长潜能的能力的特征,所述原代细胞亲本通常仅具有有限数量的培养分裂能力。
96.待被重编程的细胞可以在重编程之前部分或终末分化。因此,待被重编程的细胞可以是终末分化的体细胞,以及成体干细胞或体干细胞。
97.在一些实施方案中,重编程涵盖将分化细胞(例如,体细胞)的分化状态向多能状态或专能状态的完全逆转。在一些实施方案中,重编程涵盖分化细胞向未分化细胞(例如胚胎样细胞)的分化状态的完全或部分逆转。重编程可导致细胞表达特定基因,其表达进一步有助于重编程。在本文所述的某些实施方案中,分化细胞的重编程导致分化细胞呈现具有自我更新和分化为所有三种胚层谱系的细胞的能力的未分化状态。这些是诱导的多能干细胞(ipsc或ips细胞)。
98.将体细胞重编程为ips细胞的方法描述于例如美国专利号8,129,187b2;8,058,065b2;美国专利申请2012/0021519a1;singh等人,front.cell dev.biol.(february,2015);以及park等人,nature 451:141
‑
146(2008);将其通过引用以其整体并入。具体地,通过引入重编程转录因子的组合从体细胞产生ipsc。重编程因子可以作为例如蛋白质,核酸(mrna分子、dna构建体或编码它们的载体)或其任何组合引入。小分子也可以增强或补充引入的转录因子。虽然已经确定另外的因素影响例如重编程的效率,但组合足以将体细胞重编程为诱导的多能状态的四个重编程因子的标准组包括oct4(八聚体结合转录因子
‑
4)、sox2(性别决定区y)
‑
盒子2、klf4(kruppel样因子
‑
4)和c
‑
myc。已经发现另外的蛋白质或核酸因子(或编码它们的构建体),包括但不限于lin28+nanog、esrrb、pax5 shrna、c/ebp、p53 sirna、utf1、dnmt shrna、wnt3a、sv40 lt(t)、htert)或小分子化学试剂,包括但不限于bix
‑
01294、bayk8644、rg108、aza、地塞米松、vpa、tsa、saha、pd0325901+chir99021(2i)和
a
‑
83
‑
01替代来自基础或标准组的四种重编程因子中的一种或其它重编程因子,或者提高了重编程的效率。
99.用于从体细胞(例如,不包括生殖系细胞的身体的任何细胞;成纤维细胞等)产生多能干细胞的特定途径或方法对所要求保护的发明不是关键的。因此,将体细胞重编程为多能表型的任何方法都适用于本文所述的方法。
100.如shi,y.,等人,(2008)cell
‑
stem cell 2:525
‑
528,huangfu,d.,等人,(2008)nature biotechnology 26(7):795
‑
797以及marson,a.,等人,(2008)cell
‑
stem cell 3:132
‑
135所示,通过添加各种小分子,可以提高从起始细胞群体中得到的重编程的效率(即重编程细胞的数目)。提高重编程效率的试剂的一些非限制性实例包括可溶性wnt、wnt条件培养基、bix
‑
01294(g9a组蛋白甲基转移酶)、pd0325901(mek抑制剂)、dna甲基转移酶抑制剂、组蛋白脱乙酰酶(hdac)抑制剂、丙戊酸、5
’‑
氮杂胞苷,地塞米松、辛二酰苯胺(suberoylanilide)、异羟肟酸(saha)、维生素c和曲古抑菌素(tsa)等。
101.为了证实用于本文所述方法的多能干细胞的诱导,可以测试分离的克隆的一种或多种干细胞标志物的表达。这种在来源于体细胞的细胞中的表达将细胞鉴定为诱导的多能干细胞。干细胞标志物可以包括但不限于ssea3、ssea4、cd9、nanog、oct4、fbx15、ecat1、esg1、eras、gdf3、fgf4、cripto、dax1、zpf296、slc2a3、rex1、utf1和nat1等。在一个实施方案中,表达nanog和ssea4的细胞被鉴定为多能的。检测此类标志物表达的方法可以包括,例如,rt
‑
pcr和检测编码多肽存在的免疫学方法,如蛋白质印迹或流式细胞术分析。细胞内标志物可以经由rt
‑
pcr最好地鉴定,而细胞表面标志物可以例如通过免疫细胞化学容易地鉴定。
102.分离的细胞的多能干细胞特征可以通过评价ipsc分化为三个胚层中每一个的细胞的能力的测试来证实。作为一个实例,裸鼠中的畸胎瘤形成可以用于评价分离克隆的多能性特征。将细胞引入裸鼠,并使用对不同种系谱系的标志物具有特异性的抗体对由细胞产生的肿瘤进行组织学和/或免疫组织化学。包含来自所有三个胚层,即内胚层、中胚层和外胚层的细胞的肿瘤的生长进一步表明或证实细胞是多能干细胞。
103.成体干细胞:成体干细胞是来源于出生后或新生期后有机体或者来自成体有机体的组织的干细胞。成体干细胞在结构上不同于胚胎干细胞,不仅在其相对于胚胎干细胞表达或不表达标志物,而且存在表观遗传差异,例如dna甲基化模式的差异。预期从成体干细胞分化的心肌细胞和/或神经元也可用于本文所述的方法。分离成体干细胞的方法描述于例如美国专利号9,206,393b2;和美国申请号2010/0166714a1;将其通过引用以其整体并入本文。体外分化
104.如本文所述的某些方法和组合物使用在体外从干细胞分化的中胚层谱系细胞。通常,在整个分化过程中,多能细胞将遵循沿着特定发育谱系的发育途径,例如原胚层
‑
外胚层、中胚层或内胚层。
105.胚胎胚层是获得所有组织和器官的来源。中胚层是例如平滑肌和横纹肌的来源,包括心肌、结缔组织、血管、心血管系统、血细胞、骨髓、骨骼、生殖器官和排泄器官。
106.胚层可以通过特定生物标志物的表达和基因表达来鉴定。检测这些生物标志物的测定包括,例如,rt
‑
pcr、免疫组织化学和蛋白质印迹。由早期中胚层细胞表达的生物标志
物的非限制性实例包括hand1、esm1、hand2、hopx、bmp10、fcn3、kdr、pdgfr
‑
α、cd34、tbx
‑
6、snail
‑
1、mesp
‑
1和gsc等。由早期外胚层细胞表达的生物标志物包括但不trpm8、pou4f1、olfm3、wnt1、lmx1a和cdh9等。由早期内胚层细胞表达的生物标志物包括但不限于lefty1、eomes、nodal和foxa2等。本领域技术人员可以基于细胞类型和发育中获得细胞的胚层来确定在进行分化方案时要监测哪些谱系标志物。
107.体外特定发育谱系的诱导是通过在促进谱系定向的特定试剂或其组合存在下培养干细胞来完成的。通常,本文所述的方法包括向细胞培养基中逐步添加试剂(例如小分子、生长因子、细胞因子、多肽、载体等)或使细胞与促进分化的试剂接触。特别地,中胚层形成由转录因子和生长因子信号传导诱导,所述生长因子信号传导包括但不限于vegt、wnt信号传导(例如经由β
‑
连环蛋白)、骨形态发生蛋白(bmp)途径、成纤维细胞生长因子(fgf)途径和tgfβ信号传导(例如活化素a)。参见例如clemens等人,cell mol life sci.(2016),将其通过引用以其整体并入本文。
108.在细胞个体发育的上下文中,术语“分化(differentiate)”或“分化(differentiating)”是相对术语,意指“分化细胞”是比其前体细胞沿发育途径进一步发展的细胞。因此,在一些实施方案中,重编程的细胞可以分化成谱系限制的前体细胞(如中胚层干细胞),其继而可以进一步沿途径分化成其它类型的前体细胞(如组织特异性前体,例如心肌细胞前体),然后分化成末期分化的细胞,其在某些组织类型中起特征性作用,并且可保留或不保留进一步增殖的能力。
109.通常,体外分化的细胞将在整个逐步过程中表现出多能性标志物(例如,hnf4
‑
α、afp、gata
‑
4和gata
‑
6)的下调,并且表现出谱系特异性生物标志物(例如,中胚层、外胚层或内胚层标志物)表达的增加。参见例如tsankov等人,nature biotech(2015),其描述了人多能干细胞系的表征和沿着特定谱系的分化。可以通过本领域已知的多种方法监测分化过程的效率。这包括使用标准技术,例如免疫细胞化学、rt
‑
pcr、流式细胞术、功能测定、光学跟踪等检测胚层生物标志物的存在。
110.在任何方面的一些实施方案中,体外分化的细胞是选自以下的中胚层谱系细胞类型:心肌细胞、骨骼肌细胞、平滑肌细胞、肾细胞、肝细胞、内皮细胞、皮肤细胞、肾上腺皮质细胞、骨细胞、白细胞和小胶质细胞。心肌细胞分化
111.在本文所述的方法和组合物的一些实施方案中,从干细胞体外分化的细胞是心肌细胞。从esc或ipsc分化心肌细胞的方法是本领域已知的。在任何方面的一些实施方案中,心肌细胞从来源于例如,如本文所述或如本领域已知的移植接受者的ipsc分化。
112.在某些实施方案中,esc或ipsc向心肌细胞的逐步分化按以下顺序进行:esc或ipsc>心原性中胚层>心脏祖细胞>心肌细胞(参见,例如,lian等人,nat prot(2013);美国申请号2017/0058263 a1;2008/0089874 a1;2006/0040389 a1;美国专利号10,155,927 b2;9,994,812 b2;和9,663,764 b2,其各自的内容通过引用以其整体并入本文)。还参见例如laflamme等人,nature biotech 25:1015
‑
1024(2007),将其通过引用以其整体并入本文。在这些分化方案中,可以向细胞培养基中加入或从细胞培养基中移除试剂,以逐步的方式指导向心肌细胞的分化。可以促进心肌细胞分化的因子和试剂的非限制性实例包括小分子(例如wnt抑制剂、gsk3抑制剂)、多肽(例如生长因子)、核酸、载体和图案化基底(例如纳
米图案)。心血管发育中必需的生长因子(包括但不限于成纤维细胞生长因子2(fgf2)、转化生长因子β(tgfβ)、超家族生长因子活化素a和bmp4、血管内皮生长因子(vegf)和wnt抑制剂dkk
‑
1)的添加也可以有益于指导沿着心脏谱系的分化。帮助促进心肌细胞分化的因子和条件的另外实例包括但不限于缺乏胰岛素的b27补充剂、细胞条件培养基、外部电起搏和纳米图案化基底等。
113.仅举例来说,胚胎干细胞或ips细胞可以在胚胎成纤维细胞条件培养基(例如,小鼠,mef
‑
cm)中培养并接种到细胞外基质(例如,由engelbreth holm
‑
swarm(ehs)小鼠肉瘤细胞分泌的明胶蛋白混合物)上。为了开始分化心肌细胞,向细胞施用含有碱性成纤维细胞生长因子(bfgf)的新培养基约6
‑
7天。7天之后,用包含b27补充剂(本文称为rpmi
‑
b27)并补充有如下细胞因子的洛斯维
·
帕克纪念研究所(roswell park memorial institute)1640培养基替代成纤维细胞条件培养基:(a)用100ng/ml人重组活化素a处理约24小时,然后(b)用10ng/ml人重组bmp4处理约4天。然后可以将培养基更换为不含补充细胞因子的rpmi
‑
b27培养基,并且每2
‑
3天向培养物补料新培养基,持续另外的2
‑
3周。
114.通常,在加入活化素a之后约12天,分化成心肌细胞的细胞在培养物中开始搏动和收缩。这可以使用标准细胞培养和显微镜技术进行监测。
115.除了体外分化的心肌细胞功能读数(例如搏动细胞)之外,体外分化的心肌细胞还将表达对成体心肌细胞具有特异性的生物标志物。心肌细胞生物标志物的非限制性实例包括心肌肌钙蛋白t(ctnt)、α
‑
辅肌动蛋白或肌球蛋白重链。尽管优选存在另外的蛋白质标志物,以及例如心肌细胞成熟的功能标志,但可用于本文所述的方法和组合物中的最低体外分化的人心肌细胞将表达心肌肌钙蛋白t。如果必要或需要,然后可以使用percoll梯度或者针对心肌细胞生物标志物(例如,肌钙蛋白t、α
‑
辅肌动蛋白、肌球蛋白重链或鱼尼丁受体2)的细胞分选技术富集心肌细胞。心肌细胞富集的实例见于例如xu等人,circ res.(2002);laflamme等人,am.j.pathol.167,663
–
671(2005);以及miltenyi bioteccharacterization by flow cytometry psc
‑
derived cardiomyocyte subtypes(2017);将其通过引用以其整体并入本文。
116.体外分化的心肌细胞成熟可以通过许多参数来评估,如细胞的电成熟、细胞的代谢成熟或体外分化细胞的收缩成熟。心肌细胞成熟蛋白、生物化学和电成熟标志物的实例见于,例如,wo2019/035032a2,将其通过引用以其整体并入本文。
117.确定细胞的电成熟的此类方法的非限制性实例包括全细胞膜片钳(手动或自动)、多电极阵列、场电位刺激、钙成像和光学标测等。可在全细胞电流钳或场电位记录期间电刺激细胞以产生电和/或收缩响应。心肌细胞的场电位和生物电位的测量可以用于确定分化阶段和细胞成熟。
118.对于心肌细胞,与参考水平相比,电成熟由一种或多种以下标志物确定:增加的一种或多种离子通道基因的基因表达、增加的钠电流密度、增加的内向整流钾通道电流密度、增加的动作电位频率、增加的钙波频率和增加的场电位频率。测量基因表达的方法是本领域已知的,例如rt
‑
pcr和转录组测序。
119.代谢测定可以用于确定如本文所述的体外分化细胞的分化阶段和细胞成熟。代谢测定的非限制性实例包括细胞生物能学测定(例如,seahorse bioscience xf细胞外通量分析仪)和氧消耗测试。具体地,细胞代谢可以通过耗氧率(ocr)、脂肪酸应激测试期间的
ocr迹线、ocr的最大变化、fccp添加之后的ocr的最大变化以及其它参数中的最大呼吸能力来定量。此外,代谢挑战或乳酸盐富集测定可以提供细胞成熟的测量或此类细胞的各种处理效果的测量。
120.例如,与参考水平相比,体外分化心肌细胞的代谢成熟由一种或多种以下标志物确定:相对于未成熟的体外分化的心肌细胞,增加的线粒体功能活性、增加的脂肪酸代谢、增加的耗氧率(ocr)、增加的磷酸化acc水平或活性、增加的脂肪酸结合蛋白(fabp)水平或活性、增加的丙酮酸脱氢酶激酶
‑
4(pdk4)水平或活性、增加的线粒体呼吸能力、增加的线粒体体积和增加的线粒体dna水平。哺乳动物细胞通常使用葡萄糖作为它们的主要能源。然而,心肌细胞能够从不同的来源如乳酸或脂肪酸产生能量。在一些实施方案中,乳酸补充的和葡萄糖耗尽的培养基或者细胞使用乳酸或脂肪酸作为能源的能力可用于鉴定成熟心肌细胞及其功能变化。
121.与参考水平相比,体外分化细胞(例如心肌细胞,骨骼肌或平滑肌)的收缩成熟通过一种或多种以下标志物确定:增加的搏动频率、增加的收缩力、增加的α
‑
肌球蛋白重链(α
‑
mhc)水平或活性、增加的肌节水平或活性、降低的循环指数、增加的肌钙蛋白水平或活性、增加的肌联蛋白n2b水平或活性、增加的细胞面积和增加的纵横比。收缩性可以通过诸如视频分析的光学跟踪方法来测量。对于视频跟踪方法,可以测量组织或单细胞的位移以确定收缩力、频率等。另外的细胞类型
122.本文所述的方法和组合物还用于或可应用于体外分化的中胚层谱系细胞,包括骨骼肌细胞、平滑肌细胞、肾细胞、内皮细胞、皮肤细胞、肾上腺皮质细胞、骨细胞、白细胞和小胶质细胞。
123.分化干细胞衍生的骨骼肌细胞、平滑肌和/或脂肪细胞的方法描述于,例如,美国专利号10,240,123b2;以及cheng等人,am j physiol cell physiol(2014)中。分化肾细胞的方法描述于例如tajiri等人,scientific reports 8:14919(2018);taguchi等人,cell stem cell 14:53
‑
67(2014);和美国申请010/0021438a1中。分化内皮细胞(例如,血管内皮)的方法描述于例如美国专利号10,344,262b2以及olgasi等人,stem cell reports 11:1391
‑
1406(2018)中。分化产生激素的细胞的方法描述于,例如,7,879,603b2以及abu
‑
bonsrah等人,stem cell reports 10:134
‑
150(2018)中。分化骨细胞的方法描述于例如csobonyeiova等人,j adv res 8:321
‑
327(2017);美国专利号7,498,170b2;6,391,297b1;以及美国申请号2010/0015164a1中。分化小胶质细胞的方法描述于例如wo 2017/152081 a1中。分化上皮细胞和皮肤细胞的方法描述于例如kim等人,stem cell research and therapy(2018);美国专利号7,794,742b2;6,902,881b2中。分化血细胞和白细胞的方法描述于,例如,美国专利号6,010,696a和6,743,634b2中。分化干细胞衍生的β细胞的方法描述于例如wo2016/100930a1中。上述参考文献中的每一篇均通过引用以其整体并入本文。富集特定细胞类型的方法
124.本文所述的干细胞、祖细胞和/或体外分化的细胞可以在小鼠胚胎成纤维细胞(mef)饲养细胞层、胶原酶iv或者基本上促进期望细胞类型的体外分化和/或维持期望细胞的成熟、存活、表型的任何其它基质或支架上培养。在一些实施方案中,使用荧光活化细胞分选(facs)、淘选方法、磁性颗粒选择、颗粒分选器选择和本领域技术人员已
知的其它方法,包括密度分离(xu等人,(2002)circ.res.91:501;u.s.s.n.20030022367)和基于其它物理特性的分离(doevendans等人,(2000)j.mol.cell.cardiol.32:839
‑
851),对给定标志物或标志物组具有特异性的抗体或类似试剂可以用于分开和非离期望的细胞。可以进行阴性选择,包括选择和去除具有不期望的标志物或特征(例如成纤维细胞标志物、上皮细胞标志物等)的细胞。
125.未分化的es细胞表达可以用作检测未分化细胞存在的标志物的基因。示例性es细胞标志物包括阶段特异性胚胎抗原(ssea)
‑
3、ssea
‑
4、tra
‑1‑
60、tra
‑1‑
81、碱性磷酸酶或者例如u.s.s.n.2003/0224411;或bhattacharya(2004)blood 103(8):2956
‑
64(各自通过引用以其整体并入本文)中所述的那些。在心脏祖细胞上表达的示例性标志物包括但不限于tmem88、gata4、isl1、myl4和nkx2
‑
5。此类标志物可以评估或用于去除或确定例如体外分化的心肌细胞群体中未分化细胞或祖细胞的存在。类似地,未分化细胞的标志物的存在(无论是胚胎标志物还是其它标志物)都可以用于评价可用于本文所述的方法和组合物中的其它中胚层谱系细胞类型的群体。降低prpf31的水平和/或活性的试剂
126.前体mrna加工因子31,也称为u4/u6小核核糖核蛋白prp31;hprp31或prpf31是基因prpf31编码的剪接体(splieceosome)的组成部分。prpf31是一种普遍表达的61
‑
kda剪接因子蛋白,其激活剪接体复合物。剪接体复合体包含多肽和小核rna(snrna),其在rna剪接过程中发挥去除内含子,即转录的前rna的非编码区的功能。prpf31的添加对于剪接体复合物向活化状态的转变是必需的(参见例如liu等人,2007,以及schaffert等人,embo j.(2014),将其通过引用以其整体并入本文)。
127.prpf31的基因、mrna和氨基酸序列是本领域已知的,例如人prpf31基因(ncbi geneid:26121))、人mrna转录物(ncbi参考序列:nm_015629.4(seq id no:4))和人氨基酸序列(ncbi参考序列:np_056444.3(seq id no:5))。
128.在某些实施方案中,本文所述的方法和组合物包括使用抑制或降低用于移植的细胞或细胞制备物(例如,用于移植的体外分化的细胞)中prpf31的水平或活性的一种或多种试剂。
129.prpf31的水平可以通过本领域已知的方法测定,例如免疫沉淀或其它下拉测定、蛋白质印迹、qpcr、rt
‑
pcr和免疫细胞化学。因此,这些方法可以用于确定给定的处理或试剂是否降低prpf31蛋白、mrna或两者的水平。用于rt
‑
pcr的引物可以基于mrna序列,例如基于seq id no:5制备。特异性结合人prpf31的抗体可得自例如novus(centennial,co)、santa cruz(dallas,tx)和(cambridge,ma),并且可用于例如检测在用降低prpf31水平的试剂处理后例如体外分化的中胚层谱系细胞,如心肌细胞等中prpf31的变化。
130.在一些实施方案中,试剂降低prpf31的活性。在一些实施方案中,与适当的对照相比,试剂将prpf31的活性降低至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或更多。
131.prpf31的活性可以通过本领域已知的任何方法测定。例如,prpf31在剪接中的活性可以使用如wilke等人,mol.vis.14:683
‑
690(2008)(将其通过引用以其整体并入)所述
基于转染的测定而构建的小基因来测定。尽管不希望受理论束缚,但预期prpf31抑制对移植细胞的存活或植入的促进的影响与prpf31在mrna剪接中的活性有关。prpf31与u4/u6 snrnp复合物中的u4 snrnp结合,并且被认为通过与u5特异性prpf6蛋白结合而在u4/u6 di
‑
snrnp与u5之间形成桥。参见例如makarova等人,embo j.21:1148
‑
1157(2002)。因此,在另一种方法中,可以通过在细胞中或在体外测定prpf31与prpf6的相互作用来评价prpf31活性,例如经由prpf31/prpf6复合物形成的共免疫沉淀或其它测定。
132.可选地,预期prpf31在促进存活和/或植入中的活性不依赖于该因子在剪接中的活性。可以评价例如与prpf31结合或促进prpf31修饰的试剂对prpf31活性的抑制。
133.在一个实施方案中,可以通过使体外分化的细胞,例如中胚层谱系的细胞,例如体外分化的心肌细胞与所述试剂接触以及将所述细胞移植到适当的动物模型中来证实降低prpf31活性的试剂的作用。然后证实相对于未处理细胞促进移植细胞存活的试剂是降低prpf31活性的试剂。
134.wilke等人的出版物还描述了测量这种复合物形成的下拉测定,以及突变的prpf31多肽,其具有在剪接时以显性负性方式作用的a216p错义突变。预期a216p突变蛋白的瞬时表达可用于降低如本文所述的方法和组合物中用于移植的体外分化细胞中的prpf31活性。
135.在任何方面的一些实施方案中,试剂是小分子、多肽、抗体、核酸分子、rnai、包含核酸分子的载体、反义寡核苷酸或基因编辑系统。
136.在一些实施方案中,试剂降低prpf31的水平。在一些实施方案中,与适当的对照相比,试剂将prpf31的水平降低至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或更多。
137.在一些实施方案中,降低prpf31的水平或活性的试剂是小分子。小分子是有机或无机分子,其可以包括但不限于肽、肽模拟物、氨基酸、氨基酸类似物、多核苷酸、多核苷酸类似物、适配体、核苷酸、核苷酸类似物、分子量小于约10,000克/摩尔的有机或无机化合物(例如,包括杂有机(heterorganic)和有机金属化合物)、分子量小于约5,000克/摩尔的有机或无机化合物、分子量小于约1,000克/摩尔的有机或无机化合物以及此类化合物的盐、酯和其它药学上可接受的形式。“小分子”的实例包括但不限于goodman and gillman’s“the pharmacological basis of therapeutics”,第13版,(2018)中所述的化合物;通过引用并入本文。用于筛选小分子的方法是本领域已知的,并且可以用于鉴定在给定期望靶标(例如prpf31多肽)的情况下例如调节prpf31水平或活性方面有效的小分子。
138.在任何方面的一些实施方案中,降低prpf31的水平或活性的试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。
139.在任何方面的一些实施方案中,抑制性核酸是抑制性rna或rna干扰分子(irna)。
140.rnai,也称为干扰rna(irna),是含有rna(或例如下文所述修饰的核酸)并经由高度保守的rna诱导的沉默复合物(risc)途径介导rna转录物的靶向切割的一类试剂中的任一种。在任何方面的一些实施方案中,如本文所述的irna影响靶标(例如prpf31)的表达和/或活性的抑制。在任何方面的一些实施方案中,使细胞与抑制剂(例如,irna)接触导致细胞中靶标mrna水平降低至少约10%、约20%、约30%、约40%、约50%、约60%、约70%、约
80%、约90%、约95%、约99%、多达并包括在不存在irna的情况下在细胞中发现的靶标mrna水平的100%。
141.在任何方面的一些实施方案中,irna可以是dsrna。dsrna包括两条rna链,其充分互补以在使用dsrna的条件下杂交形成双链体结构。dsrna的一条链(反义链)包括与靶序列基本上互补且通常完全互补的互补区。靶序列可以来源于在靶标表达期间形成的mrna的序列,例如,它可以跨越一个或多个内含子边界。另一条链(有义链)包括与反义链互补的区域,使得两条链在合适的条件下结合时杂交并形成双链体结构。在一个实施方案中,irna可以是或包括单链rna,所述单链rna通过自身互补性折叠在其自身上以形成靶向目的转录物的碱基配对的双链体。这些被称为短发夹rna或shrna,并且如果需要,可以由引入到细胞中的构建体编码。通常,双链体结构的长度为15
‑
30个碱基对(包括端值),更通常为18
‑
25个碱基对(包括端值),更通常为19
‑
24个碱基对(包括端值),并且最通常为19
‑
21个碱基对(包括端值)。类似地,与靶序列互补的区域的长度为15
‑
30个碱基对(包括端值),更通常的长度为18
‑
25个碱基对(包括端值),更通常的长度为19
‑
24个碱基对(包括端值),并且最通常的长度为19
‑
21个碱基对(包括端值)。在任何方面的一些实施方案中,dsrna的长度为15
‑
20个核苷酸(包括端值),在其它实施方案中,dsrna的长度为25
‑
30个核苷酸(包括端值)。如普通技术人员将认识到的,靶向切割的rna的靶区域最通常是较大rna分子的一部分,通常是mrna分子。在相关的情况下,mrna靶标的“一部分”是mrna靶标的连续序列,其长度足以作为rnai指导切割(即,通过risc途径切割)的底物。在某些情况下,具有短至9个碱基对的双链体的dsrna可以介导rnai指导的rna切割。最常见的靶标长度为至少15个核苷酸,优选15
‑
30个核苷酸,如上所述。
142.抑制性核酸类型的示例性实施方案可以包括例如本领域已知的sirna、shrna、mirna和/或amirna。本领域普通技术人员可以设计和测试靶向prpf31 mrna的rnai试剂。可公开获得的rnai设计软件允许本领域技术人员在给定的靶标转录物内选择一个或多个序列,所述靶标转录物是或可能介导靶基因表达的有效敲低,并且存在设计和制备rnai试剂的商业来源。在任何方面的一些实施方案中,rnai分子包含seq id no:1或seq id no:2的核酸序列。
143.在任何方面的一些实施方案中,irna(例如dsrna)的rna被化学修饰以增强稳定性或其它有益特征。本文所述的核酸可以通过本领域良好建立的方法合成和/或修饰,如在“current protocols in nucleic acid chemistry,”beaucage,s.l.等人,(edrs.),john wiley&sons,inc.,new york,ny,usa中所述的那些方法,将其在此通过引用并入本文。修饰包括,例如,(a)末端修饰,例如,5’末端修饰(磷酸化,缀合,反向连接等)、3’末端修饰(缀合,dna核苷酸,反向连接等),(b)碱基修饰,例如,用稳定碱基、去稳定碱基或与伴侣的扩展库(repertoire)碱基配对的碱基、去除碱基(无碱基核苷酸)或缀合碱基替换,(c)糖修饰(例如,在2’位或4’位)或糖的替换,以及(d)主链修饰,包括磷酸二酯键的修饰或替换。可用于本文所述实施方案的rna化合物的具体实例包括但不限于含有修饰的主链或无天然核苷间连键的rna。具有修饰主链的rna尤其包括在主链中不具有磷原子的那些。为了本说明书的目的并且如本领域有时所提及的,在核苷间主链中不具有磷原子的修饰的rna也可以被认为是寡核苷。在任何方面的一些实施方案中,修饰的rna将在其核苷间主链中具有磷原子。
144.修饰的rna主链可以包括,例如,硫代磷酸酯,手性硫代磷酸酯,二硫代磷酸酯,磷酸三酯,氨基烷基磷酸三酯,甲基和其它烷基膦酸酯,包括3
’‑
亚烷基膦酸酯和手性膦酸酯,次膦酸酯,氨基磷酸酯,包括3
’‑
氨基氨基磷酸酯和氨基烷基氨基磷酸酯,硫羰基氨基磷酸酯(thionophosphoramidates),硫羰基烷基磷酸酯(thionoalkylphosphonates),硫羰基烷基磷酸三酯和具有正常3
’‑5’
键的硼烷磷酸酯(boranophosphates),这些的2
’‑5’
连接的类似物,以及具有相反极性的那些,其中相邻的核苷单元对连接3
’‑5’
至5
’‑3’
或2
’‑5’
至5
’‑2’
。还包括各种盐、混合盐和游离酸形式。其中不包括磷原子的修饰的rna主链具有由短链烷基或环烷基核苷间连键、混合杂原子和烷基或环烷基核苷间连键、或者一个或多个短链杂原子或杂环核苷间连键形成的主链。这些包括具有吗啉代连键(部分由核苷的糖部分形成);硅氧烷主链;硫化物、亚砜和砜主链;甲酰基(formacetyl)和硫代甲酰基(thioformacetyl)主链;亚甲基甲酰基和硫代甲酰基主链;含烯烃的主链;氨基磺酸酯主链;亚甲基亚氨基和亚甲基肼基主链;磺化和磺酰胺主链;酰胺主链;其它具有混合的n、o、s和ch2组成部份,和具有杂原子主链的寡核苷,特别是
‑‑
ch2
‑‑
nh
‑‑
ch2
‑‑
、
‑‑
ch2
‑‑
n(ch3)
‑‑
o
‑‑
ch2
‑‑
[称为亚甲基(甲基亚氨基)或mmi主链]、
‑‑
ch2
‑‑
o
‑‑
n(ch3)
‑‑
ch2
‑‑
、
‑‑
ch2
‑‑
n(ch3)
‑‑
n(ch3)
‑‑
ch2—和
‑‑
n(ch3)
‑‑
ch2
‑‑
ch2
‑‑
[其中天然磷酸二酯主链表示为
‑‑
o
‑‑
p
‑‑
o
‑‑
ch2
‑‑
]的那些。
[0145]
在适合或预期用于irna的其它rna模拟物中,核苷酸单元的糖与核苷间连键,即主链均被新基团替换。保持碱基单元用于与适当的核酸靶标化合物杂交。一种这样的寡聚化合物,即已显示具有优异杂交特性的rna模拟物,被称为肽核酸(pna)。在pna化合物中,rna的糖主链被含有酰胺的主链,特别是氨基乙基甘氨酸主链替换。核碱基被保留并直接或间接地与主链的酰胺部分的氮杂氮原子结合。
[0146]
irna的rna也可以被修饰以包括一种或多种锁核酸(lna)。锁核酸是具有修饰的核糖部分的核苷酸,其中核糖部分包含连接2’和4’碳的额外的桥。这种结构有效地将核糖“锁定”在3
’‑
内切结构构象中。已经显示将锁核酸添加到sirna中增加了sirna在血清中的稳定性,并降低了脱靶效应(elmen,j.等人,(2005)nucleic acids research 33(1):439
‑
447;mook,or.等人,(2007)mol canc ther 6(3):833
‑
843;grunweller,a.等人,(2003)nucleic acids research 31(12):3185
‑
3193)。
[0147]
修饰的rna也可以含有一个或多个取代的糖部分。本文所述的irna,例如dsrna,可以在2’位包括以下之一:oh;f;o
‑
、s
‑
或n
‑
烷基;o
‑
、s
‑
或n
‑
烯基;o
‑
、s
‑
或n
‑
炔基;或o
‑
烷基
‑
o
‑
烷基,其中所述烷基、烯基和炔基可以是取代或未取代的c1
‑
c10烷基或c2
‑
c10烯基和炔基。示例性的合适修饰包括o[(ch2)no]mch3、o(ch2).noch3、o(ch2)nnh2,o(ch2)nch3、o(ch2)nonh2和o(ch2)non[(ch2)nch3)]2,其中n和m为1至约10。在任何方面的一些实施方案中,dsrna在2’位包括以下之一:c1至c10低级烷基、取代的低级烷基、烷芳基、芳烷基、o
‑
烷芳基或o
‑
芳烷基、sh、sch3、ocn、cl、br、cn、cf3、ocf3、soch3、so2ch3、ono2、no2、n3、nh2、杂环烷基、杂环烷芳基、氨基烷基氨基、聚烷基氨基、取代的甲硅烷基、rna裂解基团、报告基团、嵌入剂、用于改善irna的药代动力学特性的基团、或用于改善irna的药效动力学特性的基团、以及具有类似特性的其它取代基。在任何方面的一些实施方案中,修饰包括2’甲氧基乙氧基(2'
‑
o
‑‑
ch2ch2och3,也称为2
’‑
o
‑
(2
‑
甲氧基乙基)或2
’‑
moe)(martin等人,helv.chim.acta,1995,78:486
‑
504),即烷氧基
‑
烷氧基。另一种示例性修饰是2
’‑
二甲氨基
氧基乙氧基,即o(ch2)2on(ch3)2基团,也称为2
’‑
dmaoe(如下文实施例中所述),以及2
’‑
二甲氨基乙氧基乙氧基(在本领域中也称为2
’‑
o
‑
二甲氨基乙氧基乙基或2
’‑
dmaeoe),即2'
‑
o
‑‑
ch2
‑‑
o
‑‑
ch2
‑‑
n(ch2)2(也在下文的实施例中描述)。
[0148]
其它修饰包括2
’‑
甲氧基(2
’‑
och3)、2
’‑
氨基丙氧基(2'
‑
och2ch2ch2nh2)和2
’‑
氟(2
’‑
f)。也可在irna的rna上的其它位置进行类似的修饰,特别是在3’末端核苷酸或2
’‑5’
连接的dsrna中的糖的3’位和5’末端核苷酸的5’位。irna也可以具有糖模拟物,如环丁基部分代替戊呋喃糖基。
[0149]
抑制性核酸还可以包括核碱基(在本领域中通常简称为“碱基”)修饰或取代。如本文所用,“未修饰的”或“天然的”核碱基包括嘌呤碱基腺嘌呤(a)和鸟嘌呤(g)以及嘧啶碱基胸腺嘧啶(t)、胞嘧啶(c)和尿嘧啶(u)。修饰的核碱基包括其它合成的和天然的核碱基,如5
‑
甲基胞嘧啶(5
‑
me
‑
c)、5
‑
羟基甲基胞嘧啶、黄嘌呤、次黄嘌呤、2
‑
氨基腺嘌呤、腺嘌呤和鸟嘌呤的6
‑
甲基和其它烷基衍生物、腺嘌呤和鸟嘌呤的2
‑
丙基和其它烷基衍生物、2
‑
硫尿嘧啶、2
‑
硫代嘧啶和2
‑
硫代胞嘧啶、5
‑
卤代尿嘧啶和胞嘧啶、5
‑
丙炔基尿嘧啶和胞嘧啶、6
‑
偶氮基尿嘧啶、胞嘧啶和胸腺嘧啶、5
‑
尿嘧啶(假尿嘧啶)、4
‑
硫尿嘧啶、8
‑
卤素、8
‑
氨基、8
‑
硫醇、8
‑
硫代烷基、8
‑
羟基和其它8
‑
取代的腺嘌呤和鸟嘌呤、5
‑
卤素特别是5
‑
溴、5
‑
三氟甲基和其它5
‑
取代的尿嘧啶和胞嘧啶、7
‑
甲基鸟嘌呤和7
‑
甲基腺嘌呤、8
‑
氮杂鸟嘌呤和8
‑
氮杂腺嘌呤、7
‑
脱氮鸟嘌呤和7
‑
脱氮腺嘌呤和3
‑
脱氮鸟嘌呤和3
‑
脱氮腺嘌呤。这些核碱基中的某些对于提高本发明特征的抑制性核酸的结合亲和力是特别有用的。这些包括5
‑
取代的嘧啶、6
‑
氮杂嘧啶以及n
‑
2、n
‑
6和o
‑
6取代的嘌呤,包括2
‑
氨基丙基腺嘌呤,5
‑
丙炔基尿嘧啶和5
‑
丙炔基胞嘧啶。已经显示5
‑
甲基胞嘧啶取代将核酸双链体稳定性提高0.6
‑
1.2℃(sanghvi,y.s.,crooke,s.t.和lebleu,b.,eds.,dsrna research and applications,crc press,boca raton,1993,pp.276
‑
278),并且是示例性碱基取代,甚至更特别地当与2
’‑
o
‑
甲氧基乙基糖修饰组合时。
[0150]
上述修饰的核酸、主链和核碱基的制备是本领域已知的。
[0151]
本发明中特征的抑制性核酸的另一种修饰包括将抑制性核酸与一种或多种配体、部分或缀合物化学连接,所述配体、部分或缀合物增强irna的活性、细胞分布、药代动力学特性或细胞摄取。此类部分包括但不限于脂质部分,如胆固醇部分(letsinger等人,proc.natl.acid.sci.usa,1989,86:6553
‑
6556),胆酸(manoharan等人,biorg.med.chem.let.,1994,4:1053
‑
1060),硫醚,例如,铍基
‑
s
‑
三苯甲基硫醇(beryl
‑
s
‑
tritylthiol)(manoharan等人,ann.n.y.acad.sci.,1992,660:306
‑
309;manoharan等人,biorg.med.chem.let.,1993,3:2765
‑
2770),巯基胆固醇(oberhauser等人,nucl.acids res.,1992,20:533
‑
538),脂族链,例如十二烷二醇或十一烷基残基(saison
‑
behmoaras等人,embo j,1991,10:1111
‑
1118;kabanov等人,febs lett.,1990,259:327
‑
330;svinarchuk等人,biochimie,1993,75:49
‑
54),磷脂,例如二
‑
十六烷基
‑
rac
‑
甘油或三乙基
‑
铵1,2
‑
二
‑
o
‑
十六烷基
‑
rac
‑
甘油
‑3‑
膦酸酯(manoharan等人,tetrahedron lett.,1995,36:3651
‑
3654;shea等人,nucl.acids res.,1990,18:3777
‑
3783),多胺或聚乙二醇链(manoharan等人,nucleosides&nucleotides,1995,14:969
‑
973),或金刚烷乙酸(manoharan等人,tetrahedron lett.,1995,36:3651
‑
3654),棕榈基部分(mishra等人,biochim.biophys.acta,1995,1264:229
‑
237),或十八烷基胺或己基氨基
‑
羰基氧基胆固醇
部分(crooke等人,j.pharmacol.exp.ther.,1996,277:923
‑
937)。
[0152]
在任何方面的一个实施方案中,降低prpf31的试剂是反义寡核苷酸,例如,具有与靶mrna序列互补的序列的核酸。反义寡核苷酸通常被设计成通过与靶标杂交以及在转录、翻译或剪接水平中止表达来阻断dna或rna靶标的表达。本文所述的反义寡核苷酸被设计成在典型的细胞内条件下与靶标杂交。因此,选择与靶标充分互补的寡核苷酸,即,在细胞环境的背景下充分良好地且以足够的特异性杂交,以产生期望的效果。例如,降低prpf31水平的反义寡核苷酸可以分别包含至少10个、至少15个、至少20个、至少25个、至少30个或更多个与人prpf31基因的编码序列(例如,seq id no:4
‑
5)的一部分互补的碱基。
[0153]
在任何方面的一些实施方案中,试剂是适配体。适配体通常由相对较短的寡核苷酸组成,所述较短的寡核苷酸的长度范围通常为20至80个核苷酸,例如,至少20个核苷酸、至少30个核苷酸、至少40个核苷酸、至少50个核苷酸、至少60个核苷酸、至少70个核苷酸、或80个核苷酸或更多。适配体可以连接到较长的序列上,例如在适配体的一端或另一端,尽管影响适配体二级结构的附加序列可影响适配体功能。适配体的功能活性,即与给定的靶分子结合,涉及适配体中的部分或元件与靶分子上的部分或元件之间的相互作用。适配体通常通过与靶标(例如蛋白质)的非共价相互作用与特定靶标结合,所述非共价相互作用包括但不限于静电相互作用、疏水相互作用和/或它们的互补形状。本领域技术人员最初可以使用本领域已知的计算机模型,例如unpack、aptani、3d
‑
dart、moderna或统一的核酸折叠和杂交包(unified nucleic acid folding and hybridization package,unafold),或任何其它寡核苷酸结构预测模型来设计靶向prpf31的适配体。在这样的设计后,可以合成分子并测试其结合和抑制活性(如本领域已知的)。需要时,可以由编码适配体序列的构建体在细胞中表达适配体。
[0154]
本文所述的降低prpf31的水平或活性的核酸可以商购获得,使用例如核苷亚磷酰胺或其它方法化学合成,或者通过dna或rna提取方法从生物样品中分离。这些分离方法包括但不限于柱纯化、乙醇沉淀、苯酚
‑
氯仿提取或酸性硫氰酸胍
‑
苯酚氯仿提取(agpc)。
[0155]
在某些实施方案中,载体可用于表达本文所述的降低本文所述的体外分化细胞中prpf31的水平或活性的试剂,其包括但不限于一种或多种多肽、肽、核酶、肽核酸、sirna或rnai分子,包括例如反义寡核苷酸、反义多核苷酸、sirna、shrna、微rna及其反义对应物(例如,antagomir)、抗体、抗原结合片段或其任何组合。
1.载体是设计用于递送至宿主细胞或用于在不同宿主细胞之间转移遗传物质的核酸构建体。如本文所用,载体可以是病毒或非病毒的。术语“载体”涵盖当与适当的控制元件结合时能够复制并且能够将遗传物质转移到细胞中的任何遗传元件。载体可以包括但不限于克隆载体、表达载体、质粒、噬菌体、转座子、粘粒、人工染色体、病毒、病毒体等。
[0156]
在任何方面的一些实施方案中,载体选自质粒和病毒载体。
[0157]
表达载体是指导rna或多肽(例如抗prpf31抗体)从其中包含的与载体上的转录调节序列连接的核酸序列表达的载体。表达的序列通常但不一定是细胞异源的。表达载体可以包含另外的元件,例如,表达载体可以具有两个复制系统,从而允许其在两种有机体中维持,例如在用于表达的人细胞中和在用于克隆和扩增的原核生物宿主中维持。“表达”是指参与产生rna和蛋白质的细胞过程,并且在适当的情况下分泌蛋白质,在适用情况下包括但不限于例如转录、转录物加工、翻译和蛋白质折叠、修饰和加工。“表达产物”包括从基因转
录的rna和通过翻译从基因转录的mrna获得的多肽。
[0158]
整合载体将其递送的rna/dna永久掺入到宿主细胞染色体中。非整合载体保持游离型,这意味着其中包含的核酸从不整合到宿主细胞染色体中。整合载体的实例包括逆转录病毒载体、慢病毒载体、杂合腺病毒载体和单纯疱疹病毒载体。
[0159]
非整合载体包括非整合病毒载体。非整合病毒载体消除了整合逆转录病毒造成的主要风险之一,因为它们不会将其基因组整合到宿主dna中。一个实例是epstein barr orip/核抗原
‑
1(“ebna1”)载体,其能够进行有限的自我复制并且已知在哺乳动物细胞中起作用。包含来自爱泼斯坦病毒(epstein
‑
barr virus)orip和ebna1的两个元件,ebna1蛋白与病毒复制子区orip的结合在哺乳动物细胞中维持质粒的相对长期的附加体存在。orip/ebna1载体的这种特定特征使其理想地用于产生无整合的宿主细胞。其它非整合性病毒载体包括腺病毒载体和腺相关病毒(aav)载体。
[0160]
另一种非整合病毒载体是rna仙台病毒载体,其可以在不进入感染细胞的细胞核的情况下产生蛋白。f缺陷型仙台病毒载体在感染细胞的细胞质中保留几代,但在几代(例如,10代)后被迅速稀释并完全丢失。这允许所选择的异源基因在靶细胞中的自限性瞬时表达。
[0161]
非整合载体的另一个实例是微环载体。微环载体是环状载体,其中质粒骨架已被释放,仅留下真核启动子和待表达的cdna。
[0162]
如上所述,在一些实施方案中,本文所述的试剂在细胞中由病毒载体表达。“病毒载体”包括核酸载体构建体,其包括病毒来源的至少一个元件并且具有包装到病毒载体颗粒中的能力。病毒载体可以含有编码如本文所述的多肽试剂的核酸来代替非必需病毒基因。载体和/或颗粒可用于在体外或体内将核酸转移到细胞中的目的。
[0163]
在一些实施方案中,本文所述的核酸和载体可用于在体外或体内向细胞提供反义核酸、rnai、适配体或包含核酸的载体。本文所述的核酸可使用促进核酸进入细胞的任何转染试剂或其它物理手段递送。用于向细胞施用、递送核酸或使细胞与核酸接触的方法和组合物是本领域已知的,例如脂质体、纳米颗粒、外来体、纳米胶囊、缀合物、醇、富含聚赖氨酸的化合物、富含精氨酸的化合物、磷酸钙、微泡、显微注射和电穿孔。“增加细胞摄取的试剂”是促进分子,例如核酸或肽或多肽或本来不能有效地穿过脂质膜而经过细胞膜的其它分子转运的分子。例如,核酸可以与亲脂性化合物(例如,胆固醇、生育酚等),细胞穿透肽(cpp)(例如,穿透素、tat、syn1b等)或多胺(例如,精胺)缀合。增加细胞摄取的试剂的其它实例公开于例如winkler(2013).oligonucleotide conjugates for therapeutic applications.ther.deliv.4(7);791
‑
809中。
[0164]
本领域已知的测定可用于测试核酸递送至体外分化的细胞或组织的效率。本领域技术人员可以通过测量期望转基因的mrna和/或蛋白质水平(例如,经由逆转录pcr、蛋白质印迹分析和酶联免疫吸附测定(elisa))来评估引入的效率。在一些实施方案中,本文所述的载体包含报告蛋白,其可用于评估期望转基因的表达,例如通过荧光显微镜或发光板读数器检查报告蛋白的表达。
[0165]
在一些实施方案中,降低prpf31的水平或活性的试剂是编码多肽的核酸或编码多肽的载体。多肽可以涵盖单数“多肽(polypeptide)”以及复数“多肽(polypeptides)”,并且包括两个或更多个氨基酸的任何链。本领域中存在多核苷酸和多肽结构的常规命名法。例
如,单字母和三字母缩写被广泛用于描述氨基酸:丙氨酸(a;ala)、精氨酸(r;arg)、天冬酰胺(n;asn)、天冬氨酸(d;asp)、半胱氨酸(c;cys)、谷氨酰胺(q;gln)、谷氨酸(e;glu)、甘氨酸(g;gly)、组氨酸(h;his)、异亮氨酸(i;ile)、亮氨酸(l;leu)、甲硫氨酸(m;met)、苯丙氨酸(f;phe)、脯氨酸(p;pro)、丝氨酸(s、ser)、苏氨酸(t;thr)、色氨酸(w;trp)、酪氨酸(y;tyr)、缬氨酸(v;val)和赖氨酸(k;lys)。本文提供的氨基酸残基优选为“l”异构形式。然而,“d”异构形式的残基可以取代任何l
‑
氨基酸残基,前提是保留了多肽的期望特性。
[0166]
在一些实施方案中,降低prpf31的水平或活性的试剂是融合多肽。在一些实施方案中,降低prpf31的水平或活性的试剂是抗体、胞内抗体(intrabody)、编码抗体的核酸、编码胞内抗体的核酸或其片段。在一些实施方案中,抗体、胞内抗体或其片段通过靶向细胞中的prpf31来抑制或减少剪接体的组装。
[0167]
本文所述的“抗体”涵盖任何抗体或抗体片段(即功能性抗体片段),或保留与期望抗原或表位(例如prfp31)的抗原结合活性的抗原结合片段。在一个实施方案中,抗体或其抗原结合片段包含免疫球蛋白链或其片段和至少一个免疫球蛋白可变结构域序列。抗体的实例包括但不限于scfv、fab片段、fab'、f(ab')2、单域抗体(dab)、重链、轻链、重链和轻链、完整抗体(例如,包括fc、fab、重链、轻链、可变区等中的每一个)、双特异性抗体、双链抗体(diabody)、线性抗体、单链抗体、胞内抗体、单克隆抗体、嵌合抗体或多聚体抗体。此外,抗体可以来源于任何哺乳动物,例如灵长类动物、人、大鼠、小鼠、美洲驼、马、山羊等。在一个实施方案中,抗体是人的或人源化的。在一些实施方案中,抗体是修饰的抗体。在一些实施方案中,抗体的组分可以单独表达,使得抗体在表达两种或更多种蛋白组分后自组装。在一个实施方案中,抗体或其抗原结合片段包含构架区或fc区。抗体片段可以保留完整抗体活性的10
‑
99%(例如,10
‑
90%、10
‑
80%、10
‑
70%、10
‑
60%、10
‑
50%、10
‑
40%、10
‑
30%、10
‑
20%、50
‑
99%、50
‑
90%、50
‑
80%、50
‑
70%、50
‑
60%、20
‑
99%、30
‑
99%、40
‑
99%、60
‑
99%、70
‑
99%、80
‑
99%、90
‑
99%或其间的任何活性)。本文还预期功能性抗体片段包含大于完整抗体活性(例如,至少2倍或更高)的活性。在另一个实施方案中,抗体片段包含对其靶标的亲和力,其基本上类似于完整抗体对相同靶标(例如表位)的亲和力。
[0168]
本文所述的抗体或免疫球蛋白分子可以是任何类型(例如igg、ige、igm、igd、iga和igy),类别(例如igg1、igg2、igg3、igg4、iga1和iga2)或免疫球蛋白分子的亚类,如本领域技术人员所理解的。此外,在人中,轻链可以是κ链或λ链。
[0169]
抗体分子的抗原结合结构域是参与抗原结合的抗体分子(例如免疫球蛋白(ig)分子)的一部分。抗体的抗原结合位点通常由重链(h)和轻链(l)可变区(v)的氨基酸残基形成。在称为高变区的重链和轻链的可变区内的三个高度发散的区段设置在称为“框架区”(fr)的更保守的侧翼区段之间。fr是天然存在于免疫球蛋白的高变区之间并与其相邻的氨基酸序列。在典型的抗体分子中,轻链的三个高变区和重链的三个高变区相对于彼此设置在三维空间中以形成抗原结合表面,其与结合抗原的三维表面互补。每个重链和轻链的三个高变区被称为“互补决定区”或“cdr”。框架区和cdr已经在例如kabat,e.a.等人,(1991)sequences of proteins of immunological interest,第五版,u.s.department of health and human services,nih publication no.91
‑
3242,以及chothia,c.等人,(1987)j.mol.biol.196:901
‑
917中定义和描述。每个可变链(例如,可变重链和可变轻链)通常由以氨基酸顺序从氨基末端到羧基末端排列的三个cdr和四个fr组成:fr1、cdr1、fr2、
cdr2、fr3、cdr3和fr4。抗体可变区内的cdr赋予抗原特异性和结合亲和力。通常,在每个重链可变区中有三个cdr(hcdr1、hcdr2、hcdr3),以及在每个轻链可变区中有三个cdr(lcdr1、lcdr2、lcdr3)。给定cdr的精确氨基酸序列边界可使用许多已知方案中的任一种来确定,包括kabat等人,(1991),“sequences of proteins of immunological interest,”5th ed.public health service,national institutes of health,bethesda,md.(“kabat”编号方案),al
‑
lazikani等人,(1997)jmb 273,927
‑
948(“chothia”编号方案)中所述的那些。根据“chothia”编号方案定义的cdr有时也称为“高变环”。例如,在kabat下,人重链可变区(vh)中的cdr氨基酸残基编号为31
‑
35(hcdr1)、50
‑
65(hcdr2)和95
‑
102(hcdr3);人轻链可变结构域(vl)中的cdr氨基酸残基编号为24
‑
34(lcdr1)、50
‑
56(lcdr2)和89
‑
97(lcdr3)。在chothia下,vh中的cdr氨基酸编号为26
‑
32(hcdr1)、52
‑
56(hcdr2)和95
‑
102(hcdr3);vl中的氨基酸残基编号为26
‑
32(lcdr1)、50
‑
52(lcdr2)和91
‑
96(lcdr3)。每个vh和vl通常包括从氨基末端到羧基末端按以下顺序排列的三个cdr和四个fr:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
[0170]
全长抗体通常是免疫球蛋白(ig)分子(例如igg、ige、igm抗体),例如,其是天然存在的,并且通过正常免疫球蛋白基因片段重组过程形成。
[0171]
功能性抗体片段或抗原结合片段与完整(例如全长)抗体所识别的抗原或表位结合相同的抗原或表位。术语“抗体片段”或“功能片段”还包括由可变区组成的分离的片段,如由重链和轻链的可变区组成的“fv”片段或其中轻链和重链可变区通过肽接头(“scfv蛋白”)连接的重组单链多肽分子。在一些实施方案中,抗体片段不包括没有抗原结合活性的抗体部分,如fc片段或单个氨基酸残基。在一些实施方案中,功能性抗体片段保留完整或全长抗体的至少20%的活性,例如如通过测量靶蛋白(例如prpf31)的抑制程度所评估的。在其它实施方案中,功能性抗体片段保留完整抗体的至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或甚至100%(即,基本上类似)的活性。本文还预期与完整抗体相比,功能性抗体片段将包含增加的活性(例如,至少1倍、至少2倍、至少5倍、至少10倍、至少100倍或更多)。
[0172]
当需要胞内抗体时,即在细胞中表达以靶向细胞内抗原,例如prpf31的抗体时,编码抗prpf31抗体或融合蛋白的核酸或基因通常不编码分泌序列。胞内抗体可以包括scfv。在一些情况下,它可以编码分泌序列,但也具有预期的靶向序列。在其它实施方案中,胞内抗体基因编码另一种细胞内靶向序列,例如核定位序列。因此,通过掺入信号传导基序,如c
‑
末端er保留信号、线粒体靶向序列、核定位序列等,可以将胞内抗体导向特定的细胞区室。
[0173]
在一些实施方案中,降低prpf31的水平或活性的试剂是prpf31的显性负性突变体或者包含一个或多个点突变的prpf31。这种prpf31突变是本领域已知的,并且例如由vithana等人,mol cell.(2001);deery等人,hum mol gen.(2002);waseem等人,invest.ophtal.vis.sci.(2007);以及rio frio clin invest.(2008)描述,其各自通过引用以其整体并入本文。移植组合物
[0174]
在一个方面,本文描述了促进移植的人体外分化细胞的存活和/或植入的方法,所述方法包括使人体外分化的细胞与降低prpf31的水平或活性的试剂接触,以及将所述细胞
移植到有需要的对象的组织中。在一些实施方案中,体外分化的细胞是中胚层谱系的。在一些实施方案中,体外分化的细胞是心肌细胞。体外分化的细胞可以是任何上述细胞,或如本领域已知的在体外分化的其它中胚层谱系细胞。
[0175]
对于用降低prpf31的水平或活性的试剂处理细胞,用该试剂处理的制剂、剂量和时间将随试剂的性质而变化。例如,可以仅将穿过细胞质膜的小分子或其它试剂施用至维持细胞的培养基中,而不容易穿过质膜的小分子或其它试剂可以与促进递送到细胞中的部分一起配制。确定给定试剂是否将通过其自身的质膜,例如通过被动转运运输,或者是否需要与促进或有助于膜转运的另一种试剂或实体一起配制的因素论述在例如综述文章“getting across the cell membrane:an overview for small molecules,peptides,and proteins,”,yang&hinner,methods mol.biol.1266:29
‑
53(2015)中,将其通过引用以其整体并入本文。作者注意到小的非极性气体如氧气、二氧化碳和氮气及小的极性分子如乙醇容易穿过膜,但是甚至稍微大一些的代谢物如尿素和甘油具有较低的渗透性,并且质膜实际上不能渗透较大的不带电荷的极性分子和所有带电的分子,包括离子。因此,对于许多肽、多肽、寡核苷酸或多核苷酸以及许多有机化合物和小分子,需要考虑采用其它机制的方法。
[0176]
许多分子,包括糖(葡萄糖、半乳糖、果糖),氨基酸和核苷酸通过膜转运蛋白转运穿过细胞膜。将希望跨膜转运的试剂与转运蛋白的天然底物缀合可以将一些试剂有效地递送至胞液。参见,例如,dahan等人,expert opin.drug deliv.9:1001
‑
1013(2012)以及majumdar et al.,adv.drug deliv.rev.56:1437
‑
1452(2004),其各自通过引用并入本文。
[0177]
膜的有限机械破坏可用于将小分子至蛋白质范围内的试剂引入细胞中。因此,电穿孔、含有期望试剂的溶液中迫使细胞通过微流体通道的装置(参见,例如,sharei等人,proc.natl.acad.sci.u.s.a.110:2082
‑
2087(2013))和穿透细胞膜的硅纳米线(shalek等人,proc.natl.acad.sci.u.s.a.107:1870
‑
1875(2010))可以促进培养的细胞对试剂的摄取。
[0178]
试剂与细胞穿透肽(cpp)的缀合也可以促进大分子(包括蛋白质)的摄取。cpps的实例包括病毒tat肽(参见,例如,fawell等人,proc.natl.acad.sci.u.s.a.91:664
‑
668(1994),nagahara等人,nat.med.4:1449
‑
1452(1998)以及langel,handbook of cell
‑
penetrating peptides.2
nd
.boca raton:crc press(2010))和两亲性pep
‑
1肽(参见例如morris等人,nat.biotechnol.19:1173
‑
1176(2001))。可以促进缀合的货物蛋白试剂的摄取的其它蛋白包括,例如,自身抗体3e10,其可以跨细胞膜转运,已经被提出渗透到核中(参见,例如,hansen等人,sci.transl.med.4 157ra142(2012))以及显示跨细胞膜递送外源磷酸酶(参见,例如,lawlor等人,hum.mol.genet.22:1525
‑
1538(2013))。可选地,已经报道将蛋白质试剂包装在病毒样颗粒中或将它们连接到工程化的噬菌体t4头以促进胞质递送(参见,例如,kaczmarczyk等人,proc.natl.acad.sci.u.s.a.108:16998
‑
17003(2011)以及tao等人,proc.natl.acad.sci.u.s.a.110:5846
‑
5851(2013))。所引用的每篇参考文献通过引用并入本文中。
[0179]
用于跨细胞膜递送试剂的基于脂质和聚合物的制剂包括将试剂封装在脂质体中的那些制剂或将试剂与脂质复合的那些制剂。对于将核酸(例如,sirna、反义寡核苷酸、核酶、适配体、编码蛋白质试剂的构建体、shrna、反义表达盒、适配体等)引入细胞,此类方法
是良好确立的。用于脂质转染的商业制剂是容易获得的,例如lipofectamine
tm
(thermofisher scientific)转染试剂等。已经报道阳离子脂质和中性脂质的混合物转运带负电荷的蛋白质(参见,例如,zelphati等人,j.biol.chem.276:35103
‑
35110(2001)以及torchilin,drug discov.today technol.5:e95
‑
e103(2008),将其各自通过引用并入本文)。包括聚乙烯亚胺(pei)和聚
‑
β
‑
氨基酯纳米颗粒的基于聚合物的制剂在施用至细胞时增强了包括蛋白质在内的货物的内体逃逸(参见,例如,behr,chim.int.j.chem.51:34
‑
36(1997)以及su等人,biomacromolecules 14:1093
‑
1102(2013),将其各自通过引用并入本文)。递送制剂的其它实例包括但不限于多层囊泡(mlv)、单层囊泡(umv)、peg包被的脂质体、外来体、纳米颗粒和(promega corporation,madison wi)。
[0180]
本领域已知的任何这些或其它方法或制剂可以应用于如本文所述的用于将降低prpf31水平或活性的试剂引入体外分化细胞的给定试剂。
[0181]
在递送本文所述的试剂的上下文中,术语“接触”、“递送(delivering)”或“递送(delivery)”旨在涵盖从细胞外部递送降低prpf31的水平或活性的试剂和在细胞内例如通过核酸构建体或载体的表达递送。例如,通过向细胞培养基中加入试剂,可以从细胞外部引入本文所述的试剂,本文所述的体外分化细胞在所述细胞培养基中维持或生长。可选地,可以通过在细胞内由外源构建体(例如,病毒或其它表达载体)表达来递送本文所述的试剂。此类构建体可以是游离的或稳定地整合在细胞基因组中。在一个实施方案中,使体外分化的中胚层谱系细胞或心肌细胞与本文所述的试剂接触的步骤包括使用由构建体稳定表达试剂的细胞。在另一个实施方案中,使体外分化的细胞或心肌细胞与本文所述的试剂接触的步骤包括使用由构建体瞬时表达试剂的细胞。
[0182]
关于剂量,降低prpf31的水平或活性的试剂的用量将取决于试剂和制剂的性质。因此,将无需与另一种试剂缀合或复合物形成而通过细胞膜的试剂可以以皮摩尔至微摩尔浓度应用于培养的细胞,所述浓度可以经由剂量反应滴定以直接的方式优化。需要与用于跨膜递送的另一种试剂缀合或复合物形成的试剂也可以在一定浓度范围内滴定以有效敲低prpf31 mrna、蛋白质或活性。一旦鉴定了敲低prpf31的水平或活性的工作范围,就可以使用体内实验来鉴定为存活和/或植入提供最佳结果的剂量,在体内实验中,将处理过的细胞注射或以其它方式施用至例如动物模型。
[0183]
在本文的实施例中显示了以5纳摩尔(nm)浓度靶向prpf31(例如,seq id no:1)的sirna,以在经由脂质转染引入时对体外分化的心肌细胞提供有益效果。在实践中,浓度可以例如在0.5nm至50nm或其间的任何浓度变化。
[0184]
关于时间,用给定的试剂或制剂处理细胞的持续时间和相对于向对象施用处理的细胞的此类处理的时间也可以随着试剂的性质和细胞的性质(例如,心肌细胞对比肾、骨或其它中胚层谱系细胞类型)而变化。然而,本领域普通技术人员可以确定对于给定的试剂和制剂,将细胞处理多长时间以实现最佳的prpf31抑制或敲低,以及在向对象施用细胞之前多长时间开始细胞的处理。通常,关于细胞施用的计划时间,需要更长时间来实现敲低或抑制的试剂应该更早地施用。在任何方面的一些实施方案中,在将细胞施用至对象之前1
‑
48小时,例如在将细胞施用至对象之前1
‑
36小时、1
‑
24小时、1
‑
18小时、1
‑
12小时、1
‑
6小时、1
‑
4小时或1
‑
2小时,使体外分化的细胞与降低prpf31的水平或活性的试剂接触。在任何方面的一些实施方案中,使细胞与降低prpf31的水平或活性的试剂在将所述细胞施用至对象之
前至少1小时、之前至少2小时、之前至少3小时、之前至少4小时、之前至少6小时、之前至少8小时、之前至少10小时、之前至少12小时、之前至少14小时、之前至少16小时、之前至少18小时、之前至少24小时、之前至少30小时、之前至少36小时、之前至少42小时或之前至少48小时接触。
[0185]
如本文所述的移植组合物包含用与药学上可接受的载体混合的降低体外分化的细胞中prpf31的水平或活性的试剂处理那些细胞。移植组合物可以被配制用于例如通过注射施用至需要修复或功能增强的组织或器官。可选地,移植组合物可以配制在如本文所述或如本领域已知的支架上或支架中,例如,以帮助将移植的细胞保留在给定的物理位置或进一步增加存活和/或植入。与支架缔合的细胞也可以被配制用于注射,例如,其中支架是具有流体稠度的凝胶或其它基质。可选地,在支架更牢固时,可以配制与支架缔合的细胞以应用于组织或器官或通过外科手术植入到组织或器官中或者植入到组织或器官上。
[0186]
本领域技术人员可以根据例如待修复的损伤程度和细胞类型来确定移植或植入所需的细胞数目。例如,如本文所述的体外分化的心肌细胞可以施用于需要改善心脏功能的对象。在一些实施方案中,向对象施用约1千万至约100亿个心肌细胞。为了用于本文所述的各个方面,有效量的人心肌细胞可以包含至少1x107、至少2x107、至少3x107、至少4x107、至少5x107、至少6x107、至少7x107、至少8x107、至少9x107、至少1x108、至少2x108、至少3x108、至少4x108、至少5x108、至少6x108、至少7x108、至少8x108、至少9x108、至少1x109、至少2x109、至少3x109、至少4x109、至少5x109、至少6x109、至少7x109、至少8x109、至少9x109、至少1x109、至少1x10
10
或更多个细胞用于移植或植入。类似数目的其它体外分化的中胚层谱系细胞可以用于移植或植入到不同的组织。
[0187]
虽然本文所述的用于植入或移植的细胞通常是完全分化的,但它们可以具有有限的增殖潜力,这意味着优选长期存活和/或植入,并且降低细胞中prpf31的水平或活性的处理可以促进此类存活和植入。还预期在一些实施方案中,可以如本文所述对从多能干细胞体外分化的细胞至从期望细胞类型向上游发育的中胚层谱系的干细胞或前体细胞进行处理,以降低prpf31的水平或活性并施用,使得处理的细胞在施用至对象后之后数目扩增并分化。
[0188]
在一些实施方案中,本文所述的移植组合物将缺少或基本上缺少降低prpf31水平的试剂。也就是说,细胞可以在体外用该试剂瞬时处理,然后在没有该试剂的情况下配制用于移植。在该背景下的“基本上缺乏”是指移植组合物或制剂仅在处理之后和施用之前或施用过程中具有保留在细胞中的试剂。这不是必需的,但在一些实施方案中,并且根据试剂的性质和与其一起使用的递送制剂,在配制用于移植之前,从培养的贴壁细胞中洗去或除去试剂可能是有利的。在其它实施方案中,预期细胞可以在包含试剂的移植组合物中(例如在具有细胞的溶液或悬液中)配制和施用。支架组合物
[0189]
在一个方面,本文所述的体外分化的细胞可以与提供支架或基底以支持细胞的制剂混合或者在所述制剂之中或之上生长。支架是包含生物相容性材料(其包括但不限于凝胶、片材、基质或晶格)的结构,其可以在期望位置包含细胞,但允许因子进入存活和功能所必需的环境或者允许因子在存活和功能所必需的环境中扩散。适用于支架的多种生物相容性聚合物是本领域已知的。
[0190]
此类支架或基底可以在将细胞固定在给定位置(例如在植入之后)提供物理优势,以及在提供例如用于进一步成熟的细胞外信号(extracellular cues)或例如维持表型直到细胞建立提供生物化学优势。
[0191]
生物相容性合成、天然以及半合成聚合物可用于合成可用作支架材料的聚合物颗粒。通常,为了实施本文所述的方法,优选支架生物降解,使得体外分化的细胞可以在植入之前从聚合物中分离,或者使得支架在对象中随时间降解并且不需要去除。因此,在一个实施方案中,支架提供用于体外分化细胞的生长和/或递送至有需要的对象的临时结构。在一些实施方案中,支架允许人细胞以适于移植或施用至有需要的对象的形状生长,从而允许在植入之前移除支架并降低支架本身引发的排斥或过敏反应的风险。
[0192]
可以使用的聚合物的实例包括天然聚合物和合成聚合物,尽管合成聚合物对于再现性和控制释放动力学是优选的。可使用的合成聚合物包括可生物降解的聚合物,如聚(丙交酯)(pla)、聚(乙醇酸)(pga)、聚(丙交酯
‑
共
‑
乙交酯)(plga或pla/pga共聚物)以及其它聚羟基酸、聚(己内酯)、聚碳酸酯、聚酰胺、聚酐、聚磷腈、聚氨基酸、聚原酸酯、聚缩醛、聚氰基丙烯酸酯和可生物降解的聚氨酯;生物不可降解的聚合物,如聚丙烯酸酯、乙烯
‑
乙酸乙烯酯聚合物和其它酰基取代的纤维素乙酸酯及其衍生物;聚氨酯,聚苯乙烯,聚氯乙烯,聚氟乙烯,聚(乙烯基咪唑),氯磺化聚烯烃和聚环氧乙烷。可生物降解的天然聚合物的实例包括蛋白质如白蛋白、胶原、纤维蛋白和丝织物,多糖如藻酸盐、肝素和糖单元的其它天然存在的可生物降解的聚合物。可选地,可以使用上述聚合物的组合。在一个方面,可以使用通常不存在于细胞外基质中的天然聚合物。
[0193]
pla、pga和pla/pga共聚物特别用于形成可生物降解的支架。pla聚合物通常由乳酸的环酯制备。l(+)和d(
‑
)形式的乳酸均可以用于制备pla聚合物,以及d(
‑
)和l(+)乳酸的不旋光的dl
‑
乳酸混合物。制备聚交酯的方法在专利文献中有充分的记载。以下美国专利(其教导在此通过引用并入)详细描述了合适的聚交酯,它们的特性和它们的制备:dorough的美国专利第1,995,970号;schneider的美国专利第2,703,316号;salzberg的美国专利第2,758,987号;zeile的美国专利第2,951,828号;higgins的美国专利第2,676,945号;以及trehu的美国专利第2,683,136号;第3,531,561号。
[0194]
pga是乙醇酸(羟基乙酸)的均聚物。在乙醇酸向聚(乙醇酸)的转化中,乙醇酸最初与自身反应以形成环酯乙交酯,其在热和催化剂的存在下转化为高分子量直链聚合物。pga聚合物及其特性更详细地描述于cyanamid research develops world's first synthetic absorbable suture",chemistry and industry,905(1970)中。
[0195]
纤维可以通过熔融纺丝、挤出、浇铸或聚合物加工领域中熟知的其它技术形成。如果用于在植入之前去除支架,则优选的溶剂是通过加工完全去除的溶剂或加工后剩余量的生物相容性的溶剂。
[0196]
用于基质中的聚合物应该满足为细胞提供足够的支持以及随后的生长和增殖所必需的机械和生化参数。可以使用instron测试仪表征聚合物的机械性能,如拉伸强度,通过凝胶渗透色谱法(gpc)表征聚合物的聚合物分子量,通过差示扫描量热法(dsc)表征聚合物的玻璃化转变温度,通过红外(ir)光谱表征聚合物的键结构。
[0197]
基底或支架可以是纳米图案化的或微图案化的,具有允许生长并促进支架上心脏细胞或组织的成熟的凹槽和脊。支架可以是任何期望的形状并且可以包括可用于本文所述
的方法的宽范围的几何形状。形状的非限制性列表包括例如补片(patches)、中空颗粒、管、片材、圆柱体、球体和纤维等。支架的形状或尺寸不应大幅阻止细胞生长、细胞分化、细胞增殖或任何其它细胞过程,支架也不应经由例如细胞凋亡或坏死诱导细胞死亡。此外,应注意确保支架形状允许营养物从周围介质递送到群体中细胞的适当表面积,从而不损害细胞活力。本领域技术人员还可以根据需要改变支架孔隙率。
[0198]
在一些实施方案中,通过用化合物如基底膜组分,纤连蛋白,琼脂,琼脂糖,明胶,阿拉伯树胶,i型、ii型、iii型、iv型和v型胶原,层粘连蛋白,糖胺聚糖,聚乙烯醇,其混合物,以及细胞培养或组织工程领域技术人员已知的其它亲水性和肽附着材料(peptide attachment materials)包被聚合物来增强细胞与聚合物的连接。用于包被聚合物支架的材料的实例包括聚乙烯醇和胶原。如本领域技术人员将理解的,matrigel
tm
不适合施用于人类对象,因此本文所述的组合物不包括matrigel
tm
。
[0199]
在一些实施方案中,可能需要向支架添加生物活性分子/因子。可以使用本文所述的基质递送多种生物活性分子。
[0200]
在一个实施方案中,生物活性因子包括生长因子。生长因子的实例包括血小板衍生生长因子(pdgf)、转化生长因子α或β(tgfβ)、骨形态发生蛋白4(bmp4)、成纤维细胞生长因子7(fgf7)、成纤维细胞生长因子10(fgf10)、表皮生长因子(egf/tgfβ)、血管内皮生长因子(vegf),其中一些也是血管生成因子。这些因子是本领域技术人员已知的并且可商购获得或描述于文献中。生物活性分子可以掺入基质中并通过基质的扩散和/或降解随时间释放,或者它们可以与细胞悬液一起悬浮。药学上可接受的载体
[0201]
用降低prpf31水平或活性的试剂处理的体外分化细胞可以通过与药学上可接受的载体混合而配制用于移植。如本文所用,术语“药学上可接受的”、“生理学上可耐受的”及其语法变体,当它们是指组合物、载体、稀释剂和试剂时,可互换使用,并且表示材料能够施用至哺乳动物或施用在哺乳动物上,而不产生不期望的生理学效应,如毒性、移植排斥、变态反应等。药学上可接受的载体将不会促进对与之混合的试剂的免疫应答的提高,除非这样需要。
[0202]
通常,本文所述的包含体外分化细胞的组合物作为包含细胞与药学上可接受的载体组合的液体悬浮液制剂施用。本领域技术人员将认识到,在移植组合物中使用的药学上可接受的载体将不包括以基本上干扰待递送至对象的细胞活力的量的缓冲剂、化合物、冷冻保存剂、防腐剂或其它试剂。包含细胞的制剂可以包括例如允许维持细胞膜完整性的渗透缓冲液以及任选地,在施用时维持细胞活力或增强植入的营养物。此类制剂和悬浮液是本领域技术人员已知的和/或可以使用常规实验适应于与本文所述的细胞一起使用。
[0203]
移植组合物可以任选地含有另外的生物活性成分,其进一步促进施用的细胞或任选地组合物所施用的组织、器官或对象的存活、植入或功能。实例包括但不限于生长因子、营养物、止痛剂、抗炎药和小分子药物,如激酶活化剂等。
[0204]
用于移植组合物的细胞悬液的生理学上可耐受的载体包括无菌生理盐水溶液,其不包含除细胞以外的另外材料或包含缓冲液如生理ph值的磷酸钠,如磷酸盐缓冲盐水。此外,水性载体可以含有一种以上的缓冲盐以及盐,如氯化钠和氯化钾,右旋糖,聚乙二醇和其它溶质。
施用与功效
[0205]
本文描述了促进移植的体外分化的人细胞(包括中胚层谱系的细胞,包括但不限于心肌细胞)的存活和/或植入的组合物和方法。用降低prpf31的水平或活性的试剂处理的细胞的移植可以涉及将包含在悬浮液(含有或没有基质或支架)中的细胞的移植组合物注射到期望位置,例如需要修复的组织中。可选地,移植可以涉及将包含在基质中或支架上的细胞的移植组合物手术放置到期望位置、组织或器官(例如需要修复的组织或器官)之上或之中。
[0206]
可以通过本领域已知的任何方法,例如,通过监测移植后的组织或器官功能来确定移植细胞的存活或植入。功效的测量的或可测量的参数包括临床上可检测的功能或疾病的标志物,例如,临床或生物标志物的升高或降低的水平、功能参数以及与用于健康或疾病或病症的临床上接受的症状或标志物的等级相关的参数。可以通过组织学和分子方法定量或定性地确定移植细胞的存活和植入。在一种方法中,存活和植入可以在适当的动物模型(例如,如本文实施例中所论述的nod scidγ小鼠模型)中评价。使用这种模型,可以注射人细胞,然后通过测量接受者组织(例如心脏组织)中的人特异性标志物来评价存活和植入。简而言之,注射的细胞数目对比移植的数目的测量提供了植入效率的测量。组织中活的移植细胞的测量提供了存活的测量。移植细胞的活力可以通过几种方法中的任一种来确定或测量,包括例如针对人标志物的组织学和/或免疫组织化学。细胞来自移植的鉴定是基于人标志物的存在,并且细胞的形态和/或它们在组织中的组织可以指示细胞活力。作为一个实例,除了在心脏组织中存在收缩带外,马森弹性三色染色(masson elastic trichrome)或movat五色组织学染色还特别可用于评估间质纤维化,心肌细胞坏死和杂乱(disarray)。可选地,可以使用激光捕获显微解剖和人dna序列(例如,人alu重复序列)的定量。作为评价移植物存活的另一种选择,可以定量匀浆组织(例如心脏组织)中的人dna序列。例如,可以将用或不用prpf31抑制剂处理的细胞,例如心肌细胞移植到多只小鼠的组织,例如心脏组织中。在移植之后的选定时间点,可以收获来自单个小鼠的组织并评价人dna的存在和/或量,作为移植细胞的维持或持久性的量度。
[0207]
本文所用的术语“有效量”是指减轻疾病或病症的至少一种或多种症状(包括但不限于损伤、疾病或病症)所需的如本文所述处理的体外分化细胞群体的量。“有效量”涉及提供期望效果的组合物的足够量,这取决于施用的细胞类型和所解决的疾病或病症,例如治疗心肌梗塞后具有梗塞区域的对象、改善心肌细胞植入、预防心脏损伤后心力衰竭的发作、增强移植物的血管化、增强肾功能等所必需的量。因此,术语“治疗有效量”是指用降低prpf31水平或活性的试剂处理的人体外分化细胞或者包含此类细胞的组合物的量,当施用至典型对象(如患有心脏疾病或处于心脏疾病病风险的对象等)时,其足以促进特定效果。本文所用的有效量还包括足以预防或延迟疾病症状的发展,改变疾病症状的进程(例如但不限于减缓疾病症状的进展)或逆转疾病症状的量。应理解,对于任何给定的情况,适当的“有效量”可以由本领域普通技术人员使用常规实验来确定。
[0208]
在一些实施方案中,在根据本文所述的方法施用细胞之前,首先诊断对象患有影响包含体外分化类型的细胞的组织或器官的疾病或病症。在一些实施方案中,在施用细胞之前,首先诊断对象处于发展疾病(例如,心肌损伤或肾病后的心力衰竭)或病症的风险中。
[0209]
如上所述,为了用于本文所述的各个方面,有效量的人心肌细胞为至少1x107、至
少2x107、至少3x107、至少4x107、至少5x107、至少6x107、至少7x107、至少8x107、至少9x107、至少1x108、至少2x108、至少3x108、至少4x108、至少5x108、至少6x108、至少7x108、至少8x108、至少9x108、至少1x109、至少2x109、至少3x109、至少4x109、至少5x109、至少6x109、至少7x109、至少8x109、至少9x109、至少1x109、至少1x10
10
个或更多个细胞用于移植或植入。类似数目的其它体外分化的中胚层谱系细胞可以用于移植或植入到不同的组织。细胞或包含它们的移植组合物的有效量最初可以通过使用适当的动物模型来估计。作为一个实例,心肌梗塞的鼠、犬和猪模型是已知的,并且可以用于测量对于治疗有效的细胞或包含它们的移植组合物的量。
[0210]
在一些实施方案中,包含用降低prpf31水平或活性的试剂处理的人体外分化细胞的组合物允许比在不进行此类处理的情况下施用此类细胞时的植入高至少20%的效率将所述细胞植入期望的组织或器官中;在其它实施方案中,此类效率是在没有此类处理的情况下施用细胞时移入的效率的至少30%,至少40%,至少50%,至少60%,至少70%,至少80%,至少90%,至少1倍,至少2倍,至少5倍,至少10倍,至少100倍或更多倍。
[0211]
当细胞是体外分化的心肌细胞时,通过心脏内施用或递送将有效量的心肌细胞施用至对象。在此上下文中,“心脏内”施用或递送是指所有施用途径,由此以导致这些细胞与对象的心肌直接接触的方式施用心肌细胞群体,包括但不限于直接心脏注射、心肌内注射、梗塞区内注射、缺血或缺血周围区域注射、注射到壁变薄的区域中、注射到处于不适应心脏重塑风险的区域、在手术期间(例如心脏搭桥手术、在心脏微型泵或起搏器的植入期间等)注射或植入。在一些这样的实施方案中,将细胞注射到心肌(例如心肌细胞)中,或注射到心房和/或心室的腔中。在一些实施方案中,细胞的心脏内递送包括施用方法,由此将细胞例如作为细胞悬液经由单次注射或多次“微型”注射施用至经历手术的对象心脏的期望区域中。
[0212]
制剂的选择将取决于所使用的具体组合物和待施用的经处理细胞的数目;此类制剂可以由熟练的从业者调整。然而,作为实例,当组合物包含在药学上可接受的载体中的心肌细胞时,组合物可以是以细胞/ml溶液的有效浓度在适当的缓冲液(例如,盐水缓冲液)中的细胞悬液。制剂还可以包含细胞营养物、单糖(例如,用于渗透压调节)或其它维持细胞活力的组分。可选地,如上文所述,制剂可以包含支架,例如如本文所述或如本领域已知的可生物降解的支架。
[0213]
在一些实施方案中,可以在用所述细胞治疗之前或之后施用有助于对象治疗的另外的试剂。此类另外的试剂可以用于,例如,制备用于细胞施用的靶组织。可选地,可以在细胞之后施用另外的试剂以支持所施用的细胞移入和生长或整合到组织或器官中。在一些实施方案中,另外的试剂包含生长因子,如vegf、pdgf、fgf、afgf、bfgf、igf或notch信号传导化合物。可以使用其它示例性试剂,例如,以减少心肌细胞移植时心脏上的负荷(例如,β阻断剂、降低血压的药物等)。
[0214]
在任何方面的一些实施方案中,另外的试剂从施用处理的细胞之前至少1小时、至少5小时、至少10小时、至少15小时、至少20小时、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天、至少7天、至少8天、至少9天、至少10天开始施用。在任何方面的一些实施方案中,另外的试剂与处理的细胞的施用同时或在其之后施用。
[0215]
治疗的功效可以由熟练的临床医生确定。然而,如果在施用包含如本文所述的经
处理的细胞的移植组合物之后,疾病,例如心脏疾病、心力衰竭、心脏损伤或心脏病症、肾病或病症等的任何一种或全部症状或者其它临床上接受的症状或标志物减少例如至少10%,并且包括例如至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%或更多,治疗被认为是如本文所用的术语“有效治疗”。测量这些指标的方法是本领域技术人员已知的和/或本文所述的。
[0216]
在移植的细胞是心肌细胞时,心脏疾病或心脏病症或心脏损伤的指标包括功能指标或参数,例如,心博量、心率、左心室射血分数、心律、血压、心脏容量、反流等,以及生化指标,如心脏损伤的标志物如血清乳酸脱氢酶或血清肌钙蛋白等的降低。作为一个实例,心肌缺血和再灌注与降低的心脏功能有关。当与缺血和/或再灌注之前相比,已经经历缺血心脏事件和/或已经接受再灌注治疗的对象具有降低的心脏功能。心脏功能的测量包括例如射血分数和缩短分数(fractional shortening)。射血分数是随着每次心跳从心室泵出的血液分数。术语“射血分数”适用于右心室和左心室。lvef是指左心室射血分数(lvef)。缩短分数是指舒张末期与收缩末期尺寸之差除以舒张末期尺寸。
[0217]
可以用于评估心脏功能参数的临床测试的非限制性实例包括超声心动图(具有或没有多普勒血流成像)、心电图(ekg)、运动应激测试、动态心电图(holter monitoring)或利钠肽(例如,心房利钠肽)的测量。
[0218]
在必要或需要时,可以使用损伤或疾病的动物模型来测量如本文所述的特定组合物的有效性。例如,可以使用分离的工作兔或大鼠心脏模型,或者犬或猪中的冠状动脉结扎模型。心脏功能的动物模型可用于监测梗塞区域、冠状动脉灌注、电传导、左心室舒张末期压、左心室射血分数、心率、血压、肥大程度、舒张松弛功能、心输出量、心率变异性和心室壁厚度等。
[0219]
为了监测移植细胞的植入或存活,可以例如,通过引入指导标志物表达的构建体来标示或标记细胞,所述标志物例如但不限于gfp或其它荧光蛋白或表位标签。当将表达此类标志物的细胞施用至动物模型时,可以测量任何细胞的功能参数,但也可以在施用细胞后移除组织,并例如,经由荧光显微镜或免疫组织化学测试或测定标志物的表达。因此,标志物表达的持久性或水平可用于测量本文所述的细胞处理在使用此类动物模型增强或促进细胞存活和/或植入方面的功效。
[0220]
除了用降低prpf31的水平或活性的试剂处理细胞之外,当细胞是心肌细胞时,本领域已知的促进或增强移植的心肌细胞的存活、植入、成熟和/或功能的其它方法或处理可以在施用处理的细胞之前、同时或平行或之后进行。参见,例如,wo2018/170280,其描述了心外膜细胞与体外分化的心肌细胞的体外分化和共移植等。还发现此类治疗促进心肌细胞植入以及增强移植后的心脏功能。wo2018/170280通过引用以其整体并入本文,但特别注意其中描述的用于心肌细胞移植、心肌细胞成熟度的标志物和测量、与心外膜细胞的共移植、移植物植入的测量、存活和/或功能、以及此类移植功效的测量的方法。
[0221]
在其它实施方案中,本文所述的移植组合物可用于治疗疾病或改善存活,例如以降低心血管疾病的发作、严重程度的发生率。治疗性治疗的功效可以通过功能输出(例如测量心输出量或肾功能),标志物,水平或表达(例如心肌酶的血清水平、缺血的标志物、肾功能或功能不全)和/或电图手段(例如心电图)来评估疾病症状是否存在。此外,如本领域技术人员将理解的,修饰本文所述的移植组合物的能力可以允许它们基于对象的特定症状组
和/或疾病的严重程度定制治疗,并且进一步使副作用或毒性最小化。
[0222]
本文所述的组合物和方法的一些实施方案可以根据以下编号的段落中的任一个来定义:1.组合物,其包含从干细胞体外分化的人细胞和降低前体mrna加工因子31(prpf31)的水平或活性的试剂。2.如段落1所述的组合物,其中所述从干细胞体外分化的细胞是心肌细胞。3.如段落1
‑
2中任一项所述的组合物,其中所述从干细胞体外分化的细胞是中胚层谱系细胞。4.如段落1
‑
3中任一项所述的组合物,其中所述体外分化的细胞是选自以下的细胞类型:心肌细胞、骨骼肌细胞、平滑肌细胞、肾细胞、内皮细胞、皮肤细胞、肾上腺皮质细胞、骨细胞、白细胞和小胶质细胞。5.如段落1
‑
4中任一项所述的组合物,其中所述体外分化的人细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。6.如段落1
‑
5中任一项所述的组合物,其中所述干细胞来源于健康对象。7.如段落1
‑
6中任一项所述的组合物,其中所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。8.如段落1
‑
7中任一项所述的组合物,其中所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。9.如段落7所述的组合物,其中所述载体选自质粒和病毒载体。10.如段落8所述的组合物,其中所述rnai分子包含seq id no:1的核酸序列。11.用于移植到接受者的移植组合物,所述组合物包含已经与降低prpf31的水平或活性的试剂接触的体外分化的人心肌细胞和药学上可接受的载体。12.如段落11所述的移植组合物,其中所述试剂选自小分子、多肽、核酸分子或包含核酸分子的载体。13.如段落11
‑
12中任一项所述的移植组合物,其中所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。14.如段落12所述的移植组合物,其中所述载体选自质粒和病毒载体。15.如段落13所述的移植组合物,其中所述rnai分子包含seq id no:1的核酸序列。16.如段落11
‑
15中任一项所述的移植组合物,其中所述体外分化的人心肌细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。17.如段落11
‑
16中任一项所述的移植组合物,其中所述心肌细胞从来源于所述移植接受者的ipsc分化。18.移植体外分化的人心肌细胞的方法,所述方法包括将已经与降低prpf31的水平或活性的试剂接触的体外分化的人心肌细胞移植到对象的心脏组织中。19.如段落18所述的方法,其中所述接触的心肌细胞相比未接触所述试剂的心肌细胞在移植后更大程度地存活。20.如段落18
‑
19中任一项所述的方法,其中所述对象患有心肌梗塞。
21.如段落18
‑
20中任一项所述的方法,其中所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。22.如段落18
‑
20中任一项所述的方法,其中所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。23.如段落21所述的方法,其中所述载体选自质粒和病毒载体。24.如段落22所述的方法,其中所述rnai分子包含seq id no:1的核酸序列。25.如段落18
‑
24中任一项所述的方法,其中所述人心肌细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。26.如段落25所述的方法,其中所述ipsc来源于所述对象。27.如段落25所述的方法,其中所述ipsc来源于健康供体。28.促进移植的人体外分化的心肌细胞存活和/或植入的方法,所述方法包括使人体外分化的心肌细胞与降低prpf31水平或活性的试剂接触,以及将所述细胞移植到有需要的人对象的心脏组织中。29.如段落28中任一项所述的方法,其中所述对象患有心肌梗塞。30.如段落28
‑
29中任一项所述的方法,其中所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。31.如段落28
‑
30中任一项所述的方法,其中所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。32.如段落30所述的方法,其中所述载体选自质粒和病毒载体。33.如段落31所述的方法,其中所述rnai分子包含seq id no:1的核酸序列。34.促进移植的中胚层谱系细胞存活和/或植入的方法,所述方法包括:向有需要的对象施用与降低所述对象中prpf31的水平或活性的试剂接触或者用其处理的中胚层谱系细胞。35.如段落34所述的方法,其中所述中胚层衍生细胞是体外分化的中胚层谱系细胞。36.如段落35所述的方法,其中所述中胚层谱系细胞在体外从ips细胞或胚胎干细胞分化。37.如段落34
‑
36中任一项所述的方法,其中所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。38.如段落37所述的方法,其中所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。39.如段落37所述的方法,其中所述载体选自质粒和病毒载体。40.如段落38所述的方法,其中所述rnai分子包含seq id no:1的核酸序列。41.如段落36
‑
40中任一项所述的方法,其中所述ipsc来源于所述对象。42.如段落36
‑
40中任一项所述的方法,其中所述ipsc来源于健康供体。43.如段落34
‑
42中任一项所述的方法,其中所述移植的中胚层谱系细胞是选自以下的细胞类型:心肌细胞、骨骼肌细胞、平滑肌细胞、肾细胞、内皮细胞、皮肤细胞、肾上腺皮质细胞、骨细胞、白细胞和小胶质细胞。44.用于移植到接受者的移植组合物,所述组合物包含已经与降低prpf31的水平
或活性的试剂接触或者用其处理的体外分化的中胚层谱系细胞和药学上可接受的载体。45.如段落44所述的移植组合物,其中所述试剂选自小分子、多肽、核酸分子或包含核酸分子的载体。46.如段落44
‑
45中任一项所述的移植组合物,其中所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。47.如段落45所述的移植组合物,其中所述载体选自质粒和病毒载体。48.如段落46所述的移植组合物,其中所述rnai分子包含seq id no:1的核酸序列。49.如段落44
‑
48中任一项所述的移植组合物,其中所述体外分化的中胚层谱系细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。50.如段落44
‑
49中任一项所述的移植组合物,其中所述中胚层谱系细胞从来源于移植接受者的ipsc分化。51.移植体外分化的中胚层谱系细胞的方法,所述方法包括将已经与降低prpf31的水平或活性的试剂接触或者用其处理的体外分化的中胚层谱系细胞移植到对象的组织中。52.如段落51所述的方法,其中所述接触的体外分化的中胚层谱系细胞相比未接触所述试剂的体外分化的中胚层谱系细胞在移植后更大程度地存活。53.如段落51
‑
52中任一项所述的方法,其中所述对象患有心肌梗塞。54.如段落51
‑
53中任一项所述的方法,其中所述试剂是小分子、多肽、核酸分子或包含核酸分子的载体。55.如段落51
‑
54中任一项所述的方法,其中所述试剂包含或编码核酸分子,所述核酸分子包含靶向prpf31或其rna转录物的反义序列、适配体或rna干扰分子(rnai)。56.如段落54中任一项所述的方法,其中所述载体选自质粒和病毒载体。57.如段落55所述的方法,其中所述rnai分子包含seq id no:1的核酸序列。58.如段落51
‑
57中任一项所述的方法,其中所述中胚层谱系细胞从诱导的多能干细胞(ipsc)或从胚胎干细胞分化。59.如段落58所述的方法,其中所述ipsc来源于所述对象。60.如段落58所述的方法,其中所述ipsc来源于健康供体。61.如段落51
‑
60中任一项所述的方法,其中所述移植的中胚层谱系细胞是选自以下的细胞类型:心肌细胞、骨骼肌细胞、平滑肌细胞、肾细胞、内皮细胞、皮肤细胞、肾上腺皮质细胞、骨细胞、白细胞和小胶质细胞。
[0223]
除非另有说明,否则本文使用的所有技术和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同的含义。
[0224]
应理解,本公开内容不限于本文所述的特定方法、方案和试剂等,并且因此可以变化。本文所用的术语仅出于描述特定实施方案的目的,且不旨在限制仅由权利要求限定的本公开内容的范围。
[0225]
为了描述和公开例如在可能结合本公开内容使用的这类出版物中描述的方法,在本文中通过引用明确地并入鉴定的所有专利和其它出版物。在本技术的申请日之前,这些
出版物仅出于它们的公开内容而提供。在这方面的任何内容均不应被解释为承认本技术的发明人无权凭借先前公开内容或出于任何其它原因而先于此类公开内容。关于这些文件的内容的日期或代表的所有陈述都是基于申请人可获得的信息,并且不构成对这些文件的日期或内容的正确性的任何认可。
实施例
实施例1:通过prpf31基因表达敲低改善移植的干细胞衍生的心肌细胞的存活背景
[0226]
lamacchia等人(2015)描述了在低渗和低氧胁迫条件下敲低一组基因对秀丽隐杆线虫(c.elegans)存活的影响。选择候选基因列表用于测试其在人多能干细胞衍生的心肌细胞(hpsc
‑
cm)中的敲低效应。基于以下标准选择6种候选基因。首先,它们在秀丽隐杆线虫模型中显示出稳健的效果。其次,人同系物显示与秀丽隐杆线虫基因的高序列同一性。下面的表1包括选择用于分析的六种候选基因。表1:候选基因基因敲低
[0227]
在来源于rues2胚胎干细胞系的hpsc
‑
cm中进行基因敲低。对于每个目的基因,使用脂质体rnaimax(thermo fisher)温育48小时,用5nm sirna转染hpsc
‑
cm。对照是未处理的或用阴性对照杂乱的sirna转染的。通过定量rtpcr证实敲低的效率。将所得细胞冷冻保存用于移植(图1)。移植
[0228]
对于移植,雄性nod scidγ(nsg)小鼠通过永久闭塞左前降支而经受心肌梗塞。在闭塞之后立即将在10μl rpmi培养基中的2.5
×
105个细胞注射到梗塞部位的左心室壁中。注射后三天,处死小鼠,收集心脏,并在液氮中快速冷冻,用于随后的分析。组织分析
[0229]
用dneasy blood and tissue kit(qiagen)根据制造商的说明从心脏组织分离dna。使用sybr mastermix(applied biosystems)和cfx connect pcr仪器(biorad)通过定量pcr测定所得dna样品中人alu序列的存在。人alu元件引物是gtc agg aga tcg aga cca tcc c(正向)和tcc tgc ctc agc ctc cca ag(反向),如robey等人(2008)所述。掺入到
100ng天然小鼠心脏dna中的1
‑
100,000pg的人dna用于在每个测定中产生标准曲线。结果
[0230]
与未处理的和对照的sirna处理的hpsc
‑
cm相比,具有prpf31敲低的hpsc
‑
cm的存活增加(分别为p=0.008和p=0.007;未配对t检验)(图2)。结果总结
[0231]
注意,尽管六种不同基因中的每一种在秀丽隐杆线虫中敲除后显示出稳健的存活增强,但只有一种,即prpf31在小鼠模型中提供了移植心肌细胞存活的益处。基于这些结果,下调prpf31表达可以改善移植的哺乳动物细胞如体外分化的hpsc
‑
cm的植入/存活。参考文献
[0232]
lamacchia jc,frazier hn,iii,roth mb(2015)glycogen fuels survival during hyposmotic
‑
anoxic stress in caenorhabditis elegans.genetics 201:65
‑
74.
[0233]
robey te,saiget mk,reinecke h,murry ce(2008)systems approaches to preventing transplanted cell death in cardiac repair.j mol cell cardiol 45(4):567
‑
581.序列seq id no:1sirna序列cgggauaaguacucaaagatt作为替代,seq id no:1的3’端的tt突出端可以被uu取代(seq id no:3)。seq id no:2sirna反义链ucuuugaguacuuaucccggaseq id no:4
‑
智人(homo sapiens)前体mrna加工因子31(prpf31),mrna ncbi参考序列:nm_015629.4
seq id no:5
‑
u4/u6小核核糖核蛋白prp31[智人]ncbi参考序列:xp_006723200.1
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1