使用复合电磁场对疼痛进行多模态或多路复用电调制的方法和设备与流程
使用复合电磁场对疼痛进行多模态或多路复用电调制的方法和设备
1.相关申请的交叉引用
2.本技术要求2019年5月6日提交的且标题为“使用关于差异目标的多路复用电信号来调制神经组织中的细胞活性的方法和设备”的第62/843,757号美国临时申请的优先权和权益,所述美国临时申请的全部内容具体地说以引用的方式并入本文中。
3.本技术还要求2020年1月22日提交的且标题为“使用复合电磁场对疼痛进行多模态电调制的方法和设备”的第62/964,281号美国临时申请的优先权和权益,所述美国临时申请的全部内容具体地说以引用的方式并入本文中。
技术领域
4.本公开涉及用于提供对神经结构的多模态或多路复用刺激的系统和方法,并且更具体地说,涉及用于用具有特性参数的多个组分的电磁信号来控制疼痛的系统和方法。
背景技术:
5.术语脊髓刺激(scs)用于描述对慢性疼痛的高级控制疗法,其中经由植入在硬膜外腔中的电极阵列(或多个电极阵列)将变化电场施加到脊髓的背侧区段(dc)。也被称为强直的传统scs传统上利用在40
‑
250hz之间变化的电场,通过用由刺激电场产生的被称为感觉异常的感知麻刺感覆盖经靶向疼痛位置来针对所述经靶向目标疼痛位置。此疗法已在临床上利用了约半个世纪。主要作用模式是基于由melzack和wall制定的闸门控制理论,尽管对所述机制的充分理解尚未阐明。强直scs背后的概念是通过所施加变化电场引发的感觉异常屏蔽行进到大脑的疼痛信号,或“为所述疼痛信号关闭闸门”,然而,频率、波形形状、幅度和脉冲宽度与scs借以提供镇痛效果的机制之间的关系尚未充分理解。
技术实现要素:
6.本文中公开了用于通过使用其中电磁信号具有特性频率、幅度和相位极性的多个组分的对神经结构的多模态刺激来控制患者的疼痛的设备和方法。根据本公开,用于疼痛控制的多模态调制考虑使用振荡电磁场,所述电磁场经由电极(被称作接触件或导线)的阵列使用时间和幅度特性施加到特定神经结构以调制神经胶质和神经元相互作用作为用于缓解慢性疼痛的机制。更具体地说,示例性方面提供了一种用于在脊髓(sc)和背根神经节(drg)两者中调制参与包含炎症/免疫系统介质、离子通道和神经递质的多种途径的基因的表达的设备和方法。在一个示例性实施例中,此类表达调制是通过脊髓刺激或外周神经刺激引起的。在一个实施例中,用于产生对神经结构的多模态刺激的一个或多个信号的幅度和频率可针对可植入多模态信号产生器中的疼痛缓解和低功率用途进行优化,如本文中所描述。
7.根据一个示例性实施例,提供设备和方法以用于通过使用多路复用刺激信号来靶向不同神经结构使得多个刺激信号在时域中多路复用,在下文被称作“差异目标多路复用
刺激”,来控制患者的疼痛。举例来说,信号产生器可多路复用可具有不同信号特性(例如,脉冲频率、幅度或脉冲持续时间)的信号以产生用于疼痛控制的差异目标多路复用刺激。根据本公开的方面,信号产生器的输出可用于产生可施加到多个电极(亦被称作接触件)的不同集合的单独振荡电磁场(刺激信号)。电极可为经设计以将相应刺激信号施加到特定神经结构的不同部分的导线的部分。
8.本公开的各种方面涉及使用多种时间和幅度特性以便调制神经胶质和神经元相互作用作为用于缓解慢性疼痛的机制。多路复用刺激信号具有允许以差异方式协同靶向神经胶质细胞和神经元的特性。举例来说,公开了涉及用于调制参与同神经组织中的神经胶质和神经元的相互作用相关联的包含炎症/免疫系统介质、离子通道和神经递质的多种途径的基因和蛋白质的表达的设备和方法的实施例。在实施例中,此类表达调制可通过脊髓刺激、背根神经节刺激、脑部刺激或外周神经刺激中的任一个引起。在实施例中,组合以产生对神经结构的差异目标多路复用刺激的信号的幅度、相位极性、波形和频率可针对可植入信号产生器中的疼痛缓解和低功率用途进行优化,如本文中所描述。
9.在差异目标多路复用刺激疗法的实施例中,利用高频电荷平衡双相脉冲信号集,其中高频信号的第一相位的极性可为阴极或阳极。在实施例中,使用低频信号集,其可具有与高频信号的波形特性不同的波形特性。双相电荷平衡低频信号的第一相位的极性可为阴极或阳极。高频和低频刺激信号可经由相应电极集合通过对来自每一电极的个别脉冲进行多路复用来递送到神经组织。在某些实施例中,相应电极集合可共同定位成非常接近于同一神经组织(例如,在同一椎骨附近)。
10.根据本公开的一个方面,一种用于控制受试者的疼痛的方法包括通过调节用于钙结合、细胞因子、细胞粘附或特异性免疫反应的基因和蛋白质中的任一个来调制受刺激神经组织中的神经胶质细胞的活性。在一个实施例中,调制神经胶质细胞的活性包括使神经胶质细胞暴露于包括多个信号组分的刺激。所述方法还包括与神经元活性的调节相关的神经元基因和蛋白质的同步调制,例如离子通道、神经递质释放或细胞内钙调节。在实施例中,调制神经元的活性包括使神经元暴露于包括多个信号组分的刺激。在不受理论束缚的情况下,认为不同类型的目标细胞(神经胶质细胞和神经元)的靶向调制有助于使由于神经系统的敏化而已受慢性疼痛病况的发展影响的神经胶质细胞相互作用正常化。
11.根据本公开的方面,一种用于通过使用一个或多个电极阵列内的多个电极来将差异目标多路复用刺激提供到各种神经组织位置来控制受试者的疼痛的方法,所述电极位于中枢或外周神经系统内的相关解剖位置中,适合于各种身体部位的疼痛。在实施例中,电极阵列以脊柱内方式定位在硬膜外腔内以便接近脊髓的不同方面、或背根神经节所位于的孔或脊髓圆锥上方和下方的侧腔以便刺激背神经根。用差异目标多路复用信号刺激这些解剖位置中的神经组织可缓解与各种病理病况相关联的颈部、上肢、躯干、腰部和下肢的慢性疼痛。在另一实施例中,电极阵列可定位成接近不同解剖位置中的损伤外周神经。电极阵列也可放置在运动皮层或脑深层结构中以递送差异目标多路复用刺激且为各种病理病况提供缓解。
12.根据本公开的另一方面,一种差异目标多路复用刺激系统包括:存储器,其用于存储多个信号参数程序;选择装置,其用于选择多个信号参数程序中的一个;信号产生器,其可由多个信号参数程序中的所选择者控制;以及输出单元,其用于连接到至少一个电极阵
列;其中刺激系统被配置成经由输出单元将具有至少一个神经胶质刺激信号和至少一个神经元刺激信号的多个电信号提供到至少一个电极阵列。神经胶质刺激信号和神经元刺激信号中的每一个可为组合具有不同参数的多个脉冲电信号的结果。此类参数可包含脉冲频率、脉冲宽度、脉冲幅度、主动或被动电荷平衡模式、占空比等中的任一个。在实施例中,系统进一步包括包围差异目标多路复用信号产生器和输出单元的生物兼容性材料的罩壳。在另一实施例中,选择装置被配置成用于接收用于修改构成差异目标多路复用刺激信号的多个信号的相应电参数中的任一个的用户可定义指令。
13.根据本公开的又另一方面,一种用于控制受试者的疼痛的方法包括使用一个或多个电信号来调制受刺激神经组织中的神经元的激活。对神经元的调制可包含降低神经元的去极化的阈值,以及用差异目标多路复用信号激活或去激活受试者的神经组织中的神经传递。同步地,方法可包含使用调制受刺激神经组织中的神经胶质细胞的激活的一个或多个电信号。对神经胶质细胞的调制可包含降低微神经胶质、少突胶质细胞和星形胶质细胞的激活,增加神经胶质的神经保护效果,调节与神经胶质激活相关联的神经递质,以及调节由神经胶质细胞控制的蜂窝状通信过程。在实施例中,由对受试者的神经组织中的神经元和神经胶质细胞的差异目标多路复用刺激提供的电信号的特性具有不同的相应脉冲频率、脉冲幅度、脉冲宽度、电荷平衡模式、占空比、相间延迟和相位极性中的任一个。在另一实施例中,差异地靶向神经组织区域的神经元和神经胶质细胞的多路复用信号中的每一个可由单个电脉冲信号或由两个或更多个不同电脉冲信号的组合提供。
14.根据本公开的另一方面,一种用于控制受试者的疼痛的方法包括通过降低神经元的去极化的阈值以及用差异目标多路复用信号激活或去激活受试者的神经组织中的神经传递来调制神经元的活性;以及通过降低微神经胶质、少突胶质细胞和星形胶质细胞的激活、增加神经胶质细胞的神经保护效果、调节与神经胶质激活相关联的神经递质以及调节由神经胶质细胞控制的蜂窝状通信过程来调制神经胶质细胞的活性。对神经元活性和神经胶质细胞活性的调制是使用具有独特特性的脉冲电信号来实现的,所述特性例如频率、幅度、脉冲宽度、电荷平衡模式、相位极性、占空比和相间延迟,并且所述脉冲电信号可同步或在彼此不相同的两个不同时间段内递送;其中这些差异目标多路复用刺激信号改变了神经结构内的神经元和神经胶质细胞的突触可塑性,并且重新建立了存在于非慢性疼痛状态中的神经胶质相互作用所需的平衡。
15.根据另一方面,本公开提供了一种用于控制受试者的疼痛的方法,其包括通过降低神经元的去极化的阈值以及用差异目标多路复用信号激活或去激活受试者的神经组织中的神经传递来调制神经元的活性;以及通过降低微神经胶质、少突胶质细胞和星形胶质细胞的激活、增加神经胶质细胞的神经保护效果、调节与神经胶质激活相关联的神经递质,以及调节由神经胶质细胞控制的细胞通信过程来调制神经胶质细胞的活性;其中对多路复用信号的相应特性的操纵改变了受试者的神经组织内的神经元和神经胶质细胞的突触可塑性。
16.本文中还公开了一种设备,其包括被配置成用于与一个或多个电极阵列电耦合以差异地靶向神经组织中的神经元和神经胶质细胞的多路复用信号产生模块。
17.任选地,差异目标多路复用信号产生模块被布置成用于产生多个电信号,所述多个电信号可被组合成可递送到一个或多个电极阵列的多路复用信号。
18.任选地,差异目标多路复用信号产生模块包括各种电信号源或端子,其中一个或多个电极阵列包括电极的至少第一子组和第二子组。在一个实施例中,电极的第一子组可电耦合到第一电信号源和/或端子,并且电极的第二子组可电耦合到第二电信号源和/或端子。电极的多个子组可与多个电信号源和/或端子电耦合。
19.任选地,差异目标多路复用信号产生模块被配置成用于具有用于提供对应于如本文中所描述的神经胶质刺激信号和神经元刺激信号的脉冲电信号的操作模式。任选地,此类脉冲电信号为电荷平衡的且可具有不同特性参数,例如脉冲频率、脉冲幅度、脉冲宽度、前导相位极性、电荷平衡模式、相间延迟和占空比。
20.任选地,差异目标多路复用信号产生模块被配置成用于具有用于将电信号提供到电极阵列中的对应于本文中所描述的方法中的任一个的刺激的电极的子组的操作模式。
21.任选地,差异目标多路复用信号产生模块可被配置成用于具有用于提供在20hz与1,500hz之间的脉冲电信号的操作模式。靶向神经胶质细胞的电信号的频率可不同于靶向神经元的电信号的频率。这些电信号的其它特性,例如脉冲宽度、电荷平衡模式(主动或被动)、相间延迟和/或幅度可不同。神经胶质刺激信号和神经元刺激信号可以使得刺激同时递送而不需要相应信号之间的脉冲重叠的方式进行多路复用。
22.如本文中所使用,被配置成用于具有操作模式的差异目标多路复用信号产生模块可包括含有至少定义如所描述的操作模式的指令的存储器模块,其中操作模式任选地为用户可选择操作模式且存储器模块任选地包括用于额外操作模式的指令。在某些实施例中,差异目标多路复用信号产生模块被配置成用于将电信号递送到如所指定的一个或多个电极阵列内的电极的一个或多个子组。
23.任选地,差异目标多路复用信号产生模块包括两个或更多个电信号源,例如信号产生器,其可独立地控制且被配置成用于递送具有可针对电信号源中的每一个单独地设置的参数的电信号。
24.任选地,设备是非可植入的,例如拨号系统,其包括信号产生模块,所述信号产生模块包括被配置成用于递送具有可针对信号中的每一个单独地设置的参数的多个电信号的至少一个信号产生器。
25.任选地,可植入差异目标多路复用信号产生器模块被调适成用于与一个或多个电极阵列电耦合,或任选地与一个或多个电极阵列耦合。可植入差异目标多路复用产生器模块包括产生器电路系统和壳体。壳体气密地密封产生器电路系统,并且可由耐久生物兼容性材料制成。差异目标多路复用信号产生器模块具有用于建立与在一个或多个电极阵列中实施的电极的电连接的输出接口,例如用于电耦合到在一个或多个电极阵列上实施的电极的两个或更多个子组的两个或更多个端子。
26.任选地,可植入差异目标多路复用信号产生器模块包括两个或更多个信号产生器和定时器电子电路系统,所述定时器电子电路系统可使信号产生器中的一个从属于另一信号产生器,使得可在由至少两个信号产生器产生的信号之间产生延迟。
27.根据本公开的另一方面,一种差异目标多路复用刺激装置包括用于连接到至少一个电极阵列的输出单元,以及至少一个信号产生器,其中刺激装置被布置成用于经由输出单元将差异目标多路复用刺激信号提供到至少一个电极阵列。电极阵列内的至少一个电极被配置成用于使神经组织及其构成神经胶质细胞和神经元暴露于差异目标多路复用刺激
信号。差异目标多路复用刺激装置可为疼痛治疗装置。
28.任选地,差异目标多路复用刺激装置被布置成用于产生可提供到被称为刺激导线的至少一个特定电极阵列的差异目标多路复用电信号。
29.任选地,差异目标多路复用刺激装置可具有输出单元,所述输出单元包含用于连接到第一刺激导线的第一输出和用于连接到第二刺激导线的第二输出。第一刺激导线包含第一电极阵列。第二刺激导线包含第二电极阵列。
30.任选地,差异目标多路复用刺激装置被布置成用于将至少第一多路复用电信号提供到第一输出且将至少第二多路复用电信号提供到至少第二输出。第一多路复用电信号和其它多路复用电信号可在例如幅度、频率、相位极性、波形形状、宽度、占空比和相间延迟的一个或多个参数方面不同。在一些实施例中,多路复用电信号中的一些可具有相同参数集合,而其它多路复用电信号中的一个或多个具有至少一个不同参数。
31.根据本公开的另一方面,一种用于操作差异目标多路复用信号产生模块的方法包含将信号产生模块连接到已提供到受试者的身体的一个或多个刺激导线。方法包含使用差异目标多路复用信号产生模块来为一个或多个刺激导线中的至少一个产生第一多路复用信号,以及使用差异目标多路复用信号产生模块来为一个或多个刺激导线中的至少一个产生第二多路复用信号。第一多路复用信号和其它多路复用信号中的至少一个可在其间具有至少一个不常见参数。
32.根据本公开的另一方面,提供了一种导电材料,例如金属或导电聚合物,例如呈电极的形式,以用于将差异目标多路复用刺激信号施用于受试者以治疗疼痛。差异目标多路复用刺激信号可在其间具有至少一个不常见参数。
33.任选地,第一多路复用刺激信号为神经胶质刺激信号且第二多路复用刺激信号为神经元刺激信号。第一多路复用刺激信号可为具有在100hz到100khz之间的频率的一个电信号或两个或更多个电信号的组合。第二多路复用刺激信号可为具有低于第一多路复用刺激信号的频率的例如在20hz与500hz之间的频率的一个电信号或两个或更多个电信号的组合。第一多路复用刺激信号与第二多路复用刺激信号之间的频率的比率在5:1到5,000:1的范围内。
34.根据本公开的另一方面,一种差异目标多路复用刺激系统包括:存储器,其用于存储多个差异目标多路复用信号参数程序;选择装置,其用于选择多个差异目标多路复用信号参数程序中的一个;差异目标多路复用信号产生器装置,其可由多个差异目标多路复用信号参数程序中的选择控制;以及输出单元,其用于连接到由电极阵列构成的至少一个刺激导线;其中刺激装置被配置成经由输出单元将由差异目标多路复用信号产生器根据差异目标多路复用信号参数程序的选择产生的差异目标多路复用刺激信号提供到至少一个刺激导线。差异目标多路复用刺激系统可进一步包括包围差异目标多路复用刺激信号产生器装置和输出单元的生物兼容性材料的罩壳。在一个实施例中,差异目标多路复用刺激信号产生器装置在其操作模式中产生两个或更多个多路复用电信号。在一个实施例中,差异目标多路复用刺激系统可与包括电极的子组的至少一个刺激导线组合,并且其中电极的子组电耦合到两个或更多个多路复用刺激信号。
35.根据本公开的另一方面,差异目标多路复用刺激疗法的优化包括有条理地选择差异目标多路复用刺激信号和适合被治疗受试者的需要的对应特性参数。此可以本文中所描
述的方式包含组分的组合。在一个实施例中,还可通过设置最适当电场来优化差异目标多路复用刺激,此通过在一个或多个刺激导线中选择单极、双极、三极、防护阴极、防护阳极或任何其它多级布置来调制受刺激神经结构中的神经胶质相互作用,所述刺激导线已定位在脊椎内在脊髓的背柱附近、邻接于脊髓的任何其它方面、在椎间孔中,或邻近于对应于其中患者经历疼痛的身体的特定解剖区域的背神经根,或在经靶向以针对各种病理病况提供缓解的颅内结构中。在另一实施例中,还可通过设置最适当电场来优化差异目标多路复用刺激,此通过在一个或多个刺激导线中选择单极、双极、三极、防护阴极、防护阳极或任何其它多级布置来调制受刺激神经结构中的神经胶质相互作用,所述刺激导线已定位在与患者经历疼痛的身体的特定解剖区域相关联的一个或多个外周神经附近。
36.根据另一示例性方面,本公开提供了一种电磁刺激系统,其包括:存储器,其用于存储多个多模态信号参数程序;选择装置,其用于选择多个多模态信号参数程序中的一个;信号产生器,其可由多个多模态信号参数程序中的所选择者控制;以及输出单元,其用于连接到至少一个电极;其中刺激系统被配置成经由输出单元将具有启动相位信号段和强直相位信号段的复合电信号提供到至少一个电极。在一个实施例中,系统进一步包括包围多模态信号产生器和输出单元的生物兼容性材料的罩壳。在另一实施例中,选择装置被配置成用于接收用于修改复合电信号的启动相位信号段和强直相位信号段的相应幅度、相对相位、波形形状和宽度中的任一个的用户可定义指令。在另一实施例中,选择装置被配置成用于接收用于修改复合电信号的幅度和频率中的任一个的用户可定义指令。
37.根据又另一示例性方面,本公开提供了一种用于控制受试者的疼痛的方法,其包括:a)用复合电磁场的组分降低受试者的神经纤维的去极化的阈值;以及b)同步用复合电磁场的第二组分激活神经胶质细胞;无需将药理学化合物施用于受试者。在一个实施例中,复合电磁场的组分具有不同的相应频率、幅度、相位或谐波含量中的任一个。在另一实施例中,可通过单个电磁信号或通过两个或更多个不同电磁信号的组合来提供复合电磁场。
38.根据再另一示例性方面,一种用于控制受试者的疼痛的方法包括:a)在第一时间段内用复合电磁场的第一组分降低受试者的神经纤维的去极化的阈值;以及b)同步在与第一时间段不相同的第二时间段期间用复合电磁场的第二组分调制神经胶质细胞活性;其中复合电磁场改变神经结构内的神经元和神经胶质细胞的突触可塑性。
39.根据另一示例性方面,本公开提供了一种用于控制受试者的疼痛的方法,其包括:a)用双相信号的第一相位段降低受试者的神经纤维的去极化的阈值;以及b)用双相信号的第二相位段调制受试者的神经胶质细胞活性;其中对双相信号的操纵改变了神经纤维内的神经元和神经胶质细胞的突触可塑性。
40.根据再另一示例性方面,本公开提供一种用于控制受试者的疼痛的方法,其包括:a)通过调节钙结合蛋白、细胞因子、细胞粘附或特异性免疫反应蛋白的基因中的任一个的多模态电磁刺激来激活神经胶质细胞;以及b)在一时间段期间全身性地、硬膜外地或鞘内地将药理学物质施用于受试者。在一个实施例中,此类药理学物质可通过刺激导线注射,所述刺激导线可具有将药理学试剂直接递送到硬膜外腔或鞘内腔中的端口。任选地,可使用缓释制剂来将药理学试剂浸渍到刺激导线上,以便将药理学物质缓慢洗脱到导线周围的神经组织中。
41.根据又另一示例性方面,本公开提供了一种用于控制受试者的疼痛的方法,其包
括:a)用复合电磁场的组分降低受试者的神经纤维的去极化的阈值;以及b)同步用复合电磁场的其它组分调制神经胶质细胞活性;其中复合电磁场的组分以钙依赖性方式控制所调制神经胶质细胞内的谷氨酸和谷氨酰胺的平衡。在一个实施例中,复合电磁场的组分具有不同的相应频率、幅度、相位、谐波含量或矩形波形的宽度中的任一个。在另一实施例中,可通过单个电信号或通过多于一个不同电信号来提供复合电磁场的组分。
42.根据再另一示例性方面,一种用于控制受试者的疼痛的方法包括:a)用具有其阳极相位的可变持续时间的非对称双相电磁信号调制神经胶质细胞,所述可变持续时间经选择以调制从所述神经胶质细胞释放的谷氨酸的量;以及b)用具有其阴极相位的可变持续时间的非对称双相电磁信号调制神经胶质细胞,所述可变持续时间经选择以调制从所述神经胶质细胞释放的谷氨酸的量。
43.根据又另一方面,一种用于控制受试者的疼痛的方法包括:a)用具有其阴极和阳极相位的可变持续时间的非对称双相电磁信号调制神经胶质细胞,所述可变持续时间经选择以调制从所述神经胶质细胞释放的谷氨酸的量,其中电磁场以钙依赖性方式控制所调制神经胶质细胞内的谷氨酸和谷氨酰胺的平衡。
44.本文中还公开了一种包括信号产生模块的设备,所述信号产生模块被配置成用于与一个或多个导线电耦合。
45.任选地,信号产生模块被布置成用于产生复合电信号。复合电信号可为多个电信号的总和信号。任选地,信号产生模块被布置成用于产生多模态信号,例如经频率调制的信号。复合信号和/或多模态信号可提供到一个或多个导线。
46.任选地,信号产生模块包括至少第一和第二电信号源或端子,并且一个或多个导线包括电极的至少第一子组和第二子组。电极的第一子组可电耦合到第一电信号源和/或端子,并且电极的第二子组可电耦合到第二电信号源和/或端子。
47.任选地,信号产生模块被配置成用于具有用于提供对应于如本文中所描述的第一和第二电磁刺激的至少第一和第二电信号的操作模式。任选地,第一和第二电信号具有不同频率、幅度和相位极性特性。
48.任选地,信号产生模块被配置成用于具有用于将电信号提供到对应于本文中所描述的方法中的任一个的电磁刺激的电极的操作模式。
49.任选地,信号产生模块可被配置成用于具有用于将具有一频率的第一电信号提供到电极的第一子组且将具有相同频率的至少第二电信号提供到电极的第二子组的操作模式。频率可在500hz与1,500hz之间。第一和第二电信号的其它参数可不同,所述参数例如脉冲宽度和/或幅度。第一电信号可与第二电场同步地(即,同时地)激发,或相对于第一电信号异步地(例如,在给定时间延迟的情况下)激发。
50.如本文中所使用,被配置成用于具有操作模式的信号产生模块可包括含有至少定义如所描述的操作模式的存储器模块,其中操作模式任选地为用户可选择操作模式且存储器模块任选地包括用于额外操作模式的指令。在某些实施例中,信号产生模块被配置成用于将电信号递送到如所指定的一个或多个导线。
51.任选地,设备是非可植入的,例如,拨号系统,其包括信号产生模块,所述信号产生模块包括至少两个信号产生器,所述信号产生器被配置成用于递送具有可针对信号产生器中的每一个单独地设置的参数的电信号,例如启动信号和强直信号。
52.任选地,提供可植入多模态产生器,其被调适成用于与一个或多个导线电耦合,或任选地与一个或多个导线耦合。可植入多模态产生器包括产生器电路系统和壳体。壳体可气密地密封产生器电路系统,并且可由耐久生物兼容性材料制成。产生器具有用于建立与一个或多个导线上实施的电极的电连接的输出接口,例如用于电耦合到一个或多个导线上实施的电极的第一子组和第二子组的至少第一端子和第二端子。
53.根据本公开的另一示例性方面,提供了一种电磁刺激装置,其包含用于连接到至少一个电极的输出单元,以及信号产生器,其中刺激装置被布置成用于经由输出单元将多模态刺激信号提供到至少一个电极。多模态刺激信号可为电磁信号。至少一个电极被配置成用于使神经胶质细胞和神经元暴露于多模态刺激信号。至少一个导线可包含一电极阵列或多个电极阵列。
54.任选地,信号产生器被布置成用于产生多模态电信号,例如经频率调制的信号或经幅度调制的信号。多模态电信号可提供到至少一个导线。
55.任选地,信号产生器被布置成用于将第一电信号提供到第一输出且将至少第二电信号提供到至少第二输出。第一电信号和其它电信号可在例如幅度、频率、相位、相位极性、波形形状和宽度的参数方面不同。第一电信号和其它电信号可在例如幅度、频率、相位、相位极性、波形形状和宽度的参数方面对应。至少第二电信号可为强直刺激信号,并且第一电信号可具有高于强直刺激信号的频率的频率。
56.根据本公开的另一示例性方面,提供了一种用于操作信号产生模块的方法。方法包含将信号产生模块连接到一个或多个导线。导线可能已提供到受试者的身体。方法包含使用信号产生模块来为一个或多个导线中的至少一个中产生第一振荡电磁场,并且使用信号产生模块来为一个或多个导线中的至少一个中产生第二振荡电磁场。第一振荡电磁场和其它振荡电磁场中的至少一个可在其间具有至少一个不常见参数。
57.任选地,复合信号的第一组分为启动信号,并且第二组分为强直信号。第一组分可具有在200hz与100khz之间的频率。第二组分可具有低于第一刺激的频率,例如在10hz与500hz之间。在示例性实施例中,第一刺激的频率和第二刺激的频率具有在2:1到40:1、4:1到40:1、10:1到40:1、20:1到40:1、至多70:1、至多140:1等的范围内的比率。
58.根据本公开的另一示例性方面,一种电磁刺激系统包括:存储器,其用于存储多个多模态信号参数程序;选择装置,其用于选择多个多模态信号参数程序中的一个;多模态信号产生器,其可由多个多模态信号参数程序中的所选择者控制;以及输出单元,其用于连接到至少一个电极;其中刺激装置被配置成经由输出单元将由多模态信号产生器根据多模态信号参数程序中的所选择者产生的多模态刺激信号提供到至少一个电极。
59.根据本公开的另一示例性方面,疗法的优化包括有条理地选择适合所治疗的患者的需要的多模态刺激波形和参数。此可以本文中所描述的方式包含组分的组合。
60.根据本公开的另一示例性方面,一种控制受试者的疼痛的方法包括:用双相信号的第一相位段降低受试者的神经纤维的去极化的阈值;以及用双相信号的第二相位段调制受试者的神经胶质细胞活性。
61.在示例性实施例中,双相信号的第一相位段来源于第一电信号,所述第一电信号具有设置为对应于受试者的启动感知阈值(ppt)百分比的值的电流幅度,并且双相信号的第二相位段来源于第二电信号,所述第二电信号具有设置为对应于受试者的强直感知阈值
(tpt)百分比的值的电流幅度。如本文中所使用,术语感知阈值或感觉异常阈值(pt)与任何类型的刺激有关,所述刺激包含启动刺激和强直刺激。
62.应了解,鉴于方法所描述的方面、特征和选项中的任一个同等地适用于系统、信号产生模块和刺激装置。应理解,可组合如本文中所描述的以上方面、特征和选项中的任一个或多个。
附图说明
63.结合附图参考以下详细描述可更容易地理解本发明的各种特征和优点,其中相同的附图标记指代相同的结构元件,并且其中:
64.图1为说明根据本公开的实施例的用于疼痛控制的设备的示意图;
65.图2说明可与根据本公开的实施例的系统一起利用的可植入多模态调制装置的示意性电路图;
66.图3a和38在概念上说明与根据本公开的实施例的系统一起利用的电极阵列;
67.图4在概念上说明表示可在根据本公开的实施例的主要多模态调制的实例中使用的信号的一对迹线;
68.图5在概念上说明表示可在根据本公开的实施例的主要多模态调制的实例中使用的信号的一对迹线;
69.图6在概念上说明表示可在根据本公开的实施例的主要多模态调制的实例中使用的信号的一对迹线;
70.图7在概念上说明可用于根据本公开的实施例的多模态调制的具有大于调制频率的载波频率的经频率调制的信号;
71.图8在概念上说明可用于根据本公开的实施例的多模态调制的具有小于调制频率的载波频率的经频率调制的信号;
72.图9在概念上说明可用于根据本公开的实施例的多模态调制的复合信号双相脉冲实例;
73.图10在概念上说明可用于根据本公开的实施例的多模态调制的具有矩形双相启动组分和非对称双相强直组分的复合信号;
74.图11在概念上说明可用于根据本公开的实施例的多模态调制的具有连续改变的频率的复合信号;
75.图12在概念上说明可用于根据本公开的实施例的多模态调制的具有与对称双相强直组分相加的白噪声启动组分的复合信号;
76.图13在概念上说明根据本公开的实施例的可植入系统与人类受试者的放置;
77.图14在概念上说明根据本公开的实施例的可植入系统与人类受试者的放置;
78.图15在概念上说明在利用根据本公开的系统和方法的临床前动物研究中获得的结果的图表;
79.图16a和168在概念上说明在利用根据本公开的系统和方法的短时间试点临床试验期间获得的结果的图表;
80.图17a
‑
17e在概念上说明指示刺激电磁场信号的极性如何影响基因表达的实验结果的图表;
81.图18说明示例性患者适配/设置工作流程;
82.图19说明根据本公开的示例性方面的包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,其中两个信号,即2和4,具有与其它两个信号不同的强度;
83.图20说明根据本公开的示例性方面的包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,所有多路复用的信号具有不同强度;
84.图21说明根据本公开的示例性方面的包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,所有多路复用的信号具有不同强度,同时信号2具有不同脉冲宽度;
85.图22说明根据本公开的示例性方面的包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,所有多路复用的信号具有不同强度,同时信号具有不同脉冲宽度且信号3具有不同脉冲频率;
86.图23说明根据本公开的示例性方面的包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在一个电极阵列中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,信号2具有不同脉冲宽度,同时所有信号在脉冲频率和强度方面不同;以及
87.图24为根据本公开的示例性方面的灰度图,其相对于原色(白色)相对于由疼痛模型引起的倍数改变展示差异目标多路复用疗法对基因表达的影响,其中较深灰色指示向上或向下调节的表达的较大改变。
具体实施方式
88.本技术要求2019年5月6日提交的且标题为“使用关于差异目标的多路复用电信号来调制神经组织中的细胞活性的方法和设备”的第62/843,757号美国临时申请的优先权和权益。本技术还要求2020年1月22日提交的且标题为“使用复合电磁场对疼痛进行多模态电调制的方法和设备”的第62/964,281号美国临时申请的优先权和权益,所有这些申请的内容出于所有目的以全文引用的方式并入本文中。
89.通过应结合图式阅读的以下描述将更完全地理解本公开。在本描述中,相同的数字指代本公开的各种实施例内的类似元件。所属领域的技术人员将易于了解,本文中所描述的方法、设备和系统仅仅是示例性的,并且在不脱离本公开的精神和范围的情况下可做出变化。
90.施加到神经结构的振荡电磁场在调制两种不同的细胞群:神经元和神经胶质细胞时会引起突触可塑性的改变。这与对神经元的影响同时发生,所述影响例如通过刺激机械敏感性纤维以屏蔽行进到脑部的伤害感受性信号(或为所述伤害感受性信号关闭闸门)的
动作电位产生或阻断。另外,神经胶质细胞为免疫活性细胞,其构成神经系统中最常见细胞群,并且在慢性神经性疼痛的发展和维持中发挥重要作用。神经胶质细胞负责通过使用与神经元和其它神经胶质细胞的恒定化学通信来监测神经系统的状态。微神经胶质是负责监测脑部和脊髓的神经胶质细胞。在神经(或脑部)损伤之后,这些细胞经激活并且对被视为对中枢神经系统(cns)稳态构成威胁的任何刺激做出反应。此激活涉及微神经胶质的形态改变,伴随着趋化性和吞噬活性的改变,以及诱导免疫系统反应的趋化因子和细胞因子的释放。已经证明微神经胶质为对损伤的cns直接反应者。损伤还会触发星形胶质细胞的激活,所述星形胶质细胞为监测突触间隙的神经胶质细胞,并且因此经由调节神经和神经胶质递质分子以及免疫细胞参与突触修剪而参与突触可塑性。星形胶质细胞的激活和调节持续更长时间,并且因此可假设星形胶质细胞在影响慢性疼痛的突触可塑性的改变中发挥重要作用。存在支持此假设的实验证据。值得注意的是,在外周神经系统(pns)处,类似于星形胶质细胞的少突胶质细胞、雪旺氏细胞和卫星神经胶质细胞发挥重要作用。
91.由atp介导的钙离子和磷酸化过程在神经胶质对损伤的反应中发挥重要作用。电脉冲引发星形胶质细胞中钙离子浓度的改变,所述钙离子经由钙波在星形胶质细胞之间传播。此又会向例如谷氨酸、腺苷和atp等递质的释放发出信号,即使在调制神经元兴奋性和突触传递两者的钠通道阻断之后也是如此。外部振荡电场的存在接着为神经胶质细胞提供刺激以影响受损伤负面影响的突触。电场提供启动响应,将突触的功能移向正常状态。
92.在不受理论束缚的情况下,有可能电刺激神经胶质细胞,因为其反应(神经胶质去极化、离子的释放/捕捉、神经胶质递质的释放)取决于具体参数,例如刺激的幅度、频率、相位极性、波形形状和宽度(在矩形波形的情况下)。举例来说,谷氨酸从星形胶质细胞的释放可与在双相脉冲刺激期间施用的阳极电流的量成比例调制。海马星形胶质细胞的单相阴极刺激促进谷氨酸的释放。阳极组分的引入减少了释放的谷氨酸的量。鉴于神经胶质细胞和神经元对电场的反应不同;接着有可能用明显不同的电参数差异地调制这些细胞群的反应。此理论为多模态刺激奠定了机制基础。用设置在最佳频率、幅度、波形、宽度和相位的电磁场进行亚阈值刺激可调制神经胶质细胞的行为以及其在突触水平与神经元相互作用的方式。因此,多模态调制提供了以钙依赖性方式控制谷氨酸和谷氨酰胺平衡的能力,以及以适当方式用电磁场调制此类平衡的可能性。
93.电磁场调制基因和蛋白质的表达,所述基因和蛋白质参与涉及突触可塑性、神经保护、神经形成和炎症的许多过程。从慢性神经性疼痛的动物模型获得的同侧dc和drg组织的全基因组表达分析,其中scs连续应用达72小时,提供的发现为下文所描述的多模态方法的发展提供了信息。在不希望受理论束缚的情况下,基因表达结果指示除电场阻断或屏蔽神经传信之外或独立于电场阻止或屏蔽神经传信,还可能在分子水平下引发镇痛效果。举例来说,scs被鉴定为具有钙结合蛋白(cabp)、细胞因子(tnf、116、111b、cxcl16、lfg)、细胞粘附(ltgb)和特异性免疫反应蛋白(cd68、tlr2)的上调基因,所有这些都已与神经胶质激活有关。调制参数,尤其是振荡频率和幅度,可在作用模式中发挥重要作用。
94.多模态调制方法
95.根据本公开的一个示例性方面,一种用于多模态调制的方法利用其中至少一种组分以高于另一组分的频率振荡的复合电场。此复合电场被认为提供超过由其自身的任一电场提供的疼痛缓解的量的疼痛缓解。较高频率“启动”组分的电场提供持续电化学电位,此
可促进以较低频率振荡的另一组分对神经的刺激。在不受理论束缚的情况下,启动组分降低神经纤维的去极化的阈值,同步调制神经胶质激活。启动组分还可降低受刺激组织的阻抗,此允许电场更好地穿透到神经组织中。启动组分的频繁脉冲还促成经由电刺激的膜集成的神经纤维的去极化的下限阈值。另外,启动组分可促进神经元去同步化,其为一种有助于重建已非自然同步的神经元回路以维持对脑部的伤害感受性输入的机制。
96.在所公开的主要多模态调制技术中,去极化机制与低于或略高于感觉异常阈值(pt)的幅度组合,因此即使施加强直刺激,患者也可能会或可能不会感到刺痛。在某些实施例中,包含以高于强直频率提供电刺激的主要组分的复合信号可激活允许将突触可塑性复位到更接近于由损伤引起的中枢敏化之前的状态的状态,由此提供一种用于长效疼痛缓解的机制。
97.在某些实施例,启动频率(pf)可设置为在200hz与100khz之间的任何频率。在使用电荷平衡脉冲矩形电组分(例如,双相对称、双相非对称、电容器耦合单相)时,启动组分的脉冲宽度(pw)可设置为低至10μs且大至启动频率所允许的。举例来说,具有每相位相等pw和20μs相间延迟的双相组分的最大pw在pf=1,200hz时为395μs或在pf=500hz时为980μs。可使用电压或电流控制的复合信号,尽管电流控制的信号可能更合乎需要,因为此类信号不取决于正受刺激的组织中的时间阻抗变化。
98.在某些实施例中,第一或启动频率在1000hz与1400hz之间(突发),或在750hz与1050hz之间(平均)。根据实施例,可在n个脉冲空间的重复集合内对多个信号进行多路复用。模式内的每一脉冲空间可对应于具有相应参数的不同电信号。可通过在n个脉冲中的一个中多路复用第二强直信号组分来产生较低平均频率。根据实施例,启动频率信号组分的突发频率可为强直信号频率的整数倍数(m),使得强直脉冲空间仅包含每m次重复n个脉冲空间集合的脉冲。空白脉冲空间导致在“突发”频率下的n
‑
1个脉冲的突发,接着是“错过”脉冲,导致在n个脉冲的集合中较低的“平均”频率。如本文中所使用,在不包含与强直信号相关联的脉冲的情况下单独计算启动信号的平均频率。在一些实施例中,使用相对于强直信号的不同电极集合来将启动信号递送到不同物理位置。在另一示例性实施例中,第一或启动频率设置为1200hz(突发)或900hz(平均)。在某些实施例中,可在不同电极群组的单独程序上提供在突发内的每一脉冲,其中配置被设置成允许个别幅度变化性。
99.在其它示例性实施例中,第二或强直组分被设置在约50hz的频率下,交错到治疗中以考虑平均启动频率,尽管本文中考虑了其它强直值和范围,例如,20hz到200hz、20hz到100hz、30hz到80hz等。
100.多路复用调制方法
101.在其它示例性实施例中,本公开认识到神经组织中不同的神经胶质细胞和神经元以不同方式对电场做出反应,有可能用明显不同的电信号差异地调制这些细胞群的反应,所述电信号含有特性在于靶向和调制特定细胞类型的活性的参数。所公开的系统和方法是基于以此类多路复用方式递送此类信号以调制神经组织中的神经胶质细胞和神经元的活性以便平衡远离引起受试者的疼痛感觉的状态的神经胶质相互作用。多路复用信号影响与相关生物过程相关联的基因和蛋白质的表达,所述基因和蛋白质已被确定受慢性疼痛的影响。将差异目标多路复用scs信号施加到神经性疼痛的活体模型使此类基因的表达正常化,并且因此使相关联的生物过程朝向健康动物中所发现的生物过程正常化,所述健康动物在
本文中被称作原始动物。
102.rna测序已用于研究差异目标多路复用scs对与神经性疼痛的啮齿动物模型中的各种生物过程相关联的mrna的集合的影响。加权基因相关网络分析(wgcna)将大于9,000个rna转录物聚集在四十一个模块中,所述模块根据表达模式聚集这些rna转录物。wgcna得到基因本体富集分析(goea)的补充,所述基因本体富集分析确定涉及聚集在模块中的基因转录物的生物过程。wgcna允许比较一组受试者相对于未接受疗法的受试者的对照组和原始受试者的对照组的疗法的效果。wgcna展示相对于原始动物疼痛模型显著影响二十四个模块中的基因的表达模式。基于差异目标多路复用的连续应用达48小时的疗法使此类模块中的十二个中的表达模式逆转回原始表达图案。表1说明与由经差异靶向多路复用scs疗法相对于慢性疼痛的效果显著逆转的模块相关联的生物过程,其中goea确定富集的生物过程。图24说明灰度图,其中分组在相关生物过程中的重要基因通过其在慢性疼痛下相对于原始(健康)的表达水平之间的倍数改变比率进行分类。所述图还说明差异目标多路复用疗法的效果,其中大部分基因的表达朝向原始受试者的水平折曲。
103.表1.相对于经由goea获得的对慢性疼痛和相关生物过程的影响,wgcna模块显著受差异目标多路复用影响
[0104][0105]
在示例性实施例中,信号处理器从一或多个信号产生器模块接收信号且可编程以执行用于将单独信号组合成单个复合信号的多种算法,包含幅度调制、频率调制、信号求和、信号同步、相位调制、卷积等中的任一个,或其任何组合,以及响应于用户输入数据而从波表或数字振荡器实时产生定制信号。与分接延迟模块结合的信号处理器促进了提供到电极阵列的各种信号的多路复用。
[0106]
在其它示例性实施例中,差异目标多路复用装置的中央处理器模块可存取在数学上描述一个或多个信号的波形的所存储数字数据,并且可从此类数据阶跃函数产生在不同频率下的模拟信号。处理器对此类数据进行算法操纵以获得所要信号处理结果。与中央处理模块相关联的数模转换器可将处理后的信号转换成具有正确幅度的单个输出以用于耦合到一个或多个电极阵列。以此方式,多路复用的单独信号的相互影响可通过能够以模拟多路复用的单独信号的使用的方式刺激/调制神经胶质细胞与神经元之间的相互作用的单个电复合信号来实现。
[0107]
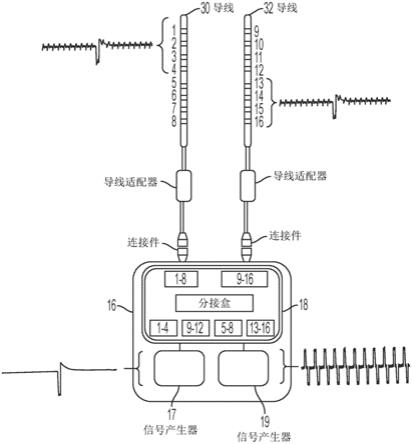
在其它示例性实施例中,本文中所描述的系统和装置可用于产生各种差异目标多
路复用电调制信号,例如图19
‑
23中所说明的那些信号。所属领域的从业人员可了解,可根据本公开构想其它差异目标多路复用电调制信号。
[0108]
图19说明包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,信号2和4具有与另外两个信号不同的强度(幅度)。
[0109]
如图19中所展示,信号1、2和3以高于交错信号4的频率的频率共同地重复。因此,信号1、2和3的突发频率是平均频率的3/4(忽略交错信号4)。根据各种实施例,信号1、2和3的组合可提供到第一电极集合,而交错信号4可提供到第二电极集合。如本文中所使用,术语同时适用于相对于彼此的信号1
‑
4。确切地说,个别脉冲不需要重叠以被视为是同步的,因为信号各自由一起以对应频率形成信号的多个脉冲构成。
[0110]
图20说明包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,多路复用的四个信号中的每一个具有不同强度。
[0111]
图21说明包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,所有多路复用的信号具有不同强度,同时信号2具有不同脉冲宽度。
[0112]
图22说明包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,所有多路复用的信号具有不同强度,同时信号2具有不同脉冲宽度,并且信号3具有不同脉冲频率。
[0113]
图23说明包括四个不同信号的差异多路复用信号的迹线,其中信号1、2和3在电极阵列中的至少一个中多路复用以靶向特定类型的神经细胞,而信号4使用相同或另一电极阵列来以不同频率与其它三个信号多路复用以靶向另一类型的神经细胞,信号2具有不同脉冲宽度,同时所有信号在脉冲频率和强度方面不同。
[0114]
图24为灰度图,其相对于原色(白色)相对于由疼痛模型引起的倍数改变展示差异目标多路复用疗法对基因表达的影响,其中较深灰度指示向上或向下调节的表达的较大变化。
[0115]
如下文将更详细地论述,用于编程的示例性过程可被配置成确定一个程序的程序算法,接着将其它程序的算法匹配或设置为相同或基于第一程序而进行调整。另外,在示例性实施例中,可使用多个不同启动频率,其中对幅度、脉冲宽度和频率进行不同选择以缓解疼痛。
[0116]
启动组分的幅度可设置为低于启动感知阈值(ppt)的值,但不排除将其设置为处于或高于ppt。可通过在从受试者获得反馈的同时缓慢增加幅度来找到ppt。一旦感知开始被记录,则启动组分的幅度可改变为作为ppt百分比(%ppt)的值。在1500hz的示例性pf的情况下,在以低于pf(例如,10hz到99khz)的强直频率设置的电组分独立地施加到导线中的其它电极之前,可接着设置信号达给定时间,例如,10
‑
30分钟。在一个实施例中,举例来说,
在200hz的示例性pf的情况下,强直频率可在大致10hz到199hz的范围内。在主要刺激模式中,强直频率将低于启动频率,但不一定限于低于启动频率的频率的特定范围。
[0117]
电荷平衡的,例如,双相对称、双相非对称或电容器耦合单相的,脉冲信号的脉冲宽度(pw)可低至10μs,并且也可大至所设置强直频率所允许的。在示例性实施例中,脉冲宽度可在约100微秒与500微秒之间、在约100微秒与400微秒之间、在约150微秒与200微秒之间,或脉冲宽度的任何不同值、范围或组合。
[0118]
信号产生和递送电路系统还可允许修改脉冲宽度信号的占空比和其中可改变初始启动的时间的各种方案,以及启动信号相对于强直信号被递送的时间打开或关闭的时间。可为电压或电流控制的强直电组分的幅度可设置为高于、低于或处于强直感知阈值(tpt)。可通过在从患者获得反馈的同时增加强直组分的幅度来获得pt。可接着将强直幅度设置为对应于tpt百分比(%tpt)的值。在一个实施例中,在本文中所描述的主要多模态调制方法中,启动组分和强直组分都可低于100khz。在另一实施例中,强直信号可低于500hz。在再另一实施例中,强直信号可低于100hz。在一个实施例中,取决于所选择的频率的具体值,启动组分频率与强直组分频率的比率可在2:1到40:1、4:1到40:1、10:1到40:1、20:1到40:1、至多70:1、至多140:1等的范围内。
[0119]
在多模态调制疗法的又另一实施例中,启动组分可为双相的,其中双相启动组分的第一相位的极性可为阴极或阳极。在此实施例的情况下,强直组分可具有不同于启动组分的那些特性的特性。强直组分可为双相的,其中双相强直信号的第一相位的极性为阴极或阳极。
[0120]
在多模态调制疗法的示例性实施例中,主动再充电模式提供恢复脉冲,所述恢复脉冲在与输入相反的方向上施加相等电荷,由此驱动每一方向的波形。
[0121]
本文中所公开的技术可用微创手术实现,所述微创手术优于需要大量手术干预和医疗费用的那些手术,但在特殊情况下,可能需要手术植入。可使用类似于图3a和38中所说明的电刺激导线,但可使用具有不同的电极数目、电接触件的大小、接触件之间的间距和阵列内的电极的几何布置的其它设计以将电磁刺激递送到神经结构。在示例性实施例中,各种电极和导线配置提供被配置成调制神经胶质细胞和神经元的间距。
[0122]
在实施例中,导线包括多个电极的圆柱形布置,例如,所述电极数目在4个与16个之间。导线的直径可足够小,以允许在标准临床实践下使用硬膜外针经皮植入到脊椎管中。电极由还耐腐蚀的生物兼容性材料制成,例如铱铂合金。举例来说,以八个电极予以实施的50cm长的导线可具有1.35mm的直径,其中每一圆柱形电极具有3.0mm的长度和4.0mm的电极之间的间距。导电金属线可从电极延伸到导线的远端部分到金属连接器中。金属线可围封在由生物兼容性耐久聚合物制成的三重绝缘安全壳内。
[0123]
在脊髓的多模态调制的情况下,各种多接触件导线可定位在硬膜外腔中以刺激已经描述的细胞群。在一个特定布置中,导线可彼此平行地定位,但不一定在硬膜外腔内共面。图3a说明可用于所公开的多模态调制技术的两个八接触电极阵列。应注意,导线的极性还可在编程阶段期间定制为双极、单极或防护阴极配置。可能电极阵列布置的另一实例展示于图38中,其中导线相对于彼此交错地布置。疗法的定制和优化可包括在任一类型的导线布置中在适当的脊椎段处在硬膜外腔内定位导线。
[0124]
其它布置可用于沿着脊椎管刺激不同位置,例如,导线不需要并行。举例来说,在
一个布置中,一个导线可专用于在给定椎骨水平处在脊髓处递送信号,而另一导线提供相对于另一导线的位置更尾部或头部的信号。原则上,导线可位于脊髓中在任何椎骨水平处,也可定位在外周,因为多模态调制背后的原理适用于调查轴突的外周神经胶质细胞。
[0125]
此外,多模态刺激电磁场位置和穿透还可用于通过设置此类电极阵列的单极、双极或防护阴极布置来将多模态刺激信号递送到每一导线内的特定电极阵列的疗法的定制和优化。举例来说,对于延伸到下肢中的一个中的患有下背疼痛的患者的疗法可能需要以交错布置将刺激导线沿着椎骨水平胸8(ts)和胸12(t12)定位在硬膜外腔内。导线的更头部的电极阵列可设置为单极、双极或防护阴极布置。导线的更尾部的另一电极阵列可设置为单极、双极或防护阴极布置。临床医生将能够以有条不紊的方式定制电极阵列设置,从而可基于患者的反馈而优化疗法。
[0126]
任选地,还可通过将导线定位在外周神经附近中来使用疼痛缓解,如图14中所说明。外周神经刺激(pns)为针对慢性疼痛的替代疗法,其中目标神经已经被确定为疼痛来源。目前对pns治疗效果的理解也是基于闸门控制理论。然而,外周神经中的感觉神经元的轴突由已知相应地对刺激的频率特性做出反应的神经胶质细胞包围。
[0127]
多模态外周神经刺激涉及将一个或多个刺激导线定位在目标神经周围或附近。如本文中所描述,导线连接到具有多模态容量的信号产生器。根据本技术中所描述的原理和方法,多模态刺激递送到由神经元轴突和其对应神经胶质细胞(雪旺氏细胞)组成的神经组织。可使用侵入性手术途径或经皮地利用针套管来将导线植入以定位在目标神经周围。
[0128]
替代地,如将为接近皮肤表面的目标神经(例如迷走神经、四肢关节中的神经等)的刺激的情况,导线可布置在导电生物兼容性垫内部以用于经皮递送多模态电磁场。此实施例构成经皮电神经多模态刺激(tenms)。在此实施例中,多模态信号的启动高频组分降低皮肤和皮下组织的阻抗,并且允许强直信号的更好穿透。启动信号还为神经肌肉关节中的突触周围神经胶质细胞提供调制信号。已知这些细胞区别不同刺激模式且相应地做出反应,因此允许用多模态刺激调制突触。多模态信号的强直组分用于在下限阈值下刺激神经元轴突。
[0129]
系统组件
[0130]
图1在概念上说明可用于执行本文中所公开的方法的多模态刺激系统的实施例。如所说明,系统包括其中的每一个可以电极接触件阵列予以实施的一对电导线30和32、分接盒18和信号产生器17和19。分接盒18通过适当的连接器电耦合到导线30和32以及信号产生器17和19。分接盒18以及信号产生器17和19可放置在被称作外部刺激器单元(esu)系统16的罩壳中。产生器17和19中的每一个递送具有可针对彼此单独设置的参数的特定信号。产生器17和19中的每一个可具有类似于本文中所描述的产生器20的功能特性和架构元件,而无适合于植入到患者体内的外部罩壳。在一个实施例中,系统16还可包含本文中参考可植入多模态产生器20和图2所描述的模块中的一个或多个。
[0131]
esu系统16电耦合到其中的每一个可以电极接触件阵列予以实施的电导线。在实施例中,如图1中所说明,一对导线30和32使用适当的连接器来耦合到esu 16。在另一实施例中,可使用以电极阵列予以实施的单个导线。在用于执行主要多模态调制的配置中,产生器17或19中的一个可被配置成递送启动组分,例如1,200hz,并且另一产生器可被配置成递送强直组分,例如,以50hz。分接盒18可用于重新配置信号到导线30和32中的恰当电极接触
件的递送。在图1中所说明的实施例中,电极阵列30中的电极接触件1
‑
8可被拆分,使得电极接触件1
‑
4递送不同于在其电极接触件5
‑
8处递送的例如启动信号的第二信号的第一信号,例如,强直信号。类似地,电极阵列32中的电极接触件9
‑
16可被拆分,使得其电极接触件9
‑
12递送类似于由电极阵列30中的电极接触件1
‑
4递送的信号的信号,而其电极接触件13
‑
16递送类似于在电极阵列30中的电极接触件5
‑
8处递送的信号的信号,如所说明。
[0132]
可植入多模态产生器
[0133]
图2在概念上说明包括可植入多模态产生器(img)20的元件的框图。产生器电路系统可气密地密封在由例如不锈钢或钛的耐久生物兼容性材料制成的壳体中。产生器20具有用于建立与在将多模态信号递送到神经胶质细胞和神经元的先前描述的导线30和32内实施的电极阵列电连接的输出接口。在一个实施例中,可植入多模态产生器20包括中央处理模块25、存储器模块28、遥测模块26、电源模块21、信号产生器模块23、信号产生器模块24,以及分接和延迟模块22,以及信号处理器27,包含其输出接口。在实施例中,可植入多模态产生器20的元件可如图2中所说明的互连,或可通过中央总线连接,这取决于实施方案而实现所有组件之间能够相互通信。
[0134]
中央处理模块25可以微处理器集成电路予以实施或可包括功能性减小的小比例逻辑,但在任一实施方案中包含实现与外部编程器单元(未展示)或用户控制的遥控器36的信息的双向无线通信的无线收发器功能性。
[0135]
可以ram或rom存储器予以实施的存储器模块28可用于存储可由中央处理模块25执行的调制程序,所述中央处理模块产生产生器20的功能信息。中央处理模块25能够按照用户的命令从存储器模块28存储和检索信息。
[0136]
遥测模块26用于经由无线协议与外部编程器单元(或控制遥控器)通信且包含收发器电路系统以便根据任何数目个已建立的无线协议与远离产生器20的装置进行无线通信。
[0137]
电源模块21可包括可再充电或不可再充电电池和将来自电池的电力分配到可植入多模态产生器20中的所有其它组件的电子电路。
[0138]
信号产生器模块23包括允许递送任何波形的电荷平衡波形的电子电路系统,所述波形包含但不限于双相或单相脉冲、正弦波列、锯齿波列、三角波列和其脉冲串。
[0139]
在一个实施例中,信号产生器模块23包括允许噪声信号的递送的电子电路系统,所述噪声信号例如具有恒定功率频谱密度的白噪声或在倍频程间隔中具有相等能量的粉红噪声,或其中信号频谱内的能量以其它模式分布的其它噪声信号。在一个实施例中,噪声信号可用作本文中所公开的技术中的启动组分。信号产生器模块23能够在1hz到100khz的范围内的频率下递送这些波形。对于脉冲递送,取决于频率,信号产生器模块23能够在例如小至1μs且大至250ms的宽度的范围内递送矩形脉冲波。信号产生器模块23进一步能够产生一定范围的相间延迟。信号产生器模块23被设计成分别在例如0v到30v或0ma到30ma的值的范围内递送具有电压控制或电流控制的幅度的信号。信号产生器模块23还能够产生具有占空比的脉冲。信号产生器模块23由中央处理模块25根据用户在外部编程器单元(或控制遥控器)中选择的参数进行控制。信号产生器模块23可以模拟或数字电路系统或其组合予以实施。
[0140]
信号产生器模块24可在结构上和功能上类似于或不类似于信号产生器模块23,并
且可独立地控制和编程。
[0141]
信号处理器27可以专用数字信号处理器(dsp)予以实施,或可包括可编程通用dsp。信号处理器27可以任何数目个商业上可获得的信号处理集成电路组件予以实施,所述信号处理集成电路组件具有能够对输入到其中的一个或多个信号执行算法操纵的专用指令集和处理器。
[0142]
信号处理器27从信号产生器模块23和24接收信号并且可编程以执行用于将单独信号组合成单个复合信号的多种算法,包含幅度调制、频率调制、信号求和、信号同步、相位调制、卷积等中的任一个,或其任何组合,以及响应于用户输入数据而从波表或数字振荡器实时产生定制信号。信号处理器27可具有与其相关联的用于在执行信号处理或其它任务时本地存储数据和程序变量的暂存性存储器区域。另外,信号处理器27还可包括专用模拟电路系统,例如滤波器、控制电路系统和用于从来自信号产生器模块23和24的信号产生复合信号的电路系统。取决于由信号产生器模块23和24产生的信号的输出是模拟的还是数字的,信号处理器27还可包含其自身的模数转换器和用于将任何输入信号转换成恰当格式以用于处理和将信号转换成恰当格式以用于输出到分接和延迟模块22的数模转换器。
[0143]
分接和延迟模块22包括精确的定时器电子电路系统,其可使信号产生器模块23或24中的一个从属于另一个,使得可在从其产生的信号之间产生延迟,从而可由用户对此类信号的同步递送进行编程。分接和延迟模块22还并入有被称为分接件的电子电路系统,其允许用户选择其中输出阵列1将信号递送到一对电极阵列的所有顶部(在脊髓刺激期间的嘴部)电极接触件(例如,强直50hz,250μs脉冲宽度,3.0ma),而输出阵列2将信号递送到一对电极阵列的所有底部电极接触件(例如,具有1,200hz、100μs脉冲宽度、3.5ma的启动信号)的选项。此选项的实例展示于图3a中。
[0144]
另一选项为图38中所说明的一个选项,其中可略过分接选项。在所述情况下,给定电极阵列中的所有接触件将被设置为与由例如信号产生器模块23递送的调制参数相同的调制参数。另一电极阵列中的所有接触件将被设置为与由另一信号产生器模块提供的调制参数相同的调制参数。在其中将相同复合信号作为输出提供到阵列1和阵列2的实施例中,分接和延迟模块22的功能性可完全由信号处理器27执行,从而避免了对分接和延迟模块22的需要,假设适当的输出接口用于将信号处理器27的输出恰当地耦合到电极阵列。
[0145]
在一个实施例中,产生器20的所有或大部分功能块可制造在单个集成电路芯片上,所述集成电路芯片包含微处理器和相关联的存储器、无线换能器和一个或多个数字振荡器。替代地,数字振荡器可换成其中已存储有各种波形数据值的数学描述的波表,所述波表可使用数模转换器转换成模拟信号,取决于其相应实施方案而集成到处理器模块25或信号产生器模块23或24中或与所述处理器模块或信号产生器模块相关联。此类波表可存储在处理器模块25或存储器模块28中。
[0146]
在其它实施例中,img 20的各种模块可经由其内部的中央总线通信,或可具有其间的专用直接连接,或其任何组合。
[0147]
在一个实施例中,img 20或esu 16可由临床医生使用允许控制系统的所有方面的软件来进行编程。所述软件可在被称为临床医生编程器(cp)软件的基于计算机的界面中进行存取。所述软件可以无线通信协议予以实施以用于img 20或esu 16的远程存取。esu 16还可具备用于与cp交互的例如usb或微ubs端口的网络端口。在img 20的情况下,cp软件使
得临床医生能够与中央处理模块25通信以定义由信号产生器模块23或24产生的信号的参数集,例如幅度、频率、相位、相位极性、波形形状和宽度(矩形波形)等中的任一个,并且通过定义分接和延迟模块22的操作参数来进一步定义其相对定时的参数。此类经定义参数集可作为一个或多个配置程序存储在存储器模块28中或在与中央处理模块25相关联的存储器中。
[0148]
在一个实施例中,一个或多个配置程序可存储在与远程控制器36相关联的存储器中,并且其参数可通过遥测模块26传递到img 20以用于控制产生器模块23或24以及分接和延迟模块22。cp软件可使得临床医生能够进一步定义患者可通过远程控制器36控制哪一参数并且定义对此类参数的任何限制。
[0149]
举例来说,临床医生可设置和存储具有参数的配置程序#1,所述配置程序提供由具有设置为1,200hz、150μs pw的双相对称矩形脉冲信号组分和设置为%ppt的基于电流的幅度的启动以及递送50hz、400μs pw和设置为%pt的基于电流的幅度的双相非对称脉冲(矩形和指数衰减相位)的强直信号组分组成的主要多模态刺激。复合信号可递送到导线中的特定电极集合。
[0150]
临床医生还可设置和存储配置程序#2,所述配置程序提供由具有在900hz和300μs pw下的双相对称矩形脉冲的启动信号组分和递送100hz和400μs pw且各自设置为其自身的基于电流的幅度设置特定%pt的双相对称矩形脉冲的强直信号组分组成的主要多模态刺激。这些信号可递送到可不同于配置程序#1中所使用的电极集合的导线中的特定电极集合。系统允许根据存储器模块28的存储容量设置和存储临床医生认为必要的额外配置程序。
[0151]
多模态配置程序的有限控制可经由远程控制器36供患者使用。在一个实施例中,临床医生可使用cp存取一个或多个配置程序以控制已存储在esu 16或img 20中的配置程序的参数中的任一个。患者可能够用远程控制器浏览和/或选择任何可用的配置程序。举例来说,患者可能够将任何特定配置程序的基于电流的幅度改变为由ppt或pt确定的特定设置,以便优化疼痛缓解。应注意,远程控制器36可具备简单接口,例如选择器开关或拨号盘,以选择适当的配置程序,或包含具有方向键或触敏菜单的视觉显示器的更复杂的用户接口。
[0152]
在本文中所描述的实施例中,存在用于通过编程装置对系统进行用户反馈和控制的选项。如上文所陈述,用于启动和强直频率的初始设置将由医生或临床领域工程师编程。在此之后,装置可允许患者改变许多设置,包含启动频率和强直频率、任一频率的参数,例如幅度、占空比、脉冲宽度或相位。在一个实施例中,患者将能够将强直刺激频率从其初始设置调整到10hz与启动频率(fp)减一之间的任何频率。使用1,200hz的启动频率的上述实例,强直频率可在10hz与1,199hz之间进行调整。
[0153]
在另一实施例中,患者将能够更改强直幅度的幅度,其中幅度的范围限于零与启动刺激幅度之间。在刺激波形由通过潜伏期分隔的离散脉冲构成时,患者还可能够更改启动刺激或强直刺激的脉冲宽度和占空比。这些值将受到所选择频率的限制。刺激频率决定了脉冲之间的时间(本文中定义为周期)。由于电荷平衡的要求,脉冲宽度不可大于周期除以二。因此,患者可在10μs的最小值与周期的一半之间移位脉冲宽度。
[0154]
最后一个由患者控制的方面是波形的相位。在此实施例中,患者将能够在其整个
周期内移位强直刺激或启动刺激。零的相位将对应于在占空比开始时出现的脉冲,并且循环的其余部分不含刺激。用户可将脉冲的位置沿着占空比移位到任一点,其中相位被限制在等于周期的最大值。脉冲在其周期内的相移会产生电场或信号自身的不同建设性影响。这将产生神经组织特有的波形,尽管其由相同的启动频率和强直频率构成。允许患者调整这些参数的目的是让每一患者能够更好地控制其疼痛缓解。
[0155]
图4在概念上说明表示在主要多模态调制的实例中使用的信号40和45的一对迹线。信号40充当启动电组分且可包括例如其中频率为1,200hz、pw=200μs和相间延迟为20μs(尽管本文中考虑了其它延迟,例如,疗法脉冲与再充电/恢复脉冲之间的80微秒延迟,其中恢复脉冲的结束与下一刺激脉冲之间有40微秒的间隙(例如,对于指数衰减恢复脉冲))的双相矩形脉冲。信号45充当强直组分且可包括例如其中频率为50hz、pw=200μs且相间延迟为20μs的双相矩形脉冲。在此实例中,强直组分的幅度被设置为大于启动组分的幅度。为了视觉清晰度起见,信号40和信号45已在图4中偏移。信号40和45可用于使用本文中所描述的系统和技术来产生复合信号。
[0156]
图5在概念上说明表示在主要多模态调制的实例中使用的信号50和55的一对迹线。信号55充当启动电组分且可包括例如其中频率为1,200hz、pw=150μs且相间延迟为20μs的双相矩形脉冲。信号50充当强直组分且可包括例如其中频率为50hz、pw=400μs且相间延迟为20μs的双相非对称矩形/指数衰减脉冲。在此实例中,强直组分的幅度被设置为大于启动组分的幅度。信号50和55可用于使用本文中所描述的系统和技术来产生复合信号。
[0157]
图6在概念上说明表示在主要多模态调制的实例中使用的信号60和65的一对迹线。信号60充当启动电组分且可包括例如具有特定最大幅度的白噪声。信号65充当强直组分且可包括例如其中频率为50hz、pw=400μs且相间延迟为20μs的双相对称矩形脉冲。在此实例中,强直组分的幅度被设置为大于启动组分的幅度。应注意,在图4
‑
6中,为了视觉清晰度起见,表示强直波形和启动波形的信号偏移,此类偏移并不意味在任何情况下都是限制性的。信号60和65可用于使用本文中所描述的系统和技术来产生复合信号。
[0158]
esu 16或img 20可使用单个复合调制/刺激信号来递送多模态刺激,所述信号具有有节奏地变化的特性,并且因此具有获得与组合两个单独信号组分时相同的结果的交变磁场特性。在此类实施例中,利用特征在于典型交变特性的复合信号以获得对神经胶质细胞与神经元之间的相互作用的相同刺激和调制。此类复合信号可由信号处理器27产生,所述信号处理器能够执行用于将单独信号组合成单个复合信号的多种算法,包含幅度调制、频率调制、信号求和、信号同步、相位调制,或卷积或其任何组合,以及从波表或实时产生定制信号,此类复合信号具有周期性或非周期性特性中的任一个。另外,脉冲宽度调制可用于产生具有可变地改变的谐波能量含量的复合信号,可类似地利用所述复合信号来获得对神经胶质细胞和神经元细胞的所要多模态刺激。
[0159]
图7
‑
12在概念上说明通过频率调制、双组合正弦、双组合双相矩形脉冲、频率变化信号和白噪声分别与低频脉冲组合形成的可用于多模态调制的多模态复合信号的实例。图7在概念上说明经频率调制的复合信号70,其中在于不一定等于递送启动组分的时间段的给定时间段内递送其强直信号组分之前的给定时间段内递送其启动信号组分。在所说明实施例中,复合信号70可由递送达1ms的1,200hz的正弦启动组分接着递送达2ms的180hz的正弦强直组分形成。利用本文中所描述的用户接口,用户可能够控制如本文中所描述的每一
启动信号和强直信号组分的频率、幅度和持续时间。
[0160]
图8在概念上说明双正弦复合信号80,其中启动组分具有较低幅度且被卷积成强直组分。在所说明实施例中,复合信号80可由100hz的正弦强直组分和1,200hz的正弦启动组分形成,其中强直组分具有为启动组分的幅度的八倍的幅度。利用本文中所描述的用户接口,用户可能够控制如本文中所描述的每一组分的频率、幅度和相移。
[0161]
图9在概念上说明由两个双相矩形信号组成的复合信号90。启动组分具有比强直组分的幅度更低的幅度且与强直信号进行卷积。在所说明实施例中,复合信号90可由10,000hz和50μs pw的启动信号在具有900μs pw的250hz双相矩形信号中卷积形成,其中强直组分的幅度为启动组分的幅度的十倍。利用本文中所描述的用户接口,用户可用户将能够控制如本文中所描述的每一组分的频率、幅度和相移。
[0162]
图10在概念上说明由两个双相矩形信号组成的复合信号100。启动组分具有比强直组分的幅度更低的幅度且与强直信号进行卷积。在所说明实施例中,复合信号100可由1,200hz和150μs pw的启动信号在具有400μs pw的50hz双相非对称矩形/指数衰减信号中卷积形成,其中强直组分的幅度为启动组分的幅度的五倍。利用本文中所描述的用户接口,用户可能够控制如本文中所描述的每一组分的频率、幅度和相移。
[0163]
图11在概念上说明频率变化的复合信号110,其中启动组分初始地以大于强直组分的频率递送,并且接着在开始新信号循环之前在给定时间内减小到强直组分频率。实例可包括1,000hz的开始启动频率,所述开始启动频率在50ms周期内下滚到200hz的强直频率,同时幅度保持恒定。在所说明实施例中,在信号从启动频率下滚到强直频率时,复合信号110可根据幅度的线性或非线性改变形成。利用本文中所描述的用户接口,用户可能够控制如本文中所描述的每一组分的频率、幅度和下滚时间。
[0164]
图12在概念上说明复合信号120,其中启动组分为噪声且与双相对称矩形强直组分进行卷积。在所说明实施例中,复合信号110可由等效于具有100hz的强直频率和200μs pw的强直组分幅度的三分之一的噪声幅度形成。可在10
‑
500hz范围内随机且非线性地递送强直组分,以便产生随机谐振效应。在将随机谐振用于强直组分的实施例中,可能需要伪随机信号产生技术。举例来说,可使用一系列齐纳二极管和晶体管获得随机化,以产生基于通过电路的电子的随机移动的伪随机信号。
[0165]
在一些实施例中,可从设置成各种伪随机计数参数的石英振荡器和定时电路的谐波振荡中获得随机化。在其它实施例中,基于珀尔帖的热电偶可用于基于患者的身体的热噪声而产生随机化。所属领域的技术人员应了解,可利用许多其它基于数字或模拟电路的配置来获得随机数。一旦获得,随机数可用于产生数字高或低信号,从而产生一系列随机的强直脉冲以施加到神经组织。此类随机化电路还可用于产生近似于真实白噪声、粉红噪声、蓝噪声、褐噪声、灰噪声或频谱内的任何其它能量分布的噪声。
[0166]
利用本文中所描述的用户接口,用户将能够控制如本文中所描述的每一组分的频率、幅度和相移。
[0167]
根据本公开的实施例,多模态产生器20的中央处理器模块25可存取存储的数字数据,所述数字数据在数学上描述了一个或多个信号的波形,并且可从此类数据阶跃函数中产生不同频率的模拟信号。处理器对此类数据进行算法操纵以获得所要信号处理结果。与中央处理模块25相关联的数模转换器可将处理后的信号转换成具有正确幅度的单个输出
以用于耦合到一个或两个电极阵列30和32。以此方式,可用能够以模拟两个单独信号的使用的方式刺激/调制神经胶质细胞与神经元之间的相互作用的单个电复合信号来实现两个单独信号的相互作用效应。
[0168]
在模拟经频率调制的主要多模态调制信号的复合信号中,构成信号组分,例如启动信号或强直信号,可在频率调制算法中充当程序或载波信号。举例来说,经频率调制的多模态信号可具有比调制频率(例如,50hz)更大(例如,1,000hz)的载波频率,从而得到如图7中所说明的刺激信号。在另一实例中,经频率调制的多模态信号可具有比调制频率(例如,1,000hz)更小(例如,50hz)的载波频率,从而得到如图8中所说明的刺激信号。在这些实施例中,可在10
‑
500hz范围内随机且非线性地递送强直组分以产生如本文中所描述的随机谐振效应。
[0169]
图13在概念上说明在人类受试者处于俯卧位置的情况下的可植入系统的另一实施例。展示可植入系统的实例,其中两个导线30和32都定位在背侧脊髓上方在特定椎骨水平处。可编程可植入多模态产生器(img)20使用导电缆线来附接到导线,并且通过可植入多模态产生器20内的含于电源模块21内的可再充电或不可再充电的长寿命电池供电。外部电池充电器34可用于使用电感(即,无线)充电对产生器再充电。可以包含蓝牙或其它的任何数目个无线通信协议予以实施的无线远程控制件36可用于与img 20通信以使得患者能够在医生的决定下调整参数。所述系统可使用外部编程器单元来编程,所述外部编程器单元例如可经由无线通信协议将信息传递到img 20的计算机(未展示)。
[0170]
图14在概念上说明在人类受试者处于俯卧位置的情况下的可植入系统的另一实施例。展示类似于本文中参考图13所说明的系统的可植入系统的实例,其中导线定位在外周神经附近。
[0171]
根据本公开的再另一方面,一种用于控制受试者的疼痛的方法包括通过调节钙结合蛋白、细胞因子、细胞粘附或特异性免疫反应蛋白的基因中的任一个的多模态电磁刺激来激活神经胶质细胞,以及在一时间段期间全身性地、硬膜外地或鞘内地将药理学物质施用于受试者。在其它实施例中,此类药理学物质可通过刺激导线注射,所述刺激导线可具有将药理学试剂直接递送到硬膜外腔或鞘内腔中的端口。任选地,可使用缓释制剂来将药理学试剂浸渍到刺激导线上,以便将药理学物质缓慢洗脱到导线周围的神经组织中。
[0172]
适合与所公开方法一起使用的药理学物质可包括代谢型或离子型谷氨酸受体拮抗剂,例如(s)
‑4‑
羧基苯基甘氨酸(cpg)、(rs)
‑
a
‑
甲基
‑4‑
羧基苯基甘氨酸(mcpg)或犬尿氨酸(kya)。在另一实施例中,合适的药理学物质可包括钾通道拮抗剂,例如4
‑
氨基吡啶(4ap),或α
‑
2肾上腺素能受体激动剂,例如可乐定,或钙通道激动剂,例如w
‑
芋螺毒素mvllc,nmda受体激动剂,例如氯胺酮或神经胶质细胞调制剂,如阿仑膦酸盐、环孢菌素a、大麻素受体激动剂(cb1r或cb2r)或针对至少细胞因子(例如肿瘤坏死因子α、白细胞介素1或6等)的单克隆抗体,或融合蛋白,如依那西普或阿巴西普。此类药理学物质可通过调制神经胶质细胞内或外的谷氨酸、钾或钙离子的释放来帮助激活或去激活神经胶质细胞。
[0173]
在一个实施例中,激活神经胶质细胞包括使神经胶质细胞暴露于刺激,所述刺激是复合电磁场。由单个、两个或多个同步施加的电磁场产生的多模态信号可通过降低所施用的药理学试剂渗透组织的阻力同时提供根据此类药理学试剂(离子电渗效应)的电性质(极性、极化率)将药理学化合物导向目标神经组织的电力来促进所述药理学试剂的靶向递
送。多模态信号的启动组分的刺激特性可降低组织阻力,因此药理学物质可更好地渗透到目标神经组织中。另外,可优化多模态电场的极性以将药理学物质导向到前述目标神经组织。
[0174]
实例1
[0175]
参考图15,实行使用神经性慢性疼痛的动物模型的初始试点研究(n=29)。在此研究中,通过在三叉分支点处横切坐骨神经的胫骨和腓骨分支,同时保留腓肠神经,以手术方式引发外周神经损伤(保留性神经损伤sni模型)。在横切四天之后,受试者出现机械和热超敏反应(异常性疼痛),这被视为类似疼痛的行为。受试者在对应于坐骨神经的神经支配的椎骨水平处植入有小的圆柱形四接触件导线,所述导线以手术方式安装到所述受试者的硬膜外腔中。在术后第四天,使用冯弗雷(von frey)细丝对受试者进行行为测试。这些具有不同拉伸强度的细丝用于测量受神经损伤影响的皮肤区域对机械刺激的敏感性。在sni模型中,损伤同侧后爪的足底区域变得超敏。超敏受试者将在用极低拉伸强度的细丝刺激时抽出其脚爪。与用作正常行为控制的对侧后爪相比,同侧后爪的机械超敏反应明显。
[0176]
在多模态刺激的一个特定实例中,植入在大鼠脊髓背侧上方硬膜外腔中的电极连接到电流源,所述电流源递送启动信号,所述启动信号由以0.1ma(33%运动阈值,mt)的幅度以1,200hz和30μs的pw振荡的电荷平衡双相对称矩形脉冲组成。其与强直信号组合,所述强直信号为以50hz、50μs的pw和0.2ma(66%mt)的幅度振荡的电荷平衡双相对称矩形脉冲。连续地施加电刺激达两小时,并且在受试者正受到刺激时每十五分钟执行一次机械敏感性行为测试。在刺激关闭达一小时之后每十五分钟继续进行行为测试,并且接着每小时进行一次,直到刺激后三小时。图16将结果展示为从其中获得的各种记录的平均值。
[0177]
行为数据指示,多模态刺激在刺激十五分钟之后改善机械异常性疼痛,刺激关闭之后改善持续多于一个小时,指示所施加场存在残余效果,此表明对神经系统的调制。
[0178]
实例2
[0179]
在实例中,在外周神经损伤之后慢性神经性疼痛引发的大鼠中评估脊髓刺激(施用达72小时)的同侧背脊髓(dc)组织中的全基因组表达效应。确切地说,在实例中,对于连续scs动物和假手术治疗动物在一种最常用的慢性神经性疼痛(保留性神经损伤,sni)的啮齿动物模型中的动物之间比较了全基因组表达水平,所述假手术治疗动物即其中疼痛模型被诱发且其被植入但不被刺激的动物。
[0180]
目前研究中所采用的实验室大鼠的商业上可获得的全基因组表达谱微阵列能够调查约21,000个基因的表达。基于集群统计(使用加权基因相关网络分析(wgcna))的富集分析允许确定包含在生物学作用方面彼此高度相关的基因的模块(或子集)。基因本体分析允许根据更具体的生物过程和分子功能性对模块内的基因进行分组。允许在特定途径内确定关键基因的进一步精细化。
[0181]
如本文中所描述,通过比较治疗过的动物的基因组发现,scs上调和下调与各种相关过程相关联的基因。
[0182]
脊髓比较基因组学
[0183]
因为刺激是在脊髓背侧区域的顶部执行的,所以检查了脊髓背侧细胞的表达差异,此指示基因在此组织中的分子功能性和生物学功能上的作用。wgcna确定了scs显著上调了参与免疫系统激活的基因(错误发现率(fdr)调整后的p值=0.016);而参与磷酸化和
与跨膜转运相关的活性的基因(fdr p值=0.011)被下调,与包含再生和发育的神经元活性的调节相关联的基因也被下调。数据的精细化确定了52个关键基因。在这些关键基因当中,以下被确定为尤其值得注意,因为它们被描述为参与神经胶质激活、免疫反应和神经元活性的过程:
[0184]
钙结合蛋白(cabp1):此基因由scs确定为显著下调(即,减少1.4倍到1.5倍)。经编码的钙结合蛋白1调节肌醇1,4,5
‑
三磷酸(itp)受体的钙依赖性活性。itp受体经由钙波参与星形胶质细胞之间的传信,所述钙波被认为在传播星形胶质细胞激活的细胞间通信中起发挥cabp1的下调可能会减少星形胶质细胞的激活,否则星形胶质细胞有利于突触重塑,从而导致慢性疼痛状态。
[0185]
toll样受体2(tlr2):此基因由scs确定为显著上调(即,增加2.4倍到2.8倍)。tlr2在包含微神经胶质和星形胶质细胞的经激活神经胶质细胞中表达;然而,在经激活微神经胶质中的表达大于在星形胶质细胞中的表达。经编码的toll样受体2蛋白诱导可能导致例如il
‑
10的抗炎细胞因子分泌的一系列事件。
[0186]
趋化因子cxcl16:此基因由scs确定为显著上调(即,增加2.2倍到3.6倍)。此为通过刺激驱动神经胶质细胞与神经元之间的相互作用的跨膜趋化因子。cxcl16由微神经胶质和星形胶质细胞表达,作为神经保护剂。scs对此基因的上调指示脊髓中的神经保护过程可能涉及对微神经胶质的调制。
[0187]
神经胶质成熟因子(gmfg):此基因由scs确定为显著上调(即,增加2.1倍到2.3倍)。此基因被认为参与神经胶质分化和神经再生。人们对此基因知之甚少。scs对其的上调可能与可能导致神经元再生的神经胶质激活过程相关联。
[0188]
由脊髓刺激确定为上调或下调的其它关键基因参考下表2进行描述:
[0189]
表2
[0190]
[0191][0192][0193]
对于上述基因,经考虑任何被认为具有统计学意义的表达水平改变都可预测结果(例如,可在充足持续时间内操纵双相信号以产生经调制的神经胶质细胞内的一个或多个此类基因的表达的统计学显著改变,作为scs已对受试者实现所要效果的指示)。与适当的对照(例如,对照细胞、组织和/或值)相比,上调的统计学显著水平可包含所测定细胞、群和/或组织的至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍、至少1
‑
9倍、至少2倍、至少2.1倍、至少2.2倍、至少2.3倍、至少2.4倍、至少2.5倍、至少2.6倍、至少2.7倍、至少2.8倍、至少2.9倍、至少3倍、至少3.1倍、至少3.2倍、至少3.3倍、至少3.4倍、至少3.5倍、至少3.6倍、至少3.7倍、至少3.8倍、至少3.9倍、至少4倍、至少5倍等。类似地,与适当的对照(例如,对照细胞、组织和/或值)相比,下调的统计学显著水平可包含所测定细胞、群和/或组织的至少1.2倍、至少1.3倍、至少1.4倍、至少1.5倍、至少1.6倍、至少1.7倍、至少1.8倍,至少1
‑
9倍,至少2倍,至少2.1倍,至少2.2倍,至少2.3倍,至少2.4倍,至少2.5倍,至少2.6倍、至少2.7倍、至少2.8倍、至少2.9倍、至少3倍、至少3.1倍、至少3.2倍、至少3.3倍、至少3.4倍、至少3.5倍、至少3.6倍、至少3.7倍、至少3.8倍、至少3.9倍、至少4倍、至少5倍等。
[0194]
许多参与炎症和免疫反应的基因都与神经胶质活性相关联。外周神经损伤伴随着
基因和蛋白质的调节,不仅在损伤部位处,而且在传入的同侧cns结构中,例如drg和脊髓。近期在神经性疼痛的sni动物模型的脊髓和drg中执行了蛋白质组学分析。此研究指示,观察到蛋白质沿着轴突向体细胞转运和易位,并且接着相互蛋白质转运回外周以诱导轴突再生。有趣的是,脊髓呈现出神经保护蛋白,其中一些与神经胶质细胞激活相关联。损伤后神经胶质细胞的激活诱导了一系列事件,包含炎症和免疫反应,其接着发展为有利于神经元的异位放电的外周敏化。警报最终扩展到脊髓水平的cns,其中微神经胶质显然试图保护系统的完整性。最终,神经胶质细胞反应过度且诱导了重塑突触的因子的释放。这些突触可塑性的改变表现为慢性疼痛。
[0195]
结果指示对脊髓的电刺激引发了调制神经胶质细胞和神经元之间相互作用的基因和蛋白质的调节。这些分子事件产生镇痛作用是合理的。
[0196]
实例3
[0197]
相位极性对先前提出的基因调制的影响是使用慢性神经性疼痛的动物模型实行的。在此实例中,脊髓组织是从动物身上获得的,使用每相50hz的频率和200μs的脉冲宽度的矩形波形来刺激所述组织,所述波形可为单相阴极、单相阳极或具有初始阴极极性的对称双相。从组织中提取rna且通过逆转录制备cdna。使用实时pcr来评估rna表达水平,并且对水平进行量化和标准化。基于上述实验(实例2),选择包含用于神经胶质激活标记物(tlr2、cxcl16)、用于钙依赖性神经胶质过程的标记物(cabp1)、用于免疫系统激活的标记物(cd68)和阿片受体(oprm1)的一组基因以供分析。
[0198]
图17a
‑
17e在概念上说明所观察到的所选择基因的表达水平相对于刺激波形中使用的相位的极性的图表,所述所选择基因包含a)钙结合蛋白(cabp1);b)趋化因子(cxcl16);c)toll样受体2(tlr2);d)cd68分子;e)阿片受体mu
‑
1(oprm1)。很明显,信号相位的极性影响了这些基因的调节。双相刺激相对于阳极刺激和阴极刺激增加了响应于星形胶质细胞释放谷氨酸的与神经胶质激活相关联的基因(tlr2和cxcl16)的水平。相对于单相刺激(阴极或阳极),双相刺激增加了cabp1的水平。单相刺激(阴极或阳极)和双相刺激两者都产生类似水平的免疫相关基因cd68,以及编码阿片受体oprm1的基因。
[0199]
实例4
[0200]
受试患者是一名65岁的女性患者,其诊断为糖尿病神经病变综合征,主诉下肢到足部的严重双侧疼痛。患者多次治疗失败,所述治疗包含物理疗法、药物控制和手术干预。
[0201]
患者接受了基于高频无感觉异常的scs系统的脊髓刺激器试验。两个导线定位在硬膜外腔后部,导线中的一个的顶端位于ts的顶部且另一个位于t9的顶端。患者在七天之后返回以结束高频无感觉异常scs试验,患者报告仅30%的疼痛缓解。
[0202]
此时,应用了本公开的多模态刺激系统。所述系统使用两个外部产生器来进行重新编程,以在神经组织中产生复合信号。一个产生器设置为50hz、400μs pw的强直。另一个设置为900hz或1,200hz、150μs pw的启动。在患者回家之前,50hz信号的幅度初始地设置为0.6ma,并且900hz信号的幅度初始地设置为2.2ma。这些幅度在治疗期间不会引发感觉异常。在疗法的20小时之后,患者报告腿部疼痛缓解了57%。
[0203]
患者经重新编程以接收1,200hz的启动频率。在重新编程之后,患者继续经历疼痛缓解而无麻刺感。更重要的是,重新编程54小时之后,疼痛缓解率增加到71%。
[0204]
试验总结:
[0205]
1.在四天的治疗期间,受试患者没有经历感觉异常。
[0206]
2.患者报告无感觉异常的多模态治疗优于高频刺激治疗。
[0207]
3.患者报告她的腿部和脚部的疼痛缓解了71%。
[0208]
4.腿部剧烈疼痛明显减轻。
[0209]
5.足部灼热感得到缓解,使得患者能够忍受比疗法之前更长的步行时间。
[0210]
实例5
[0211]
受试患者是一名76岁的女性,其被诊断患有背部手术失败综合征。患者的下背部和腿部有慢性疼痛。受试者已接受常规治疗,但未取得临床成功。治疗之前疼痛数值评分报告为8分,背部疼痛放射至腿部。使用非平行对齐(即,它们彼此偏移)植入一对scs试验导线,并且设置了高频无感觉异常程序。患者报告高频治疗后背部和腿部的完全疼痛缓解。患者报告睡眠改善和维柯丁摄入减少。接着使用多模态刺激来对患者进行重新编程,其中启动参数设置为1,200hz、150μs pw和3ma,而强直参数设置为50hz、400μs pw和4.9ma。
[0212]
在接下来的几天内,在多模态疗法下,患者的背部和腿部几乎没有疼痛(0
‑
10数值评分标度中的0
‑
1)。
[0213]
患者还报告她能够增加活动量,并且可上下楼梯(这是她在scs治疗之前避免的活动)。自处于疗法试验期以来,家人对日常活动的改善印象深刻。
[0214]
总结:
[0215]
1.在为期三天的多模态scs疗法期间,患者没有经历感觉异常。
[0216]
2.患者能够减少止痛药的摄入。
[0217]
3.患者报告了轻微的背部疼痛和腿部疼痛(0
‑
10数值标度内的平均值为0.5)。
[0218]
4.患者报告睡眠习惯有显着改善。
[0219]
5.患者报告说,她进行scs疗法之前无法进行的日常活性的能力显着提高。
[0220]
实例6
[0221]
参考图16a和168,实行了使用人类志愿者的观察性研究(n=22)。这些受试者是在标准临床实践下控制的商业脊髓刺激系统试验期的部分。受试者在完成其试验期后自愿接受尝试多模态调制。相对于脊髓刺激疗法开始之前存在的疼痛数值评分(nrs),疼痛缓解等于或高于50%指示试验期成功。所有受试者都植入有两个八电极试验导线。其中十三人的导线相对彼此交错,并且其中五人的导线彼此平行。其中九名受试者尝试了传统的基于感觉异常的刺激系统(50
‑
70hz),并且其中十三名受试者尝试了高频系统(10,000hz)。四名受试者在传统的基于感觉异常的刺激(50
‑
70hz)中试验失败,并且三名受试者在高频无感觉异常刺激(10,000hz)中试验失败。尝试了短至三小时和长至四天的多模态刺激。除22名受试者中的一名之外的所有受试者在感觉异常或感知阈值(pt)下成功尝试了多模态刺激。受试者的平均疼痛缓解率为72%,并且所有受试者都宣称对多模态刺激疗法感到满意。
[0222]
示例性实施例描述了多种患者适配/设置选项。参考图18,在1800处大体上展示了用于适配/设置患者的工作流程,并且所述工作流程包含将电极或电极组放置在神经区域(脊神经、外周神经、特定区域或集群等)处,如步骤1802中所展示。对于放置在神经区域处的电极或电极组,信号(包含频率和脉冲宽度)在强度/幅度上斜升直到指示感觉异常(步骤1804)。一旦指示感觉异常,强度就会斜升或斜降到不再指示感觉异常的程度。这提供了感觉异常阈值的指示,其可被存储为感觉异常阈值。任选地,可在1810处执行信号强度/幅度
的降低。在1812处,执行强度/幅度的调整(例如,随着时间递增)直到为患者建立最佳或首选设置。
[0223]
在示例性实施例中,在操作后,患者程序可被设置为感知百分比(%tpt或%ppt)的范围中的一个。在一个示例性实施例中,此类范围为65%
‑
75%感知。其它示例性实施例考虑的范围在20%与90%之间、30%与80%之间、40%与80%之间、50%与80%之间、60%与80%之间,等等。另外,%tpt和%ppt可能会有所不同,其中根据不同的定位或不同的效果,不同频率类型之间的百分比或电极或电极组之间的百分比不同。
[0224]
在示例性实施例中,信号的强度/幅度可初始地设置为零,随后增加直到患者指示感知阈值,随后降低到上文所提及的pt百分比。此外,在示例性实施例中,每一电极或电极组的程序设置是可个别地调整的。
[0225]
另外,在示例性实施例中,可通过在电极组上执行一个脉冲的设置,然后复制程序设置(匹配设置)或通过在将这些程序设置粘贴到其它电极组中之前对程序设置进行某些改变(不同设置)来提高编程效率。
[0226]
在示例性实施例中,感知(tpt或ppt)的建立还可针对每一电极组单独进行,从而提供用于确定不同所要效果(启动和强直、定位等)中的每一个的有效水平的相关水平,或提供为特定患者量身定制的可用于为所述患者快速找到最佳或首选设置的基线。
[0227]
此外,将幅度降低到百分比或感知(tpt或ppt),然后增加电极组中的每一个或组类型(启动与刺激/强直)可能是有益的,因为:其可促进从减轻疼痛和功率消耗角度(相对于从感知和递减开始,本说明书也考虑了这一点)两者中进行有益的选择;认识到即使不同刺激类型(启动和强直)之间存在协同作用,但在每一组或类型的幅度独立地设置时,所述组合也会额外有效;并且认识到不同的刺激类型可能会由患者不同地感受到,患者更喜欢一种而不是另一种。
[0228]
正如已提及的那样,额外示例性实施例包含用于为患者建立舒适水平的替代方法,例如建立感知并且不是减少到百分比而是向上或向下递增以找到舒适水平。和以前一样,此可对一个或多个组进行且复制(或部分复制),或可在没有此类复制的情况下个别地完成。
[0229]
下面是其中编程效率示例性地提高的示例性编程设置过程的描述。
[0230]
实例7
[0231]
选择某一脊柱位置来分配电极。举例来说,可指定最靠近t8和t9的中间的电极。对于“a组”程序1,阴极放置在/分配到最靠近t8的中间的电极。阳极放置在阴极下方的两个电极上。将装置速率设置为所要频率,例如300hz;并且将编程速率改变为低于装置速率的速率,例如,1/6装置速率,或50hz。脉冲宽度可设置为所要宽度,例如,200微秒。程序1可关闭。对于a组中的程序2,阴极可放置在最靠近t9的中间的电极上,并且阳极放置在阴极下方的两个电极上。可设置脉冲宽度的一些变化,例如,pw=170微秒。程序2可关闭。
[0232]
在示例性程序设置中,b组可与a组相同地设置,不同之处在于其比a组低1/2椎骨段(并且在第二导线上)。b组被激活且程序1被选择。程序1被激活,所有电极都被选择。阴极和阳极接着滑下半个椎骨段(其中阴极现在位于最靠近t9的顶部的电极上)。程序2被激活,所有电极都被选择;并且阴极和阳极滑下半个椎骨段(其中阴极位于最靠近t9/t10椎间盘空间的电极上。所述程序关闭。
[0233]
在另一示例性“c组”程序设置中,电极设置与a组相同,不同之处在于其比a组低四分之一椎骨段,同样,在第二个导线上。c组被激活,选择程序1。程序1被激活,选择所有电极。随后,阴极和阳极向下滑动四分之一椎骨段(其中阴极位于最靠近t8的底部的电极上)。随后,程序2被激活,所有电极被选择,阴极和阳极向下移动四分之一椎骨段(其中阴极位于最靠近t9的底部的电极上)。所述程序关闭。
[0234]
在示例性实施例中,对于编程幅度,对于a组,程序1(a1),程序1中的强度斜升直到感觉到感觉异常。随后,其以个别增量斜降直到患者失去感觉异常。此被记录为ld感觉异常阈值。强度随后降低到pt百分比(例如,70%)作为最终ld幅度,程序1的刺激继续保持。
[0235]
改变为a组中的程序2(a2),程序2中的强度斜升直到感觉到感觉异常。随后,强度以个别增量斜降直到患者失去感觉异常。所述值被记录为hd感觉异常阈值。强度降低到pt百分比(例如,65%)并且被记录为最终hd幅度。程序2的刺激继续保持。
[0236]
对于a组程序3(a3),强度增加到a组程序2的强度。对于a组程序4(a4),强度增加到a组程序2的强度。
[0237]
在示例性实施例中,对于编程幅度,对于b组程序1(b1),程序1中的强度斜升直到感觉到感觉异常。随后,其以个别增量斜降直到患者失去感觉异常。此被记录为ld感觉异常阈值。强度随后降低到pt百分比(例如,70%)作为最终ld幅度,程序1的刺激继续保持。
[0238]
改变为b组中的程序2(b2),程序2中的强度斜升直到感觉到感觉异常。随后,强度以个别增量斜降直到患者失去感觉异常。所述值被记录为hd感觉异常阈值。强度降低到pt百分比(例如,65%)并且被记录为最终hd幅度。程序2的刺激继续保持。
[0239]
对于b组程序3(b3),强度增加到b组程序2的强度。对于b组程序4(b4),强度增加到b组程序2的强度。
[0240]
在示例性实施例中,对于编程幅度,对于组c程序1(c1),程序1中的强度斜升直到感觉到感觉异常。随后,其以个别增量斜降直到患者失去感觉异常。此被记录为ld感觉异常阈值。强度随后降低到pt百分比(例如,70%)作为最终ld幅度,程序1的刺激继续保持。
[0241]
改变为c组中的程序2(c2),程序2中的强度斜升,直到感觉到感觉异常。随后,强度以个别增量斜降直到患者失去感觉异常。所述值被记录为hd感觉异常阈值。强度降低到pt百分比(例如,65%)并且被记录为最终hd幅度。程序2的刺激继续保持。
[0242]
对于c组程序3(c3),强度增加到c组程序2的强度。对于c组程序4(c4),强度增加到c组程序2的强度。
[0243]
在示例性程序设置中,a2的程序被复制且粘贴到a3和a4中。类似地,b2的程序被复制且粘贴到b3和b4中。最后,c2的程序被复制且粘贴到c3和c4中。相应地,在此示例性实施例中,每一组中存在4个程序,创建了3个组,全部为0.0ma。
[0244]
在示例性实施例中,在初始设置之后,患者可以间隔开的增量朝向pt向上调整频率,例如,在调整之间具有4小时的等待时间以促进对疼痛缓解改善的准确评估。示例性实施例记录和/或调节此类调整、等待时间和评估。在其它示例性实施例中,来自患者的客观反馈可被合并到此类调整考虑中,例如经由感测患者的姿势或其它物理感测的患者方面、状况或参数的改变来使用知情循环。
[0245]
读者应了解,本文中所描述的多模态调制技术,通过例如频率、幅度或脉冲宽度调制的复合信号,和多模态调制实现,可用于调节调制神经胶质细胞与神经元之间相互作用
的基因和蛋白质,如本文中所描述。此外,如本文中所描述,还可使用多路复用技术来调节调制神经胶质细胞与神经元之间相互作用的基因和蛋白质。
[0246]
其它示例性实施例提供了一种用于控制受试者的疼痛的方法,其包括:经由至少一个电极将双相信号的第一相位段施加到神经区域,第一相位段具有在750hz与1400hz之间的频率;并且经由所述至少一个电极将双相信号的第二相位段施加到所述神经区域,第二相位段具有低于第一相位段的频率的频率。在其它示例性实施例中,第一相位段具有约1200hz(突发)和900hz(平均)的频率。在其它示例性实施例中,第二相位段具有约50hz的频率。
[0247]
在其它示例性实施例中,第一相位段和第二相位段具有不同的相应幅度、波形形状、宽度、相位极性和相对于彼此的相位中的任一个。
[0248]
在其它示例性实施例,双相信号为非对称双相信号。在其它示例性实施例中,双相信号为经频率调制的信号。在其它示例性实施例中,双相信号为经相位调制的信号。在其它示例性实施例中,双相信号为经脉冲宽度调制的信号。在其它示例性实施例中,在不对受试者施用药理学物质的情况下执行双相信号的施加。
[0249]
在其它示例性实施例中,第一相位段的脉冲宽度在约170微秒与400微秒之间。
[0250]
在其它示例性实施例中,双相信号来源于第一电信号,所述第一电信号具有设置为对应于受试者的感知阈值百分比的值的电流幅度。
[0251]
在其它示例性实施例中,信号的幅度初始地设置为零,随后增加直到患者指示感知阈值,随后降低到预定感知百分比。在其它示例性实施例中,感知百分比在20%与90%之间。在其它示例性实施例中,感知百分比在65%与75%之间。
[0252]
其它示例性实施例包含为作为至少一个电极上的第一脉冲的所述双相信号产生程序,并且进一步包含为单独的电极或电极组产生所述程序的精确或更改后的副本。
[0253]
其它示例性实施例包含为作为至少一个电极上的第一脉冲的所述双相信号产生程序,并且进一步包含为至少一个单独的电极或电极组单独地产生程序,包含独立地评估患者的感知且根据所述感知向上或向下调整信号的幅度。
[0254]
在其它示例性实施例中,神经区域包括脊髓神经区域。在其它示例性实施例中,神经区域包括外周神经区域。在其它示例性实施例中,神经区域包括神经簇。
[0255]
在其它示例性实施例中,第一相位段包括启动组分。在其它示例性实施例中,第二相位段包括强直组分。
[0256]
在其它示例性实施例中,双相信号来源于:第一电信号,其具有设置为对应于受试者的启动感知阈值(ppt)百分比的值的电流幅度;以及第二电信号,其具有设置为对应于强直感知阈值(tpt)百分比的值的电流幅度。
[0257]
如本文中所使用,术语“药理学物质”意谓任何有形的化学物质、药物、药品或治疗物质,无论是合成的还是天然存在的,无论对受试者的是施用形式如何,其被施用于受试者的身体。
[0258]
在本说明书的各种地方,以组或范围的形式公开数值。所述描述确切地说意欲包含此类组和范围的成员的每一个个别子组合以及此类组或范围的各种端点的任何组合。举例来说,0到40的范围内的整数专门意欲个别地公开0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39
和40,并且1到20的范围内的整数专门意欲个别地公开1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20。
[0259]
出于清晰度和简明描述的目的,在本文中将特征描述为相同或单独实施例的部分,然而,应了解,概念的范围可包含具有本文中所描述的全部或一些特征的组合的实施例。
[0260]
对于所属领域的技术人员来说,显而易见的是,可对本文中所公开的设备和过程进行修改,包含替换各种组分值或连接节点,而不脱离如由本文中所阐述的权利要求定义的本公开的真实精神和范围。举例来说,尽管本文中所描述的实施例主要公开了脉冲矩形信号的使用,但可类似地使用其它波形形状来获得相同的效果。举例来说,单相脉冲波、电荷平衡双相脉冲波、电荷不平衡双相脉冲波、具有延迟脉冲的电荷平衡双相波、电荷平衡双相快反转波和电荷平衡双相慢反转波中的任一个都可用作本文中所描述的多模态调制技术中的刺激波形。另外,可使用由具有不同波形形状的周期性电信号定义的其它变化电磁场以及噪声信号和甚至具有不规则非重复形状的非周期性电信号。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1