与生物素部分结合的生理活性物质和包含所述生理活性物质的用于口服施用的组合物的制作方法
1.本发明涉及一种与生物素部分键合的生理活性物质,以及包含所述生理活性物质的用于口服施用的组合物。更具体地,本发明涉及一种与生物素部分键合的具有优异体内口服吸收的生理活性物质,以及一种包含所述生理活性物质的用于口服施用的组合物。
背景技术:
2.近年来,随着经济进步和科学技术的加速发展,饮食变得西化,并且高热量、高脂肪食物产品的消费日益增加。因此,由于各种代谢疾病而患有糖尿病和肥胖症等的人群正在迅速增长。
3.糖尿病是具有多种并发症的疾病,并且其治疗需要限制饮食,这显著降低患者的生活质量。人们对糖尿病治疗和管理的认识不断提高,并且迫切需要开发用于改善或治疗糖尿病的治疗剂。
4.糖尿病被归类为“i型”糖尿病,其是由无法产生胰岛素引起的;或者被归类为“ii型”糖尿病,其中胰岛素产生正常但胰岛素抵抗导致调控新陈代谢的能力降低。ii型糖尿病和肥胖症是彼此的相互危险因素。它们是代谢疾病的原因,并且增加动脉粥样硬化的风险,动脉粥样硬化是糖尿病患者的主要死亡原因,从而使它们都是极其危险的疾病。
5.最近,胰高血糖素衍生物受到关注。当血糖水平由于诸如药物治疗、疾病、激素或酶缺乏的原因开始下降时,胰腺产生胰高血糖素。胰高血糖素向肝脏发出信号,分解糖原以释放葡萄糖,从而使血糖升高至正常水平。除了其高血糖效应外,据报告胰高血糖素还抑制食欲并激活脂肪细胞的激素敏感性脂肪酶,以促进脂肪分解并表现出抗肥胖效应。胰高血糖素的一种衍生物胰高血糖素样肽-1(glp-1)是正在开发中的作为减轻糖尿病患者的高血糖症的治疗剂的物质,并且其功能包括促进胰岛素合成和分泌、抑制胰高血糖素分泌、抑制胃排空、促进葡萄糖的使用以及抑制食物摄入。
6.毒蜥外泌肽-4(由蜥蜴毒制成,其与glp-1具有大约50%氨基酸同源性)据报告也激活glp-1受体以减轻糖尿病患者的高血糖症。
7.然而,当口服施用时肽和蛋白质药物的问题是它们由于酶攻击而分解,并且肠膜渗透性低。
技术实现要素:
8.有待由本发明解决的问题
9.本发明的目的是提供一种与生物素部分键合的具有优异体内口服吸收的生理活性物质,以及一种包含所述生理活性物质的用于口服施用的组合物。
10.用于解决问题的手段
11.本发明的一个方面提供了一种与生物素部分键合的生理活性物质以及一种用于制备所述生理活性物质的方法。
12.本发明的另一方面提供了一种用于口服施用的组合物,所述组合物包含与生物素部分键合的生理活性物质。
13.本发明的另一方面提供了一种药物组合物,所述药物组合物包含与生物素部分键合的生理活性物质。
14.本发明的另一方面提供了一种用于预防或治疗糖尿病的药物组合物,所述组合物包含与生物素部分键合的生理活性物质。
15.本发明的另一方面提供了一种用于预防或治疗肥胖症的药物组合物,所述组合物包含与生物素部分键合的生理活性物质。
16.本发明的另一方面提供了一种用于预防或治疗骨质疏松症的药物组合物,所述组合物包含与生物素部分键合的生理活性物质。
17.本发明的另一方面提供了一种用于预防或治疗脂肪肝的药物组合物,所述组合物包含与生物素部分键合的生理活性物质。
18.本发明的另一方面提供了一种用于预防或治疗肠易激综合征的药物组合物,所述组合物包含与生物素部分键合的生理活性物质。
19.本发明的另一方面提供了一种用于预防或治疗神经变性疾病的药物组合物,所述组合物包含与生物素部分键合的生理活性物质。
20.发明效果
21.根据本发明的一个实施方案的与生物素部分键合的生理活性物质可与水溶性生物素键合,以具有优异的体内口服吸收。
22.根据本发明的一个实施方案的与生物素部分键合的生理活性物质可抵御肽和其他生理活性物质与酶分离,从而最终促进生理活性物质对肠膜的渗透及其在肠中的吸收。
23.根据本发明的一个实施方案的与生物素部分键合的生理活性物质,通过与生物素(一种类型的水溶性维生素b7)键合,可经由钠依赖性复合维生素转运蛋白通过主动转运而被吸收。
24.根据本发明的一个实施方案,所述生物素部分可与生理活性物质的非活性区域键合,并且由此不抑制所述生理活性物质的活性。
附图说明
25.图1是本发明的实施方案3的纯化色谱图。
26.图2是本发明的实施方案1至实施方案3的最终物质的色谱图。
27.图3是本发明的实施方案1至实施方案3的maldi-tof质谱。
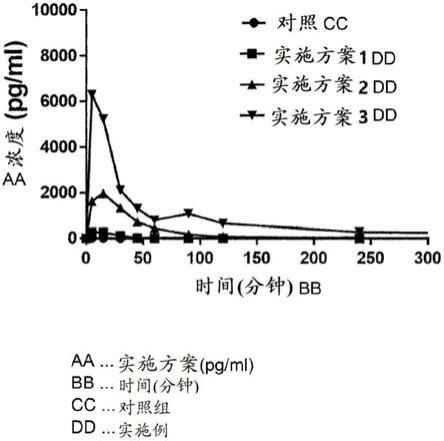
28.图4是示出在口服施用于大鼠后按小时计的实施方案1至实施方案3的血液浓度的图。
29.图5是示出向每个试样施用葡萄糖后的血糖变化的图。
30.图6是示出向每个试样施用葡萄糖后的血糖变化的图。
31.图7是示出向每个试样施用葡萄糖后的血糖变化的图。
32.图8是示出向每个试样施用葡萄糖后的血糖变化的图。
33.图9是本发明的实施方案10的纯化色谱图。
34.图10是本发明的实施方案10的纯化后色谱图。
35.图11是本发明的实施方案11的反相色谱图。
36.图12是本发明的实施方案10和实施方案11的maldi-tof质谱。
37.图13是本发明的实施方案12和实施方案13的纯化色谱图。
38.图14是本发明的实施方案12的纯化后色谱图。
39.图15是本发明的实施方案13的纯化后色谱图。
具体实施方式
40.在下文中,将详细描述本发明的实施例和实施方案,以使本领域的普通技术人员能够容易地实施本发明。
41.然而,本发明可以各种不同的形式实施,并且不限于本文描述的实施例和实施方案。在本发明的整个说明书中,当某个部分被称为“包含”某个要素时,除非明确相反地说明,否则这并不排除其他要素,而是意味着还可包含其他要素。
42.在整个说明书中用作指代程度的术语的术语“约”和“基本上”等用于指处于或接近所陈述的任何独特制造或材料公差的数值,并且用于防止侵权者对所提供以有助于理解本发明的提及准确或绝对数值的公开内容的不正当使用。贯穿本发明使用的术语“步骤,其中(step wherein)”或
“……
的步骤(step of)”并不意味着“用于
……
的步骤(step for)”。
43.在本发明的整个说明书中,在马库什权利要求书中使用的术语“其组合”是指包括马库什权利要求书的表述中陈述的要素的组中的至少一者的混合物或组合,所述混合物或组合包含选自包括这些要素的组的至少一者。在本发明的整个说明书中,“和/或b”意指“和b,或a或b”。
44.本发明的一个方面提供了一种与生物素部分键合的生理活性物质以及一种用于制备所述生理活性物质的方法。根据本发明的一方面的与生物素部分键合的生理活性物质可具有优异的体内口服吸收。
45.一般来说,肽和蛋白质药物是高度水溶性的,并且属于bcs(生物制药分类系统)的第3类,其肠吸收有限。肽和蛋白质药物的特征在于它们是高度亲水性的并且具有大分子量,它们可通过低ph的胃酸分解,并且它们受诸如胰蛋白酶的酶的攻击而在肠内吸收率低。肽和蛋白质药物通常具有约0.1%的口服生物利用度(ba),从而使它们难以用作药物组合物。而肠溶包衣胶囊被用来使[此类药物]通过胃来克服这一问题,但此技术存在不能从根本上改善肽和蛋白质吸收的问题。
[0046]
另一方面,根据本发明的一个实施方案的与生物素部分键合的具有改善的肠膜渗透性的药物活性物质可在肠内具有改善的吸收。
[0047]
更具体地,根据本发明的一个实施方案的与生物素部分键合的生理活性物质,通过与生物素(一种类型的水溶性维生素b7)键合,可经由钠依赖性复合维生素转运蛋白通过主动转运而被吸收。
[0048]
在本发明中,“未取代的或取代的”是指[某物]可未被取代或可被取代。“取代的”意指具有一个或多个取代基,并且取代基是指与母体基团中的任意原子共价键合或稠合的化学部分,如亚烷基或杂亚烷基。
[0049]
在本发明中,“卤基”意指氟、氯、溴或碘等。
[0050]
在本发明中,“烷基”是指通过从脂肪族或脂环族、饱和或不饱和烃化合物的碳原
子除去氢原子而获得的单价部分,其实例包括甲基、乙基、丙基、丁基、戊基、己基、正丙基、正丁基、正戊基、异丙基、异丁基、仲丁基、叔丁基、异戊基和新戊基。
[0051]
在本发明中,“杂烷基”是包含至少一个杂原子的烷基,并且杂原子意指其中杂原子位于烷基中的任意碳原子位置、从而取代c、ch、ch2或ch3的烷基。
[0052]
在本发明中,“亚烷基”是指通过从脂肪族或脂环族、饱和或不饱和烃化合物的碳原子除去氢原子而获得的二价部分。
[0053]
在本发明中,“杂亚烷基”是指包含至少一个杂原子的亚烷基。
[0054]
在本发明中,“芳基”是指通过从具有环原子的芳族化合物的芳族环原子除去氢原子而获得的单价部分。例如,在“c
5-10
芳基”中,碳具有5至10个环原子,并且这是通过从芳族化合物的芳族环原子除去氢原子而获得的单价部分。芳基的实例包括苯、苊、芴、非那烯、醋菲和源自醋蒽的基团。
[0055]
在本发明中,“杂芳基”是包含至少一个杂原子的芳基,例如,吡啶、嘧啶、苯并噻吩、呋喃基、二氧戊环基、吡咯基、噁唑基、吡啶基、哒嗪基、嘧啶基、异苯并呋喃、吲哚、异吲哚、吲嗪、吲哚啉、异吲哚啉、嘌呤、苯并二噁烷、喹啉、异喹啉、喹嗪、苯并噁嗪、苯并噻嗪、吡啶并吡啶、喹喔啉、喹唑啉、噌啉、酞嗪、萘啶、蝶啶、啶、吡啶并吲哚、二苯并对二噁英(oxanthrene)、吩噁噻、吩嗪和吩噁嗪等。
[0056]
在本发明中,“亚芳基”是指通过从具有环原子的芳族化合物的芳族环原子除去氢原子而获得的二价部分。
[0057]
在本发明中,“杂亚芳基”是指包含至少一个杂原子的亚芳基。
[0058]
在本发明中,“烯基”是指具有至少一个碳-碳双键的烷基,其实例包括乙烯基(-ch=ch2)、1-丙烯基(-ch=chch3)、异丙烯基、丁烯基、戊烯基和己烯基。
[0059]
在本发明中,“炔基”是指具有至少一个碳-碳三键的烷基,其实例包括乙炔基和2-丙炔基。
[0060]
根据本发明的一个实施方案,生物素部分可由以下通式a表示。
[0061]
[通式a]
[0062][0063]
在通式a中,
[0064]
x是能够与生理活性物质键合的官能团,
[0065]
y是间隔基,
[0066]
z是键合单元,
[0067]
b可由以下化学式a-1表示,
[0068]
[化学式a-1]
[0069]
[0070]
z连接至化学式a-1的
[0071]
t是末端基团,
[0072]
m是1至10的整数,
[0073]
n是0或者1至10的整数,并且当n=0时,y直接与b或t键合,
[0074]
并且p是0至1的整数。
[0075]
在本发明的一个实施方案中,在通式a中,x是能够与生理活性物质键合的官能团。尽管不限于此,官能团可包括能够与硫醇基团、羧基和/或胺基团反应的官能团,例如马来酰亚胺、琥珀酰亚胺、n-羟基琥珀酰亚胺、醛或羧基。
[0076]
在本发明的一个实施方案中,当与生理活性物质键合时,官能团x可保持其结构,或者被去除或修饰。
[0077]
y是间隔基并且可具有带体内可裂解性的结构。例如,而不限于此,y可对应于直接键,或在其结构中包含来自包括以下的组的至少一者:取代的或未取代的c
1-50
直链亚烷基、取代的或未取代的c
1-50
非直链亚烷基、取代的或未取代的c
1-50
直链杂亚烷基、取代的或未取代的c
1-50
非直链杂亚烷基、取代的或未取代的c
1-50
亚芳基、取代的或未取代的c
1-50
杂亚芳基、-o-、-c(o)、-c(o)nr-、-c(o)o-、-s-、-nr-或-nor-,其中r可以是氢、取代的或未取代的c
1-50
烷基、取代的或未取代的c
1-50
芳基或乙二醇重复单元(-(ch2ch2o)
n-,其中n是至少1且不超过20的整数)。
[0078]
z是能够与b键合的键合单元,并且可包括例如(但不限于此)氨基酸、多肽、亚烷基、胺或聚酰胺基胺结构。
[0079]
尽管不限于此,氨基酸可包括赖氨酸、5-羟基赖氨酸、4-oxalicine、4-硫杂赖氨酸、4-硒代赖氨酸、4-硫杂高赖氨酸、5,5-二甲基赖氨酸、5,5-二氟赖氨酸、反式-4-二氢赖氨酸、2,6-二氨基-4-已炔酸、顺式-4-二氢赖氨酸、6-n-甲基赖氨酸、二氨基庚二酸、鸟氨酸、3-甲基鸟氨酸、α-甲基鸟氨酸、瓜氨酸、高瓜氨酸、精氨酸、天冬氨酸、天冬酰胺、谷氨酸、谷氨酰胺、组氨酸、鸟氨酸、脯氨酸、丝氨酸或苏氨酸。
[0080]
如果n是0,则b或t可直接与y(间隔基)键合。
[0081]
t是末端集团,但不限于此,可以是例如氢或nh2。
[0082]
如果p是0,则b可以是末端。
[0083]
根据本发明的一方面,在下面的通式a中,m可以是1至10的整数,并且具体地可以是1至8、1至5和1至4的整数。
[0084]
在本发明的一个方面,x可选自包括以下的组:马来酰亚胺、琥珀酰亚胺、n-羟基琥珀酰亚胺、琥珀酸琥珀酰亚胺酯、戊二酸琥珀酰亚胺酯、琥珀酰亚胺基甲酯、琥珀酰亚胺基戊酯、碳酸琥珀酰亚胺酯、碳酸对硝基苯酯、醛、胺、硫醇、羟胺、碘乙酰胺、氨基氧类、酰肼、羟基、丙酸酯、吡啶基、烷基卤、乙烯基砜、羧基、酰肼、卤素乙酰胺、c
2-5
炔基、c
6-20
芳基二硫化物、c
5-20
杂芳基二硫化物、异氰酸酯、硫酯、亚氨酯以及它们的衍生物。
[0085]
在本发明的一个具体方面,x是马来酰亚胺、n-羟基琥珀酰亚胺、醛或胺。
[0086]
在本发明的一个方面,y不存在、是取代的或未取代的直链或支链c
1-50
亚烷基、取代的或未取代的直链或支链c
1-50
杂亚烷基、取代的或未取代的c
6-50
亚芳基、或取代的或未取代的c
6-50
杂亚芳基,并且如果被取代,则包含选自包括以下的组的至少一者:=o、-c(o)nh2、-oh、-cooh、-sh、=nh和-nh2。
[0087]
在本发明的一个方面,y是取代的直链或支链c
1-50
杂亚烷基,并且包含至少一个-c(o)-。
[0088]
在本发明的一个方面,y是-(c(o))
q-(ch2)
r-(c(o)nh
s-(ch2)
r-(och2ch2)
t-(c(o))
q-,其中q、r、s和t是独立选择的,q和s是0或1,r是1至20的整数,并且t是0至20的整数。
[0089]
在本发明的一个方面,y是-(ch2)rc(o)nhnh-,其中r是1至20的整数。
[0090]
在本发明的一个方面,y包含-c(o)-。
[0091]
在本发明的一个方面,y包含-c(o)nh-。
[0092]
在本发明的一个方面,z是以下中的任一者,并且各自可以是独立选择的。
[0093]
a)与x一起形成氨基酸或其衍生物或与x分开;或者
[0094]
b)是取代的或未取代的直链或非直链c
1-50
杂亚烷基,
[0095]
并且当被取代时包含选自包括以下的组的至少一者:=o、-c(o)nh2、-oh、-cooh、-sh、=nh和-nh2。
[0096]
在本发明的一个方面,z通过b和-nh-连接。
[0097]
在本发明的一个方面,z是亲水性氨基酸或其衍生物。
[0098]
具体地,在本发明的一个方面,z可选自包括以下的组:赖氨酸、精氨酸、组氨酸、谷氨酰胺、天冬酰胺、苏氨酸、半胱氨酸、丝氨酸以及它们的衍生物。
[0099]
在本发明的一个方面,z包含至少一个甘油和至少一个聚乙二醇或其键。
[0100]
在本发明的一个方面,z包含表示键合位点,至少一个键合至所述键合位点,并且u是1至20的整数。
[0101]
在本发明的一个方面,z包含并且-(ch2)3nh-进一步与键合。
[0102]
在本发明的一个方面,t可选自包括以下的组:胺、c
1-8
烷基、c
1-8
烯基、卤基、羟基、硫醇、磺酸、羧基、苯基、苄基、醛、叠氮化物、氰酸酯、异氰酸酯、硫氰酸酯、异硫氰酸酯、腈和膦酸。
[0103]
在本发明的一个具体方面,t是胺。
[0104]
在本发明的一个方面,生物素部分选自包括以下的组:
[0105]
[0106][0107]
[0108][0109]
[0110][0111]
[0112][0113]
[0114][0115][0116]
[0117][0118]
根据本发明的一个实施方案,生物素部分和生理活性物质可通过各种键而键合。所述键可由生物素部分的官能团与生理活性物质的官能团键合而形成,尽管不限于此,所述键可以是例如硫醇-醚键或酰胺键。
[0119]
在一个实施方案中,生物素部分与生理活性物质之间的键可通过以下反应式1的方法形成。在下面的反应式1中,表示包含硫醇基团的生理活性物质,并且表示根据本发明的一个实施方案的包含马来酰亚胺基团的生物素部分与生理活性物质中存在的半胱氨酸残基的硫醇基团(-sh)之间的反应。
[0120][0121]
[反应式1]
[0122]
在一个实施方案中,生物素部分与生理活性物质之间的键可通过以下反应式2的方法形成。反应式2中,表示包含胺基团的生理活性物质,并且表示根据本发明的一个实施方案的包含n-羟基琥珀酰亚胺的生物素部分与生理活性物质中存在的胺基团(-nh2)之间的反应。
[0123][0124]
[反应式2]
[0125]
根据本发明的一个实施方案,对生理活性物质可能没有特别限制。
[0126]
在本发明中,生理活性物质意指为了特定目的可在体内施用的聚合物物质。
[0127]
根据本发明的一个实施方案,生理活性物质可以是用于药物组合物中的物质。然
而不限于这些,[所述物质]可以是用于例如糖尿病的预防或治疗、肥胖症的预防或治疗、骨质疏松症的预防或治疗、脂肪肝的预防或治疗、肠易激综合征的预防或治疗或神经变性疾病的预防或治疗的物质。
[0128]
根据本发明的一个实施方案,生理活性物质(但不限于这些)可以是例如多肽、蛋白质、多糖或其衍生物。生理活性物质(但不限于这些)可以是例如胰高血糖素、glp-1(胰高血糖素样肽-1)、glp-2(胰高血糖素样肽-2)、gip(葡萄糖依赖性促胰岛素多肽)、exending-4、胰岛素、甲状旁腺激素、干扰素、促红细胞生成素、降血钙素、血清素、利妥昔单抗、曲妥珠单抗、尿酸酶、组织纤溶酶原激活物、胸腺球蛋白、疫苗、肝素或肝素类似物、抗凝血酶iii、非格司亭、醋酸普兰林肽、艾塞那肽、依替巴肽、抗蛇毒素、igg、igm、hgh、甲状腺素、凝血因子vii和viii、单克隆抗体、充当治疗剂的糖脂以及它们的衍生物。
[0129]
根据本发明的一个实施方案,生物素部分可与生理活性物质的非活性区域键合。
[0130]
生物素部分可与生理活性物质的非活性区域键合而不抑制生理活性物质的生物活性,并且因此表现出与生理活性物质的生物活性相同或相对于生理活性物质的生物活性改善的生物活性。
[0131]
尽管不限于这些,psa可例如,可包含非活性区域上的暴露的-sh基团并且生物素部分可与所述-sh基团键合。此外,psa可包含非活性区域上的暴露的-nh
3+
基团或-nh2基团,并且生物素部分可与所述暴露的-nh
3+
基团或-nh2基团键合。此外,psa可包含非活性区域上的暴露的-n末端并且生物素部分可与所述暴露的n-末端键合。在多肽的情况下,psa可通过非活性区域的赖氨酸氨基酸的-nh3+基团、-nh2基团键合,或者,如果多肽的n-末端是非活性区域,则通过所述n-末端键合,以使得多肽的活性不受抑制。
[0132]
即,根据本发明的一个实施方案,可调整生物素部分与psa键合的位置,以使得所述键避开表现出活性的位点。
[0133]
根据本发明的一个实施方案,psa可以是具有以下seq.id.no.1至7中的任一个的氨基酸序列的多肽,或其衍生物。
[0134]
seq.id.no.1:h(aib)qgtftsdyskyldeqaakefvqwlmnt
[0135]
seq.id.no.2:haegtftsdvssylegqaakefiawlvkgr
[0136]
seq.id.no.3:hadgsfsdemntildnlaardfinwliqtkltd
[0137]
seq.id.no.4:yaegtfisdysiamdkihqqdfvnwllaqkgkkndwkhnitq
[0138]
seq.id.no.5:hgegtftsdlskqmeeeavrlfiewlknggpssgappps
[0139]
seq.id.no.6:svseiqlmhnlgkhlnsmervewlrkklqdvhnf
[0140]
seq.id.no.7:hsqgtftsdyskyldsrraqdfvqwlmn
[0141]
此外,psa可以是具有以下seq id.no.15和16的氨基酸序列的蛋白质,或具有seq.id.no.17和16的氨基酸序列的蛋白质,其中所述蛋白质通过seq.id.no.15或17的第六半胱氨酸与第十一半胱氨酸之间、seq.id.no.15或17的第七半胱氨酸与seq.id.no.16的第七半胱氨酸之间以及seq.id.no.15或17的第二十半胱氨酸与seq.id.no.16的第十九半胱氨酸之间的二硫键键合。
[0142]
seq.id.no.15 giveqcctsicsleqlenycn
[0143]
seq.id.no.16:fvnqhlcgshlvealylvcgergffytpkt
[0144]
seq.id.no.17:giveqcctsicslyqlenycn
[0145]
根据本发明的一个实施方案,半胱氨酸可被取代或插入多肽中以调整与生物素部分的键合位点。
[0146]
作为非限制性实例,选自包括由seq.id.no.1至7表示的氨基酸序列的组的多肽的非活性区的氨基酸中的任何至少一个可被半胱氨酸氨基酸取代,或者可在其处插入半胱氨酸氨基酸。在此,生物素部分与半胱氨酸氨基酸的-sh基团键合。此外,其中插入了半胱氨酸氨基酸的多肽可以是具有seq.id.no.8至14中的任一个的氨基酸序列的多肽。
[0147]
seq.id.no.8:h(aib)qgtftsdyskyldeqaakefvqwlmntc
[0148]
seq.id.no.9:haegtftsdvssylegqaakefiawlvkgrc
[0149]
seq.id.no.10:hadgsfsdemntildnlaardfinwliqtkitdc
[0150]
seq.id.no.11:yaegtfisdysiamdkihqqdfvnwllaqkgkkndwkhnitqc
[0151]
seq.id.no.12:hgegtftsdiskqmeeeavrlfiewlknggpssgapppsc
[0152]
seq.id.no.13:svseiqlmhnlgkhlnsmervewlrkklqdvhnfc
[0153]
seq.id.no.14:hsqgtftsdyskyldsrraqdfvqwlmntc
[0154]
根据本发明的一个实施方案,具有生物素部分的psa可与选自包括以下的组的至少一者共价键合或形成微球:肽和非肽聚合物、脂肪酸、胆固醇、抗体、抗体片段、白蛋白及其片段、核苷酸、纤连蛋白、转铁蛋白、fcrn键合物质、糖类、弹性蛋白、肝素以及它们的衍生物。
[0155]
非肽聚合物可选自包括以下的组:聚乙二醇(peg)、聚丙二醇、乙二醇和丙二醇的共聚物、聚氧乙烯化多元醇、聚乙烯醇(pva)、多糖、葡聚糖、聚乙烯基乙醚、pla(聚乳酸)、plga(乳酸-共-乙醇酸)、脂质聚合物、几丁质、透明质酸以及它们的组合。
[0156]
本发明的另一方面提供了一种用于制备与生物素部分键合的psa的方法,所述方法包括获得生物素部分;使所述生物素部分与psa反应;以及,在所述反应完成后分离与所述生物素部分键合的psa的步骤。
[0157]
根据本发明的一个实施方案,在获得生物素部分时,所述生物素部分可由以上通式a表示。
[0158]
根据本发明的一个实施方案,在使混合物反应时,生物素部分与psa的反应摩尔比可以是0.5或更大。具体地,生物素部分与psa的摩尔比可以是0.5至5。可基于生物素部分的分子结构、分子量、溶解度、反应溶液的ph、反应温度和反应时间等选择合适的反应摩尔比。
[0159]
根据本发明的一个实施方案,所述反应可使用缓冲溶液或有机溶剂进行。对缓冲溶液或有机溶剂没有特别限制,并且可取决于生物素部分的结构适当地选择本领域中常用的缓冲溶液。
[0160]
在本发明的一个实施方案中,反应步骤的温度和持续时间可取决于所使用的生物素部分和psa的特性进行适当调整。尽管不限于这些,[所述反应]可例如在4℃下进行至少三个小时,或者在室温下进行更短的持续时间。这可与所用生物素部分的反应程度相关。在经过合适的反应时间后,可通过降低反应溶液的ph来终止反应。
[0161]
根据本发明的一个实施方案,可在反应步骤之后进行除去未反应的材料的步骤。用于除去未反应的材料的方法可以是本领域中常用的方法。然而所述方法不限于这些,可通过例如使用合适的缓冲溶液例如pbs(磷酸盐缓冲盐水)的渗析除去[未反应的材料]。
[0162]
根据本发明的一个实施方案,[所述方法]可在分离步骤之后包括纯化步骤。分离
和纯化步骤可使用尺寸排阻色谱法、高效液相色谱法或离子交换色谱法进行,但不限于这些。
[0163]
本发明的另一方面提供了一种用于口服组合物的组合物,所述组合物包含上文中描述的与生物素部分键合的psa。
[0164]
根据本发明的一个实施方案的与生物素部分键合的生理活性物质,通过与生物素(一种类型的水溶性维生素b7)键合,可经由钠依赖性复合维生素转运蛋白通过主动转运而被吸收,从而促进肠膜渗透性和肠内的吸收。
[0165]
本发明的又一方面提供了一种药物组合物,所述药物组合物包含上文中描述的与生物素部分键合的psa。可取决于psa的类型来确定药物组合物的用途。此外,药物组合物可以是用于口服施用的组合物。
[0166]
根据本发明的一个实施方案,可提供一种用于预防或治疗糖尿病的药物组合物,所述组合物包含与生物素部分键合的psa。
[0167]
psa可用于预防或治疗糖尿病。尽管不限于这些,例如,psa可以是具有seq.id.no.1至14的氨基酸序列的多肽,具有seq.id.no.15和16的氨基酸序列的蛋白质,具有seq.id.no.17和16的氨基酸序列的蛋白质,或其衍生物。
[0168]
此外,所述蛋白质通过seq.id.no.15或17的第六半胱氨酸与第十一半胱氨酸之间、seq.id.no.15或17的第七半胱氨酸与seq.id.no.16的第七半胱氨酸之间以及seq.id.no.15或17的第二十半胱氨酸与seq.id.no.16的第十九半胱氨酸之间的二硫键键合。
[0169]
根据本发明的一个实施方案,可提供一种用于预防或治疗肥胖症的药物组合物,所述组合物包含与生物素部分键合的psa。
[0170]
psa可用于预防或治疗肥胖症。尽管不限于这些,例如,psa可以是具有seq.id.no.1至14的氨基酸序列的多肽,具有seq.id.no.15和16的氨基酸序列的蛋白质,具有seq.id.no.17和16的氨基酸序列的蛋白质,或其衍生物。
[0171]
此外,所述蛋白质通过seq.id.no.15或17的第六半胱氨酸与第十一半胱氨酸之间、seq.id.no.15或17的第七半胱氨酸与seq.id.no.16的第七半胱氨酸之间以及seq.id.no.15或17的第二十半胱氨酸与seq.id.no.16的第十九半胱氨酸之间的二硫键键合。
[0172]
根据本发明的一个实施方案,可提供一种用于预防或治疗脂肪肝的药物组合物,所述组合物包含与生物素部分键合的psa。
[0173]
psa可用于预防或治疗脂肪肝。尽管不限于这些,例如,psa可以是具有seq.id.no.1至14的氨基酸序列的多肽,具有seq.id.no.15和16的氨基酸序列的蛋白质,具有seq.id.no.17和16的氨基酸序列的蛋白质,或其衍生物。
[0174]
此外,所述蛋白质通过seq.id.no.15或17的第六半胱氨酸与第十一半胱氨酸之间、seq.id.no.15或17的第七半胱氨酸与seq.id.no.16的第七半胱氨酸之间以及seq.id.no.15或17的第二十半胱氨酸与seq.id.no.16的第十九半胱氨酸之间的二硫键键合。
[0175]
根据本发明的一个实施方案,可提供一种用于预防或治疗肠易激综合征的药物组合物,所述组合物包含与生物素部分键合的psa。
[0176]
psa可用于预防或治疗肠易激综合征。尽管不限于这些,例如,psa可以是具有seq.id.no.1至14的氨基酸序列的多肽,具有seq.id.no.15和16的氨基酸序列的蛋白质,具有seq.id.no.17和16的氨基酸序列的蛋白质,或其衍生物。
[0177]
此外,所述蛋白质通过seq.id.no.15或17的第六半胱氨酸与第十一半胱氨酸之间、seq.id.no.15或17的第七半胱氨酸与seq.id.no.16的第七半胱氨酸之间以及seq.id.no.15或17的第二十半胱氨酸与seq.id.no.16的第十九半胱氨酸之间的二硫键键合。
[0178]
根据本发明的一个实施方案,可提供一种用于预防或治疗神经变性疾病的药物组合物,所述组合物包含与生物素部分键合的psa。
[0179]
psa可用于预防或治疗神经变性疾病。尽管不限于这些,例如,psa可以是具有seq.id.no.1至14的氨基酸序列的多肽,具有seq.id.no.15和16的氨基酸序列的蛋白质,具有seq.id.no.17和16的氨基酸序列的蛋白质,或其衍生物。
[0180]
此外,所述蛋白质通过seq.id.no.15或17的第六半胱氨酸与第十一半胱氨酸之间、seq.id.no.15或17的第七半胱氨酸与seq.id.no.16的第七半胱氨酸之间以及seq.id.no.15或17的第二十半胱氨酸与seq.id.no.16的第十九半胱氨酸之间的二硫键键合。
[0181]
根据本发明的一个实施方案,包含与生物素部分键合的生理活性物质作为活性成分的药物组合物可以各种口服和非口服施用形式配制和施用,但不限于这些。
[0182]
配制时,常用的填充剂、增溶剂、增积剂、键合剂、润湿剂、崩解剂、表面活性剂以及其他稀释剂和赋形剂可用于制剂。
[0183]
用于口服施用的固体制剂包括片剂、丸剂、粉末、颗粒和胶囊,并且可将至少一种赋形剂例如淀粉、碳酸钙、蔗糖或乳糖混合到化合物中来配制此类固体制剂。
[0184]
此外,除了简单赋形剂之外,还使用润滑剂如硬脂酸镁或滑石。用于口服施用的液体制剂包括悬浮液、口服液体、乳剂和糖浆,除了常用的水和液体石蜡稀释剂外,所述液体制剂还可包含各种赋形剂,例如润湿剂、调味剂、甜味剂和防腐剂。非口服还用的制剂包括无菌水溶液、非水性溶剂、悬浮液、乳剂、冻干药物和栓剂。作为非水性溶剂或悬浮液,可使用丙二醇、聚乙二醇(peg)、基于植物的油如橄榄油和可注射酯如油酸乙酯。
[0185]
此外,可添加钙或维生素d3以提高作为增生性疾病或自身免疫性疾病的治疗剂的功效。
[0186]
根据本发明的一个实施方案的药物组合物的施用剂量的范围可取决于体重、年龄、性别、健康状况、饮食、施用间隔、施用方法、排泄率和疾病的严重程度而多样化,但是通常可每天一次施用或在每日有效剂量内跨多次施用而施用。此外,有效剂量可通过每一周或两周多次施用而施用。
[0187]
在下文中,将通过实施方案和实验性实施例详细描述本发明。条件是以下实施方案和实验性实施例仅意图用于举例说明本发明,并且本发明的范围不受以下实施方案和实验性实施例的限制。
[0188]
[实施方案]
[0189]
《实施方案:生物素部分的制备》
[0190]
缩写列表
[0191]
hbtu3-[双(二甲基氨基)亚甲基]-3h-苯并三唑-1-氧化物六氟磷酸盐
[0192]
diea:乙基二异丙基胺
[0193]
hatu:1-[双(二甲基氨基)亚甲基]-1h-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐
[0194]
dic:二异丙基碳二亚胺
[0195]
hobt:1-羟基苯并三唑
[0196]
mbha:4-甲基二苯甲基胺盐酸盐)
[0197]
fmoc:9-芴基甲氧基羰基
[0198]
dmf:二甲基甲酰胺
[0199]
spps:固相肽合成
[0200]
hplc:高效液相色谱法
[0201]
lcms:液相色谱质谱法
[0202]
一般spps方法
[0203]
在一些情况下,肽的固相合成可通过使用可在酸性条件下裂解的基团,例如,2-fmoc-氧基-4-甲氧基苄基或在d-肽酰胺键中保护的具有2,4,6-三甲氧基苄基的d-肽键来改进。所用的fmoc保护的氨基酸衍生物是推荐的标准品:例如,由anaspect、bachem、iris biotech或novabiochem供应的fmoc-ala-oh、fmoc-arg(pbf)-oh、fmoc-asn(trt)-oh、fmoc-asp(otbu)-oh、fmoc-cys(trt)-oh、fmoc-gln(trt)-oh、fmoc-glu(otbu)-oh、fmoc-gly-oh、fmoc-his(trt)-oh、fmoc-ile-oh、fmoc-leu-oh、fmoc-lys(boc)-oh、fmoc-met-oh、fmoc-phe-oh、fmoc-pro-oh、fmoc-ser(tbu)-oh、fmoc-thr(tbu)-oh、fmoc-trp(boc)-oh、fmoc-tyr(tbu)-oh或fmoc-val-oh等。n-末端氨基酸是在α氨基中保护的boc。例如,使用了由anaspec、bachem、iris biotech或novabiochem供应的fmoc-8-氨基-3,6-二氧杂辛酸(dioxaoctanopic acid)、fmoc-氨甲环酸、fmoc-异哌啶酸、fmoc-glu-otbu、fmoc-lys(fmoc)-oh。
[0204]
使用spps进行肽合成
[0205]
可使用hbtu/diea、hatu/diea或dic/hobt作为偶联剂在连接酰胺mbha树脂中使用普通fmoc化学合成肽。合成中使用的反应物和偶联剂包括以下组合
[0206]
[表1]
[0207][0208]
使用spss的肽合成过程的示例性方案包括以下。
[0209]
1)将dmf添加至含有连接酰胺mbha树脂的容器中,并使其膨胀2小时(sub:0.68mmol/g,1.0mmol,1.47g或5mmol,7.35g,sub:0.68mmol/g)。2)添加20%哌啶/dmf,然后混合30分钟。3)除去1)-2)的溶剂,接着用dmf洗涤(30秒x5次)。4)添加反应物(#1至#5的反
应物中的1种),然后混合30秒,接着添加偶联剂(#1至#5的偶联剂中的1种),并氮气鼓泡1小时。5)添加20%哌啶/dmf,接着混合30分钟。
[0210]
在上述1)至5)的示例性方案中,#1至#5的反应物和偶联剂的组合可使用至少一次以进行重复合成。为了除去fmoc,将[混合物]用20%哌啶/dmf溶液处理30分钟。
[0211]
用于肽纯化和分析的一般过程
[0212]
将未纯化的肽溶解于水、tfa和acn的合适混合物中,使用制备型hplc进行纯化,干燥并定量。使用制备型hplc纯化的条件包括以下表2中所示的那些。
[0213]
[表2]
[0214][0215]
使用制备型hplc纯化后,使用分析型hplc或lms来分析最终产物的特性。
[0216]
分析表明获得了以下表3的生物素部分。
[0217]
[表3]
[0218][0219]
b1:
[0220][0221]
b2:
[0222][0223]
b3:
[0224][0225]
b4:
[0226][0227]
b5:
[0228][0229]
此外,通过使用spss的1)至5)的肽合成方案,以及纯化和分析,获得了以下生物素部分。在表4中,x、y、z和b包括在本说明书的通式a的定义中。
[0230]
[表4]
[0231]
[0232][0233]
《实施方案:与生物素部分结合的生理活性物质的制备》
[0234]
《实施方案1至3》
[0235]
1)制备实施例
[0236]
使用添加有0.3%三乙胺(tea,sigma)的dmso溶剂作为反应溶剂,制备了以下表5中所述的具有seq.id.no.12的多肽的多肽-生物素部分与以上表3中所述的生物素部分(分别使用b1、b2和b3;seq.id.no.12的多肽:b1、b2或b3)之间的1:2摩尔比的混合物。使所述混合物在室温下反应至少30分钟,并且通过添加与混合物的体积相同体积的1%三氟乙酸来终止反应。
[0237]
[表5]
[0238][0239][0240]
2)分离、纯化和确认
[0241]
使用反相高效液相色谱法(下文称为“hplc”)分离和纯化以上实施方案1至3的反应产物。
[0242]
supersil ods-1柱(10x250mm,5μm,lb science,south korea)用作柱。使用30%-50%溶剂b(含0.1%tfa的乙腈)和溶剂a(含0.1%tfa的蒸馏水),流动相条件线性变化,保持4.7m/min的流速。在uv吸收光度计中在280nm处进行监测,收集在12与14分钟之间检测到的峰。在真空下从收集的峰中蒸发有机溶剂和tfa,然后使用具有适当分子量截留的超速离心过滤器进行浓缩和纯化。使用hplc分析确认经纯化物质的纯度。在接近室温的恒定温度下,使用gemini c18柱(4.6x250mm,5μm;phenomenex,ca,usa)进行分析。分析使用梯度洗脱法,使用包含三氟乙酸测试溶液:乙腈混合物(混合比为70:30,然后20分钟后为50:50)的流动相以1ml/min的流速进行。在280nm处观察到uv吸光度。
[0243]
图1是实施方案3的纯化色谱图。
[0244]
图2是实施方案1至实施方案3的最终物质的色谱图。
[0245]
在使用uv检测器进行分析时,没有观察到除与生物素部分键合的多肽以外的峰,并且以百分比表示每个色谱图中峰的面积,确认实施方案1至3的纯度为99%或更高。
[0246]
分子量检查
[0247]
测量在实施方案1至实施方案3中获得的最终物质的分子量。
[0248]
使用maldi-tof质谱法测量分子量。作为基质溶液,使用含有0.1%tfa的用chca(α-氰基-4-羟基肉桂酸)饱和的50%乙腈溶液。在线性模式和反射模式下检查质谱,并通过在0.1mg/ml下最终物质的浓度来检查分子量。
[0249]
图3是实施方案1至实施方案3的maldi-tof质谱。参照图3,证实通过maldi-tof质谱分离的物质的分子量与其理论分子量相匹配。
[0250]
《实施方案4至9》
[0251]
使用与实施方案1至3相同的方法,通过使生物素部分与seq.id.no.8和13的多肽键合来制备多肽-生物素部分,如以下表6所示。
[0252]
[表6]
[0253][0254]
[评价]
[0255]
反应速率和产率
[0256]
基于在初始混合物获得步骤中添加的多肽的量,通过在具有生物素部分的混合物的hplc分析下比较实施方案1至3的hlpc峰面积来发现反应速率。
[0257]
是通过基于在初始混合物获得步骤中添加的多肽的量来定量最终纯化物质的量来发现本发明的产率。结果在以下表7中示出。
[0258]
[表7]
[0259] 实施方案1至3结合位置c40反应速率》99%产率80%
[0260]
测量实施方案1至3的口服吸收率
[0261]
为了确认口服吸收率,比较了药物行为。
[0262]
将试样分别以100和500μg/kg的量静脉内和口服施用于体重大约200g的实验大鼠(sd大鼠),然后收集血清并进行酶联免疫吸附测定以测量随时间推移,血液药物浓度的变化。从颈静脉收集血液样品。结果被计算为平均值,并且具有seq.id.no.5的氨基酸序列的多肽用作对照。在实验的结果中,发现口服吸收率相对于对照提高了大约257倍(对于实施方案1)、270倍(对于实施方案2)和大约557倍(对于实施方案3)。
[0263]
图4是示出在口服施用于大鼠后按小时计的实施方案1至实施方案3的血液浓度的图。如图4所示,证实与对照相比,实施方案1至3表现出优异的口服吸收。
[0264]
测量实施方案1至3的血糖调节能力
[0265]
为了确认葡萄糖耐量,将呈口服glp-1激动剂剂型的实施方案1至3口服施用于小鼠,并通过腹膜内葡萄糖耐量测试(ipgtt)测量血糖调节功效。
[0266]
为了测量动物模型中的腹膜葡萄糖耐量,将100μg的试样(1μg/小鼠,seq.id.no.1)在-60分钟时口服施用于9周龄雄性小鼠(c57bl/6),然后腹膜内注射200μg葡萄糖(2g/kg),并且观察在-60、0、20、40、60、90和120分钟时从尾静脉收集的血液中的血糖变化。对于对照1,皮下施用具有seq.id.no.5的氨基酸序列的多肽,并且对于对照2,口服施用所述多肽。
[0267]
图5是示出向每个试样施用葡萄糖后的血糖变化的图。如图5所示,证实实施方案1至3具有葡萄糖调节能力。
[0268]
测量实施方案5和实施方案6的血糖调节能力
[0269]
为了确认葡萄糖耐量,将实施方案5和6口服施用于小鼠,并通过腹膜内葡萄糖耐量测试测量血糖调节功效。
[0270]
为了测量动物模型中的腹膜葡萄糖耐量,将100μg的试样(500μg/kg,seq.id.no.2)在-20分钟时口服施用于9周龄雄性小鼠(c57bl/6),然后腹膜内注射200μg葡萄糖(2g/kg),并且观察在-20、0、20、40、60、90和120分钟时从尾静脉收集的血液中的血糖变化。
[0271]
图6是示出向每个试样施用葡萄糖后的血糖变化的图。如图6所示,证实实施方案5和6具有葡萄糖调节能力。
[0272]
测量实施方案8和实施方案9的口服吸收率
[0273]
测量实施方案8和9的口服吸收率。将试样通过皮下注射和口服以20μg/kg的量施用于体重大约200g的实验大鼠(sd大鼠),然后分离血清并进行酶联免疫吸附测试以测量随时间推移,血液药物浓度的变化。从颈静脉收集血液样品。测量的结果如以下表8所示。具有seq.id.no.6的氨基酸序列的多肽用作对照。
[0274]
[表8]
[0275] 与皮下施用相比的生物利用度(%)对照,20μg/kg,皮下注射-实施方案8,20μg/kg,口服施用7.8实施方案9,20μg/kg,口服施用4.9
[0276]
如上所示,根据本发明的一个实施方案的与生物素部分键合的多肽被证实在肠中具有高吸收率。
[0277]
《实施方案10》
[0278]
使用来自表3的生物素部分b4和以下表9中具有seq.id.no.5的氨基酸序列的多肽,制备了与生物素部分键合的多肽。
[0279]
[表9]
[0280][0281]
1)制备实施例
[0282]
使用添加有0.3%三乙胺(tea,sigma)的dmso溶剂作为反应溶剂,制备了seq.id.no.5的多肽与以上表3中的b4之间1:4摩尔比的混合物。使所述混合物在室温下反应两小时,并且通过添加与混合物的体积相同体积的1%三氟乙酸来终止反应。
[0283]
2)分离、纯化和确认
[0284]
使用反相hplc分离和纯化实施方案10的反应产物。
[0285]
supersil ods-1柱(10x250mm,5μm,lb science,south korea)用作柱。使用30%-50%溶剂b(含0.1%tfa的乙腈)和溶剂a(含0.1%tfa的蒸馏水),流动相条件线性变化,保持4.7m/min的流速。在uv吸收光度计中在280nm处监测,收集在12.7分钟时检测到的峰。在真空下从收集的峰中蒸发有机溶剂和tfa,然后使用具有适当分子量截留的超速离心过滤器进行浓缩和纯化。使用hplc分析确认经纯化物质的纯度。在接近室温的恒定温度下,使用gemini c18柱(4.6x250mm,5μm;phenomenex,ca,usa)进行分析。分析使用包含三氟乙酸测试溶液:乙腈混合物(混合比为70:30,然后20分钟后为50:50)的流动相以1ml/min的流速进行。在280nm处观察到uv吸光度。
[0286]
图9是本发明的实施方案10的纯化色谱图。在11.7分钟时检测到seq.id.no.1的未反应的多肽,并且在12.7分钟时检测到与生物素部分键合的实施方案10的物质。
[0287]
图10是本发明的实施方案10的纯化后色谱图。确认了与生物素部分键合的多肽的单峰,并且未观察到其他峰。以百分比表示色谱图中的峰面积,确认纯度为95%或更高。
[0288]
3)确认分子量
[0289]
测量在实施方案10中获得的最终物质的分子量。
[0290]
使用maldi-tof质谱法测量分子量。作为基质溶液,使用含有0.1%tfa的用chca(α-氰基-4-羟基肉桂酸)饱和的50%乙腈溶液。在线性模式和反射模式中检查质谱。
[0291]
《实施方案11》
[0292]
使用来自表3的生物素部分b5和以下表10中具有seq.id.no.12的氨基酸序列的多肽制备了与生物素部分键合的多肽。
[0293]
[表10]
[0294][0295]
1)制备实施例
[0296]
使用添加有0.3%三乙胺(tea,sigma)的dmso溶剂作为反应溶剂,制备了
seq.id.no.12的多肽与以上表3中的b5之间1:2摩尔比的混合物。使所述混合物在室温下反应30分钟,并且通过添加与混合物的体积相同体积的1%三氟乙酸来终止反应。
[0297]
2)分离、纯化和确认
[0298]
使用反相hplc分离和纯化实施方案10的反应产物。
[0299]
supersil ods-1柱(10x250mm,5μm,lb science,south korea)用作柱。使用30%-50%溶剂b(含0.1%tfa的乙腈)和溶剂a(含0.1%tfa的蒸馏水),流动相条件线性变化,保持4.7m/min的流速。在uv吸收光度计中在280nm处监测,收集在11分钟至13分钟时检测到的峰。在真空下从收集的峰中蒸发有机溶剂和tfa,然后使用具有适当分子量截留的超速离心过滤器进行浓缩和纯化。使用hplc分析确认经纯化物质的纯度。在接近室温的恒定温度下,使用gemini c18柱(4.6x250mm,5μm;phenomenex,ca,usa)进行分析。分析使用包含三氟乙酸测试溶液:乙腈混合物(混合比为70:30,然后20分钟后为50:50)的流动相以1ml/min的流速进行。在280nm处观察到uv吸光度。
[0300]
图11是本发明的实施方案11的反相色谱图。确认了与生物素部分键合的多肽的单峰,并且未观察到其他峰。以百分比表示色谱图中的峰面积,确认纯度为90%或更高。
[0301]
3)确认分子量
[0302]
测量在实施方案11中获得的最终物质的分子量。
[0303]
使用maldi-tof质谱法测量分子量。作为基质溶液,使用含有0.1%tfa的用chca(α-氰基-4-羟基肉桂酸)饱和的50%乙腈溶液。在线性模式和反射模式中检查质谱。
[0304]
图12是本发明的实施方案10和实施方案11的maldi-tof质谱。参照图12,maldi-tof质谱证实经分离的物质的分子量与其理论分子量相匹配。
[0305]
《实施方案12和13》
[0306]
使用来自表3的生物素部分b4和以下表11中具有seq.id.no.15和16的氨基酸序列的多肽制备了与生物素部分键合的多肽。
[0307]
[表11]
[0308][0309]
1)制备实施例
[0310]
使用添加有0.3%三乙胺(tea,sigma)的dmso溶剂作为反应溶剂,制备了seq.id.no.15和16的多肽与以上表3中的b4之间1:16摩尔比的混合物。使所述混合物在室温下反应两小时,并且通过添加与混合物的体积相同体积的含1%三氟乙酸的30%乙腈/蒸馏水溶液来终止反应。
[0311]
2)分离、纯化和确认
[0312]
使用反相hplc分离和纯化实施方案12和13的反应产物。
[0313]
supersil ods-1柱(10x250mm,5μm,lb science,south korea)用作柱。使用30%-40%溶剂b(含0.1%tfa的乙腈)和溶剂a(含0.1%tfa的蒸馏水),流动相条件线性变化,保持4.7m/min的流速。在uv吸收光度计中在280nm处监测,收集在12.7分钟时检测到的峰。在真空下从收集的峰中蒸发有机溶剂和tfa,然后使用具有适当分子量截留的超速离心过滤器进行浓缩和纯化。使用hplc分析确认经纯化物质的纯度。在接近室温的恒定温度下,使用gemini c18柱(4.6x250mm,5μm;phenomenex,ca,usa)进行分析。分析使用包含三氟乙酸测试溶液:乙腈混合物(混合比为70:30,然后20分钟后为50:50)的流动相以1ml/min的流速进行。在280nm处观察到uv吸光度。
[0314]
图13是本发明的实施方案12和实施方案13的纯化色谱图。在12.1分钟时检测到seq.id.no.7的未反应的多肽,在12.3分钟时检测到与生物素部分键合的实施方案12的物质,并且在12.5分钟时检测到实施方案13的物质。
[0315]
图14是本发明的实施方案12的纯化后色谱图。确认了与生物素部分键合的多肽的单峰,并且未观察到其他峰。以百分比表示色谱图中的峰面积,确认纯度为95%或更高。
[0316]
图15是本发明的实施方案13的纯化后色谱图。确认了与生物素部分键合的多肽的单峰,并且未观察到其他峰。以百分比表示色谱图中的峰面积,确认纯度为95%或更高。
[0317]
3)确认分子量
[0318]
测量在实施方案12和13中获得的最终物质的分子量。
[0319]
使用maldi-tof质谱法测量分子量。作为基质溶液,使用含有0.1%tfa的用chca(α-氰基-4-羟基肉桂酸)饱和的50%乙腈溶液。在线性模式和反射模式中检查质谱。
[0320]
[评价]
[0321]
测量实施方案10和11的血糖调节能力
[0322]
为了确认葡萄糖耐量,将呈口服glp-1激动剂剂型的实施方案10和11口服施用于小鼠,并通过腹膜内葡萄糖耐量测试(ipgtt)测量血糖调节功效。
[0323]
为了测量动物模型中的腹膜葡萄糖耐量,将100μg的在实施方案10和11中制备的与生物素部分键合的多肽(10μg/小鼠,seq.id.no.1)在-20分钟时口服施用于9周龄雄性小鼠(c57bl/6),然后腹膜内注射200μg葡萄糖(2g/kg),并且观察在-20 0、0、20、40、60、90和120分钟时从尾静脉收集的血液中的血糖变化。对于对照,口服施用包含由seq.id.no.5表示的氨基酸序列的毒蜥外泌肽-4。
[0324]
图7是示出向每个试样施用葡萄糖后的血糖变化的图。如图7所示,证实实施方案10至11具有血糖调节能力。
[0325]
测量实施方案12和13的生物活性
[0326]
比较了生物素部分的键合之前和之后多肽的生物活性。此外,比较了根据生物素部分的键合位置的生物活性。
[0327]
具体地,使用胰岛素生物测定试剂盒(discoverx,#93-0466y3-00007)测量了生物活性。
[0328]
将pathhunter u2os insrb生物测定细胞分布在96孔板中,然后在assaycomplete
tm
细胞涂铺试剂5(cp5)中培养24小时。然后,以300、60、20、6.67、2.22、0.74、0.25、0.05和0.01的浓度以20μg添加相应的药物。培养3小时后,添加10μg的检测试剂1,并且反应15分钟,然后添加40μg的检测试剂2,并且反应60分钟。然后,使用96孔酶标仪测量发
光。包含具有seq.id.no.15的氨基酸序列的链a和具有seq.id.no.16的氨基酸序列的链b的蛋白质用作对照。在此,所述蛋白质在链a的c6-链a的c11、链a的c7-链b的c7和链a的c20-链b的c19之间具有二硫键。
[0329]
[表12]
[0330] ec
50
(ng/ml)对照4.06实施方案1219.58实施方案1355.31
[0331]
测量实施方案12和13的血糖调节能力
[0332]
为了确认葡萄糖耐量,将呈口服蛋白质剂型的实施方案12和13口服施用于小鼠,并通过腹膜内葡萄糖耐量测试测量血糖调节功效。
[0333]
为了测量动物模型中的腹膜葡萄糖耐量,将100μg的在实施方案12和13中制备的与生物素部分键合的多肽(10μg/小鼠)在-20分钟时口服施用于9周龄雄性小鼠(c57bl/6),然后腹膜内注射200μg葡萄糖(2g/kg),并且观察在-20、0、20、40、60、90和120分钟时从尾静脉收集的血液中的血糖变化。同时,包含具有seq.id.no.15的氨基酸序列的链a和具有seq.id.no.16的氨基酸序列的链b的蛋白质用作对照。
[0334]
图8是示出向每个试样施用葡萄糖后的血糖变化的图。如图8所示,证实实施方案12至13具有葡萄糖调节能力。
[0335]
本领域技术人员可通过日常实验了解或确认本说明书中所陈述的本发明的具体实施例的多种等效物。此类等效物意图包括在所附权利要求书中。本发明的前述描述意图是示例性的,并且本发明所属技术领域的普通技术人员将能够理解,在不改变本发明的技术理念或其基本特征的情况下,本发明可容易地修改为其他具体形式。因此,上文中描述的实施方案应被理解为在所有方面都是示例性的和非限制性的。例如,被描述为组合的相应组分要素可单独实施,并且同样被描述为分开的组分要素可以组合形式实施。可从所附权利要求及其等效概念的含义和范围推导出的所有修改或改变形式都可被解释为包括在本发明的范围内。
[0336]
工业实用性
[0337]
本发明是与生物素部分键合的具有优异体内口服吸收的生理活性物质和包含所述生理活性物质的用于口服施用的组合物,并且可通过使用诸如spss的方法制备生物素部分并将所述生物素部分与生理活性物质混合来制备与生物素部分键合的生理活性物质。此外,本发明具有能够抵御由于生物素部分的键合所致的生理活性物质的分解,并且最终促进生理活性物质对肠膜的渗透及其在肠中的吸收的益处。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1