用于治疗剂投予的组成物及方法与流程
用于治疗剂投予的组成物及方法
背景技术:
1.基因疗法及反义寡核苷酸疗法作为用于神经疾病或病症的治疗的巨大潜力早已被注意到。与仅依靠治疗神经疾病或障碍的症状的手术或药物不同,患者可通过直接靶向潜在疾病/病症病因被治疗,尤其是具有潜在遗传因素的患者。此外,通过靶向神经疾病或病症的潜在遗传病因,基因疗法及基于反义寡核苷酸的治疗方法可提供比标准药物疗法更长时段的持续治疗且具有有效治愈患者的潜力。然而,尽管如此,神经病症的基因疗法及基于反义寡核苷酸的治疗方法的临床应用仍需要在若干方面中进行改良。这些疗法关注的一个领域为向中枢神经系统有效递送治疗剂。诸如aav9的载体在小鼠静脉内投予时可以穿过血脑屏障,但在较大动物的静脉内递送此类载体是困难的,因为需要极高载体剂量来保证有效且周边器官中的高转导可能与毒性有关。另一投予途径(实质内(intraparenchymal)注射)需要较低剂量的载体且可有效转导至中枢神经系统(central nervous system;cns)的靶向区域。然而,实质内注射可能不适用于治疗需要在整个cns中递送载体的病症。
2.因此,需要鉴别用于将基因疗法或基因表现靶向cns中的所关注组织或细胞类型的组件及其使用方法,其可减少脱靶效应、增加目标组织及/或细胞类型中的治疗功效及/或通过降低实现功效所需的有效剂量来增加患者安全性及耐受性。
技术实现要素:
3.本文提供在一些具体实施例中可用于治疗诸如dravet综合征(dravet syndrome)的神经元疾病的组成物及方法。
4.在一些具体实施例中,本发明提供一种向灵长类动物投予载体的方法,其包含向灵长类动物脑室内(intracerebroventricular;icv)投予载体,其中载体包含细胞类型选择性调控组件。在一些具体实施例中,本发明提供一种向灵长类动物投予载体的方法,其包含向灵长类动物脑室内(icv)投予载体,其中载体包含调控组件,其中与可操作地连接至cmv启动子时的转基因表现相比,调控组件使得转基因表现增加至少2倍。在一些具体实施例中,本发明提供一种向灵长类动物投予载体的方法,其包含向灵长类动物脑室内(icv)投予载体,其中载体为单侧投予。在一些具体实施例中,本发明提供一种向灵长类动物投予载体的方法,其包含向灵长类动物脑室内(icv)投予载体,其中载体不为自身互补型aav。在某些具体实施例中,灵长类动物为人类。在某些具体实施例中,灵长类动物为非人类灵长类动物。在某些具体实施例中,非人类灵长类动物为旧大陆猴、红毛猩猩、大猩猩、黑猩猩、食蟹猕猴、恒河猕猴或豚尾猕猴。在某些具体实施例中,载体包含可操作地连接至调控组件的核苷酸序列。在某些具体实施例中,调控组件在神经元细胞中选择性地表现。在某些具体实施例中,神经元细胞选自以下种类及其组合:单极、双极、多极或伪单极神经元。在某些具体实施例中,神经元细胞为gaba性(gabaergic)神经元。在某些具体实施例中,调控组件在胶细胞中选择性地表现。在某些具体实施例中,胶细胞选自以下种类及其组合:星状细胞、寡树突神经胶质细胞、室管膜细胞、许旺细胞及卫星细胞。在某些具体实施例中,调控组件在非神经元细胞中选择性地表现。在某些具体实施例中,载体被投予至超过一个脑室。在某些具
体实施例中,载体为两侧投予。在某些具体实施例中,载体为同时投予。在某些具体实施例中,载体为相继投予。在某些具体实施例中,载体的各剂为相隔至少24小时投予。在某些具体实施例中,载体被投予至一个脑室。在某些具体实施例中,灵长类动物进一步接受载体的静脉内投予。在某些具体实施例中,灵长类动物进一步接受载体的鞘内投予。在某些具体实施例中,鞘内投予包含鞘内脑池投予或鞘内腰椎投予。在某些具体实施例中,载体包含编码多肽的核苷酸序列。在某些具体实施例中,多肽为dna结合蛋白。在某些具体实施例中,dna结合蛋白选自以下种类及其组合:锌指蛋白(zinc finger protein;zfp)、锌指核酸酶(zinc finger nuclease;zfn)或转录活化因子样效应物核酸酶(transcription activator-like effector nuclease;talen)。在某些具体实施例中,核苷酸序列为密码子优化变体及/或其片段。在某些具体实施例中,载体包含编码引导rna(grna)的核苷酸序列。在某些具体实施例中,载体包含编码减少目标基因的表现的干扰rna(rnai)的核苷酸序列。在某些具体实施例中,rnai减少选自以下种类及其组合的目标基因的表现:sod1、htt、τ或α-突触核蛋白。在某些具体实施例中,载体包含编码减少目标基因的表现的反义寡核苷酸的核苷酸序列。在某些具体实施例中,载体选自以下种类及其组合:慢病毒、逆转录病毒、质体或单纯疱疹病毒(herpes simplex virus;hsv)。在某些具体实施例中,载体为腺相关病毒(adeno-associated virus;aav)载体。在某些具体实施例中,aav为单股aav。在某些具体实施例中,aav为自身互补型aav。在某些具体实施例中,腺相关病毒载体为以下者中的任一者:aav1、scaav1、aav2、aav3、aav4、aav5、scaav5、aav6、aav7、aav8、aav9、scaav9、aav10、aav11、aav12、rh10、禽类aav、牛类aav、犬类aav、马类aav、灵长类aav、非灵长类aav及绵羊类aav,或其任何杂合体。在某些具体实施例中,aav载体为aav5。在某些具体实施例中,aav载体为aav9。在某些具体实施例中,载体包含5'aav反向末端重复(inverted terminal repeat;itr)序列及3'aav itr序列。在某些具体实施例中,载体在药学上可接受的载剂中投予。在某些具体实施例中,载体为与造影剂组合投予。在某些具体实施例中,载体不与造影剂组合投予。在某些具体实施例中,投予为通过注射途径进行。在某些具体实施例中,投予为通过输注途径进行。
5.在一些具体实施例中,本发明提供一种用于表现目的基因或其生物活性变体及/或片段的方法,其包含向灵长类动物投予治疗有效量的编码目的基因的腺相关病毒1(aav1)载体或腺相关病毒5(aav5)载体,其中投予途径选自以下种类及其组合:静脉内投予、鞘内投予、脑室内投予、实质内投予或其组合。在某些具体实施例中,灵长类动物为人类。在某些具体实施例中,灵长类动物为非人类灵长类动物。在某些具体实施例中,非人类灵长类动物为旧大陆猴、红毛猩猩、大猩猩、黑猩猩、食蟹猕猴、恒河猕猴或豚尾猕猴。在某些具体实施例中,aav1载体或aav5载体包含可操作地连接至调控组件的核苷酸序列。在某些具体实施例中,调控组件具有细胞类型选择性。在某些具体实施例中,调控组件在神经元细胞中选择性地表现。在某些具体实施例中,神经元细胞选自以下种类及其组合:单极、双极、多极或伪单极神经元。在某些具体实施例中,神经元细胞为gaba性神经元。在某些具体实施例中,调控组件在胶细胞中选择性地表现。在某些具体实施例中,胶细胞选自以下种类及其组合:星状细胞、寡树突神经胶质细胞、室管膜细胞、许旺细胞及卫星细胞。在某些具体实施例中,调控组件在非神经元细胞中选择性地表现。在某些具体实施例中,aav1或aav5被投予至超过一个脑室。在某些具体实施例中,aav1或aav5为两侧投予。在某些具体实施例
中,aav1或aav5为同时投予。在某些具体实施例中,aav1或aav5为相继投予。在某些具体实施例中,aav1或aav5的各剂相隔至少24小时投予。在某些具体实施例中,aav1或aav5被投予至一个脑室。在某些具体实施例中,aav1或aav5包含编码多肽的核苷酸序列。在某些具体实施例中,多肽为dna结合蛋白。在某些具体实施例中,dna结合蛋白选自以下种类及其组合:锌指蛋白(zfp)、锌指核酸酶(zfn)或转录活化因子样效应物核酸酶(talen)。在某些具体实施例中,核苷酸序列为密码子优化变体及/或其片段。在某些具体实施例中,载体包含编码引导rna(grna)的核苷酸序列。在某些具体实施例中,aav1或aav5包含编码减少目标基因的表现的干扰rna(rnai)的核苷酸序列。在某些具体实施例中,rnai减少选自以下种类及其组合的目标基因的表现:sod1、htt、τ或α-突触核蛋白。在某些具体实施例中,aav1或aav5包含编码减少目标基因的表现的反义寡核苷酸的核苷酸序列。在某些具体实施例中,载体选自以下种类及其组合:慢病毒、逆转录病毒、质体或单纯疱疹病毒(hsv)。在某些具体实施例中,aav1或aav5在药学上可接受的载剂中投予。在某些具体实施例中,载体与造影剂组合投予。在某些具体实施例中,载体不与造影剂组合投予。在某些具体实施例中,投予为通过注射途径进行。在某些具体实施例中,投予为通过输注途径进行。
6.在一些具体实施例中,本发明提供一种在有需要的灵长类动物中抑制或治疗与神经元疾病相关的一或多种症状的方法,其包含向灵长类动物投予选自由腺相关载体1(aav1)或腺相关载体5(aav5)组成的群的腺相关载体(aav),其中投予途径选自以下种类及其组合:静脉内投予、鞘内投予、脑室内投予、实质内投予或其组合。在某些具体实施例中,神经元疾病选自以下种类及其组合:溶体储积症、dravet综合征、阿兹海默氏病(alzheimer's disease)、帕金森氏病(parkinson's disease)、亨廷顿氏病(huntington's disease)、肌萎缩性侧索硬化症(amyotrophic lateral sclerosis;als)、脊髓性肌萎缩症(spinal muscular atrophy;sma)、癫痫症、神经退化、动作障碍症、运动障碍症或情绪障碍症。在某些具体实施例中,灵长类动物为人类。在某些具体实施例中,灵长类动物为非人类灵长类动物。在某些具体实施例中,非人类灵长类动物为旧大陆猴、红毛猩猩、大猩猩、黑猩猩、食蟹猕猴、恒河猕猴或豚尾猕猴。
7.在一些具体实施例中,本发明提供一种向灵长类动物投予载体的方法,其包含向灵长类动物脑室内(icv)投予载体,其中载体包含转基因,且与通过任何其他投予途径投予载体时的转基因表现相比,icv投予使得中枢神经系统(cns)中的转基因表现增加至少1.25倍。在某些具体实施例中,与通过任何其他投予途径投予载体时的转基因表现相比,icv投予在中枢神经系统(cns)中产生大至少1.5倍、1.75倍、2倍、3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍或75倍或至少20-90倍、20-80倍、20-70倍、20-60倍、30-90倍、30-80倍、30-70倍、30-60倍、40-90倍、40-80倍、40-70倍、40-60倍、50-90倍、50-80倍、50-70倍、50-60倍、60-90倍、60-80倍、60-70倍、70-90倍、70-80倍、80-90倍的转基因序列表现。在一些具体实施例中,icv投予引起在整个脑中的基因转移。在某些具体实施例中,基因转移发生在额叶皮质、顶叶皮质、颞叶皮质、海马回、延脑及枕叶皮质中。在某些具体实施例中,基因转移具有剂量依赖性。在某些具体实施例中,载体进一步包含细胞类型选择性调控组件。在某些具体实施例中,调控组件在脑中选择性地表现。在某些具体实施例中,调控组件在额叶皮质、顶叶皮质、颞叶皮质、海马回、延脑及枕叶皮质中选择性地表现。在某些具体实施例中,调控组件在脊柱中选择性地表现。在某些具体实施例
中,调控组件在脊髓及背根神经节中选择性地表现。在某些具体实施例中,调控组件在神经元细胞中选择性地表现。在某些具体实施例中,神经元细胞选自以下种类及其组合:单极、双极、多极或伪单极神经元。在某些具体实施例中,神经元细胞为gaba性神经元。在某些具体实施例中,调控组件在胶细胞中选择性地表现。在某些具体实施例中,胶细胞选自以下种类及其组合:星状细胞、寡树突神经胶质细胞、室管膜细胞、许旺细胞及卫星细胞。在某些具体实施例中,调控组件在非神经元细胞中选择性地表现。图式简单说明
8.本发明的新颖特征在随附申请专利范围中细致阐述。将参考阐述利用本发明原理的说明性具体实施例及其随附图式的以下详细描述来获得对本发明的特征及优点的更优选理解:
9.[图1]展示自脑样本采集的组织厚片的例示性表示且指示针对额叶皮质、顶叶皮质、颞叶皮质、海马回、小脑、延脑及枕叶皮质中的每一者获得的组织戳取样本(punch)的位置及数目。对于每种类型的组织样本,组织戳取样本为获自右及左半球且在一些情况下,获得来自两个厚片的戳取样本。
[0010]
[图2]展示经由单侧脑室内(icv)、大池内(intracisterna magna;icm)及鞘内腰椎(it-腰椎)投予途径以高剂量(1e+13载体基因体复本(vg)/动物)投予的用aav9-cba-egfp-kash处理的动物的不同组织厚片及戳取样本上的组织分布。数据表示为每二倍体基因体的载体复本数(vcn/二倍体基因体)。冠状切片(coronal section;cs)2l表示来自厚片2的左半球的组织戳取样本,cs 2r表示来自厚片2的右半球的组织戳取样本,cs 8l表示来自厚片8的左半球的顶部戳取的组织戳取样本(参见图1),cs 8l2表示来自厚片8的左半球的底部戳取的组织戳取样本(参见图1等)。
[0011]
[图3]展示经由单侧icv、icm及it-腰椎投予途径以高剂量(1e+13vg/动物)投予的用aav9-cba-egfp-kash处理的动物的脑中的平均vcn/二倍体基因体。各数据点表示各组织戳取样本的vc/二倍体gdna且水平条柱表示各投予途径的所有组织戳取样本的平均vcn/二倍体基因体。用单侧icv投予获得的vcn/二倍体基因体在统计学上显著高于用icm或it-腰椎投予获得的vcn/二倍体基因体。
[0012]
[图4]展示经由单侧icv、icm及it-腰椎投予途径以高剂量(1e+13vg/动物)投予的用aav9-cba-egfp-kash处理的动物的脑的不同区域(例如,额叶皮质(frontal cortex;fc)、顶叶皮质(parietal cortex;pc)、颞叶皮质(temporal cortex;tc)、枕叶皮质(occipital cortex;oc)、海马回(hippocampus;hip)、小脑(cerebellum;cb)及延脑(medulla;med))上的vcn/二倍体基因体。
[0013]
[图5]展示经由单侧icv、icm及it-腰椎投予途径以高剂量(1e+13vg/动物)投予的用aav9-cba-egfp-kash处理的动物的脊髓(spinal cord;sc)、背根神经节(dorsal route ganglion;drg)、心脏、肝脏、肾脏及脾组织样本中的vcn/二倍体基因体。c2为指颈部区域水平2,t1及t8为指胸部区域水平t1及t8,且l4为指脊髓的腰椎区域水平4。
[0014]
[图6]展示经由单侧脑室内(icv)、大池内(icm)、鞘内腰椎(it-腰椎)及静脉内(尾部静脉注射)投予途径以低剂量(2.4e+12vg/动物)投予的用aav9-cba-egfp-kash或aav9-seq id 76-egfp-wpre处理的动物的不同组织厚片及戳取样本上的组织分布。数据表示为vcn/二倍体基因体。对于单侧icv投予,数据点表示三种经处理动物的平均值。如实施方案1
中所描述,用aav9-cba-egfp-kash处理一种动物,且如实施方案2中所描述,用aav9-seq id 76-egfp-wpre处理两种动物。组织戳取样本如上述图2所示。获自厚片12中的延脑组织的一种戳取样本(图上所示)具有极高水平的vcn/二倍体基因体,推测归因于戳取接近icm投予的位点。
[0015]
[图7]展示经由单侧icv、icm及it-腰椎及iv投予途径以低剂量(2.4e+12vg/动物)投予的用aav9-cba-egfp-kash或aav9-seq id 76-egfp-wpre处理的动物的脑中的平均vcn/二倍体基因体。各数据点表示各组织戳取样本的vcn/二倍体基因体且水平条柱表示各投予途径的所有组织戳取样本的平均vcn/二倍体基因体。用单侧icv投予获得的vcn/二倍体基因体在统计学上显著高于用icm、it-腰椎及iv投予获得的vcn/二倍体基因体。对于单侧icv投予,数据点表示三种经处理动物的平均值。如实施方案1中所描述,用aav9-cba-egfp-kash处理一种动物,且如实施方案2中所描述,用aav9-seq id 76-egfp-wpre处理两种动物。自此数据集排除具有极高水平的vcn/二倍体基因体的icm戳取样本(如图6中所示)。
[0016]
[图8]展示经由单侧icv、icm及it-腰椎投予途径以低剂量(2.4e+12vg/动物)投予的用aav9-cba-egfp-kash或aav9-seq id 76-egfp-wpre处理的动物的脑的不同区域(例如,额叶皮质(fc)、顶叶皮质(pc)、颞叶皮质(tc)、枕叶皮质(oc)、海马回(hip)、小脑(cb)及延脑(med))上的vcn/二倍体基因体。对于单侧icv投予,数据点表示三种经处理动物的平均值。如实施方案1中所描述,用aav9-cba-egfp-kash处理一种动物,且如实施方案2中所描述,用aav9-seq id 76-egfp-wpre处理两种动物。
[0017]
[图9]展示经由单侧icv、icm、it-腰椎及iv投予途径以低剂量(2.4e+12vg/动物)投予的用aav9-cba-egfp-kash或aav9-seq id 76-egfp-wpre处理的动物的脊髓(sc)、背根神经节(drg)、心脏、肝脏、肾脏及脾组织样本中的vcn/二倍体基因体。对于单侧icv投予,数据点表示三种经处理动物的平均值。如实施方案1中所描述,用aav9-cba-egfp-kash处理一种动物,且如实施方案2中所描述,用aav9-seq id 76-egfp-wpre处理两种动物。
[0018]
[图10]展示经由单侧脑室内(icv)或两侧icv投予以高剂量(1e+13vg/动物)投予的用aav9-cba-egfp-kash处理的动物的不同组织厚片及戳取样本上的组织分布。数据表示为vcn/二倍体基因体。组织戳取样本如上述图2所示。
[0019]
[图11]展示经由单侧脑室内(icv)或两侧icv投予以高剂量(约2.4e+13vg/动物)投予的用aav9-cba-egfp-kash或aav9-seq id 76-egfp-wpre处理的动物的不同组织厚片及戳取样本上的组织分布。数据表示为vcn/二倍体基因体。对于单侧icv投予,数据点表示三种经处理动物的平均值。如实施方案1中所描述,用aav9-cba-egfp-kash处理一种动物,且如实施方案2中所描述,用aav9-seq id 76-egfp-wpre处理两种动物。组织戳取样本如上述图2所示。
[0020]
[图12]展示经由单侧icv或两侧icv投予途径以高剂量(icv-h)的1e+13vg/动物或低剂量(icv-l)的2.4e+12vg/动物投予的用aav9-cba-egfp-kash或aav9-seq id 76-egfp-wpre处理的动物的脑中的平均vcn/二倍体基因体。各数据点表示各组织戳取样本的vcn/二倍体基因体且水平条柱表示各投予途径的所有组织戳取样本的平均vcn/二倍体基因体。在高剂量及低剂量两者下,用单侧icv投予获得的vcn/二倍体基因体高于用两侧icv获得的vcn/二倍体基因体。对于以低剂量(icv-l)进行单侧icv投予,数据点表示三种经处理动物
laboratory notebook(j.e.cellis编,1998)academic press;animal cell culture(r.i.freshney编,1987);introduction to cell and tissue culture(j.p.mather及p.e.roberts,1998)plenum press;cell and tissue culture:laboratory procedures(a.doyle,j.b.griffiths及d.g.newell编,1993-1998)j.wiley and sons;methods in enzymology(academic press,inc.);gene transfer vectors for mammalian cells(j.m.miller及m.p.calos编,1987);current protocols in molecular biology(f.m.ausubel等人编,1987);pcr:the polymerase chain reaction,(mullis等人编,1994);sambrook及russell,molecular cloning:a laboratory manual,第3版,cold spring harbor laboratory press,cold spring harbor,ny(2001);ausubel等人,current protocols in molecular biology,john wiley&sons,ny(2002);harlow及lane,using antibodies:a laboratory manual,cold spring harbor laboratory press,cold spring harbor,ny(1998);coligan等人,short protocols in protein science,john wiley&sons,ny(2003);short protocols in molecular biology(wile及sons,1999)。
[0034]
酶促反应及纯化技术为根据制造商的说明书如所属技术领域中通常所实行或如本文所描述来进行。本文所描述的与分析化学、生物化学、免疫学、分子生物学、合成有机化学、及医学及药物化学结合使用的命名法、及其实验室程序及技术为所属技术领域中彼等熟知且常用者。标准技术为用于化学合成及化学分析。b.定义
[0035]
在整个本说明书及具体实施例中,字词「包含(comprise)」或诸如「包含(comprises)」或「包含(comprising)」的变体应理解为暗示包括所陈述整数或整数群但不排除任何其他整数或整数群。
[0036]
应理解,每当本文中用语言「包含」描述具体实施例时,亦提供用术语「由...组成」及/或「基本上由...组成」所描述的类似具体实施例。
[0037]
术语「包括」用以意为「包括(但不限于)」。「包括」及「包括(但不限于)」可互换使用。
[0038]
在术语「例如(e.g.)」或「举例而言(for example)」之后的任何实施例并不意为穷尽性的或限制性的。
[0039]
除非另外为情形所需,否则单数术语应包括复数且复数术语应包括单数。
[0040]
借助于实施例,「组件」意为一种组件或超过一种组件。
[0041]
尽管阐述本发明的广泛范围的数值范围及参数为近似值,但尽可能精确地报导特定实施例中所阐述的数值。然而,任何数值均固有地含有因其各别测试测量值中发现的标准偏差所必然引起的某些误差。此外,本文所揭示的所有范围应理解为涵盖其中所包含的任何及所有子范围。举例而言,应将「1至10」的规定范围视为包括最小值1与最大值10之间(且包括最小值及最大值)的任何及所有子范围;亦即,所有子范围以最小值1或更大(例如,1至6.1)开始且以最大值10或更小(例如,5.5至10)结束。
[0042]
在本发明的方面或具体实施例根据马库西群组(markush group)或其他替代分组进行描述的情况下,本发明不仅涵盖整体列出的整个群组,而且亦单独地涵盖群组的每一成员及主群组的所有可能子群组,且亦涵盖缺乏一或多个群组成员的主群组。本发明亦设想明确排除本发明中的群组成员中的任一者的一或多者。
[0043]
如本文所使用,除非上下文另外清楚地指示,否则单数形式「一(a/an)」及「该」意欲亦包括复数形式。此外,就实施方式及/或申请专利范围中使用的术语「包括(including/includes)」、「具有(having/has/with)」或其变化形式的程度而言,此类术语意欲以类似于术语「包含」的方式为包括性的。
[0044]
术语「aav」为腺相关病毒的缩写,且可用于指代病毒自身或其衍生物。除非另有要求,否则该术语涵盖所有血清型、亚型以及天然存在及重组形式两者。缩写「raav」为指重组腺相关病毒。术语「aav」包括aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、rh10及其杂合体、禽类aav、牛类aav、犬类aav、马类aav、灵长类aav、非灵长类aav及绵羊类aav。aav的各种血清型的基因体序列以及自然末端重复序列(terminal repeat;tr)、rep蛋白及衣壳子单元的序列为所属技术领域中已知的。此类序列可发现于文献中或诸如genbank的公共数据库中。如本文所使用,「raav载体」为指包含不属于aav来源的聚核苷酸序列(亦即与aav异源的聚核苷酸)(典型地为一种用于细胞的遗传转化的目的序列)的aav载体。一般而言,异源聚核苷酸为通过至少一个且一般由两个aav反向末端重复序列(itr)侧接。itr序列为所属技术领域中很好理解的术语且为指发现于反向中的病毒基因体的末端处的相对短的序列。raav载体可为单股(ssaav)或自身互补型(scaav)。「aav病毒」或「aav病毒颗粒」为指由至少一个aav衣壳蛋白及衣壳化聚核苷酸raav载体组成的病毒颗粒。若颗粒包含异源聚核苷酸(亦即,除野生型aav基因体(诸如待递送至哺乳动物细胞的转基因)以外的聚核苷酸),则其典型地称为「raav病毒颗粒」或简称为「raav颗粒」。
[0045]
术语「约(about)」或「大约(approximately)」意为在如由所属技术领域中具有通常知识者所测定的特定值的可接受误差范围内,其将部分取决于如何测量或测定该值,亦即测量系统的限制。举例而言,根据所属技术领域中的实践,「约」可意为在一个或超过一个标准偏差内。替代地,「约」可意为高于或低于既定值至多20%、至多15%、至多10%、至多5%或至多1%的范围。
[0046]
术语「测定(determining)」、「测量(measuring)」、「评估(evaluating)」、「评定(assessing)」、「分析(assaying)」、「分析(analyzing)」及其文法等效者可在本文中互换地使用以指任何测量形式,且包括测定要素是否存在(例如,侦测)。此等术语可包括定量及/或定性测定两者。评定可为相对或绝对的。
[0047]
「表现卡匣」为指包含一或多个可操作地连接至编码序列(例如,基因)的调控组件的用于表现的核分子。
[0048]
术语「有效量」或「治疗有效量」为指足以影响如下文所定义的预期应用(包括(但不限于)疾病治疗)的本文所描述的组成物的量。治疗有效量可根据预期治疗应用(于细胞中或活体内)或所治疗的个体及疾病病况(例如,个体的体重及年龄、疾病病况的严重程度)、投予方式及类似者而改变,其可由所属技术领域中具有通常知识者容易地确定。该术语亦适用于将在目标细胞中诱导特定反应的剂量。特定剂量将取决于所选择的特定组成物、待遵循的给药方案、其是否与其他化合物组合投予、投予时序、其所投予的组织及承载其的物理递送系统而变化。
[0049]
核苷酸或肽序列的「片段」为指短于全长或参考dna或蛋白质序列的序列片段。
[0050]
当提及诸如蛋白质、多肽、核酸及/或聚核苷酸的分子时,如本文所使用的术语「生物活性」意为分子保持至少一种实质上与全长或参考蛋白质、多肽、核酸及/或聚核苷酸的
生物活性类似的生物活性(功能性或结构性)。
[0051]
术语「试管内」为指发生于个体体外的事件。举例而言,试管内分析涵盖个体体外的任何分析操作。试管内分析涵盖基于细胞的分析,其中采用存活或死亡细胞。试管内分析亦涵盖无细胞分析,其中不采用完整细胞。
[0052]
术语「活体内」为指发生于个体体内的事件。
[0053]
「经分离」核酸为指已与其天然环境的组分分离的核酸分子。经分离核酸包括通常含有核酸分子的细胞中所含有的核酸分子,但该核酸分子存在于染色体外,存在于不同于其天然染色体位置的染色体位置处,或仅含有编码序列。
[0054]
如本文所使用,「可操作地连接(operably linked)」、「可操作的连接(operable linkage)」、「可操作地连接(operatively linked)」或其文法等效物为指基因组件(例如,启动子、强化子、聚腺苷酸化序列等)的并接,其中组件处于允许其以预期方式操作的关系。举例而言,若调控组件帮助引发编码序列的转录,则可包含启动子及/或强化子序列的调控组件以可操作方式连接至编码区。在调控组件与编码区之间可存在中间残基,只要维持此功能关系即可。
[0055]
「药学上可接受的载剂」为指药物调配物或组成物中除活性成分外的对个体无毒的成分。药学上可接受的载剂包括(但不限于)缓冲液、赋形剂、稳定剂或防腐剂。
[0056]
术语「药物调配物」或「药物组成物」为指呈准许其中所含活性成分的生物活性有效的形式,且不含有对调配物将投予的个体有不可接受毒性的额外组分的制剂。
[0057]
术语「调控组件」为指能够影响(例如,增加、减少或调节)可操作连接的序列(诸如基因)的表现的核酸序列或基因组件。调控组件包括(但不限于)启动子、强化子、抑制子、缄默子、绝缘子序列、内含子、utr、反向末端重复(itr)序列、长末端重复序列序列(long terminal repeat sequence;ltr)、稳定性组件、转译后反应组件或polya序列或其任何组合。调控组件可例如通过调节基因表现的转录阶段、转录后阶段或转译阶段处的基因表现;通过调节转译(例如,使mrna稳定以用于转译的稳定性组件)、rna裂解、rna剪接及/或转录终止的水平;通过向增加基因表现的编码区募集转录因子;通过提高产生rna转录物的速率、提高所产生rna的稳定性及/或提高自rna转录物的蛋白质合成的速率;及/或通过防止rna降解及/或提高其稳定性以促进蛋白质合成而在dna及/或rna层级水平下起作用。在一些具体实施例中,调控组件为指强化子、抑制子、启动子或其任何组合,尤其强化子加启动子组合或抑制子加启动子组合。在一些具体实施例中,调控组件衍生自人类序列。
[0058]
术语「个体(subject)」及「受试者(individual)」在本文中可互换使用以指脊椎动物,优选为哺乳动物,更优选为人类。本文所描述的方法可适用于人类治疗学、兽医学应用及/或疾病或病况的动物模型中的临床前研究。
[0059]
如本文所使用,术语「治疗(treat/treatment)」、「疗法」及类似者为指获得所需药理学及/或生理学功效,包括(但不限于)缓解、推迟或减缓进展;减少影响或症状;预防发作;预防复发;抑制、改善疾病或病症的发作;获得关于疾病、病症或医学病况的有益或所需结果,诸如治疗效益及/或预防效益。如本文所使用,「治疗」涵盖对哺乳动物,尤其人类的疾病的任何治疗,且包括:(a)预防疾病出现于可易患疾病或处于获得疾病的风险下但尚未诊断患有该疾病的个体中;(b)抑制疾病,亦即遏制其发展;及(c)缓解疾病,亦即引起疾病消退。治疗效益包括根除或改善所治疗的潜在病症。此外,经由根除或改善与潜在病症相关的
生理症状中的一或多者来达成治疗效益,从而观测到个体的改善,尽管该个体仍可能罹患潜在病症。在一些情况下,对于预防效益,向处于罹患特定疾病的风险下的个体,或向报导疾病的生理症状中的一或多者,即使尚未得到此疾病的诊断的个体投予组成物。本发明的方法可用于任何哺乳动物。在一些情况下,治疗可引起症状的减少或停止。预防作用包括推迟或消除疾病或病况的出现;推迟或消除疾病或病况的症状发作;减缓、阻止或逆转疾病或病况的进展;或其任何组合。
[0060]
核苷酸序列的「变体」为指与最常见野生型dna序列(例如,通过其genbank寄存编号提及的cdna或序列)或特定参考序列相比具有基因改变或突变的序列。
[0061]
如本文所使用,「载体」为指可用于介导将其所连接的另一核酸分子递送至其可复制或表现的细胞中的核酸分子。术语包括作为自我复制核酸结构的载体以及并入其已引入的宿主细胞的基因体中的载体。某些载体能够导引其可操作地连接的核酸的表现。此类载体在本文中称为「表现载体」。载体的其他实施例包括质体、病毒载体及黏接质体(cosmid)。
[0062]
一般而言,可互换使用的「序列一致性」或「序列同源性」分别为指两个聚核苷酸或多肽序列的精确的核苷酸与核苷酸或氨基酸与氨基酸对应性。两个或更多个序列(聚核苷酸或氨基酸)可通过测定其「一致性百分比」(亦称为「同源性百分比」)而进行比较。可将与参考序列(例如,核酸或氨基酸序列)的一致性百分比计算为两个最佳比对序列之间的精确相配物的数目除以参考序列的长度且乘以100。当针对序列一致性测定相配物的数目时,不将保守性取代视为相配物。应了解,当第一序列(a)的长度不等于第二序列(b)的长度时,a:b序列的一致性百分比将不同于b:a序列的一致性百分比。序列比对(诸如出于评定一致性百分比的目的)可通过任何适合比对算法或程序来进行,包括(但不限于)尼德曼-翁施算法(needleman-wunsch algorithm)(参见例如,可于全球信息网ebi.ac.uk/tools/psa/emboss_needle/上获得的emboss needle比对器)、blast算法(参见例如,可于全球信息网blast.ncbi.nlm.nih.gov/blast.cgi上获得的blast比对工具)、史密斯-沃特曼算法(smith-waterman algorithm)(参见例如,可于全球信息网ebi.ac.uk/tools/psa/emboss_water/上获得的emboss water比对器)及clustal omega比对程序(参见例如,全球信息网clustal.org/omega/及f.sievers等人,mol sys biol.7:539(2011))。可使用所选算法的任何适合参数(包括预设参数)来评定最佳比对。blast程序为基于karlin及altschul,proc.natl.acad.sci.usa 87:2264-2268(1990)的比对方法及如altschul等人,j.mol.biol.215:403-410(1990);karlin及altschul,proc.natl.acad.sci.usa 90:5873-5877(1993);及altschul等人,nucleic acids res.25:3389-3402(1997)中所论述的比对方法。
[0063]
除非另外指示,否则本文中所使用的所有术语具有其对于所属技术领域中具有通常知识者所意为的相同含义且本发明的实践将采用分子生物学、微生物学及重组dna技术的常规技术,其在所属技术领域中具有通常知识者的知识范围内。c.核酸构筑体
[0064]
在一些具体实施例中,本发明为关于投予包含细胞类型选择性调控组件的载体的方法。在一些具体实施例中,载体包含调控组件。在一些具体实施例中,与可操作地连接至cmv启动子时的转基因表现相比,调控组件使得转基因表现增加至少2倍。在一些具体实施例中,方法包含投予载体(例如aav9),该等载体包含可操作地连接至调控组件的核苷酸序
列(例如,编码多肽的核苷酸序列)。因此,在一些方面中,本文中提供适用于实践本发明的方法的核酸组分及组成物。
[0065]
在一些具体实施例中,核酸为dna分子。在一些具体实施例中,核酸为rna分子。在一些具体实施例中,核酸为本文所揭示的载体中的任一者中的dna分子。在一些具体实施例中,核酸分子包含本文所揭示的转基因中的任一者。在一些具体实施例中,核酸分子包含本文所揭示的调控组件中的任一者。在一些具体实施例中,核酸为包含本文所揭示的转基因中的任一者及本文所揭示的调控组件中的任一者的dna分子。在一些具体实施例中,核酸分子为包含本文所揭示的转基因中的任一者的rna核酸分子。在一些具体实施例中,rna分子为自本文所揭示的dna分子(例如,包含本文所揭示的转基因及调控组件中的任一者的dna分子)中的任一者转录。在一些具体实施例中,rna分子为自本文所揭示的dna分子(例如,包含本文所揭示的转基因及调控组件中的任一者的dna分子)中的任一者转录,其中rna分子包含转基因序列。1.转基因
[0066]
在一些具体实施例中,可根据本发明方法使用的本文所提供的核酸分子中的任一者包含可操作地连接至用于本文所揭示的方法中的调控组件的转基因序列。在一些具体实施例中,本发明组成物及方法的转基因可用于抑制或治疗与神经元疾病(例如,dravet综合征)相关的一或多种症状。
[0067]
所关注的任何转基因可经设计且用于本发明方法中。在一些具体实施例中,与参考核苷酸序列相比,转基因包含经修饰核苷酸序列(例如,替代性密码子)。在一些具体实施例中,转基因可设计以具有某些有益特性,例如,所表现的转基因在与疾病(例如,阿兹海默氏病)治疗上相关的细胞亚群中特异性表现。在一些具体实施例中,转基因为dna核酸分子。在一些具体实施例中,转基因为已自本文所描述的dna核酸分子中的任一者转录的rna核酸分子。
[0068]
在一些具体实施例中,转基因编码治疗蛋白。在一些具体实施例中,治疗蛋白在个体(例如,灵长类动物)中的表现降低罹患疾病或病症(例如,神经疾病或病症)的风险。在一些具体实施例中,转基因编码蛋白质的野生型版本且可投予至表现蛋白质的突变型版本的个体。在一些具体实施例中,转基因编码蛋白质的野生型版本且可投予至个体以便提高蛋白质的野生型版本在个体中的表现量。在一些具体实施例中,转基因编码蛋白质的突变型形式,其中与蛋白质的野生型版本相比,突变型蛋白质与增加的或组成性活性相关。在一些具体实施例中,转基因编码蛋白质的特定同功异构物,其中特定蛋白质同功异构物在个体中的表现与罹患疾病或病症(例如,人类载脂蛋白e2)的风险的降低相关。在一些具体实施例中,将特定蛋白质同功异构物投予至表现相同蛋白质(例如,人类载脂蛋白e4)的有害同功异构物的个体。
[0069]
在一些具体实施例中,转基因包含编码多肽的序列。在一些具体实施例中,转基因包含编码基因编辑多肽的序列。在一些具体实施例中,通过转基因编码的多肽为dna结合蛋白。在一些具体实施例中,dna结合蛋白选自由以下者组成的群:锌指蛋白(zfp)、锌指核酸酶(zfn)及转录活化因子样效应物核酸酶(talen)。在一些具体实施例中,转基因包含密码子优化变体及/或其片段的核苷酸序列。
[0070]
在一些具体实施例中,转基因包含编码引导rna(grna)的序列。在一些具体实施例
中,转基因包含编码可操作地连接至调控组件的grna的序列。在一些具体实施例中,引导rna可与经rna引导的dna结合剂(例如,cas核酸酶)及供体构筑体组合使用。在一些具体实施例中,供体构筑体可与基因编辑系统(例如,crispr/cas系统;zfn系统;talen系统)一起使用。
[0071]
如本文所使用,术语「引导rna」及「grna」在本文中互换使用以为指crrna(亦称为crispr rna)或crrna及trrna(亦称为tracrrna)的组合。crrna及trrna可以单一rna分子(单引导rna,sgrna)或以两个独立rna分子(双引导rna,dgrna)形式缔合。「引导rna」或「grna」为指单引导rna或双引导rna形式两者。trrna可为天然存在的序列或与天然存在的序列相比具有修饰或变化的trrna序列。诸如sgrna或dgrna的引导rna可包括如本文所描述的经修饰rna。
[0072]
在一些具体实施例中,转基因包含编码反义寡核苷酸的序列。在一些具体实施例中,转基因包含编码可操作地连接至调控组件的反义寡核苷酸的序列。在一些具体实施例中,反义寡核苷酸减少目标基因的表现。在一些具体实施例中,转基因编码靶向与cns病症相关的基因的反义寡核苷酸,诸如(例如)电压闸控离子信道或其次单元。电压闸控离子信道包括钠信道、钙信道、钾信道及质子信道。电压闸控钠信道次单元的实施例包括scn1b(nm_001037.4)、scn1a(nm_001165963.1)、scn2b(nm_004588.4)、scn2a、snc8a、kv3.1、kv3.2或kv3.3。在一些具体实施例中,转基因编码靶向scn1a或scn8a的前体mrna的反义寡核苷酸或scn1a的天然反义聚核苷酸。
[0073]
在一些具体实施例中,本技术案提供一种编码靶向或能够上调神经传递素调节剂的反义寡核苷酸的转基因。神经传递素调节剂可涉及调节神经传递素在cns中的产生或释放。举例而言,神经传递素调节剂可辅助突触融合以释放神经传递素。神经传递素调节剂的实施例为stxbp1(nm_001032221.3)。
[0074]
在一些具体实施例中,本技术案提供编码可操作地连接至细胞类型选择性调控组件的反义寡核苷酸的转基因,其中反义寡核苷酸能够上调所关注的基因(诸如电压闸控离子信道或其次单元)的表现或功能。在一些具体实施例中,本技术案提供编码促进具有保留内含子的电压闸控钠信道前体mrna的剪接的反义寡核苷酸的转基因。在另一具体实施例中,本技术案提供编码调节电压闸控钠信道前体mrna的剪接的反义寡核苷酸的转基因。在另一具体实施例中,本技术案提供编码靶向电压闸控钠信道的天然反义聚核苷酸的反义寡核苷酸的转基因。在一些具体实施例中,转基因编码能够上调scn1a的表现或功能的反义寡核苷酸。在一些具体实施例中,转基因编码能够下调scn8a的表现或功能的反义寡核苷酸。
[0075]
在一些具体实施例中,本技术案提供编码反义寡核苷酸的转基因,该反义寡核苷酸促进外显子跳跃、外显子增加(exon inclusion)、保留内含子的移除、或目标基因的有害mrna的根除、降解或去活化、或目标基因的天然反义聚核苷酸的根除、降解或去活化。在一些具体实施例中,目标基因为scn1a或scn8a。可例如在us 2017/0240904、us 9,771,579、wo 2017/106377、us 9,976,143及wo 2017/106382中发现适合与本文揭示的组成物及方法结合使用的各种反义寡核苷酸。
[0076]
如本文所使用,术语「反义寡核苷酸」为指寡核苷酸(例如,rna、dna、模拟物、嵌合体、其类似物或同源物)、核糖核酸酶、外部引导序列(external guide sequence;egs)寡核苷酸、单股或双股rna干扰(rnai)化合物(诸如短干扰rna(sirna)、微干扰rna(mirna)、小时
序rna(strna)、短发夹rna(shrna)、小rna诱导的基因活化(rnaa)、小活化rna(sarna)或小细胞核rna(snrna)(诸如u1或u7snrna))及与目标核酸的至少一部分杂合且调节其功能的其他寡聚化合物。因此,反义寡核苷酸可为dna、rna、dna样、rna样或其混合物,或可为此等中的一或多者的模拟物。反义寡核苷酸可为单股、双股、环状或发夹寡聚化合物且可含有诸如内部或末端凸起、错配或环的结构元素。可通过将两股杂合以形成全部或部分双股寡核苷酸或通过使具有足够自身互补性的单股杂合且形成完全或部分双股寡核苷酸来形成双股反义寡核苷酸。两股可在内部连接,留下游离3'或5'端,或可连接以形成连续发夹结构或环。发夹结构可在5'或3'端含有悬垂物,从而产生具有单股特征的延伸部。双股反义寡核苷酸视情况可在末端包括悬垂物。当仅由一股形成时,dsrna可采取把自身对折以形成双螺旋的自身互补型发夹型分子的形式。因此,dsrna可为完全或部分双股的。基因表现的特异性调节可通过反义rna寡核苷酸在转殖基因细胞系中的稳定表现或经由基因疗法来实现。当由两股形成,或采用把自身对折以形成双螺旋的自身互补型发夹型分子的形式的单股时,两股(或单股的双螺旋形成区域)为以沃森-克里克(watson-crick)方式进行碱基配对的互补rna股。在一些具体实施例中,本文提供的反义寡核苷酸为单股rna寡核苷酸。在某些具体实施例中,单股反义rna经提供作为经修饰huu7snrna分子的部分。
[0077]
在各种具体实施例中,通过如本文所提供的转基因编码的反义寡核苷酸可与目标基因或序列完全或部分互补。在某些具体实施例中,反义寡核苷酸与目标序列的间的同源性、序列一致性或互补性为约40%至约60%。在一些具体实施例中,同源性、序列一致性或互补性为约60%至约70%。在一些具体实施例中,同源性、序列一致性或互补性为约70%至约80%。在一些具体实施例中,同源性、序列一致性或互补性为约80%至约90%。在一些具体实施例中,同源性、序列一致性或互补性为约90%、约92%、约94%、约95%、约96%、约97%、约98%、约99%或约100%。
[0078]
在一些具体实施例中,转基因包含编码rna(rnai)的序列。在一些具体实施例中,转基因包含编码可操作地连接至调控组件的rna的序列。在一些具体实施例中,rnai减少目标基因的表现。在一些具体实施例中,rnai减少选自由以下种类的组合的目标基因的表现:sod1、htt、τ或α-突触核蛋白。如本文所使用,术语「rnai」为指与目标rna具有足够序列互补性以导引rna干扰的rna(或其类似物)。2.调控组件
[0079]
调控组件可在dna及/或rna水平下起作用。调控组件可用以调节所关注的细胞类型的基因表现选择性。调控组件可用以在基因表现的转录阶段、转录后阶段或转译阶段调节基因表现。调控组件包括(但不限于)启动子、强化子、内含子或其他非编码序列。在rna水平下,调节可在转译(例如,使mrna稳定以用于转译的稳定性组件)、rna裂解、rna剪接及/或转录终止的水平下进行。在一些情况下,调控组件可将转录因子募集至增加所关注的细胞类型的基因表现选择性的编码区。在一些情况下,调控组件可增加产生rna转录物的速率,增加所产生rna的稳定性且/或增加自rna转录物进行蛋白质合成的速率。
[0080]
调控组件为能够影响(例如,增加)基因(例如,报导基因,诸如egfp或荧光素酶;转基因;或治疗性基因)在一或多种细胞类型或组织中的表现的核酸序列或基因组件。在一些情况下,调控组件可为转基因、内含子、启动子、强化子、utr、反向末端重复(itr)序列、长末端重复序列(ltr)、稳定性组件、转译后反应组件或polya序列或其组合。在一些情况下,调
控组件为启动子、强化子、内含子序列或其组合。在一些情况下,调控组件衍生自人类序列(例如,hg19)。
[0081]
在一些情况下,本发明的调控组件引起可操作地连接的转基因的较高或增加的表现,其中测定与对照相比较高或增加的表现,例如组成性启动子、cmv启动子、cag、超核心启动子(super core promoter;scp)、ttr启动子、proto 1启动子、ucl-hlp启动子、mincmv、efs或cmve启动子。可用于通过本文所揭示的调控组件测定较高或增加的转基因表现的其他对照组包括单独缓冲液或单独载体。在一些情况下,阳性对照组为指具有已知表现活性的re,诸如seq id no:39,其可用于比较。在一些情况下,调控组件驱动与阳性对照组(例如,seq id no:39或可操作地连接至转基因的已知启动子)相当的类似或较高转基因表现。
[0082]
在某些具体实施例中,载体包含可操作地连接至调控组件的核苷酸序列。在某些具体实施例中,核苷酸序列可操作地连接至具有少于或等于400个碱基对(bp)、300bp、250bp、200bp、150bp、140bp、130bp、120bp、110bp、100bp、70bp或50bp的调控组件。在某些具体实施例中,调控组件为以下者中的任一者或其组合:seq id no:1-29中的任一者、cba、cmv、scp、serpe_ttr、proto1、mincmv、ucl-hlp、cmve、cag或efs。在某些具体实施例中,调控组件为seq id no:31、seq id no:33、cba或mincmv中的任一者或其组合。在某些具体实施例中,调控组件为seq id no:33。在某些具体实施例中,调控组件为cba。在某些具体实施例中,调控组件为mincmv。在某些具体实施例中,本文所揭示的载体包含具有可操作地连接至任何转基因(例如,dna结合蛋白)的seq id no:1-40(如下表5及表6所示)中的任一者的启动子。在某些具体实施例中,调控组件为细胞类型选择性的。在某些具体实施例中,调控组件在神经元细胞中选择性地表现。在某些具体实施例中,调控组件在选自由单极、双极、多极或伪单极神经元组成的群的神经元细胞中选择性地表现。在某些具体实施例中,调控组件在gaba性神经元中选择性地表现。在某些具体实施例中,调控组件在胶细胞中选择性地表现。在某些具体实施例中,胶细胞为以下胶细胞类型中的任一者:星状细胞、寡树突神经胶质细胞、室管膜细胞、许旺细胞或卫星细胞。在某些具体实施例中,调控组件在微神经胶质细胞中选择性地表现。在某些具体实施例中,调控组件在非神经元细胞中选择性地表现。
[0083]
在一些具体实施例中,调控组件衍生自人类调控组件。在一些具体实施例中,将序列视为人类衍生的,其与人类序列具有至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%或100%一致性。在一些情况下,调控组件含有人类衍生序列及非人类衍生序列以使得整个调控组件与人类基因体具有低序列一致性,而调控组件的一部分与人类基因体中的序列具有100%序列一致性(或局部序列一致性)。
[0084]
在某些具体实施例中,本发明提供复数个调控组件,其可操作地连接至任何转基因以增加或改良转基因表现在cns中(例如,在pv神经元中)的选择性。通过使用一或多个本文所揭示的调控组件增加基因表现的选择性,吾人可改善基因疗法的功效、降低产生治疗效果所需的有效剂量、最小化副作用或脱靶效应且/或增加患者安全性及/或耐受性。
[0085]
在一个方面中,一或多个调控组件可操作地连接至表现卡匣中的任何转基因以调节细胞中的基因表现,诸如相对于一或多种非目标细胞类型或组织(例如,非pv cns细胞类型),目标细胞类型或组织(例如,pv细胞)中的转基因的靶向表现。在一些情况下,转基因在目标细胞类型或组织中的靶向表现包括目标细胞类型或组织中的基因表现的增加。
[0086]
在一些情况下,将一或多个调控组件可操作地连接至基因引起基因在cns(诸如小白蛋白(parvalbumin;pv)神经元)中的目标组织或细胞类型中的靶向表现。在一些情况下,一或多个调控组件(例如,seq id no:41-75,或其功能片段或组合,或与其具有至少80%、至少90%、至少95%或至少99%序列一致性的序列)增加cns(诸如pv神经元)中的目标组织或细胞类型中的基因表现的选择性。在一些情况下,基因疗法包含本文所揭示的一或多个调控组件,其中调控组件可操作地连接至转基因且驱动转基因在pv神经元中的选择性表现。
[0087]
在一些情况下,基因在pv神经元中的选择性表现用于治疗与内源基因中的单倍不足及/或基因缺陷相关的疾病或病况,其中基因缺陷可为基因的突变或基因的失调。此类基因缺陷可引起基因产物及/或功能及/或活性受损的基因产物的水平降低。在一些情况下,表现卡匣包含基因、次单元、变体或其功能片段,其中来自表现卡匣的基因表现用于治疗与基因缺陷、功能及/或活性受损及/或内源基因的失调相关的疾病或病况。在一些情况下,疾病或病况为dravet综合征、阿兹海默氏病、癫痫症、神经退化、τ蛋白病变(tauopathy)、神经元过度兴奋及/或癫痫。
[0088]
在一些情况下,本文所揭示的调控组件中的任一者或多者引起小白蛋白细胞中的基因表现的选择性增加。在一些情况下,本文所揭示的调控组件为pv细胞选择性的。在一些情况下,pv细胞选择性调控组件与在pv细胞中的选择性基因表现比在非pv cns细胞类型中的表现更相关。在一些情况下,pv细胞选择性调控组件与非pv cns细胞类型中的减少的基因表现相关。调控组件的非限制性实施例包括seq id no:41-75,如表7中所提供。
[0089]
在某些具体实施例中,载体包含可操作地连接至调控组件的核苷酸序列,其中与可操作地连接至cmv启动子时的转基因表现相比,调控组件使得转基因表现增加至少2倍。在某些具体实施例中,相对于相同类型哺乳动物细胞中来自cmv启动子的相同转基因序列的表现量,启动子序列在哺乳动物细胞中产生大至少5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍或75倍,或至少20-90倍、20-80倍、20-70倍、20-60倍、30-90倍、30-80倍、30-70倍、30-60倍、40-90倍、40-80倍、40-70倍、40-60倍、50-90倍、50-80倍、50-70倍、50-60倍、60-90倍、60-80倍、60-70倍、70-90倍、70-80倍、80-90倍的转基因序列表现。在某些具体实施例中,启动子序列驱动转基因序列在高百分比神经元细胞中的表现,例如至少20%、25%、30%、40%、45%、50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或更高,或至少20-90%、20-80%、20-70%、30-90%、30-80%、30-70%、40-90%、40-80%、40-70%、50-90%、50-80%、50-70%、60-90%、60-80%、60-70%、70-90%、70-80%、80-100%、80-95%、80-90%、90-100%或90-95%的含有表现转基因的载体的gaba性细胞。在某些具体实施例中,启动子序列驱动转基因在高百分比胶细胞中的表现,例如至少20%、25%、30%、40%、45%、50%、55%、60%、65%、70%、75%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或更高,或至少20-90%、20-80%、20-70%、30-90%、30-80%、30-70%、40-90%、40-80%、40-70%、50-90%、50-80%、50-70%、60-90%、60-80%、60-70%、70-90%、70-80%、80-100%、80-95%、80-90%、90-100%或90-95%的含有表现转基因的载体的寡树突神经胶质细胞。
[0090]
在一些方面中,aav表现卡匣包含可操作地连接至至少3kb的转基因的不超过120bp的人类衍生的调控组件,其中与可操作地连接至cmv启动子时的转基因表现相比,调控组件使得转基因表现增加至少2倍。在一些情况下,转基因表现增加至少50倍。在一些情况下,转基因表现增加至少100倍。在一些情况下,增加的转基因表现发生在至少2种不同细胞类型(例如,兴奋性神经元及抑制性神经元)中。在一些情况下,增加的转基因表现发生在至少3种不同细胞类型(例如,兴奋性神经元、抑制性神经元及肝细胞)中。
[0091]
在一些情况下,转基因在细胞或活体内中的此类高表现与无该等调控组件的转基因表现相关,其中与无调控组件的转基因表现相比,或与通过阴性对照组(例如,单独缓冲液、单独载体或包含已知不具有表现活性的序列的载体)的转基因表现相比,具有调控组件的转基因表现为至少1.5倍、至少2倍、至少3倍、至少4倍、至少5倍、至少6倍、至少7倍、至少8倍、至少9倍、至少10倍、至少15倍、至少20倍、至少25倍、至少50倍、至少100倍、至少150倍、至少200倍、至少250倍、至少300倍、至少400倍、至少500倍、至少600倍、至少700倍、至少800倍、至少900倍、至少1000倍、至少1010倍、至少1020倍、至少1030倍、至少1040倍或至少1050倍。
[0092]
在一些情况下,一或多个调控组件引起在至少2种、至少3种、至少4种、至少5种、至少6种、至少7种、至少8种、至少9种或至少10种不同细胞类型中的高转基因表现。在一些情况下,本发明的一或多个调控组件可操作地连接至转基因以用于适合于全身投予的基因疗法治疗。在一些情况下,本发明的一或多个调控组件可操作地连接至转基因以用于适合于向中枢神经系统投予的基因疗法治疗。在一些情况下,本发明的一或多个调控组件可操作地连接至转基因以用于适合于向脑脊髓液投予的基因疗法治疗。在一些情况下,本发明的一或多个调控组件可操作地连接至转基因以用于适合于在神经元或神经胶质中表现的基因疗法治疗。d.载体
[0093]
在一些具体实施例中,本发明提供包含本文所揭示的核酸分子中的任一者的载体(例如,本文所揭示的载体中的任一者)。在一些具体实施例中,载体为病毒载体(例如,腺相关病毒载体)。在一些具体实施例中,载体为病毒颗粒。在一些具体实施例中,载体为非病毒载体。在一些具体实施例中,本文所揭示的方法中的任一者可用于向个体(例如,灵长类动物)投予本文所揭示的载体中的任一者。
[0094]
在一些具体实施例中,使用所属技术领域中可用的各种已知及适合方法,试管内或活体内将本文所描述的核酸分子提供(或递送)给细胞或组织。在一些具体实施例中,使用本文所描述的方法,试管内或活体内将本文所描述的核酸分子提供(或递送)给细胞或组织。常规的基于病毒及非病毒的基因递送方法可用于将本文所揭示的核酸分子引入至细胞(例如,神经元细胞)及目标组织中。非病毒表现载体系统包括核酸载体诸如(例如)直链寡核苷酸及环状质体;人造染色体,诸如人类人造染色体(human artificial chromosomes;hac)、酵母人造染色体(yeast artificial chromosomes;yac)及细菌人造染色体(bac或pac);游离型载体;转位子(例如,piggybac);及黏接质体。病毒载体递送系统包括dna及rna病毒,诸如(例如)逆转录病毒载体、慢病毒载体、腺病毒载体及腺相关病毒载体。将本文所描述的核酸分子并入至非病毒及病毒表现系统中的任一者中的方法已为所属技术领域中具通常知识者所已知。
[0095]
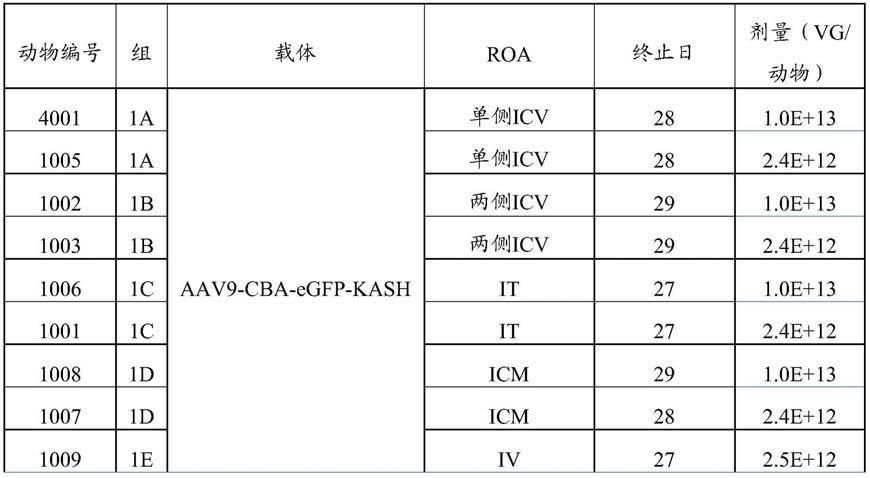
用于核酸的非病毒递送的方法及组成物为所属技术领域已知的,包括物理及化学方法。物理方法通常为指在促进基因物质的胞内递送中采用物理力来抵消细胞膜障壁的递送方法。物理方法的实施例包括使用针、弹道dna、电穿孔、声致穿孔(sonoporation)、光致穿孔(photoporation)、磁转染及水穿孔(hydroporation)。化学方法通常为指其中化学载剂将核酸分子递送至细胞的方法且可包括无机颗粒、基于脂质的载剂、基于聚合物的载剂及基于肽的载剂。
[0096]
在一些具体实施例中,使用无机颗粒向目标细胞投予非病毒表现载体。无机颗粒可指奈米颗粒,诸如经工程改造得到各种大小、形状及/或孔隙率以自网状内皮系统逸出或保护经包覆分子免于降解的奈米颗粒。无机奈米颗粒可由金属(例如,铁、金及银)、无机盐或陶瓷(例如,钙、镁或硅的磷酸盐或碳酸盐)来制备。此等奈米颗粒的表面可经涂布以促进dna结合或靶向基因递送。亦可使用磁性奈米颗粒(例如,超磁性氧化铁)、富勒烯(fullerene)(例如,可溶性碳分子)、碳奈米管(例如,圆柱形富勒烯)、量子点及超分子系统。
[0097]
在一些具体实施例中,使用阳离子脂质(例如,阳离子脂质体)向目标细胞投予非病毒表现载体。已研究各种类型的脂质的基因递送,诸如(例如)脂质奈米乳液(例如,其为通过乳化剂稳定的一种不可混溶液体于另一种液体中的分散液)或固体脂质奈米颗粒。在一些具体实施例中,可使用脂质奈米颗粒(lipid nanoparticles;lnp)递送非病毒表现载体。在一些具体实施例中,lnp包含阳离子脂质。在一些具体实施例中,lnp包含十八-9,12-二烯酸(9z,12z)-3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙酯(亦称为(9z,12z)-十八-9,12-二烯酸3-((4,4-双(辛氧基)丁酰基)氧基)-2-((((3-(二乙氨基)丙氧基)羰基)氧基)甲基)丙酯)或另一可离子化脂质。参见例如wo2017/173054、wo2015/095340及wo2014/136086以及其中所提供的参考文献的脂质。
[0098]
在一些具体实施例中,使用基于肽的递送媒剂向目标细胞投予非病毒表现载体。基于肽的递送媒剂可具有保护待递送的基因物质、靶向特定细胞受体、破坏核内体膜及将遗传物质递送至细胞核中的优点。在一些具体实施例中,使用基于聚合物的递送媒剂向目标细胞投予非病毒表现载体。基于聚合物的递送媒剂可包含天然蛋白、肽及/或多醣或合成聚合物。在一个具体实施例中,基于聚合物的递送媒剂包含聚乙烯亚胺(pei)。pei可将dna缩合至带正电颗粒中,该等带正电颗粒结合至阴离子细胞表面残基且经由胞吞作用携带至细胞中。在其他具体实施例中,基于聚合物的递送媒剂可包含聚-l-离氨酸(pll)、聚(dl-乳酸)(pla)、聚(dl-丙交酯-共-糖苷)(plga)、聚鸟氨酸、聚精氨酸、组蛋白、鱼精蛋白、树枝状聚合物、聚葡萄胺糖、聚葡萄糖的合成氨基衍生物及/或阳离子丙烯酸聚合物。在某些具体实施例中,基于聚合物的递送媒剂可包含聚合物的混合物,诸如(例如)peg及pll。
[0099]
在一些具体实施例中,本文中所揭示的核酸分子中的任一者可使用任何已知的适合病毒载体进行递送,该病毒载体包括例如:逆转录病毒(例如,a型、b型、c型及d型病毒);腺病毒;小病毒(例如,腺相关病毒或aav);冠状病毒;负股rna病毒,诸如正黏病毒(例如,流感病毒);杆状病毒(例如,狂犬病及水泡性口炎病毒);副黏病毒(例如,麻疹及仙台病毒(sendai));正股rna病毒,诸如小核糖核酸病毒及α病毒;及双股dna病毒,包括腺病毒、疱疹病毒(例如,1型及2型单纯疱疹病毒(herpes simplex virus)、埃-巴二氏病毒(epstein-barr virus)、巨细胞病毒);及痘病毒(例如,牛痘、禽痘及金丝雀痘)。逆转录病毒的实施例
包括禽类白血病肉瘤病毒、1型人类t-淋巴病毒(human t-lymphotrophic virus type 1;htlv-1)、牛白血病病毒(bovine leukemia virus;blv)、慢病毒及泡沫病毒属。其他病毒包括例如诺沃克病毒(norwalk virus)、披衣病毒(togavirus)、黄病毒、呼肠孤病毒(reoviruses)、乳多泡病毒(papovavirus)、嗜肝dna病毒及肝炎病毒。病毒载体可根据其整合至宿主基因体中的能力而分为两个组-整合及非整合。致癌逆转录病毒及慢病毒可整合至宿主细胞染色体中,而腺病毒、腺相关病毒及疱疹病毒主要以染色体外游离基因体形式保持于细胞核中。
[0100]
在一些具体实施例中,适合病毒载体为逆转录病毒载体。逆转录病毒为指逆转录病毒科的病毒。逆转录病毒的实施例包括致癌逆转录病毒,诸如鼠类白血病病毒(murine leukemia virus;mlv),及慢病毒,诸如人类免疫缺陷病毒1(human immunodeficiency virus 1;hiv-1)。逆转录病毒基因体为单股(ss)rna且包含可以顺式或反式提供的各种基因。举例而言,逆转录病毒基因体可含有顺式作用序列,诸如两个长末端重复序列(ltr),具有用于基因表现、逆转录及整合至宿主染色体中的组件。其他组分包括封装信号(psi或ψ),以供用于将特定rna封装至新形成的病毒颗粒及聚嘌呤管道(ppt)(在逆转录期间起始正股dna合成的位点)中。另外,在一些具体实施例中,逆转录病毒基因体可包含gag、pol及env基因。gag基因编码结构蛋白,pol基因编码伴随ssrna且进行将病毒rna逆转录为dna的酶,且env基因编码病毒包膜。一般而言,gag、pol及env以反式提供以用于病毒复制及封装。
[0101]
在一些具体实施例中,本文所提供的逆转录病毒载体可为慢病毒载体。识别慢病毒的至少五个血清组或血清型。不同血清型的病毒可不同地感染某些细胞类型及/或宿主。举例而言,慢病毒包括灵长类逆转录病毒及非灵长类逆转录病毒。灵长类逆转录病毒包括hiv及猿猴免疫缺陷病毒(simian immunodeficiency virus;siv)。非灵长类逆转录病毒包括猫类免疫缺陷病毒(feline immunodeficiency virus;fiv)、牛免疫缺陷病毒(bovine immunodeficiency virus;biv)、山羊关节炎-脑炎病毒(caprine arthritis-encephalitis virus;caev)、马传染性贫血病毒(equine infectious anemia virus;eiav)及维思纳病毒(visnavirus)。慢病毒或慢病毒载体可能够转导静止细胞。如同致癌逆转录病毒载体,慢病毒载体的设计可基于顺式作用及反式作用序列的分离。
[0102]
在一些具体实施例中,本发明提供经设计以用于通过优化治疗性逆转录病毒载体递送的表现载体。逆转录病毒载体可为包含以下者中的任一者或多者的慢病毒:左(5')ltr;有助于病毒封装及/或核导入的序列;启动子;视情况选用的一或多个额外调控组件(诸如(例如)强化子或polya序列);视情况选用的慢病毒反向反应组件(rre);视情况选用的绝缘子;及右(3')逆转录病毒ltr。
[0103]
在一些具体实施例中,本文所提供的病毒载体为腺相关病毒(aav)。aav为感染人类及一些其他灵长类物种的小型、复制缺乏型、无包膜动物病毒。尚未知晓aav引起人类疾病且诱导轻度免疫反应。aav载体亦可在不整合至宿主细胞基因体中的情况下感染分裂细胞及静止细胞两者。
[0104]
aav基因体天然地由长度为约4.7kb的直链单股dna组成。基因体由通过长度为约145bp的反向末端重复(itr)序列侧接的两个开放阅读框架(open reading frames;orf)组成。itr由5'端处的核苷酸序列(5'itr)及位于3'端处的含有回文序列的核苷酸序列(3'itr)组成。itr通过互补碱基配对折叠以形成t形发夹结构而以顺式起作用,该互补碱基配
对在第二股合成的起始dna复制期间充当引子。两个开放阅读框架编码参与病毒粒子的复制及封装的rep及cap基因。在一些具体实施例中,本文所提供的aav载体不含有rep或cap基因。此类基因可以反式提供用于产生病毒粒子,如下文进一步描述。
[0105]
在一些具体实施例中,aav载体可包括填充核酸。在一些具体实施例中,填充核酸可编码绿色荧光蛋白或提供对诸如康霉素(kanamycin)或安比西林(ampicillin)的抗生素具有抗性的抗生素抗性基因。在某些具体实施例中,填充核酸可位于itr序列的外部(例如,相比于转基因序列及调控序列,其位于5'itr序列与3'itr序列之间)。
[0106]
在一些具体实施例中,aav载体为以下者中的任一者:aav1、aav2、aav3、aav3b、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、aav12、aav13、aav-dj、aav-dj8、aav-dj9或嵌合、杂合或变体aav。aav亦可为自身互补型aav(scaav)。此等血清型不同之处在于其趋向性或其所感染的细胞类型。在一些具体实施例中,aav载体包含来自多个血清型(例如,假型)的基因体及衣壳。举例而言,aav可包含封装于血清型5或血清型9的衣壳中的血清型2的基因体(例如,itr)。假型可提高转导效率以及改变趋向性。在一些具体实施例中,aav为aav9血清型。在某些具体实施例中,经设计以用于通过aav递送的表现载体包含5'itr及3'itr。
[0107]
在一些具体实施例中,aav血清型6或aav血清型9的itr可用于本文所揭示的aav载体中的任一者中。然而,可选择来自其他适合血清型的itr。本发明的aav载体可由各种腺相关病毒产生。可通过将一种血清型的重组基因体封装至衍生自另一aav血清型的衣壳中来改变载体的趋向性。在一些具体实施例中,raav病毒的itr可基于aav1-12中的任一者的itr且可与选自以下者中的任一者的aav衣壳合并:aav1-12、aav-dj、aav-dj8、aav-dj9或其他经修饰血清型。在特定具体实施例中,基于待用aav载体靶向的细胞或组织来选择aav itr及/或衣壳。
[0108]
在一些具体实施例中,本发明提供一种载体,其包含本文所揭示的核酸中的任一者,其中载体为aav载体或aav病毒颗粒,或病毒粒子。在一些具体实施例中,aav载体或aav病毒颗粒,或病毒粒子可用于递送本文所揭示的核酸分子中的任一者,该等核酸分子包含可操作地连接至本文所揭示的转基因中的任一者的本文所揭示的调控组件中的任一者,无论在活体内、活体外或试管内。在一些具体实施例中,此aav载体为复制缺陷性的。在一些具体实施例中,aav病毒经工程改造或经遗传修饰以使得其可仅在辅助因子的存在下复制且产生病毒粒子。
[0109]
在一些具体实施例中,经设计以用于通过aav递送的表现载体包含5'itr;启动子;核酸分子,其包含可操作地连接至转基因(例如,编码smna1的转基因)的调控组件;及3'itr。在一些具体实施例中,经设计以用于通过aav递送的表现载体包含:5'itr;强化子;启动子;核酸分子,其包含可操作地连接至转基因(例如,编码smna1的转基因)的调控组件;polya序列;及3'itr。
[0110]
在一些具体实施例中,本发明提供一种包含本文所揭示的核酸中的任一者的病毒载体。术语「病毒颗粒(viral particle)」及「病毒粒子(virion)」在本文可互换使用且为关于感染性及典型地复制缺陷性的病毒颗粒,其包含封装于衣壳内的病毒基因体(例如,病毒表现载体),且视具体情况,例如对于逆转录病毒,可为衣壳周围的脂质包膜。「衣壳」为指封装病毒基因体的结构。衣壳由数种由蛋白质制成的寡聚结构次单元组成。举例而言,aav具
有通过以下三种衣壳蛋白的相互作用形成的二十面体衣壳:vp1、vp2及vp3。在一些具体实施例中,本文所提供的病毒粒子为通过封装aav载体所获得的重组aav病毒粒子,如本文所描述,该aav载体包含可操作地连接至蛋白质外壳中的转基因及条形码序列的候选调控组件。
[0111]
在一些具体实施例中,本文所提供的重组aav病毒粒子可通过衣壳化衍生自病毒颗粒中的特定aav血清型的aav基因体制备,该病毒颗粒由与相同特定血清型的aav对应的天然cap蛋白质形成。在其他具体实施例中,本文所提供的aav病毒颗粒包含病毒载体,该病毒载体包含封装至来自不同血清型的蛋白质中的给定aav血清型的itr。参见例如bunning h等人,j gene med 2008;10:717-733。举例而言,具有来自给定aav血清型的itr的病毒载体可封装至以下中:a)由衍生自相同或不同aav血清型的衣壳蛋白构成的病毒颗粒(例如,aav2itr及aav9衣壳蛋白;aav2itr及aav8衣壳蛋白;等);b)由来自不同aav血清型或突变体的衣壳蛋白的混合物构成的嵌合体病毒颗粒(例如,aav2itr与aav1及aav9衣壳蛋白);c)由已通过不同aav血清型或变体之间的结构域交换截短的衣壳蛋白构成的嵌合病毒颗粒(例如aav2itr与具有aav9结构域的aav8衣壳蛋白);或d)靶向病毒颗粒,其经工程改造以显示选择性结合结构域,使得能够与目标细胞特异性受体进行严格相互作用(例如,aav5itr与通过插入肽配体而基因上截短的aav9衣壳蛋白;或通过将肽配体偶合至衣壳表面而进行非基因修饰的aav9衣壳蛋白)。
[0112]
技术人员应了解,本文所提供的aav病毒粒子可包含任何aav血清型的衣壳蛋白。在一个具体实施例中,病毒颗粒包含来自选自由以下者组成的群的aav血清型的衣壳蛋白:aav1、aav2、aav5、aav6、aav8及aav9。
[0113]
所属技术领域中已知诸多用于生产重组aav(raav)病毒粒子的方法,包括转染、稳定细胞系产生及感染性杂合病毒产生系统,其包括腺病毒-aav杂合体、疱疹病毒-aav杂合体(conway,j e等人,(1997)j.virology 71(11):8780-8789)及杆状病毒-aav杂合体。在一些具体实施例中,用于生产raav病毒粒子的raav生产培养物包含:1)在杆状病毒生产系统的情况下的适合宿主细胞,包括例如人类衍生细胞系,诸如hela、a549或293细胞,或昆虫衍生的细胞系,诸如sf-9;2)适合辅助病毒功能,由野生型或突变型腺病毒(诸如温度敏感性腺病毒)、疱疹病毒、杆状病毒或提供辅助功能的质体构筑体提供;3)aav rep及cap基因及基因产物;4)核酸分子,其包含可操作地连接至转基因(例如,编码可操作地连接至如本文所描述的报导基因序列的核结合域的核苷酸序列)的候选调控组件,其由aav itr序列侧接;其中核酸分子包含一或多个条形码序列;及5)用于支持raav生产的适合培养基及培养基组分。
[0114]
在一些具体实施例中,生产细胞系为经提供rep及cap蛋白质的杆状病毒表现载体感染的昆虫细胞系(典型地为sf9细胞)。此系统不需要腺病毒辅助基因(ayuso e等人,curr.gene ther.2010,10:423-436)。
[0115]
如本文所使用,术语「cap蛋白」为指具有天然aav cap蛋白(例如,vp1、vp2、vp3)的至少一种功能活性的多肽。cap蛋白的功能活性的实施例包括诱导衣壳的形成、促进单股dna的积聚、促进aav dna封装至衣壳中(亦即衣壳化)、结合至细胞受体及促进病毒粒子进入宿主细胞中的能力。原则上,任何cap蛋白可用于本发明的上下文中。
[0116]
已报导cap蛋白对宿主趋向性、细胞、组织或器官特异性、受体使用、感染效率及
aav病毒的免疫原性具有影响。因此,可考虑到例如个体的物种(例如,人类或非人类)、个体的免疫状态、个体对长期或短期治疗的适合性或特定治疗性应用(例如,治疗特定疾病或病症,或递送至特定细胞、组织或器官)来选择用于raav中的aav cap。在某些具体实施例中,cap蛋白衍生自由aav1、aav2、aav5、aav6、aav8及aav9血清型组成的群的aav。
[0117]
在一些具体实施例中,可通过前述aav cap中的一者或其编码核酸的突变诱发(亦即,通过插入、缺失或取代)来产生用于本文所提供的方法中的aav cap。在一些具体实施例中,aav cap与前述aav cap中的一或多者具有至少70%、75%、80%、85%、90%、95%、98%或99%或更大相似性。
[0118]
在一些具体实施例中,aav cap为嵌合的,包含来自两个、三个、四个或更多个前述aav cap的结构域。在一些具体实施例中,aav cap为源自两种或三种不同aav或重组aav的vp1、vp2及vp3单体的嵌合体。在一些具体实施例中,raav组成物包含超过一个前述cap。
[0119]
在一些具体实施例中,用于raav病毒粒子的aav cap经工程改造以含有异源序列或其他修饰。举例而言,赋予选择性靶向或免疫逃避的肽或蛋白质序列可工程改造为cap蛋白。可替代地或另外,cap可经化学修饰以使得raav的表面聚乙烯羟乙酸化(亦即,聚乙二醇化),其可促进免疫逃避。cap蛋白亦可经突变诱发(例如,以移除其天然受体结合,或掩蔽免疫原性抗原决定基)。
[0120]
如本文所使用,术语「rep蛋白」为指具有天然aav rep蛋白(例如,rep 40、52、68、78)的至少一种功能活性的多肽。rep蛋白的功能活性的实施例包括与蛋白质的生理功能相关的任何活性,包括经由识别促进dna复制、dna复制的aav来源的结合及切口以及dna解螺旋酶活性。额外的功能包括调节自aav(或其他异源)启动子的转录且将aav dna定点整合至宿主染色体中。在一些具体实施例中,aav rep基因可来自血清型aav1、aav2、aav4、aav5、aav6、aav7、aav8、aav9、aav10或aavrh10。
[0121]
在一些具体实施例中,可通过前述aav rep中的一者或其编码核酸的突变诱发(亦即,通过插入、缺失或取代)来产生用于本发明方法中的aav rep蛋白。在一些具体实施例中,aav rep与前述aav rep中的一或多者具有至少70%、75%、80%、85%、90%、95%、98%或99%或更大相似性。
[0122]
如本文所使用,表述「辅助功能」或「辅助基因」为指aav进行复制所依赖的病毒蛋白质。辅助功能包括aav复制所需的彼等蛋白质,包括(但不限于)参与aav基因转录活化、阶段特异性aav mrna剪接、aav dna复制、cap表现产物合成及aav衣壳装配的彼等蛋白质。基于病毒的辅助功能可衍生自已知辅助病毒中的任一者,诸如腺病毒、疱疹病毒(除1型单纯疱疹病毒以外)及痘疮病毒。辅助功能包括(但不限于):腺病毒e1、e2a、va及e4或疱疹病毒ul5、ulb、ul52及ul29,及疱疹病毒聚合酶。在一优选具体实施例中,aav进行复制所依赖的蛋白质衍生自腺病毒。
[0123]
在一些具体实施例中,可通过前述病毒蛋白中的一者或其编码核酸的突变诱发(亦即,通过插入、缺失或取代)来产生用于本发明方法中的aav进行复制所依赖的病毒蛋白。在一些具体实施例中,病毒蛋白与前述病毒蛋白中的一或多者具有至少70%、75%、80%、85%、90%、95%、98%或99%或更大相似性。
[0124]
分析aav进行复制所依赖的cap蛋白、rep蛋白及病毒蛋白的功能的方法为所属技术领域中众所熟知的。
[0125]
在一些具体实施例中,病毒表现载体可与向目标细胞投予的脂质递送媒剂(例如,如本文所描述的阳离子脂质体或lnp)相关联。
[0126]
含有本文所描述或所属技术领域已知的核酸分子的各种递送系统可投予至生物体以供活体内递送至细胞或活体外投予至细胞或细胞培养物。投予为通过常用于引入分子以最终与血液、流体或细胞接触的途径中的任一者来进行,该等途径包括(但不限于)注射、输注、局部施用及电穿孔。投予此类核酸的适合方法为可获得的且为所属技术领域中具通常知识者已知。
[0127]
可活体内或活体外递送核酸分子以靶向各种细胞及/或组织。在一些具体实施例中,递送可靶向各种器官/组织及对应细胞,例如靶向脑、心脏、骨胳肌肉、肝脏、肾脏、脾或胃。在一些具体实施例中,将核酸分子递送至神经元细胞或胶细胞中的一者或两者。在一些具体实施例中,递送可靶向患病细胞,诸如(例如)肿瘤或癌症细胞。在一些具体实施例中,递送可靶向干细胞、血细胞或免疫细胞。
[0128]
在一些具体实施例中,本发明提供一种本文所揭示的载体中的任一者或本文所揭示的核酸中的任一者的混合物。在一些具体实施例中,混合物或核酸分子包含约10、约50、约100、约250、约500、约750、约1000、约1250、约1500、约1750、约2000、约2500、约3000、约3500、约4000、约4500、约5000、约5500、约6000、约6500、约7000、约7500、约8000、约8500、约9000、约9500、约10000个或更多个不同的调控组件。e.药物组成物
[0129]
在某些具体实施例中,本发明提供包含本文所揭示的核酸构筑体、表现载体、病毒载体或病毒颗粒中的任一者的组成物。在一些具体实施例中,本发明提供包含病毒载体或病毒颗粒的组成物,该病毒载体或病毒颗粒包含可操作地连接至调控组件的核苷酸序列。在特定具体实施例中,此类组成物适合于基因疗法应用。药物组成物优选在制造及储存条件下为无菌且稳定的。无菌溶液可例如通过经由无菌过滤膜过滤来实现。
[0130]
药物组成物中的可接受载剂及赋形剂优选在所用剂量及浓度下对接受者无毒。可接受载剂及赋形剂可包括缓冲液,诸如磷酸盐、柠檬酸盐、hepes及tae;抗氧化剂,诸如抗坏血酸及甲硫氨酸;防腐剂,诸如氯化六羟季铵、十八烷基二甲基苯甲基氯化铵、间苯二酚及苯扎氯铵;蛋白质,诸如人类血清白蛋白、明胶、聚葡萄糖及免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯啶酮;氨基酸,诸如甘氨酸、麸酰胺酸、组氨酸及离氨酸;及碳水化合物,诸如葡萄糖、甘露糖、蔗糖及山梨醇。本发明的药物组成物可以可注射调配物形式非经肠投予。注射用药物组成物可使用无菌溶液或任何药学上可接受的液体作为媒剂来调配。药学上可接受的媒剂包括(但不限于)无菌水及生理盐水。
[0131]
本发明的药物组成物可在微胶囊,诸如羟甲基纤维素或明胶-微胶囊及聚甲基丙烯酸甲酯微胶囊中制备。本发明的药物组成物亦可在其他药物递送系统,诸如脂质体、白蛋白微球体、微乳液、奈米粒子及奈米胶囊中制备。用于基因疗法的药物组成物可在可接受的稀释剂中,或可包含其中嵌入有基因递送媒剂的缓慢释放基质。
[0132]
本文所提供的药物组成物可经调配以用于非经肠投予、皮下投予、静脉内投予、全身性投予、肌内投予、动脉内投予、实质内投予、鞘内投予、鞘内脑池投予(亦称为大池内投予)、鞘内腰椎投予、脑室内投予或腹膜内投予。在一特定具体实施例中,药物组成物经调配以用于脑室内投予。在一个具体实施例中,药物组成物经调配以用于鞘内投予。在一个具体
实施例中,药物组成物经调配以用于鞘内脑池投予。在一个具体实施例中,药物组成物经调配以用于鞘内腰椎投予。在一个具体实施例中,药物组成物经调配以用于静脉内投予。在一个具体实施例中,药物组成物经调配以用于全身性投予。
[0133]
药物组成物可经调配以用于以下或经由以下投予:经鼻、喷雾、经口、气溶胶、经直肠或经阴道投予。组织目标可为特异性的,例如中枢神经系统,或其可为若干组织,例如中枢神经系统及肝脏组织的组合。例示性组织或其他目标可包括肝脏、骨胳肌、心肌、脂肪沈积物、肾脏、肺、血管内皮、上皮、造血细胞、神经元细胞、胶细胞、中枢神经系统及/或csf。在一特定具体实施例中,将本文所提供的药物组成物向csf投予,亦即通过脑室内注射、鞘内脑池注射或鞘内腰椎注射。此等方法中的一或多者可用于投予本发明的药物组成物。
[0134]
在某些具体实施例中,本文所提供的药物组成物包含「有效量」或「治疗有效量」。如本文所使用,此类量为指实现所需治疗性结果所需要的有效量、剂量及时间段。
[0135]
本发明的药物组成物的剂量视包括投予途径、待治疗的疾病及个体的身体特征(例如,年龄、体重、一般健康)的因素而定。可调节剂量以提供最佳治疗反应。典型地,剂量可为在不诱导显著毒性的情况下有效治疗疾病的量。在一个具体实施例中,本文所提供的aav载体可以5
×
1010至1
×
1014gc/kg(每千克患者体重的基因体复本(gc/kg))的范围内的量或剂量投予至患者以用于治疗神经元疾病(包括例如dravet综合征)。在一更特定具体实施例中,aav载体以包含于以下范围内的量投予:约5
×
1010gc/kg至约1
×
1013gc/kg、或约1
×
1011至约1
×
1015gc/kg、或约1
×
1011至约1
×
1014gc/kg、或约1
×
1011至约1
×
1013gc/kg、或约1
×
1011至约1
×
1012gc/kg、或约1
×
1012至约1
×
1014gc/kg、或约1
×
1012至约1
×
1013gc/kg、或约5
×
1011gc/kg、1
×
1012gc/kg、1.5
×
1012gc/kg、2.0
×
1012gc/kg、2.5
×
1012gc/kg、3
×
1012gc/kg、3.5
×
1012gc/kg、4
×
1012gc/kg、4.5
×
1012gc/kg、5
×
1012gc/kg、5.5
×
1012gc/kg、6
×
1012gc/kg、6.5
×
1012gc/kg、7
×
1012gc/kg、7.5
×
1012gc/kg、8
×
1012gc/kg、8.5
×
1012gc/kg、9
×
1012gc/kg、9.5
×
1012gc/kg、1
×
1013gc/kg、1.5
×
1013gc/kg、2.0
×
1013gc/kg、2.5
×
1013gc/kg、3
×
1013gc/kg、3.5
×
1013gc/kg、4
×
1013gc/kg、4.5
×
1013gc/kg、5
×
1013gc/kg、5.5
×
1013gc/kg、6
×
1013gc/kg、6.5
×
1013gc/kg、7
×
1013gc/kg、7.5
×
1013gc/kg、8
×
1013gc/kg、8.5
×
1013gc/kg、9
×
1013gc/kg或9.5
×
1013gc/kg。gc/kg可例如通过qpcr或数字液滴pcr(digital droplet pcr;ddpcr)测定(参见例如m.lock等人,hum gene ther methods.2014年4月;25(2):115-25)。在另一具体实施例中,本文所提供的aav载体可以1
×
109至1
×
1011iu/kg(载体的感染性单元(iu)/个体或患者的体重(kg))的范围内的量或剂量投予至患者以用于治疗神经元疾病(包括例如dravet综合征)。在某些具体实施例中,药物组成物可以所需单位剂量形成。此类单一剂量单位可含有约1
×
109gc至约1
×
1015gc。
[0136]
本发明的药物组成物可例如每天、每周、每月、每半年、每年或按医疗需要向对其有需要的个体投予一或多次(例如,1-10次或更多次)。在一例示性具体实施例中,单次投予为足够的。在一个具体实施例中,药物组成物适用于人类个体中且通过脑室内投予进行投予。在一个具体实施例中,药物组成物适用于人类个体中且通过脑室内投予、静脉内投予、鞘内投予、实质内投予或其组合进行投予。在一个具体实施例中,药物组成物为通过快速注射经由周边静脉递送。在其他具体实施例中,药物组成物为通过历经约10分钟(
±
5分钟)、历经约20分钟(
±
5分钟)、历经约30分钟(
±
5分钟)、历经约60分钟(
±
5分钟)或历经约90分
钟(
±
10分钟)的输注而经由周边静脉递送。在一个具体实施例中,药物组成物通过快速注射递送至csf。在其他具体实施例中,药物组成物为通过历经约10分钟(
±
5分钟)、历经约20分钟(
±
5分钟)、历经约30分钟(
±
5分钟)、历经约60分钟(
±
5分钟)或历经约90分钟(
±
10分钟)的输注而递送至csf。
[0137]
在另一方面中,本发明进一步提供一种套组,其包含在一或多种容器中的如本文所描述的核酸构筑体、病毒载体、病毒颗粒或药物组成物。套组可包括描述如何向患者投予套组内所含的核酸分子、载体或病毒粒子的说明书或封装材料。套组的容器可为任何适合材料,例如玻璃、塑料、金属等,且具有任何适合大小、形状或组态。在某些具体实施例中,套组可包括一或多种含有呈适合液体或溶液形式的核酸构筑体、病毒载体、病毒颗粒或药物组成物的安瓿或注射器。f.投予方法
[0138]
在一些具体实施例中,本发明提供经由本文所揭示的投予途径中的任一者向对其有需要的个体(例如,灵长类动物)投予本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者的方法。在一些具体实施例中,方法包含经由脑室内投予来投予本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者。在一些具体实施例中,方法包含经由静脉内投予来投予本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者。在一些具体实施例中,方法包含经由鞘内投予来投予本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者。在一些具体实施例中,方法包含经由实质内投予来投予本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者。在下文更详细地论述投予本文所揭示的载体中的任一者的方法。此等方法亦可用于投予本文所揭示的核酸构筑体、病毒颗粒及/或药物组成物中的任一者。
[0139]
本发明涵盖向灵长类动物(例如,人类)投予载体的方法,其包含脑室内(icv)投予载体。本文亦描述用于表现所关注基因或其生物活性变体及/或片段的组成物及方法,其包含向灵长类动物投予治疗有效量的编码所关注基因的腺相关病毒1(aav1)载体或腺相关病毒5(aav5)载体,其中投予途径选自由以下者组成的群:静脉内投予、鞘内投予、脑室内投予、实质内投予或其组合。此外,本文描述在有需要的灵长类动物中抑制或治疗与神经元疾病相关的一或多种症状的组成物及方法,其包含向灵长类动物投予选自由aav1或aav5组成的群的aav,其中投予途径选自由以下者组成的群:静脉内投予、鞘内投予、脑室内投予、实质内投予或其组合。
[0140]
在一些具体实施例中,本发明提供经由鞘内投予或脑室内投予向个体(例如,灵长类动物)投予本文所揭示的载体中的任一者的方法。在鞘内投予的情况下,将本发明的载体递送至其中的鞘内空间为位于脊髓周围且充满脑脊髓液的空间。此空间由由蛛网膜材料及硬脑膜组成的双层膜包围。鞘内空间为蛛网膜材料下方的空间,即双层膜的内层,且因此,鞘内投予意为投予至蛛网膜下空间中。脑周围的空间及脊髓周围的空间皆充满csf,且脑中的大脑脑室亦充满csf。大脑脑室、大脑周围空间及鞘内空间连接以形成一个连续空间,csf在其中循环。因此,涵盖脑室内投予及鞘内投予作为向csf投予本文所揭示的载体中的任一者的方法。
[0141]
在一些具体实施例中,本发明提供向个体(例如,灵长类动物)投予本文所揭示的载体中的任一者的方法。在一些具体实施例中,将载体递送至cns。在一些具体实施例中,将
载体递送至脑脊髓液。在一些具体实施例中,将载体投予至脑实质。在一些具体实施例中,通过脑室内投予将载体递送至灵长类动物。在一些具体实施例中,通过静脉内投予将载体递送至个体(例如,灵长类动物)。在一些具体实施例中,通过鞘内投予(例如鞘内脑池或鞘内腰椎投予,)将载体递送至个体(例如,灵长类动物)。在一些具体实施例中,将载体递送至蛛网膜下池,例如大池。在一些具体实施例中,将载体递送至围绕脊神经的腰椎蛛网膜下空间中。在一些具体实施例中,通过实质内投予将载体递送至个体(例如,灵长类动物)。可通过实质内投予、鞘内投予或脑室内投予来实现本文所描述的载体在中枢神经系统内的广泛分布。
[0142]
在一些具体实施例中,将本文所揭示的载体中的任一者与造影剂(例如,钆或钆特醇(gadoteridol))组合投予至个体(例如,灵长类动物)。在其他具体实施例中,载体不与造影剂(例如,钆或钆特醇)组合投予。
[0143]
在一些具体实施例中,经由脑室内(icv)投予将本文所揭示的载体中的任一者投予至脑室中的任一者或多者。在一些具体实施例中,经由icv单侧投予将载体投予至一个脑室中,例如投予至左侧脑室或右侧脑室中。在一些具体实施例中,经由icv单侧投予将载体投予至左侧脑室中。在一些具体实施例中,经由icv单侧投予将载体投予至右侧脑室中。在一些具体实施例中,经由icv两侧投予将载体例如投予至左侧脑室及右侧脑室中。在一些具体实施例中,经由icv投予将载体投予至一个脑室,例如仅投予至左脑室中。在一些具体实施例中,经由icv投予将载体仅投予至左侧脑室。在一些具体实施例中,经由icv投予将载体仅投予至右侧脑室。在一些具体实施例中,经由icv投予将载体仅投予至第三脑室。在一些具体实施例中,经由icv投予将载体仅投予至第四脑室。在一些具体实施例中,经由icv投予将载体投予至超过一个脑室,例如投予至左脑室、右脑室及第三脑室中。在一些具体实施例中,经由icv同时投予将载体例如在同一时间点投予至左脑室及右脑室中。在一些具体实施例中,经由icv连续投予将载体例如在不同时间点处投予至左脑室及右脑室中。在一些具体实施例中,经由icv投予相隔至少24小时来投予各剂的载体。
[0144]
在一些具体实施例中,本发明提供一种向灵长类动物投予载体的方法,其包含向灵长类动物脑室内(icv)投予载体,其中载体包含转基因,且其中与通过任何其他投予途径投予载体时的转基因表现相比,icv投予使得中枢神经系统(cns)中的转基因表现增加至少1.25倍。在某些具体实施例中,与通过任何其他投予途径投予载体时的转基因表现相比,icv投予在中枢神经系统(cns)中产生大至少1.5倍、1.75倍、2倍、3倍、5倍、10倍、15倍、20倍、25倍、30倍、35倍、40倍、45倍、50倍、55倍、60倍、65倍、70倍或75倍,或至少20-90倍、20-80倍、20-70倍、20-60倍、30-90倍、30-80倍、30-70倍、30-60倍、40-90倍、40-80倍、40-70倍、40-60倍、50-90倍、50-80倍、50-70倍、50-60倍、60-90倍、60-80倍、60-70倍、70-90倍、70-80倍、80-90倍的转基因序列表现。在一些具体实施例中,icv投予引起在整个脑中的基因转移。在某些具体实施例中,基因转移发生在额叶皮质、顶叶皮质、颞叶皮质、海马回、延脑及枕叶皮质中。在某些具体实施例中,基因转移为剂量依赖性的。在某些具体实施例中,载体进一步包含细胞类型选择性调控组件。在某些具体实施例中,调控组件在脑中选择性地表现。在某些具体实施例中,调控组件在额叶皮质、顶叶皮质、颞叶皮质、海马回、延脑及枕叶皮质中选择性地表现。在某些具体实施例中,调控组件在脊柱中选择性地表现。在某些具体实施例中,调控组件在脊髓及背根神经节中选择性地表现。在某些具体实施例中,调控组件
在神经元细胞中选择性地表现。在某些具体实施例中,神经元细胞选自由以下者组成的群:单极、双极、多极或伪单极神经元。在某些具体实施例中,神经元细胞为gaba性神经元。在某些具体实施例中,调控组件在胶细胞中选择性地表现。在某些具体实施例中,胶细胞选自由以下者组成的群:星状细胞、寡树突神经胶质细胞、室管膜细胞、许旺细胞及卫星细胞。在某些具体实施例中,调控组件在非神经元细胞中选择性地表现。
[0145]
在一些具体实施例中,本发明提供通过多个投予途径向个体(例如,灵长类动物)投予本文所揭示的载体中的任一者。在一些具体实施例中,本发明提供通过一种投予途径(例如,脑室内投予)投予本文所揭示的载体中的任一者及亦通过另一投予途径(例如,静脉内投予)投予相同载体的方法。在一些具体实施例中,本发明提供通过脑室内投予来投予本文所揭示的载体中的任一者及亦通过静脉内投予来投予相同载体的方法。在一些具体实施例中,本发明提供通过鞘内投予来投予本文所揭示的载体中的任一者及亦通过静脉内投予来投予相同载体的方法。在一些具体实施例中,本发明提供通过一种投予途径(例如,脑室内投予)投予本文所揭示的载体中的任一者及通过另一投予途径(例如,静脉内投予)投予额外治疗剂(例如,本文所揭示的额外治疗剂中的任一者)的方法。在一些具体实施例中,本发明提供通过脑室内投予来投予本文所揭示的载体中的任一者及通过静脉内投予来投予额外治疗剂的方法。在一些具体实施例中,本发明提供通过鞘内投予来投予本文所揭示的载体中的任一者及通过静脉内投予来投予额外治疗剂的方法。在一些具体实施例中,本发明提供通过静脉内投予来投予本文所揭示的载体中的任一者及通过脑室内投予来投予额外治疗剂的方法。在一些具体实施例中,本发明提供通过静脉内投予来投予本文所揭示的载体中的任一者及通过鞘内投予来投予额外治疗剂的方法。在一些具体实施例中,鞘内投予包含鞘内脑池投予。在一些具体实施例中,鞘内投予包含鞘内腰椎投予。在一些具体实施例中,投予途径为静脉内投予、鞘内投予、脑室内投予或实质内投予中的任一者或其组合。在一些具体实施例中,投予途径为皮下投予、肌内投予、动脉内投予、腹膜内投予或颅内投予中的任一者或其组合。
[0146]
在一些具体实施例中,投予包含经由注射投予。在一些具体实施例中,投予包含经由插管投予。在一些具体实施例中,载体作为大丸剂,例如,作为单一注射剂投予。在一些具体实施例中,载体连续地投予,例如,使用注射泵输注。
[0147]
在一些具体实施例中,脑室内(icv)投予包含将插管穿过颅骨中的孔、穿过脑组织而插入至充满csf的脑室中。在一些具体实施例中,插入单一插管(例如,插入至两个侧脑室中的任一者中)。在一些具体实施例中,可插入两根插管(插入至两个侧脑室中)。在一些具体实施例中,插管可连接至用于单次投予的注射器或输注泵或控制装置(诸如ommaya储集器)。在一些具体实施例中,本发明提供将本文所揭示的载体中的任一者投予至个体的一或多个侧脑室。由于对神经血管损伤及颅内出血的关注,不经常进行脑室的重复「轻触」。此规则的例外可为早产儿,其在病理条件下通常具有极大脑室、薄皮质表层及囟门未闭(open fontanelle),使得重复轻触的累积风险在此群体中降低。
[0148]
由于脑池靠近重要脑组织,因此鞘内脑池内输注在人类中不常进行。然而,在一些具体实施例中,可将鞘内输注装置(例如,medtronic装置)插入于腰椎蛛网膜下空间中且导管朝向颅骨朝上延伸以用于投予。在一些具体实施例中,对人类的鞘内投予包含在约l4/l5间隙处以手术方式插入导管且投予(i)快速给药(经由注射器或ommaya储集器),(ii)短期
输注(经由泵)或(iii)长期输注(经由可植入可程序化泵系统,例如synchromed ii、medtronic,其中泵置放于体内某处的皮下凹穴,诸如腹部区域)。参见例如hamza m等人,neuromodulation,2015;18(7):636-48。
[0149]
在一些具体实施例中,鞘内投予本文所揭示的载体中的任一者包含藉助于腰椎穿刺将载体投予至腰池中。在一些具体实施例中,可在无菌条件下用局部麻醉剂在床边进行脊椎穿刺。在一些具体实施例中,脊椎穿刺针经由下腰椎中的层间空间推进至硬膜囊中。在一些具体实施例中,当获得csf时,确认进入腰池。参见例如cook am等人,pharmacotherapy.2009;29(7):832-45。
[0150]
在一些具体实施例中,通过经由脊椎穿刺针注射载体而向个体(例如,灵长类动物)投予本文所揭示的载体中的任一者。此技术常用于投予化学治疗药物。此技术的优点包括其相对低的风险及在局部麻醉剂下在床边进行的能力。此技术的主要缺点为每次给药必须进行单独穿刺,其产生引入感染、产生皮肤-csf瘘、损伤神经根及引起脊椎内出血的累积风险。在一些具体实施例中,为规避此问题,可通过使用具有较大touhy针的类似技术来置放临时留置导管。
[0151]
在一些具体实施例中,本文所揭示的载体中的任一者可通过将导管穿过针的中心推进至个体的硬膜囊中而向个体(例如,灵长类动物)投予,其中针随后经取出。在一些具体实施例中,接着将导管进行皮下隧穿穿过皮肤,在此处其可无菌地接入预定剂量的所选鞘内药物。此技术的主要缺点包括导管长期置放的感染风险及由于闭塞、扭结或移位的导管故障。然而,此缺点可通过在几天(例如,1-4天)的后移除或替换导管来减轻。
[0152]
在一些具体实施例中,经由基于导管的装置来投予本文揭示的载体中的任一者。在一些具体实施例中,植入永久性基于导管的装置。在一些具体实施例中,植入暂时性基于导管的装置。在一些具体实施例中,针对永久性接入,植入连接至皮下储集器(例如,ommaya储集器)的导管。在一些具体实施例中,导管连接至ommaya储集器。通过使用25号针头,经由无菌穿刺头皮至储集器中,可在床边反复地使用ommaya储集器。在一些具体实施例中,在注射治疗剂之前,抽取几毫升的csf。尽管与接入脑室内隔室的其他方法相比不大可能,但ommaya储集器的污染及感染为一种风险(大约10%的患者最后具有混杂有细菌的csf)。由于植入的持续时间(通常》1年),与其他更临时接入装置进行比较,在报导ommaya储集器感染性并发症的系列的情况下,感染速率通常呈现得更高。ommaya储集器可出现的其他罕见并发症包括脑白质病、白质坏死及脑内出血。
[0153]
在需要限制接入csf空间的情形下,可置放脑室造瘘术。通过此技术,导管在皮肤下隧穿远离毛刺孔。导管通常连接至无菌收集腔室。可按需要无菌接入导管以用于投予本文所揭示的载体中的任一者。在一些具体实施例中,可通过将溶液注射至脑室造瘘术的最近端口中且用少量标准生理盐水(3至5ml)将溶液冲洗至脑中来投予载体。在此滴注之后,脑室造瘘术导管典型地被夹紧至少15分钟以允许经注射溶液在重新打开排液管的前在csf中平衡。颅内压持续升高的患者可无法忍受csf引流的突然停止,因此脑室造瘘术夹持应谨慎的进行且密切监测患者。脑室造瘘术对于需要csf引流的有限时间段或脑室内投予本文所揭示的载体中的任一者的条件为理想的。
[0154]
在一些具体实施例中,本发明提供向个体投予本文所揭示的载体中的任一者的方法,其中个体为灵长类动物。在一些具体实施例中,灵长类动物为人类。在一些具体实施例
中,灵长类动物为非人类灵长类动物。在一些具体实施例中,非人类灵长类动物为旧大陆猴、红毛猩猩、大猩猩、黑猩猩、食蟹猕猴、恒河猕猴或豚尾猕猴。g.治疗方法
[0155]
本发明涵盖治疗对其有需要的个体(例如,灵长类动物,诸如人类或食蟹猕猴)的方法,其包含向个体投予本文所揭示的核酸、载体、病毒颗粒及/或组成物中的任一者。
[0156]
在一些具体实施例中,本发明提供治疗灵长类动物(例如,人类或食蟹猕猴)的方法,其包含向灵长类动物脑室内(icv)投予本文所揭示的载体中的任一者。在特定具体实施例中,本发明提供用于表现所关注基因或其生物活性变体及/或片段的组成物及方法,其包含向对其有需要的灵长类动物(例如,人类或食蟹猕猴)投予治疗有效量的编码所关注基因的腺相关病毒1(aav1)载体及/或腺相关病毒5(aav5)载体。在一些具体实施例中,经由静脉内投予、鞘内投予、脑室内投予、实质内投予或其组合向灵长类动物投予aav1或aav5载体。本发明进一步提供抑制或治疗对其有需要的灵长类动物(例如,人类或食蟹猕猴)的与神经元疾病或病症相关的一或多种症状的组成物及方法,其包含向该灵长类动物投予选自由腺相关载体1(aav1)或腺相关载体5(aav5)组成的群的腺相关载体(aav)。在一些具体实施例中,经由静脉内投予、鞘内投予、脑室内投予、实质内投予或其组合向灵长类动物投予aav1或aav5载体。
[0157]
在一些具体实施例中,本发明提供用于治疗神经元疾病或病症的方法。适合于治疗的神经元疾病或病症包括(但不限于):dravet综合征、阿兹海默氏病、帕金森氏病、亨廷顿氏病、肌肉萎缩性侧索硬化症(als)、脊髓性肌萎缩症(sma)、癫痫症、神经退化性病症、动作障碍症、运动障碍症、情绪障碍症、运动神经元疾病、进行性肌肉萎缩症(progressive muscular atrophy;pma)、进行性延髓性麻痹、假性延髓性麻痹、原发性侧索硬化、aids的神经后果、发育障碍症、多发性硬化症、神经发育障碍症、中风、脊髓损伤及创伤性脑损伤。
[0158]
在某些具体实施例中,本发明提供治疗对其有需要的个体(例如,灵长类动物)的神经元疾病或病症的方法,其包含向个体投予治疗有效量的本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者。在一些具体实施例中,此类个体已诊断患有神经元疾病或病症或处于神经元疾病或病症的风险下,其中神经元疾病或病症为以下者中的任一者或多者:dravet综合征、阿兹海默氏病、帕金森氏病、亨廷顿氏病、肌肉萎缩性侧索硬化症(als)、脊髓性肌萎缩症(sma)、癫痫症、神经退化性病症、动作障碍症、运动障碍症、情绪障碍症、运动神经元疾病、进行性肌肉萎缩(pma)、进行性延髓性麻痹、假性延髓性麻痹、原发性侧索硬化、aids的神经后果、发育障碍症、多发性硬化症、神经发育障碍症、中风、脊髓损伤及创伤性脑损伤。
[0159]
在一些情况下,使用本文所描述的核酸构筑体、载体、病毒载体、病毒颗粒或药物组成物的治疗引起与神经元疾病或病症相关的症状的改良。举例而言,可针对指示对治疗作出积极反应的经改良运动功能而对帕金森患者进行症状监测。向处于罹患神经元病症的风险下的个体投予使用如本文所描述的方法的疗法可预防一或多种症状的出现或减缓其进展。
[0160]
在某些具体实施例中,本发明的方法及组成物可用于治疗已诊断患有神经元疾病(例如,dravet综合征)的个体。在各种具体实施例中,本文所揭示的神经元疾病或病症中的任一者通过已知基因事件(例如,所属技术领域中已知的scn1a突变中的任一者)引起或具
有未知原因。
[0161]
在某些具体实施例中,本发明的方法及组成物可用于治疗处于罹患疾病或病症风险下的个体。在一些具体实施例中,可已知个体易患疾病,例如神经元疾病(例如,dravet综合征)。在一些具体实施例中,个体可由于基因事件或由于已知风险因素而易患疾病。举例而言,个体可携有与dravet综合征相关的scn1a的突变。
[0162]
在某些具体实施例中,一或多种额外治疗剂(例如,药物化合物)与本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者共同投予。在某些具体实施例中,额外治疗剂经设计以治疗与本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者相同的疾病、病症或病况。在某些具体实施例中,额外治疗剂经设计以治疗与本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者不同的疾病、病症或病况。在某些具体实施例中,额外治疗剂经设计以治疗本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中任一者的一或多者的非所需副作用。在某些具体实施例中,本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者与额外药物剂组合投予以治疗额外药物剂的非所需作用。在某些具体实施例中,一或多种治疗剂与本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者共同投予以产生组合作用。在某些具体实施例中,一或多种治疗剂与本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者共同投予以在经治疗个体(例如,灵长类动物)中产生协同效应。
[0163]
在某些具体实施例中,将本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者及额外治疗剂同时投予。在某些具体实施例中,本文所揭示的核酸构筑体、病毒载体、将病毒颗粒及/或药物组成物中的任一者及额外治疗剂在不同时间投予。在某些具体实施例中,将本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者及额外治疗剂一起制备成单一调配物。在某些具体实施例中,单独制备本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者及额外治疗剂。
[0164]
在某些具体实施例中,可与本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者共同投予的治疗剂包括抗精神病药剂,诸如(例如)氟哌啶醇、氯丙嗪、氯氮平(clozapine)、喹硫平(quetapine)及奥氮平(奥氮平);抗抑郁剂,诸如(例如)氟西汀(fluoxetine)、盐酸舍曲林(sertraline hydrochloride)、文拉法辛(venlafaxine)及去甲替林(nortriptyline);安定剂,诸如(例如)苯并二氮呯、可那氮平(clonazepam)、帕罗西汀(paroxetine)、万拉法星(venlafaxin)及β-阻断剂;情绪稳定剂,诸如(例如)锂、丙戊酸盐、拉莫三嗪(lamotrigine)及卡马西平(carbamazepine);麻痹剂,诸如(例如)肉毒杆菌毒素;及/或其他实验药剂,包括(但不限于)四苯那嗪(xenazine)、肌酸、辅酶q10、海藻糖、二十二碳六烯酸、acr16、乙基-epa、阿托西汀(atomoxetine)、西它普兰(citalopram)、迪美本(dimebon)、美金刚(memantine)、苯丁酸钠、雷美替胺(ramelteon)、熊脱氧胆酸(ramelteon)、金普萨(zyprexa)、西那辛(xenasine)、泰必利(tiapride)、利鲁唑(riluzole)、金刚胺、[123i]mni-420、阿托西汀、四苯那嗪、地高辛(digoxin)、右美沙芬(detromethorphan)、华法林(warfarin)、阿普若伦(alprozam)、酮康唑、奥美拉唑(omeprazole)、胆碱酯酶抑制剂、多奈哌齐(donepezil)、雷斯替明(rivastigmine)、加兰他敏(galantamine)、左旋多巴(levodopa)及二甲胺四环素。
[0165]
在某些具体实施例中,本文所揭示的一或多种核酸构筑体、病毒载体、病毒颗粒及/或药物组成物与渗透剂(例如,甘露醇或山梨醇)组合投予。在一些具体实施例中,渗透剂为多元醇(polyol/polyhydric alcohol),例如甘露醇及山梨醇。在一些具体实施例中,渗透剂为糖,例如蔗糖或麦芽糖。在一些具体实施例中,渗透剂为氨基酸或其衍生物,例如甘氨酸或脯氨酸。在某些具体实施例中,渗透剂藉助于注射或输注共同投予至csf。在一些具体实施例中,通过血管内注射或输注、脑室内注射或输注、鞘内脑池注射或输注或鞘内腰椎注射或输注来引入渗透剂。在一些具体实施例中,渗透剂的引入可与本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者的投予同时进行。在一些具体实施例中,可在投予本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者的前将渗透剂引入至csf中。在一些具体实施例中,可在投予本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者的后将渗透剂引入至csf中。
[0166]
在一些具体实施例中,一旦渗透剂(例如,甘露醇)及治疗剂(例如,本文所揭示的核酸构筑体、病毒载体、病毒颗粒及/或药物组成物中的任一者)制备成向个体投予的溶液,则将其投予至csf中。在一些具体实施例中,通过诸如血管内注射或输注、脑室内注射或输注、鞘内脑池注射或输注或鞘内腰椎注射或输注的途径来投予制备溶液。在一些具体实施例中,使注射或输注持续一段时间且流动速率适合于特定核酸构筑体、病毒载体、病毒颗粒及/或药物组成物。在一些具体实施例中,可能更需要鞘内预输注渗透剂(例如,甘露醇)溶液,使得其可在鞘内投予治疗剂的前作用于局部环境。h.实施方案
[0167]
使用腺相关病毒(aav)载体的基因疗法具有治疗影响中枢神经系统的病症的转化潜力。小动物模型中的研究表明,将aav载体递送至脑脊髓液(csf)中可成功地使基因转移至整个脑及脊髓中的细胞,使得神经疾病适合于基因疗法方法。将此方法转译成临床的本质为鉴别将aav递送至大型动物模型的csf中的安全且有效的途径。
[0168]
在此研究中,吾等直接比较在对照剂量下,aav9在五种不同csf递送途径中的生物分布及转导效率:幼年中和抗体(nab)阴性雄性食蟹猕猴(长尾猕猴(macaca fascicularis))的单侧脑室内(icv)、两侧icv、鞘内腰椎(it-腰椎)及大池内(icm)途径。在类似剂量下,csf内途径另外与静脉内(iv)注射相比较。吾等亦经由icv投予系统地定量临床上验证的aav血清型(包括aav血清型9(aav9)、aav血清型5(aav5)及aav血清型1(aav1))的生物分布及转导效率。
[0169]
吾等使用表现通过鸡β肌蛋白启动子(cba)经由三重转染hek293细胞驱动的绿色荧光蛋白(egfp)的aav载体。经由数位液滴pcr(ddpcr)滴定载体。评估在cns组织及周边器官上的生物分布。
[0170]
因此,在此多层研究中,吾等证实了各种投予途径及aav血清型对将目标病毒递送至各种脑结构的功效。吾人的发现告知了针对临床转译cns指导的基因疗法的csf内投予途径的选择及aav衣壳血清型选择。实施方案1:食蟹猕猴中的投予途径研究
[0171]
此研究的目标为比较食蟹猕猴的中枢神经系统(cns)在五种不同投予途径中的生物分布:单侧脑室内(icv)、两侧icv、鞘内(it)腰椎、大池内(icm)或静脉内(iv)注射。使各动物注射有在鸡β肌蛋白(cba)启动子(称作aav9-cba-egfp-kash)的控制下的含有编码
egfp-kash的表现卡匣的aav9。aav9颗粒在pbs+0.001%pf-68中调配且以高剂量(1.0e+13vg/动物)或低剂量(2.4e+12vg/动物)投予。无论投予途径如何,均向各动物投予体积为2ml的经调配病毒颗粒。研究设计阐述于下表1中。
[0172]
表1.投予途径研究的研究设计。
[0173]
实验上未治疗的雄性食蟹猕猴(长尾猕猴)用于此研究中。在初始给药时,动物为10至11个月大且称重为1.4
±
0.2kg。通过简单随机分组程序将动物分配至研究组。在初始研究之前,针对aav9、aav5及aav1的中和抗体(nab)效价的水平来测试动物的血液样本。选择抗体结果低或阴性的动物进行研究。脑室内投予
[0174]
将动物麻醉、准备手术且安装于mri兼容立体定位架(kopf)中。进行基线mri以建立目标坐标。进行切口且穿过目标位置上方的颅骨钻一个孔。使针下降至适当位置且将aav9-cba-egfp-kash载体输注至侧脑室中。显影剂注射及荧光分析术为用于验证针在脑室中的位置。对于各左及右两侧icv治疗以0.1ml/分钟的速率持续10分钟且对于单侧icv治疗以0.1ml/分钟的速率持续20分钟来输注aav9-cba-egfp-kash。在完成输注的后,使针在原位保持1至2分钟。在完成给药的后,以标准方式闭合皮肤且使动物恢复。鞘内(it)腰椎注射
[0175]
将动物用异氟醚麻醉且以外侧侧卧置放。经由经皮针刺接入腰池。如通过对比染料荧光分析术来验证针为插入于l3/l4之间。在置放针头之后,确认阳性csf流动。将含有aav9-cba-egfp-kash的注射器连接至针头且历经1分钟手动缓慢输注载体。完成注射后,移除注射器且确认csf流动。在完成给药之后,将动物置放在特伦德伦伯(trendelenburg)位置中持续10分钟。大池内(icm)注射
[0176]
将动物用异氟醚麻醉且以外侧侧卧置放。经由经皮针刺接入大池。将针头插入于颅骨底部与c1之间。将含有aav9-cba-egfp-kash的注射器连接至针头且历经1分钟手动缓慢输注载体。完成注射后,移除注射器且确认csf流动。静脉内注射
[0177]
使用快速注射至尾部静脉中使动物注射有aav9-cba-egfp-kash。
[0178]
在给药之后,在整个研究期间中对动物进行常规监测且每周抽取血液样本。评估以下参数及指标:死亡率、临床观察结果、体重、体检、临床病理学参数(临床化学)、中和抗体样本分析、pbmc、csf、生物分布及基因表现分析、肉眼尸检发现及组织病理学检查。
[0179]
此研究的结果证实,测试物品的投予不与任何无法预期的死亡率、临床发现、体重变化或肉眼可见的观察相关。在评估临床化学指针后,所有投予aav9-cba-egfp的动物(无论投予途径如何)在个别丙氨酸转胺酶(alt)、天冬氨酸转胺酶(ast)及/或麸氨酸去氢酶(gldh)活性方面增加,此视为aav载体相关的且指示肝细胞效应。
[0180]
使所有动物存活至预定尸检。在安乐死及盐水灌注之后,将脑移除且切成4至5mm的冠状切片(参见图1),且使用8mm活组织检查戳取器自两侧均匀厚片收集qpcr样本。各位点使用新的戳取器。将各活组织检查戳取样本切成两半(一半用于qpcr且另一半用于rt-qpcr)。自脑收集的组织样本包括:4个皮质区域((额叶、顶叶、颞叶及枕叶),在可能时2个切片)、海马回(在可能时2个切片)、延脑及小脑。
[0181]
对于使用qpcr的生物分布研究,自心脏、肝脏、肺、肾脏(两个)、脑、脊髓(sc)、背根神经节(drg)、睪丸及脾(50至100mg)收集组织样本(除脾的外,每个组织样本100至200mg)。自颈部(c2)、胸部(t1及t8)及腰椎(l4)区域收集脊髓及drg。将样本收集于个别预标记的冷冻管中,在液氮中速冻且置放于干冰上。将样本在-60℃至-90℃下冷冻储存。
[0182]
对于使用rt-pcr的基因表现研究,自心脏、肝脏、肺、肾脏(两个)、脾、淋巴结、脑、脊髓、drg及睪丸收集组织样本。自(c3、c4、t2、t3、t9、t10、l2及l5)收集脊髓及drg。将样本单独地置放于含有rna-later的预标记冷冻管中且冷藏(2℃至8℃)持续24至48小时。将样品自冷藏移除且在-60℃至-90℃下冷冻储存。
[0183]
病理组织学组织收集。在收集qpcr及rt-qpcr样本之后,将所有剩余脑组织、脊髓及drg、周边器官(肺充气4%)在室温下固定于4%多聚甲醛(pfa)中持续24至48小时且接着转移至70%乙醇。载体复本数分析
[0184]
在各种脑区域、脊髓、背根神经节、心脏、肝脏、肾脏及脾中测定载体复本数(vcn)。对于脑样本,使用来自各种脑区域的组织戳取样本(参见图1),例如额叶皮质(2个戳取样本,厚片2的各半球各1个)、顶叶皮质(4个戳取样本,厚片4及8的各半球各1个)、颞叶皮质(2个戳取样本,厚片6的各半球各1个)、海马回(4个戳取样本,厚片8及10的各半球各1个)、小脑(2个戳取样本,厚片12的各半球各1个)、延脑(2个戳取样本,厚片12的各半球各1个)及枕叶皮质(2个戳取样本,厚片14的各半球各1个)。如下文所阐述处理所有组织样本。
[0185]
用dneasy血液及组织套组(qiagen)分离组织dna。使用uv分光亮度计测定且标准化dna数量。将100ng组织dna以及针对egfp区域的taqpath proamp multiplex master mix(thermo fisher scientific)及taqman引子及探针添加至50μl反应物中。通过限制酶线性化及用dna清洁及浓缩器套组(zymo research)进行纯化来制备质体标准曲线。通过uv分光亮度法对线性化dna进行定量且自每10μl 106个复本10倍连续稀释至50个复本。如针对组织样本,将稀释的标准曲线添加至50μl反应物中。taqman qpcr系使用lightcycler 96系统(roche,life science)进行,以使用两步循环方案(初始变性/酶活化:95℃持续10分钟,40个循环:95℃持续15秒,60℃持续60秒)测定生物分布研究的组织中的载体复本数。猴基因
体白蛋白(alb)序列充当基因体dna含量的内部对照且在单独反应中扩增。若alb ct值小于26,则认为样本合格。
[0186]
egfp引子探针序列:
[0187]
fw:aaccgcatcgagctgaagg;
[0188]
rv:gccatgatatagacgttgtggc;
[0189]
探针:aggaggacggcaacatcctggggca
[0190]
食蟹猕猴白蛋白序列:
[0191]
fw:gctgttatctcttgtgggctgt
[0192]
rv:aaactcatgggagctgccggtt
[0193]
探针:ccacacaaatctctccctggcattg
[0194]
载体复本数分析的结果展示,icv投予比icm投予在将aav递送至脑时更有效,且icv比it-腰椎或iv投予在将aav递送至脑时显著更有效(参见图2至图9)。另外,结果展示,单侧icv投予比两侧icv投予在向脑递送aav时相当或更有效(参见图10至图14)。非人类灵长类动物血清中抗aav中和抗体(nab)效价的测定
[0195]
测定用病毒载体处理前后中和抗体的效价。293aav细胞系购自cell biolabs公司(san diego,ca)且在补充有10%热灭活fbs的dmem中培养。使用nano-荧光素酶分析系统及-multi+微量盘多模式读取器(promega(madison,wi))。nhp血清为获自给药前及给药后第1、14及28天获得的血液抽取物。在使用之前,使血清样本在56℃下热灭活30分钟。
[0196]
在分析的第1天,将293aav细胞以1
×
104个/100μl(aav1及aav5)或1.5
×
104个/100μl(aav9)接种于96孔平底培养盘中,且在37℃,5%co2下培育隔夜。在第2天,在将样本与aav-cmv_nluc载体混合之前进行nhp血清样本的连续稀释且在37℃下培育1小时。各盘亦产生100%载体转导对照及0%转导(信号背景)对照。最后,将共培育混合物转移至96孔平底培养盘以分别实现aav1、aav5及aav9的1000、2000及10000的感染倍率(multiplicity of infection;moi)。在37℃下培育48小时之后,根据制造说明书制备nano-荧光素酶分析试剂且将其添加至盘中,且在greiner bio-one白色聚苯乙烯lumitrac 200微量盘(greiner bio one)中测量发光。
[0197]
分析结果展示于下表2中。将抗aav中和抗体效价定义为最高血清稀释度的倒数,在该稀释度下,与阴性对照组相比,aav转导减少了》50%。
[0198]
投予aav9载体后,所有动物具有可测量的持续直至研究结束的抗aav9衣壳中和抗体(参见表2)。表2.用aav9载体治疗处理的动物的中和抗体效价。
投予途径研究的免疫组织化学分析
[0199]
在aav投予之后测定绿色荧光蛋白(gfp)表现在各种组织中的水平。在盐水灌注之后,将组织固定于4%多聚甲醛中持续48小时,转移至70%乙醇,经石蜡包埋且以5μm切片。在用二甲苯及酒精移除石蜡之后,在柠檬酸盐缓冲液(ph 6)中在95℃下进行热量回收持续20min。以1:5000用鸡抗gfp(aves labs gfp1020)进行初级抗体染色隔夜,接着以1:1000用山羊抗鸡-hrp(thermo a16054)侦测1小时。以1:100使用tsa-fitc(perkinelmer)持续10min,随后进行dapi染色。使用10
×
物镜用pe vectra3使载玻片成像,且分别在4及40ms时拍摄dapi及fitc染色的影像。
[0200]
如图15中所示,通过不同投予途径投予的给药有aav9载体的动物在脑区域、脊髓及背根神经节中展示不同程度的gfp表现。实施方案2:食蟹猕猴中的aav血清型研究
[0201]
此研究的目标为使用3种不同aav血清型aav1、aav5及aav9来比较食蟹猕猴的中枢神经系统(cns)中的生物分布。使动物注射有在鸡β肌蛋白(cb a)启动子(称作aavx-cba-egfp-kash)的控制下的含有编码egfp-kash的表现卡匣的aav载体(aav1、aav5或aav9)或在具有seq id no:76且含有土拔鼠肝炎病毒转录后调控组件(wpre)(称作aav9-seq id 76-egfp-wpre)的启动子的控制下的含有编码egfp的表现卡匣的aav9载体。aav颗粒在pbs+0.001%pf-68中调配且以下表所列的剂量投予。向各动物投予体积为2ml的经调配病毒颗粒。研究设计阐述于下表3中。表3.aav血清型研究的研究设计。
[0202]
动物如实施方案1中所阐述给药以供进行单侧icv注射。如实施方案1中所阐述对动物进行常规监测且每周抽取血液样本。除动物3002之外,所有动物存活至预定尸检。在第14天,注意到动物3002为运动失调的,活性降低且异常。动物继续衰退且经安乐死。
[0203]
所有投予aav9-cba-egfp的动物(无论投予途径或批次如何)及投予aav5-cba-egfp或aav1-cba-egfp的少数个体在个别丙氨酸转胺酶(alt)、天冬氨酸转胺酶(ast)及/或麸氨酸去氢酶(gldh)活性方面增加,此视为aav载体相关的且指示肝细胞效应。在aav9-seq id76-egfp-wpre投予的后未观察到类似效应。
[0204]
在安乐死的后,如实施方案1中所阐述对组织进行qpcr、rt-qpcr及组织病理学处理。如实施方案1中所描述测定载体复本数。结果展示,尽管aav9水平稍微较高,aav1、aav5及aav9在脑中展示相当的载体转导(参见图16-图19)。
[0205]
如上文实施方案1中所阐述亦针对血清型研究测定中和抗体效价。aav9载体的结果在上表2中展示且aav5及aav1载体的结果如下表4中所展示。表4.用aav5及aav1载体处理的动物的中和抗体效价。
[0206]
投予aav1、aav5及aav9载体后,所有动物具有可测量的持续直至研究结束的抗aav衣壳中和抗体(参见表2及表4)。
[0207]
如上文实施方案1中所阐述亦针对用aav1、aav5及aav9处理的动物测定gfp表现量的ihc分析。如图20中所示,在脑及脊髓组织中的所有三种血清型中观察到不同程度的gfp表现。实施方案3:etfscn1a生物分布
[0208]
此研究的目标为当经由单侧脑室内(icv)注射以4.8e+13vg/动物或8e+13vg/动物的剂量投予时,比较etfscn1a在幼年食蟹猕猴的中枢神经系统(cns)中的生物分布。使各动物注射有在gaba选择性调控组件(regaba-etfscn1a)的控制下的用含有编码etfscn1a的表现卡匣的aav9。aav9颗粒在pbs+0.001%普洛尼克酸中调配且以4.8e+13vg/动物或8e+13vg/动物的剂量投予。向各动物投予体积为2ml的经调配病毒颗粒。研究设计阐述于表8中。
[0209]
将二十四个月大的食蟹猕猴如表8中所指示分组。在初始研究之前,使用上述nab效价分析测试来自动物的血液样本的针对aav9的中和抗体效价的水平。选择抗体结果低或阴性的动物进行研究。使用标准手术程序经由icv注射来投予样本。将解冻的给药材料短暂储存于湿冰上且仅在给药的前升温至室温。将动物麻醉、准备手术,且安装于mri兼容立体定位架(kopf)中。进行基线mri以建立目标坐标。进行切口且穿过目标位置上方的颅骨钻一个孔。用样本制备连接至36”微孔延伸装置的3ml bd注射器且将其置放于输注泵中。激活延伸线。打开硬脑膜,且将给药针推进至距软脑膜13.0至18.1mm的深度。显影剂注射及荧光分析术用于确认脊椎穿刺针在右侧脑室中的位置。使3.0”22g quinke bd脊椎休伯(huber)点针填充有造影剂以确定在连接经激活延伸线及注射器之前的位置。将泵设定为0.1ml/分钟,持续19至20分钟。给药后手动推送缓冲液以清除延伸线。完成输注后,使针原位保持1至2分钟,且接着取出针头。在第1天投予一次媒剂及测试物品且使个体维持27或29天恢复期。表8.生物分布研究设计
[0210]
在给药之后,在整个研究期间对动物进行常规监测且定期抽取血液样本。etfscn1a投予不与任何无法预期的死亡率、临床发现或肉眼可见的观察相关。使aav9-regaba-etfscn1a处理的动物存活直至在第28天
±
2天的预定尸检。在每天或每周体检期间,未观察到临床或行为体征、体温升高或体重减少。在aav9-regaba-etfscn1a处理的动物中观察到肝脏转胺酶(alt及ast)的暂时升高,但在无免疫调节的研究结束时完全分解,且未提及血清胆红素或碱性磷酸酶的伴随增加。无其他测量的临床化学指针为显著的。在肝脏组织病理学研究中未报导显微镜观察结果。相对于处理前值,csf白血球在最终收集中升高,但在对照组与aav9-regaba-etfscn1a处理的动物的间相当。未观察到aav9-regaba-etfscn1a相关的脑脊液细胞增多(pleocytosis)。所有动物的非神经元组织的宏观观察结果及详细微观组织病理学检查为并不显著的。组织包括主要周边器官(亦即,心脏、肺、脾、肝脏及性腺)。神经元组织的宏观观察结果及详细微观组织病理学并未展示任何显著的发
现。组织包括脑、脊髓及相关的背根神经节(来自颈部、胸部及腰椎区域)。研究由三名独立病理学家进行,包括在专门的神经病理学场所的一名病理学家。
[0211]
icv投予aav9并未预防血清中的给药后免疫反应,因为在给药后四周观察到抗aav9衣壳中和抗体。然而,csf中的中和抗aav9抗体水平保持不变且与给药前水平相当(表9)。表9:aav9血清nab效价
[0212]
在预定尸检期间,在给药后27-29天自主要器官(心脏脑室、肝叶、肺心叶、肾、脾、胰脏及颈部淋巴结)收集样本。经由八毫米戳取收集戳取样本且如下文所论述进一步处理。实施方案4:etfscn1a在脑中的生物分布
[0213]
ddpcr用于测量etfscn1a在脑中的生物分布。测量来自食蟹猕猴脑组织的各种区域(fc:额叶皮质;pc:顶叶皮质;tc:颞叶皮质;hip:海马回;med:延脑;oc:枕叶皮质)的样本的载体复本数以评定etfscn1a在通过单侧icv以aav9形式投予时在gaba选择性调控组件(regaba-etfscn1a)的控制下的生物分布。用dneasy血液及组织套组(qiagen)分离组织dna。使用uv分光亮度计测定且标准化dna数量。将20奈克组织dna与用于探针的ddpcr super mix(无dutp)(bio-rad)及针对etfscn1a序列区域的taqman引子及探针一起添加至20微升反应物中。使用自动液滴发生器及热循环器(bio-rad)产生液滴且扩增模板。在pcr步骤之后,盘经装载且通过qx2000液滴读取器读取以测定组织中的载体复本数。猴白蛋白(mfalb)基因充当标准化基因体dna含量的内部对照且在相同反应中扩增。etfscn1a及mfalb的引子及探针阐述于表10中。表10:etfscn1a及mfalb的引子及探针
[0214]
当以每动物4.8e+13病毒基因体(平均1.3-3.5vg/二倍体基因体)给药时,etfscn1a广泛分布于整个脑中(图21)。另外,当将以每动物4.8e+13病毒基因体给药的regaba-etfscn1a的整个脑中的基因转移与以各种剂量经由icv给药的egfp的整个脑中的基因转移进行比较时,观察到vg/二倍体基因体随剂量增加而增加。此指示当经由icv以aav9形式投予时,脑中的基因转移以剂量依赖性方式出现。实施方案5:etfscn1a在脑中的转录
[0215]
通过测量etfscn1a mrna使用基于ddpcr的基因表现分析来评定在gaba选择性调控组件regaba(regaba-etfscn1a)的控制下的etfscn1a的转录。用用于脑组织的rneasy plus迷你套组(qiagen)或rneasy脂质组织迷你套组(qiagen)分离组织rna。使用uv分光亮度计测定且标准化rna数量且使用生物分析仪rna芯片检查rna质量(rin)。一微克组织rna用于dna酶处理且通过superscript vilo cdna合成套组以及ezdnase
tm
酶套组(thermo fisher)进行cdna合成。将50微克rna转化为cdna。将cdna与用于探针的ddpcr super mix(无dutp)(bio-rad)及针对etfscn1a序列区域的taqman引子及探针一起添加至20微升反应物中(表11)。使用自动液滴发生器及热循环器(bio-rad)产生液滴且扩增模板。在pcr扩增之后,盘经装载且通过qx2000液滴读取器读取以提供组织中的基因表现量。猴基因arfgap2(mfarfgap2)(thermo fisher scientific)充当用于标准化基因表现量的内源性对照且在相同反应中扩增。arfgap2的平均转录物为1.85e+6/μg rna(图22,上部边界)。通过下部边界指示侦测极限。
[0216]
在所有动物中的整个脑中观察到etfscn1a mrna指示对于所有aav9-regaba-etfscn1a处理的猕猴,gaba选择性启动子regaba在脑组织中具转录活性(图22)。fc:额叶皮质;pc:顶叶皮质;tc:颞叶皮质;hip:海马回;med:延脑;oc:枕叶皮质。表11:针对etfscn1a序列区域的taqman引子及探针
实施方案6:外周组织中的etfscn1a生物分布及转录
[0217]
进一步测量各种器官中的载体复本数以评估当通过单侧icv以aav9形式投予时在整个身体的组织中的regaba-etfscn1a的转导。亦通过ddpcr测量etfscn1a的转录水平以评定在通过单侧icv以aav9形式投予时在整个身体的组织中的gaba选择性调控组件regaba的控制下的转录活性etfscn1a。如上文通常描述执行两种方法。脊髓(sc)及背根神经节(drg)中的regaba-etfscn1a转导及etfscn1a的转录与脑中观察到的水平相当。除肝脏之外,regaba-etfscn1a转导在除脑之外的周边组织中较低(图23)。regaba-etfscn1a在肝脏中的转导高于在脑中的转导。在包括心脏、肺及性腺的周边组织中未侦测到etfscn1a的转录。然而,肝脏中的etfscn1a转录水平与脑中量测的etfscn1a的水平相当。此外,肝脏中的etfscn1a转录在标准化为载体复本存在的数目时极其低(与脑中etfscn1a的转录相比大约低1000倍)。总体而言,此证实在gaba选择性调控组件regaba的控制下的etfscn1a的转录受限于cns。i.序列表5:例示性调控组件核酸序列的清单
表6:本文所揭示的额外核酸序列
表7:本文所揭示的额外核酸序列的清单。
参考文献并入
[0218]
本说明书中所提及的所有公开案、专利及专利申请案均以引用的方式并入本文中,其引用的程度如各单独的公开案、专利或专利申请案经特定及单独地指示以引用的方式并入一般。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1