用于产生调节性CD4的制作方法
用于产生调节性cd4
+
t细胞的鞘脂
背景技术:
1.调节性t细胞(treg细胞或treg)最初被描述为cd4
+
cd25
+ t细胞。treg细胞主要与免疫系统的调节有关。归因于它们的形成机制,treg细胞分成天然treg细胞(ntreg),其在胸腺中分化并且随后转运到身体外周;以及诱导性/适应性treg细胞(itreg),其在身体外周产生。treg细胞的特征在于表达cd4,以及与激活的效应t细胞(cd25
low
,也称为cd25-t细胞)中的cd25表达相比,白介素-2受体的α链的表达增加(cd25
high
,也称为cd25
+
)。因此,treg细胞可通过cd25的表达水平与效应t细胞区分。约2%至10%的cd4
+ t细胞表达高水平的cd25(cd25
high
)并且为treg细胞。除cd25的高表达以外,treg细胞还具有与激活的效应t细胞(cd127
high
,也称为cd127
+
,t细胞)中的cd127表达相比,介白素-7受体的α链的低表达(cd127
low
,也称为cd127-)。此外,典型地,cd4
+
cd25
high treg细胞表达转录因子叉头盒(forkheadbox,foxp3),其对所述细胞的发育和抑制能力至关重要,如下文所描述。
2.treg细胞调节免疫系统的主要焦点是抑制自身反应性效应t细胞,即cd4
+
和cd8
+ t细胞和b细胞的激活并且还抑制其扩增,以及控制树突状细胞、巨噬细胞和自然杀伤细胞的激活。调节性t细胞在限制针对外来抗原的免疫应答和维持对自身抗原的耐受方面发挥重要作用。除维持耐受和因此自身免疫疾病的相关预防之外,调节性t细胞还在对过敏原和病原性微生物的免疫应答的抑制控制中发挥重要作用。其还促成诱导免疫系统针对器官移植的耐受,并且防止在妊娠期间针对胎儿的过度免疫应答。因此,treg细胞促进或维持对抗原,典型地对自身抗原的耐受。仅cd4
+
cd25
+ t细胞具有高抑制活性。
3.自身免疫疾病的共同点为身体对自身抗原起反应。自身抗原被误解为入侵者标记并且载体细胞受自身免疫系统攻击。
4.treg细胞已在多种自身免疫疾病,包括甲状腺炎、卵巢炎、胃炎或炎性肠病等中显示具有缺陷。这些缺陷由发炎组织中treg细胞数量损失、缺陷型treg细胞、通过白介素-2受体的信号传导减少和抑制活性的不稳定性体现。由此,已经认识到,表达foxp3的cd4
+
cd25
+ t细胞在调节自身免疫反应方面非常重要。举例来说,foxp3基因中的突变导致非功能性treg细胞并且可在人类中引起伴有过度增殖性t细胞的致死性多自身免疫疾病。已发现从患有多发性硬化症(ms)的患者的外周血中分离的treg细胞具有功能障碍。实验性自身免疫性脑脊髓炎(eae),即多发性硬化症的实验动物模型中的研究展现,通过cd4
+
cd25
+ t细胞的过继转移增加功能性treg细胞数量可提供一定程度的保护。
5.已描述移植物抗宿主病中出现的自身免疫性(tivol等人,《血液(blood)》,2005)。
6.所属领域中需要一种自身免疫疾病的有效治疗方法,其使用提供低副作用风险的物质靶向cd4
+
cd25
+ t细胞。此需要源于一个事实,即当前利用免疫抑制药物的治疗方法也使正在起作用的免疫细胞失活,其中药物携带有害副作用的风险。
7.本发明公开了鞘脂在产生用于治疗自身免疫疾病的treg细胞中的有用性。
8.在本发明中,已显示可通过使用鞘脂促进treg细胞产生来治疗自身免疫疾病,其中treg细胞可在体外以及体内两者产生。通过本发明方法产生的treg细胞可引入到患有自身免疫疾病的受试者中。
技术实现要素:
9.在下文中,详细地描述本发明。本发明的特征描述于各个段落中。然而,这不意味着一个段落中所描述的特征与其它段落中所描述的一种或多种特征分离。相反地,一个段落中所描述的特征可与其它段落中所描述的一种或多种特征组合。
10.如本文所用,术语“包含(comprise/s/ing)”意指包括或涵盖所公开的特征和未具体提及的其它特征。术语“包含”还意指“由”指定特征“组成(consist/s/ing of)”的意义,因此不包括除指定特征外的其它特征。因此,本发明的主题的特征可在于除如所指示的特征之外的其他特征。
11.在第一方面,本发明提供一种式(i)的物质
[0012][0013]
其中
[0014]
r1为具有6至20个碳原子的烷基或烯基;
[0015]
r2为h或缺失,其中o通过双键结合,
[0016]
r3为h或酰基-c(o)r5,其中r5为具有1至10个碳原子的烷基或烯基,并且
[0017]
r4为h或磷酸基,
[0018]
其用作药剂。
[0019]
在第二方面,本发明提供一种式(i)的物质
[0020][0021]
其中
[0022]
r1为具有6至20个碳原子的烷基或烯基;
[0023]
r2为h或缺失,其中o通过双键结合,
[0024]
r3为h或酰基-c(o)r5,其中r5为具有1至10个碳原子的烷基或烯基,并且
[0025]
r4为h或磷酸基,
[0026]
其用于预防或治疗患有自身免疫疾病的受试者的方法。
[0027]
在以上的一个实施方式中,本发明提供式(i)的物质,其中所述物质为二氢鞘氨醇、二氢鞘氨醇-1-磷酸和/或3-酮-二氢鞘氨醇,优选的,其中式(i)的物质为二氢鞘氨醇。
[0028]
在以上的一个实施方式中,其中所述物质呈赤型形式,优选赤型-二氢鞘氨醇、赤型-二氢鞘氨醇-1-磷酸和/或赤型-3-酮-二氢鞘氨醇,更优选的,所述物质呈d-赤型形式,再更优选d-赤型-二氢鞘氨醇、d-赤型-二氢鞘氨醇-1-磷酸和/或d-赤型-3-酮-二氢鞘氨醇,并且最优选d-赤型-二氢鞘氨醇。
[0029]
在以上的一个实施方式中,所述物质与药剂组合使用。在一个优选实施方式中,所
述药剂选自下组:视黄酸、克帕松(copaxone)、胰岛素、能够与cd3相互作用的分子、能够与cd28相互作用的分子、转化生长因子β(tgfβ)、白介素-2(il-2)、短链脂肪酸、胆汁酸、多糖a、n3多不饱和脂肪酸、视黄酸、维生素d(vitd)、维生素c(vitc)、多酚、槲皮素、白藜芦醇、非类固醇抗炎药(nsaid)、雷帕霉素(rapamycin)和/或来自自身反应性蛋白质的肽片段,更优选的,所述药剂为tgfβ和/或il-2。
[0030]
在第三方面,本发明提供一种用于体外产生调节性t细胞(treg细胞)的方法,其包括以下步骤:
[0031]
1)提供前体cd4
+ t细胞,
[0032]
2)在如本文所定义的式(i)的物质存在下,培养步骤1)中所提供的前体cd4
+ t细胞,以及任选地,
[0033]
3)分离产生的调节性t细胞(treg细胞)。
[0034]
在以上的一个实施方式中,本发明提供以上方法,其进一步包括在能够诱导调节性t细胞(treg细胞)产生的其他化合物存在下,培养前体cd4
+ t细胞的步骤;优选在能够与cd3相互作用的分子、能够与cd28相互作用的分子、转化生长因子β(tgfβ)、白介素-2(il-2)、短链脂肪酸、胆汁酸、多糖a、n3多不饱和脂肪酸、视黄酸、维生素d(vitd)、维生素c(vitc)、多酚、槲皮素、白藜芦醇、非类固醇抗炎药(nsaid)、雷帕霉素和/或来自自身反应性蛋白质的肽片段存在下;更优选的,在tgfβ和/或il-2存在下;更优选的,在(1)tgfβ和/或il-2;和(2)抗cd3抗体和/或抗cd28抗体;和/或(3)肽片段存在下;更优选的,在tgfβ、抗cd3抗体和抗cd28抗体存在下或在tgfβ和肽片段存在下;最优选的,在tgfβ、il-2、抗cd3抗体和抗cd28抗体存在下或在tgfβ、il-2和肽片段存在下。
[0035]
在以上的一个实施方式中,前体cd4
+ t细胞为从受试者,优选从脾、淋巴结或外周血中分离的初始cd4
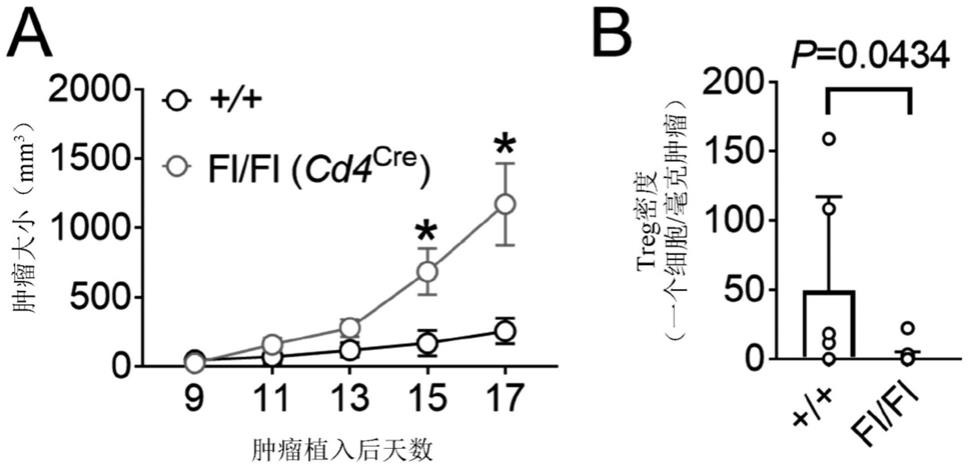
+ t细胞,或前体cd4
+ t细胞为脾细胞或从受试者,优选从静脉血中分离的外周血单核细胞(pbmc)。
[0036]
在以上的一个实施方式中,使用流式细胞术分选或磁性细胞分选使用细胞表面标记分离前体cd4
+ t细胞,优选的,其中这些细胞表面标记为cd4
+
和cd25
+
或cd25
high
,或为cd4
+
和cd25
+
或cd25
high
和cd127-或cd127
low
。
[0037]
在以上的一个实施方式中,受试者患有自身免疫疾病。
[0038]
在以上的一个实施方式中,将步骤2)中的物质添加到0.1至20μm的最终浓度,优选添加到1至15μm的最终浓度,更优选添加到3至10μm的最终浓度,最优选添加到5至6.25μm的最终浓度。
[0039]
在以上的一个实施方式中,将步骤2)中的前体cd4
+ t细胞培养24至144小时,优选24小时至120小时,更优选48小时至96小时。
[0040]
在第四方面,本发明提供可通过本发明方法获得的调节性t细胞(treg细胞),其优选用作药剂,更优选用于预防或治疗患有自身免疫疾病的受试者的方法。
[0041]
在本发明的一个实施方式中,自身免疫疾病为自身免疫性脑炎、自身免疫性脑脊髓炎、类风湿性关节炎、1型糖尿病、银屑病、自身免疫性肾病、系统性红斑狼疮、乳糜泻、炎性肠病或移植物抗宿主病,优选自身免疫疾病为多发性硬化症。
[0042]
在第五方面,本发明提供一种试剂盒,其包含转化生长因子β(tgf-β)和/或白介素-2(il-2)以及式(i)的物质,和任选地能够诱导调节性t细胞(treg细胞)产生的其他化合
物,优选为能够与cd3相互作用的分子、能够与cd28相互作用的分子、短链脂肪酸、胆汁酸、多糖a、n3多不饱和脂肪酸、视黄酸、维生素d(vitd)、维生素c(vitc)、多酚、槲皮素、白藜芦醇、非类固醇抗炎药(nsaid)、雷帕霉素和/或来自自身反应性蛋白质的肽片段;优选的,试剂盒包含(1)tgfβ和/或il-2;和(2)抗cd3抗体和/或抗cd28抗体;和/或(3)肽片段;更优选的,试剂盒包含tgfβ、抗cd3抗体和抗cd28抗体或试剂盒包含tgfβ和肽片段;最优选的,试剂盒包含tgfβ、il-2、抗cd3抗体和抗cd28抗体或试剂盒包含tgfβ、il-2和肽片段。
[0043]
本发明由先前报道(wu等人,2019)的后续研究中得到的意外发现产生。在公开的报道中,发现针对感染的保护性t细胞应答需要蛋白质sptlc2(由基因sptlc2编码)(hanada等人,2003)。因为已知t细胞防止感染和癌症,所以假设sptlc2也是抗肿瘤t细胞功能所需的。为了检验此假设,使sptlc2
flox/flox
小鼠(由纽约州上州大学(upstate university,new york)xian-cheng jiang教授产生)与cd4-cre小鼠(可从杰克逊实验室(jackson laboratory)商购)繁殖以产生sptlc2
flox/flox
cd4-cre小鼠。基因sptlc2和cd4分别编码蛋白质sptlc2和cd4(cd4为t细胞的标记蛋白)。在sptlc2
flox/flox
cd4-cre小鼠中,基因sptlc2在表达cd4蛋白的t细胞中具有缺陷。实际上,t细胞中sptlc2的遗传缺陷减弱抗肿瘤免疫(图1a)。一个意外的观察结果是t细胞的一个亚群,称为调节性t细胞(treg细胞),因sptlc2缺陷减少。已知treg细胞促进b16肿瘤生长(klages等人,2010)。然而,在sptlc2
flox/flox
cd4-cre小鼠中肿瘤生长增加与treg细胞减少相关。因此,数据支持sptlc2增强treg细胞形成而不管微环境如何的想法。因为treg细胞在抑制自身免疫中是必需的,所以抑制sptlc2可适用于治疗自身免疫疾病。
[0044]
为了探究抑制sptlc2以治疗自身免疫的可能性,通过将sptlc2
flox/flox
小鼠与foxp3cre-yfp小鼠(由纽约州纪念斯隆-凯特林癌症中心(memorial sloan kettering cancer center,new york)alexander rudensky教授产生;yfp=黄色荧光蛋白)杂交来繁殖具有treg细胞特异性sptlc2缺陷的小鼠品系,即sptlc2
flox/flox
foxp3cre-yfp小鼠。在此品系中,基因sptlc2在表达foxp3蛋白的treg细胞中具有缺陷。使用体外培养分析,发现treg细胞的免疫抑制功能需要sptlc2(图2)。因为treg细胞在维持自身耐受以预防自身免疫疾病,如多发性硬化症、类风湿性关节炎、1型糖尿病和移植物抗宿主(gvh)病的发展中发挥极重要作用,所以使用多发性硬化症的eae小鼠模型确定sptlc2是否调节自身免疫。
[0045]
与野生型对照小鼠相比,sptlc2
flox/flox
foxp3cre-yfp小鼠发展出更严重的eae(图3)。这些结果促使我们假设补充sptlc2下游的代谢产物,如二氢鞘氨醇,增强treg细胞产生并且改善自身免疫疾病。sptlc2下游的代谢途径显示于图4d中。为了检验此假设,在体外treg细胞产生系统中将二氢鞘氨醇添加到t细胞中。如所报道,细胞因子tgf-β诱导表达foxp3的treg细胞(chen等人,2003)。二氢鞘氨醇进一步增加foxp3蛋白表达(图4a)。另一方面,在炎性t细胞(也称为产生白介素-17的t细胞,或th17细胞)分化条件下,二氢鞘氨醇减少il-17的产生。因为th17细胞促进eae发展并且treg细胞拮抗eae发展(park等人,2005;mcgeachy等人,2005),所以测试二氢鞘氨醇是否改善eae症状。用二氢鞘氨醇治疗eae小鼠降低了eae临床评分(图5)。总的来说,我们的实验结果表明1)在体外和体内两者情况下,二氢鞘氨醇增加免疫抑制treg细胞并且减少炎性th17细胞和2)二氢鞘氨醇改善eae的症状。因此,已鉴别出1)一种产生treg细胞以抑制炎症的新方法和2)治疗自身免疫疾病的小分子物质。
[0046]
小分子物质为式(i)的物质
[0047][0048]
其中
[0049]
r1为具有6至20个碳原子的烷基或烯基;
[0050]
r2为h或缺失,其中o通过双键结合,
[0051]
r3为h或酰基-c(o)r5,其中r5为具有1至10个碳原子的烷基或烯基,并且
[0052]
r4为h或磷酸基。
[0053]
如本文所用,术语“烷基”是指含有指定数目的碳原子的可为直链或支链的饱和烃链。式(i)的物质中的烷基选自基团甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一基、十二基、十三基、十四基、十五基、十六基、十七基、十八基、十九基和二十基以及其大量不同支链异构体。尤其优选具有10至16个碳原子的直链和支链r1烷基。
[0054]
术语“烯基”是指含有指定数目的碳原子的可为直链或支链的不饱和烃链。烯基可具有1、2或3个不饱和键。式(i)的物质中的烯基选自基团乙烯基、丙烯基、丁烯基、戊烯基、己烯基、庚烯基、辛烯基、壬烯基、癸烯基、十一烯基、十二烯基、十三烯基、十四烯基、十五烯基、十六烯基、十七烯基、十八烯基、十九烯基和二十烯基以及其大量不同支链异构体。尤其优选具有10至16个碳原子的直链和支链r1烯基。
[0055]
烷基或烯基可未被取代或被以下基团独立地取代1或2次:卤素、c
1-6
烷基、c
1-6
卤烷基、c
1-6
烷氧基、c
1-6
卤烷氧基、c
1-6
烯基、-oh、-nh2和-nh(ch3)。
[0056]
术语“卤烷基”是指其中一个或多个氢原子被卤基替换的烷基,并且包括其中所有氢已被卤基替换的烷基部分。
[0057]
术语“烷氧基”是指-o-烷基。
[0058]
术语“卤烷氧基”是指其中一个或多个氢原子被卤基替换的烷氧基。
[0059]
术语“卤基”或“卤素”是指氟、氯、溴或碘的基团。
[0060]
最优选的式(i)的物质为具有式c
18h39
no2的二氢鞘氨醇,其中在式(i)中,r1为c
13
烷基,r2为h,r3为h并且r4为h。
[0061]“式(i)的物质”理解为一种或多种,如2或3种式(i)的物质。
[0062]
本文所描述的式(i)的物质用作药剂,优选用于预防或治疗患有自身免疫疾病的受试者的方法。由此,式(i)的物质通过增强可有效改善自身免疫疾病的treg细胞的产生起作用。
[0063]
在本发明的一个实施方式中,式(i)的物质与另一药剂组合使用。“药剂”意指适用于或用于或将用于治疗自身免疫疾病的任何组分,包括具有一般免疫抑制活性的任何组分,如糖皮质激素,如泼尼松(prednisone)、地塞米松(dexamethasone)或氢化可的松(hydrocortisone),细胞抑制剂,烷化剂,如氮芥(环磷酰胺)、亚硝基脲或铂化合物,抗代谢物,如叶酸类似物,如甲氨蝶呤,嘌呤类似物,如硫唑嘌呤或巯嘌呤,嘧啶类似物,如氟尿嘧啶,或蛋白质合成抑制剂,细胞毒性抗生素,如放线菌素d(dactinomycin)、蒽环霉素
(anthracycline)、丝裂霉素c(mitomycin c)、博来霉素(bleomycin)或光神霉素(mithramycin),抗体,如单克隆抗体,如莫罗单抗(muromonab)-cd3,作用于亲免素的药物,如环孢素(ciclosporin)、他克莫司(tacrolimus)、西罗莫司(sirolimus)、依维莫司(everolimus),干扰素,如ifn-β,阿片,霉酚酸酯,或小生物剂,如芬戈莫德(fingolimod)或多球壳菌素(myriocin)。因此,在本发明的一个优选实施方式中,所述药剂为免疫抑制剂,优选选自下组:视黄酸、克帕松、胰岛素、能够与cd3相互作用的分子、能够与cd28相互作用的分子、转化生长因子β(tgfβ)、白介素-2(il-2)、短链脂肪酸、胆汁酸、多糖a、n3多不饱和脂肪酸、视黄酸、维生素d(vitd)、维生素c(vitc)、多酚、槲皮素、白藜芦醇、非类固醇抗炎药(nsaid)、雷帕霉素和/或来自自身反应性蛋白质的肽片段,更优选tgfβ和/或il-2。
[0064]
此外,“药剂”包括正在或将要特定用于治疗给定自身免疫疾病的任何组分。在ms的情况下,此类药物的实例为特非德拉(tecfidera)、捷灵亚(gilenya)、奥克维(ocrevus)、克帕松、奥巴捷(aubagio)、阿沃纳斯(avonex)、泰萨布里(tysabri)、利比(rebif)、阿克撒(acthar)、兰特拉达(lemtrada)或当前正在开发的药物,如s1p调节剂,如乌妥昔单抗(ublituximab)、泰萨布里、兰特拉达、阿扎拉(arzerra)、l abt-555或genmab。在1型糖尿病的情况下,此类组分的实例为胰岛素或当前正在开发的药物,如钠-葡萄糖协同转运蛋白(sglt)抑制剂(嗪奎塔(zynquista)、苏格拉(suglat)、安达唐(forxiga)、欧唐静(jardiance))、单克隆抗体(例如remd-477、佩利珠单抗(peplizumab))、细胞疗法(例如vc-01、vc-02clbs-03或dcvac/dia)、白介素受体激动剂和胰高血糖素样肽1受体激动剂。所属领域的技术人员已知用于治疗其它自身免疫疾病的药剂的实例。此外,“药剂”还包括一般来说促进健康的此类物质或组分,如维生素、抗氧化剂等。在本发明的情形下,“药剂”还理解为可使用和/或组合一种或多种,如2、3或4种药剂。
[0065]
此外,本发明提供一种体外产生treg细胞的方法。
[0066]
在本发明中,“调节性t细胞”或“treg细胞”以如所属领域中已知的通常含义理解。特定来说,如本文所提及的调节性t细胞为能够抑制病原性效应t细胞应答或非所需效应t细胞应答,更特定地,抑制针对自身抗原的病原性效应t细胞应答,再更特定地,抑制自身免疫疾病中的病原性效应t细胞应答,最特定地,改善自身免疫疾病的t细胞。此外,如本文所提及的treg细胞可表征为cd4
+
cd25
+ t细胞,优选cd4
+
cd25
high t细胞,更优选cd4
+
cd25
+
cd127-t细胞,再更优选cd4
+
cd25
high
cd127
low t细胞。如本文所用,术语cd25
+
和cd25
high
、术语cd127
+
和cd127
high
、术语cd25-和cd25
low
以及术语cd127-和cd127
low
的使用与如所属领域中已知的定义(simonetta f.等人,2013)一致。此外,如本文所提及的treg细胞的特征可在于表达foxp3蛋白(hori等人,2003)。因此,又再更优选地,如本文所提及的treg细胞为cd4
+
cd25
high
cd127
low
foxp3
+ t细胞。
[0067]
此外,根据本发明方法产生的treg细胞优选特征在于产生大量foxp3蛋白(chen等人,2003)。此外,根据本发明方法产生的treg细胞优选特征在于以高水平表达程序性细胞死亡蛋白1,也称为pd-1。pd-1为细胞表面上的免疫检查点蛋白,通过下调免疫系统并且通过抑制t细胞炎性活性促进自身耐受,在调节免疫系统针对细胞的应答方面发挥作用(ishida等人,1992)。此预防自身免疫疾病。因此,根据本发明方法产生的treg细胞的免疫抑制能力高于未用式(i)的物质处理的treg细胞(park等人,2016)。
[0068]
如本文所用,术语“前体cd4
+ t细胞”意指可发育成treg细胞,优选cd4
+
lithocholic acid)(hang等人,2018);多糖a;n3多不饱和脂肪酸,例如c
18-22
;视黄酸;vitd;vitc;多酚egcg(wong等人,2011);槲皮素;白藜芦醇;nsaid,例如阿司匹林(javeed等人,2009)和/或雷帕霉素。“其他化合物”理解为“一种或多种,如2、3或4种其他化合物”。
[0074]
此外,如上文所提及的培养基可含有来自自身反应性蛋白质的肽片段(本文中也称为“肽片段”,即受试者的自身蛋白质,受试者可针对其产生自身免疫应答)作为其他化合物。由此,肽片段包含受试者的效应t细胞所针对的此蛋白质的序列或表位或由其组成。因此,待添加到培养基中的蛋白质和因此其肽片段取决于受试者中待治疗的疾病。举例来说,在患有1型糖尿病的受试者中,效应t细胞是胰岛素特异性的。因此,如果产生treg细胞以向患有1型糖尿病的受试者施用,则可将胰岛素肽添加到培养基中。其它实例为ms的髓鞘碱性蛋白(mbp)、ms的髓鞘少突胶质细胞糖蛋白(mog)、ms的髓鞘相关糖蛋白(mag)或ms的蛋白脂蛋白(plp)。“肽片段”理解为“一种或多种,如2、3或4种肽片段”。
[0075]
优选地,除式(i)的物质之外,培养基还含有tgfβ和/或il-2,更优选培养基含有(1)tgfβ和/或il-2;(2)能够与cd3相互作用的分子,如抗cd3抗体和/或能够与cd28相互作用的分子,如抗cd28抗体;和/或(3)如上文所定义的肽片段。再更优选地,培养基含有(1)tgfβ和/或il-2;和(2)能够与cd3相互作用的分子,如抗cd3抗体和能够与cd28相互作用的分子,如抗cd28抗体;或(3)如上文所定义的肽片段。此外,再更优选地,培养基含有tgfβ、il-2、能够与cd3相互作用的分子,如抗cd3抗体和能够与cd28相互作用的分子,如抗cd28抗体,或培养基含有tgfβ、il-2和如上文所定义的肽片段。又再更优选地,培养基含有tgfβ、抗cd3抗体和抗cd28抗体或培养基含有tgfβ和如上文所定义的肽片段。最优选地,培养基含有tgfβ、il-2、抗cd3抗体和抗cd28抗体或培养基含有tgfβ、il-2和如上文所定义的肽片段。
[0076]
取决于产生本发明的treg细胞的方式,培养基以分化方式包含其他化合物。除式(i)的物质之外,包含待分化成根据本发明方法产生的treg细胞的初始cd4
+ t细胞的培养基优选还含有tgfβ和/或il-2,和任选的能够与cd3相互作用的分子,如抗cd3抗体和/或能够与cd28相互作用的分子,如抗cd28抗体,并且更优选tgfβ、il-2、抗cd3抗体和抗cd28抗体。除式(i)的物质之外,包含脾细胞或pbmc的培养基优选还含有tgfβ和/或il-2和任选的如上文所定义的肽片段,以及任选的能够与cd3相互作用的分子,如抗cd3抗体和/或能够与cd28相互作用的分子,如抗cd28抗体,并且更优选tgfβ、il-2、如上文所定义的肽片段、抗cd3抗体和抗cd28抗体。
[0077]
培养基还可含有通常在细胞培养、细胞疗法和/或treg细胞培养中的添加剂。这些的实例为抗生素、氨基酸补充剂、维生素补充剂和/或痕量元素补充剂。
[0078]
培养基中的前体cd4+ t细胞的浓度与总体积相适应,并且优选为1至5
×
106个细胞/毫升。
[0079]
技术人员可容易地确定培养期。优选地,将前体cd4+ t细胞培养24至144小时,优选24小时至120小时,更优选48小时至96小时,任选地在如上文所定义的其他化合物存在下。
[0080]
不必在培养开始时将式(i)的物质添加到培养步骤中。相反地,其可在前体cd4+ t细胞已在培养基中在如上文所定义的其他化合物存在下培养一段时间后添加到培养基中。举例来说,前体cd4+ t细胞,如初始cd4
+ t细胞、脾细胞或pbmc的培养可在tgf-β/il-2/能够与cd3相互作用的分子/能够与cd28相互作用的分子/如上文所定义的肽片段存在下进
行,持续12至72小时,优选24至48小时的时间段,其后,添加式(i)的物质且再继续12至72小时,优选24至48小时的时间段的培养,总共24至144小时,优选24小时至120小时,更优选48小时至96小时。
[0081]
式(i)的物质添加到培养基中,到达0.1至20μm,优选1至15μm,更优选3至10μm,最优选5至6.25μm的最终浓度。
[0082]
培养在适于产生treg细胞的温度,优选25℃至37℃,最优选37℃下进行。
[0083]
培养后,包含根据本发明方法产生的treg细胞的培养基可按需要原样使用,或其可经分离并且因此纯化以排除其它细胞或培养基的组分。可通过所属领域中已知的方法进行分离,例如facs分选具有标记cd4
+
cd25
high
cd127
low
的细胞(b
é
zie s.等人,2018)。
[0084]
在本发明中已显示,通过使用式(i)物质的本发明方法产生treg细胞,同时抑制产生炎性il-17的t细胞(th17细胞)的产生。还在tgfβ存在下获得th17细胞产生的这种抑制,尽管tgfβ诱导th17细胞产生。因此,使用式(i)的物质的优点是除产生能够改善自身免疫反应的高度抑制性treg细胞之外,th17细胞产生量低。因此,通过向受试者施用式(i)的物质,与不使用式(i)的物质相比,减少th17细胞产生,使得归因于th17细胞的炎症反应缺乏或减少。通过向受试者施用根据本发明方法产生的treg细胞,培养基中th17细胞的杂质低,也使得施用根据本发明方法产生的treg细胞的受试者中归因于th17细胞的炎症反应缺乏或减少。在本发明方法中,与不使用(i)的物质相比,在式(i)的物质存在下,th17细胞的产生极大地减少。因此,在式(i)的物质存在下,本发明方法的步骤2)中获得的培养基中存在的表达foxp3的cd4
+
细胞(如cd4
+
cd25
high
cd127
low
foxp3
+
)全体的1%至20%,优选2%至15%,更优选4%至10%,再更优选5%至8%并且最优选约6.1%为th17细胞。由此,术语“约”意指指定数目的
±
0.5%至10%,如0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%或10%。
[0085]
在本发明方法中,与不使用(i)的物质相比,在式(i)的物质存在下,表达foxp3的cd4
+
细胞的产生增强。因此,在式(i)的物质存在下,本发明方法的步骤2)中获得的培养基中存在的cd4
+
细胞全体的31%至90%,优选40%至86%,更优选50%至80%,再更优选60%至75%并且最优选约72%或85.4%为表达foxp3的cd4
+
细胞(如cd4
+
cd25
high
cd127
low
foxp3
+
)。由此,术语“约”意指指定数目的
±
0.5%至10%,如0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%或10%。
[0086]
自身免疫疾病是由对身体正常部分的异常免疫反应引起的病况。在本发明的一个实施方式中,自身免疫疾病为自身免疫性脑炎、自身免疫性脑脊髓炎、类风湿性关节炎、1型糖尿病、银屑病、自身免疫性肾病、系统性红斑狼疮、乳糜泻、炎性肠病或移植物抗宿主病,优选其中自身免疫疾病为多发性硬化症。
[0087]
本发明提供一种药剂,其包含式(i)的物质和药学上可接受的载剂(其提供所需特征),任选地另外包含如上文所定义的药剂。此外,本发明提供一种药剂,其包含根据本发明方法产生的treg细胞和药学上可接受的载剂(其提供所需特征),任选地另外包含如上文所定义的药剂。此外,本发明提供一种药剂,其包含式(i)的物质、根据本发明方法产生的treg细胞和药学上可接受的载剂,并且任选地另外包含如上文所定义的药剂。为了生产药剂,式(i)的物质和/或根据本发明方法产生的treg细胞和任选的药剂必须与(一种或多种)药学上可接受的载剂一起以药物剂型组合。
[0088]
药剂可针对适于向受试者施用药剂的任何种类的施用模式制造,施用模式包括全
身、经鼻、肠胃外、阴道、局部、直肠或口服施用。肠胃外施用包括皮下、皮内、肌内、静脉内或腹膜内施用。
[0089]
药剂可配制成各种剂型,包括用于口服施用的固体剂型,如胶囊、片剂、丸剂、粉末、颗粒;用于口服施用的液体剂型,如药学上可接受的乳液、微乳液、溶液、悬浮液、糖浆和酏剂;可注射制剂,例如无菌可注射水性或油性悬浮液;用于直肠或阴道施用的组合物,优选栓剂;以及用于皮肤或经皮施用的剂型,如软膏、糊剂、乳膏、洗剂、凝胶、粉末、溶液、喷雾剂、吸入剂或贴剂。优选地,根据本发明方法产生的treg细胞被配制成液体剂型,更优选配制成可注射制剂。
[0090]
任何特定受试者的特定治疗有效剂量将取决于多种因素,包括式(i)的物质和/或根据本发明方法产生的treg细胞的活性,剂型,受试者的年龄、体重和性别,治疗持续时间以及医疗领域中已知的其它因素。
[0091]
每隔一天向受试者施用,总共8次施加的式(i)的物质的总剂量可为1000微克/千克体重。以单剂量或多剂量向受试者施用的根据本发明方法产生的treg细胞的总剂量可为一次输注中例如每位患者5
×
106至2.6
×
109的量,如先前所报道(bluestone等人,2015)。单剂量组合物可以含有此类量或其约数以构成日剂量。
[0092]
如本文所用,术语“受试者”为哺乳动物,如灵长类动物、啮齿动物、猫科动物、犬科动物或驯养的农畜。优选地,受试者为人、小鼠、大鼠、兔、猫、犬、牛、马、山羊或绵羊。
[0093]
根据本发明方法产生的treg细胞可向患有自身免疫疾病的受试者施用。由此,根据本发明方法产生的treg细胞可由自身前体cd4
+ t细胞产生,如由自身初始cd4
+ t细胞或自身pbmc产生,即由作为根据本发明方法产生的treg细胞再次引入的相同受试者的供体产生,以便预防或治疗自身免疫疾病。可替代地,根据本发明方法产生的treg细胞可由同种异体或异种前体cd4
+ t细胞产生,如由同种异体或异种初始cd4
+ t细胞或同种异体或异种脾细胞或pbmc,即由与根据本发明方法产生的treg细胞所引入的受试者不同的供体(相同或不同物种)产生。在一个实施方式中,供体可为健康供体,即供体未患有自身免疫疾病。可替代地,供体可患有自身免疫疾病。优选地,前体cd4
+ t细胞为在已通过本发明方法处理后再引入到相同受试者中的自身细胞,所述细胞从所述受试者中分离。
[0094]
此外,本发明提供一种治疗或预防自身免疫疾病的方法,其中所述方法包括向受试者施用足以治疗或预防自身免疫疾病的量的式(i)的物质。
[0095]
此外,本发明提供一种治疗或预防自身免疫疾病的方法,其中所述方法包括向受试者施用足以治疗或预防自身免疫疾病的量的根据本发明产生的treg细胞。
[0096]
此外,本发明提供一种治疗或预防自身免疫疾病的方法,所述方法包括以下步骤:
[0097]
1)提供前体cd4
+ t细胞,
[0098]
2)在式(i)的物质存在下,培养步骤1)中所提供的前体cd4
+ t细胞,
[0099]
3)任选地分离产生的调节性t细胞(treg细胞),以及
[0100]
(4)将足以治疗或预防自身免疫疾病的量的由此产生的调节性t细胞(treg细胞)返回到受试者中。
[0101]
返回可以适于将treg细胞引入到受试者中的任何方式进行。尤其优选的返回模式为静脉内施加、动脉内施加、腔内施加、鞘内施加或皮内施加。静脉内施加是优选的,因为这使得能够直接引入到外周系统中并且因此引入到血液循环中,在那里treg细胞自然地起作
用。
附图说明
[0102]
图1.t细胞的sptlc2缺陷增加肿瘤生长但减少treg细胞形成。将sptlc2
flox/flox
cd4-cre(fl/fl,8只小鼠)和sptlc2
+/+
cd4-cre(+/+,11只小鼠)小鼠皮下植入2
×
105个黑素瘤b16细胞。肿瘤大小用卡尺测量并且计算为长度
×
宽度
×
宽度/2。线图显示随时间推移的肿瘤生长(a)。肿瘤通过70μm细胞过滤器压碎以制备单细胞悬浮液,快速离心并且再悬浮于40%珀可(percoll)中。将含有肿瘤细胞和肿瘤浸润性细胞的40%珀可加载到80%珀可上并且以2000rpm旋转15分钟。肿瘤浸润性白细胞发现于离心后40%与80%珀可之间的中间层中并且收集以用于facs染色和细胞计数。条形图显示肿瘤中表达foxp3蛋白的treg细胞的密度,计算为treg细胞的数量除以肿瘤的重量(b)。数据表示为平均值
±
sem以及3次(a)和2次(b)独立实验的累积。*,p《0.05,学生t检验(student's t-test)。
[0103]
图2.treg细胞中的sptlc2缺陷影响treg细胞的免疫抑制功能。yfp阳性cd4
+ treg细胞和yfp阴性cd4
+
非treg细胞经facs分选。在t细胞刺激物抗cd3和抗cd28涂布的微珠(每个细胞培养物4
×
104个微珠;16ng/ml抗cd3和16ng/ml抗cd28存在下,在250μl完全培养基中培养2
×
104个非treg细胞。非treg细胞与treg细胞以指定比(例如“8:1”意指2
×
104个非treg细胞加2.5
×
103个treg细胞)共培养。线图显示相对于非treg细胞:treg细胞的抑制%。数据为3次独立实验的累积。结果表示为平均值
±
sem。*,p《0.05,学生t检验。
[0104]
图3.treg细胞中的sptlc2缺陷增强eae小鼠模型中的自身免疫。线图显示相对于eae诱导后数天内的eae临床评分。使用五对小鼠。结果表示为平均值
±
sem。*,p《0.05,学生t检验。
[0105]
图4.二氢鞘氨醇促进treg细胞体外产生并且抑制炎性th17细胞形成。yfp阴性cd4
+
非treg初始t细胞从foxp3cre-yfp小鼠中进行facs分选(250μl完全培养基中的1
×
105个细胞)。在用于treg细胞的细胞因子tgfβ(5ng/ml)和il-2(10ng/ml)以及用于th17细胞的tgfβ(5ng/ml)、il-6(20ng/ml)和抗ifnγ(10μg/ml)存在或不存在的情况下,用抗cd3和抗cd28激活初始t细胞三天。a:在细胞因子tgfβ(5ng/ml)或媒剂对照dmso(无tgfβ)存在下,用二氢鞘氨醇(5μm)诱导treg细胞形成后foxp3蛋白表达的流式细胞术分析。b:在二氢鞘氨醇(5μm)存在或不存在的情况下,用tgfβ(5ng/ml)、il-6(20ng/ml)和抗ifnγ(10μg/ml)诱导th17细胞形成后il-17蛋白表达的流式细胞术分析。c:在tgfβ(5ng/ml)和l-丝氨酸(5μm)、3-kds(5μm)、二氢鞘氨醇(5μm)、二氢神经酰胺(50nm)、神经酰胺(50nm)、鞘氨醇(1μm)、鞘氨醇-1-磷酸(1μm)、二氢鞘氨醇1-磷酸(1μm)或媒剂对照dmso(仅tgfβ)存在下,诱导treg细胞形成后foxp3蛋白表达的流式细胞术分析。d:描绘如所指示的鞘脂结构和鞘脂生物合成途径。每个facs图中的数字显示facs图中所示的总细胞群内指定细胞群的百分比。
[0106]
图5.二氢鞘氨醇处理改善eae发展。线图显示相对于eae诱导后数天内的eae临床评分。结果表示为平均值
±
sem。*,p《0.05,**,p《0.01,学生t检验。
实施例
[0107]
方法
[0108]
小鼠。c57bl/6背景的sptlc2
fl/fl
和foxp3
cre
小鼠分别由xian-cheng jiang教授(纽
约州纽约州立大学州南部医学中心(suny downstate medical center,new york))和alexander rudensky教授(纽约州纪念斯隆-凯特林癌症中心)提供。c57bl/6背景的cd4
cre
小鼠购自杰克逊实验室。所有小鼠维持在dkfz无特定病原体设施中。在所有实验中,将年龄和性别匹配的同窝出生仔畜(5-10周龄)用作对照小鼠。所有研究均在德国卡尔斯鲁厄行政区(karlsruhe)地区委员会批准后根据dkfz法规进行。
[0109]
b16黑素瘤植入和肿瘤浸润性免疫细胞制备。b16-f10黑素瘤细胞皮下注射到sptlc2
flox/flox
cd4-cre、sptlc2
+/+
cd4-cre、sptlc2
flox/flox
foxp3-cre-yfp和sptlc2
+/+
foxp3-cre-yfp小鼠(每只小鼠2
×
105个细胞)。使用卡尺每2-3天测量一次肿瘤。在指定时间点处死小鼠并且使用镊子和剪刀收集肿瘤。肿瘤通过70μm细胞过滤器压碎以产生单细胞悬浮液。将肿瘤细胞离心且再悬浮于40%珀可中并且加载到80%珀可中进行梯度离心。离心后,在40%与80%珀可之间的中间层中发现免疫细胞。随后将免疫细胞抽吸到新管中进行流式细胞术染色。
[0110]
eae诱导和监测。每只小鼠用200μg在弗氏完全佐剂(freund's complete adjuvant)中乳化的mog35-55肽皮下免疫。腹膜内注射百日咳毒素(每只小鼠400ng)。在指示时,小鼠腹膜内注射二氢鞘氨醇(从免疫当天到实验结束的每隔一天)。每天使用以下评分标准对eae症状进行评分:0,无病征;1,尾无力;2,下肢无力(1或2条后肢不完全瘫痪);3,截瘫(2条后肢完全瘫痪);4,截瘫伴有前肢无力或瘫痪;5,垂死状态或死亡。出于小鼠福利原因,如果评分达到3,我们就处死小鼠。
[0111]
小鼠原代t细胞培养。完全培养基用于细胞培养并且通过用10%胎牛血清、青霉素/链霉素抗生素和非必需氨基酸补充rpmi 1640纯培养基来制备。对于treg和th17细胞体外分化,使用流式细胞术分选仪从sptlc2
+/+
foxp3cre-yfp野生型小鼠中纯化初始脾t细胞。foxp3在细胞核中表达并且foxp3蛋白的facs染色需要细胞固定和透化,这杀死细胞并且不适合于后续细胞培养。在此foxp3cre-yfp小鼠品系中,通过yfp蛋白表达报告foxp3蛋白表达。表达foxp3的细胞无法在不固定和透化细胞的情况下直接进行facs分选,并且因此保存细胞活力。yfp阳性cd4
+ treg细胞和yfp阴性cd4
+
非treg细胞经facs分选。在用于treg细胞的细胞因子tgfβ(5ng/ml)和il-2(10ng/ml)以及用于th17细胞的tgfβ(5ng/ml)、il-6(20ng/ml)和抗ifnγ(10μg/ml)存在或不存在的情况下,用t细胞刺激物抗cd3和抗cd28激活初始cd4
+ t细胞(250μl培养基中的1
×
105个细胞)三天。如所指示添加二氢鞘氨醇或其它鞘脂(1或5μm)。通过流式细胞术分析检查foxp3和白介素-17(il-17)蛋白质表达。
[0112]
流式细胞术。facs缓冲液(含0.5%fcs的pbs)用于染色细胞表面抗原。为了染色细胞内抗原,将细胞用百进生技(biolegend)固定缓冲液(用于细胞因子)或电子生物科学(ebioscience)固定/透化缓冲液(用于转录因子)固定。使用live/dead可固定死细胞染色剂(赛默飞世尔科技(thermo fisher scientific))排除死细胞。对于treg细胞共培养抑制分析,应答细胞用celltrace violet标记(37℃,20分钟)且用含1%fbs的rpmi 1640培养基洗涤3次。样品在lsr ii上运行并且使用flowjo软件(flowjo,llc,bd)分析。
[0113]
抗体和细胞因子。抗体从百进生技、电子生物科学和bd生物科学(bd biosciences)订购,以使用流式细胞术检测以下抗原:cd4(gk1.5)、il-17(tc11-18h10.1)和foxp3(fjk-16s)。抗cd3(17a2)和抗cd28(37.51)用于细胞培养。
[0114]
实施例1
[0115]
t细胞的sptlc2缺陷增加肿瘤生长但减少treg细胞形成。将sptlc2
flox/flox
cd4-cre(fl/fl,8只小鼠)和sptlc2
+/+
cd4-cre(+/+,11只小鼠)小鼠植入2
×
105个黑素瘤b16细胞。结果显示于图1中。我们观察到,t细胞中sptlc2的遗传缺陷减弱抗肿瘤免疫(图1a),并且我们进一步观察到,t细胞的一个亚群,称为调节性t细胞(treg细胞),因sptlc2缺陷减少(图1b)。
[0116]
实施例2
[0117]
treg细胞中的sptlc2缺陷影响treg细胞的免疫抑制功能。我们使用流式细胞术分选仪从sptlc2
flox/flox
foxp3cre-yfp小鼠或sptlc2
+/+
foxp3cre-yfp小鼠中纯化treg和非treg细胞。foxp3在细胞核中表达并且foxp3蛋白的facs染色需要细胞固定和透化,这杀死细胞并且不适合于后续细胞培养。在此foxp3cre-yfp小鼠品系中,通过yfp蛋白表达报告foxp3蛋白表达。我们无法在不固定和透化细胞的情况下直接对表达foxp3的细胞进行facs分选,并且因此保存细胞活力。yfp阳性cd4
+ treg细胞和yfp阴性cd4
+
非treg细胞经facs分选。非treg细胞用荧光染料celltrace violet(ctv,以确定细胞增殖)标记,并且在t细胞刺激物抗cd3和抗cd28存在下与或不与sptlc2缺陷或足够的treg细胞共培养三天。抑制%以[(在无treg细胞情况下的t细胞增殖速率-在treg细胞情况下的t细胞增殖速率)/在无treg细胞情况下的t细胞增殖速率%]计算。我们发现treg细胞的免疫抑制功能需要sptlc2。结果显示于图2中。
[0118]
实施例3
[0119]
treg细胞中的sptlc2缺陷增强eae小鼠模型中的自身免疫。在sptlc2
flox/flox
foxp3cre-yfp小鼠或sptlc2
+/+
foxp3cre-yfp小鼠中诱导eae。简单来说,每只小鼠用200μg在弗氏完全佐剂中乳化的mog
35-55
肽皮下免疫。腹膜内注射百日咳毒素(每只小鼠400ng)。每天对eae症状进行评分。与野生型对照小鼠相比,sptlc2
flox/flox
foxp3cre-yfp小鼠发展出更严重的eae。结果显示于图3中。
[0120]
实施例4
[0121]
二氢鞘氨醇促进treg细胞体外产生并且抑制炎性th17细胞形成。使用流式细胞术分选仪从sptlc2
+/+
foxp3cre-yfp野生型小鼠中纯化初始脾t细胞。在细胞因子tgf-β(图4a,以诱导treg细胞形成)或tgf-β加白介素-6(il-6)(图4b,以诱导th17细胞形成)存在或不存在的情况下,用t细胞刺激物抗cd3和抗cd28以及il-2激活初始cd4
+ t细胞三天。添加二氢鞘氨醇(5μm)或媒剂对照dmso。通过流式细胞术分析检查foxp3和白介素-17(il-17)蛋白质表达。可替代地,在二氢鞘氨醇或其它鞘脂或媒剂对照存在下,在treg细胞诱导条件(与图4a相同)下培养初始cd4
+ t细胞,随后对foxp3蛋白表达进行流式细胞术分析(图4c)。描绘结构和鞘脂生物合成途径(图4d)。如所报道,细胞因子tgf-β诱导表达foxp3的treg细胞(chen等人,2003)。发现二氢鞘氨醇或其它鞘脂增加foxp3蛋白表达,诱导treg细胞形成并且减少il-17蛋白表达。
[0122]
实施例5
[0123]
二氢鞘氨醇处理改善eae发展。c57bl/6小鼠用200μg在弗氏完全佐剂中乳化的mog
35-55
肽皮下免疫以诱导eae发展。腹膜内注射百日咳毒素(每只小鼠400ng)。小鼠腹膜内注射二氢鞘氨醇(1000微克/千克体重,每两天一次注射,第1天至第15天)。每天对eae症状进行评分。结果显示在图5中。
[0124]
参考文献
[0125]
berod l.等人,《自然
·
医学(nature medicine)》20:1327-1333,2014.
[0126]bé
zie s.等人,《免疫学前沿(frontiers in immunology)》8,文章2014,2018.
[0127]
blackley s.等人,《病毒学杂志(journal of virology)》81:13325-13334,2007.
[0128]
bluestone j.a.等人,《科学
·
转化医学(science translational medicine)》7:315ra189,2015.
[0129]
chen w.等人,《实验医学杂志(the journal of experimental medicine)》198:1875-1886,2003.
[0130]
goyvaerts c.等人,《基因疗法(gene therapy)》19:1133-1140,2012.
[0131]
hanada k.等人,《生物化学与生物物理学报(biochim biophys acta)》1632:16-31,2003.
[0132]
hang s.等人,biorxiv doi:https://doi.org/10.1101/465344,2018.
[0133]
hori s.等人,《科学(science)》299:1057-1061,2003.
[0134]
ishida y.等人,《欧洲分子生物学学会杂志(embo journal)》11:3887-3895 1992.
[0135]
javeed a.等人,《移植免疫学(transplantation immunology)》20:253-260,2009.
[0136]
klages k.等人,《癌症研究(cancer research)》70:7788-7799,2010.
[0137]
mcgeachy m.j.等人,《免疫学杂志(j immunol.)》175:3025-3032,2005.
[0138]
park h.等人,《自然
·
免疫学(nature immunology)》6:1133,2005.
[0139]
park b.等人,《癌症发现(cancer discovery)》6:1366-1381 2016.
[0140]
simonetta f.等人,《免疫学前沿》4,文章215,2013.
[0141]
tivol等人,《血液》.2005年6月15日;105(12):4885-4891.
[0142]
wong c.等人,《免疫学通讯(immunology letters)》139:7-13,2011.
[0143]
wu j.等人,《免疫(immunity)》50:1-14,2019.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1