用于载体的多重shRNA的制作方法
用于载体的多重shrna
1.相关申请的交叉引用
2.本技术要求2019年5月2日提交的序列号为62/842,049的美国临时申请的申请日的权益,该申请的全部公开内容通过引用并入本文,如同在本文中完全阐述一样。
技术领域
3.本发明涉及到基因调控领域。
背景技术:
4.rna干扰(“rnai”)参与转录后的基因调控,rnai技术被描述为构成全球药物开发市场的一个关键部分,该市场到2025年将达到约1600亿美元。在植物和动物中进行rnai基因调控的机制之一是通过称为microrna(“mirna”)的小非编码rna的表达。mirna能够靶向特定的信使rna(“mrna”)进行降解,从而促使基因沉默。
5.由于microrna途径在基因活性调控中的重要性,研究人员目前正在探索小干扰rna(“sirna”,这是人工设计的分子)可以介导rnai的程度。sirna可以导致靶分子(例如mrna)的裂解。与mirna类似,为了识别靶分子,sirna依赖于碱基的互补性。
6.在称为sirna的分子类别中,已知有短发夹(short hairpin)rna(“shrna”)。shrna是单链分子,其包含有义区和能够与有义区杂交的反义区。shrna能够形成茎环结构,其中有义区和反义区形成茎的一部分或全部。使用shrna的一个优点是它们可以作为单个分子被递送或转录,而当sirna有两条独立的链时,这是不可能的。然而,像其他sirna一样,shrna基于碱基的互补性靶向mrna。
7.许多病症、疾病和失调是由多种蛋白质之间的相互作用引起的。因此,研究人员正在寻找有效的方法来同时向细胞或生物体递送多重sirna。
8.一种递送选择是使用载体技术在细胞中表达shrna,在细胞中通过内源性mirna途径对shrna进行处理。对每种shrna使用单独的载体可能很麻烦,而且难以同时在细胞中递送。因此,研究人员已经开始探索使用能够表达多种shrna的载体。遗憾的是,迄今为止,研究人员还未能开发出足够有效的多重体(multiplex)系统。研究人员所描述的问题包括:(a)载体重组和shrna表达缺失的风险;(b)由于多重盒中的位置效应,shrna功能性降低;(c)shrna克隆的复杂性;(d)rnai处理饱和;(e)细胞毒性;和(f)不良的脱靶效应。参见,例如,wo2016/061232a2,multiplexed shrnas and use thereof,2016年4月21日公开。
9.因此,仍然需要开发有效的盒和载体来递送多重microrna基shrna。
技术实现要素:
10.本发明提供了用于递送和/或表达多重microrna基shrna的多核苷酸、载体和方法,以及包含或使用所述多核苷酸或载体的治疗细胞。通过本发明的各种实施方案,本领域普通技术人员可以有效且高效地使用和/或引起多种shrna的表达。
11.根据第一实施方案,本发明涉及包含多重microrna基shrna编码区的多核苷酸,其
中所述多重microrna基shrna编码区包含编码两种或多种人工mirna基shrna核苷酸序列的序列,其中每种人工mirna基shrna核苷酸序列包含:(a)mirna支架序列,其中mirna支架是mir-196a-2支架序列或者与mir-196a-2支架序列或截断的mir-196a-2支架序列具有至少80%同一性的序列,其中所述截断的mir-196a-2支架序列在其5’端或3’端中一者或两者上缺失1-6个核苷酸;(b)活性序列,其中每种人工mirna基shrna核苷酸序列的活性序列长18-40个核苷酸;和(c)乘客序列(passenger sequence),其中在每种人工mirna基shrna核苷酸序列中,活性序列与乘客序列至少80%互补,每种乘客序列长18-40个核苷酸。如果并非全部活性序列都是相同的,每种或两种或多种活性序列可以不同。与其他支架相比,mir-196a-2支架在多重应用中的效率出乎意料地更高。
12.根据第二实施方案,本发明提供了包含多重microrna基shrna编码区的多核苷酸,其中所述多重microrna基shrna编码区包含编码以下项的序列:(a)x种人工mirna基shrna核苷酸序列,其中每种人工mirna基shrna核苷酸序列包含(i)mirna支架序列,例如seq id no:31或与seq id no:31具有至少80%同一性或在5’端和3’端中一者或两者截断的seq id no:31的截断版本,(ii)活性序列,其中每种人工mirna基shrna核苷酸序列的活性序列长18-40个核苷酸,和(iii)乘客序列,其中在每种人工mirna基shrna核苷酸序列中,活性序列与乘客序列至少80%互补,每种乘客序列长18-40个核苷酸;和(b)y种接头序列,其中每种接头序列与靶生物体基因组内的内源序列不具有同一性,其中x大于或等于2,y=x-1,其中每种接头序列位于一对连续的人工mirna基shrna核苷酸序列之间。可选地,多核苷酸还编码包含seq id no:19的5’侧翼序列和包含seq id no:22的3’侧翼序列。
13.根据第三实施方案,本发明提供了包含多重microrna基shrna编码区的多核苷酸,其中所述多重microrna基shrna编码区包含编码以下项的序列:(a)x种人工mirna基shrna核苷酸序列,其中每种人工mirna基shrna核苷酸序列包含(i)mirna支架序列,(ii)活性序列,其中每种人工mirna基shrna核苷酸序列的活性序列长18-40个核苷酸,和(iii)乘客序列,其中在每种人工mirna基shrna核苷酸序列中,活性序列与乘客序列至少80%互补,每种乘客序列长18-40个核苷酸;和(b)y种接头序列,其中每种接头序列独立地与选自由seq id no:1至seq id no:16组成的序列组中的序列具有至少80%同一性,其中x大于或等于2,y=x-1,其中每种接头序列位于一对连续的人工mirna基shrna核苷酸序列之间。使用这些新型和非显而易见的接头的多重体有效地沉默多重靶点。
14.在使用前述接头的一些实施方案中,在至少一种人工microrna核苷酸序列中,支架序列包含mir-196a-2支架序列或者与mir-196a-2支架序列或截断的mir-196a-2支架序列至少80%相同的序列。在一些实施方案中,至少两种人工microrna核苷酸序列具有包含mir-196a-2支架序列或与mir-196a-2支架序列或截断的mir-196a-2序列至少80%相同的序列的支架序列。在一些实施方案中,在每种人工microrna核苷酸序列中,支架序列包含mir-196a-2支架序列或与mir-196a-2支架序列至少80%相同的序列。
15.根据第四实施方案,本发明提供了表达载体,其包含:(a)本发明的多重microrna基shrna编码区;(b)5’侧翼序列,其中所述5’侧翼序列是,例如,30到180个核苷酸长度,并且位于多重microrna基shrna编码区的上游;和(c)3’侧翼序列,其中3’侧翼序列是,例如,30到180个核苷酸长度,并且位于多重microrna基shrna编码区的下游。
16.在一些实施方案中,多重microrna基shrna编码区由编码多种mir-196a-2重复支
架的序列组成,这些重复支架的序列由相同或可变长度的接头分开。多个重复支架可以形成多重体,也称为shrna簇,其在每一个的3’和5’端上侧接,例如30个至180个核苷酸。簇可以位于启动子位点(例如rna聚合酶ⅱ依赖性启动子)的下游。作为非限制性实例,可能存在包含seq id no:31或与seq id no:31至少80%相同的序列,或seq id no:31截断版本的序列的支架的多重复制,其中截断版本在其5’端或3’端缺少1-6个核苷酸。
17.根据第五实施方案,本发明提供了降低一种或多种靶核苷酸(例如mrna)表达的方法。该方法包括向细胞或生物体施用本发明的多核苷酸或载体。
18.根据第六实施方案,本发明提供了抑制多种基因的方法,所述方法包括将表达载体引入细胞或生物体,其中表达载体包含本发明的多核苷酸。
19.根据第七实施方案,本发明提供了本发明的多核苷酸或载体作为药物的用途。
20.根据第八实施方案,本发明提供了包含本发明多核苷酸或载体的治疗细胞。
21.本发明的各种实施方案可用于减少和控制单种或多重基因的表达。各种实施方案赋予的效率可能有益于基础研究以及诸如医学的应用领域,包括但不限于体内和体外治疗、农业和生物生产。
附图说明
22.图1是本发明的载体的代表图。
23.图2是本发明的另一载体的代表图。
24.图3显示由具有六种不同支架的mirna的活性链和乘客链引起的沉默的柱状图。
25.图4显示用慢病毒颗粒转导的u2os细胞中的mrna表达水平的柱状图,所述慢病毒颗粒表达了靶向akt1、cdk5、ilk和ppib的多重microrna基shrna(moi=1)。
26.图5显示用慢病毒颗粒转导的u2os细胞中的mrna表达水平的柱状图,所述慢病毒颗粒表达了靶向cdc42、cttnb1、rac1和trim28的多重microrna基shrna(moi=1)。
27.图6显示用慢病毒颗粒转导的hek293t细胞中的mrna表达水平的柱状图,所述慢病毒颗粒表达了靶向cdc42、cttnb1、rac1和trim28的多重microrna基shrna(moi=1)。
28.图7显示在hek293t细胞中不同的多重microrna基shrna中cdc42、ctnnb1、rac1和trim28的基因表达水平的柱状图。
29.图8a和8b显示在hek293t细胞中使用多达12种microrna基shrna的多重体时基因表达水平的柱状图。
30.图9显示当具有mir-196a-2的多重体转导至人原代t细胞中时基因表达水平的柱状图。
31.图10显示当具有mir-196a-2的多重体转导至hek293t细胞中时基因表达水平的柱状图,包括具有不同长度的接头、没有接头或截断接头的mir-196a-2。
具体实施方式
32.现在将详细参考本发明的各种实施方案,其示例在附图中示出。在以下描述中,阐述了许多具体细节,以便提供对本发明的透彻理解。然而,除非另有说明或从上下文中隐含,否则这些细节旨在作为示例,不应被认为以任何方式限制本发明的范围。此外,结合各种或特定实施方案描述的特征不应被解释为不适合结合本文公开的其他实施方案使用,除
非上下文中明确陈述或暗示了这种排他性。
33.提供标题是为了方便读者,并不限制本文公开的任何实施方案的范围。
34.定义
35.除非另有说明或在上下文中隐含,否则以下术语和短语具有下面提供的含义。
[0036]“人工mirna基shrna”是包含茎环结构的“前体microrna(pre-mirna)或初级mirna(pri-microrna)”,其中茎环结构是衍生自特定内源性mirna的连续多核苷酸,其中茎环结构的茎包含活性链-乘客链双链体,其中活性链的序列不同于特定参考mirna的内源性活性链的序列。本公开的人工mirna基shrna的乘客链序列也不同于特定参考内源性mirna的内源性乘客链序列。
[0037]
活性链-乘客链双链体之外的人工mirna基shrna序列(即活性链-乘客链双链体任一侧的环和茎区域,可选地包括侧翼序列,如下文详述)在本文中被称为“mirna支架”、“支架部分”或简称为“支架”。因此,另一方面,本公开提供了有用于产生人工mirna基shrna序列的mirna支架。本公开的人工mirna基shrna序列包含衍生自(即,具有至少60%同一性,高达且包括100%同一性)特定内源性mirna的mirna支架,还包含不是衍生自该相同特定内源性mirna的活性链-乘客链双链体。本公开的单种mirna支架可用于提供几乎无限数量的不同的人工mirna基shrna序列,每种序列具有相同的mirna支架序列。尽管本公开引用活性链和乘客链,但是本领域普通技术人员将认识到这是惯例,并且包括当它们是同一多核苷酸的一部分时,例如单链多核苷酸或双链多核苷酸的相同链。
[0038]“活性序列”是指与靶序列部分或完全互补以及与乘客序列部分或完全互补的活性链序列。活性序列也可以称为成熟序列。在一些实施方案中,当细胞处理mirna或shrna序列时,活性序列可以将酶或分子复合物导向内源性靶分子(例如mrna)序列。
[0039]
短语“编码为(code for)”和术语“编码”是指一种序列包含与参考核苷酸序列具有同一性的序列、与参考核苷酸序列相当的dna或rna、或dna或rna或参考核苷酸序列的dna或rna互补序列。因此,当提到编码为或编码所述的dna序列的序列时,除非另有说明,意指下列任何一种序列:相同的dna序列、dna序列的互补序列、该序列相当的rna,或该序列的rna互补序列。
[0040]
术语“microrna”、“mirna”和“mir”可互换使用,并指能够进入rnai途径并调节基因表达的非编码rna。
[0041]
术语“短发夹rna”、“小发夹rna”和“shrna”可互换使用,并指人工设计的单链rna,该单链rna能够进入rnai途径并调节基因表达,还能够形成茎环结构。
[0042]“多重microrna基shrna”是指包含多种线性排列的人工microrna基shrna序列的序列。可选地,在多重microrna基shrna中,在人工mirna基shrna序列之间可以有接头序列。
[0043]“多重microrna基shrna编码区”是编码多重microrna基shrna的多核苷酸区域。
[0044]“多重体(multiplex)”是编码多种相同类型分子(例如多种sirna或shrna或mirna)的多核苷酸。在多重体中,当分子是相同类型时(例如,均为shrna),它们可以是相同的或包含不同的序列。在相同类型的分子之间,可能存在中间(intervening)序列,例如本文所述的接头,或者可能没有接头。本发明多重体的例子是编码多种串联的mirna基shrna的多核苷酸。多重体可以是单链的、双链的或者既有单链区域又有双链区域。
[0045]“核苷酸”是包含磷酸部分、核糖糖分子和含氮碱基的核糖核酸或脱氧核糖核酸。
如本领域普通技术人员将认识到的,在dna中,四种天然存在的碱基是腺嘌呤(a)、胞嘧啶(c)、鸟嘌呤(g)和胸腺嘧啶(t),而在rna中,碱基是a、c、g和尿嘧啶(u)。当从rna到dna时,a的补体是t,u的补体是a,当从dna到rna(即转录)时,t的补体是a,a的补体是u。除非另有说明,核苷酸可以是未修饰的或在其含氮碱基、糖或骨架的任何位置发生修饰。
[0046]“脱靶”效应是指除了预期基因之外的基因的沉默或转录减少,其中活性序列与预期基因具有足够的互补性。例如,脱靶效应可能部分或全部归因于乘客序列的沉默。另外或可选地,脱靶效应可能是由于细胞或生物体基因组内或一组表达的mrna内的内源性序列的相似性,所述表达的mrna与活性序列具有相同或不同程度上的互补性。
[0047]“乘客序列(passenger sequence)”是与活性序列部分或完全互补的shrna部分。乘客序列也可以称为星形序列(star sequence)。
[0048]“多核苷酸”是包含多种修饰或未修饰的核苷酸或其组合的分子。多核苷酸可以是rna、dna或其组合,以及单链或双链或同时包含单链区域和双链区域。在本发明的范围内,多核苷酸可以是包含所述序列或元件并编码多重体shrna的载体。多核苷酸或多核苷酸内的区域或序列的长度可以由核苷酸的数量来定义,核苷酸的数量理解为指连续核苷酸的数量。
[0049]
术语“预防”(prevent)、“预防”(preventing)、“预防”(prevention)是指在症状出现之前,使用或施用本发明的多核苷酸或载体,联用或不联用额外的多核苷酸、载体或其他化合物(如药物的活性成分)进行治疗,特别是对具有疾病或失调风险的患者。
[0050]“支架”是mirna中排除了mirna的活性序列和乘客序列的一部分。
[0051]“靶”是具有与活性序列部分或全部互补的dna或rna序列的分子。“靶序列”是活性序列对其具有所需互补水平的靶的序列,可以用dna的四种碱基(a、t、g和c)或rna的四种碱基(a、u、g和c)来描述。“靶生物体”是其中存在靶序列并且可以施用本文所述多核苷酸或载体的生物体。“生物体”是独立的动物、植物、多细胞或单细胞的生命形式。通常地,但非排他地,生物体是多细胞生物体。
[0052]“治疗细胞”是基于细胞向受试者提供治疗益处的能力而选用于或施用于受试者的细胞。可以是治疗性细胞的细胞例子包括但不限于任何真核细胞,例如植物、鸟类或哺乳动物,例如人类或其他动物的细胞。可以是治疗细胞的细胞类型包括但不限于造血干/祖细胞、记忆t细胞、调节t细胞、b细胞、巨噬细胞、诱导多能干细胞(“ipsc”),和不变自然杀伤t细胞。
[0053]
术语“治疗”(treat)、“治疗”(treating)、“治疗”(treatment)是指减轻或消除疾病或失调,或与疾病或失调相关的一种或多种症状,或减缓疾病或失调的进展(progress)。
[0054]
多重microrna基shrna编码区
[0055]
本发明的多核苷酸包含、基本上由或由多重microrna基shrna编码区组成。多重microrna基shrna编码区编码两种或多种人工mirna基shrna序列。每种人工mirna基shrna序列包含mirna支架序列、活性序列和乘客序列。在一些实施方案中,包含人工shrna序列的多重microrna基shrna编码区的每个部分能够形成茎环结构。在茎环结构中,活性序列和乘客序列至少(如果不是全部的话)构成茎的一部分。所述多重microrna基shrna编码区可以包含多种mirna基shrna,这些mirna基shrna相互裂解形成shrna,或者所述多重microrna基shrna可以被转录成microrna或者被复制并随后转录成microrna,这些microrna可以被加
工形成多种shrna。
[0056]
在一些实施方案中,多重microrna基shrna编码区编码多于两种人工mirna基shrna序列、多于三种人工mirna基shrna序列、多于四种人工mirna基shrna序列、多于五种人工mirna基shrna序列、多于六种人工mirna基shrna序列、多于七种人工mirna基shrna序列或多于八种人工mirna基shrna序列。在一些实施方案中,在多重microrna基shrna编码区中,存在二至十二种人工mirna基shrna序列、或二至十种人工mirna基shrna序列、或三至十种人工mirna基shrna序列、或三至八种人工mirna基shrna序列。在一些实施方案中,在一种多重microrna基shrna编码区内,有两种、三种、四种、五种、六种、七种、八种、九种、十种、十一种或十二种人工mirna基shrna序列。人工mirna基shrna序列的编码或序列可以在多核苷酸中以5’至3’或3’至5’线性排列。
[0057]
人工mirna基shrna序列的支架可以是天然存在的microrna支架或人工制造的支架,即与任何天然存在的支架的序列不具有同一性。在一些实施方案中,选择或设计一种、多于一种或所有的支架,使得对于其中编码的mirna,存在链选择偏差,这将允许活性链相比于乘客链具有更高的功能性。在一些实施方案中,这种偏差导致活性链的沉默比乘客链至少高20%、30%、40%。50%、60%、70%或80%。
[0058]
在一些实施方案中,一种或多种支架来源于天然存在的序列,因此尽管与天然存在的序列不相同,但一种或多种或每种支架具有与天然存在的支架序列至少80%、至少85%、至少90%或至少95%同一性的序列。作为非限制性实例,支架可以与以下mirna相同或衍生自以下mirna:mir-196a-2(hsa-mir-196a-2)、mir-26b(hsa-mir-26b)、mir-204(hsa-mir-204)和mir-126(hsa-mir-126)。用于本发明的其他的mirna支架序列可以与以下支架相同或衍生自以下支架:hsa-let-7f、hsa-let-7g、hsa-let-7a、hsa-let-7b、hsa-let-7c。hsa-mir-29a、hsa-mir-140-3p、hsa-let-7i、hsa-let-7e、hsa-mir-7-1、hsa-mir-7-2、hsa-mir-7-3、hsa-mir-26a、hsa-mir-26a、hsa-mir-340、hsa-mir-101、hsa-mir-29c、hsa-mir-191、hsa-mir-222、hsa-mir-34c-5p、hsa-mir-21、hsa-mir-378、hsa-mir-100、hsa-mir-192、hsa-mir-30d、hsa-mir-16、hsa-mir-432、hsa-mir-744、hsa-mir-29b、hsa-mir-130a或hsa-mir-15a支架。
[0059]
当支架不同于天然存在的支架时,这种相对于内源性mirna支架序列的差异可能是由于,例如一种或多种核苷酸的添加、缺失或取代(或其组合)。在一些实施方案中,可以使用或引入添加、缺失或取代,因为它们增强了mirna基shrna的功能性。在一些实施方案中,一种、多种或所有支架在其5’端和3’端中一者或两者被截断。当支架被截断时,截断量不应对支架的功能产生不利影响。例如,相对于支架的天然序列,从支架(例如mir-196a-2支架)的5’端、3’端或5’端和3’端两者截断一至六个、或一至五个、或四至六个、或四至五个核苷酸。
[0060]
在多重microrna基shrna编码区内,每种人工mirna基shrna序列的支架,其mirna基shrna编码区所编码可以是相同的,或者它们中的至少两种所编码可以是不同的,或者它们中的每一种所编码可以是不同的。此外,在一些实施方案中。支架可以随机排列,或者基于支架本身或活性序列的尺寸,或者基于支架和活性序列的组合长度(例如,从最大至最小,或者相反),或者靶基因表达的普遍程度(例如,从最普遍至最不普遍,或者相反),或者按照gc含量排列。
[0061]
在多重microrna基shrna编码区内,每种人工mirna基shrna序列的活性序列可以相同,或者至少两种不同,或者每种不同。如果两种序列不相同,则它们是不具有同一性的。因此,在最大比对的条件下,序列之间至少有一种差异(添加、取代或缺失)。在一些实施方案中,在最大比对的条件下,不超过95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、40%或35%的核苷酸是相同。
[0062]
在一些实施方案中,每种活性序列的长度为18-40个核苷酸,或18至35个核苷酸长度,或20至30个核苷酸长度。每种乘客序列可以与活性序列的长度相同,也可以更短或更长(从而导致凸起),在一些实施方案中,每种乘客序列的长度为18-40个核苷酸长度,或18至35个核苷酸长度,或20至30个核苷酸长度。在一些实施方案中,每种乘客序列与其对应的活性序列100%互补,或者与其对应的活性序列至少80%、至少85%、至少90%或至少95%互补。
[0063]
在一些实施方案中,在活性序列和乘客序列之间存在至少一种错配。例如,在一种或每种人工mirna基shrna核苷酸序列中,乘客序列可以与活性序列互补,但除了以下:活性序列的位置1编码t或u和乘客序列中相对的核苷酸编码g,由活性序列和乘客序列形成的双链体在活性序列的位置12含有错配,以及要么没有额外的错配或摆动对,要么在位置5、18、19、20、21、22或23中的一个或多个有错配或摆动对并且在双链体活性序列的位置2、3、4、6-11和13-17的任一个都没有错配或摆动对,其中活性序列的位置相对于活性序列的5’端进行编号,并且可选地其中双链体的活性序列的长度在约19至25个核苷酸之间。
[0064]
优选地,每种活性序列被设计成与靶序列至少80%、至少85%、至少90%或至少95%互补。在一些实施方案中,在多重体中,每种活性序列可以与对应于不同靶分子区域的靶序列互补。在其他实施方案中,两种或多种活性序列可以与相同靶序列互补,或者与相同靶分子的部分重叠靶序列互补,或者与相同靶分子的非重叠靶序列互补。在其他实施方案中,所有活性序列可以与相同靶序列互补,或者与相同靶分子的部分重叠靶序列互补,或者与相同靶分子的非重叠靶序列互补。例如,靶序列可以对应于dna序列,例如染色体或线粒体dna的区域;或rna序列,例如mrna序列或其区域;或病毒核苷酸序列或其区域。靶序列是其一部分的较大dna序列或rna序列可以位于靶分子上,例如染色体、线粒体dna或rna分子,例如mrna。
[0065]
多核苷酸可以是单链或双链的。当其是双链时,第一条链可以包含所有人工mirna基shrna序列和任何接头序列(如果存在),在一些实施方案中,第二条链包含与每种人工mirna基shrna序列和每种接头序列(如果存在)互补的序列。在多核苷酸是双链的其他实施方案中,第二条链不包含与第一条链上的任何人工mirna基shrna序列互补的任何序列。在后一种的实施方案中,在多核苷酸内,人工mirna基shrna序列可以形成发夹或茎环结构,编码活性序列的区域和编码乘客序列的区域形成茎环结构的部分或全部茎。在不包含与人工mirna基shrna序列互补的序列的第二条链中,可能存在也可能不存在与一种或多种或所有接头序列(如果存在)和/或侧翼序列(如果存在)互补的序列。
[0066]
接头
[0067]
在一些实施方案中,没有接头,支架彼此紧邻。在其他实施方案中,在至少两种或每对连续的人工mirna基shrna序列之间是接头序列。因此。如果有x种人工mirna基shrna序列,将有多达y种接头序列,其中x≥2且y=x-1。在一些实施方案中。接头(如果存在),它的
长度可以是1-60个核苷酸、30-60个核苷酸,或者40-50个核苷酸。在一些实施方案中,接头较短,例如是6个或更少的核苷酸或者4个、5个或6个核苷酸。在一些实施方案中,存在具有六个或更少核苷酸的接头,并且从支架的5’端和3’端中一者或两者截断多达六个核苷酸。作为非限制性实例,每种接头可以是4至6个a核苷酸或4至6个c核苷酸或4至6个g核苷酸,或4至6个u核苷酸,或a、g、c或u核苷酸的任何组合。
[0068]
在一些实施方案中,构建至少一种、至少两种或所有接头,以使接头与它将被导入的生物体或细胞中天然存在的核苷酸序列杂交的可能性最小化。在一些实施方案中,接头序列与任何天然存在的序列既不具有同一性也不互补。在一些实施方案中,接头与引入本发明多核苷酸或载体的生物体或细胞中任何天然存在的序列具有同一性或互补的程度不超过95%、或90%、或85%、或80%、或75%、或70%、或65%、或60%、或55%、或50%、或45%、或40%。
[0069]
在一些实施方案中,在连续的人工mirna基mirna序列之间,仅存在接头序列,不存在中间序列或其他序列。在其他实施方案中,可以存在其他的序列。在本发明的多核苷酸中,当存在两种或多种接头时,两种或多种接头可以是相同的,或者两种或多种接头可以是不同的,或者所有接头可以是相同的或者每种接头可以是不同的。
[0070]
在一些实施方案中,每种接头序列包含或由以下序列组成:与选自由seq id no:1至seq id no:16组成的组的序列100%相同或互补的序列,或者与选自seq id no:1至seq id no:16的序列至少80%、至少85%、至少90%或至少95%相同或互补的序列。对于核酸,当使用a%同一性(例如,80%相同)时,这通常应被解释为在最大比对下,在连续参考序列的整个长度上具有同一性,而不是在它的一小部分上或者在非连续的延伸上具有同一性。因此,如果一个序列在全长上具有80%同一性,那么它与参考序列只有80%的同一性,例如,在一段延伸上5个核酸残基中有4个是具有同一性的。
[0071]
侧翼序列
[0072]
在本发明的一些实施方案中,多重microrna基shrna编码区的两侧是5’侧翼序列和/或3’侧翼序列。作为非限制性实例,这些侧翼区域中的每一个的长度可以是30至180个核苷酸、或50至160个核苷酸、或80至120个核苷酸。
[0073]5’
侧翼序列的例子包括包含、基本上由或由seq id no:17-seq id no:19或其互补序列组成的序列,以及与seq id no:17-seq id no:19或其互补序列具有至少80%、至少85%、至少90%、至少95%或至少98%同一性的序列。
[0074]3’
侧翼序列的例子包括包含、基本上由或由seq id no:20-seq id no:22或其互补序列组成的序列,以及与seq id no:20-seq id no:22或其互补序列具有至少80%、至少85%、至少90%、至少95%或至少98%同一性的序列。
[0075]
mir-196a-2多重体
[0076]
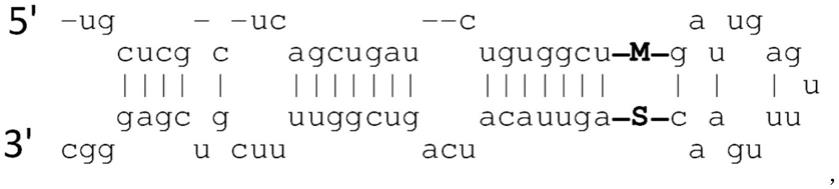
在一些实施方案中,存在一种或多种人工mirna基shrna序列,其包含与mir-196a-2相同或衍生自mir-196a-2的序列。在一些实施方案中,至少一种、至少两种或所有支架包括(seq id no:31):
[0077][0078]
其中m是成熟序列(也称为活性序列),s是星形序列(也称为乘客序列)。在一些实施方案中。每种人工mirna基shrna核苷酸序列由(seq id no:32)定义:ugcucgcuca gcugaucugu ggcunnnnnn nnnnnnnnnn nnngauugag uuuugaacnn nnnnnnnnnn nnnnnnnagu uacaucaguc gguuuucguc gagggc。
[0079]
在一些实施方案中,在至少一种人工mirna基shrna核苷酸序列中,支架序列包含mir-196a-2支架序列或者与mir-196a-2支架序列或截断的mir-196a-2支架序列具有至少80%、至少85%、至少90%或至少95%同一性的序列。在这些实施方案中的一些中,在至少两种人工mirna基shrna核苷酸序列中,支架序列包含mir-196a-2支架序列或者与mir-196a-2支架序列或截断的mir-196a-2支架具有至少80%、至少85%、至少90%或至少95%同一性的序列。在一些实施方案中,每种人工mirna基shrna核苷酸序列包含mir-196a-2支架序列或者与mir-196a-2支架序列或截断的mir-196a-2支架序列具有至少80%、至少85%、至少90%或至少95%同一性的序列。
[0080]
在一些实施方案中,本发明的多重体在载体中被编码,所述载体也编码mirna模拟物。mirna模拟物的编码可以位于多重体编码的上游或下游。此外,mirna模拟物的表达可以在多重体转录物的同一转录物中,或在单独的转录物中。mirna模拟物的例子包括但不限于西格玛奥德里奇公司(sigma-aldrich)的人mirna模拟物、达尔曼康公司(dharmacon,inc)的microrna模拟物、凯杰公司(qiagen)的mirna模拟物和美国生命技术公司(life technologies)的mirvana
tm
模拟物。模拟物可以与mirna相同或与mirna至少80%相似,至少90%相似或100%相似。
[0081]
载体
[0082]
本发明的各种实施方案涉及使用单链或双链载体来递送和/或表达本发明的多核苷酸,例如编码多种mirna基shrna的多重体盒。这些载体可以包括,基本上由,或者由dna、rna或dna/rna杂交体组成。载体的例子包括但不限于质粒、小环dna(mini-circle dna)、闭合线性dna(也称为dna)、体外转录或合成的rna或信使rna、以及病毒载体。病毒载体的例子包括但不限于腺病毒载体、痘苗病毒载体、逆转录病毒载体、腺相关病毒载体、单纯疱疹病毒载体、仙台病毒载体和塞姆利基森林病毒载体。
[0083]
图1显示了本发明的载体设计100,其中在表达目的基因(“goi”)、选择标记或报告子或其组合的慢病毒载体内,跟随有多重microrna基shrna盒。按照5’到3’的顺序,所示的载体包含5’长串联重复(ltr)序列110、逆转录病毒psi包装元件105、反向应答元件(rre)120、pol ii启动子位点130、goi序列140、本发明的多重microrna基shrna 150、土拨鼠肝炎病毒(whp)转录后调节元件(wpre)155,和3’sin(自失活)ltr序列160。
[0084]
图2显示了本发明载体内的多重体盒的例子。多重体盒250的上游是pol ii启动子230和5’侧翼序列275。盒的下游是3’侧翼序列295。在盒内是编码为多重microrna基shrna
的序列,该序列靶向第一序列280以及1-10重复支架单元序列290(靶向不同的序列)和一种或多种接头285。
[0085]
将本发明的盒(例如多核苷酸)插入载体并产生包含盒的载体的方法为本领域普通技术人员所熟知。例子包括使用合成法或酶法产生盒以及使用限制性酶和连接酶插入盒。产生载体方法的具体实例描述于fowler et al.,improved knockdown from artificial micrornas in an enhanced mir-155 backbone:a designer's guide to potent multi-target rnai,nucleic acids research,2016,vol.44.no.5,其全部公开内容通过引用并入本文。
[0086]
递送
[0087]
本发明的多核苷酸和载体的递送可以是主动或被动的。在一些实施方案中,选择和设计载体以靶向受体或某些类型的细胞。因此,它们可以与特定选择的抗原复合、结合或被特定选择的抗原包封。此外,可以通过体外或体内递送,并且可以是向细胞或生物体递送。递送的例子包括转导和转染的标准技术。参见,例如,liu et al.,inhibition of hiv-1 by multiple sirnas expressed from a single microrna polycistron,nucleic acids research,2008,vol.36,no.9,2811-2824;choi et al.,multiplexing seven mirna-based shrnas to suppress hiv replication,american society of gene and cell therapy,vol.23.no.2,310-320,feb.2015。这两篇参考文献的全部公开内容通过引用并入本文。
[0088]
此外,递送可以通过使用载体的外泌体/胞外囊泡包封或与纳米颗粒结合来完成。这些技术描述于hundry,e.et al.,exosome-associated aav vector as a robust and convenient neuroscience tool,gene therapy 23.380-392(2016)和riley,michael k.,recent advances in nanomaterials for gene delivery-a review,nanomaterials,2017may;7(5):94,这两篇文献的公开内容通过引用并入本文。
[0089]
药物
[0090]
在各种实施方案中,本发明涉及用于表达本发明多核苷酸或载体的药物。此外,本发明的各种实施方案提供了本发明的载体和多核苷酸作为药物的用途。药物可以主动或被动施用,并且可以单独施用或与一种或多种其他多核苷酸、载体、活性成分和/或非活性成分共同施用。如下所述,该药物可用于治疗癌症、遗传性和变性疾病、传染病、自身免疫性疾病等。
[0091]
细胞
[0092]
本发明的多核苷酸和载体可以被引入或用于所需的细胞类型,其可以称为靶细胞。因此,在各种实施方案中,本发明涉及能够表达本发明载体或多核苷酸的治疗细胞。
[0093]
例如,可以基于待治疗的疾病或失调来选择靶细胞。一种或多种细胞可以衍生自、获得于或包含于人体或人以外的动物(例如,任何哺乳动物,如灵长类动物)。人靶细胞的例子包括但不限于肝细胞、胰腺细胞、骨骼肌细胞、成纤维细胞、视网膜细胞、滑膜关节细胞、参与听觉过程的细胞、肺细胞、t细胞、b细胞、巨噬细胞、nk细胞、神经元、胶质细胞、干细胞(包括ipsc)、内皮细胞和癌细胞。在一些实施方案中,细胞来源于细胞系或ips细胞。
[0094]
可以提供含有本发明多核苷酸或载体的细胞,用于治疗或诊断药物的制造和/或开发。此外,可以提供含有本发明多核苷酸或载体的细胞,用于制造治疗或预防疾病、失调
或病症的药物。在一些实施方案中,提供了含有本发明多核苷酸或载体的细胞,用于制造和/或开发用于医学的药物或疫苗,例如用作药物。
[0095]
在一些实施方案中,本发明涉及通过将本发明的载体或多核苷酸引入细胞系来转化细胞系。
[0096]
在其他实施方案中,本发明涉及根据本发明的细胞系在制造用于治疗疾病、失调或病症的药物中的用途,其中细胞系包含本发明的多核苷酸或载体。
[0097]
用于与本发明有关的细胞系可以,例如选自商业供应商或由本领域普通技术人员开发的细胞系,和/或根据需要治疗的受试者进行筛选和开发。细胞系的例子包括但不限于u2os、hek293t、hek293、hela、a549、lovo、pc6、pc12、nih/3t3和cho以及体内和体外细胞。
[0098]
此外,本发明的各种实施方案还提供了根据本发明用于治疗的任何其他实施方案生产或使用的细胞系。在一个实施方案中,本发明设计用于产生治疗性细胞(如car t细胞)的方法。car t细胞可以衍生于原代t细胞,或分化于干细胞。合适的干细胞包括但不限于哺乳动物干细胞,如人干细胞,包括但不限于造血、神经、胚胎、诱导多能干细胞(ipsc)、外胚层、内胚层、间胚层、肝脏、胰腺、肌肉和视网膜干细胞。其他干细胞包括但不限于哺乳动物干细胞,例如小鼠干细胞,如小鼠胚胎干细胞。
[0099]
在各种实施方案中,本发明的多核苷酸或载体可用于敲除各种类型的细胞或细胞系中单种基因或多种基因的表达,包括但不限于来自哺乳动物的细胞。该技术可用于敲除基因,通过使非宿主细胞对宿主无免疫原性或耐受宿主攻击来预防移植物抗宿主病。这些基因包括但不限于主要组织相容性复合体(mhc)基因,包括共受体(hla-f、hla-g)、抗原呈递分子(26种ⅰ类和24种ⅱ类基因)、固有免疫应答(mica、micb、hcp5)、炎症(nkbbil、lta、tnf、ltb、lst1、ncr3、aif1)、免疫受体(ly6)、热休克蛋白(hspa1l、hspa1a、hspa1b)、补体级联、调控受体(notch4)、抗原处理(tap、hla-dm、hla-do)和肽转运(ring1)。
[0100]
该技术也可用于敲除与免疫细胞(如t细胞和nk细胞)自相残杀有关的基因,或者提醒患者或动物的免疫系统有外来细胞、颗粒或分子进入患者或动物体内的基因,或者编码蛋白质的基因,所述蛋白质是用于损害或增强免疫反应的当前治疗靶,例如cd52、ctla4、cd47、havcr2、cd274、cd95、a2ar、cd7、tet2、ccr6、pd1和pdcd1。该技术也可用于产生用作疾病模型或基因功能研究的转基因动物。
[0101]
抑制基因
[0102]
在各种实施方案中,本发明提供了抑制一种或多种靶基因的方法。在一些实施方案中,两种或多种或所有靶基因的表达降低到低于载体不表达时表达的60%、50%、40%、30%、20%或10%的水平。该方法包括施用和/或致引本发明的多核苷酸或载体的表达。这些方法可以在体外或体内进行。
[0103]
治疗性应用
[0104]
在一些实施方案中,本发明提供了治疗应用,例如基因治疗,包括但不限于疾病和失调的治疗。例如,本发明的各种实施方案可用于治疗癌症。在这些应用中,由本发明的多重体产生的shrna可以用于下调涉及肿瘤存活和进展、转移或耐受化学或免疫疗法的基因的表达。根据本发明可以治疗的癌症的例子包括但不限于卵巢癌、乳腺癌、胃癌、黑色素瘤、胰腺癌、结直肠癌、宫颈癌、胶质瘤、多发性骨髓瘤、骨肉瘤、肺癌、肝癌、前列腺癌、白血病和淋巴瘤。
[0105]
shrna的潜在应用还包括但不限于治疗或预防遗传性和变性疾病,如:阿尔茨海默病、帕金森氏病、亨廷顿氏病、眼咽肌营养不良、肌小管性肌病、肌强直性营养不良、家族性心肌病、海绵样脑白质营养不良、色素性视网膜炎、马查多-约瑟夫病、索斯比眼底营养不良、血红蛋白病,肌萎缩性脊髓侧索硬化(als)。进一步的例子,包括年龄相关性黄斑变性、淀粉样变性病和高脂血症。
[0106]
通过使用本文所述的技术,感染性疾病也可以从使用shrna进行基因下调中获益。例子包括但不限于乙型肝炎、丙型肝炎、人乳头瘤病毒感染(和预防与hpv相关的宫颈癌)、人类免疫缺陷病毒、冠状病毒等。
[0107]
其他潜在的治疗应用还可能包括但不限于以下的治疗:预防心血管疾病中的新生内膜形成、抗血栓形成、改善神经性疼痛、治疗眼部疾病、减少或治疗神经元损伤、预防或减少移植物抗宿主病(例如,产生用于癌症治疗的同种异体细胞,如car t细胞)、诱导多能干细胞、治疗自身免疫性疾病(如ⅰ型糖尿病、狼疮、类风湿性关节炎和多发性硬化症),以及自闭症谱系障碍和其他发育障碍(如脆性x综合征)。通过使用沉默和替代方法,本发明还可用于治疗涉及常染色体基因突变的疾病,例如囊性纤维变性、着色性干皮病和马凡综合征。在这种方法中,使用突变基因序列特异性的shrna敲除突变基因。被敲除的基因同时被野生型、功能型基因所取代。
[0108]
生物生产
[0109]
生物生产是指基于生物制品的治疗药物的生产,包括但不限于基于蛋白质的治疗药物、疫苗、基因治疗药物以及细胞治疗药物。通过本发明的各种实施方案,可以产生可用于提高生物制品产量和/或提高、增加或增强生产生物制品的细胞的性能和成活力性的shrna。这些细胞包括但不限于中国仓鼠卵巢(cho)、幼仓鼠肾(bhk21)、鼠骨髓瘤细胞(ns0和sp2/0)、人胚胎肾293(hek 293)、纤维肉瘤ht-1080、人和昆虫细胞。
[0110]
涉农产业
[0111]
涉农产业是指农业生产产业。通过本发明的各种实施方案,可以生产shrna用于通过工程化抗疾病的动物或改善生长或其他性状(如肌肉质量)来改善原料。
[0112]
实施例
[0113]
在下面的实施例中,使用了下面描述的实验方案:
[0114]
多重microrna基shrna克隆
[0115]
载体是通过标准分子生物学方案产生的。通过连接多个退火的双链5
’‑
磷酸化寡核苷酸克隆多重microrna基shrna盒,双链5
’‑
磷酸化寡核苷酸带有3至7个核苷酸的悬臂,悬臂与载体骨架的侧翼双链寡核苷酸的悬臂互补。使用t4dna连接酶进行连接。通过sanger测序法验证克隆。
[0116]
慢病毒颗粒
[0117]
使用反式慢病毒shrna包装系统(horizon discovery/dharmacon)在hek293t细胞中产生慢病毒颗粒。通过流式细胞术测定转导72小时的hek293t细胞中绿色荧光阳性细胞的数量,来评估包装的慢病毒颗粒的滴度。滴度按下式计算:滴度=[f
×
(co/v)]
×
d,其中f为流式细胞仪测定的gfp阳性细胞的相对频率,co为培养孔中靶细胞的初始数量,v为接种量的体积,d为病毒稀释因子。只使用其中gfp+细胞的频率等于或高于2但等于或低于20%的培养孔进行滴度计算。
[0141][0142]
如表ⅲ所示,将表ⅱ的人工mirna基shrna组合成含有多重microrna基shrna的载体。
[0143]
表ⅲ[0144]
[0145][0146]
*在表ⅲ中,接头编号标识了表ⅰ的序列id no;5’和3’侧翼序列编号标识每种载体中使用的序列id no的组合。
[0147]
实施例2:支架
[0148]
利用载体对功能性和脱靶效应进行比较,每种载体包含具有成熟(活性)和引导(乘客)序列的单一支架。支架为:mir-196a-2、mir-30a、mir-26b、mir-196a-2、mir-204以及mir-126。作为对照,也采用不含mirna序列的载体进行了测量。
[0149]
从hela细胞分离的基因组dna中通过pcr扩增得到内源性microrna,其包括200-300bp侧翼的茎环区域。将microrna克隆到载体中,在cmv启动子和序列验证下共表达microrna和gfp。转染前一天,将hela细胞以10000个细胞/孔接种于96孔板,microrna表达质粒(60ng)与双荧光素酶报告质粒(psicheck2(promega);40ng)共转染,双荧光素酶报告质粒在renilla荧光素酶3’utr中含有活性链-靶序列或乘客链-靶序列的。数据按不含microrna插入物(仅载体)的克隆载体与具有相应靶序列的psicheck2质粒的共转染进行归一化,并进一步按萤火虫荧光素酶表达进行归一化,以计算敲除效率。
[0150]
如图3中的数据所示,每种载体的活性链导致了mir-196-1、mir-30a、mir-26b、mir-196a-2、mir-204和mir-126的至少50%沉默。载体的乘客链显示出不同程度的沉默。在mir-26b、mir-196a-2和mir-204中,活性链和乘客链之间的差异最大。
[0151]
实施例3:用指向ppib、ilk、cdk5和akt1的多重载体进行基因敲除
[0152]
将多重microrna基shrna载体转导到u2os细胞中,并通过rt-qpcr分析基因敲除。在多重体中编码的shrna设计为靶向ppib、ilk、cdk5和akt1。(见表ⅱ的seq id no:23-26和表ⅲ的sv01-sv15)
[0153]
图4提供了mrna表达(感染复数(moi)=3)。这些结果表明,在u2os细胞中几乎所有多重microrna基shrna设计都实现了≥70%的敲除。此外,这些结果表明,在盒中shrna的位置不影响功能,并且在使用两种或四种多重microrna基shrna的设计中沉默没有差异。
[0154]
实施例4:用指向cdc42、cttnb1、rac1和trim28的多重载体进行敲除基因
[0155]
将多重microrna基shrna载体转导到u2os细胞中,并通过rt-qpcr分析基因敲除。在多重体中编码的shrna设计为靶向cdc42、cttnb1、rac1和trim28。使用在载体设计sv03(sv19、sv20、sv21)和sv09(sv22、sv23、sv24)中的接头构建载体(见表ⅱ的seq id no:27-30和表ⅲ的sv19-sv24)。通过改变shrna在盒中的位置,为每组四种基因靶构建了三种载体。还测试了单种mirna基shrna。
[0156]
图5提供了用于单种、sv19、sv20、sv21、sv22、sv23和sv24(见表ⅲ)的mrna表达(感染复数(moi)=1)。图6提供了在经转导hek293t细胞中用于单种、sv19、sv20、sv21、sv22、sv23和sv24(见表ⅲ)的mrna表达(感染复数(moi)=1)。这些结果表明,在两种细胞系中,所有载体均独立于shrna位置而影响有效的基因敲除活性。结果还示出了,使用基于序列选择的所述接头时沉默的有效性。
[0157]
实施例5:具有不同支架的多重体
[0158]
将包含靶向cdc42、ctnnb1、rac1和trim28的活性序列的多重microrna转导到hek293t细胞中。在多重体sv47中,所有支架均为mir196a-2(表ⅳ)。在所有其他多重体中,有两种或更多种不同的支架(表
ⅴ
)。除了载体sv81,在每种载体内,支架之间存在长度为6-14个核苷酸的接头。在sv81中,不存在接头。结果如图7所示。如图所示,仅具有mir-196a-2支架的载体始终比具有所有其他支架表现得更好,并且只有在sv47中,所有支架都是mir-196a-2,所有四种靶的基因都受到抑制。此外,当载体包含不同的支架时,缺少接头会出现问题。
[0159]
表ⅳ[0160][0161][0162]
表
ⅴ
[0163][0164]
实施例6:多重体中的多种支架
[0165]
构建了包含4至12种连续mir-196a-2支架的多重microrna。每种支架包含活性序列,活性序列靶向akt1、cdk5、ilk、ppib、cdc42、ctnnb1、rac1、trim28、chuk、hif1a、prkdc和rps6ka3中的一种。多重体被转导到hek293t细胞中。如图8a和8b所示,用具有多种mir-196a-2支架的多重体进行转导,一致地显示出基因抑制作用。
[0166]
实施例7:t细胞中的多重体
[0167]
构建了包含4种连续mir-196a-2支架的多重microrna基shrna。每种支架包含活性序列,活性序列靶向cdc42、ctnnb1、rac1和trim28中的一种。多重体被转导到人原代t细胞中。如图9所示。与对照(ntc)相比,用具有多种mir-196a-2支架的多重体进行转导,显示出对所有四种基因表达的有效降低。
[0168]
实施例8:没有接头和短接头
[0169]
构建了具有4种mir-196a-2支架的其他shrna多重体,这些支架包含针对prkdc、chuk、rps6ka3和hif1a的活性序列。构建这些多重体来评估在具有短接头或没有接头的情况下基因敲除的性能。结果表明,当使用mir-196a-2支架时,在短接头或没有接头的情况中如果不如长接头好,则表现相似(见图10)。
[0170]
如下所述,构建了具有接头或截断mir-196a-2支架的其他shrna多重构建物:
[0171]
sv53:6核苷酸长度的接头
[0172]
sv54:没有接头
[0173]
sv55:截断2个核苷酸(5’和3’端各1个核苷酸)
[0174]
sv56:截断6个核苷酸(5’和3’端各3个核苷酸)
[0175]
sv57:截断12个核苷酸(5’和3’端各6个核苷酸)
[0176]
sv58:截断16个核苷酸(5’和3’端各8个核苷酸)
[0177]
对于sv53(6个核苷酸长度接头)和sv54(没有接头),对所有四种基因均能有效沉默。每种基因相对于对照均沉默至低于60%的表达水平,这反映了正常的基因表达。
[0178]
对于sv55(截断2个核苷酸),四种靶中每一种基因沉默表达水平在对照的20%到45%之间。对于sv56(截断6个核苷酸),四种靶中每一种的基因表达水平降低到对照的35%到65%之间的水平。
[0179]
相比之下,对于sv57(截断12个核苷酸),只有一种靶(prkdc)被沉默到低于60%的水平,对于sv58(截断16个核苷酸),没有靶被沉默到低于对照60%的水平。
[0180]
因此,mir-196a-2支架可以承受在其5’和/或3’端截断少于6个核苷酸,而不影响多重体功能,并且所有四种基因的表达相对于对照(ntc)均降低到低于60%(见图10)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1