在超声治疗期间针对动态改变的介质的偏差校正的制作方法
在超声治疗期间针对动态改变的介质的偏差校正
1.相关申请
2.本技术要求于2019年7月25日提交的美国临时专利申请no.62/878,481的优先权和利益,其全部公开内容在此通过引用并入本文。
技术领域
3.本发明总体涉及超声治疗,具体涉及用于校正在超声治疗期间由动态改变的介质引起的偏差的系统和方法。
背景技术:
4.诸如良性或恶性肿瘤之类的组织、器官或其他身体部位可以通过以外科手术方式去除组织来进行侵入式治疗,或者通过使用例如热消融而具有最小的侵入或完全是非侵入式的。两种方法可以有效地治疗特定的局部情况,但是涉及用于避免破坏或损伤其他健康组织的精细的过程。
5.可以使用经聚焦的超声来实现的热消融对于治疗由健康组织或器官包围或邻近健康组织或器官的病变组织具有特别的吸引力,因为超声能量的影响可以限制在明确界定的目标区域。由于相对短的波长,超声能量可以聚焦到具有仅几毫米的截面的区域(例如,在一兆赫兹(1mhz)下截面小至1.5毫米(mm))。此外,因为声能通常很好地穿过软组织,所以介入的解剖结构通常不对限定期望的聚焦区域形成阻碍。因此,超声能量可以聚焦在小的目标,以使病变组织消融,同时使对周围的健康组织损伤最小化。
6.为了使超声能量聚焦在期望的目标,可以将驱动信号发送到具有许多换能器元件的声换能器,使得在聚焦区域处产生相长干涉。在目标处,可以传送足够的声强,以对组织加热,直到发生坏死,即直到组织被破坏。优选地,聚焦区域外部的沿着声能经过的声路径(“经过区域”)的非目标组织暴露于低强度声束,因此如果受到任何加热也将是仅受到最少地加热,由此使对聚焦区域外部的组织的损伤最小化。
7.通常,根据治疗计划,经常基于目标的预定义模型和病人的解剖结构来传送超声能量。在治疗期间,使用例如磁共振成像(mri)设备监测在目标处的温度。如果所测量的温度低于用于坏死的期望的目标温度,则增大从换能器发射的超声能量。然而,在一些情况下,在目标处的温度对已增大的超声能量没有响应。例如,穿过经过区域中的非目标组织的超声波束可能由于在超声期间超声能量的吸收而引起的非目标组织的性质的改变而散焦;因此,增大声能可以不显著地增大散焦波束在目标区处的强度。
8.因此,对在超声过程期间考虑由非目标组织吸收的超声能量的影响以提高目标治疗的效率同时避免对非目标组织的损伤的方法存在需求。
技术实现要素:
9.本发明的各实施例提供系统和方法,用于在超声期间考虑由非目标组织吸收或折射的超声能量的影响,并且基于此,动态地调整一个或多个超声参数值,以实现除了目标区
处的温度以外的附加目的(例如,最佳聚焦、声耦合的匹配等)。在一些实施例中,在超声过程以前和/或在超声过程期间建立数据结构(例如,自动聚焦校正表),所述数据结构使多个温度值和与每个换能器元件相关联且与在目标处生成最佳焦点(或其他目的)相关的对应的超声参数值(例如,频率、幅度、相位等)关联。附加地或备选地,在一些实施例中,使用超声参数的值的改变而不是值本身。例如,颅中的温度改变可以与一个或多个超声参数值(例如,相位)的改变关联,即相位偏差的改变以已知的方式取决于颅温度的改变。因此,当颅温度从基线水平上升到新水平时,该改变预测相位偏差,可以通过查找自动聚焦校正表对相位偏差进行相应地校正。因此,测量的值可以是参数(例如,温度)的值或参数值的改变;并且参数可以与目标本身或预测目标处的效果的另一区域(例如,颅)关联。
10.自动聚焦校正表可以通过以下操作来建立:在目标区处生成和/或引入声反射器(例如,微泡),并且测量和分析从声反射器反射的信号。在超声过程期间,基于建立的自动聚焦表和(例如,使用mri)实时测量的和/或使用物理模型预测的温度,可以确定用于在目标区处生成最佳焦点的对应的超声参数值。在一些实施例中,在超声过程期间实时地测量目标区和/或非目标区中的温度分布;基于温度分布和换能器元件的几何结构,可以确定沿着从换能器元件中的每一个换能器元件到目标区的声路径的非目标组织(例如,颅)中的特定温度值(例如,温度升高)并且将其与对应的换能器元件相关联。然后可以确定与每个换能器元件相关联的用于补偿由沿着到目标的波束路径的温度升高而引起的偏差的超声参数值。在治疗期间,可以基于使用自动聚焦表确定的参数值和/或与换能器元件相关联的特定温度值来启用换能器元件。在各实施例中,在生成最佳焦点之后,换能器元件中的至少一些换能器元件的功率可以增大,以使目标处的温度上升到用于组织坏死或其他治疗效果的期望的目标温度。
11.要注意的是,温度仅是这样的一个参数:该参数的改变预测超声参数值(例如,频率、幅度和/或相位)的对应的改变(由于声性质的改变),并且此外,测量的值无需在目标处,即使目标是感兴趣的区域。其他参数(例如,组织灌注的改变、成腔(cavitation)事件的数量、目标区/非目标区中吸收的累积能量、超声处理的数量、超声处理之间的时间间隔、mri图像的对比度、作为时间的函数的温度轮廓、从位于经过区域中的介入组织(例如,颅)反射的声信号的幅度和/或相位等)是这样的参数:所述参数的改变可以与超声参数值的对应的改变(由于目标组织和/或非目标组织的声性质的改变)可预测地关联,并且因此所述其他参数在本发明的范围内。因此,应该理解的是,可以通过使这些参数中的一个或多个参数的值(或值的改变)和与每个换能器元件相关联的用于在目标处生成最佳焦点(或其他目的)的超声参数值(或其中的改变)关联来建立本文描述的数据结构。
12.因此,本发明的各实施例在调整用于治疗目标组织的超声参数值以前,调整与一个或多个换能器元件相关联的一个或多个超声参数值,以实现最佳聚焦或其他目的(例如,声耦合的匹配等)。以这种方式,在增大目标处的温度以前,可以正确地考虑在超声过程期间由施加声能引起的目标组织/非目标组织上的效果(例如,散焦、声耦合的失配等)。因此,该方法可以在焦点处生成用于治疗目的且同时避免对位于路径区域中的非目标组织的损伤的充分的声能和强度,由此有利地提高在目标处的治疗效率和在非目标组织区中的安全性两者。
13.因此,在一个方面,本发明涉及用于在目标区的治疗期间向目标区传送超声能量
的系统。在各实施例中,所述系统包括:具有多个换能器元件的超声换能器;以及控制器,被配置为:(a)在治疗以前填充数据结构,该数据结构使多个实时参数值和与一个或多个换能器元件相关联的、用于至少在目标区的第一部分中生成声能的聚焦区域的一个或多个超声参数值(例如,频率、相位和/或功率电平)的对应的校正值关联;(b)在治疗期间,(i)预测或引起对目标区的第二部分或非目标区中的一个或多个实时参数值的测量;(ii)至少部分地基于所预测或测量的实时参数值和数据结构的内容,确定超声参数值的校正值;以及(iii)至少部分地基于所确定的校正值来启用换能器元件,以在目标区的第二部分中生成聚焦区域。在一个实施方式中,控制器还被配置为在治疗期间重复步骤(i)至步骤(iii)。
14.在一些实施例中,数据结构中的实时参数值中的每一个表示相关联的实时参数的值的改变。相关联的实时参数可以包括:温度、组织灌注的改变、成腔事件的数量、目标区和/或非目标区中吸收的累积能量、超声处理的数量、超声处理之间的时间间隔、mri图像的对比度、作为时间的函数的温度轮廓、和/或与从位于超声换能器与目标区之间的介入组织反射的声信号相关联的幅度和/或相位。
15.此外,数据结构可以包括实时参数值的多个范围,每个范围与超声参数值的校正值之一相对应;控制器还可以被配置为:识别所预测或测量的实时参数值所属的实时参数值的范围;以及基于所述识别来确定至少一个超声参数的校正值。备选地,数据结构可以包括实时参数值的多个范围,每个范围与超声参数值的校正值的范围相对应;控制器还可以被配置为:识别所预测或测量的实时参数值所属的数据结构中的实时参数值的范围;基于所述识别来确定校正值的对应的范围;以及至少部分地基于所预测或测量的实时参数值出现在所识别的范围内的位置,确定超声参数值的在校正值的范围中的校正值。
16.在一个实施例中,系统还包括:用于测量在目标区的第二部分或非目标区处的实时参数值的成像仪和/或温度测量设备。附加地或备选地,控制器还可以被配置为:使用物理模型预测在目标区的第二部分或非目标区处的实时参数值。在一些实施例中,控制器还被配置为:调整与换能器元件相关联的功率电平,以在目标区的第二部分中实现目标温度。
17.在各实施例中,数据结构中的实时参数值不包括所预测或测量的实时参数值;控制器还被配置为:基于数据结构中的实时参数值和超声参数值的对应的校正值,使用内插或外插来确定超声参数值的校正值。此外,数据结构中的实时参数值可以包括实时测量的参数值和使用物理模型计算的参数值的组合。
18.目标区的第一部分和第二部分可以相同。备选地,目标区的第一部分与目标区的第二部分不同;然后控制器还可以被配置为:基于数据结构中的实时参数值和数据结构中的用于在目标区的第一部分中生成聚焦区域的超声参数值的对应的校正值,使用内插或外插来确定超声参数值的校正值。
19.在一些实施例中,控制器还被配置为:确定由换能器元件向聚焦区域传送的穿过介入组织区之后的声能;以及至少部分地基于所传送的声能来调整与换能器元件相关联的功率电平。例如,控制器还可以被配置为:当聚焦区域中的所传送的声能低于预定的阈值时,减小换能器元件的功率电平。相反,控制器还可以被配置为:当聚焦区域中的所传送的声能超过预定的阈值时,增大换能器元件的功率电平。在一个实施例中,控制器还被配置为:预测或引起对目标区的第二部分或非目标区中的实时参数值的分布的测量;可以基于实时参数值的所预测或测量的分布进一步确定参数值的校正值。
20.在另一个方面,本发明涉及从具有多个换能器元件的超声换能器向目标区传送超声能量的方法。在各实施例中,所述方法包括:(a)在传送超声能量以前填充数据结构,该数据结构使多个实时参数值和与一个或多个换能器元件相关联的、用于至少在目标区的第一部分中生成声能的聚焦区域的一个或多个超声参数值(频率、相位和/或功率电平)的对应的校正值关联;(b)预测或引起对目标区的第二部分或非目标区中的一个或多个实时参数值的测量;(c)至少部分地基于所预测或测量的实时参数值和数据结构的内容,确定与换能器元件相关联的超声参数值的校正值;以及(d)至少部分地基于超声参数值的所确定的校正值来启用换能器元件,以在目标区的第二部分中生成聚焦区域。
21.在一些实施例中,数据结构中的实时参数值中的每一个表示相关联的实时参数的值的改变。相关联的实时参数可以包括:温度、组织灌注的改变、成腔事件的数量、目标区和/或非目标区中吸收的累积能量、超声处理的数量、超声处理之间的时间间隔、mri图像的对比度、作为时间的函数的温度轮廓、和/或与从位于超声换能器与目标区之间的介入组织反射的声信号相关联的幅度和/或相位。
22.此外,数据结构可以包括实时参数值的多个范围,每个范围与超声参数值的校正值之一相对应;控制器还可以被配置为:识别所预测或测量的实时参数值所属的实时参数值的范围;以及基于所述识别来确定至少一个超声参数的校正值。备选地,数据结构可以包括实时参数值的多个范围,每个范围与超声参数值的校正值的范围相对应;控制器还可以被配置为:识别所预测或测量的实时参数值所属的数据结构中的实时参数值的范围;基于所述识别来确定校正值的对应的范围;以及至少部分地基于所预测或测量的实时参数值出现在所识别的范围内的位置,确定超声参数值的在校正值的范围中的校正值。
23.在一个实施例中,使用物理模型预测在目标区的第二部分或非目标区处的实时参数值。此外,所述方法还可以包括:在传送超声能量期间重复步骤(b)至步骤(d)。此外,所述方法还可以包括:调整与换能器元件相关联的功率电平,以在目标区的第二部分中实现目标温度。
24.在一些实施例中,数据结构中的实时参数值不包括实时温度;所述方法还包括:基于数据结构中的实时参数值和超声参数值的对应的校正值,使用内插或外插通过计算来确定超声参数值的校正值。在一个实施例中,所述方法还包括:预测或引起对目标区的第二部分或非目标区中的实时参数值的分布的测量;可以基于实时参数值的所预测或测量的分布进一步确定超声参数值的校正值。
25.目标区的第一部分和第二部分可以相同。备选地,目标区的第一部分与目标区的第二部分不同;所述方法还可以包括:基于数据结构中的实时参数值和用于在目标区的第一部分中生成聚焦区域的超声参数值的对应的校正值,使用内插或外插通过计算来确定超声参数值的校正值。
26.如本文所使用的,术语“基本上”表示
±
10%,并且在一些实施例中表示
±
5%。贯穿本说明书,对“一个示例”、“示例”、“一个实施例”或“实施例”的引用意味着结合该示例所描述的特定特征、结构或特性被包括在本技术的至少一个示例中。因此,贯穿本说明书在各个地方出现的短语“在一个示例中”、“在示例中”、“在一个实施例中”或“在实施例中”不一定都引用相同示例。此外,可以在本技术的一个或多个示例中以任何合适的方式来组合特定特征、结构、例程、步骤或特性。本文提供的标题仅为了方便,并且不意在限制或解释要求
保护的技术的范围或含义。
附图说明
27.图1a示出了根据当前发明的各实施例的聚焦超声系统;
28.图1b示意性地描绘了根据当前发明的各实施例的示例性mri系统;
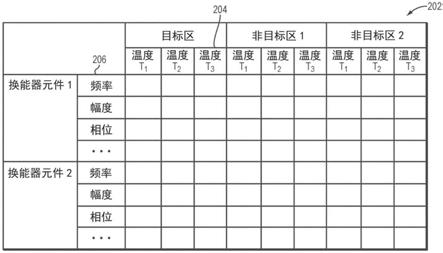
29.图2和图3b至图3d描绘了根据当前发明的各实施例的示例性自动聚焦校正表;
30.图3a示意性地描绘了根据当前发明的各实施例的包括多个部分的目标区;
31.图4a至图4c是示出根据本发明的各实施例的用于建立自动聚焦校正表的示例性方法的流程图;以及
32.图5是示出根据本发明的各实施例的示例性超声治疗过程的流程图。
具体实施方式
33.图1a示出了用于使超声波聚焦到病人的目标区101上的示例性超声系统100。系统100可以以各种方式使超声能量成形,产生例如点聚焦、线聚焦、环形聚焦或同时形成多个焦点。在各实施例中,系统100包括换能器元件104的相控阵列102、驱动相控阵列102的波束成形器106、与波束成形器106通信的控制器108、以及向波束成形器106提供输入电信号的频率发生器110。
34.阵列102可以具有适于将其放置在颅或除了颅以外的身体部位的表面上的弯曲的(例如,球面或抛物面)形状,或者可以包括一个或多个平面部分或其他形状的部分。阵列102的尺寸可以根据应用在毫米和几十厘米之间变化。阵列102的换能器元件104可以是压电陶瓷、电容式微机械超声换能器(cmut)或微机电系统(mems)元件,并且可以安装在硅橡胶或适于使元件104之间的机械耦合衰减的任何其他材料中。也可以使用压电复合材料或通常以促进将电能转换到声能的方式成形的任意材料。为了保证相对换能器元件104的最大功率传输,元件104可以被配置用于电谐振,与输入阻抗相匹配。
35.换能器阵列102耦合到波束成形器106,波束成形器106驱动各个换能器元件104,以使它们共同产生聚焦的超声波束或场。对于n个换能器元件,波束成形器106可以包含n个驱动电路,每个电路包括或包含放大器118和移相电路120;驱动电路驱动换能器元件104之一。波束成形器106从频率发生器110接收通常在0.1mhz至4.0mhz的范围内的射频(rf)输入信号,频率发生器110可以是例如可从斯坦福研究系统(stanford research systems)获得的model ds345发生器。输入信号可以分成用于波束成形器106的n个放大器118和延迟电路120的n个通道。在一些实施例中,频率发生器110与波束成形器106进行集成。射频发生器110和波束成形器106被配置为在相同的频率下(或者在一些实施例中,元件的不同组在不同的频率下)但是在不同的相位和/或不同的幅度下驱动换能器阵列102的各个换能器元件104。
36.由波束成形器106施加的放大或衰减因数α
1-αn以及相移a
1-an用于使超声能量通过非均质的组织(例如,位于从换能器元件到目标区的超声波束的声路径或“路径区域”中的病人的颅或不同的组织)传输并聚焦到目标区(例如,病人的脑中的区域)上。通过调整放大因数和/或相移,可以在目标区创建聚焦区域的期望的形状和强度。
37.可以使用控制器108计算放大因数和相移,控制器108可以通过软件、硬件、固件、
硬连线或其任意组合来提供相关的计算功能。例如,控制器108可以使用以常规方式利用软件编程的通用或专用数字数据处理器,并且无需过度的试验来确定换能器元件104的频率、相移和/或放大因数。在特定实施例中,控制器计算是基于与位于换能器102与目标101之间的介入组织(例如,经过区域)的特性(例如,结构、厚度、密度等)及其对声能的传播的影响有关的信息。在各实施例中,这种信息从诸如磁共振成像(mri)设备、计算机断层扫描(ct)设备、正电子发射成像(pet)设备、单光子发射计算成像(spect)设备或超声波成像设备等的成像仪112获得。图像采集可以是三维的(3d),或者备选地,成像仪112可以提供适于重建目标区101和/或其他区域(例如,围绕目标101的区域、位于换能器与目标101之间的经过区域中的区域或另一目标区)的三维图像的二维(2d)图像的集合。可以在成像仪112、控制器108或单独的设备中实现图像处理功能。
38.此外,超声系统100和/或成像仪112可以用于检测来自位于或靠近(例如,在10mm之内)目标区101的声反射器(例如,微泡)的信号,如下文进一步描述的。附加地或备选地,系统100可以包括声信号传感器(例如,水听器或适合的替代物)124,该声信号传感器检测从声反射器发射和/或反射的超声波,并且可以将其接收的信号提供给控制器108以用于如下所述的进一步处理。此外,超声系统100可以包括用于将声反射器非经肠胃地引入病人的身体的配给(administration)系统126。在pct公开no.wo2019/116095中描述了合适的配给系统的示例,该pct公开的全部内容通过引用并入本文。成像仪112、声信号传感器124和/或配给系统126可以使用控制换能器操作的相同的控制器108来操作;备选地,它们可以由彼此相互通信的一个或多个专用控制器分别控制。
39.图1b示出了示例性成像仪—即mri装置112。装置112可以包括圆柱电磁体134,该电磁体134在电磁体134的孔136中生成必需的静态磁场。在医疗过程期间,可以将病人置于孔136内且在可移动的支撑台138上。感兴趣的解剖结构区域140(例如,病人的头部)可以被置于成像区142内,电磁体134在成像区142中生成基本上均匀的场。一组圆柱磁场梯度线圈144也可以设置在孔136内并且围绕病人。梯度线圈144在预定的时间处并且在三个相互正交的方向上生成预定的幅度的磁场梯度。利用场梯度,不同的空间位置可以与不同的进动频率相关联,由此给出其空间分辨率的mr图像。围绕成像区142的rf发射器线圈146将rf脉冲发射到成像区142中,以使病人的组织发射磁共振(mr)响应信号。原始mr响应信号由rf线圈146感测并且被传递给然后计算mr图像的mr控制器148,mr图像可以显示给用户。备选地,可以使用分离的mr发射器线圈和接收器线圈。使用mri装置112获取的图像可以向放射师和医师提供利用常规x射线术无法可视化的不同组织之间的视觉对比和病人的解剖结构的详细的内部视图。
40.mri控制器148可以控制脉冲序列(即磁场梯度和rf激励脉冲的相关的定时和强度)和响应检测时段。mri控制器148可以与换能器控制器108组合成一体的系统控制设施。
41.使用常规图像处理系统将mr响应信号放大、调节和数字化为原始数据,并且通过本领域技术人员已知的方法将其进一步转换成图像数据的阵列。图像处理系统可以是mri控制器148的一部分,或者可以是与mri控制器148和/或换能器控制器108通信的单独的设备(例如,包含图像处理软件的通用计算机)。因为响应信号是组织相关和温度相关的,所以可以对响应信号进行处理,以识别图像中的治疗目标区(例如,要通过热量破坏的肿瘤)101,以及根据图像计算温度图。此外,可以使用例如热mri或基于mr的声辐射力成像来实时
监测由超声应用引起的声场。因此,使用mri数据,可以驱动超声换能器102以使超声波聚焦到目标区101(或目标区101附近),同时监测目标和周围组织的温度和/或声场强度。
42.如上所述,mr成像可以提供定量地监测体内温度的非侵入式方式。这在mr引导的热治疗(例如,mr引导的聚焦超声(mrgfus)治疗)中特别有用,其中应该连续地监测目标区101的温度,以评估治疗的进展并校正热传导和能量吸收的局部差异,由此避免对围绕目标的组织的损伤。对温度的监测(例如,测量和/或映射)通常基于与合适的图像处理软件相结合的mr成像(被称为mr测温术或mr热成像)。
43.在可用于mr测温术的各种方法中,prf偏移法通常是所选择的方法,这是由于其相对于温度改变为线性、与组织类型几乎无关、以及由其获得的温度图的高空间和时间分辨率。prf偏移法基于水分子中的质子的mr谐振频率随着温度而线性改变(具有有利地在组织类型间相对恒定的比例常数)的现象。因为随温度的频率改变较小,对于体积大的水仅为-0.01ppm/℃并且在组织中大约是-0.0096ppm/℃至-0.013ppm/℃,所以prf偏移通常利用相敏成像法来检测,其中成像被执行两次:首先在温度改变以前获取基线prf相位图像,然后在温度改变之后获取第二相位图像——即治疗图像,由此捕捉与温度的改变成比例的小的相位改变。然后可以通过以下操作根据(重建,即实空间)图像来计算温度改变的图:在逐像素的基础上确定基线图像与治疗图像之间的相位差异,并且基于prf温度依赖性将所述相位差异转换成温度差异,同时考虑诸如静态磁场的强度和回波时间(te)(例如,梯度回波(gradient-recalled echo)的回波时间)等的成像参数。
44.在各实施例中,在超声治疗过程以前,mri装置112获取目标101和/或非目标区(例如,位于换能器104与目标101之间的经过区域中的区域)的一个或多个图像。获取的mr图像提供用于治疗计划的目的的准确的位置信息、以及用于确定在目标区和/或非目标区处的温度的基线相位图。通常,mri测温序列从采集基线图像(例如,在超声处理开始处)开始;可以每2秒至每5秒获取一个新的相位图像。
45.在一些实施例中,超声治疗涉及声反射器(例如,微泡)。例如,微泡可以由声能(例如,使用换能器102)生成和/或由用于自动聚焦的体注入(例如,使用配给系统126)引入。从所有(或至少一些)换能器元件104发射的超声波由反射器反射;反射信号可以由声信号传感器124和/或换能器元件104检测。然后可以将测量的信号提供给控制器108,以获得与反射相关联的信息(例如,幅度和/或相位);可以将这些信息与和从换能器元件104发射的超声波相关联的幅度和/或相位进行比较。基于它们之间的偏差,可以调整换能器元件104的驱动信号,以补偿偏差,由此改善聚焦性质。在一些实施例中,该自动聚焦过程迭代地执行直到实现最佳聚焦性质。例如,在pct公开no.wo2018/020315和pct申请no.pct/ib2019/001340(在2019年12月18日提交)中提供了用于在目标区处自动聚焦超声波束的方法;例如,在pct公开no.wo2018/020315、wo2019/116107、wo2019/058171、wo2019/116097、wo2019/002947和wo2019/116095、以及美国专利公开no.2019/0083065和2019/0178851中提供了用于生成微泡和/或将微泡引入目标区101的方法。前述申请的全部内容通过引用并入本文。
46.在各实施例中,在治疗的目标区101处生成具有期望的治疗温度的焦点以前,动态地调整换能器102的超声参数值,以实现目标区处的附加目的(例如,最佳聚焦、声耦合的匹配等)。参考图2,为了创建在目标101处的最佳焦点,在一个实施例中,在超声治疗过程以
前,建立使温度204与和每个换能器元件104相关联的一个或多个对应的超声参数值(例如,频率、功率电平、相位等)206关联的自动聚焦校正表202。附加地或备选地,在一些实施例中,至少一个超声参数值的值是基于相对于另一参数(例如,温度)的改变而不是基于参数的值本身确定的。例如,表示接收超声治疗的病人的颅的病人专用3d颅仿形(或体外颅)可以在超声过程以前创建。3d颅仿形然后可以设置在与用于治疗病人的环境类似的环境中;超声波可以穿过3d颅仿形施加到在目标区101处引入/生成的微泡。
47.基于测量的来自目标区101的反射信号,可以确定与每个换能器元件相关联的用于在目标处生成最佳焦点的超声参数值(例如,功率电平、相位、频率等)。此外,在预治疗超声过程期间,可以启用mri装置,以测量在目标区101和/或非目标区(例如,位于经过区域中或经过区域外部的颅仿形部分)处的温度。因此,可以在预治疗超声过程期间通过使用声信号传感器124和/或换能器元件104分析来自目标101的反射信号,并且使用mri装置测量在目标区和/或非目标区处的温度,来生成自动聚焦校正表202;再次,自动聚焦校正表202使在目标区/非目标区处的温度与和每个换能器元件相关联的用于在目标处101生成最佳焦点的对应的超声参数值关联。例如,在美国专利公开no.2020/0085409中提供了用于创建病人专用3d颅仿形的方法,该美国专利公开的全部内容通过引用并入本文。
48.在一些实施例中,自动聚焦校正表202可以基于先前已经历超声治疗的病人的追溯性研究来创建。附加地和/或备选地,可以使用物理模型基于计算预测来建立自动聚焦校正表202。例如,物理模型可以基于与各个换能器元件104的几何结构以及换能器元件104相对于目标101的位置和定向有关的信息来预测从每个换能器元件104到目标位置101的波束路径;在一个实施方式中,使用成像仪112获得这些信息。此外,成像仪112可以获得诸如与目标组织和/或非目标组织有关的解剖特性(例如,类型、性质、结构、厚度、密度等)之类的信息。基于获得的信息,可以创建组织模型,以表征目标组织和/或非目标组织的物质特性(例如,组织在使用的声频率或速度下的能量吸收)。例如,在pct公开no.wo2018/130867中描述了用于创建组织模型的方法,该pct公开的全部内容通过引用并入本文。在一些实施例中,物理模型则包括病人的颅的沿着从每个换能器元件104到目标101的波束路径的解剖特性和/或物质特性,以用于预测由所述解剖特性和/或物质特性引起的偏差。基于预测的偏差,可以确定与每个换能器元件104相关联的用于补偿偏差并且由此在目标101处创建最佳焦点的超声参数值。
49.此外,物理模型可以预测由所施加的超声能量引起的目标区/非目标区处的温度分布。例如,基于超声换能器元件104的关联的相位和/或幅度设置以及目标组织/非目标组织的解剖特性和/或物质特性,物理模型可以通过计算预测在特定的超声频率下传送到目标区和/或非目标区的超声能量的量、在目标区和/或非目标区处的超声能量或压力到热量的转换和/或组织位移、和/或所引起的热量的传播和组织上的位移效果。通常,模拟采用(或包括)微分方程的形式。例如,物理模型可以由pennes模型和生物热方程构成或包括所述pennes模型和生物热方程以用于模拟组织中的热传递。例如,在美国专利公开no.2015/0359603中提供了用于模拟超声处理及其在组织上的效果的方法,该美国专利公开的全部公开内容通过引用并入本文。
50.在各实施例中,在超声治疗过程期间基于以下建立自动聚焦校正表202:(i)使用物理模型的计算预测,(ii)在目标区/非目标区处的温度的实时测量,(iii)用于在目标101
处创建最佳焦点的超声参数值,以及(iv)来自目标101的反射信号。例如,在超声治疗过程的开始处,当在目标区/非目标区处的温度低于阈值(例如,没有导致显著的临床效果)时,可以(例如,使用成像仪112)测量目标组织和/或非目标组织的实时温度,并且可以使用上述自动聚焦方法确定与每个换能器元件104相关联的用于在目标101处创建最佳焦点的对应的超声参数值。可以然后将(例如,使用成像仪112获得的)这些信息和目标组织/非目标组织的解剖特性和/或物质特性提供给物理模型。基于此,物理模型可以预测或估计温度和与每个换能器元件104相关联的用于在目标处101生成最佳焦点的对应的超声参数值之间的关系。此外,基于预测的关系,物理模型可以估计在超声治疗过程的稍后的阶段中用于在超过阈值的各个温度下在目标区中生成最佳焦点的超声参数值。因此,可以建立包括低于和超过阈值的温度及其对应的超声参数值在内的自动聚焦校正表202。如本文所使用的,术语“显著的临床效果”表示具有临床医生认为显著的不期望的(并且有时缺少期望的)效果,例如开始损伤组织或其他临床上的不利影响,无论是暂时的还是永久的。
51.再次参考图1a,包括目标区/非目标区处的温度及其对应的超声参数值在内的自动聚焦校正表202可以与其相应的换能器元件104一起存储在可由控制器108访问的存储器162中的数据库160中。存储器可以包括一个或多个易失性或非易失性存储设备或基本上由其构成,例如随机存取存储器(ram)设备(例如dram、sram等)、只读存储器(rom)设备、磁盘、光盘、闪存设备和/或其他固态存储器设备。存储器的全部或一部分可以远离超声系统100和/或成像仪112定位,例如,作为经由网络(例如,以太网、wifi、蜂窝电话网、互联网、或任意局域网或广域网或能够支持数据传输和通信的网络的组合)连接到超声系统100和/或成像仪112的一个或多个存储设备。如本文所使用的,术语“存储”宽泛地表示任意形式的数字存储,例如光存储、磁存储、半导体存储等。
52.在超声治疗过程期间,在目标区和/或非目标区处的温度可以如上所述地(例如,使用mri或其他温度测量设备)实时地进行测量或使用物理模型进行预测。基于测量/预测的实时温度和建立的自动聚焦表202,可以确定与每个换能器元件104相关联的用于在目标处生成最佳焦点的对应的超声参数值。例如,再次参考图2,如果在时间t1处的目标101中的测量/预测的实时温度是t1,则将检索自动聚焦表202中的与目标温度t1相关联的超声参数值。控制器108然后可以基于已检索的超声参数值来操作换能器元件104。可选地,在生成最佳焦点之后,换能器元件104的功率/强度可以增大,以将在目标区101处的温度增大到期望的治疗温度。
53.在各实施例中,增大换能器元件104的功率/强度导致要对位于经过区域中的非目标组织施加(并且由非目标组织吸收)附加的超声能量;因此,超声波束可能再次散焦。因此,在一个实施方式中,对目标区和/或非目标区处的温度连续进行测量或实时进行预测,并且基于测量/预测的实时温度和自动聚焦校正表202,可以动态地调整超声参数值,以维持目标101处的最佳焦点。这样的调整可以连续执行,直到在目标区101处实现期望的治疗温度。
54.在一些实施例中,自动聚焦表202可以不包括与实时测量温度t相对应的信息。例如,参考图2,自动聚焦表202可以仅包括与温度t1、t2和t3相关联的超声参数值,但是t1《t《t2。在各实施例中,可以执行内插或外插,以基于与t1和t2相关联的超声参数值获得与t相关联的超声参数值。
55.此外,参考图3a和图3b,目标101可以跨越大的体积,并且自动聚焦表202可以包括用于在目标的多个部分302、304中生成最佳焦点的信息。在这种情况下,也可以执行内插和/或外插,以获得用于在目标部分306、308处生成最佳焦点的超声参数值,目标部分306、308不包括在自动聚焦表202中。
56.参考图3c,在各实施例中,自动聚焦校正表202包括一个或多个温度范围312,每个范围与用于在目标处生成最佳焦点(或其他目的)的超声参数值中的一个或多个超声参数值相对应。在治疗期间,在(例如,使用mri)测量实时温度和/或(使用物理模型)预测实时温度之后,可以识别所预测/测量的实时参数值所属的温度的范围。基于此,可以确定与所识别的温度范围相对应的用于在目标处生成最佳焦点的超声参数值。备选地,参考图3d,每个温度范围312可以与用于在目标处生成最佳焦点(或其他目的)的超声参数值的范围314相对应。再次,当测量/预测实时温度时,可以识别所预测/测量的实时参数值所属的温度的范围。基于此,可以确定超声参数值的对应的范围314。在一个实施例中,可以使用内插或外插计算范围314内的用于在目标处生成最佳焦点的超声参数值。也就是说,测量/预测的温度落在范围312内的位置可以线性地确定在对应的参数值范围314内的适当的参数值;例如,如果测量/预测的温度在范围312中的一个范围的中点处,则对应的参数值可以是对应的范围314的中点。
57.在一些实施例中,在超声过程期间(例如,使用mri)实时地测量和/或(使用物理模型)预测目标区和/或非目标区中的温度分布;基于温度分布和换能器元件的几何结构,可以确定沿着从每个换能器元件104到目标区的声路径的非目标组织(例如,颅)中的特定的温度值(例如,温度升高)并且将其与对应的换能器元件104相关联。然后可以确定与每个换能器元件104相关联的用于补偿由沿着到目标的波束路径的温度升高而引起的偏差的超声参数值。在治疗期间,可以基于使用自动聚焦表确定的参数值和/或与其相关联的特定的温度值来启用换能器元件104。
58.此外,各个换能器元件的强度可以相同或不同。在一个实施例中,换能器元件104被驱动以生成在其相应的强度下的超声能量,同时确保传送到目标101的超声能量的总量共同满足阈值,以导致目标组织的坏死。与每个换能器元件104相对应的强度可以例如基于以下来确定:由换能器元件104贡献的在穿过经过区域之后到达焦点的声能;经过区域中的组织的不同的热敏性等。当能量贡献低于预定的阈值时,从换能器元件发射的较大量的声能在到达焦点之前由位于经过区域中的非目标组织吸收;因此,为了避免过度加热和损伤非目标组织,可以驱动在焦点处具有较低能量贡献的换能器元件104,以产生较低强度的输出,或者在一些实施例中,在超声治疗过程期间停用。相反,当来自换能器元件104的能量贡献超过预定的阈值时,可以驱动换能器元件104以产生较高强度的输出。这个方法可以有利地在焦点中生成用于治疗目的的充分的声能和强度,同时避免损伤位于与较低能量的换能器元件相关联的路径区域中的非目标组织。例如,在美国专利公开no.2010/0179425和2018/0071553中提供了用于确定每个换能器元件的能量贡献和基于其能量贡献控制各个换能器元件的强度的方法,该美国专利公开的全部内容通过引用并入本文。
59.图4a至图4c是根据本文的示出用于建立自动聚焦校正表的示例性方法的流程图。可以基于测量、预测或其组合来建立自动聚焦校正表。例如,参考图4a,在第一步骤402中,在超声治疗过程以前,可以创建表示接收超声治疗的病人的颅的病人专用3d颅仿形(或体
外颅)并且将其设置在与用于治疗病人的环境类似的环境中。在第二步骤404中,可以将声反射器(例如,微泡)引入目标区(例如,通过使用换能器102施加声能来生成和/或使用配给系统126通过体注入引入)。在第三步骤406中,启用换能器102以向声反射器施加超声波,并且测量来自声反射器的反射信号。在第四步骤408中,可以基于测量的反射信号来确定与每个换能器元件104相关联的用于在目标处生成最佳焦点的超声参数值。在第五步骤410中,例如使用成像仪112测量由施加超声波引起的目标区和/或非目标区处的温度。可选地,可以调整换能器元件104的超声参数值(步骤412);步骤406至步骤412可以迭代地执行。随后,可以建立使温度与用于在目标处创建最佳焦点(或实现除了达到期望的治疗温度以外的其他附加目的)的超声参数值关联的自动聚焦校正表(步骤414)。
60.图4b描绘了用于在执行超声治疗过程以前使用物理模型建立自动聚焦校正表的方法。在第一步骤422中,启用成像仪112,以获得信息,例如(i)换能器元件的几何结构以及其相对于目标的位置和定向和/或(ii)目标组织和/或非目标组织的解剖特性(例如,类型、性质、结构、厚度、密度等)。在第二步骤424中,基于在步骤422中获得的信息来建立表征目标组织和/或非目标组织的物质特性(例如,组织在使用的声频率或速度下的能量吸收)的组织模型。在第三步骤426中,基于在步骤422中获得的信息和在步骤424中建立的组织模型来实现物理模型,以预测由位于经过区域中的介入组织引起的偏差。在第四步骤428中,可以基于预测的偏差来确定与每个换能器元件104相关联的用于补偿偏差并且在目标处创建最佳焦点的超声参数值。在第五步骤430中,物理模型预测由所施加的超声能量引起的目标区/非目标区处的温度分布。在第六步骤432中,建立使温度与用于在目标处创建最佳焦点(或实现除了达到期望的治疗温度以外的其他附加目的)的超声参数值关联的自动聚焦校正表。
61.图4c描绘了用于在超声治疗过程期间建立自动聚焦校正表的方法。在第一步骤442中,将声反射器(例如,微泡)引入目标区101。在第二步骤444中,启用换能器102以向声反射器施加超声波,并且测量来自声反射器的反射信号。在第三步骤446中,可以基于测量的反射信号来确定与每个换能器元件104相关联的用于在目标处生成最佳焦点的超声参数值。在第四步骤448中,例如使用成像仪112测量在目标区和/或非目标区处的温度。在第五步骤450中,实现物理模型以对温度和与每个换能器元件相关联的用于在目标处生成最佳焦点的对应的超声参数值之间的关系进行预测或估计。此外,物理模型可以估计用于在各种温度下在目标区中生成最佳焦点的超声参数值(步骤452)。然后建立使温度与用于在目标处创建最佳焦点的超声参数值关联的自动聚焦校正表(步骤454)。
62.图5是示出与本文一致的用于执行超声治疗过程的方法的流程图。在第一步骤502中,启用换能器102以向目标区101发射超声波;在一个实施例中,施加超声波引起目标区和/或非目标区处的小于预定阈值的温度升高(例如,没有导致显著的临床效果)。在第二步骤504中,在超声治疗过程期间,实时地(例如,使用mri或其他温度测量设备)测量和/或(例如,使用物理模型)预测在目标区和/或非目标区处的温度。在第三步骤506中,与换能器102相关联的控制器108访问存储自动聚焦校正表的数据库,以基于测量/预测的温度来检索和/或估计用于在目标处创建最佳焦点(或实现除了达到期望的治疗温度以外的其他附加目的)的超声参数值。在第四步骤508中,基于检索/估计的超声参数值来操作超声换能器元件。在可选的第五步骤510中,可以调整换能器元件的功率/强度,以增大目标区处的温度以
用于对目标区的治疗。步骤502至步骤510可以迭代地执行,直到达到在目标101处的期望的治疗温度。
63.要注意的是,对施加了超声波以用于建立自动聚焦校正表202的目标区可以与对施加了超声波以用于治疗的目标区相同或不同。例如,再次参考图3a,目标区可以包括多个部分302-308;超声波可以首先发射到部分302,以用于如上所述地建立自动聚焦校正表202。一旦建立了自动聚焦校正表202,换能器元件104就可以如上所述地向部分302或不同的部分(例如,部分304、部分306、部分308)发射超声波,以对部分中的组织进行坏死。再次,可以基于自动聚焦校正表202中的与部分302相关联的数据来内插或外插用于与部分302不同的部分中的组织的坏死的超声参数值。
64.因此,各实施例通过以下有利地提高了目标的治疗效率:考虑在超声过程期间由声能施加引起的目标组织/非目标组织上的效果(例如,散焦、声耦合的失配等),并且基于所述效果,调整超声参数值以在调整超声参数值以实现期望的治疗温度以前实现附加目的(例如,最佳聚焦、声耦合的匹配等)。因此,可以在焦点中充分地生成用于治疗目的的声能和强度,同时可以避免(或至少减少)对位于路径区域中的非目标组织的损伤。
65.通常,可以在以硬件、软件或两者的组合实现的一个或多个模块中构建例如包括以下操作的用于执行超声治疗过程的功能:创建表示接收超声治疗的病人的颅的病人专用3d颅仿形(或体外颅);操作成像仪以获得与(i)换能器元件的几何结构和其相对于目标的位置和定向、以及(ii)目标组织和/或非目标组织的解剖特性(例如,类型、性质、结构、厚度、密度等)有关的信息;创建组织模型以表征目标组织和/或非目标组织的物质特性;实现物理模型以预测由位于经过区域中的介入组织引起的偏差、以及由施加超声能量引起的目标区/非目标区处的温度分布;将声反射器(例如,微泡)引入目标区;向声反射器施加超声波并且测量来自声反射器的反射信号;测量和/或预测在目标区/非目标区处的温度;确定与每个换能器元件相关联的用于在目标处生成最佳焦点的超声参数值;建立自动聚焦校正表;将自动聚焦校正表存储在数据库中;访问数据库以检索存储在其中的数据;以及在超声治疗过程以前和/或在超声治疗过程期间动态地调整超声参数值(例如,频率、幅度、相位等),如上所述,所述功能无论是被集成在成像仪的控制器和/或超声系统内,还是由单独的外部控制器提供。对于将所述功能提供为一个或多个软件程序的实施例,所述程序可以用诸如python、java、c、c++、c#、basic、各种脚本语言和/或html等的许多高级语言中的任意语言编写。附加地,软件可以用针对驻留在目标计算机上的微处理器(例如,控制器)的汇编语言实现;例如,如果软件被配置为在ibm pc或仿制pc上运行,则软件可以用英特尔80x86汇编语言实现。软件可以体现在包括但不限于软盘、跳跃驱动器(jump drive)、硬盘、光盘、磁带、prom、eprom、eeprom、现场可编程门阵列或cd-rom的制品上。使用硬件电路的实施例可以使用例如一个或多个fpga、cpld或asic处理器来实现。
66.此外,本文使用的术语“控制器”宽泛地包括用于执行如上所述的任意功能的所有需要的硬件组件和/或软件模块;控制器可以包括多个硬件组件和/或软件模块,并且所述功能可以散布在不同的组件和/或模块中。
67.本文使用的术语和表述用作描述而非限制的术语和表述,并且在使用这些术语和表述时不意在排除所示出和描述的特征或其各部分的任何等同物。此外,已经描述了本发明的特定实施例,本领域技术人员将清楚的是,在没有背离本发明的精神和范围的情况下,
可以使用包括本文公开的构思的其他实施例。因此,所描述的实施例在所有方面被视为仅是说明性的而不是限制性的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1