高亲脂性生理活性物质的控释制剂的制作方法
1.本发明涉及高亲脂性生理活性物质的制剂,尤其是控释制剂及其生产。例如,高亲脂性的生理活性物质是药物活性成分。大麻素是高亲脂性药物活性成分的示例。
背景技术:
2.许多生理活性物质具有高亲脂性,即它们具有相对较高的log p,例如log p为4或更高,log p为正辛醇/水分配系数的十进制对数。
3.提供具有此类生理活性物质的制剂(尤其是口服制剂)代表特殊的挑战,尤其是如果要实现生理活性物质的控释。
4.具有强亲脂性的生理活性物质包括大麻素。
5.大麻素是一组异质性的药理活性物质,对所谓的大麻素受体有亲和力。大麻素包括例如四氢大麻酚(thc)和非精神活性的大麻二酚(cbd)。
6.大麻素作为药物引起了相当大的兴趣。有证据表明,大麻素有助于治疗许多临床疾病,包括疼痛、炎症、癫痫、睡眠障碍、多发性硬化症、神经性厌食症和精神分裂症的症状(n.bruni et al.,cannabinoid delivery systems for pain and inflammation treatment.molecules 2018,23,2478)。
7.然而,提供合适的剂型是困难的,因为大麻素是高亲脂性分子(log p 6-7),水溶性极低(2-10μg/ml)。
8.大麻素的口服生物利用度较低,因此建议经皮、经鼻内和经粘膜给药。
9.此外,由于大麻素的高亲脂性,成盐(即ph调节)、潜溶(cosolvency)(如乙醇、丙二醇、peg400)、胶束化(如聚山梨酯80、cremophor-elp)、乳化(包括微乳化和纳米乳化)、络合(例如环糊精)和包封在脂质基制剂(例如脂质体)中是现有技术中考虑的制剂策略。还提出了纳米颗粒系统(n.bruni et al.,引用文献同上)。
10.专利文献中提出了各种固体口服剂型,例如在wo 2008/024490a2和wo2018/035030a1中。这些文件不包含释放行为的数据,因此对所提出的大麻素给药形式的实际适用性尚不清楚。
11.wo 2015/065179a1描述了除大麻二酚外还含有乳糖和蔗糖脂肪酸单酯的压制片剂。
12.屈大麻酚(dronabinol,δ9-thc)以胶囊和口服溶液的形式上市。胶囊是一种软明胶胶囊,含有芝麻油中的活性成分。
13.含nabiximols的成品药物是一种口腔喷雾剂,喷洒在脸颊内侧。
14.最近获批用于治疗某些形式癫痫的制剂epidiolex以口服溶液的形式提供,除活性成分大麻二酚外,还含有赋形剂无水乙醇、芝麻油、草莓味香剂和三氯蔗糖。
15.然而,尽管有所有这些建议,仍需要改进高亲脂性生理活性物质(例如大麻素等药物活性成分)的剂型,尤其是固体口服剂型。
技术实现要素:
16.本发明的目的是提供用于强亲脂性生理活性物质(例如大麻素)的固体剂型,特别是固体口服剂型,,其释放生理活性物质/多种生理活性物质,并且可以以简单的方式制备。
17.通过提供一种固体剂型来实现该目的,该固体剂型包含含有一种或多种高亲脂性生理活性物质的基质、一种或多种水溶性粘合剂,以及基于所有组分重量不超过20wt.-%的其他赋形剂,其中如果生理活性物质log p为4或更高,则其具有高亲脂性。
18.令人惊讶的是,发现可提供高亲脂性生理活性物质的固体剂型,尤其是固体口服剂型,其中可借助水溶性粘合剂的量(基于高亲脂性物质/多种高亲脂性物质的量)来控制释放。使用一种或多种水溶性粘合剂不仅可以形成含有生理活性物质/多种生理活性物质的基质,还用于控制释放。特别是,水溶性粘合剂促进仅极微溶于水的高亲脂性物质的释放。只有通过粘合剂,这些物质才会以足够的数量和速度释放。
19.从下面对本发明的详细描述中可以得出进一步的目的及其解决方案。
附图说明
20.在下文中,参照附图对本发明进行了更详细的解释。
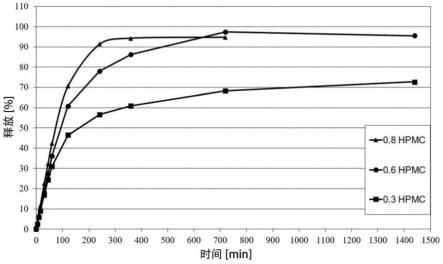
21.图1显示了三种微丸产品的体外释放,它们包括作为活性物质的2-[1r-3-甲基-6r-(1-甲基乙烯基)-2-环己烯-1-基]-5-戊基-1,3-苯二酚和低粘度羟丙基甲基纤维素。
具体实施方式
[0022]
根据本发明提供的剂型包含一种或多种高亲脂性生理活性物质。
[0023]
如果物质的log p为4或更高,则其具有高亲脂性。log p是正辛醇/水分配系数的十进制对数。通过实验可以确定分配系数。值通常指室温(25℃)。也可以从分子结构粗略计算分配系数。
[0024]
根据本发明的微丸特别适用于log p为5或更高的生理活性物质,特别适用于log p为6或更高的生理活性物质。
[0025]
术语“生理活性物质”是指向人或动物给药以在人或动物体内产生作用的物质。例如,生理活性物质可以是人用或兽用药品或食品补充剂的药物活性物质。
[0026]
根据本发明可使用的高亲脂性药物活性物质的示例为大麻素。
[0027]
大麻素既可以是植物大麻素,也可以是合成大麻素。
[0028]
植物大麻素是一组约70种的萜酚类(terpenophenolic)化合物(v.r.preedy(ed.),handbook of cannabis and related pathologies(1997))。这些化合物通常含有单萜残基,该残基连接到酚环上,并具有位于酚羟基的间位的c
3-c5烷基链。
[0029]
优选的一组大麻素是四氢大麻酚,通式(1)如下:
[0030][0031]
其中r选自c
1-c
20-烷基、c
2-c
20-烯基或c
2-c
20-炔基中,并任选地具有一个或多个取代基。
[0032]
在上述通式(1)的另一个优选化合物组中,r选自c
1-c
10-烷基或c
2-c
10-烯基,并任选地具有一个或多个取代基。
[0033]
特别地,在式(1)中,r是式为c5h
11
的烷基。
[0034]
通式(1)的化合物可以立体异构体的形式存在。中心6a和10a优选各自具有r构型。
[0035]
四氢大麻酚尤其是δ9-thc,化学名称为(6ar,10ar)-6,6,9-三甲基-3-戊基-6a,7,8,10a-四氢-6h-苯并[c]色烯-1-酚。该结构通过以下公式(2)反映:
[0036][0037]
另一组优选的大麻素是大麻二酚,通式(3)如下:
[0038][0039]
其中r选自c
1-c
20-烷基、c
2-c
20-烯基或c
2-c
20-炔基中,并任选地具有一个或多个取代基。
[0040]
在具有上述通式(3)的另一个优选化合物组中,r选自c
1-c
10-烷基或c
2-c
10-烯基中,并任选地具有一个或多个取代基。
[0041]
特别地,在式(3)中,r是式为c5h
11
的烷基。
[0042]
大麻二酚尤其是2-[1r-3-甲基-6r-(1-甲基乙烯基)-2-环己烯-1-基]-5-戊基-1,3-苯二酚。
[0043]
根据本发明,可以使用δ9-thc((6ar,10ar)-6,6,9-三甲基-3-戊基-6a,7,8,10a-四氢-6h-苯并[c]色烯-1-醇)和cbd(2-[1r-3-甲基-6r-(1-甲基乙烯基)-2-环己烯-1-基]-5-戊基-1,3-苯二酚)的组合。
[0044]
另一组优选的大麻素是大麻酚(cannabinol),通式(4)如下:
[0045][0046]
其中r选自c
1-c
20-烷基、c
2-c
20-烯基或c
2-c
20-炔基中,并任选地具有一个或多个取代基。
[0047]
在具有上述通式(4)的另一个优选化合物组中,r选自c
1-c
10-烷基或c
2-c
10-烯基中,并任选地具有一个或多个取代基。
[0048]
特别地,在式(4)中,r是分子式为c5h
11
的烷基。
[0049]
大麻酚尤其是6,6,9-三甲基-3-戊基-6h-二苯并[b,d]吡喃-1-酚。
[0050]
根据本发明,还可以使用大麻提取物的大麻素或大麻素混合物。
[0051]
例如,nabiximols是一种植物提取物混合物,用作大麻植物(cannabis sativa l.)叶和花的药物,具有标准化含量的四氢大麻酚(thc)和大麻二酚(cbd)。
[0052]
也可使用合成大麻素。
[0053]
其中包括3-(1,1-二甲基庚基)-6,6a,7,8,10,10a-六氢-1-羟基-6,6-二甲基-9h-二苯并[b,d]吡喃-9-酮。该化合物含有两个立体中心。药物大麻隆(nabilone)是(6ar,10ar)形式和(6as,10as)形式的1:1混合物(外消旋体)。根据本发明,大麻隆是优选的大麻素。
[0054]
合成大麻素的另一个示例是jwh-018(1-萘基-(1-戊基吲哚-3-基)甲酮。
[0055]
根据本发明,基质中含有一种或多种强亲脂性生理活性物质,如一种或多种药物活性成分,例如大麻素。该基质优选不含任何其他生理活性物质。
[0056]
该基质含有一种或多种水溶性粘合剂。这些粘合剂是聚合成膜物质。
[0057]
合适的水溶性成膜剂的示例有甲基纤维素(mc)、羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、羟乙基纤维素(hec)、羧甲基纤维素钠(na-cmc)和聚乙烯吡咯烷酮(pvp)。
[0058]
优选的是羟丙基甲基纤维素(hpmc),特别是低粘度hpmc,如在20℃、2%(w/w)水溶液时粘度为6mpa
·
s或更低的hpmc。
[0059]
特别优选的是可获得的商品名为的hpmc,其在20℃、2%(w/w)的水溶液时粘度为3mpa
·
s。
[0060]
一种或多种高亲脂性生理活性物质和一种或多种水溶性结粘合剂的基质可含有其他常用赋形剂,如一种或多种填充剂或载体。根据本发明,基于所有组分的重量,其他赋形剂的量限制为不超过20wt.-%。优选地,基于所有组分的重量,其他赋形剂的量不超过10wt.-%。
[0061]
在特别优选的实施例中,基质由高亲脂性的生理活性物质/多种高亲脂性的生理活性物质和粘合剂组成,例如大麻素和粘合剂。
[0062]
该基质含有一种或多种水溶性粘合剂,基于高亲脂性生理活性物质的总量,总量为0.1-10wt.-%,优选总量为0.5-8wt.-%,尤其是总比例为1-6wt.-%。
[0063]
假定如果水溶性粘合剂的用量太少,则释放只会发生得非常缓慢而且不完全。通过选择规定范围内的比例,可调节生理活性物质的释放。例如,可调节口服剂型的释放,使
生理活性物质在胃肠通道的常规时间内释放生理活性物质。
[0064]
根据本发明的固体口服剂型包括含有一种或多种高亲脂性生理活性物质的基质,可以以任何形式提供和使用。例如,剂型可以颗粒剂、基质微丸或基质片剂的形式提供,或可包括这些形式中的任一种。
[0065]
可采用本身已知方式进行制备。
[0066]
在优选实施例中,该剂型包含基质微丸。
[0067]
基质微丸的尺寸通常在30μm至1800μm范围内,因此可通过筛分分析确定尺寸。
[0068]
例如,基质微丸可以小袋的形式提供,或可进一步加工。
[0069]
例如,基质微丸还可以提供一种或多种其他的包衣。这允许对释放进行额外控制。
[0070]
在优选实施例中,不提供控制释放的包衣。
[0071]
基质微丸也可用于获得多颗粒剂型。它们可以装入胶囊或掺入片剂中。
[0072]
可将具有不同释放曲线的基质微丸组合成一个剂型(胶囊/片剂/小袋)。
[0073]
根据本发明的固体剂型释放其中所包含的高亲脂性生理活性物质,或者,如果含有超过一种的高亲脂性生理活性物质,则在消化道中摄入后释放其中所包含的所有高亲脂性生理活性物质。该剂型特别用于控制释放。特别是,它们在2小时内释放超过30wt.-%且小于80wt.-%所含的生理活性物质。此外,它们尤其在3小时内释放超过40wt.-%且小于90wt.-%所含的生理活性物质。此外,它们在4小时内释放超过50wt.-%且小于95wt.-%所含的生理活性物质。如果包含超过一种的生理活性物质,则该信息与所含的所有物质相关。
[0074]
在每种情况下,在叶片搅拌器装置中,在37℃条件下,在1000ml ph值为6.8的磷酸盐缓冲液中添加0.4%80,测定释放。
[0075]
示例
[0076]
下面的示例展示了如何通过使用水溶性成膜物质来控制高亲脂性生理活性物质的释放。
[0077]
示例1-微丸的生产
[0078]
使用下表1中所示的成分量制备微丸。
[0079]
为此目的,将2-[1r-3-甲基-6r-(1-甲基乙烯基)-2-环己烯-1-基]-5-戊基-1,3-苯二酚(canapure ph)溶于96%乙醇中。该活性成分的log p约为6.1。
[0080]
将hpmc溶于水中,制备另一种溶液。
[0081]
然后将hpmc溶液逐渐加入到大麻二酚溶液中。
[0082]
然后加入无定形二氧化硅(fp)。
[0083]
用螺旋桨搅拌器搅拌。
[0084]
将所得喷雾液体喷洒在由微晶纤维素制成的起始片芯上。
[0085]
这是在带有wurster插件的mini-glatt流化床系统中进行的。空气入口空气温度为40℃。平均喷雾速度为0.5g/min。
[0086]
表1-所用物质和含量
[0087][0088]
表2-产品
[0089][0090]
示例2-释放
[0091]
在1000ml ph值为6.8的磷酸盐缓冲液中加入0.4%80(特别是在37℃下),使用叶片搅拌器装置测定示例1中所得微丸产品的释放。所得结果如图1所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1