封装有HPVmRNA的核酸脂质颗粒疫苗的制作方法
封装有hpv mrna的核酸脂质颗粒疫苗
技术领域
1.本发明涉及封装有hpv mrna的核酸脂质颗粒疫苗。
背景技术:
2.人乳头瘤病毒(human papillomavirus,hpv)为不具有包膜的具有作为基因组的环状双链dna的病毒,存在约200种基因型(非专利文献1)。其中存在使感染细胞致癌的基因型,特别是已被证明与以宫颈癌为代表的癌的发病相关的基因型16和18被分类为高风险型(非专利文献2)。
3.在hpv的基因组中编码8个病毒蛋白质,根据在病毒的生命周期中表达的时期分类为早期基因(e1,e2,e4,e5,e6,e7)和晚期基因(l1, l2)。早期基因对病毒复制及感染细胞的癌化进行调控,l1及l2为成为病毒颗粒外壳(衣壳)的结构蛋白质(非专利文献3)。
4.hpv感染在扁平上皮的基底层存在的角质细胞前体细胞。对hpv的感染而言,起始于通过构成衣壳的l1蛋白质与存在于宿主细胞膜表面的硫酸乙酰肝素蛋白多糖进行吸附(非专利文献4)。由于担任防御hpv感染的中和抗体是以l1蛋白质作为靶标的,因此在目前上市的预防疫苗中,作为药效成分而包含l1蛋白质的vlp(virus-like particle)抗原。另外,在现有的3种所有的预防疫苗中,包含基因型16和18的l1 vlp抗原。任一种疫苗虽然都在未经历hpv感染的青少年的人群中对hpv基因型16 和18的预防效果有95%以上,但未确认到对宫颈癌及为癌前状态的宫颈上皮内瘤变的治疗效果(非专利文献5)。
5.在hpv感染细胞中,由于致癌蛋白e6及e7而导致细胞周期异常。是因为承担细胞周期、诱导凋亡性细胞死亡的p53、prb的功能被e6及 e7阻碍(非专利文献6,7)。已经确认e6及e7中对致癌活性重要的区域,当作为疫苗抗原使用e6及e7时,可以插入灭活突变而提高安全性(非专利文献8-10)。
6.针对hpv感染的宿主防御免疫为中和抗体的诱导,和细胞毒性t细胞(cytotoxic t cell,ctl)、辅助性t细胞的诱导。特别是为非结构蛋白质的e6、e7,是诱导ctl的目标抗原,作为hpv感染引起的宫颈癌,及宫颈上皮内瘤变的治疗疫苗抗原受关注(非专利文献11)。
7.在专利文献1中,记载了hpv基因型6,11,16,18,31,33,39, 45,52及58的e6和e7融合抗原基因序列。在该文献记载的基因序列中,在e6的n末端添加ige前导序列,在e6和e7的翻译区域序列之间插入了弗林蛋白酶的切割位点。另外,将突变插入e6的p53结合区域和e7的 prb结合区域,将e6及e7的致癌活性灭活。将该基因序列导入到哺乳类表达质粒中,作为对于hpv的dna基因疫苗在小鼠模型中实施了药效评价。免疫为使用电穿孔法在小鼠大腿部进行肌内施用。
8.现有技术文献
9.非专利文献
10.非专利文献1:virology 2013;445:2e10.
11.非专利文献2:j natl cancer inst 1995;87:796-802.
12.非专利文献3:j clin virol 2005;32(suppl.1):s7e15.
13.非专利文献4:proc natl acad sci u.s.a 2009;106:20458e63.
14.非专利文献5:gynecologic oncology 146(2017)196-204
15.非专利文献6:cell 1990;63:1129e36
16.非专利文献7:cancer res 1996;56:4620e4.
17.非专利文献8:j virol,1989,p.2650-2656
18.非专利文献9:j virol,1992,p.1329-1335
19.非专利文献10:j virol,1994,p.5698-5705
20.非专利文献11:nat rev cancer.2006,6(10):753-763.
21.专利文献
22.专利文献1:jp 2016-512553
23.发明概述
24.发明要解决的问题
25.本发明的目的在于提供用于预防和/或治疗人乳头瘤病毒引起的感染的疫苗。
26.用于解决问题的方法
27.本发明人发现对移植了癌细胞的小鼠施用封装有编码人乳头瘤病毒 e6-e7抗原的mrna的脂质颗粒时,观察到肿瘤退缩效果,从而完成了本发明。
28.本发明的要点如下所述。
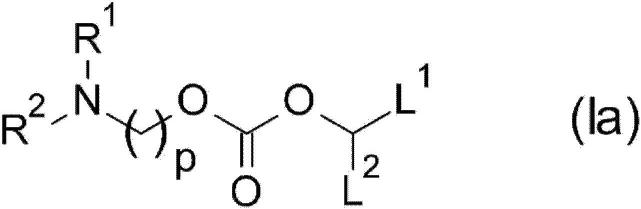
29.(1)封装有能够表达人乳头瘤病毒e6抗原及e7抗原的核酸的脂质颗粒,其中脂质包含通式(ia)所示的阳离子脂质或其药学上允许的盐,
30.[化学式1]
[0031][0032]
式中,
[0033]
r1及r2独立地表示c
1-c3烷基;
[0034]
l1表示任选具有1个或多个c
2-c4烷酰基氧基的c
17-c
19
烯基;
[0035]
l2表示任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烷基,或任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烯基;
[0036]
p为3或4。
[0037]
(2)根据(1)所述的颗粒,其中通式(ia)中的r1及r2同时为甲基。
[0038]
(3)根据(1)或(2)所述的颗粒,其中通式(ia)中的p为3。
[0039]
(4)根据(1)~(3)中任一项所述的颗粒,其中通式(ia)中的l1为任选具有 1个或多个乙酰氧基的c
17-c
19
烯基。
[0040]
(5)根据(1)~(4)中任一项所述的颗粒,其中通式(ia)中的l2为任选具有 1个或多个乙酰氧基的c
10-c
12
烷基,或任选具有1个或多个乙酰氧基的 c
10-c
19
烯基。
[0041]
(6)根据(1)~(4)中任一项所述的颗粒,其中通式(ia)中的l2为任选具有 1个或
多个乙酰氧基的c
10-c
12
烷基,或任选具有1个或多个乙酰氧基的 c
17-c
19
烯基。
[0042]
(7)根据(1)~(6)中任一项所述的颗粒,其中,通式(ia)中的l1为(r)-11
‑ꢀ
乙酰氧基-顺-8-十七碳烯基,顺-8-十七碳烯基,或(8z,11z)-十七碳二烯基。
[0043]
(8)根据(1)~(7)中任一项所述的颗粒,其中通式(ia)中的l2为癸基,顺
ꢀ‑
7-癸烯基,十二烷基,或(r)-11-乙酰氧基-顺-8-十七碳烯基。
[0044]
(9)根据(1)所述的颗粒,其中阳离子脂质如下述结构式所示:
[0045]
[化学式2]
[0046][0047]
(10)根据(1)所述的颗粒,其中阳离子脂质如下述结构式所示:
[0048]
[化学式3]
[0049][0050]
(11)根据(1)所述的颗粒,其中阳离子脂质如下述结构式所示:
[0051]
[化学式4]
[0052][0053]
(12)根据(1)~(11)中任一项所述的颗粒,其中脂质进一步包含两亲性脂质,甾醇类及peg脂质。
[0054]
(13)根据(12)所述的颗粒,其中两亲性脂质为选自由二硬脂酰磷脂酰胆碱,二油酰磷脂酰胆碱及二油酰磷脂酰乙醇胺组成的组中的至少1种。
[0055]
(14)根据(12)或(13)所述的颗粒,其中甾醇类为胆固醇。
[0056]
(15)根据(12)~(14)中任一项所述的颗粒,其中peg脂质为1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇和/或n-[甲氧基聚(乙二醇)2000]氨基甲酰]-1,2-二肉豆蔻氧基丙基-3-胺。
[0057]
(16)根据(12)~(15)中任一项所述的颗粒,其中两亲性脂质,甾醇类,阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为15%以下,甾醇类为20~55%,阳离子脂质为40~65%,peg脂质为1~5%,总脂质重量相对于核酸重量的比率为15~30。
[0058]
(17)根据(16)所述的颗粒,其中两亲性脂质、甾醇类、阳离子脂质及 peg脂质的脂质组成为,以摩尔量计,两亲性脂质为5~15%,甾醇类为 35~50%,阳离子脂质为40~55%,peg脂质为1~3%,总脂质重量相对于核酸重量的比率为15~25。
[0059]
(18)根据(17)所述的颗粒,其中两亲性脂质、甾醇类、阳离子脂质及 peg脂质的脂质组成为,以摩尔量计,两亲性脂质为10~15%,甾醇类为 35~45%,阳离子脂质为40~50%,peg脂质为1~2%,总脂质重量相对于核酸重量的比率为17.5~22.5。
[0060]
(19)根据(18)所述的颗粒,其中两亲性脂质、甾醇类、阳离子脂质及 peg脂质的脂质组成为,以摩尔量计,两亲性脂质为10~15%,甾醇类为 35~45%,阳离子脂质为45~50%,peg脂质为1.5~2%,总脂质重量相对于核酸重量的比率为17.5~22.5。
[0061]
(20)根据(1)~(19)中任一项所述的颗粒,其中人乳头瘤病毒为hpv16 型。
[0062]
(21)根据(20)所述的颗粒,其中人乳头瘤病毒为hpv16型,hpv16 型的e6抗原由与seq id no:8的氨基酸序列至少具有95%同一性的氨基酸序列组成。
[0063]
(22)根据(20)或(21)所述的颗粒,其中人乳头瘤病毒为hpv16型, hpv16型的e7抗原由与seq id no:9的氨基酸序列至少具有95%同一性的氨基酸序列组成。
[0064]
(23)根据(20)~(22)中任一项所述的颗粒,其中人乳头瘤病毒为hpv16 型,能够表达hpv16型的e6抗原及e7抗原的核酸为包含帽子结构(cap), 5’非翻译区域(5
’‑
utr),前导序列(leader sequence),e6的翻译区域,蛋白酶切割序列(弗林蛋白酶切割位点),e7的翻译区域,3’非翻译区域(3
’‑
utr) 及polya尾部(polya)的mrna。
[0065]
(24)根据(23)所述的颗粒,其中能够表达hpv16型的e6抗原及e7 抗原的核酸的序列由与seq id no:2,4或6中的任一序列至少具有90%同一性的核苷酸序列组成。
[0066]
(25)根据(1)~(24)中任一项所述的颗粒,其中核酸包含至少1个修饰核苷酸。
[0067]
(26)根据(25)所述的颗粒,其中修饰核苷酸包含在5位取代的嘧啶核苷酸和/或在1位任选取代的假尿苷中的至少1个。
[0068]
(27)根据(25)所述的颗粒,其中修饰核苷酸为选自由5-甲基胞苷,5
‑ꢀ
甲氧基尿苷,5-甲基尿苷,假尿苷,及1-烷基假尿苷组成的组中的至少1 个。
[0069]
(28)根据(1)~(27)中任一项所述的颗粒,平均粒径为30nm~300nm。
[0070]
(29)根据(1)~(28)中任一项所述的颗粒用于制备用于预防和/或治疗人乳头瘤病毒引起的感染的组合物的用途。
[0071]
(30)根据(29)所述的颗粒的用途,其中感染为hpv16型的人乳头瘤病毒引起的感染。
[0072]
(31)组合物,含有(1)~(28)中任一项所述的颗粒。
[0073]
(32)根据(31)所述的组合物,其用于在体内或体外表达人乳头瘤病毒 e6抗原及e7抗原。
[0074]
(33)根据(31)或(32)所述的组合物,其作为药物使用。
[0075]
(34)根据(33)所述的组合物,其用于诱导对于人乳头瘤病毒的免疫反应。
[0076]
(35)根据(33)或(34)所述的组合物,其用于预防和/或治疗人乳头瘤病毒感染。
[0077]
(36)体外表达人乳头瘤病毒e6抗原及e7抗原的方法,其包括将(31) 或(32)所述的组合物导入细胞。
[0078]
(37)体内表达人乳头瘤病毒e6抗原及e7抗原的方法,其包括将 (31)~(35)中任一项所述的组合物施用于哺乳动物。
[0079]
(38)诱导对于人乳头瘤病毒的免疫反应的方法,其包括将(33)或(34) 所述的组合物施用于哺乳动物。
[0080]
(39)预防和/或治疗人乳头瘤病毒感染的方法,其包括将(33)~(35)中任一项所述的组合物施用于哺乳动物。
[0081]
另外,本发明的其他实施方式的要点如下。
[0082]
(1-1)封装有能够表达人乳头瘤病毒e6抗原及e7抗原的核酸的脂质颗粒,其中脂质包含通式(ia)所示的阳离子脂质或其药学上允许的盐,
[0083]
[化学式5]
[0084][0085]
式中,
[0086]
r1及r2独立地表示c
1-c3烷基;
[0087]
l1表示任选具有1个或多个c
2-c4烷酰基氧基的c
17-c
19
烯基;
[0088]
l2表示任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烷基,或任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烯基;
[0089]
p为3或4。
[0090]
(1-2)根据(1-1)所述的颗粒,其中通式(ia)中的r1及r2同时为甲基。
[0091]
(1-3)根据(1-1)或(1-2)所述的颗粒,其中通式(ia)中的p为3。
[0092]
(1-4)根据(1-1)~(1-3)中任一项所述的颗粒,其中通式(ia)中的l1为任选具有1个或多个乙酰氧基的c
17-c
19
烯基。
[0093]
(1-5)根据(1-1)~(1-4)中任一项所述的颗粒,其中通式(ia)中的l2为任选具有1个或多个乙酰氧基的c
10-c
12
烷基,或任选具有1个或多个乙酰氧基的c
10-c
19
烯基。
[0094]
(1-6)根据(1-1)~(1-4)中任一项所述的颗粒,其中通式(ia)中的l2为任选具有1个或多个乙酰氧基的c
10-c
12
烷基,或任选具有1个或多个乙酰氧基的c
17-c
19
烯基。
[0095]
(1-7)根据(1-1)~(1-6)中任一项所述的颗粒,其中通式(ia)中的l1为 (r)-11-乙酰氧基-顺-8-十七碳烯基,顺-8-十七碳烯基,或(8z,11z)-十七碳二烯基。
[0096]
(1-8)根据(1-1)~(1-7)中任一项所述的颗粒,其中通式(ia)中的l2为癸基,顺-7-癸烯基,十二烷基,或(r)-11-乙酰氧基-顺-8-十七碳烯基。
[0097]
(1-9)根据(1-1)所述的颗粒,其中阳离子脂质如下述结构式所示:
[0098]
[化学式6]
[0099]
[0100]
(1-10)根据(1-1)所述的颗粒,其中阳离子脂质如下述结构式所示:
[0101]
[化学式7]
[0102][0103]
(1-11)根据(1-1)所述的颗粒,其中阳离子脂质如下述结构式所示:
[0104]
[化学式8]
[0105][0106]
(1-12)根据(1-9)或(1-10)所述的颗粒,其中脂质进一步包含两亲性脂质,甾醇类及peg脂质。
[0107]
(1-13)根据(1-11)所述的颗粒,其中脂质进一步包含两亲性脂质,甾醇类及peg脂质。
[0108]
(1-14)根据(1-12)所述的颗粒,其中两亲性脂质为选自由二硬脂酰磷脂酰胆碱,二油酰磷脂酰胆碱及二油酰磷脂酰乙醇胺组成的组中的至少1 种。
[0109]
(1-15)根据(1-13)所述的颗粒,其中两亲性脂质为选自由二硬脂酰磷脂酰胆碱,二油酰磷脂酰胆碱及二油酰磷脂酰乙醇胺组成的组中的至少1 种。
[0110]
(1-16)根据(1-12)或(1-14)所述的颗粒,其中甾醇类为胆固醇。
[0111]
(1-17)根据(1-13)或(1-15)所述的颗粒,其中甾醇类为胆固醇。
[0112]
(1-18)根据(1-12),(1-14),(1-16)中任一项所述的颗粒,其中peg脂质为1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇和/或n-[甲氧基聚(乙二醇)2000]氨基甲酰]-1,2-二肉豆蔻氧基丙基-3-胺。
[0113]
(1-19)根据(1-13),(1-15),(1-17)中任一项所述的颗粒,其中peg脂质为1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇和/或n-[甲氧基聚(乙二醇)2000]氨基甲酰]-1,2-二肉豆蔻氧基丙基-3-胺。
[0114]
(1-20)根据(1-12)~(1-19)中任一项所述的颗粒,其中两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为22.5%以下,甾醇类为15~55%,阳离子脂质为40~65%,peg脂质为 1~5%,总脂质重量相对于核酸重量的比率为15~30。
[0115]
(1-21)根据(1-20)所述的颗粒,其中两亲性脂质为5~22.5%。
[0116]
(1-22)根据(1-21)所述的颗粒,其中两亲性脂质为10~22.5%。
[0117]
(1-23)根据(1-20)~(1-22)中任一项所述的颗粒,其中peg脂质为1~3%。
[0118]
(1-24)根据(1-23)所述的颗粒,其中peg脂质为1~2%。
[0119]
(1-25)根据(1-12),(1-14),(1-16),(1-18)中任一项所述的颗粒,其中两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为5~15%,甾醇类为35~50%,阳离子脂质为40~55%, peg脂质为1~3%,总脂质重量相对于核酸重量的
比率为15~30。
[0120]
(1-26)根据(1-25)所述的颗粒,其中两亲性脂质为10~15%,甾醇类为 35~45%,阳离子脂质为40~50%,peg脂质为1~2%。
[0121]
(1-27)根据(1-26)所述的颗粒,其中两亲性脂质为10~15%,甾醇类为 35~45%,阳离子脂质为45~50%,peg脂质为1.5~2%。
[0122]
(1-28)根据(1-13),(1-15),(1-17),(1-19)中任一项所述的颗粒,其中两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为15~22.5%,甾醇类为15~40%,阳离子脂质为40~60%, peg脂质为1~3%,总脂质重量相对于核酸重量的比率为15~30。
[0123]
(1-29)根据(1-28)所述的颗粒,其中阳离子脂质为45~60%,peg脂质为1~2%。
[0124]
(1-30)根据(1-29)所述的颗粒,其中两亲性脂质为17.5~22.5%。
[0125]
(1-31)根据(1-20)~(1-30)中任一项所述的颗粒,其中总脂质重量相对于核酸重量的比率为15~25。
[0126]
(1-32)根据(1-31)所述的颗粒,其中总脂质重量相对于核酸重量的比率为15~22.5。
[0127]
(1-33)根据(1-32)所述的颗粒,其中总脂质重量相对于核酸重量的比率为17.5~22.5。
[0128]
(1-34)根据(1-1)~(1-33)中任一项所述的颗粒,其中人乳头瘤病毒为 hpv16型。
[0129]
(1-35)根据(1-34)所述的颗粒,其中人乳头瘤病毒为hpv16型,hpv16 型的e6抗原由与seq id no:8的氨基酸序列至少具有95%同一性的氨基酸序列组成。
[0130]
(1-36)根据(1-34)或(1-35)所述的颗粒,其中人乳头瘤病毒为hpv16 型,hpv16型的e7抗原由与seq id no:9的氨基酸序列至少具有95%同一性的氨基酸序列组成。
[0131]
(1-37)根据(1-34)~(1-36)中任一项所述的颗粒,人乳头瘤病毒为 hpv16型,能够表达人乳头瘤病毒e6抗原及e7抗原的核酸编码hpv16 型的e6抗原及e7抗原的融合蛋白,所述融合蛋白由与seq id no:17 的氨基酸序列至少具有95%同一性的氨基酸序列组成。
[0132]
(1-38)根据(1-34)~(1-37)中任一项所述的颗粒,其中人乳头瘤病毒为 hpv16型,能够表达hpv16型的e6抗原及e7抗原的核酸为包含帽子结构(cap),5’非翻译区域(5
’‑
utr),前导序列(leader sequence),e6的翻译区域,蛋白酶切割序列(弗林蛋白酶切割位点),e7的翻译区域,3’非翻译区域(3
’‑
utr)及polya尾部(polya)的mrna。
[0133]
(1-39)根据(1-38)所述的颗粒,其中能够表达hpv16型的e6抗原及 e7抗原的核酸的序列由与seq id no:2,4或6中的任一序列至少具有 90%同一性的核苷酸序列组成。
[0134]
(1-40)根据(1-1)~(1-33)中任一项所述的颗粒,其中人乳头瘤病毒为 hpv18型。
[0135]
(1-41)根据(1-40)所述的颗粒,其中人乳头瘤病毒为hpv18型,hpv18 型的e6抗原由与seq id no:14的氨基酸序列至少具有95%同一性的氨基酸序列组成。
[0136]
(1-42)根据(1-40)或(1-41)所述的颗粒,其中人乳头瘤病毒为hpv18 型,hpv18型的e7抗原由与seq id no:15的氨基酸序列至少具有95%同一性的氨基酸序列组成。
[0137]
(1-43)根据(1-40)~(1-42)中任一项所述的颗粒,其中人乳头瘤病毒为 hpv18型,能够表达人乳头瘤病毒e6抗原及e7抗原的核酸编码hpv18 型的e6抗原及e7抗原的融合蛋白,所述融合蛋白由与seq id no:18 的氨基酸序列至少具有95%同一性的氨基酸序列
组成。
[0138]
(1-44)根据(1-40)~(1-43)中任一项所述的颗粒,其中人乳头瘤病毒为 hpv18型,能够表达hpv18型的e6抗原及e7抗原的核酸为包含帽子结构(cap),5’非翻译区域(5
’‑
utr),前导序列(leader sequence),e6的翻译区域,蛋白酶切割序列(弗林蛋白酶切割位点),e7的翻译区域,3’非翻译区域(3
’‑
utr)及polya尾部(polya)的mrna。
[0139]
(1-45)根据(1-44)所述的颗粒,其中能够表达hpv18型的e6抗原及 e7抗原的核酸的序列由与seq id no:11或13中的任一序列至少具有90%同一性的核苷酸序列组成。
[0140]
(1-46)根据(1-1)~(1-45)中任一项所述的颗粒,其中核酸包含至少1个修饰核苷酸。
[0141]
(1-47)根据(1-46)所述的颗粒,其中修饰核苷酸包含在5位取代的嘧啶核苷酸和/或在1位任选取代的假尿苷中的至少1个。
[0142]
(1-48)根据(1-46)所述的颗粒,其中修饰核苷酸包含选自由5-甲基胞苷,5-甲氧基尿苷,5-甲基尿苷,假尿苷,及1-烷基假尿苷组成的组中的至少1个。
[0143]
(1-49)根据(1-46)所述的颗粒,其中修饰核苷酸包含选自由5-甲基胞苷,5-甲基尿苷,及1-甲基假尿苷组成的组中的至少1个。
[0144]
(1-50)根据(1-1)~(1-49)中任一项所述的颗粒,平均粒径为 30nm~300nm。
[0145]
(1-51)根据(1-1)~(1-50)中任一项所述的颗粒用于制备用于预防和/或治疗人乳头瘤病毒引起的感染的组合物的用途。
[0146]
(1-52)根据(1-51)所述的颗粒的用途,其中感染为hpv16型或hpv18 型的人乳头瘤病毒引起的感染。
[0147]
(1-53)组合物,含有根据(1-1)~(1-50)中任一项所述的颗粒。
[0148]
(1-54)根据(1-53)所述的组合物,其用于在体内或体外表达人乳头瘤病毒e6抗原及e7抗原。
[0149]
(1-55)根据(1-53)或(1-54)所述的组合物,其作为药物使用。
[0150]
(1-56)根据(1-55)所述的组合物,其用于诱导对于人乳头瘤病毒的免疫反应。
[0151]
(1-57)根据(1-55)或(1-56)所述的组合物,其用于预防和/或治疗人乳头瘤病毒感染。
[0152]
(1-58)体外表达人乳头瘤病毒e6抗原及e7抗原的方法,其包括将 (1-53)或(1-54)所述的组合物导入细胞。
[0153]
(1-59)体内表达人乳头瘤病毒e6抗原及e7抗原的方法,其包括将 (1-53)~(1-57)中任一项所述的组合物施用于哺乳动物。
[0154]
(1-60)诱导对于人乳头瘤病毒的免疫反应的方法,其包括将(1-55)或 (1-56)所述的组合物施用于哺乳动物。
[0155]
(1-61)预防和/或治疗人乳头瘤病毒感染的方法,其包括将 (1-55)~(1-57)中任一项所述的组合物施用于哺乳动物。
[0156]
发明效果
[0157]
根据本发明能够预防和/或治疗人乳头瘤病毒引起的感染。另外,根据本发明能够预防和/或治疗人乳头瘤病毒引起的感染导致的疾病(宫颈癌,及宫颈上皮内瘤变等)。另外,本发明的颗粒在代谢稳定性、体外活性,体内活性,迅速发挥药效,药效的持续性、物理
稳定性、药物相互作用,安全性等方面具有优异的性质,作为用于治疗或预防上述疾病的药物有用。
[0158]
在本说明书中包含在作为本技术的优先权的基础的日本专利申请特愿2019-207001的说明书和/或附图中所记载的内容。
附图说明
[0159]
[图1]hek293t细胞中来自封装mrna核酸脂质颗粒的hpv基因型16的e7蛋白表达水平。实施例14-17;封装mrna核酸脂质颗粒,nc;未进行处理而成的阴性对照。试验以一式两份实施,平均值以柱状图,各个数据以圆圈符号示出。
[0160]
[图2]在c57bl/6小鼠中,dna疫苗模型和封装mrna核酸脂质颗粒的ctl诱导水平。pdna;参考例1的dna疫苗模型施用组,实施例 9,11,13;施用封装mrna核酸脂质颗粒组,nc;未进行处理而成的阴性对照组。pbmc;外周血单核细胞,脾细胞(splenocyte);脾细胞。
[0161]
[图3]在c57bl/6小鼠中,封装mrna核酸脂质颗粒的ctl诱导水平。实施例14-17;施用封装mrna核酸脂质颗粒组,nc;未进行处理而成的阴性对照组。脾细胞(splenocyte);脾细胞。
[0162]
[图4]在除去cd4阳性细胞及cd8阳性细胞的小鼠中,封装mrna 核酸脂质颗粒的抗体诱导能力。对照组;未经封装mrna核酸脂质颗粒处理的小鼠,实施例20;实施例20的施用封装mrna核酸脂质颗粒的小鼠。对照组(未去除),实施例20(未去除);不施用去除抗体的对照组。对照组(cd4去除),实施例20(cd4去除);去除cd4阳性细胞的抗体施用组。对照组(cd8去除),实施例20(cd8去除);cd8阳性细胞去除抗体施用组。
[0163]
[图5]除去cd4阳性细胞及cd8阳性细胞的小鼠中,封装mrna核酸脂质颗粒的ctl诱导能力。对照组;未经封装mrna核酸脂质颗粒处理的小鼠,实施例20;实施例20的施用封装mrna核酸脂质颗粒的小鼠。对照组(未去除),实施例20(未去除);不施用去除抗体的对照组。对照组 (cd4去除),实施例20(cd4去除);去除cd4阳性细胞的抗体施用组。对照组(cd8去除),实施例20(cd8去除);cd8阳性细胞去除抗体施用组。
[0164]
[图6]tc-1癌移植模型中,封装mrna核酸脂质颗粒的癌增殖抑制效果。对照组;不施用封装mrna核酸脂质颗粒的对照组,实施例20;实施例20的施用封装mrna核酸脂质颗粒小鼠。对照组(未去除),实施例 20(未去除);不施用去除抗体的对照组。对照组(cd4去除),实施例20(cd4 去除);去除cd4阳性细胞的抗体施用组。对照组(cd8去除),实施例 20(cd8去除);cd8阳性细胞去除抗体施用组。肿瘤尺寸以肿瘤的长(mm)
ꢀ×
宽(mm)
×
高(mm)的体积表示。
[0165]
[图7]在c57bl/6小鼠中,封装mrna核酸脂质颗粒的ova特异性的抗体诱导水平。实施例21-27;施用封装mrna核酸脂质颗粒组,nc;未进行处理而成的阴性对照组。
[0166]
[图8]在c57bl/6小鼠中,封装mrna核酸脂质颗粒的ova特异性的ifn-γ产生水平。实施例21-27;施用封装mrna核酸脂质颗粒组, nc;未进行处理而成的阴性对照组。无刺激;非刺激而成的阴性对照, mhc i类;c57bl/6小鼠的mhc i类限制性的表位肽刺激,ova;ova 蛋白刺激。
[0167]
[图9]在c57bl/6小鼠中,封装mrna核酸脂质颗粒的ctl诱导水平。实施例28-32;施用封装mrna核酸脂质颗粒组,nc;未进行处理而成的阴性对照组。脾细胞(splenocyte);脾
细胞。
[0168]
[图10]在c57bl/6小鼠中,封装mrna核酸脂质颗粒的hpv18e6特异性的ifn-γ产生水平。实施例37-40;施用封装mrna核酸脂质颗粒组, nc;施用缓冲液的阴性对照组。无肽;无肽处理的阴性对照组,hpv18e6 重叠肽;hpv18e6池肽处理组
[0169]
[图11]在c57bl/6小鼠中,封装mrna核酸脂质颗粒的ctl诱导水平。实施例41-52;施用封装mrna核酸脂质颗粒组,nc;施用缓冲液的阴性对照组。
[0170]
[图12]在c57bl/6小鼠中,封装mrna核酸脂质颗粒的hpv16e7特异性的ifn-γ产生水平。实施例41-52;施用封装mrna核酸脂质颗粒组, nc;施用缓冲液的阴性对照组。无肽;无肽处理的阴性对照组,mhc i 类肽;hpv16e7的mhc i类限制性表位肽处理组。
具体实施方式
[0171]
以下,对本发明的实施形态进一步详细说明。
[0172]
本发明提供封装有能够表达人乳头瘤病毒e6抗原及e7抗原的核酸的脂质颗粒,其中脂质包含通式(ia)所示的阳离子脂质或其药学上允许的盐,
[0173]
[化学式9]
[0174][0175]
式中,
[0176]
r1及r2独立地表示c
1-c3烷基;
[0177]
l1表示任选具有1个或多个c
2-c4烷酰基氧基的c
17-c
19
烯基;
[0178]
l2表示任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烷基,或任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烯基;
[0179]
p为3或4。
[0180]
对通式(ia)中的r1及r2而言,独立地表示c
1-c3烷基,优选同时为甲基。
[0181]
通式(ia)中的p为3或4,优选为3。
[0182]
通式(ia)中的l1表示任选具有1个或多个c
2-c4烷酰基氧基的c
17-c
19
烯基,优选为任选具有1个或多个乙酰氧基的c
17-c
19
烯基。作为l1,具体可例示(r)-11-乙酰氧基-顺-8-十七碳烯基,顺-8-十七碳烯基,或(8z,11z)
‑ꢀ
十七碳二烯基等。
[0183]
通式(ia)中的l2表示任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烷基,或任选具有1个或多个c
2-c4烷酰基氧基的c
10-c
19
烯基显示,优选地为任选具有1个或多个乙酰氧基的c
10-c
12
烷基,或任选具有1个或多个乙酰氧基的c
10-c
19
烯基。或者另外也优选通式(ia)中的l2为任选具有1 个或多个乙酰氧基的c
10-c
12
烷基,或任选具有1个或多个乙酰氧基的 c
17-c
19
烯基。作为l2,具体可例示癸基,顺-7-癸烯基,十二烷基,或(r)-11
‑ꢀ
乙酰氧基-顺-8-十七碳烯基等。
[0184]
作为构成本发明的颗粒的成分的阳离子脂质,具体可例示如下述的结构式:
[0185]
[化学式10]
[0186][0187]
[化学式11]
[0188][0189]
[化学式12]
[0190][0191]
分别表示的二乙酸(7r,9z,26z,29r)-18-({[3-(二甲基氨基)丙氧基]羰基} 氧基)三十五碳-9,26-二烯-7,29-二基酯,碳酸3-二甲基氨基丙基(9z,12z)
‑ꢀ
二十八碳-19,22-二烯-11-基酯,乙酸(7r,9z)-18-({[3-(二甲基氨基)丙氧基] 羰基}氧基)二十八碳-9-烯-7-基酯。
[0192]
通式(ia)表示的阳离子脂质可以为1种化合物或2种以上的化合物的组合。
[0193]
制备通式(ia)表示的阳离子脂质的方法记载在国际公报第2015/005253 号小册子中。
[0194]
本发明的脂质可以进一步包含两亲性脂质,甾醇类及peg脂质。
[0195]
两亲性脂质为对极性、非极性的溶剂均具有亲和性的脂质,具体可例示二硬脂酰磷脂酰胆碱,二油酰磷脂酰胆碱,二油酰磷脂酰乙醇胺,这些的组合等。作为本发明的颗粒中使用的两亲性脂质,优选二硬脂酰磷脂酰胆碱和/或二油酰磷脂酰乙醇胺,更优选二硬脂酰磷脂酰胆碱。
[0196]
甾醇类为具有羟基的甾醇,具体可例示胆固醇等。
[0197]
peg脂质为具有peg修饰的脂质,具体可例示1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇和/或n-[甲氧基聚(乙二醇)2000]氨基甲酰]-1,2-二肉豆蔻氧基丙基-3-胺,这些的组合等,优选为1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇。
[0198]
对两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成没有特别限制,优选以摩尔量计,两亲性脂质为22.5%以下,甾醇类为15~55%,阳离子脂质为40~65%,peg脂质为1~5%,总脂质重量相对于核酸重量的比率为15~30,更优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为5~22.5%,甾醇类为15~55%,阳离子脂质为40~65%,peg脂质为1~5%,总脂质重量相对于核酸重量的比率为15~30,进一步优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为10~22.5%,甾醇类为15~55%,阳离子脂质为40~65%,peg脂质为1~5%,
总脂质重量相对于核酸重量的比率为15~30。在上述脂质组成中,peg脂质的比例以摩尔量计更优选为1~3%,进一步更优选1~2%,特别优选1.5~2%。另外,在上述脂质组成中,总脂质重量相对于核酸重量的比率更优选为15~25,进一步更优选 15~22.5,特别优选17.5~22.5。
[0199]
当作为阳离子脂质使用碳酸3-二甲基氨基丙基(9z,12z)-二十八碳
ꢀ‑
19,22-二烯-11-基酯,或二乙酸(7r,9z,26z,29r)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基)三十五碳-9,26-二烯-7,29-二基酯的情况下,对两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成没有特别限制,优选以摩尔量计,两亲性脂质为15%以下,甾醇类为20~55%,阳离子脂质为40~65%, peg脂质为1~5%,更优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为5~15%,甾醇类为35~50%,阳离子脂质为40~55%,peg脂质为1~3%,进一步更优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为10~15%,甾醇类为35~45%,阳离子脂质为40~50%,peg脂质为1~2%,进一步更优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为10~15%,甾醇类为35~45%,阳离子脂质为45~50%,peg脂质为1.5~2%,特别优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为12.5%,甾醇类为41%,阳离子脂质为45%,peg脂质为1.5%。在上述脂质组成中,总脂质重量相对于核酸重量的比率优选为15~30,更优选为15~25,进一步更优选15~22.5,特别优选17.5~22.5。
[0200]
当作为阳离子脂质使用乙酸(7r,9z)-18-({[3-(二甲基氨基)丙氧基]羰基} 氧基)二十八碳-9-烯-7-基酯的情况下,对两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成没有特别限制,优选以摩尔量计,两亲性脂质为12.5~22.5%,甾醇类为15~45%,阳离子脂质为40~65%,peg脂质为 1~5%,更优选为两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为15~22.5%,甾醇类为15~40%,阳离子脂质为40~60%,peg脂质为1~3%,更优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为15~22.5%,甾醇类为15~40%,阳离子脂质为45~60%,peg脂质为1~2%,进一步更优选两亲性脂质、甾醇类、阳离子脂质及peg脂质的脂质组成为,以摩尔量计,两亲性脂质为17.5~22.5%,甾醇类为15~40%,阳离子脂质为 45~60%,peg脂质为1~2%。在上述脂质组成中,总脂质重量相对于核酸重量的比率优选为15~30,更优选为15~25,进一步更优选15~22.5,特别优选17.5~22.5。
[0201]
作为本发明中具体脂质的组合,可以组合使用以下这些:作为两亲性脂质为二硬脂酰磷脂酰胆碱,二油酰磷脂酰胆碱,或二油酰磷脂酰乙醇胺,作为甾醇类为胆固醇,作为阳离子脂质为二乙酸 (7r,9z,26z,29r)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基)三十五碳-9,26-二烯-7,29-二基酯,碳酸3-二甲基氨基丙基(9z,12z)-二十八碳-19,22-二烯-11
‑ꢀ
基酯,或乙酸(7r,9z)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基)二十八碳-9
‑ꢀ
烯-7-基酯,作为peg脂质为1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇或 n-[甲氧基聚(乙二醇)2000]氨基甲酰]-1,2-二肉豆蔻氧基丙基-3-胺。另外,优选为使用下述这些的脂质的组合:作为两亲性脂质为二硬脂酰磷脂酰胆碱,或二油酰磷脂酰乙醇胺,作为甾醇类为胆固醇,作为阳离子脂质为二乙酸(7r,9z,26z,29r)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基)三十五碳
ꢀ‑
9,26-二烯-7,29-二基酯,或乙酸(7r,9z)-18-({[3-(二甲基氨基)丙氧基]羰基} 氧
基)二十八碳-9-烯-7-基酯,作为peg脂质为1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇。作为本发明中具体脂质的组合,更优选作为两亲性脂质为二硬脂酰磷脂酰胆碱,作为甾醇类为胆固醇,作为阳离子脂质为二乙酸 (7r,9z,26z,29r)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基)三十五碳-9,26-二烯-7,29-二基酯,或乙酸(7r,9z)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基) 二十八碳-9-烯-7-基酯,作为peg脂质为1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇。
[0202]
在本发明中,被脂质颗粒封装的核酸为能够表达人乳头瘤病毒e6抗原及e7抗原的那些。对被脂质颗粒封装的核酸表达的人乳头瘤病毒e6抗原和e7抗原而言,可以为两者的融合蛋白,在e6抗原和e7抗原之间可以包含蛋白酶切割序列。对人乳头瘤病毒的基因型没有特别限定,可例示 hpv16型,18型,31型,33型,35型,39型,45型,51型,52型,56 型,58型,59型,68型。hpv16型,18型,31型,33型,35型,39 型,45型,51型,52型,56型,58型,59型,68型已被证明与以宫颈癌为代表的癌的发病相关。
[0203]
hpv16型的e6抗原的氨基酸序列示于seq id no:8。被脂质颗粒封装的核酸可以为编码由与seq id no:8的氨基酸序列至少具有95%、优选为96%,更优选为97%同一性的氨基酸序列组成的hpv16型的e6抗原的那些。
[0204]
hpv16型的e7抗原的氨基酸序列示于seq id no:9。被脂质颗粒封装的核酸可以为编码由与seq id no:9的氨基酸序列至少具有95%、优选为96%,更优选为97%同一性的氨基酸序列组成的hpv16型的e7抗原的那些。
[0205]
hpv18型的e6抗原的氨基酸序列示于seq id no:14。被脂质颗粒封装的核酸可以为编码由与seq id no:14的氨基酸序列至少具有95%、优选为96%,更优选为97%同一性的氨基酸序列组成的hpv18型的e6 抗原的那些。
[0206]
hpv18型的e7抗原的氨基酸序列示于seq id no:15。被脂质颗粒封装的核酸可以为编码由与seq id no:15的氨基酸序列至少具有95%、优选为96%,更优选为97%同一性的氨基酸序列组成的hpv18型的e7 抗原的那些。
[0207]
蛋白酶切割序列(furin cleavage site,弗林蛋白酶切割位点)的氨基酸序列示于seq id no:16。作为蛋白酶切割序列,为被弗林蛋白酶蛋白切割的序列即可,可列举例如:r-x-k/r-r(r为精氨酸,k为赖氨酸,x表示任意氨基酸)表示的序列等(j.biol.chem.1992,267,16396; j.biol.chem.1991,266,12127)。
[0208]
hpv16型的e6抗原及e7抗原的融合蛋白氨基酸序列示于seq id no: 17。被脂质颗粒封装的核酸可以为编码hpv16型的e6抗原及e7抗原的融合蛋白的那些,所述融合蛋白由与seq id no:17的氨基酸序列至少具有95%、优选为96%,更优选为97%同一性的氨基酸序列组成。
[0209]
hpv18型的e6抗原及e7抗原的融合蛋白氨基酸序列示于seq id no: 18。被脂质颗粒封装的核酸可以为编码hpv18型的e6抗原及e7抗原的融合蛋白的那些,所述融合蛋白由与seq id no:18的氨基酸序列至少具有95%、优选为96%,更优选为97%同一性的氨基酸序列组成。
[0210]
氨基酸序列的同一性(identity)是指将相应的氨基酸为完全一致的氨基酸作为相同氨基酸,将氨基酸相对于全长序列的一致比例写作数值。本发明中序列的同一性使用序列分析软件genetyx-sv/rc(genetics株式会社制)算出,该算法在本技术领域中通常使
用。本发明的被脂质颗粒封装的核酸编码的氨基酸在保持与seq id no:8,9,14-18有一定以上的同一性的范围内,可以发生氨基酸的突变(取代),缺失,插入和/或添加。
[0211]
对本发明的被脂质颗粒封装的核酸编码的氨基酸而言,可以保持上述的序列同一性,并在seq id no:8,9,14-18的氨基酸序列中有数个位置(优选为5个位置以下,更优选为3,2或1个位置)中,每1个位置有数个(优选为10个以下,更优选为7个以下,进一步优选为5,4,3,2或1 个)氨基酸的取代,缺失,插入和/或添加。
[0212]
能够表达人乳头瘤病毒(例如:hpv16型,hpv18型)的e6抗原及e7 抗原核的酸可以为包含帽子结构(cap),5’非翻译区域(5
’‑
utr),前导序列 (leader sequence),e6的翻译区域,蛋白酶切割序列(弗林蛋白酶切割位点), e7的翻译区域,3’非翻译区域(3
’‑
utr)及polya尾部(polya)的mrna。帽子结构(cap)存在于众多真核生物的mrna的5’末端,为具有7-甲基鸟苷结构的部位。作为帽子结构,可列举例如cap0,cap1,cap2, arca(anti-reverse cap analog)等,该帽子结构如下述的结构式所示,
[0213]
[化学式13]
[0214][0215]
(式中,base表示未修饰或经修饰的任意核酸碱基,rna表示任意的多核苷酸)。
[0216]
[化学式14]
[0217][0218]
[化学式15]
[0219][0220]
[化学式16]
[0221][0222]
作为本发明的mrna的帽子结构,优选为cap0,或cap1,更优选为 cap1。5’非翻译区域(5
’‑
utr)的序列例如为:seq id no:2的序列中碱基编号2~70的序列,seq id no:4的序列中碱基编号2~70的序列,及seqid no:6的序列中碱基编号2~70的序列,seq id no:11的序列中碱基编号2~70的序列,seq id no:13的序列中碱基编号2~70的序列。前导序列(leader sequence)的序列例如为:seq id no:2的序列中碱基编号 71~124的序列,seq id no:4的序列中碱基编号71~124的序列,及seqid no:6的序列中碱基编号71~124的序列,seq id no:11的序列中碱基编号71~124的序列,seq id no:13的序列中碱基编号71~124的序列。e6的翻译区域的序列为能够表达e6抗原的氨基酸序列的全部或一部分的序列,包含开始密码子和/或终止密码子即可,例如为:seq id no:2的序列中碱基编号125~574的序列,seq id no:4的序列中碱基编号125~574 的序列,及seq id no:6的序列中碱基编号125~574的序列,seq id no: 11的序列中碱基编号125~589的序列,seq id no:13的序列中碱基编号 125~589的序列。蛋白酶切割序列(弗林蛋白酶切割位点)的序列例如为: seq id no:2的序列中碱基编号575~595的序列,seq id no:4的序列中碱基编号575~595的序列,及seq id no:6的序列中碱基编号575~595 的序列,seq id no:11的序列中碱基
编号590~610的序列,seq id no: 13的序列中碱基编号590~610的序列。e7的翻译区域的序列为能够表达 e7抗原的氨基酸序列的全部或一部分的序列,包含开始密码子和/或终止密码子即可,例如为:seq id no:2的序列中碱基编号596~889的序列, seq id no:4的序列中碱基编号596~889的序列,及seq id no:6的序列中碱基编号596~889的序列,seq id no:11的序列中碱基编号611~925 的序列,seq id no:13的序列中碱基编号611~925的序列。3’非翻译区域(3
’‑
utr)的序列例如为:seq id no:2的序列中碱基编号890~1021的序列,seq id no:4的序列中碱基编号890~1021的序列,及seq id no: 6的序列中碱基编号890~1021的序列,seq id no:11的序列中碱基编号 926~1057的序列,seq id no:13的序列中碱基编号926~1057的序列。 polya尾部(polya)的序列例如为:seq id no:2的序列中碱基编号 1022~1123的序列,seq id no:4的序列中碱基编号1022~1123的序列,及seq id no:6的序列中碱基编号1022~1123的序列,seq id no:11 的序列中碱基编号1058~1159的序列,seq id no:13的序列中碱基编号 1058~1159的序列。在帽子结构(cap),5’非翻译区域(5
’‑
utr),前导序列 (leader sequence),e6的翻译区域,蛋白酶切割序列(弗林蛋白酶切割位点), e7的翻译区域,3’非翻译区域(3
’‑
utr)及polya尾部(polya)的序列中,可以不进行修饰,对能够表达hpv16型的e6抗原及e7抗原的核酸的序列而言,可以为由与seq id no:2,4或6中的任一序列至少具有90%、优选为95%,更优选为97%同一性的核苷酸序列组成。另外,能够表达hpv18 型的e6抗原及e7抗原的核酸的序列可以为由与seq id no:11或13中的任一序列至少具有90%、优选为95%,更优选为97%同一性的核苷酸序列组成。
[0223]
被脂质颗粒封装的核酸只要是能够表达人乳头瘤病毒e6抗原及e7抗原的核酸,可以为任何形态。可列举例如:单链dna,单链rna(例如: mrna),dna和rna混合而成的单链多核苷酸,双链dna,双链rna, dna-rna的杂交多核苷酸,dna和rna混合而成的包含两种多核苷酸的双链多核苷酸等,优选为mrna。
[0224]
构成被脂质颗粒封装的核酸的核苷酸可以为天然型的那些,也可以为修饰核苷酸,可以包含至少1个修饰核苷酸。
[0225]
修饰核苷酸可以为碱基,糖及磷酸二酯键的任意部分经修饰的那些。修饰部位可以为1个位置或2个位置以上。
[0226]
作为碱基的修饰的例子,可列举胞嘧啶的5-甲基化,5-氟化,n4-甲基化,尿嘧啶的5-甲基化(胸腺嘧啶),5-氟化,腺嘌呤的n6-甲基化,鸟嘌呤的n2-甲基化等。
[0227]
作为糖的修饰的例子,可列举d-呋喃核糖的2
’‑
o-甲基化。
[0228]
作为磷酸二酯键的修饰的例子,可列举硫代磷酸酯键。
[0229]
修饰核苷酸优选为碱基部分经修饰的那些,例如:可以为在5位取代的嘧啶核苷酸,在1位任选取代的假尿苷,具体可例示5-甲基胞苷,5-甲氧基尿苷,5-甲基尿苷,假尿苷,1-烷基假尿苷。另外,作为1-烷基假尿苷,可以为1-(c1-c6烷基)假尿苷、优选为1-甲基假尿苷或1-乙基假尿苷。作为修饰核苷酸更优选地可列举5-甲基胞苷,5-甲基尿苷,及1-甲基假尿苷。作为修饰核苷酸特别优选地可列举5-甲基胞苷及5-甲基尿苷的组合,或5-甲基胞苷及1-甲基假尿苷的组合。
[0230]
能够表达本发明的人乳头瘤病毒(例如:hpv16型,hpv18型)的e6 抗原及e7抗原的核酸可以通过由具有期望的碱基序列的dna进行体外转录反应而制备。在体外转录中必要
的酶,缓冲液,及,核苷-5
’‑
三磷酸混合物(腺苷-5
’‑
三磷酸(atp),鸟苷-5
’‑
三磷酸(gtp),胞苷-5
’‑
三磷酸(ctp)及尿苷-5
’‑
三磷酸(utp))为市售的(ampliscribet7highyieldtranscription试剂盒(epicentre),mmessagemmachinet7ultra试剂盒(lifethechnologies)等)。用于制备单链rna的dna可以使用克隆化的dna,例如:质粒dna或dna片段。质粒dna或dna片段可以使用市售的那些,也可以根据本领域中通常知晓的方法制备(例如:sambrook,j.etal.,molecularcloningalaboratorymanualsecondedition(1989),rashtchian,a.,currentopinioninbiotechnology,1995,6(1),30-36,gibsond.g.etal.,science,2008,319(5867),1215-1220中记载的方法等)。
[0231]
为了得到提高稳定性和/或安全性的mrna,也可以在体外转录反应中,通过将一部分或全部的未修饰核苷-5
’‑
三磷酸置换为修饰核苷-5
’‑
三磷酸,从而将mrna的中一部分或全部的未修饰核苷酸置换为修饰核苷酸(kormann,m.,naturebiotechnology,2011,29,154-157.)。
[0232]
为了得到提高稳定性和/或安全性的mrna,可以在体外转录反应后通过使用加帽酶的方法在mrna的5’末端导入帽子结构(上述cap0结构)。另外,可以进一步通过将具有cap0的mrna与2
’‑
o-甲基转移酶进行作用的方法将cap0转换为cap1。加帽酶及2
’‑
o-甲基转移酶可使用市售的产品(例如:vacciniacappingsystem,m2080;mrnacap2
’‑
o-甲基转移酶,m0366,均为newenglandbiolab制)。使用市售的产品时,可以按照产品附带的方案制备具有帽子结构的mrna。
[0233]
mrna的5’末端的帽子结构也可以通过与使用酶的方法不同的方法引入。例如可以通过将arca或cleancap添加到体外转录反应中,将arca具有的帽子类似物的结构,或源自cleancap的cap1结构引入mrna。arca及cleancap可使用市售的产品(arca,n-7003;cleancapreagentag,n-7113,均为trilinkbiotechnologies制)。使用市售的产品时,可以按照产品附带的方案制备具有帽子结构的mrna。
[0234]
本发明的核酸封装脂质颗粒可以利用薄膜法,反相蒸发法,乙醇注入法,醚注入法,脱水再水合法,表面活性剂透析法,水合法,冻融法等方法制备。可以通过例如:国际公开公报第2015/005253号中记载的方法制备核酸封装脂质颗粒。本发明的核酸封装脂质颗粒也可以通过将核酸溶液与脂质溶液在微流路内混合而制备。可以使用例如:precisionnanosystems公司的nanoassemblr(注册商标),依照附带的方案记载的方法制备。
[0235]
本发明的颗粒的平均粒径可以为30nm~300nm,优选为30~200nm,更优选为30~100nm。平均粒径可以通过使用zetapotential/particlesizernicomp(注册商标)380zls(particlesizingsystems)等仪器,基于动态光散射法等原理而测定体积平均粒径而得。
[0236]
本发明的颗粒可以用于制备用于预防和/或治疗人乳头瘤病毒感染引起的疾病(宫颈癌,宫颈上皮内瘤变,肛门癌、口咽癌,尖锐湿疣)的组合物。感染可以为由hpv16型,18型,31型,33型,35型,39型,45型,51型,52型,56型,58型,59型,68型,6型,11型的人乳头瘤病毒引起的感染、优选为hpv16型和/或hpv18型,更优选为hpv16型。
[0237]
可以使用本发明的颗粒在体内或体外表达人乳头瘤病毒e6抗原及e7抗原。因此,本发明提供体外表达人乳头瘤病毒e6抗原及e7抗原的方法,其包括将含有上述颗粒的组合物导入细胞。另外,本发明也提供体内表达人乳头瘤病毒e6抗原及e7抗原的方法,其包括将
含有上述颗粒的组合物施用于哺乳动物。通过体内表达人乳头瘤病毒e6抗原及e7抗原,可以诱导对于人乳头瘤病毒的免疫反应。结果是能够预防和/或治疗人乳头瘤病毒感染。因此,本发明提供诱导对于人乳头瘤病毒的免疫反应的方法,其包括将含有上述颗粒的组合物施用于哺乳动物。另外,本发明提供预防和/ 或治疗人乳头瘤病毒感染的方法,其包括将含有上述颗粒的组合物施用于哺乳动物。
[0238]
本发明的颗粒能够作为药物和作为实验用试剂利用。本发明的颗粒通常被添加到水,缓冲液,生理盐水等载体中,可将该配合物(组合物)导入细胞(体外)或施用至哺乳动物(体内)。当施用至哺乳动物的情况下,载体可以为药学上允许的载体(例如生理盐水)。另外,本发明的颗粒也可以被制剂为以脂肪,脂肪油,羊毛脂,凡士林,石蜡,蜡,树脂,塑料,乙二醇类,高级醇,甘油,水,乳化剂,悬浮剂等作为基材原料的霜,糊,软膏,凝胶,洗液等剂型。
[0239]
本发明的颗粒可以通过口服施用或者肌内施用,静脉内施用,直肠内施用,经皮施用,经黏膜施用,皮下施用,皮内施用等方法非口服给药至人,小鼠,大鼠,仓鼠,豚鼠,兔,猪,猴,猫,犬,马,山羊,绵羊,牛等哺乳动物。
[0240]
当将本发明的颗粒施用至人的情况下,例如以成人每1次约 0.001~1mg、优选为0.01~0.2mg的施用量,1次或多次,肌内注射,皮下注射,皮内注射,点滴静脉注射,或静脉注射即可,其施用量、施用次数可根据疾病的种类,症状,年龄,施用方法等而适当改变。
[0241]
当用作实验试剂的情况下,可以将本发明的颗粒导入要表达人乳头瘤病毒e6抗原及e7抗原的细胞(例如:hek293细胞及其衍生细胞(hek293t 细胞,freestyle 293细胞、expi293细胞),cho细胞,c2c12小鼠成肌细胞,永生化小鼠树突细胞(mutudc1940)),使其体外表达人乳头瘤病毒e6 抗原及e7抗原。人乳头瘤病毒e6抗原及e7抗原的表达可以通过蛋白质印迹法检测样品中人乳头瘤病毒e6抗原及e7抗原蛋白质,或通过质量分析法检测对人乳头瘤病毒e6抗原及e7抗原为特异性的肽片段进行分析。
[0242]
在本发明中,“治疗”是指在发生了由病毒或细菌等引起的传染病,或归因于该感染的疾病(例如:前癌病变、癌症等)的患者中,这些疾病的临床症状的恢复,缓解,松弛和/或延迟恶化。
[0243]
在本发明中,“预防”是指降低由病毒或细菌等造成的传染病引起的疾病的发病率。预防中包括降低由病毒或细菌等造成的传染病引起的疾病的发展的风险,或降低这些疾病的重症发展。本发明的颗粒诱导防御性免疫反应,因此对上述疾病的预防和/或治疗有效果。
[0244]
实施例
[0245]
在下文中,通过实施例具体描述本发明。另外,这些实施例是用于描述本发明,而不是限制本发明的范围。
[0246]
[实施例1]hpv16 e6-e7融合2 mrna-001的制备
[0247]
(1)hpv16 e6-e7融合2的体外转录(ivt)用的模板dna的制备
[0248]
构建质粒以制备体外转录(ivt)中使用的模板dna。制备了导入了 dna片段(seq id no:1)的质粒(pma-hpv16_融合2),所述dna片段包含将gctagc(nhei位点),t7启动子序列,人β-球蛋白的5
’‑
utr序列, kozak序列,ige前导序列-hpv16型e6-弗林蛋白酶切割位点-hpv16 型e7的翻译区域,人β-球蛋白的3
’‑
utr序列,polya尾部及actagt(spei 位点)依
次连接而成的序列。
[0249]
(2)模板dna的线性化
[0250]
在溶解了实施例1-(1)中得到的质粒(250μg)的无核酸酶水(2200μl,thermofisher产品目录#am9937)中加入10
×
cutsmartbuffer(250μl,newenglandbiolabs产品目录#b7204s),spei-hf(30μl,newenglandbiolabs产品目录#r3133l),在37℃孵育2小时之后,65℃孵育20分钟。与7.5m乙酸铵(1250μl)和乙醇(7500μl)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣用te-buffer制备成500μg/ml的溶液。
[0251]
(3)基于体外转录的,hpv16e6-e7融合2mrna-001的制备
[0252]
将实施例1-(2)中得到的500μg/ml模板dna(200μl),100mmcleancapag(200μl,trilink产品目录#t-7113),100mmatp(200μl,hongene产品目录#r1331),100mmgtp(200μl,hongene产品目录#r2331),100mm5-me-ctp(200μl,hongene产品目录#r3-029),100mm5-甲基尿苷三磷酸(200μl),无核酸酶水(1600μl,thermofisher产品目录#am9937),t7transcription5
×
buffer(800μl,promega产品目录#p140x),enzymemix,t7rna聚合酶(400μl,promega产品目录#p137x)混合,在37℃孵育4小时。与rq1rnase-freednase(100μl,promega产品目录#m6101)混合,在37℃孵育15分钟。与8mlicl溶液(2000μl,sigma-aldrich产品目录#l7026)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水之后,使用rneasymaxi试剂盒(qiagen产品目录#75162)如附带的指南的方式进行纯化。将得到的洗脱液(10.3ml,以uv换算计17013μg)和无核酸酶水(247μl),rapid碱性磷酸酶(roche产品目录#04898141001)的缓冲液(1550μl)和酶(3403μl)混合,在37℃孵育1小时后,75℃孵育15分钟。与8mlicl溶液(7750μl)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水之后,连接2根反相高效液相色谱(chromolithsemi-prep(merck产品目录#1.52016.0001),用5%乙腈,400mm乙酸三乙胺(ph7.0)/25%乙腈,400mm乙酸三乙胺(ph7.0),80℃)纯化,由此得到了目标mrna。
[0253]
得到的mrna具有seqidno:2的序列。根据experionrnastdsens(bio-rad产品目录#7007103ja)分析,确认了目标的长度。
[0254]
[实施例2]hpv16e6-e7融合10mrna-001的制备
[0255]
(1)制备hpv16e6-e7融合10的ivt用的模板dna
[0256]
构建质粒以制成ivt模板中使用的模板dna。制备了导入了dna片段(seqidno:3)的质粒(pma-hpv16_融合10),所述dna片段包含将gctagc(nhei位点),t7启动子序列,人β-球蛋白的5
’‑
utr序列,kozak序列ige前导序列-hpv16型e6-弗林蛋白酶切割位点-hpv16型e7的翻译区域,人β-球蛋白的3
’‑
utr序列,polya尾部及actagt(spei位点)依次连接而成的序列。
[0257]
(2)基于体外转录的,hpv16e6-e7融合10mrna-001的制备
[0258]
代替实施例1-(1)中得到的质粒而使用了实施例2-(1)中得到的质粒,以与实施例1-(2)及(3)同样的方法得到了mrna。
[0259]
得到的mrna具有seqidno:4的序列。通过experionrnastdsens分析,确认了
目标的长度。
[0260]
[实施例3]hpv16e6-e7融合10mrna-002的制备
[0261]
代替实施例1-(1)中得到的质粒而使用了实施例2-(1)中得到的质粒,以与实施例1-(2)同样的方法得到了模板dna。之后,代替实施例1-(3)的模板dna而使用得到的模板dna,代替100mm5-me-utp而使用100mmpseudo-utp(hongene产品目录#r5-022),以与实施例1-(3)同样的方法得到了mrna。
[0262]
得到的mrna具有seqidno:4的序列。通过experionrnastdsens分析,确认了目标的长度。
[0263]
[实施例4]hpv16e6-e7融合10mrna-003的制备
[0264]
代替实施例1-(1)中得到的质粒而使用了实施例2-(1)中得到的质粒,以与实施例1-(2)同样的方法得到了模板dna。之后,代替实施例1-(3)的模板dna而使用得到的模板dna,代替100mm5-me-ctp而使用100mmctp(hongene产品目录#r3331),代替100mm5-me-utp而使用100mmn1-甲基伪尿苷-5
’‑
三磷酸(trilink产品目录#n-1081),以与实施例1-(3)同样的方法得到了mrna。
[0265]
得到的mrna具有seqidno:4的序列。通过experionrnastdsens分析,确认了目标的长度。
[0266]
[实施例5]hpv16e6-e7融合10mrna-004的制备
[0267]
代替实施例1-(1)中得到的质粒而使用了实施例2-(1)中得到的质粒,以与实施例1-(2)同样的方法得到了模板dna。之后,代替实施例1-(3)的模板dna而使用得到的模板dna,代替100mm5-me-ctp而使用100mmctp(hongene产品目录#r3331),以与实施例1-(3)同样的方法得到了mrna。
[0268]
得到的mrna具有seqidno:4的序列。通过experionrnastdsens分析,确认了目标的长度。
[0269]
[实施例6]hpv16e6-e7融合10opt2mrna-001的制备
[0270]
(1)制备hpv16e6-e7融合10opt2的ivt用的模板dna
[0271]
构建质粒以制成ivt模板中使用的模板dna。制备了导入了dna片段(seqidno:5)的质粒(pma-hpv16_融合10_opt2),所述dna片段包含将gctagc(nhei位点),t7启动子序列,β-球蛋白的5
’‑
utr序列,kozak序列ige前导序列-hpv16型e6-弗林蛋白酶切割位点-hpv16型e7的翻译区域,β-球蛋白的’3-utr序列,polya尾部及actagt(spei位点)依次连接而成的序列。
[0272]
(2)模板dna的线性化
[0273]
在溶解了实施例6-(1)中得到的质粒(250μg)的无核酸酶水(2200μl,thermofisher产品目录#am9937)中加入10
×
cutsmartbuffer(250μl,newenglandbiolabs产品目录#b7204s),spei-hf(30μl,newenglandbiolabs产品目录#r3133l),在37℃孵育2小时之后,65℃孵育20分钟。与7.5m乙酸铵(1250μl)和乙醇(7500μl)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣用te-buffer制备成500μg/ml的溶液。
[0274]
(3)基于体外转录的,hpv16e6-e7融合10opt2mrna-001的制备
[0275]
将实施例6-(2)中得到的500μg/ml模板dna(100μl),100mmatp(150μl,hongene产
品目录#r1331),100mmgtp(150μl,hongene产品目录#r2331),100mmctp(150μl,hongene产品目录#r3331),100mmn1-甲基伪尿苷-5
’‑
三磷酸(150μl,hongene产品目录#r5-027),无核酸酶水(700μl,thermofisher产品目录#am9937),t7transcription5
×
buffer(400μl,promega产品目录#p140x),enzymemix,t7rna聚合酶(200μl,promega产品目录#p137x)混合,在37℃孵育4小时。与rq1rnase-freednase(50μl,promega产品目录#m6101)混合,在37℃孵育15分钟。与8mlicl溶液(1000μl,sigma-aldrich产品目录#l7026)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水。该溶液(962μl,以uv换算计5400μg)中加入无核酸酶水(2818μl),70℃加热20分钟后,在冰冷却下冷却10分钟。加入10
×
cappingbuffer(500mmtris-hcl(ph8.0),50mmkcl,10mmmgcl2,50mmdtt)540μl,20mmgtp(270μl,100mmgtp,hongene产品目录#r2331用无核酸酶水稀释使用),20mmsam(270μl,32mmsam,newenglandbiolabs产品目录#b9003s用无核酸酶水稀释使用),vaccinia盖帽酶(540μl,hongene产品目录#on-028),在37℃孵育4小时后,加入10
×
cappingbuffer(90μl),20mmsam(270μl),2
’‑
o-甲基转移酶(540μl,hongene产品目录#on-014),在37℃孵育4小时。与8mlicl溶液(6300μl)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水之后,连接2根反相高效液相色谱(chromolithsemi-prep(merck产品目录#1.52016.0001),用5%乙腈,400mm乙酸三乙胺(ph7.0)/25%乙腈,400mm乙酸三乙胺(ph7.0),80℃)纯化,由此得到了目标mrna。
[0276]
得到的mrna具有seqidno:6的序列。通过experionrnastdsens分析,确认了目标的长度。
[0277]
(4)基于体外转录的,hpv16e6-e7融合10opt2mrna-001的制备
[0278]
将实施例6-(2)中得到的500μg/ml模板dna(200μl),100mmatp(300μl,hongene产品目录#r1331),100mmgtp(300μl,hongene产品目录#r2331),100mmctp(300μl,hongene产品目录#r3331),100mmn1-甲基伪尿苷-5
’‑
三磷酸(300μl,hongene产品目录#r5-027),无核酸酶水(1400μl,applied-bio产品目录#am9937),t7transcription5
×
buffer,(400mmhepes-koh(ph7.5),80mmmgcl2,10mm亚精胺,200mmdtt)800μl,enzymemix,t7rna聚合酶(400μl,promega产品目录#p137x)混合,在37℃孵育8小时。与rq1rnase-freednase(100μl,promega产品目录#m6101)混合,在37℃孵育15分钟。与8mlicl溶液(2000μl,sigma-aldrich产品目录#l7026)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水。该溶液(1590μl,以uv换算计6000μg)中加入无核酸酶水(2610μl),70℃加热10分钟后,在冰冷却下冷却10分钟。加入10
×
cappingbuffer(500mmtris-hcl(ph8.0),50mmkcl,10mmmgcl2,50mmdtt)600μl,20mmgtp(300μl,100mmgtp,hongene产品目录#r2331用无核酸酶水稀释使用),20mmsam(300μl,s-adenosyl-l-methioninedisulfatetosylate(s-腺苷-l-蛋氨酸对甲苯磺酸硫酸盐),ox-chem产品目录#ax8250818溶解于0.005m硫酸,10%乙醇溶液使用),vaccinia盖帽酶(600μl,hongene产品目录#on-028),在37℃孵育4小时后,加入10
×
cappingbuffer(100μl),20mmsam(300μl),2
’‑
o-甲基转移酶(600μl,hongene产品目录#on-014),在37℃孵育4小时。与8m
licl溶液(7000μl)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃, 4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水之后,用反相高效液相色谱(chromolith performance(merck产品目录#1.02129.0001),5%乙腈,400mm乙酸三乙胺(ph 7.0)/25%乙腈,400mm 乙酸三乙胺(ph 7.0),45℃)纯化,由此得到了目标mrna。
[0279]
得到的mrna具有seq id no:6的序列。通过labchip gx touch htmrna stdsens(perkinelmer产品目录#cls960010)分析,确认了目标的长度。
[0280]
[实施例7]hpv16 e6-e7融合10 opt2 mrna-002的制备
[0281]
代替实施例6-(3)的100mm ctp而使用100mm 5-me-ctp,代替 100mm n1-甲基伪尿苷-5
’‑
三磷酸而使用100mm 5-甲基尿苷三磷酸,以与实施例6-(3)同样的方法得到了mrna。得到的mrna具有seq id no:6 的序列。通过experion rna stdsens分析,确认了目标的长度。
[0282]
[实施例8]实施例1记载的封装hpv mrna核酸脂质颗粒的制备
[0283]
(1)制备封装mrna核酸脂质颗粒
[0284]
将二硬脂酰磷脂酰胆碱(1,2-distearoyl-sn-glycero-3-phosphocholine:以下记作dspc,nof corporation),胆固醇(cholesterol:以下记作chol, sigma-aldrich,inc.),二乙酸(7r,9z,26z,29r)-18-({[3-(二甲基氨基)丙氧基] 羰基}氧基)三十五碳-9,26-二烯-7,29-二基酯(wo2015/005253的实施例23 中记载的化合物)(以下记作lp),及聚乙二醇分子量为约2000的1,2-二肉豆蔻酰-sn-甘油甲氧基聚乙二醇 (1,2-dimyristoyl-sn-glycero-3-methoxypolyethylene glycol,以下记作 peg-dmg,nof corporation)以dspc∶chol∶lp∶peg-dmg=10∶ 43.5∶45∶1.5的摩尔比,溶解于乙醇而使为总脂质浓度5mm。
[0285]
另一方面,将实施例1中得到的hpv16融合2mrna-001用柠檬酸缓冲液(20mm citrate buffer,ph 4.0)制备为51.8μg/ml。
[0286]
使用nanoassemblr benchtop(precision nanosystems inc.}将上述脂质溶液和mrna溶液以其体积比为1∶3的方式在微流路内混合,得到了核酸脂质颗粒的粗分散液。将核酸脂质颗粒的分散液通过用约25~50倍量的磷酸缓冲液(ph 7.4)透析12-18小时(float-a-lyzer g2,mwco:1,000kd, spectra/por)而去除乙醇,得到了纯化的封装mrna核酸脂质颗粒的分散液。
[0287]
另外,按照wo2015005253的实施例23中记载的方法合成了lp。
[0288]
(2)封装mrna核酸脂质颗粒的特性评价
[0289]
对包含(1)制备的核酸脂质颗粒的分散液的特性进行评价。对各自的特性评价方法进行说明。
[0290]
(2-1)mrna的封装率
[0291]
使用quant-it ribogreen rna assay试剂盒(invitrogen),根据随附的文件测定mrna的封装率。
[0292]
即,在0.015%triton x-100表面活性剂存在下及不存在下定量了核酸脂质颗粒的分散液中的mrna,根据下式算出封装率。
[0293]
{[表面活性剂存在下的mrna量]-[表面活性剂不存在下的mrna 量]}/[表面活性剂存在下的mrna量]}x 100(%)
[methoxy poly(ethyleneglycol)2000carbamyl]-1,2-dimyristyloxlpropyl-3-amine):以下记作 peg-c-dma,journal of controlled release 112(2006)280-290中记载的化合物12),将构成脂质组成设为摩尔比dspc∶chol∶lp∶peg-c-dma= 10∶38.5∶50∶1.5。
[0315]
(2)封装mrna核酸脂质颗粒的特性评价
[0316]
对包含(1)制备的核酸脂质颗粒的分散液的特性进行评价。对各自的特性评价方法进行说明。
[0317]
(2-1)mrna的封装率
[0318]
mrna的封装率使用quant-it ribogreen rna assay试剂盒 (invitrogen),根据随附的文件测定。
[0319]
即,在0.015%triton x-100表面活性剂存在下及不存在下定量了核酸脂质颗粒的分散液中的mrna,根据下式算出封装率。
[0320]
{[表面活性剂存在下的mrna量]-[表面活性剂不存在下的mrna 量]}/[表面活性剂存在下的mrna量]}x 100(%)
[0321]
(2-2)mrna和脂质的比率
[0322]
将核酸脂质颗粒的分散液中的mrna量设为(2-1)的“表面活性剂存在下的mrna量”。
[0323]
使用磷脂c-test wako(富士胶片和光纯药株式会社)根据随附的文件测定了核酸脂质颗粒的分散液中的磷脂量。即,在2%triton x-100表面活性剂存在下测定了试样中的磷脂量。
[0324]
通过反相色谱测定了核酸脂质颗粒的分散液中的胆固醇及lp量(系统: dionex ultimate 3000,柱:chromolith performance rp-18 endcapped 100-3monolithic hplc-column(merck,cat.#:1.52001.0001),buffer a:0.01%三氟乙酸,buffer,b:0.01%三氟乙酸,甲醇,(b%):82-97%(0-17min),流速: 2ml/min,温度:50℃,检测:corona cad(电喷雾检测器))。
[0325]
从磷脂,胆固醇及lp的测定值和构成核酸脂质颗粒的脂质成分的组成比算出总脂质量。
[0326]
根据下式算出总脂质的量相对于mrna的比率。
[0327]
[总脂质浓度]/[mrna浓度](wt/wt)
[0328]
(2-3)平均粒径
[0329]
核酸脂质颗粒的粒径通过zeta电位/粒度仪nicomptm380zls(particle sizing systems)测定。表中的平均粒径以体积平均粒径表示,
±
以下表示偏差。
[0330]
将结果示于表2。
[0331]
[实施例22]封装ova mrna核酸脂质颗粒的制备
[0332]
通过与实施例21同样的方法实施了封装具有seq id no:7中记载的 ova(卵清蛋白)的翻译区域的mrna的核酸脂质颗粒的制备,特性评价。其中,将构成脂质组成设为摩尔比dspc∶chol∶lp∶peg-c-dmag=10∶ 35∶50∶5。将结果示于表2。
[0333]
[实施例23]封装ova mrna核酸脂质颗粒的制备
[0334]
通过与实施例21同样的方法实施了封装具有seq id no:7中记载的 ova(卵清蛋白)的翻译区域的mrna的核酸脂质颗粒的制备,特性评价。其中,将构成脂质组成设为摩尔
比dspc∶chol∶lp∶peg-c-dma=10∶23.5∶65∶1.5。将结果示于表2。
[0335]
[实施例24]封装ova mrna核酸脂质颗粒的制备
[0336]
通过与实施例21同样的方法实施了封装具有seq id no:7中记载的ova(卵清蛋白)的翻译区域的mrna的核酸脂质颗粒的制备,特性评价。其中,将构成脂质组成设为摩尔比dspc∶chol∶lp∶peg-c-dma=10∶ 48.5∶40∶1.5。将结果示于表2。
[0337]
[实施例25]封装ova mrna核酸脂质颗粒的制备
[0338]
通过与实施例21同样的方法实施了封装具有seq id no:7中记载的 ova(卵清蛋白)的翻译区域的mrna的核酸脂质颗粒的制备,特性评价。其中,将构成脂质组成设为摩尔比dspc∶chol∶lp∶peg-c-dma=5∶ 43.5∶50∶1.5。将结果示于表2。
[0339]
[实施例26]封装ova mrna核酸脂质颗粒的制备
[0340]
通过与实施例21同样的方法实施了封装具有seq id no:7中记载的 ova(卵清蛋白)的翻译区域的mrna的核酸脂质颗粒的制备,特性评价。其中,将构成脂质组成设为摩尔比dspc∶chol∶lp∶peg-c-dma=15∶ 33.5∶50∶1.5。将结果示于表2。
[0341]
[实施例27]封装ova mrna核酸脂质颗粒的制备
[0342]
通过与实施例21同样的方法实施了封装具有seq id no:7中记载的 ova(卵清蛋白)的翻译区域的mrna的核酸脂质颗粒的制备,特性评价。其中,将构成脂质组成设为摩尔比chol∶lp∶peg-c-dma=53.5∶45∶ 1.5。将结果示于表2。
[0343]
[实施例28]实施例4所述的封装hpv mrna核酸脂质颗粒的制备
[0344]
通过与实施例8同样的方法实施了实施例4中记载的封装mrna核酸脂质颗粒的制备,特性评价。其中,代替dspc而使用二油酰磷脂酰胆碱(1,2-dioleoyl-sn-glycero-3-phosphocholine:以下记作dopc,nofcorporation),将构成脂质组成设为摩尔比dopc∶chol∶lp∶peg-dmg =10∶43.5∶45∶1.5。将结果示于表3。
[0345]
[实施例29]实施例4所述的封装hpv mrna核酸脂质颗粒的制备
[0346]
通过与实施例8同样的方法实施了实施例4中记载的封装mrna核酸脂质颗粒的制备,特性评价。其中,代替dspc而使用dopc,将构成脂质组成设为摩尔比dopc∶chol∶lp∶peg-dmg=15∶38.5∶45∶1.5。将结果示于表3。
[0347]
[实施例30]实施例4所述的封装hpv mrna核酸脂质颗粒的制备
[0348]
通过与实施例8同样的方法实施了实施例4中记载的封装mrna核酸脂质颗粒的制备,特性评价。其中,代替dspc而使用二油酰磷脂酰乙醇胺(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine:以下记作dope,nofcorporation),将构成脂质组成设为摩尔比dope∶chol∶lp∶peg-dmg =10∶43.5∶45∶1.5。将结果示于表3。
[0349]
[实施例31]实施例4所述的封装hpv mrna核酸脂质颗粒的制备
[0350]
通过与实施例8同样的方法实施了实施例4中记载的封装mrna核酸脂质颗粒的制备,特性评价。其中,代替dspc而使用dope,将构成脂质组成设为摩尔比dope∶chol∶lp∶peg-dmg=15∶38.5∶45∶1.5。将结果示于表3。
[0351]
[实施例32]实施例4所述的hpv封装mrna核酸脂质颗粒的制备
[0352]
通过与实施例8同样的方法实施了实施例4中记载的封装mrna核酸脂质颗粒的制备,特性评价。其中,将构成脂质组成设为摩尔比dspc∶ chol∶lp∶peg-dmg=12.5∶41∶45∶1.5的摩尔比。将结果示于表3。
[0353]
[实施例33]hpv18e6-e7融合1opt1mrna-001的制备
[0354]
(1)hpv18e6-e7融合1opt1的体外转录(ivt)用的模板dna的制备
[0355]
构建质粒以制备体外转录(ivt)中使用的模板dna。制备了导入了dna片段(seqidno:10)的质粒(pma-hpv18_融合1_opt1),所述dna片段包含将gctagc(nhei位点),t7启动子序列,人β-球蛋白的5
’‑
utr序列,kozak序列,ige前导序列-hpv18型e6-弗林蛋白酶切割位点-hpv18型e7的orf,人β-球蛋白的3
’‑
utr序列,polya尾部及actagt(spei位点)依次连接而成的序列。
[0356]
(2)模板dna的线性化
[0357]
在溶解了实施例33-(1)中得到的质粒(350μg)的无核酸酶水(3080μl,thermofisher产品目录#am9937)中加入10
×
cutsmartbuffer(350μl,newenglandbiolabs产品目录#b7204s),spei-hf(70μl,newenglandbiolabs产品目录#r3133l),在37℃孵育2小时之后,65℃孵育20分钟。与7.5m乙酸铵(1750μl)和乙醇(10500μl)混合,-80℃静置过夜。离心(-10℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(-10℃,4000
×
g,10分钟)之后,弃上清液,进行风干。得到的残渣用te-buffer制备成500μg/ml的溶液。
[0358]
(3)基于体外转录的,hpv18e6-e7融合1opt1mrna-001的制备
[0359]
将实施例33-(2)中得到的500μg/ml模板dna(150μl),100mmcleancapag(150μl,trilink产品目录#t-7113),100mmatp(150μl,hongene产品目录#r1331),100mmgtp(150μl,hongene产品目录#r2331),100mmctp(150μl,hongene产品目录#r3331),100mmn1-me-pseudoutp(150μl,hongene产品目录#r5-027),无核酸酶水(1200μl,thermofisher产品目录#am9937),t7transcription5
×
buffer(600μl,promega产品目录#p140x),enzymemix,t7rna聚合酶(300μl,promega产品目录#p137x)混合,在37℃孵育4小时。与rq1rnase-freednase(75μl,promega产品目录#m6101)混合,在37℃孵育15分钟。与8mlicl溶液(1500μl,sigma-aldrich产品目录#l7026)混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水之后,使用rneasymaxi试剂盒(qiagen产品目录#75162)如附带的指南的方式进行纯化。将得到的洗脱液的一部分(11.0ml,以uv换算计9813μg)和无核酸酶水(537μl),rapid碱性磷酸酶(roche产品目录#04898141001)的缓冲液(1500μl)和酶(1963μl)混合,在37℃孵育30分钟后,75℃孵育3分钟。与8mlicl溶液(15000μl)混合,-20℃静置3小时。离心(-8℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(-8℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水之后,用反相高效液相色谱(ymctriart-c85μm10
×
150mm(ymc#to12s05-1510wt),5%乙腈,400mm乙酸三乙胺(ph7.0)/25%乙腈,400mm乙酸三乙胺(ph7.0),75℃)纯化,由此得到了目标mrna。
[0360]
得到的mrna具有seqidno:11的序列。通过labchipgxtouchstandardrnareagent试剂盒(perkinelmer产品目录#cls960010)分析,确认了目标的长度。
[0361]
[实施例34]hpv18e6-e7融合1opt1mrna-002的制备
[0362]
代替实施例33-(3)的100mmctp而使用100mm5-me-ctp(hongene产品目录#r3-029),代替100mmn1-me-pseudoutp而使用100mm5-甲基尿苷三磷酸,以与实施例33-(3)同样的方法得到了mrna。
[0363]
得到的mrna具有seq id no:11的序列。通过labchip gx touchstandard rna reagent试剂盒(perkinelmer产品目录#cls960010)分析,确认了目标的长度。
[0364]
[实施例35]hpv18 e6-e7融合1 opt2 mrna-001的制备
[0365]
(1)hpv18 e6-e7融合1 opt2的ivt用的模板dna的制备
[0366]
构建质粒以制成ivt模板中使用的模板dna。制备了导入了dna片段(seq id no:12)的质粒(pma-hpv18_融合1_opt2),所述dna片段包含将gctagc(nhei位点),t7启动子序列,β-球蛋白的5
’‑
utr序列, kozak序列,ige前导序列-hpv18型e6-弗林蛋白酶切割位点-hpv18 型e7的orf,β-球蛋白的3
’‑
utr序列,polya尾部及actagt(spei位点) 依次连接而成的序列。
[0367]
(2)模板dna的线性化
[0368]
在溶解了实施例35-(1)中得到的质粒(400μg)无核酸酶水(3520μl, thermo fisher产品目录#am9937)中加入10
×
cutsmart buffer(400μl,newengland biolabs产品目录#b7204s),spei-hf(80μl,new england biolabs 产品目录#r3133l),在37℃孵育2小时之后,65℃孵育20分钟。与7.5m 乙酸铵(2000μl)和乙醇(12000μl)混合,在-20℃静置过夜。离心(4℃,4000
ꢀ×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10 分钟)之后,弃上清液,进行风干。得到的残渣用te-buffer制备成500μg/ml 的溶液。
[0369]
(3)基于体外转录的hpv18 e6-e7融合1 opt2 mrna-001的制备
[0370]
将实施例35-(2)中得到的500μg/ml模板dna(150μl),100mmatp(225μl,hongene产品目录#r1331),100mm gtp(225μl,hongene 产品目录#r2331),100mm ctp(225μl,hongene产品目录#r3331),100mmn1-me-pseudo utp(225μl,hongene产品目录#r5-027),无核酸酶水 (1050μl,thermo fisher产品目录#am9937),t7 transcription 5
×
buffer(600μl,promega产品目录#p140x),enzyme mix,t7 rna聚合酶 (300μl,promega产品目录#p137x)混合,在37℃孵育4小时。与rq1rnase-free dnase(75μl,promega产品目录#m6101)混合,在37℃孵育15 分钟。与8m licl溶液(1500μl,sigma-aldrich产品目录#l7026)混合,在
ꢀ‑
20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水。该溶液的一部分(2470μl,以uv换算计7500μg) 中加入无核酸酶水(2780μl),70℃加热10分钟后,在冰冷却下冷却5分钟。加入10
×
capping buffer(500mm tris-hcl(ph 8.0),50mm kcl,10mmmgcl2,50mm dtt)750μl,20mm gtp(375μl,100mm gtp,hongene产品目录#r2331用无核酸酶水稀释使用),20mm sam(375μl,32mm sam, new england biolabs产品目录#b9003s用无核酸酶水稀释使用),vaccinia 盖帽酶(750μl,hongene产品目录#on-028),在37℃孵育4小时后,加入 10
×
capping buffer(125μl),20mm sam(375μl),2
’‑
o-甲基转移酶(750μl, hongene产品目录#on-014),在37℃孵育4小时。与8m licl溶液(8750μl) 混合,在-20℃静置过夜。离心(4℃,4000
×
g,30分钟)之后,弃上清液,加入70%乙醇,离心(4℃,4000
×
g,10分钟)之后,弃上清液,进行风干。将得到的残渣溶解于无核酸酶水之后,用反相高效液相色谱(ymctriart-c8 5μm 10
×
150mm(ymc#to12s05-1510wt),5%乙腈,400mm乙酸三乙胺(ph 7.0)/25%乙腈,400mm乙酸三乙胺(ph 7.0),75℃)纯化,由此得到了目标mrna。
[0371]
得到的mrna具有seq id no:13的序列。通过labchip gx touchstandard rna reagent试剂盒(perkinelmer产品目录#cls960010)分析,确认了目标的长度。
[0372]
[实施例36]hpv18 e6-e7融合1 opt2 mrna-002的制备
[0373]
代替实施例35-(3)的100mm ctp而使用100mm 5-me-ctp(hongene 产品目录#r3-029),代替100mm n1-me-pseudo utp而使用100mm 5-甲基尿苷三磷酸,以与实施例35-(3)同样的方法得到了mrna。
[0374]
得到的mrna具有seq id no:13的序列。通过labchip gx touchstandard rna reagent试剂盒(perkinelmer产品目录#cls960010)分析,确认了目标的长度。
[0375]
[实施例37~40]封装hpv mrna核酸脂质颗粒的制备
[0376]
(1)制备封装mrna核酸脂质颗粒
[0377]
代替实施例1的mrna而分别使用了实施例33~实施例36的mrna,依照表4中记载的脂质摩尔比,通过与实施例8同样的方法实施了封装 mrna核酸脂质颗粒的制备,特性评价。将结果示于表4。
[0378]
[实施例41~52]封装hpv mrna核酸脂质颗粒的制备
[0379]
(1)制备封装mrna核酸脂质颗粒
[0380]
通过与实施例8同样的方法实施了实施例4中记载的封装mrna核酸脂质颗粒的制备。其中,代替二乙酸(7r,9z,26z,29r)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基)三十五碳-9,26-二烯-7,29-二基酯而使用乙酸 (7r,9z)-18-({[3-(二甲基氨基)丙氧基]羰基}氧基)二十八碳-9-烯-7-基酯 (wo2015/005253的实施例28中记载的化合物)(以下记作lp2),将构成脂质组成设为表5中记载的摩尔比。
[0381]
另外,按照wo2015005253的实施例28中记载的方法合成了lp2。
[0382]
(2)封装mrna核酸脂质颗粒的特性评价
[0383]
通过与实施例8同样的方法实施了封装mrna核酸脂质颗粒的特性评价。其中,mrna量以如下方式分析。
[0384]
将核酸脂质颗粒分散液稀释溶解在90%甲醇中,通过紫外可见分光光度计(perkinelmer公司制,lambdatm 465)测定了核酸脂质颗粒中的 mrna量。根据下式算出mrna浓度。
[0385]
{[260nm中吸光度]-[350nm中吸光度]}x 40x稀释倍率(μg/ml)
[0386]
将结果示于表5。
[0387]
[参考例1]dna疫苗模型
[0388]
参考j.yan et al./vaccine 27(2009)431-440构建了表达hpv16型e6,e7 的融合蛋白的质粒。翻译区域设为genbank登录号:fj229356记载的序列。
[0389]
(表1)
[0390][0391]
由以上结果表明,这些核酸脂质颗粒具有约100nm~约130nm的平均粒径,mrna的90%以上被封装在脂质颗粒内。
[0392]
(表2)
[0393][0394]
由以上结果表明,这些核酸脂质颗粒具有约70nm~约170nm的平均粒径,mrna的75%以上被封装在脂质颗粒内。
[0395]
(表3)
[0396][0397]
由以上结果表明,这些核酸脂质颗粒具有约80nm~约110nm的平均粒径,mrna的95%以上被封装在脂质颗粒内。
[0398]
(表4)
[0399]
[0400]
由以上结果表明,这些核酸脂质颗粒具有约90nm~约130nm的平均粒径,mrna的95%以上被封装在脂质颗粒内。
[0401]
(表5)
[0402][0403]
由以上结果表明,这些核酸脂质颗粒具有约70nm~约120nm的平均粒径,mrna的95%以上被封装在脂质颗粒内。
[0404]
[试验例1]
[0405]
来自导入封装mrna核酸脂质颗粒的培养细胞的,hpv基因型16e7疫苗抗原的表达水平(图1)
[0406]
96孔板的每1孔接种2
×
104个的人胎儿肾脏细胞系hek293t细胞,在37℃,co2浓度5%的条件下过夜培养。之后,将实施例14~17的封装 mrna核酸脂质颗粒加入hek293t细胞,使得mrna终浓度为 0.3-10μg/ml,在37℃,co2浓度5%的条件下培养48小时。培养之后,将96孔板在4℃静置1小时,每1孔加入包含0.05%tween 20的 pbs(-)(pbst)300μl,洗涤3次。之后,向在板的孔上固定了的hpv基因型16的e7表达蛋白(16e7)加入辣根过氧化物酶(hrp)标记抗16e7抗体,于室温反应2小时,用pbst洗涤孔3次之后,加入hrp底物检测。16e7 蛋白表达水平通过从各孔的450nm的吸光度中减去为背景的540nm的吸光度而算出。
[0407]
[试验例2]
[0408]
对hpv基因型16e7疫苗抗原为特异性的细胞毒性t细胞(ctl)的诱导水平(图2,3,5,9)
[0409]
c57bl/6j小鼠购自clea japan,inc.。所有的动物实验依照日本基盘健康营养研究所的机构指导方针实施。动物的所有处理都是在麻醉下进行的,在异氟醚的吸入麻醉下,或ketaral、seractal注射液的皮下施用麻醉下进行。
[0410]
在7周龄的c57bl/6小鼠的大腿部肌内接种每只mrna量为4-10μg 的封装mrna核酸脂质颗粒,间隔10天接种2次。另外,在质粒dna 的大腿部肌内施用中,每只40μg的dna通过电穿孔法施用。电穿孔法的施用条件设为30v,50ms on/100ms off,3循环。电穿孔法也为间隔 10天接种2次。在最终免疫起1周后在肝素存在下回收外周血,或者在最终免疫起1周后或者2周后回收脾脏,进行外周血单核细胞(pbmcs)及脾细胞的制备,制成评价试样。对pbmcs及脾细胞中对hpv基因型16e7 疫苗抗原为特异性的细胞毒性t细胞(ctl)的诱导水平而言,在进行基于相对于t细胞表面标记的抗体,及mhc i类分子和16e7表位的四聚体复合
体的免疫染色之后,使用facs法测定。
[0411]
[试验例3]
[0412]
向对于hpv基因型16e7疫苗抗原的抗体效价测定(图4)
[0413]
在7周龄的c57bl/6小鼠的大腿部肌内接种每只mrna量为10μg的封装mrna核酸脂质颗粒,间隔10天接种2次。在最终免疫起1周后进行在肝素存在下的外周血的回收和血浆的制备,制成评价试样。使用 elisa法测定了血浆中与hpv基因型16e7疫苗抗原结合的总igg。elisa 法的固定化处理为将16e7重组蛋白以浓度0.5μg/ml在96孔板中4℃过夜固定。同时,也制作了浓度已知的小鼠igg蛋白的稀释系列,并在同一板上进行固定以用于标准曲线。之后,用pbst洗涤3次之后,在包含1%bsa 的pbst(1%bsa/pbst)中进行1小时封闭处理。对血浆试样而言,用1%bsa/pbst制作了阶梯稀释系列,添加到16e7固定化孔中,于室温反应2小时。在用于小鼠igg标准曲线的孔中添加了1%bsa/pbst,同样进行反应。用pbst洗涤3次之后,向各孔添加hrp标记的抗小鼠igg抗体,于室温反应1小时。用pbst洗涤3次之后,加入hrp底物显色,加入作为显色终止液的1n硫酸溶液。对与16e7结合的小鼠igg浓度而言,通过从各孔的450nm的吸光度中减去为背景的540nm的吸光度后使用标准曲线算出。
[0414]
[试验例4]
[0415]
使用c57bl/6小鼠的tc-1癌细胞的移植实验和封装mrna核酸脂质颗粒的癌退縮效果(图4-6)
[0416]
将在c57bl/6小鼠的肺上皮细胞中表达hpv基因型16的e6及e7 的tc-1癌细胞系施用至小鼠侧腹的皮下,经时地测定肿瘤尺寸。作为癌移植位点的小鼠侧腹在tc-1癌细胞移植前进行剃毛,移植了每只1
×
105个的tc-1细胞。在移植tc-1细胞起8天后,以每只10μg的mrna肌内施用了实施例20的封装mrna核酸脂质颗粒。用于除去cd4阳性细胞及 cd8阳性细胞的抗体施用在施用封装mrna核酸脂质颗粒的2天前开始。
[0417]
[试验例5]
[0418]
利用抗cd4抗体,抗cd8抗体的施用去除cd4阳性及cd8阳性细胞(图4-6)
[0419]
从施用封装mrna核酸脂质颗粒的2天前到3天,在7周龄的c57bl/6 小鼠的腹膜内连续施用了每只1天100μg的抗cd4抗体(gk1.5),及抗cd8 抗体(53-6.72)。在抗体施用第3天,在大腿部肌内施用了以每只mrna量计10μg的实施例20的封装mrna核酸脂质颗粒。
[0420]
[试验例6]
[0421]
相对于ova疫苗抗原的抗体效价测定(图7)
[0422]
在7周龄的c57bl/6小鼠的尾根部皮内接种以每只mrna量计15μg 的封装mrna核酸脂质颗粒,间隔2周接种2次。在最终免疫起1周后进行外周血回收和血清的制备,制成评价试样。使用elisa法测定了与血浆中的ova疫苗抗原结合的总igg。elisa法的固定化处理中,将ova 重组蛋白以浓度1μg/ml在96孔板中4℃过夜固定。同时,也制作了浓度已知的小鼠igg蛋白的稀释系列,并在同一板上进行固定以用于标准曲线。之后,用pbst洗涤3次之后,在包含1%bsa的pbst(1%bsa/pbst)中进行1小时封闭处理。对血清试样而言,用1%bsa/pbst制作了阶梯稀释系列,添加到ova固定化孔中,于室温反应2小时。在用于小鼠igg 标准曲线的孔中添加了1%bsa/pbst,同样进行反应。用pbst洗涤3次之后,向各孔添加hrp标记的抗小鼠igg抗体,于室温反应1小时。用 pbst洗涤3次之后,加入hrp底物显色,加入作为显色终止液的1n硫酸溶液。对与16e7结合的小鼠igg浓度而言,通过从各孔的450nm的吸光度
中减去为背景的540nm的吸光度后使用标准曲线算出。
[0423]
[试验例7]
[0424]
ova疫苗抗原特异性的t细胞细胞因子产生能力(图8)
[0425]
在7周龄的c57bl/6小鼠的尾根部皮内接种以每只mrna量计15μg 的封装mrna核酸脂质颗粒,间隔2周接种2次。从最终免疫起1周后回收脾脏,制备了脾细胞。将接种于96孔培养板的脾细胞分别用ova抗原的mhc i类限制性表位肽,ova疫苗抗原蛋白质刺激,培养24小时。 ova抗原特异性的细胞因子产生水平以培养上清液为试样,使用细胞因子 elisa法进行了评价。本研究中测定了从ctl、th1产生的代表性细胞因子ifn-γ。
[0426]
[试验例8]
[0427]
hpv基因型18e6e7疫苗抗原特异性的t细胞细胞因子产生能力(图10)
[0428]
c57bl/6j小鼠购自clea japan,inc.。动物的所有处理在异氟烷的吸入麻醉下进行。
[0429]
在6周龄的c57bl/6小鼠的腓肠肌内施用以每只mrna换算计5μg 的封装mrna核酸脂质颗粒,间隔2周施用2次。从最终施用起1周后提取脾脏,制备了脾细胞。利用hpv18e6池肽(jpt公司制,产品目录 #pm-hpv18-e6)处理脾细胞,通过细胞因子elisa法测定了48小时培养后的培养上清液中ifn-γ量。
[0430]
[试验例9]
[0431]
对hpv基因型16e6e7疫苗抗原为特异性的细胞毒性t细胞(ctl)的诱导水平(图11)
[0432]
c57bl/6j小鼠购自clea japan,inc.。动物的所有处理在异氟烷的吸入麻醉下进行。
[0433]
在6周龄的c57bl/6小鼠的腓肠肌内施用以每只mrna换算计5μg 的封装mrna核酸脂质颗粒,间隔2周施用2次。从最终施用起1周后提取脾脏,制备了脾细胞。对脾细胞中对hpv基因型16的e7(hpv16e7) 为特异性的细胞毒性t细胞(ctl)的诱导水平而言,进行相对于t细胞表面标记的抗体及mhc i类分子限制性hpv16e7表位和mhc i类分子的复合体的免疫染色,使用流式细胞术测定。
[0434]
[试验例10]
[0435]
hpv基因型16e6e7疫苗抗原特异性的t细胞细胞因子产生能力(图12)
[0436]
在6周龄的c57bl/6小鼠的腓肠肌内施用以每只mrna换算计5μg 的封装mrna核酸脂质颗粒,间隔2周施用2次。从最终施用起1周后提取脾脏,制备了脾细胞。将脾细胞接种至96孔培养板,在hpv16e7的 mhc i类限制性表位肽处理下培养24小时后,通过细胞因子elisa法测定了培养上清液中的ifn-γ量。
[0437]
[试验例1~10的结果]
[0438]
实施例14~17的封装mrna核酸脂质颗粒造成的hpv基因型16的e7表达水平(图1)
[0439]
使用hek293t细胞研究了在培养细胞中,来自封装mrna核酸脂质颗粒的抗原表达水平。将结果示于图1。与实施例14,17相比,在实施例 15,16中确认了hpv血清型16的e7(16e7)蛋白表达水平更高的倾向。另一方面,与未经封装的mrna核酸脂质颗粒处理的孔相比,它们均诱导了16e7蛋白表达,说明了培养细胞中封装mrna核酸脂质颗粒的蛋白表达诱导能力。
[0440]
dna疫苗模型与封装mrna核酸脂质颗粒的ctl诱导水平的比较(图2)
[0441]
构建参考例1的dna疫苗模型,进行了与小鼠模型中实施例9,11, 13的封装mrna核酸脂质颗粒的ctl诱导能力的比较研究。将结果示于图2。对从最终免疫起1周后外周血中的16e7特异性的ctl诱导水平进行了评价,结果显示,3种封装mrna核酸脂质颗粒显示出比这些dna 疫苗模型(pdna)更高的ctl诱导能力(左图)。另外,对从最终免疫起2 周之后的脾细胞中16e7特异性的ctl诱导水平进行了评价,结果显示实施例9,11,13的封装mrna核酸脂质颗粒显示出与pdna同等以上的 ctl诱导水平(右图)。
[0442]
封装mrna核酸脂质颗粒实施例14~实施例17的小鼠中的ctl诱导能力(图3)
[0443]
研究了c57bl/6小鼠中4种封装mrna核酸脂质颗粒的16e7特异性的ctl诱导水平。将结果示于图3。虽然在个体间有偏差,在4种封装 mrna核酸脂质颗粒中全部确认了16e7特异性的ctl诱导水平。
[0444]
在封装mrna核酸脂质颗粒的抗体诱导能力中,cd4阳性细胞及cd8阳性细胞的重要性(图4)
[0445]
研究了移植tc-1癌细胞后,在除去cd4阳性细胞及cd8阳性细胞的小鼠中封装mrna核酸脂质颗粒的抗体诱导水平。将结果示于图4。当不施用去除细胞抗体的对照组(对照组(未去除))和施用实施例20的封装 mrna核酸脂质颗粒的组(实施例20(未去除))进行比较时,在实施例20(未去除)组中确认了16e7特异性的抗体水平。另外,在除去cd8阳性细胞的施用封装mrna核酸脂质颗粒组(实施例20(cd8去除))中也显示了与实施例20(未去除)组同等的抗体诱导水平。然而,可知在除去cd4阳性细胞的施用封装mrna核酸脂质颗粒组(实施例20(cd4去除))中,与实施例20(未去除)组和实施例20(cd8去除)组相比,16e7抗体诱导水平减少。根据以上结果,启示了在施用封装mrna核酸脂质颗粒带来的16e7抗原特异性的抗体诱导中,cd4阳性细胞可能是重要的。
[0446]
封装mrna核酸脂质颗粒的ctl诱导能力中,cd4阳性细胞及cd8阳性细胞的重要性(图5)
[0447]
研究了移植tc-1癌细胞后,在除去cd4阳性细胞及cd8阳性细胞的小鼠中封装mrna核酸脂质颗粒的16e7特异性的ctl诱导水平。结果见图5。当不施用去除细胞抗体的对照组(对照组(未去除))和施用实施例 20的封装mrna核酸脂质颗粒的组(实施例20(未去除))进行比较时,在实施例20(未去除)组中确认了16e7特异性的ctl水平。另一方面,在除去 cd4阳性细胞的施用封装mrna核酸脂质颗粒组(实施例20(cd4去除)) 中,与实施例20(未去除)组比较,显示了更低的ctl诱导水平。进一步,可知在除去cd8阳性细胞的施用封装mrna核酸脂质颗粒组(实施例 20(cd8去除))中,与实施例20(未去除)组相比,16e7特异性的ctl诱导水平显著减少。根据以上结果,启示了在施用封装mrna核酸脂质颗粒带来的16e7抗原特异性的ctl诱导中,cd8阳性细胞可能是必要的。
[0448]
封装mrna核酸脂质颗粒的癌增殖抑制效果中cd4阳性细胞及cd8阳性细胞的重要性(图6)
[0449]
研究了移植tc-1癌细胞后,在除去cd4阳性细胞及cd8阳性细胞的小鼠中封装mrna核酸脂质颗粒的癌退縮效果。结果见图6。当不施用去除细胞抗体的对照组(对照组(未去除))和施用实施例20的封装mrna核酸脂质颗粒的组(实施例20(未去除))进行比较时,确认了实施例20(未去除) 组中tc-1癌肿瘤的增殖抑制效果。另外,在除去cd4阳性细胞的施用封装mrna核酸脂质颗粒组(实施例20(cd4去除))中,与实施例20(未去除) 组同样显示了
tc-1癌增殖抑制效果。然而,在除去cd8阳性细胞的施用封装mrna核酸脂质颗粒组(实施例20(cd8去除))中,与实施例20(未去除)组相比,tc-1癌增殖没有被抑制,肿瘤尺寸与对照组(未去除)相同。根据以上结果,启示了在施用封装mrna核酸脂质颗粒带来的癌增殖抑制效果中,cd8阳性细胞可能是必要的。
[0450]
脂质组成的不同封装mrna核酸脂质颗粒实施例21~实施例27的ova特异性的抗体诱导水平(图7)
[0451]
对c57bl/6小鼠肌内施用实施例21~实施例27的封装mrna核酸脂质颗粒,研究了从最终免疫起1周之后的血中ova特异性的抗体诱导水平。结果见图7。ova特异性的抗体诱导水平在实施例22的封装mrna 核酸脂质颗粒中较低,在其它施用封装mrna核酸脂质颗粒组中相同。
[0452]
脂质组成不同的封装mrna核酸脂质颗粒实施例21~实施例27的ova特异性的ifn-γ诱导水平(图8)
[0453]
对c57bl/6小鼠肌内施用实施例21~实施例27的封装mrna核酸脂质颗粒,研究了从最终免疫起1周后,来自脾细胞的ova特异性的t细胞细胞因子诱导水平。将结果示于图8。在实施例26的封装mrna核酸脂质颗粒免疫组中,相对于ova的mhc i类限制性表位肽,及ova蛋白的刺激的ifn-γ诱导水平最低,实施例21,实施例22,实施例25,实施例27的ova抗原特异性的诱导水平相同。
[0454]
磷脂种类和其含量不同的封装mrna核酸脂质颗粒实施例28~实施例32的小鼠中的ctl诱导水平(图9)
[0455]
研究了c57bl/6小鼠中4种封装mrna核酸脂质颗粒的16e7特异性的ctl诱导水平。将结果示于图9。对16e7特异性的ctl诱导水平而言,磷脂种类为dopc的实施例28,实施例29,为dope的实施例30,实施例31,与为dspc的实施例32相同。
[0456]
mrna修饰不同的封装mrna核酸脂质颗粒实施例37~40的hpv18e6特异性的细胞因子产生诱导水平(图10)
[0457]
对c57bl/6小鼠肌内施用实施例37~实施例40的封装mrna核酸脂质颗粒,研究了从最终免疫起1周后,来自脾细胞的hpv18e6特异性的 t细胞细胞因子量。结果示于图10。在实施例37~实施例40的各组中,与nc组相比,观察到相对于hpv18e6池肽处理的ifn-γ产生诱导(图10)。
[0458]
脂质构成比不同的封装mrna核酸脂质颗粒实施例41~52的ctl诱导能力(图11)
[0459]
对c57bl/6小鼠肌内施用实施例41~实施例52的封装mrna核酸脂质颗粒,对从最终免疫起1周后,脾细胞中16e7特异性的ctl诱导水平进行了评价。结果见图11。16e7特异性的ctl诱导水平与nc组相比,在进行评价的全部封装mrna核酸脂质颗粒中较高。
[0460]
脂质构成比不同的封装mrna核酸脂质颗粒实施例41~52的hpv16e7特异性的ifn-γ诱导水平(图12)
[0461]
对c57bl/6小鼠肌内施用实施例41~实施例52的封装mrna核酸脂质颗粒,研究了从最终免疫起1周后,来自脾细胞的hpv16e7特异性的 t细胞细胞因子诱导水平。将结果示于图12。与nc组相比,在任一个施用封装mrna核酸脂质颗粒组中,利用hpv16e7的mhc i类限制性表位肽处理均使ifn-γ的产生增强。
[0462]
本说明书所引用的全部刊物、专利及专利申请以其原文作为参考而并入本说明书
中。
[0463]
工业实用性
[0464]
本发明可以用于人乳头瘤病毒引起的感染的预防和/或治疗中。
[0465]
序列表自由文本
[0466]
《seq id no:1》hpv16 e6-e7融合2的ivt用的模板dna。
[0467]
gctagc(nhei位点):碱基编号1~6
[0468]
t7启动子序列:碱基编号8~27
[0469]
人β-球蛋白的5
’‑
utr序列:碱基编号39~88
[0470]
kozak序列:碱基编号89~94
[0471]
ige前导序列的翻译区域:碱基编号95~148
[0472]
hpv16型e6的翻译区域:碱基编号149~598
[0473]
弗林蛋白酶切割位点:碱基编号599~619
[0474]
hpv16型e7的翻译区域:碱基编号620~913
[0475]
人β-球蛋白的3
’‑
utr序列:碱基编号914~1045
[0476]
poyla:碱暴编号1046~1147
[0477]
actagt(spei位点):碱基编号1152~1157
[0478][0479]
[0480]
《seq id no:2》hpv16 e6-e7融合2mrna-001。
[0481][0482]
《seq id no:3》hpv16 e6-e7融合10的ivt用的模板dna。
[0483]
gctagc(nhei位点):碱基编号1~6
[0484]
t7启动子序列:碱基编号8~27
[0485]
人β-球蛋白的5
’‑
utr序列:碱基编号39~88
[0486]
kozak序列:碱基编号89~94
[0487]
ige前导序列的翻译区域:碱基编号95~148
[0488]
hpv16型e6的翻译区域:碱基编号149~598
[0489]
弗林蛋白酶切割位点:碱基编号599~619
[0490]
hpv16型e7的翻译区域:碱基编号620~913
[0491]
人β-球蛋白的3
’‑
utr序列:碱基编号914~1045
[0492]
poyla:碱基编号1046~1147
[0493]
actagt(spei位点):碱基编号1152~1157
[0494][0495]
《seq id no:4》hpv16 e6-e7融合10 mrna-001~006。
[0496][0497]
《seq id no:5》hpv16 e6-e7融合10opt2模板dna。
[0498]
gctagc(nhei位点):碱基编号1~6
[0499]
t7启动子序列:碱基编号8~27
[0500]
人β-球蛋白的5
’‑
utr序列:碱基编号39~88
[0501]
kozak序列:碱基编号89~94
[0502]
ige前导序列的翻译区域:碱基编号95~148
[0503]
hpv16型e6的翻译区域:碱基编号149~598
[0504]
弗林蛋白酶切割位点:碱基编号599~619
[0505]
hpv16型e7的翻译区域:碱基编号620~913
[0506]
人β-球蛋白的3
’‑
utr序列:碱基编号914~1045
[0507]
poyla:碱基编号1046~1147
[0508]
actagt(spei位点):碱基编号1152~1157
[0509][0510]
《seq id no:6》hpv16 e6-e7融合10 opt2 mrna-001。
[0511]
[0512][0513]
《seq id no:7》seq id no:7 ova(卵清蛋白)的翻译区域
[0514][0515]
《seq id no:8》hpv16型的e6抗原的氨基酸序列。
[0516][0517]
《seq id no:9》hpv16型的e7抗原的氨基酸序列。
[0518][0519]
《seq id no:10》pma-hpv18_融合1_opt1
[0520][0521]
nhei序列:碱基编号1~6
[0522]
t7启动子:碱基编号7~24
[0523]
a:转录起始点:碱基编号25
[0524]5’‑
utr:碱基编号39~88
[0525]
kozak序列:碱基编号89~94
[0526]
ige前导序列:碱基编号95~148
[0527]
hpv18 e6序列:碱基编号149~613
[0528]
弗林蛋白酶识别序列:碱基编号614~634
[0529]
hpv18 e7序列:碱基编号635~949
[0530]3’‑
utr:碱基编号950~1081
[0531]
polya序列:碱番编号1082~1183
[0532]
spei序列:碱基编号1188~1193
[0533]
《seq id no:11》hpv18 e6-e7融合1 opt1 mrna-001及002
[0534][0535]
《seq id no:12》pma-hpv18_融合1_opt2
[0536][0537]
nhei序列:碱基编号1~6
[0538]
t7启动子:碱基编号7~24
[0539]
g:转录起始点:碱基编号25
[0540]5’‑
utr:碱基编号39~88
[0541]
kozak序列:碱基编号89~94
[0542]
ige前导序列:碱基编号95~148
[0543]
hpv18 e6序列:碱基编号149~613
[0544]
弗林蛋白酶识别序列:碱基编号614~634
[0545]
hpv18 e7序列:碱基编号635~949
[0546]3’‑
utr:碱基编号950~1081
[0547]
polya序列:碱番编号1082~1183
[0548]
spei序列:碱基编号1188~1193
[0549]
《seq id no:13》hpv18 e6-e7融合1 opt2 mrna-001及002
[0550][0551]
《seq id no:14》hpv18型的e6抗原的氨基酸序列。
[0552][0553]
《seq id no:15》hpv18型的e7抗原的氨基酸序列。
[0554][0555]
《seq id no:16》蛋白酶切割序列的氨基酸序列
[0556]
rgrkrrs
[0557]
《seq id no:17》hpv16型的e6抗原及e7抗原融合蛋白氨基酸序列
[0558]
[0559]
《seq id no:18》hpv18型的e6抗原及e7抗原融合蛋白氨基酸序列
[0560]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1