可生物降解的纳米复合疫苗、用于抑制乙型肝炎病毒复制和乙型肝炎病毒表面抗原分泌的方法与流程
1.本发明涉及乙型肝炎病毒(hbv)疫苗,特别是涉及纳米复合疫苗。
背景技术:
2.即使在21世纪,乙型肝炎病毒(hbv)感染也是一个重要的公共卫生问题。人们通过接触受污染的体液(例如血液或精液)感染hbv。垂直感染、性传播和不安全的医疗行为是病毒传播的三大主要途径。血清学证据表明,已有20亿人被感染,超过3.5亿人为慢性感染病毒。世界卫生组织(who)还将病毒性肝炎纳入其主要公共卫生优先事项。急性hbv感染的结果取决于年龄。尽管大多数患者会从hbv感染中恢复,但进展为慢性感染的患者几乎终生都携带hbv。大约95%的婴儿、30%的1-5岁儿童和不到5%的成人发展为慢性感染。慢性hbv感染会增加肝纤维化和肝细胞癌的风险。因此,hbv感染被公认为全球第十大死因。
3.人类中有8种主要的hbv基因型(a-h)。基因型a和c流行于美国,基因型a流行于非洲。东亚的感染通常是基因型b和c,而南欧和印度的感染是基因型d。在这些hbv基因型中,c与肝纤维化的发展和肝细胞癌的风险增加有关。在hbv生命周期中,共价闭合环状dna(cccdna)是hbv dna在肝细胞核内形成的结构。cccdna可以稳定地存在于宿主细胞核中,作为病毒rna转录的模板。此外,hbv dna可以整合到宿主基因组中。
4.hbv蛋白被翻译以帮助复制周期。这些蛋白质中的一些被分泌到血液循环中并且可以被识别为血清学标志物。hbv表面抗原(hbsag)和包膜抗原(hbeag)是hbv当前或既往感染患者的两个主要生物标志物。急性hbv感染患者为hbeag阳性(hbeag+),但在发展为慢性感染时转为阴性。使用针对hbc/e/sag(即hbv核心、包膜或表面抗原)的特异性抗体(hbc/e/sab),可以清楚地确定感染的急性期或慢性期。所有hbv感染者都会产生hbcab,大约80%的康复者(治愈感染)会产生hbsab。hbsag存在超过6个月被定义为慢性感染。具体来说,hbsag
+
hbsab
+
hbcab
+
hbvdna
+
患者为hbv感染者,hbsag
-
hbsab
+
hbcab
+
hbv dna
-
为康复者。大约80%的受感染成人发展为hbsab(称为抗hbs血清转化)。接种过疫苗的人表示为hbsag
-
hbsab
+
hbcab
-
hbvdna
-
。
5.慢性hbv感染可分为4个阶段:hbeag
+
免疫耐受期、hbeag
+
免疫活性期、hbeag-无活性期和hbeag-免疫反应期。所有阶段均为hbsag
+
,用于区分这些阶段的其他血清学标志物取决于hbeag和hbeab、hbv dna、丙氨酸氨基转移酶(alt;肝脏炎症的敏感标志物)水平和肝内坏死性炎症。hbeag
+
免疫耐受期的特点是hbeab
-
,dna水平高,alt正常,肝脏轻度炎症。alt和肝脏炎症的增加意味着患者进入hbeag阳性免疫活性期。此外,hbeag丢失、hbeab
+
和dna水平低代表hbeag
-
非活动期。这一阶段可能因先前的炎症而出现纤维化。一旦alt和肝脏炎症升高,患者就进入hbeag
-
免疫反应期。总体而言,患者可以反复进入与宿主免疫相关的这些阶段。医学治疗通常遵循这些不同阶段的指标。
6.显然,慢性感染是由于宿主体内存在寄生的hbv。除了将病毒基因组整合到宿主基因组中外,病毒蛋白,尤其是hbsag的免疫调节也起着重要作用。慢性hbv感染会产生大量仅
i511744中描述的纳米复合疫苗技术。简而言之,使用简单的电动力方法通过将带电聚合物溶液添加到另一种带相反电荷的聚合物溶液中而将hbcag和/或hbsag封装在纳米复合物中。在这些实施方式中,hbcag和/或hbsag是第一带电聚合物溶液中的包封免疫原。第一个带电聚合物溶液还含有带负电荷的聚-γ-谷氨酸(γ-pga)。γ-pga是可商购的(例如,milliporesigma corporation,st.louis,mo,u.s.a.)。任何合适的分子量范围的γ-pga都可以用于本发明的实施方式。在优选实施方式中,γ-pga具有约200kda或更小的重均m.w.。第二带电聚合物溶液含有带正电荷的壳聚糖(cs)。壳聚糖可从许多商业来源获得。任何具有合适分子量范围和脱乙酰度的壳聚糖均可用于本发明的实施方式。在优选实施方式中,壳聚糖可具有约10-100kda的重均分子量(mw)。具有这种分子量的壳聚糖适合在保持蛋白质和肽药物生物活性的ph值下获得足够的溶解度。
13.本发明的实施方式可以使用任何合适浓度的抗原和纳米复合物组分。示例性浓度范围如下:在第一溶液中:hbc/sag:2至0.5mg/ml和γ-pga:5-20mg/ml,在第二溶液中:cs:20至30mg/ml。纳米复合物(nc)可具有约+30mv至约+50mv的zeta电位和100nm至800nm的可调尺寸范围。这些带正电荷的hbc/s-nc在预防和治疗hbv感染方面显示出不同寻常的治疗效果。
14.本发明的一个方面涉及hbv疫苗。根据本发明的一种实施方式的hbv疫苗包含配制在纳米复合物中的hbv核心抗原(hbcag)和/或hbv表面抗原(hbc/sag)。纳米复合物包含γ-聚谷氨酸(γ-pga)和壳聚糖。通过将含有抗原蛋白的第一带电溶液与第二带电溶液混合来制备纳米复合物。各种组分的示例性浓度是:hbcag和/或hbc/sag在第一个带电溶液中约为2至0.5mg/ml并且γ-pga约为5-20mg/ml,在第二带电溶液中壳聚糖约为20至30mg/ml。纳米复合物具有约+30mv至约+50mv的zeta电位。
15.本发明的另一方面涉及治疗或预防hbv感染的方法。根据本发明一种实施方式的方法包括向有需要的对象施用包含任何上述纳米复合疫苗的组合物。本领域技术人员会理解,“治疗中或处理中(treating)”或“治疗或处理(treatment)”是指减轻或消除症状,而在疫苗的上下文中“预防中(preventing)”或“预防(prevention)”是指诱导抗体形成或免疫反应,使得疾病状况不会发生或发生的程度较小。本发明的疫苗可以通过任何合适的途径施用,例如注射(肌肉、皮下等)、鼻喷雾剂、口服等。疫苗接种的有效量将取决于几个因素(例如,制剂形式、施用途径等),并且本领域技术人员将能够在无需创造性努力的情况下确定有效量。
16.通过以下详细描述和附图,本发明的其他方面将变得显然。
附图说明
17.图1显示了sds-聚丙烯酰胺凝胶电泳中的hbcag和hbsag天然形式和还原形式。
18.图2显示了hbc/s-nc(纳米复合物)的z平均值、多分散指数(pdi)和zeta电位。pdi(多分散指数)由dls(动态光散射)测量确定。pdi定义为标准差的平方除以平均值的平方。
19.图3显示了使用c57bl/6小鼠模型测试本发明的疫苗的疫苗接种、血液取样和处死的时间表。
20.图4a显示了从第0天到第28天的体重变化图。图4b显示脾脏重量除以第28天的体重。小鼠仅接种纳米复合物(nc),或hbc/s-alum(常规佐剂)、20μg/剂hbc/s-nc,或10μg/剂
hbc/s-nc,每周监测小鼠体重直至第28天处死小鼠,取出脾脏并称重。
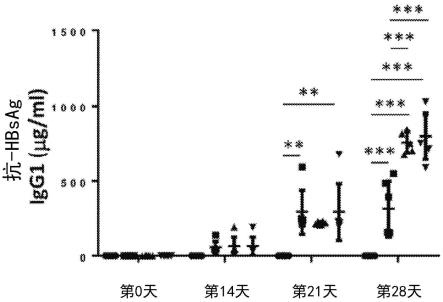
21.图5a-5d显示仅接种nc、hbc/s-alum、20μg/剂hbc/s-nc或10μg/剂hbc/s-nc后抗原特异性免疫球蛋白g1(igg1)和g2a(igg2a)血清水平。图5a显示各组中抗-hbcagigg1血清水平。图5b显示各组中的抗-hbcag igg2a血清水平。图5c显示各组中抗-hbsag igg1血清水平,和图5d显示各组中的抗-hbsag igg2a血清水平。数据表示为平均值
±
sd。使用单向方差分析进行统计分析,然后进行tukey的多重比较检验。*p《0.05,**p《0.01,***p《0.001。
22.图6显示了动物模型研究计划,包括用于测试本发明疫苗功效的aav/hbv c57bl/6小鼠模型的感染、疫苗接种、血液取样和处死的时间表。
23.图7显示aav/hbv感染小鼠血清中丙氨酸氨基转移酶(alt)水平的变化,然后用盐水(非处理,nt)、10μg/剂hbc-nc或10μg/剂hbc接种小鼠/s-nc。
24.图8显示aav/hbv感染小鼠血清中胆红素水平的变化,然后将其接种生理盐水(非处理,nt)、10μg/剂hbc-nc或10μg/剂hbc/s-nc。
25.图9显示了来自指定组的血清中hbsag滴度的变化结果。血清来自aav/hbv感染的小鼠,然后用生理盐水(非处理,nt)、10μg/剂hbc-nc或10μg/剂hbc/s-nc接种。
26.图10a-10c显示了来自指定组的个体小鼠中hbsag滴度的变化。血清来自aav/hbv感染的小鼠,然后用生理盐水、10μg/剂hbc-nc或10μg/剂hbc/s-nc接种。图10a显示了用盐水接种的结果(非处理,nt)。图10b显示了接种10μg/剂hbc-nc的结果,和图10c显示了接种10μg/剂hbc/s-nc的结果。
27.图11显示了来自指定组的血清中hbeag滴度的变化结果。用生理盐水、10μg/剂hbc-nc或10μg/剂hbc/s-nc接种aav/hbv感染的小鼠。然后,在指定时间收集血清样品用于hbeag滴度测量。
28.图12a-12c显示了来自指定组的个体小鼠中hbeag滴度的变化。血清来自aav/hbv感染的小鼠,然后用生理盐水、10μg/剂hbc-nc或10μg/剂hbc/s-nc接种。图12a显示了用盐水接种的结果(非处理,nt)。图12b显示了接种10μg/剂hbc-nc的结果,和图12c显示了接种10μg/剂hbc/s-nc的结果。
29.图13显示了在仅接种nc(非处理,nt)、10μg/剂hbc-nc或10μg/剂hbc/s-nc后第10周的抗体(hbsag特异性igg)血清水平。数据表示为平均值
±
sd。使用单向方差分析进行统计分析,然后进行tukey的多重比较检验。***p《0.001。
具体实施方式
30.慢性hbv感染是全世界的关键医学问题。考虑到毒力因素和反复炎症的结果,广泛使用预防性疫苗和药物治疗。慢性hbv感染患者以hbv s抗原(hbsag)、e抗原(hbeag)和dna作为血清学标志物。在hbsag水平高的情况下,hbv可以通过抑制先天免疫和t细胞耗竭来逃避宿主免疫。因此,最有效的治疗方法需要打破免疫耐受以恢复宿主免疫力。本发明的发明人发现,在由带电聚合物组成的纳米复合物(nc)中配制的hbv抗原可以诱导t辅助(th)1和2反应,从而打破慢性hbv感染的免疫耐受性。
31.本发明的实施方式涉及可用于预防和/或治疗hbv感染的hbv疫苗。这些疫苗包含新型纳米复合物中的抗原,可以引发高效的免疫反应。发明人发现了制备这些基于纳米颗粒的疫苗的电动力方法。这种方法与传统的疫苗技术有很大不同。该技术操纵溶液系统的
双电层,通过压缩力用(+/-)带电聚合物包封蛋白质,形成稳定、窄电荷分布和分散的球形纳米复合物(参见美国专利号10,052,390b2;eu:2754436;中国:cn103910892b;“中国台湾地区”:i511744;所有这些专利的公开内容均以引用方式全文并入)。
32.发明人出乎意料地发现,包裹在纳米复合物(nc)中的抗原(ag)可以诱导平衡的t辅助细胞(th)1和2免疫反应并维持长期抗体(ab)的产生。发现这些抗原纳米复合物比使用常规佐剂(例如明矾)的抗原诱导的免疫反应更强、更全面。由于更强和更全面的免疫反应,这些含有hbv抗原的纳米复合疫苗意外地被发现能够打破慢性hbv感染的免疫耐受。
33.本发明的疫苗可以使用市售的hbv抗原蛋白或重组蛋白或其片段。基于已知的序列,这些抗原蛋白(hbcag或hbsag)的生产可以使用本领域已知的任何合适的技术。例如,默克公司使用酵母细胞中产生的hbsag来生产hbv疫苗recombivax根据本发明的实施方式,抗原蛋白可以是全长hbcag或hbsag,或其免疫原性片段。
34.在以下实施例中,使用通过重组技术产生的全长hbcag和hbsag。为了评估hbc/sag蛋白的纯度和稳定性,将非还原蛋白或用β-巯基乙醇(2-me)或二硫苏糖醇(dtt)还原的蛋白加载到sds-聚丙烯酰胺凝胶电泳上。电泳后,这些蛋白质根据它们的分子量(hbc约19kda;hbs约24kda)被分离到相对位置。蛋白质条带的考马斯蓝染色显示出高纯度的商品hbc/sag(图1)。这些抗原用于测试本发明的疫苗。
35.为了制备抗原-纳米复合物,将hbv核心和/或表面抗原(hbc/sag)与γ-pga混合以形成第一带电聚合物溶液。然后,将该溶液与第二带电聚合物溶液(例如壳聚糖)以适当的比例混合。所得的hbc/sag-纳米复合物(hbc/s-nc)用动态光散射(dls)进行表征。dls的结果显示hbc/s-nc的尺寸范围为约100nm至约800nm,各组的平均直径范围为344nm至573nm(图2)。由动态光散射(dls)确定的低多分散指数(pdi)证明了nc颗粒的粒度变化范围不大,并且这些nc的zeta电位被确定为约+30mv至约+50mv(图2)。
36.测试这些抗原-nc引发免疫反应的能力。以两种剂量(10μg和20μg)对hbc/s-nc进行了测试,以评估对抗体产生的刺激作用。对照包括仅nc和hbc/s-alum(20μg/剂),其使用常规佐剂(明矾)。在第0天通过皮下(s.c.)途径将这些疫苗接种到c57bl/6小鼠中。在第0、14、21和28天获得血样,并在第28天处死小鼠(图3)。监测测试组中小鼠的体重并发现其稳定并且与对照组相当,表明这些疫苗接种是安全的(图4a)。此外,在第28天处死小鼠,收获脾脏。第28天脾重除以体重的比率没有显著差异,证实了这些疫苗的安全性(例如,没有明显的炎症)(图4b)。
37.通过检查它们对各种免疫细胞的影响和抗体的产生来研究这些疫苗诱导免疫反应的能力。在小鼠中,th1依赖性ifn-γ诱导igg2a的产生,而th2依赖性细胞因子il-4刺激igg1的表达。因此,igg2a和igg1免疫球蛋白同种型可分别用作th1和th2淋巴细胞极化/活化的标志物。在两个剂量(10μg/剂和20μg/剂)的hbc/s-nc组中,hbc/s-nc疫苗接种小鼠的血清hbcag特异性igg1和igg2a滴度均被诱导(图5a和图5b)。
38.如图5a所示,抗hbv核心抗原(抗hbcag)igg1滴度出现较晚,前21天纳米复合疫苗和明矾疫苗之间没有显著差异。到第28天,与常规佐剂(明矾)相比,10μg或20μg的本发明纳米复合物疫苗(hbc/s-nc)诱导了显著更高水平(约2倍)的抗hbcag igg1产生。这些结果表明,与常规疫苗(明矾作为佐剂)相比,本发明的纳米复合物疫苗在诱导th2免疫反应方面明显更有效。
39.如图5b所示,与明矾疫苗相比,10μg或20μg的本发明纳米复合物疫苗(hbc/s-nc)从第14天开始诱导显著更高水平的抗hbv核心抗原(抗hbcag)igg2a产生。到第28天,由本发明的纳米复合物疫苗(hbc/s-nc)诱导的抗-hbcag igg2a的产生比用明矾作为佐剂的疫苗诱导的高几倍(约4倍)。这些结果表明,与使用明矾作为佐剂的常规疫苗相比,本发明的疫苗(纳米复合疫苗)可以激活更高的igga2抗体滴度并引发更强的细胞介导的免疫反应(th1反应)。本发明的纳米复合物疫苗在引发th2反应和细胞介导的免疫反应(th1反应)方面比传统疫苗好得多,这确实是出乎意料的。
40.本发明的纳米复合疫苗(hbc/s-nc)还可以诱导抗hbv表面抗原(抗hbsag)特异性igg1滴度。如图5c所示,本发明的纳米复合疫苗(hbc/s-nc)从第21天开始可以诱导强烈的抗-hbsag igg1产生(th2免疫反应)。具有明矾的常规疫苗也产生了强烈的抗-hbsag igg1产生并且没有显示本发明的疫苗和明矾疫苗之间的区别(图5c)。与th2免疫反应相反,本发明的疫苗或明矾疫苗没有或很少诱导hbsag特异性igg2a滴度(th1免疫反应)(图5d)。
41.上述结果表明,hbv核心抗原(hbcag)的纳米复合物可以极化/激活thl和th2细胞,表明具有hbv核心抗原的纳米复合物疫苗可以增强体液和细胞免疫应答。另一方面,hbv表面抗原(hbsag)的纳米复合物仅极化/激活th2细胞,这表明这些疫苗可以增强体液免疫反应。更重要的是,与具有相同抗原的常规佐剂(例如明矾)相比,本发明的纳米复合物疫苗在t细胞的极化/活化方面显著更有效。
42.为了进一步检查hbc/s-nc诱导的免疫反应及其改变慢性hbv患者免疫耐受状态的潜力,我们使用动物模型研究了这些疫苗的效果—即通过接种hbc/s-nc进入aav/hbv感染的c57bl/6小鼠,由mi-hua tao教授(“台湾地区
‘
中央研究院
’”
生物医学研究所)生产。该hbv携带小鼠模型是通过将paav/hbv1.2质粒流体动力学注射(hdi)到c57bl/6小鼠中而开发的。(huang et al.,proc.natl.acad.sci.u.s.a.2006nov.21;103(47):17862-17867)。
43.图6显示了动物模型研究的实验方案。在-4周,通过静脉内(i.v.)途径(尾静脉)将aav/hbv注射到小鼠体内以产生hbv携带小鼠模型。生理盐水(非处理,nt)、两剂10μg/剂hbc-nc或10μg/剂hbc/s-nc在第1天(第0周)和第15天通过皮下接种。在第-1、7、14天、每2周至第12周和第16周收集血样。这些疫苗对hbv感染的影响由肝脏健康和hbv状态的几种标志物(makers)评估。
44.首先,通过评估血液中的丙氨酸转氨酶(alt)和胆红素水平来监测小鼠肝脏健康。alt是一种肝酶,当肝细胞受损时会在血液中释放。胆红素来自红细胞的分解并由肝脏排出。高胆红素水平可能表明肝脏有问题。图7显示了alt水平和图8显示了测试期间小鼠的胆红素水平。接种hbc/s-nc和hbc/s-nc的小鼠中的这些水平与盐水处理的对照组(nt)相似,这表明hbc/s-nc和hbc/s-nc疫苗对肝脏无毒。
45.为了研究这些纳米复合疫苗的治疗潜力,我们通过评估hbs/eag损失和hbsab血清转换来评估hbc/s-nc在治疗慢性hbv小鼠中的功效。图9总结了结果和统计数据。从第2周开始,接种hbcag-nc的组的hbsag滴度略有降低,并且这种降低的水平在整个过程中保持不变。hbc/sag-nc接种组在2周内显著降低了hbsag滴度,并且从第4周开始几乎消除了hbsag滴度并在整个测试期间保持不变。该结果表明本发明的hbc/sag-nc疫苗可以消除受感染对象的hbsag。
46.图10a-10c分别显示了对照(非处理,nt)、hbc-nc和hbc/s-nc组的hbsag的个体变
化曲线。与非处理组(图10a)相比,hbc-nc(仅核心抗原)疫苗接种导致hbsag滴度显著降低,即使这些小鼠在测试期间仍然具有较低水平的hbsag(图10b)。相比之下,hbc/s-nc(核心和表面抗原)疫苗在第4周导致hbsag滴度急剧下降或完全消除,并在整个测试期间维持在几乎检测不到的水平(图10c)。这些结果表明,虽然hbc-nc疫苗在显著降低hbsag滴度方面是有效的,但hbs/c-nc疫苗在实现消除hbsag方面更有效。
47.hbcag和hbeag蛋白的存在是病毒复制的指示。因此,患者血清中hbeag的存在可以作为慢性肝炎活性复制的标志。我们还研究了本发明的nc疫苗对hbv复制的影响。如图11所示,接种小鼠的hbeag滴度显示缓慢变化,直到第16周才缓慢下降。图12a-12c分别显示了对照(非处理,nt)、hbc-nc和hbc/s组的hbeag滴度的个体变化曲线。疫苗处理组的缓慢下降表明这些疫苗逐渐抑制了hbv复制。
48.还评估了仅nc、hbc/s-alum、hbc-nc、20μg/剂hbc/s-nc或10μg/剂hbc/s-nc接种后的抗体产生。非处理(nt)组用作对照。图13显示了在接种hbc-nc和hbc/s-nc后第10周的示例性hbsag特异性igg血清水平,与非处理对照(nt)相比。这些结果表明,hbc/s-nc疫苗刺激了高水平的hbsab,而hbc-nc疫苗仅诱导了低水平的抗体产生。
49.基于上述结果,本发明的hbc/s-nc可以引起小鼠血清中hbsag抗体的高水平产生、hbsag的快速消除和hbeag的缓慢降低。这些综合现象是hbsag血清转换的迹象。本发明的hbc/s-nc疫苗可诱导hbsag血清转化的事实表明,本发明的hbc/s-nc疫苗可以克服慢性hbv感染引起的免疫耐受,重新建立宿主免疫,从而实现功能性治愈。基于这些血清学标志物,本发明的hbc/s-nc疫苗接种可以将慢性hbv感染至少挽救为功能性治愈,这由hbsag丧失和血清中无法检测到的hbv dna水平所证明。
50.本发明的实施方式将通过具体实施例和实验细节进一步说明。本领域技术人员将理解,这些实施例仅用于说明并且不旨在限制本发明的范围,因为在不背离本发明范围的情况下其他修改和变化是可能的。实施例1.hbc/s蛋白纯度分析
51.15%丙烯酰胺凝胶用于分离hbc/s抗原和其他杂质。蛋白质分为还原组和非还原组。ags的还原是用2-me或沸腾的dtt完成的。电泳后,凝胶中的蛋白质条带用考马斯蓝染色并用重蒸水染色。2.hbc-nc或hbc/s-nc的制备和表征
52.根据本发明的实施方式,hbv核心抗原纳米复合物(hbc-nc)、hbv表面抗原纳米复合物(hbs-nc)或hbv核心和表面抗原纳米复合物(hbc/s-nc)可以下述方式或任何类似方式制备:形成抗原和γ-聚谷氨酸(γ-pga)的第一溶液,制备含有壳聚糖的第二溶液,然后将第二溶液添加到第一溶液中。可以使用任何合适的γ-pga。例如,在优选实施方式中,γ-pga可以具有约200kda或更小的重均分子量(m.w.)。类似地,可以使用任何合适的壳聚糖。在优选的实施方式中,壳聚糖可具有约10-100kda的重均分子量(m.w.)。此外,壳聚糖可以具有任何程度的脱乙酰化,例如0-100%的脱乙酰化,优选50-100%的脱乙酰化,更优选75-95%的脱乙酰化。可以使用任何合适浓度的抗原、γ-pga和壳聚糖。例如,抗原的浓度可以是2至0.5mg/ml,壳聚糖的浓度可以是20至30mg/ml,而γ-pga的浓度可以是5至20mg/ml。
53.作为一个实施例,第一溶液是用γ-聚谷氨酸(γ-pga;w/v=1%,在重蒸水中;
m.w.范围=约200kda或更小)和预定量的hbcag和/或hbsag制备的。用壳聚糖在1%乙酸中制备第二溶液(w/v=2.5%壳聚糖,m.w.范围=约10-100kda)。将第二溶液(壳聚糖溶液)添加到第一溶液(γ-pga与hbcag和/或hbsag)中以形成纳米复合物(nc)。nc在4℃保存过夜用于稳定性测试。使用malvern zetasizer nano系列(zetasizer nano zs,malvern panalytical ltd.,u.k.)测定尺寸、zeta电位和多分散指数(pdi)。3.小鼠
54.所有动物研究均在特定的无病原体条件下进行。在抗体诱导实验中,22只6至8周龄雄性c57bl/6小鼠,购自“台湾实验动物中心”,分为4组:仅nc(4只小鼠),20μg/剂hbc/s-明矾(6只小鼠)、20μg/剂hbc/s-nc(6只小鼠)和10μg/剂hbc/s-nc(6只小鼠)。在第0天和第14天给小鼠接种这些疫苗。在第0、14、21和28天对小鼠进行血液取样,并每周称重。在第28天处死小鼠后,取出脾脏并称重以评估全身炎症。用elisa测定血清中的hbc/sabs水平。
55.在aav/hbv小鼠模型中,六至八周大的雄性c57bl/6小鼠购自“台湾实验室动物育种和研究中心”。为了在免疫功能正常的小鼠肝脏中建立持久的hbv基因表达,我们使用具有高肝脏转导率的嗜肝aav血清型8载体(aav8)来传递hbvp基因组。这种重组病毒携带1.3拷贝hbv基因组(基因型d),聚合酶上有一个点突变,并包装在aav血清型8(aav8)衣壳中。aav/hbvp-载体产生所有hbv蛋白,但不产生传染性hbv颗粒。小鼠通过尾静脉静脉注射悬浮在100μl盐水中的2x 10
10
aav/hbvp。随后,测量血清hbsag和hbeag水平以确认hbv持续存在的状态。4.用于hbv抗原和特异性抗体检测的酶联免疫吸附试验(elisa)
56.将标准iggl/2a或hbc/s蛋白以适当浓度包被在96孔板上,并在4℃下保持过夜。将小鼠血清连续稀释并添加到每个孔中,室温下孵育2小时。将偶联hrp的抗igg1或抗igg2a抗体加入孔中并在室温下孵育1小时。加入tmb底物产生颜色产物,加入2n hcl终止反应。使用elecsys systems电化学发光试剂盒和cobas分析仪(e601模块,roche diagnostics gmbh)测量小鼠血清中hbsag、hbeag和抗hbs抗体的水平。5.alt和t-bil的血清水平
57.分别使用vitros chemistry products alt载玻片或t-bil载玻片,使用vitros 950化学分析仪(johnson&johnson,rochester,ny)测量血清中的丙氨酸氨基转移酶(alt)活性和总胆红素(t-bil)水平。
58.已经参考具体实施例描述了本发明的实施方式。本领域技术人员将理解这些实施例仅用于说明,并且在不背离本发明范围的情况下其他修改和变化是可能的。因此,本发明的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1