通过NEUROD1介导的星形胶质细胞到神经元转化进行创伤性脑损伤后的脑修复的制作方法
通过neurod1介导的星形胶质细胞到神经元转化进行创伤性脑损伤后的脑修复
1.相关申请的交叉应用
2.本技术要求于2019年11月25日提交的美国临时申请第62/939,978号的优先权,所述美国临时申请以全文引用的方式并入本文中。
3.序列表
4.包含在大小为29,536字节(在中测量)并且于2020年11月24日创建的命名为36pst97652wo_st25.txt的文件中的序列表以电子方式随本技术一起提交并且以全文引用的方式并入。
背景技术:
5.创伤性脑损伤(tbi)是全世界死亡和残疾的主要原因之一。cdc报告称,美国每年约有170万人因tbi需要医疗护理,每年花费超过770亿美元。全世界有5000万人受到tbi的影响,每年的花费为4000亿美元(maas等人,《柳叶刀神经病学(lancet neurol.)》,16(12):987-1048,2017)。
6.tbi会对脑组织造成急性损伤,并且还会导致神经系统的继发性损伤,从而导致慢性身体和/或精神缺陷的后果。tbi导致血脑屏障破坏、小胶质细胞增生、星形胶质细胞增生和神经元变性。成年哺乳动物的脑在损伤之后缺乏再生神经元的能力,并且缺乏能够促进tbi后神经元再生的治疗。持续需要促进tbi后受损脑修复的治疗。
技术实现要素:
7.根据本公开的各方面提供了治疗创伤性脑损伤(tbi)的方法,所述方法包含:通过向受试者的脑的受损区域中的至少一个反应性星形胶质细胞提供外源性神经源性分化因子1(neurod1,在本文中也称为nd1)来将反应性星形胶质细胞转化为功能神经元。根据各方面,所述tbi是闭锁性头部损伤。根据本公开的各方面,由于所述tbi,所述脑的所述受损区域包含非功能神经元和反应性星形胶质细胞。根据本公开的各方面,所述非功能神经元选自由死亡神经元、垂死神经元和其组合组成的组。根据本公开的各方面,存在于所述脑的所述受损区域中的非功能神经元是通过功能mri(fmri)检测的。根据本公开的各方面,所述受试者是人。
8.根据本公开的各方面提供了治疗tbi的方法,所述方法包含:通过向受试者的脑的受损区域中的至少一个反应性星形胶质细胞提供外源性neurod1来将反应性星形胶质细胞转化为功能神经元,其中所述由于tbi,所述脑的所述受损区域包含非功能神经元和反应性星形胶质细胞。根据本公开的各方面,所述受损区域中的非功能神经元和反应性星形胶质细胞的存在的主要原因不是所述受损区域中的出血。根据本公开的各方面,非功能神经元和反应性星形胶质细胞的存在的主要原因不是所述受损区域中的缺血。根据各方面,所述tbi是闭锁性头部损伤。根据本公开的各方面,所述非功能神经元是死亡神经元。根据本公开的各方面,所述非功能神经元是垂死神经元。根据本公开的各方面,存在于所述脑的所述
受损区域中的非功能神经元是通过功能mri(fmri)检测的。根据本公开的各方面,所述受试者是人。
9.根据本公开的各方面,提供所述外源性neurod1包含在所述创伤性脑损伤后约两天到约十天范围内的第一治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
10.根据本公开的各方面,所述创伤性脑损伤引起所述受损区域中一定时间段的星形胶质细胞增生,并且其中提供所述外源性neurod1包含在所述星形胶质细胞增生时间段期间或在所述星形胶质细胞增生时间段后四周内的第一治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
11.根据本公开的各方面,提供所述外源性neurod1包含在所述第一治疗时间之后且在所述星形胶质细胞增生时间段期间或在所述星形胶质细胞增生时间段后四周内的第二治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
12.根据本公开的各方面,提供所述外源性neurod1包含在所述第二治疗时间之后且在所述星形胶质细胞增生时间段期间或在所述星形胶质细胞增生时间段后四周内的第三治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
13.根据本公开的各方面,提供所述外源性neurod1包含向所述受试者施用重组表达载体,其中所述重组表达载体包含编码neurod1的核酸序列。
14.根据本公开的各方面,提供所述外源性neurod1包含向所述受试者施用重组表达载体,其中所述重组表达载体是包含编码neurod1的核酸序列的病毒表达载体。
15.根据本公开的各方面,提供所述外源性neurod1包含向所述受试者施用重组表达载体,其中所述重组表达载体是重组腺相关病毒表达载体,并且其中所述重组腺相关病毒载体包含编码neurod1的核酸序列。
16.根据本公开的各方面,所述编码neurod1的核酸序列与启动子可操作地连接。
17.根据本公开的各方面,所述启动子是胶质细胞特异性启动子。
18.根据本公开的各方面,所述胶质细胞特异性启动子是胶质纤维酸性蛋白(gfap)启动子。
19.根据本公开的各方面,所述gfap启动子是人gfap(hgfp)启动子。
20.根据本公开的各方面,除neurod1外,没有向所述至少一个反应性星形胶质细胞提供外源性转录因子。
21.根据本公开的各方面,所述neurod1包含选自由以下组成的组的氨基酸序列:seq id no:2、seq id no:4、seq id no:2的功能片段、seq id no:4的功能片段、与seq id no:2具有至少85%同一性的氨基酸序列以及与seq id no:4具有至少85%同一性的氨基酸序列。
22.根据本公开的各方面,所述neurod1由包含seq id no:1的核酸序列、与seq id no:1具有至少85%同一性的核酸序列、包含seq id no:3的核酸序列或者与seq id no:3具有至少85%同一性的核酸序列编码。
23.根据本公开的各方面,提供所述外源性neurod1包含注射到所述脑的所述受损区域中。
24.根据本公开的各方面,所述编码neurod1的核酸序列存在于病毒颗粒中。
25.根据本公开的各方面,提供所述外源性neurod1包含向所述受试者的所述受损脑区域施用约107到约10
14
个病毒颗粒。
26.提供了一种包含neurod1的组合物在制造药物中的用途,所述药物用于在受试者的脑的受损区域中将反应性星形胶质细胞转化为功能神经元,其中由于tbi,所述脑的所述受损区域包含非功能神经元和反应性星形胶质细胞。根据本公开的各方面,所述非功能神经元是死亡神经元。根据本公开的各方面,所述非功能神经元是垂死神经元。根据本公开的各方面,所述创伤性脑损伤是闭锁性头部损伤。根据本公开的各方面,所述neurod1由包含与seq id no:1具有至少85%同一性的核酸序列的核酸序列编码。根据本公开的各方面,所述编码neurod1的核酸包含与seq id no:3具有至少85%同一性的核酸序列。根据本公开的各方面,所述neurod1包含选自由以下组成的组的氨基酸序列:seq id no:2、seq id no:4、seq id no:2的功能片段、seq id no:4的功能片段、与seq id no:2具有至少85%同一性的氨基酸序列以及与seq id no:4具有至少85%同一性的氨基酸序列。
27.根据本公开的各方面,所述neurod1由包含在重组表达载体中的核酸序列编码。根据本公开的各方面,所述编码neurod1的核酸序列与启动子可操作地连接。根据本公开的各方面,所述启动子是胶质细胞特异性启动子。根据本公开的各方面,所述胶质细胞特异性启动子是gfap启动子。根据本公开的各方面,所述gfap启动子是hgfp启动子。根据本公开的各方面,所述neurod1由包含在病毒表达载体中的核酸序列编码。根据本公开的各方面,所述neurod1由包含在重组腺相关病毒表达载体中的核酸序列编码。
附图说明
28.图1a示出了建立局灶性闭锁性头部损伤模型以用于研究创伤性脑损伤治疗的各方面;所述模型包含使用电磁铁控制装置来诱导以图解方式示出于小鼠头部上的运动皮层的局灶性闭锁性头部损伤;
29.图1b是损伤诱导和病理学研究的时间线的示意图;
30.图1c是一组示出神经元标志物(neun)和星形胶质细胞标志物(gfap)的免疫染色结果的图像,所述结果反映了在创伤性脑损伤后的所指示时间点的来自假创伤性脑损伤小鼠(假tbi组)的小鼠脑中或来自创伤性脑损伤小鼠(tbi组)的小鼠脑中的存活神经元和反应性星形胶质细胞的细胞密度;
31.图1d是示出损伤核心中neun密度显著降低的图;
32.图1e是示出损伤周围区域中neun密度显著降低的图;
33.图1f是示出整个损伤区域中反应性星形胶质细胞密度显著增加的图;
34.图1g是一组示出在创伤性脑损伤后的所指示时间点的来自假创伤性脑损伤小鼠(假tbi组)的小鼠脑中或来自创伤性脑损伤小鼠(tbi组)的小鼠脑中的小胶质细胞标志物(iba1)、星形胶质细胞标志物(gfap)和细胞增殖标志物(ki67)的共免疫染色结果的图像,所述结果示出了tbi后的这些早期时间点的神经炎症过程;
35.图1h是示出小胶质细胞的增殖率在大约tbi后第1天达到峰值并且星形胶质细胞的增殖率大约在tbi后第4天达到峰值的图;
36.图2a展示了chi模型中小鼠运动皮层的损伤核心和损伤周围区域的定义;
37.图2b是一组示出chi后第6小时和第4天的早期时间点的受损脑组织的免疫染色结
果的图像。免疫染色结果示出了细胞凋亡标志物tunel与神经元标志物neun共定位,这表明有许多神经元死亡和丢失,尤其是在受损运动皮层的浅层;
38.图2c是一组示出chi后第7天的受损脑组织的髓鞘碱性蛋白(mbp)和神经丝蛋白(nf200)的免疫染色结果的图像。免疫染色结果显示,chi后损伤部位处的神经元突起受损;
39.图3a示出了小鼠运动皮层中闭锁性头部损伤,以及chi后在冲击部位处或附近施用nd1的示意图。
40.图3b图解地示出了本文实例中详细描述的chi诱导、neurod1编码病毒注射和免疫荧光实验的实验方案;
41.图3c是一组示出了在注射aav-gfap::gfp病毒(对照组,左图)或注射aav-gfap::nd1-gfp病毒(nd1组,右图)后第7天的损伤的皮层的代表性图像;
42.图3d是一组示出所指示标志物的gfp荧光和免疫荧光的图像;如所示出的,在gfap启动子控制下,gfp主要在gfap+星形胶质细胞中表达,而对照组在aav-gfap::gfp病毒注射后第7天在其它不同亚型的皮层细胞中的gfp表达非常低;
43.图3e是一组来自图2c的“放大”图像,所述图像展示了与对照组(上图)相比,在aav-gfap::nd1-gfp病毒注射后第7天,neurod1在nd1组中的gfp+星形胶质细胞中高度表达(下图);
44.图3f是一组示出gfap、neun和nd1的共染色结果的图像,所述结果示出了在aav-gfap::nd1-gfp病毒注射后的不同时间点的星形胶质细胞到神经元转化的过程;
45.图3g是示出图3d中所示出的总表达gfp的皮层细胞中不同类型的百分比的量化的图;
46.图3h是示出在aav-gfap::nd1-gfp病毒注射后的不同时间点的表达神经元标志物neun与gfp的细胞的百分比量化的图;
47.图4a是一组来自chi后第4天的受损脑的图像,所述图像展示了一些gfp+细胞同时示出gfap和neun信号两者,这指示所述细胞处于从反应性星形胶质细胞到神经元的过渡阶段;
48.图4b是一组示出在经转化的神经元中,未成熟的神经元标志物(tuj1)和成熟的神经元标志物(map2)的变化趋势暗示着经转化的神经元逐渐成熟的图像;
49.图4c是一组示出gfp荧光、neun免疫荧光和gfap免疫荧光并且示出使用(逆转录病毒)cag::nd1-gfp或(逆转录病毒)cag::gfp表达构建体证实了由neurod1引起的“星形胶质细胞到神经元”(atn)转化的图像。
50.图4d是示出使用(逆转录病毒)cag::nd1-gfp或(逆转录病毒)cag::gfp表达构建体证实了由neurod1引起的“星形胶质细胞到神经元”(atn)转化并且携带nd1的逆转录病毒将约一半的表达gfp的细胞转化为neun+,而对照组中没有星形胶质细胞转化为神经元的图;
51.图5a是一组示出大多数经转化的神经元示出foxg1信号,并且许多经转化的神经元示出tbr1信号的图像;
52.图5b是示出在nd1处理后,用浅层皮层标志物(cux1)和深层标志物(ctip2)进行的免疫染色表明皮层仍然组织良好的图像。
53.图5c是一组示出在小鼠皮层的浅层或深层中一些经转化的神经元为cux1+或
ctip2+的图像;
54.图5d是示出在gfap::nd1-gfp病毒注射后第28天,表达皮层标志物foxg1和/或tbr1或层标志物cux1和/或ctip2与gfp和neun的经转化的神经元的百分比量化结果的图;
55.图6a是一组示出在nd1处理后第28天,一些经转化的神经元在胞体内具有gaba和gad67信号两者,指示所述经转化的神经元是gaba能神经元的图像;
56.图6b是一组示出一些经转化的神经元可以对小鼠皮层中不同的gaba能神经元亚型的标志物,如小清蛋白(pavabulmin)、钙网膜蛋白(calretinin)、神经肽y、生长抑素呈阳性的图像;
57.图6c是示出在aav-gfap::nd1-gfp病毒注射后第28天的表达神经元亚型标志物的细胞的百分比量化的图;
58.图7a是一组示出在a、b和c处经转化的神经元的形态以及gfp荧光和neun免疫荧光的图像;
59.图7b是通过全细胞膜片记录获得的表示三种不同的动作电位发放模式i、ii和iii的一组三个动作电位发放模式迹线;
60.图7c是示出具有动作电位发放模式i、ii或iii的经转化的神经元的量化结果的饼图;
61.图7d是示出经转化的神经元发放的sepsc的迹线,所述sepsc的频率和振幅高于来自野生型对照的频率和振幅;
62.图7e是示出经转化的神经元发放的sipsc的迹线,所述sipsc的频率和振幅高于来自野生型对照的频率和振幅;
63.图7f是一组示出经转化的神经元发放的sepsc的频率和振幅高于来自野生型对照的频率和振幅的图;
64.图7g是一组示出经转化的神经元发放的sipsc的频率和振幅高于来自野生型对照的频率和振幅的图;
65.图8a是展现sepsc的频率在早期时间点显示出上升趋势并且然后在后期时间点下降至对照水平的图;
66.图8b是展现sepsc的振幅在neurod1施用后第一周后显著增加,然后在两个月后下降到对照水平的图;
67.图8c是示出实验方案的图,所述实验方案用于示出在neurod1施用后的早期时间点(第7天)的经转化的神经元上的神经支配;
68.图8d是一组展示在对侧注射neurod1病毒和注射ctb-647后第7天在经转化的神经元的胞体中突触标志物(vgat)与gfp和neun的共定位的图像;在胞体上也观察到来自对侧的ctb信号;
69.图8e是一组展示在对侧注射neurod1病毒和注射ctb-647后第7天在经转化的神经元的胞体中突触小泡标志物(sv2)与gfp和neun的共定位的图像;在胞体上也观察到来自对侧的ctb信号;
70.图9a是一组示出谷氨酸能突触标志物(vglut1)或gaba能突触标志物(vgat)与gpf在经nd1转化的神经元的胞体上共定位的图像;
71.图9b是一组示出突触末梢标志物(突触素,sp1)或突触小泡标志物(sv2)与gpf在
经nd1转化的神经元的细胞边界周围共定位的图像;
72.图9c是一组示出经nd1转化的神经元表现出与小鼠运动皮层中的内源性神经元相当的cfos表达的图像;
73.图9d-9f示出了在neurod1组中,丘脑神经元被(aav)突触蛋白::cre+cag::flex mcherry标记以用于顺行追踪;
74.图9d是展示为了在表达nd1-gfp的病毒所施用于的小鼠中进行顺行追踪,将病毒aav-突触蛋白::cre+aav-cag::flexmcherry(其表达红色荧光蛋白mcherry)进一步注射到小鼠丘脑中,由此标记神经元以将其轴突投射到表达gfp的经nd1转化的神经元上可视化的图像;
75.图9e是一组示出经nd1转化的神经元的图像,所述经nd1转化的神经元在胞体上具有含gfp的突触扣结,从而展示了来自其它经转化的神经元的局部神经支配;
76.图9f是一组示出经nd1转化的神经元的图像,所述经nd1转化的神经元在胞体上具有含mcherry的突触扣结,从而展示了来自远程丘脑神经元的神经支配;
77.图9g是一组图像,所述图像示出了注射ctb-467以在对侧到表达neurod1的病毒注射部位中进行逆行追踪,并且在一些经转化的神经元中发现了ctb信号;并且
78.图9h是一组示出随着转化过程的进行,在注射表达neurod1的病毒后,经转化的神经元内的平均ctb信号随着时间的推移而增加的图;对于所有所指示时间点,在采集脑样品前7天注射ctb。
具体实施方式
79.本文所使用的科学和技术术语旨在具有本领域的普通技术人员通常理解的含义。发现在各种标准参考文献的上下文中定义并使用此类术语,这些参考文献说明性地包含以下:j.sambrook和d.w.russell,《分子克隆:实验室手册(molecular cloning:a laboratorymanual)》,冷泉港实验室出版社(cold spring harbor laboratory press);第3版,2001;f.m.ausubel编辑,《精编分子生物学实验指南(short protocols in molecular biology)》,《实验室指南(current protocols)》;第5版,2002;b.alberts等人,《细胞分子生物学(molecular biology ofthe cell)》,第4版,加兰科学出版社(garland),2002;d.l.nelson和m.m.cox,《lehninger生物化学原理(lehninger principles ofbiochemistry)》,第4版,w.h.弗里曼公司(w.h.freeman&company),2004;herdewijn,p.(编辑),《寡核苷酸合成:方法与应用——分子生物学方法(oligonucleotide synthesis:methods and applications,methods in molecular biology)》,胡马纳出版社(humana press),2004;《雷明顿:药学科学与实践(remington:the science and practice ofpharmacy)》,利平科特
·
威廉斯
·
威尔金斯出版公司(lippincott williams&wilkins),第21版,2005;l.v.allen,jr.等人,《安塞尔的药物剂型和药物递送系统(ansel’s pharmaceutical dosage forms and drug delivery systems)》,第8版,宾夕法尼亚州费城:利平科特
·
威廉斯和威尔金斯出版公司(philadelphia,pa:lippincott,williams&wilkins),2004;以及l.brunton等人,《古德曼和吉尔曼的治疗学的药理学基础(goodman&gilman's the pharmacological basis oftherapeutics)》,麦格劳-希尔专业出版公司(mcgraw-hill professional),第12版,2011。
80.单数术语“一个(a)”、“一种(an)”和“所述(the)”不旨在是限制性的,并且包含复数指示物,除非另外明确地陈述或上下文另外清楚地指示。
81.当呈现一组替代方案时,具体地设想了构成所述组替代方案的成员的任何和所有组合。例如,如果项选自由a、b、c和d组成的组,则单独地设想每个替代方案(例如,单独的a、单独的b等)以及如a、b和d;a和c;b和c;等组合。当用于两个或更多个项的列表中时,术语“和/或”意指所列项中的任何一项自身或与其它所列项中的任何一项或多项的组合。例如,表达“a和/或b”旨在意指a和b中的一个或两者,即单独的a、单独的b或a和b的组合。表达“a、b和/或c”旨在意指单独的a、单独的b、单独的c、a和b的组合、a和c的组合、b和c的组合、或a、b和c的组合。
82.当本文中提供数字范围时,所述范围应被理解为包含所述范围的边缘以及所述范围的限定边缘之间的任何数字。例如,“1与10之间”包含1与10之间的任何数字以及数字1和数字10。
83.当术语“约”用于参考数字时,应当理解意指增减10%。例如,“约100”将包含90到110。
84.根据本公开的各方面提供了用于治疗受试者的创伤性脑损伤(tbi)的组合物和方法。
85.根据本公开的各方面提供了有效逆转由tbi导致的神经元损失的方法。出乎意料地,外源性神经源性分化因子1(neurod1)在胶质细胞,特别是在星形胶质细胞和/或反应性星形胶质细胞中的表达治疗有需要的受试者的tbi。因此,本公开提供了治疗受试者的tbi的方法,包含向受试者施用治疗有效量的neurod1。
86.根据本公开的各方面提供了治疗创伤性脑损伤(tbi)的方法,所述方法包含通过向受试者的脑的受损区域中的至少一个反应性星形胶质细胞提供外源性neurod1来将反应性星形胶质细胞转化为功能神经元。
87.术语“neurod1”是指涉及胚胎脑发育和成人神经发生的bhlh原神经转录因子,即神经源性分化因子1,参见cho,j.h.等人,《分子神经生物学(mol,neurobiol.)》,30:35-47,2004;kuwabara,t.等人,《自然神经科学(nature neurosci.)》,12:1097-1105,2009;以及gao,z.等人,《自然神经科学》,12:1090-1092,2009。neurod1在发育后期表达,主要在神经系统中表达,并且参与神经元分化、成熟和存活。
88.本文所使用的术语“外源性”是指neurod1,是指存在于待通过本公开的方法的操作而转化为功能神经元的胶质细胞,特别是星形胶质细胞和/或反应性星形胶质细胞中并且不天然存在于胶质细胞中的neurod1。
89.如本文所使用的,关于神经元的术语“功能”是指表现出和/或保持执行神经元特别适合或存在以执行的动作和/或任务的能力的神经元。
90.如本文所使用的术语“治疗(treat)”、“治疗(treatment)”、“治疗(treating)”和“neurod1治疗”或语法等效物是指减轻、抑制或改善tbi、tbi的症状或体征以及预防tbi的症状或体征并且包含但不限于治疗性和/或预防性治疗。
91.如本文所使用的术语“治疗有效量”旨在意指有效减轻、改善或预防待治疗的tbi的症状或体征的本发明的组合物的量。根据本公开的各方面,治疗有效量是对具有tbi的体征和/或症状的受试者具有有益效果的量。根据本公开的各方面,向受tbi影响的受试者施
用治疗有效量的neurod1提供了:通过将反应性星形胶质细胞转化为功能神经元来产生新的功能神经元;反应性星形胶质细胞的数量的减少;新的非反应性星形胶质细胞的产生;以及将新的功能神经元整合到受试者的脑的损伤区域和未损伤区域的神经元网络中。
92.术语“创伤性脑损伤”在本文中缩写为“tbi”,是指脑的突然损伤,其可以是由于头部冲击导致的闭锁性头部损伤(chi),或者是穿透性头部损伤。穿透性头部损伤的非限制性实例是物体刺穿颅骨并进入脑。根据本公开的各方面,tbi是chi。根据本公开的各方面,tbi是穿透性头部损伤。tbi可能是由于因各种来源,如但不限于跌倒、车祸、运动事故、被物体撞击或如爆炸产生的冲击波等间接冲击等对头部的直接冲击引起的。爆炸的非限制性实例是战场爆炸。根据本公开的各方面,tbi是由跌倒引起的。根据本公开的各方面,tbi是由车祸引起的。根据本公开的各方面,tbi是由运动事故引起的。根据本公开的各方面,tbi是由被物体撞击引起的。根据本公开的各方面,tbi是由如爆炸产生的冲击波等间接冲击引起的。
93.根据本公开的一方面,tbi的非限制性实例是由对受试者头部的冲击引起的脑损伤,所述损伤通过另外的功能神经元减轻、改善或预防。
94.术语“闭锁性头部损伤”在本文中缩写为“chi”,是指由于受试者头部的非穿透性损伤或未骨折和/或损害颅骨完整性的头部损伤引起的tbi。
95.根据本公开的各方面,tbi是“局灶性”的,使得对脑的原发性损伤定位于脑的与冲击部位相邻的区域。脑的继发性损伤可能存在于脑的由原发性损伤引起的其它区域。
96.术语“原发性损伤”是指在邻近冲击部位的区域中存在如死亡和/或垂死神经元等非功能神经元以及反应性星形胶质细胞,其中受损区域中存在如死亡和/或垂死神经元等非功能神经元以及反应性星形胶质细胞的主要原因不是受损区域中的出血和/或缺血。根据本公开的各方面,死亡或垂死神经元通过细胞凋亡测定和功能测定来测量。细胞凋亡测定的非限制性实例包含电子显微镜检查、tunel测定、流式细胞术、dna阶梯测定、细胞色素c的检测、膜联蛋白v的检测和胱天蛋白酶活性测定。功能测定的非限制性实例包含功能磁共振成像(fmri)。根据本公开的各方面,tbi可以由两个或更多个冲击引起,并且所述两个或更多个冲击中的每个冲击与冲击部位相关联,使得脑的原发性损伤与两个或更多个冲击部位中的每个冲击部位相关联。
97.胶质细胞中治疗有效量的neurod1治疗受试者的tbi的至少一种体征和/或症状,由此治疗tbi。
98.tbi的体征和症状连同检测和评估此类体征和症状的方法是本领域熟知的。受试者的tbi的体征和症状包含意识丧失、意识模糊、定向障碍、头痛、疲劳、语音障碍、睡眠问题、头晕、平衡问题、感觉问题、对光敏感、失明或视力改变、嗅觉丧失或改变、味觉丧失或改变、耳鸣、听觉丧失或改变、记忆问题、注意力不集中、抑郁、焦虑、躁动、情绪波动、癫痫发作、协调性丧失或减弱、运动问题,认知问题,包含学习困难、推理能力的负面变化、判断力的负面变化以及注意力或专注度的负面变化。
99.受试者tbi的体征和/或症状包含在由于tbi而受损脑区域中存在非功能神经元,如死亡和/或垂死神经元。通过根据本公开的各方面的治疗有需要的受试者的tbi的方法减少由于tbi而受损脑区域中死亡和/或垂死神经元的数量,所述方法包含向受试者的胶质细胞递送治疗有效量的neurod1。
100.受试者tbi的体征和/或症状包含在由于tbi而受损脑区域中存在反应性星形胶质细胞。通过根据本公开的各方面的治疗有需要的受试者的tbi的方法减少由于tbi而受损脑区域中反应性星形胶质细胞的数量,所述方法包含向受试者的胶质细胞递送治疗有效量的neurod1。
101.与未经治疗的具有tbi的受试者相比,胶质细胞中治疗有效量的neurod1在具有tbi的受试者中产生更多数量的功能神经元,从而治疗tbi。根据本公开的各方面,与未经治疗的具有tbi的受试者相比,胶质细胞中治疗有效量的neurod1在受tbi影响的受试者的脑区域中产生更多数量的功能神经元,从而治疗tbi。
102.需要治疗的受试者可以是人或非人哺乳动物,但也可以是非哺乳动物。因此,术语“受试者”是指人并且还是指非人哺乳动物,如但不限于非人灵长类动物、猫、狗、绵羊、山羊、马、牛、猪和啮齿动物,如但不限于小鼠和大鼠;以及非哺乳动物,如但不限于鸟类、家禽、爬行动物、两栖动物。根据本公开的各方面,所述受试者是人。
103.根据本公开的各方面,所述受试者是男性。根据本公开的各方面,所述受试者是女性。根据本公开的各方面,所述受试者是性别中立的。根据本公开的各方面,所述受试者是早产新生儿。根据本公开的各方面,早产新生儿在妊娠36周之前出生。根据本公开的各方面,所述受试者是足月新生儿。根据本公开的各方面,足月新生儿低于约2个月大。根据本公开的各方面,所述受试者是婴儿。根据本公开的各方面,所述受试者是小于约1个月大的婴儿。根据本公开的各方面,所述受试者是婴幼儿。根据本公开的各方面,婴幼儿的年龄介于2个月与24个月之间。根据本公开的各方面,婴幼儿的年龄介于2个月与3个月之间、介于2个月与4个月之间大、介于2个月与5个月之间、介于3个月与4个月之间、介于3个月与5个月之间、介于3个月与6个月之间、介于4个月与5个月之间、介于4个月与6个月之间、介于4个月与7个月之间、介于5个月与6个月之间、介于5个月与7个月之间、介于5个月与8个月之间、介于6个月与7个月之间、介于6个月与8个月之间、介于6个月与9个月之间、介于7个月与8个月之间、介于7个月与9个月之间、介于7个月与10个月之间、介于8个月与9个月之间、介于8个月与10个月之间、介于8个月与11个月之间、介于9个月与10个月之间、介于9个月与11个月之间、介于9个月与12个月之间、介于10个月与11个月之间、介于10个月与12个月之间、介于10个月与13个月之间、介于11个月与12个月之间、介于11个月与13个月之间、介于11个月与14个月之间、介于12个月与13个月之间、介于12个月与14个月之间、介于12个月与15个月之间、介于13个月与14个月之间、介于13个月与15个月之间、介于13个月与16个月之间、介于14个月与15个月之间、介于14个月与16个月之间、介于14个月与17个月之间、介于15个月与16个月之间、介于15个月与17个月之间、介于15个月与18个月之间、介于16个月与17个月之间、介于16个月与18个月之间、介于16个月与19个月之间、介于17个月与18个月之间、介于17个月与19个月之间、介于17个月与20个月之间、介于18个月与19个月之间、介于18个月与20个月之间、介于18个月与21个月之间、介于19个月与20个月之间、介于19个月与21个月之间、介于19个月与22个月之间、介于20个月与21个月之间、介于20个月与22个月之间、介于20个月与23个月之间、介于21个月与22个月之间、介于21个月与23个月之间、介于21个月与24个月之间、介于22个月与23个月之间、介于22个月与24个月之间、以及介于23个月与24个月之间。根据本公开的各方面,所述受试者是学步的儿童。根据本公开的各方面,学步的儿童的年龄介于1岁与4岁之间。根据本公开的各方面,学步的儿童的年龄介于1岁与2岁之间、
介于1岁与3岁之间、介于1岁与4岁之间、介于2岁与3岁之间、介于2岁与4岁之间以及介于3岁与4岁之间。根据本公开的各方面,所述受试者是幼儿。根据本公开的各方面,幼儿的年龄介于2岁与5岁之间。根据本公开的各方面,幼儿的年龄介于2岁与3岁之间、介于2岁与4岁之间、介于2岁与5岁之间、介于3岁与4岁之间、介于3岁与5岁之间以及介于4岁与5岁之间。根据本公开的各方面,所述受试者是儿童。根据本公开的各方面,儿童的年龄介于6岁与12岁之间。根据本公开的各方面,儿童的年龄介于6岁与7岁之间、介于6岁与8岁之间、介于6岁与9岁之间、介于7岁与8岁之间、介于7岁与9岁之间、介于7岁与10岁之间、介于8岁与9岁之间、介于8岁与10岁之间、介于8岁与11岁之间、介于9岁与10岁之间、介于9岁与11岁之间、介于9岁与12岁之间、介于10岁与11岁之间、介于10岁与12岁之间以及介于11岁与12岁之间。根据本公开的各方面,所述受试者是青少年。根据本公开的各方面,青少年的年龄介于13岁与19岁之间。根据本公开的各方面,青少年的年龄介于13岁与14岁之间、介于13岁与15岁之间、介于13岁与16岁之间、介于14岁与15岁之间、介于14岁与16岁之间、介于14岁与17岁之间、介于15岁与16岁之间、介于15岁与17岁之间、介于15岁与18岁之间、介于16岁与17岁之间、介于16岁与18岁之间、介于16岁与19岁之间、介于17岁与18岁之间、介于17岁与19岁之间以及介于18岁与19岁之间。根据本公开的各方面,所述受试者是小儿受试者。根据本公开的各方面,小儿受试者的年龄介于1天与18岁之间。根据本公开的各方面,小儿受试者的年龄介于1天与1岁之间、介于1天与2岁之间、介于1天与3岁之间、介于1岁与2岁之间、介于1岁与3岁之间、介于1岁与4岁之间、介于2岁与3岁之间、介于2岁与4岁之间、介于2岁与5岁之间、介于3岁与4岁之间、介于3岁与5岁之间、介于3岁与6岁之间、介于4岁与5岁之间、介于4岁与6岁之间、介于4岁与7岁之间、介于5岁与6岁之间、介于5岁与7岁之间、介于5岁与8岁之间、介于6岁与7岁之间、介于6岁与8岁之间、介于6岁与9岁之间、介于7岁与8岁之间、介于7岁与9岁之间、介于7岁与10岁之间、介于8岁与9岁之间、介于8岁与10岁之间、介于8岁与11岁之间、介于9岁与10岁之间、介于9岁与11岁之间、介于9岁与12岁之间、介于10岁与11岁之间、介于10岁与12岁之间、介于10岁与13岁之间、介于11岁与12岁之间、介于11岁与13岁之间、介于11岁与14岁之间、介于12岁与13岁之间、介于12岁与14岁之间、介于12岁与15岁之间、介于13岁与14岁之间、介于13岁与15岁之间、介于13岁与16岁之间、介于14岁与15岁之间、介于14岁与16岁之间、介于14岁与17岁之间、介于15岁与16岁之间、介于15岁与17岁之间、介于15岁与18岁之间、介于16岁与17岁之间、介于16岁与18岁之间以及介于17岁与18岁之间。根据本公开的各方面,所述受试者是老年人受试者。根据本公开的各方面,老年人受试者的年龄介于65岁与95岁或更多岁之间。根据本公开的各方面,老年人受试者的年龄介于65岁与70岁之间、介于65岁与75岁之间、介于65岁与80岁之间、介于70岁与75岁之间、介于70岁与80岁之间、介于70岁与85岁之间、介于75岁与80岁之间、介于75岁与85岁之间、介于75岁与90岁之间、介于80岁与85岁之间、介于80岁与90岁之间、介于80岁与95岁之间、介于85岁与90岁之间以及介于85岁与95岁之间。在一方面,有需要的受试者是成年人。根据本公开的各方面,成年人受试者的年龄介于20岁与95岁或更多岁之间。根据本公开的各方面,成年人受试者的年龄介于20岁与25岁之间、介于20岁与30岁之间、介于20岁与35岁之间、介于25岁与30岁之间、介于25岁与35岁之间、介于25岁与40岁之间、介于30岁与35岁之间、介于30岁与40岁之间、介于30岁与45岁之间、介于35岁与40岁之间、介于35岁与45岁之间、介于35岁与50岁之间、介于40岁与45岁之间、介于40岁与50岁之间、介于40岁与55岁之间、介于
45岁与50岁之间、介于45岁与55岁之间、介于45岁与60岁之间、介于50岁与55岁之间、介于50岁与60岁之间、介于50岁与65岁之间、介于55岁与60岁之间、介于55岁与65岁之间、介于55岁与70岁之间、介于60岁与65岁之间、介于60岁与70岁之间、介于60岁与75岁之间、介于65岁与70岁之间、介于65岁与75岁之间、介于65岁与80岁之间、介于70岁与75岁之间、介于70岁与80岁之间、介于70岁与85岁之间、介于75岁与80岁之间、介于75岁与85岁之间、介于75岁与90岁之间、介于80岁与85岁之间、介于80岁与90岁之间、介于80岁与95岁之间、介于85岁与90岁之间以及介于85岁与95岁之间。根据本公开的各方面,受试者的年龄介于1岁与5岁之间、介于2岁与10岁之间、介于3岁与18岁之间、介于21岁与50岁之间、介于21岁与40岁之间、介于21岁与30岁之间、介于50岁与90岁之间、介于60岁与90岁之间、介于70岁与90岁之间、介于60岁与80岁之间或介于65岁与75岁之间。根据本公开的各方面,受试者是相对年轻的老年受试者(65岁到74岁)。根据本公开的各方面,受试者是中老年受试者(75岁到84岁)。根据本公开的各方面,受试者是老年受试者(》85岁)。
104.根据本公开的各方面,治疗受试者的tbi的方法包含在tbi的局部区域中,在脑损伤部位的位置处或附近,向受试者施用治疗有效量的neurod1。
105.根据本公开的各方面,治疗受试者的tbi的方法包含在tbi的局部区域中,在由tbi引起的胶质瘢痕中或附近,向受试者施用治疗有效量的neurod1。
106.根据本公开的各方面,治疗受试者的tbi的方法包含在tbi的局部区域中,在神经胶质增生,特别是星形胶质细胞增生和/或小胶质细胞增生的区域中或附近,向受试者施用治疗有效量的neurod1。
107.术语“神经胶质增生”包含“星形胶质细胞增生”和“小胶质细胞增生”,并且是指由于脑损伤导致的星形胶质细胞和反应性星形胶质细胞的增加,即星形胶质细胞增生,以及小胶质细胞和肥大性小胶质细胞的增加,即小胶质细胞增生。不受任何科学理论的限制,神经胶质增生被认为是胶质细胞对脑损伤作出应答的保护性反应,从而提供如隔离损伤区域、去除死细胞的碎片以及保护剩余的健康细胞等有益效果。然而,神经胶质增生阻碍神经再生并且对局部微环境产生负面影响,从而导致另外的神经变性。因此,通过在胶质细胞中表达外源性neurod1来将胶质细胞(其中胶质细胞参与神经胶质增生)转化成功能神经元在tbi的治疗中提供了有益的结果。根据本公开的各方面,有益结果的非限制性实例包含:再生功能神经元以替代或至少部分地替代由于tbi而损失的神经元;通过将反应性星形胶质细胞转化为功能神经元而减少反应性星形胶质细胞的数量,由此调节神经胶质增生的负面影响;修复由tbi引起的受损神经网络;以及重新平衡被tbi破坏的微环境。
108.根据本公开的各方面,施用治疗有效量的neurod1改善了tbi在有需要的受试者中的影响。根据本公开的各方面,与静止的星形胶质细胞相比,当施用于反应性星形胶质细胞时,施用治疗有效量的neurod1具有增强的效果。根据本公开的各方面,可以在受试者发生tbi后的3天到60天之间、5天到45天之间、8天到30天之间施用治疗有效量的neurod1。根据本公开的各方面,施用可以是在受试者发生tbi后的2天到1年或更晚进行。根据本公开的各方面,治疗有效量的neurod1的施用可以是介于3天与5天之间、介于3天到10天之间、介于3天与15天之间、介于5天与10天之间、介于5天与15天之间、介于5天与20天之间、介于10天与15天之间、介于10天与20天之间、介于10天与25天之间、介于15天与20天之间、介于15天与25天之间、介于15天与30天之间、介于20天与25天之间、介于20天与30天之间、介于20天与
35天之间、介于25天与30天之间、介于25天与35天之间、介于25天与40天之间、介于30天与35天之间、介于30天与40天之间、介于30天与45天之间、介于35天与40天之间、介于35天与45天之间、介于35天与50天之间、介于40天与45天之间、介于在40天与50天之间、介于40天与55天之间、介于45天与50天之间、介于45天与55天之间、介于45天与60天之间、介于50天与55天之间、介于50天与60天之间或者介于55天与60天之间。根据本公开的各方面,治疗有效量的neurod1的施用可以是介于5天与10天之间、介于5天与15天之间、介于5天与20天之间、介于10天与15天之间、介于10天与20天之间、介于10天与25天之间、介于15天与20天之间、介于15天与25天之间、介于15天与30天之间、介于20天与25天之间、介于20天与30天之间、介于20天与35天之间、介于25天与30天之间、介于25天与35天之间、介于25天与40天之间、介于30天与35天之间、介于30天与40天之间、介于30天与45天之间、介于35天与40天之间、介于35天与45天之间或者介于40天与45天之间。根据本公开的各方面,治疗有效量的neurod1的施用可以是介于8天与10天之间、介于8天与15天之间、介于8天与20天之间、介于10天与15天之间、介于10天与20天之间、介于10天与25天之间、介于15天与20天之间、介于15天与25天之间、介于15天与30天之间、介于20天与25天之间、介于20天与30天之间或者介于25天与30天之间。
109.根据本公开的各方面,提供外源性neurod1包含在tbi后约1天到约10天范围内的第一治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,外源性neurod1在介于1天与2天之间、介于1天与3天之间、介于1天与4天之间、介于2天与3天之间、介于2天与4天之间、介于2天与5天之间、介于3天与4天之间、介于3天与5天之间、介于3天与6天之间、介于4天与5天之间、介于4天与6天之间、介于4天与7天之间、介于5天与6天之间、介于5天与7天之间、介于5天与8天之间、介于6天与7天之间、介于6天与8天之间、介于6天与9天之间、介于7天与8天之间、介于7天与9天之间、介于7天与10天之间、介于8天与9天之间、介于8天与10天之间或者介于9天与10天之间提供给至少一个反应性星形胶质细胞。根据本公开的各方面,在tbi后1天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后2天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后3天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后4天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后5天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后6天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后7天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后8天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后9天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在tbi后10天的治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。
110.根据本公开的各方面,tbi引起受损区域中一定时间段的星形胶质细胞增生,并且提供外源性neurod1包含在星形胶质细胞增生时间段期间或在星形胶质细胞增生时间段后4周内的第一治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在第一治疗时间之后且在星形胶质细胞增生时间段期间或在星形胶质细胞增生时
间段后4周内的第二治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。根据本公开的各方面,在第二治疗时间之后且在星形胶质细胞增生时间段期间或在星形胶质细胞增生时间段后4周内的第三治疗时间向至少一个反应性星形胶质细胞提供外源性neurod1。任选地提供多于三次治疗,如在第三次治疗之后的第四治疗时间进行第四次治疗,在第四次治疗之后的第五治疗时间进行第五次治疗,以此类推,涉及第六次、第七次、第八次、第九次和第十次或更多次治疗,所述治疗包含在星形胶质细胞增生时间段期间或在星形胶质细胞增生时间段后4周内施用外源性neurod1。
111.根据本公开的各方面施用治疗受试者的tbi的疗法的组合。
112.根据特定方面,向受试者施用以治疗有需要的个体受试者的tbi的另外的药剂或治疗性治疗包含如但不限于以下等治疗:修复颅骨骨折、去除血凝块、减轻颅骨内的压力、一种或多种抗炎剂的施用、一种或多种抗焦虑剂的施用、以及一种或多种抗凝血剂的施用、一种或多种抗惊厥剂的施用、一种或多种抗抑郁剂的施用、一种或多种肌肉松弛剂的施用、物理疗法、言语疗法和认知疗法。
113.根据本公开的各方面,向通过体检诊断和/或评估具有tbi的受试者施用neurod1治疗。如本文所使用的,术语“体检”是指对受试者进行的有效诊断或评估受试者的假定tbi的任何检查,包含神经学检查和身体检查。
114.根据本公开的各方面,体检包含成像技术和/或电生理学技术,并且向如通过成像技术和/或电生理学技术诊断和/或评估具有tbi的受试者施用neurod1治疗。
115.如脑电描记法(eeg)等电生理学技术可以用于评估tbi导致的神经元细胞死亡或损伤引起的神经发放的功能变化。
116.如磁共振成像(mri)、fmri、近红外光谱、正电子发射断层摄影术(pet)扫描、计算机轴向断层摄影术(cat)扫描和超声等成像技术可以用于评估tbi导致的神经元细胞死亡或损伤引起的结构和/或功能变化。
117.根据本公开的各方面,tbi导致的非功能神经元的存在通过如fmri等功能测定来检测。
118.术语“fmri”是指功能磁共振成像,一种通过检测血流相关变化来检测和测量脑活动的成像程序。
119.体检的方法可以单独地使用或以任何组合使用,以诊断和/或评估受试者的tbi。
120.此外,体检的方法可以单独地使用或以任何组合使用,以评估受试者的tbi的neurod1治疗的功效。
121.根据本公开的各方面,在治疗期间或之后监测受试者的neurod1治疗,从而监测治疗的进展和/或最终结果。通过恢复或接近恢复正常的电生理学、脑组织结构和神经元功能来诊断治疗后测定的成功的功能神经元整合和组织微环境的恢复。用于测定神经元功能的非侵入性方法包含eeg。神经元功能可以通过近红外光谱和fmri来非侵入性地测定。
122.用于测定脑组织结构的非侵入性方法包含mri、cat扫描、pet扫描或超声。
123.行为测定可以用于非侵入性地测定tbi后脑功能的恢复。行为测定应当与由tbi引起的功能丧失相匹配。例如,如果tbi引起瘫痪,则应当测试患者的移动性和肢体灵活性。如果tbi引起语言丧失或变慢,则应当测定患者通过口头语言进行交流的能力。neurod1治疗后的正常行为的恢复指示有效神经元回路的成功产生和整合。这些方法可以单独地使用或
以任何组合使用,以测定神经元功能和脑组织健康。用于评估用neurod1治疗的测定可以在neurod1治疗后的任何时间点进行,如1天、2天、3天、一周、2周、3周、一个月或更晚。此类测定可以在neurod1治疗之前进行,以便在需要时建立基线比较。
124.在根据本公开的特定方面,在受试者未经治疗的情况下将形成胶质瘢痕或者已经存在胶质瘢痕的损伤部位的外围处施用neurod1。可以通过测定组织结构或功能来确定胶质瘢痕的位置。如上所述,用于测定由tbi引起的结构和/或功能变化的非侵入性方法包含mri、fmri、cat扫描或超声。功能测定可以包含eeg记录和/或fmri。
125.在根据本公开的特定方面,neurod1以含有编码neurod1的核酸序列的表达载体的形式施用。根据本公开的各方面,含有编码neurod1的核酸序列的表达载体通过注射递送到受试者的脑中。根据本公开的各方面,含有编码neurod1的核酸序列的表达载体通过立体定向注射递送到受试者的脑中。
126.根据本公开的各方面,包含编码neurod1的核酸的病毒载体通过注射递送到受试者的中枢或外周神经组织中。根据本公开的各方面,注射到中枢或外周神经组织中选自由以下组成的组:脑内注射、脊髓注射、注射到脑脊液中和注射到外周神经节中。可替代的病毒递送方法包含但不限于静脉内注射、鼻内输注、肌肉内注射、鞘内注射和腹膜内注射。
127.根据本公开的各方面,包含编码neurod1的核酸的病毒载体通过注射递送到受试者的脑中。根据本公开的各方面,包含编码neurod1的核酸的病毒载体通过立体定向注射递送到受试者的脑中。
128.根据本公开的各方面提供了用于治疗有需要的受试者的神经病状的方法和组合物,其包含:提供包括编码neurod1的核酸的病毒载体;以及将病毒载体递送到受试者的脑中,由此病毒载体感染脑的胶质细胞,从而产生受感染的胶质细胞,并且由此外源性neurod1在受感染的胶质细胞中以治疗有效水平表达,其中与未经治疗的具有tbi的受试者相比,neurod1在受感染的细胞的表达使得具有tbi的受试者的功能神经元数量更多,由此治疗tbi。除了产生新的功能神经元之外,还使反应性胶质细胞的数量减少,从而使得所释放的神经抑制因子更少、神经炎症更少、还均匀分布的血管更多,由此使局部环境更允许神经元生长或轴突渗透,因此减轻tbi的至少一种体征和/或症状。
129.腺相关病毒(aav)载体在根据本公开的各方面的方法中特别有用,并且将在注射部位处感染分裂和非分裂细胞。aav是细小病毒科家族的ssdna动物病毒的普遍存在的、非细胞病变的、无复制能力的成员。如本文所使用的,“aav载体”是指与dna载体构建体一起包装的aav。根据本公开的各方面,aav载体选自由以下组成的组:aav载体血清型1、aav载体血清型2、aav载体血清型3、aav载体血清型4、aav载体血清型5、aav载体血清型6、aav载体血清型7、aav载体血清型8、aav载体血清型9、aav载体血清型10、aav载体血清型11和aav载体血清型12。根据本公开的各方面,aav载体选自由aav血清型2、aav血清型5和aav血清型9组成的组。根据本公开的各方面,aav载体是aav血清型1。根据本公开的各方面,aav载体是aav血清型2。根据本公开的各方面,aav载体是aav血清型3。根据本公开的各方面,aav载体是aav血清型4。根据本公开的各方面,aav载体是aav血清型5。在一方面,根据本公开的各方面,aav载体是aav血清型6。根据本公开的各方面,aav载体是aav血清型7。根据本公开的各方面,aav载体是aav血清型8。根据本公开的各方面,aav载体是aav血清型9。根据本公开的各方面,aav载体是aav血清型10。根据本公开的各方面,aav载体是aav血清型11。根据本公开
的各方面,aav载体是aav血清型12。
130.根据本公开的各方面,“flex”转换方法用于在受感染细胞中表达neurod1。术语“flex”和“翻转切除(flip-excision)”可互换地使用,以指示将两对异型的反平行loxp型重组位点安置在反向neurod1编码序列的任一侧的方法,所述反向neurod1编码序列首先经历编码序列的反向,随后切除两个位点,从而导致每个正交重组位点之一相反地定向并且不能进一步重组,从而实现稳定的反向,参见例如schnutgen等人,《自然生物技术(nature biotechnology)》21:562-565,2003;以及atasoy等人,《神经科学杂志(j.neurosci.)》,28:7025-7030,2008。由于在胶质细胞特异性启动子控制下的位点特异性重组酶将在包含反应性星形胶质细胞在内的胶质细胞中强烈表达,因此neurod1也将在包含反应性星形胶质细胞在内的胶质细胞中表达。然后,当从重组中去除neurod1前面的终止密码子时,组成型或神经元特异性启动子将驱动neurod1的高表达,从而使反应性星形胶质细胞转化成功能神经元。
131.根据本公开的特定方面,通过施用以下向有需要的受试者施用neurod1:1)包含在如gfap或s100b或aldh1l1等星形胶质细胞特异性启动子的转录控制下编码位点特异性重组酶的dna序列在内的腺相关病毒表达载体;以及2)包含在普遍存在的(组成型)启动子或神经元特异性启动子的转录控制下编码neurod1的dna序列在内的腺相关病毒表达载体,其中编码neurod1的dna序列被反向并对于neurod1表达处于错误的定向,直到位点特异性重组酶使编码neurod1的反向dna序列反向,从而允许neurod1的表达。
132.位点特异性重组酶及其识别位点包含例如cre重组酶连同识别位点loxp和lox2272位点或flp-frt重组或其组合。
133.如本文所使用的,术语“aav颗粒”是指将其核酸基因组传递到细胞的aav病毒的包装衣壳形式。
134.为了实现最佳感染,以0.1-5.0微升/分钟的受控流速注射浓度为10
10-10
14
个aav颗粒/ml、体积为1-1000μl的aav颗粒。根据本公开的各方面,注射的浓度介于10
10
个aav颗粒/ml与10
11
个aav颗粒/ml之间、介于10
10
个aav颗粒/ml与10
12
个aav颗粒/ml之间、介于10
10
个aav颗粒/ml与10
13
个aav颗粒/ml之间、介于10
11
个aav颗粒/ml与10
12
个aav颗粒/ml之间、介于10
11
个aav颗粒/ml与10
13
个aav颗粒/ml之间、介于10
11
个aav颗粒/ml与10
14
个aav颗粒/ml之间、介于10
12
个aav颗粒/ml与10
13
个aav颗粒/ml、介于10
12
个aav颗粒/ml与10
14
个aav颗粒/ml之间、或者介于10
13
个aav颗粒/ml与10
14
个aav颗粒/ml之间。根据本公开的各方面,以介于1μl与100μl之间、介于1μl与200μl之间、介于1μl与300μl之间、介于100μl与200μl之间、介于100μl与300μl之间、介于100μl与400μl之间、介于200μl与300μl之间、介于200μl与400μl之间、介于200μl与500μl之间、介于300μl与400μl之间、介于300μl与500μl之间、介于300μl与600μl之间、介于400μl与500μl之间、介于400μl与600μl之间、介于400ul与700μl之间、介于500μl与600μl之间、介于500μl与700μl之间、介于500μl与800μl之间、介于600μl与700μl之间、介于600μl与800μl之间、介于600μl与900μl之间、介于700μl与800μl之间、介于700μl与900μl之间、介于700μl与1000μl之间、介于800μl与900μl之间、介于800μl与1000μl之间或者介于900μl与1000μl之间的体积注射aav颗粒。根据本公开的各方面,流速介于0.1微升/分钟与0.2微升/分钟之间、介于0.1微升/分钟与0.3微升/分钟之间、介于0.1微升/分钟与0.4微升/分钟之间、介于0.2微升/分钟与0.3微升/分钟之间、介于0.2微升/分钟与0.4
微升/分钟之间、介于0.2微升/分钟与0.5微升/分钟之间、介于0.3微升/分钟与0.4微升/分钟之间、介于0.3微升/分钟与0.5微升/分钟之间、介于0.3微升/分钟与0.6微升/分钟之间、介于0.4微升/分钟与0.5微升/分钟之间、介于0.4微升/分钟与0.6微升/分钟之间、介于0.4微升/分钟与0.7微升/分钟之间、介于0.5微升/分钟与0.6微升/分钟之间、介于0.5微升/分钟与0.7微升/分钟之间、介于0.5微升/分钟与0.8微升/分钟之间、介于0.6微升/分钟与0.7微升/分钟之间、介于0.6微升/分钟与0.8微升/分钟之间、介于0.6微升/分钟与0.9微升/分钟之间、介于0.7微升/分钟与0.8微升/分钟之间、介于0.7微升/分钟与0.9微升/分钟之间、介于0.7微升/分钟与1.0微升/分钟之间、介于0.8微升/分钟与0.9微升/分钟之间、介于0.8微升/分钟与1.0微升/分钟之间、介于0.8微升/分钟与1.1微升/分钟之间、介于0.9微升/分钟与1.0微升/分钟之间、介于0.9微升/分钟与1.1微升/分钟之间、介于0.9微升/分钟与1.2微升/分钟之间、介于1.0微升/分钟与1.1微升/分钟之间、介于1.0微升/分钟与1.2微升/分钟之间、介于1.0微升/分钟与1.3微升/分钟之间、介于1.1微升/分钟与1.2微升/分钟之间、介于1.1微升/分钟与1.3微升/分钟之间、介于1.1微升/分钟与1.4微升/分钟之间、介于1.2微升/分钟与1.3微升/分钟之间、介于1.2微升/分钟与1.4微升/分钟之间、介于1.2微升/分钟与1.5微升/分钟之间、介于1.3微升/分钟与1.4微升/分钟之间、介于1.3微升/分钟与1.5微升/分钟之间、介于1.3微升/分钟与1.6微升/分钟之间、介于1.4微升/分钟与1.5微升/分钟之间、介于1.4微升/分钟与1.6微升/分钟之间、介于1.4微升/分钟与1.7微升/分钟之间、介于1.5微升/分钟与1.6微升/分钟之间、介于1.5微升/分钟与1.7微升/分钟之间、介于1.5微升/分钟与1.8微升/分钟之间、介于1.6微升/分钟与1.7微升/分钟之间、介于1.6微升/分钟与1.8微升/分钟之间、介于1.6微升/分钟与1.9微升/分钟之间、介于1.7微升/分钟与1.8微升/分钟之间、介于1.7微升/分钟与1.9微升/分钟之间、介于1.7微升/分钟与2.0微升/分钟之间、介于1.8微升/分钟与1.9微升/分钟之间、介于1.8微升/分钟与2.0微升/分钟之间、介于1.8微升/分钟与2.1微升/分钟之间、介于1.9微升/分钟与2.0微升/分钟之间、介于1.9微升/分钟与2.1微升/分钟之间、介于1.9微升/分钟与2.2微升/分钟之间、介于2.0微升/分钟与2.1微升/分钟之间、介于2.0微升/分钟与2.2微升/分钟之间、介于2.0微升/分钟与2.3微升/分钟之间、介于2.1微升/分钟与2.2微升/分钟之间、介于2.1微升/分钟与2.3微升/分钟之间、介于2.1微升/分钟与2.4微升/分钟之间、介于2.2微升/分钟与2.3微升/分钟之间、介于2.2微升/分钟与2.4微升/分钟之间、介于2.2微升/分钟与2.5微升/分钟之间、介于2.3微升/分钟与2.4微升/分钟之间、介于2.3微升/分钟与2.5微升/分钟之间、介于2.3微升/分钟与2.6微升/分钟之间、介于2.4微升/分钟与2.5微升/分钟之间、介于2.4微升/分钟与2.6微升/分钟之间、介于2.4微升/分钟与2.7微升/分钟之间、介于2.5微升/分钟与2.6微升/分钟之间、介于2.5微升/分钟与2.7微升/分钟之间、介于2.5微升/分钟与2.8微升/分钟之间、介于2.6微升/分钟与2.7微升/分钟之间、介于2.6微升/分钟与2.8微升/分钟之间、介于2.6微升/分钟与2.9微升/分钟之间、介于2.7微升/分钟与2.8微升/分钟之间、介于2.7微升/分钟与2.9微升/分钟之间、介于2.7微升/分钟与3.0微升/分钟之间、介于2.8微升/分钟与2.9微升/分钟之间、介于2.8微升/分钟与3.0微升/分钟之间、介于2.8微升/分钟与3.1微升/分钟之间、介于2.9微升/分钟与3.0微升/分钟之间、介于2.9微升/分钟与3.1微升/分钟之间、介于2.9微升/分钟与3.2微升/分钟之间、介于3.0微升/分钟与3.1微升/分钟之间、介于3.0微升/分钟与3.2微升/分钟之间、介于3.0微升/分钟与3.3微升/分钟之间、介于3.1微升/分
钟与3.2微升/分钟之间、介于3.1微升/分钟与3.3微升/分钟之间、介于3.1微升/分钟与3.4微升/分钟之间、介于03.2微升/分钟与3.3微升/分钟之间、介于3.2微升/分钟与3.4微升/分钟之间、介于3.2微升/分钟与3.5微升/分钟之间、介于3.3微升/分钟与3.4微升/分钟之间、介于3.3微升/分钟与3.5微升/分钟之间、介于3.3微升/分钟与3.6微升/分钟之间、介于3.4微升/分钟与3.5微升/分钟之间、介于3.4微升/分钟与3.6微升/分钟之间、介于3.4微升/分钟与3.7微升/分钟之间、介于3.5微升/分钟与3.6微升/分钟之间、介于3.5微升/分钟与3.7微升/分钟之间、介于3.5微升/分钟与3.8微升/分钟之间、介于3.6微升/分钟与3.7微升/分钟之间、介于3.6微升/分钟与3.8微升/分钟之间、介于3.6微升/分钟与3.9微升/分钟之间、介于3.7微升/分钟与3.8微升/分钟之间、介于3.7微升/分钟与3.9微升/分钟之间、介于3.7微升/分钟与4.0微升/分钟之间、介于3.8微升/分钟与3.9微升/分钟之间、介于3.8微升/分钟与4.0微升/分钟之间、介于3.8微升/分钟与4.1微升/分钟之间、介于3.9微升/分钟与4.0微升/分钟之间、介于3.9微升/分钟与4.1微升/分钟之间、介于3.9微升/分钟与4.2微升/分钟之间、介于4.0微升/分钟与4.1微升/分钟之间、介于4.0微升/分钟与4.2微升/分钟之间、介于4.0微升/分钟与4.3微升/分钟之间、介于4.1微升/分钟与4.2微升/分钟之间、介于4.1微升/分钟与4.3微升/分钟之间、介于4.1微升/分钟与4.4微升/分钟之间、介于04.2微升/分钟与4.3微升/分钟之间、介于4.2微升/分钟与4.4微升/分钟之间、介于4.2微升/分钟与4.5微升/分钟之间、介于4.3微升/分钟与4.4微升/分钟之间、介于4.3微升/分钟与4.5微升/分钟之间、介于4.3微升/分钟与4.6微升/分钟之间、介于4.4微升/分钟与4.5微升/分钟之间、介于4.4微升/分钟与4.6微升/分钟之间、介于4.4微升/分钟与4.7微升/分钟之间、介于4.5微升/分钟与4.6微升/分钟之间、介于4.5微升/分钟与4.7微升/分钟之间、介于4.5微升/分钟与4.8微升/分钟之间、介于4.6微升/分钟与4.7微升/分钟之间、介于4.6微升/分钟与4.8微升/分钟、介于4.6微升/分钟与4.9微升/分钟之间、介于4.7微升/分钟与4.8微升/分钟之间、介于4.7微升/分钟与4.9微升/分钟之间、介于4.7微升/分钟与5.0微升/分钟之间、介于4.8微升/分钟与4.9微升/分钟之间、介于4.8微升/分钟与5.0微升/分钟之间或者介于4.9微升/分钟与5.0微升/分钟之间。
135.根据本公开的各方面,将包含在普遍存在的(组成型)启动子或神经元特异性启动子的转录控制下编码neurod1的核酸的aav载体连同编码位点特异性重组酶的aav一起通过立体定向注射递送到受试者的脑中,其中编码neurod1的dna序列被反向并且对于neurod1表达处于错误的定向并且进一步包含位点特异性重组酶的重组酶活性的位点,直到所述位点特异性重组酶使编码neurod1的反向dna序列反向,由此允许neurod1的表达。
136.根据本公开的各方面,将包含在普遍存在的(组成型)启动子或神经元特异性启动子的转录控制下编码neurod1的核酸的aav载体连同根据本公开的各方面的编码中枢神经系统(cns)中的正常血流的中断区域中或中断位点处的位点特异性重组酶的腺相关病毒一起通过立体定向注射递送到受试者的脑中,其中编码neurod1的dna序列被反向并且对于neurod1表达处于错误的定向并且进一步包含位点特异性重组酶的重组酶活性的位点,直到所述位点特异性重组酶使编码neurod1的反向dna序列反向,由此允许neurod1的表达。任选地,立体定向注射的位点位于由cns中的正常血流的中断引起的胶质瘢痕中或附近。
137.根据本公开的各方面,组合物包括:第一重组表达载体,所述第一重组表达载体包括可操作地连接到编码位点特异性重组酶的核酸的胶质细胞特异性启动子;以及第二重组
表达载体,所述第二重组表达载体包括可操作地连接到编码neurod1的核酸序列的启动子、编码报告基因的核酸序列、增强子和调控元件。
138.根据本公开的各方面,组合物包括:第一重组aav表达载体,所述第一重组aav表达载体包括可操作地连接到编码位点特异性重组酶的核酸的胶质细胞特异性启动子;以及第二重组aav表达载体,所述第二重组aav表达载体包括可操作地连接到编码neurod1的核酸序列的启动子、编码报告基因的核酸序列、增强子和调控元件。
139.根据本公开的各方面,位点特异性重组酶是cre重组酶,并且重组酶活性的位点是识别位点loxp和lox2272位点。
140.术语“neurod1”涵盖:人neurod1蛋白,此处被鉴定为seq id no:2;以及小鼠neurod1蛋白,此处被鉴定为seq id no:4。除了seq id no:2和seq id no:4的neurod1蛋白之外,术语“neurod1”还涵盖neurod1蛋白的变体,如seq id no:2和seq id no:4的变体,其可以包含在本公开的方法和组合物中。如本文所使用的,术语“变体”是指天然存在的遗传变异和重组制备的变异,与参考neurod1蛋白,如seq id no:2或seq id no:4相比,所述变体中的每个变体在其氨基酸序列中含有一个或多个变化,其中所述变体保留了参考蛋白的功能性质。此类变化包含一个或多个氨基酸残基已经通过氨基酸取代、添加或缺失进行修饰的变化。术语“变体”涵盖人neurod1,包含例如哺乳类动物和鸟neurod1的直向同源物,如但不限于来自非人灵长类动物、猫、狗、绵羊、山羊、马、牛、猪、鸟、家禽动物和啮齿动物(如但不限于小鼠和大鼠)的neurod1直向同源物。在非限制性实例中,在本文中例示为氨基酸序列seq id no:4的小鼠neurod1是人neurod1的直向同源物。
141.优选的变体与seq id no:2或seq id no:4具有至少75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性,其中所述变体保留了参考蛋白的功能性质。
142.可以使用如定点诱变和pcr介导的诱变等标准分子生物学技术引入突变。本领域的技术人员将认识到,可以在不改变neurod1蛋白的功能性质的情况下引入一个或多个氨基酸突变。例如,可以在不改变seq id no:2或4的neurod1蛋白的功能性质的情况下进行一个或多个氨基酸取代、添加或缺失。
143.可以在neurod1蛋白中进行保守的氨基酸取代以产生neurod1蛋白变体,其中所述变体保留了参考蛋白的功能性质。保守氨基酸取代是本领域公认的一个氨基酸对具有类似特性的另一个氨基酸的取代。例如,每个氨基酸可以被描述为具有以下特性中的一个或多个:正电性、负电性、脂肪族、芳香族、极性、疏水性和亲水性。保守取代是具有指定结构或功能特性的一个氨基酸对具有同一特性的另一个氨基酸的取代。酸性氨基酸包含天冬氨酸、谷氨酸;碱性氨基酸包含组氨酸、赖氨酸、精氨酸;脂肪族氨基酸包含异亮氨酸、亮氨酸和缬氨酸;芳香族氨基酸包含苯丙氨酸、甘氨酸、酪氨酸和色氨酸;极性氨基酸包含天冬氨酸、谷氨酸、组氨酸、赖氨酸、天冬酰胺、谷氨酰胺、精氨酸、丝氨酸、苏氨酸和酪氨酸;并且疏水性氨基酸包含丙氨酸、半胱氨酸、苯丙氨酸、甘氨酸、异亮氨酸、亮氨酸、甲硫氨酸、脯氨酸、缬氨酸和色氨酸;并且保守取代包含每组内的氨基酸之间的取代。氨基酸还可以根据相对大小来描述:丙氨酸、半胱氨酸、天冬氨酸、甘氨酸、天冬酰胺、脯氨酸、苏氨酸、丝氨酸、缬氨酸,所有这些通常被认为是小的。
144.neurod1变体可以包含合成氨基酸类似物、氨基酸衍生物和/或非标准氨基酸,说
明性地包含但不限于α-氨基丁酸、瓜氨酸、刀豆氨酸、氰基丙氨酸、二氨基丁酸、二氨基庚二酸、二羟基-苯丙氨酸、黎豆氨酸、高精氨酸、羟脯氨酸、正亮氨酸、正缬氨酸、3-磷酸丝氨酸、高丝氨酸、5-羟色氨酸、1-甲基组氨酸、3-甲基组氨酸和鸟氨酸。
145.为了确定两个氨基酸序列或两个核酸序列的同一性百分比,出于最佳比较目的对序列进行比对(例如,可以在第一氨基酸或核酸序列的序列中引入空位,以与第二氨基酸或核酸序列进行最佳比对)。然后将对应氨基酸位置或核苷酸位置处的氨基酸残基或核苷酸进行比较。当第一序列中的位置被与在第二序列中的对应位置相同的氨基酸残基或核苷酸占据时,则这些分子在所述位置处是相同的。两个序列之间的同一性百分比是序列共有的相同位置的数量的函数(即,同一性%=相同重叠位置的数量/位置总数
×
100%)。在一个实施例中,两个序列的长度相同。
146.两个序列之间的同一性百分比的确定也可以使用数学算法来完成。用于比较两个序列的数学算法的优选的非限制性实例是karlin和altschul,1990,《美国国家科学院院刊(pnas)》87:22642268的算法,所述算法在karlin和altschul,1993,《美国国家科学院院刊》.90:58735877中被修改。将此类算法并入到altschul等人,1990,《分子生物学杂志(j.mol.biol.)》215:403的nblast和xblast程序中。用nblast核苷酸程序参数集(例如,分数=100,字长=12)执行blast核苷酸搜索,以获得与本公开的核酸分子同源的核苷酸序列。
147.用xblast程序参数集(例如,分数50,字长=3)执行blast蛋白搜索,以获得与本公开的蛋白质分子同源的氨基酸序列。为了获得用于比较目的的有空位的比对,利用如在altschul等人,1997,《核酸研究(nucleic acids res.)》25:33893402中所描述的有空位的blast。可替代地,psi blast用于执行检测分子之间的距离关系的迭代搜索。当利用blast、有空位的blast和psi blast程序时,使用相应程序(例如,xblast和nblast)的默认参数(参见,例如,ncbi网站)。
148.用于序列比较的数学算法的另一个优选的非限制性实例是myers和miller,1988,《计算机在生物科学中的应用(cabios)》4:1117的算法。将此类算法并入到align程序(第2.0版)中,所述程序是gcg序列比对软件包的一部分。当利用align程序比较氨基酸序列时,使用pam120权重残基表、空位长度罚分12以及空位罚分4。
149.在容许或不容许空位的情况下,使用类似于以上所述的那些技术的技术,确定两个序列之间的同一性百分比。在计算同一性百分比时,通常仅对确切的匹配进行计数。
150.术语“neurod1蛋白”涵盖在本公开的方法或组合物中可操作的neurod1蛋白的片段,如seq id no.2和4的片段及其变体。
151.neurod1蛋白和核酸可以从天然来源分离,如生物体的脑或表达neurod1的细胞系的细胞。可替代地,可以重组地产生neurod1蛋白或核酸,如通过使用表达构建体在体外或体内进行表达。neurod1蛋白和核酸也可以通过熟知的方法来合成。
152.本公开的方法和组合物中包含的neurod1优选地使用重组核酸技术产生。重组neurod1的生产包含将涵盖编码neurod1的核酸序列,如dna序列或rna序列的重组表达载体引入到体外或体内的宿主细胞中。
153.根据本公开的实施例,引入到宿主细胞中以产生neurod1的编码neurod1的核酸序列编码seq id no:2、seq id no:4或其变体。
promoter);腺病毒主要晚期启动子;β肌动蛋白启动子;甘油醛3-磷酸脱氢酶;葡萄糖调控蛋白78启动子;葡萄糖调控蛋白94启动子;热休克蛋白70启动子;β-驱动蛋白启动子;rosa启动子;泛素b启动子;真核起始因子4a1启动子和延长因子i启动子;所有这些启动子在本领域中都是熟知的并且可以使用常规方法从主要来源分离或从商业来源获得。启动子可以完全源自单个基因或者可以是嵌合的,具有源自多于一个基因的部分。调控序列的组合可以包含在表达载体中并且用于驱动neurod1的表达。包含在表达载体中以驱动neurod1的表达的非限制性实例是cag启动子,所述启动子组合了巨细胞病毒cmv早期增强子元件、鸡β-肌动蛋白启动子和兔β-珠蛋白基因的剪接受体。
162.根据本文所述的方法,用于驱动neurod1的表达的特定启动子是优先驱动胶质细胞,特别是星形胶质细胞和/或ng2细胞中的表达的启动子。这种启动子被称为“星形胶质细胞特异性”和/或“ng2细胞特异性”启动子。
163.星形胶质细胞特异性启动子的非限制性实例是胶质纤维酸性蛋白(gfap)启动子和醛脱氢酶1家族成员l1(aldh1l1)启动子。人gfap启动子在本文中被示出为seq id no:6。小鼠aldh1l1启动子在本文中被示出为seq id no:7。
164.ng2细胞特异性启动子的非限制性实例是硫酸软骨素蛋白聚糖4基因的启动子,也称为神经元-胶质抗原2(ng2)。人ng2启动子在本文中被示出为seq id no:8。
165.根据本文所述的方法,用于驱动neurod1的表达的特定启动子是在反应性胶质细胞中优先驱动表达的启动子。反应性胶质细胞的非限制性实例包含反应性星形胶质细胞和反应性ng2细胞。根据此公开的各方面,反应性胶质细胞是反应性星形胶质细胞。根据本公开的各方面,反应性胶质细胞是反应性ng2细胞。根据本公开的各方面,用于驱动neurod1表达的启动子被称为“反应性星形胶质细胞特异性”启动子。根据本公开的各方面,用于驱动neurod1表达的启动子被称为“反应性ng2细胞特异性”启动子。“反应性星形胶质细胞特异性”启动子的非限制性实例是脂质运载蛋白2(lcn2)基因的启动子。小鼠lcn2启动子在本文中被示出为seq id no:5。
166.普遍存在的启动子和细胞类型特异性启动子的同源物和变体可以用于表达neurod1。
167.根据本公开,启动子同源物和启动子变体可以包含在用于表达neurod1的表达载体中。术语“启动子同源物”和“启动子变体”是指与本文公开的那些启动子相比,具有基本上类似的功能性质以在编码neurod1的可操作地连接的核酸上赋予期望的表达类型,如neurod1的细胞类型特异性表达或neurod1的普遍存在表达的启动子。例如,与gfap、s100b、aldh1l1、ng2、lcn2和cag启动子相比,启动子同源物或变体具有基本上类似的功能性质以在编码neurod1的可操作地连接的核酸上赋予细胞类型特异性表达。
168.本领域的技术人员将认识到,可以在不改变给定启动子的功能性质的情况下引入一个或多个核酸突变。可以使用如定点诱变和pcr介导的诱变等标准分子生物学技术引入突变,以产生启动子变体。如本文所使用的,术语“启动子变体”是指参考启动子,如但不限于gfap、s100b、aldh1l1、ng2、lcn2和pcag启动子的分离的天然存在的或重组制备的变体。
169.本领域已知来自其它物种的启动子是具有功能的,例如小鼠aldh1l1启动子在人细胞中是具有功能的。可以使用本领域已知的生物信息学工具鉴定来自其它物种的同源物和同源启动子,参见例如,xuan等人,2005,《基因组生物学(genome biol)》6:r72;zhao等
人,2005,《核酸研究》33:d103-107;以及halees等人,2003,《核酸研究》200331:3554-3559。
170.在结构上,neurod1的细胞类型特异性启动子和/或普遍存在的启动子的同源物和变体与参考发育调节的和/或普遍存在的启动子具有至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的核酸序列同一性,并且包含用于结合rna聚合酶的位点以及任选地用于转录因子的一个或多个结合位点。
171.与seq id no:1或seq id no:3基本上相同的核酸序列的特征在于具有能够在高严格性杂交条件下与seq id no:1或seq id no:3杂交的互补核酸序列。
172.除了编码neurod1的一个或多个核酸之外,编码另外的蛋白质的一个或多个核酸序列也可以包含在表达载体中。例如,此类另外的蛋白质包含非neurod1蛋白,如包含但不限于β-半乳糖苷酶、绿色荧光蛋白的报告基因以及抗生素抗性报告基因。
173.根据本公开的各方面,重组表达载体至少编码seq id no:2的neurod1、与seq id no:2具有至少95%同一性的蛋白质或者由与seq id no:1基本上相同的核酸序列编码的蛋白质。
174.根据本公开的各方面,重组表达载体至少编码seq id no:4的neurod1、与seq id no:4具有至少95%同一性的蛋白质或者由与seq id no:2基本上相同的核酸序列编码的蛋白质。
175.任选地,报告基因包含在编码neurod1的重组表达载体中。可以包含报告基因以产生肽或蛋白质,所述肽或蛋白质用作从重组表达载体表达neurod1的替代标志物。如本文所使用的术语“报告基因”是指当通过例如化学发光、荧光、比色反应、抗体结合、诱导型标志物和/或配体结合测定表达时易于检测的基因。示例性报告基因包含但不限于绿色荧光蛋白(gfp)、增强型绿色荧光蛋白(egfp)、黄色荧光蛋白(yfp)、增强型黄色荧光蛋白(eyfp)、青色荧光蛋白(cfp)、增强型青色荧光蛋白(ecfp)、蓝色荧光蛋白(bfp)、增强型蓝色荧光蛋白(ebfp)、红色荧光蛋白(rfp)、mmgfp(zernicka-goetz等人,《发育(development)》,124:1133-11371997)、dsred、荧光素酶和β-半乳糖苷酶(lacz)。mcherry是源自dsred的用作根据本公开的各方面的报告基因的单体红色荧光蛋白。
176.根据本公开的各方面,seq id no:9是包括以下的核酸的实例:可操作地连接到编码neurod1的核酸的cag启动子、编码增强型绿色荧光蛋白(egfp)的核酸序列、增强子、土拨鼠肝炎转录后调控元件(wpre)以及分离编码neurod1的核酸和编码egfp的核酸的ires。
177.根据本公开的各方面,将seq id no:9插入到表达载体中,以便表达neurod1和报告基因egfp。
178.任选地,根据本公开的各方面,从seq id no:9中去除ires和编码egfp的核酸,并将包含cag启动子和编码neurod1的可操作地连接的核酸的剩余核酸序列插入到表达载体中,以便表达neurod1。可以任选地包含wpre或另一种增强子。
179.将遗传物质引入到受体宿主细胞中的过程,如用于在宿主细胞中瞬时或稳定表达由遗传物质编码的期望蛋白质的过程被称为“转染”或“转导”。转染技术是本领域熟知的并且包含但不限于电穿孔、颗粒加速转化(也称为“基因枪”技术)、脂质体介导的转染、磷酸钙或氯化钙共沉淀介导的转染、deae-葡聚糖介导的转染、显微注射、聚乙二醇介导的转染和热休克介导的转染。转导是指病毒介导的将遗传物质引入到受体宿主细胞中。
180.病毒介导的转染可以使用病毒载体,如源自腺病毒、aav和慢病毒的病毒载体来完成。
181.任选地,将宿主细胞离体转染或转导并且然后重新引入到宿主生物体中。例如,可以从受试者体内去除细胞或组织,用编码neurod1的表达载体转染或转导,并且然后返回到受试者。
182.将包含编码neurod1或其功能片段的核酸的重组表达载体引入到体外或体内的宿主胶质细胞中,以便在宿主胶质细胞中表达外源性neurod1,从而将胶质细胞转化成功能神经元是通过各种转染或转导方法中的任何一种方法来实现的。
183.根据本公开的各方面,通过将编码neurod1或其功能片段的mrna引入到体外或体内的宿主胶质细胞来实现宿主胶质细胞中外源性neurod1的表达,以将胶质细胞转化为功能神经元。
184.根据本公开的各方面,通过将编码neurod1或其功能片段的dna引入到体外或体内的宿主胶质细胞来实现宿主胶质细胞中外源性neurod1的表达,以将胶质细胞转化为功能神经元。
185.根据本公开的各方面,通过将neurod1蛋白引入到体外或体内的宿主胶质细胞来实现宿主胶质细胞中外源性neurod1的表达,以将胶质细胞转化为功能神经元。
186.这些和其它技术的细节是本领域已知的,例如,如以下文献中所描述的:j.sambrook和d.w.russell,《分子克隆:实验室手册》,冷泉港实验室出版社;第3版,2001;f.m.ausubel编辑,《精编分子生物学实验指南》,《实验室指南》;第5版,2002;以及engelke,d.r.,《rna干扰(rnai):rnai技术的具体细节(rna interference(rnai):nuts and bolts of rnai technology》,宾夕法尼亚州伊格尔维尔的dna出版社有限责任公司(dna press llc,eagleville,pa),2003。
187.使用重组表达载体表达neurod1是通过将表达载体引入到真核或原核宿主细胞表达系统,如昆虫细胞、哺乳动物细胞、酵母细胞、细菌细胞或本领域公认的任何其它单细胞或多细胞生物体中来完成的。宿主细胞任选地是原代细胞或永生化源性细胞。永生化细胞是可以在体外维持至少5次复制传代的细胞。
188.在产生neurod1的条件下维持含有重组表达载体的宿主细胞。可以使用已知的细胞培养技术培养和维持宿主细胞,所述细胞培养技术如celis,julio编辑,1994,《细胞生物学实验室手册(cell biology laboratory handbook),纽约的学术出版社(academic press,n.y.)中所述。本领域的技术人员可以选择和优化这些细胞的各种培养条件,包含关于特定营养物、氧气、张力、二氧化碳和降低的血清水平的培养基调配物。
189.根据本公开的各方面,将包含编码neurod1的核酸的重组表达载体引入到受试者的胶质细胞中。外源性neurod1在胶质细胞中的表达使胶质细胞“转化”成功能神经元。
190.术语“转化(conversion)”和“转化的(converted)”在本文中用于描述neurod1、其变体或其功能片段在胶质细胞中的表达引起胶质细胞,并且在特定情况下是星形胶质细胞或反应性星形胶质细胞表型改变为功能神经元表型的作用。类似地,短语“经neurod1转化的神经元”和“经转化的神经元”在本文中用于指代包含具有随之发生的功能神经元表型的外源性neurod1蛋白或其功能片段的细胞。
191.术语“表型”是指本文所提及的细胞的熟知的可检测特性。功能神经元表型可以是
但不限于以下的一种或多种:神经元形态、一种或多种神经元标志物的表达、神经元的电生理学特性、突触形成和神经递质的释放。例如,神经元表型涵盖但不限于:神经元的特征性形态方面,如树突、轴突和树突脊的存在;特征性神经元蛋白表达和分布,如在突触点中存在突触蛋白、在树突中存在map2;以下一种或多种的存在:神经元核蛋白(neun)、gaba、谷氨酸脱羧酶(gad),如gad67、叉头框-g1(foxg1)、t-脑-1(tbr1)、cux1、ctip2、小清蛋白(pv)、钙网膜蛋白(cr)、神经肽y(npy)和生长抑素(sst);以及特征性电生理体征,如自发和诱发突触事件。
192.在另外的实例中,如星形胶质细胞表型和反应性星形胶质细胞表型等胶质表型涵盖但不限于:星形胶质细胞和反应性星形胶质细胞的特征性形态方面,如通常“星形”形态;以及特征性星形胶质细胞和反应性星形胶质细胞蛋白表达,如胶质纤维酸性蛋白(gfap)的存在。
193.根据本公开的各方面,将包含编码neurod1、其变体或其功能片段的核酸的重组表达载体引入到受试者的星形胶质细胞中。外源性neurod1、其变体或其功能片段在星形胶质细胞中的表达将星形胶质细胞“转化”成功能神经元。
194.根据本公开的各方面,将包含编码neurod1、其变体或其功能片段的核酸的重组表达载体引入到受试者的反应性星形胶质细胞中。外源性neurod1、其变体或其功能片段在反应性星形胶质细胞中的表达将反应性星形胶质细胞“转化”成功能神经元。
195.根据本公开的各方面,将包含编码neurod1、其变体或其功能片段的核酸的重组表达载体引入到受试者的ng2细胞中。外源性neurod1、其变体或其功能片段在ng2细胞中的表达将ng2细胞“转化”成功能神经元。
196.将包含编码neurod1、其变体或其功能片段的核酸、编码neurod1、其变体或其功能片段的dna、编码neurod1、其变体或其功能片段的mrna,和/或neurod1蛋白、其变体、其全长或功能片段在内的表达载体任选地与用于引入到体外或体内的宿主细胞中的载体缔合。
197.在特定方面,载体是颗粒载体,如脂质颗粒,包含脂质体、胶束、单层或多层囊泡;聚合物颗粒,如水凝胶颗粒、聚乙醇酸颗粒或聚乳酸颗粒;无机颗粒,如磷酸钙颗粒,如例如美国专利第5,648,097号中所描述的;以及无机/有机颗粒载体,如例如美国专利第6,630,486号中所描述的。
198.颗粒载体可以选自以下:脂质颗粒;聚合物颗粒;无机颗粒;有机颗粒;以及混合无机/有机颗粒。颗粒类型的混合物也可以作为颗粒药学上可接受的载体被包含在内。
199.颗粒载体通常被调配成使得颗粒的平均粒度在约1nm-10微米的范围内。在特定方面,颗粒载体被调配成使得颗粒的平均粒度在约1nm-100nm的范围内。
200.对脂质体和与其制备和用途相关的方法的进一步描述可见于《脂质体:实用方法(liposomes:apractical approach)》(实用方法系列,264),v.p.torchilin和v.weissig(编辑),牛津大学出版社(oxford university press);第2版,2003。在s.m.moghimi等人,《美国实验生物学学会联合会杂(faseb j.)》2005,19,311-30中描述了纳米颗粒的另外的方面。
201.在引入包含编码外源性neurod1或其功能片段的核酸的重组表达载体之后,检测外源性neurod1的表达是使用各种标准方法中的任何一种方法来完成的,所述标准方法包含但不限于用于检测neurod1的免疫测定、用于检测neurod1核酸的核酸测定以及检测与外
源性neurod1共表达的报告基因。
202.术语“核酸”是指具有多于一个核苷酸的任何形式的rna或dna分子包含单链、双链、寡核苷酸或多核苷酸。术语“核苷酸序列”是指单链形式的核酸中的寡核苷酸或多核苷酸中的核苷酸的排序。
203.术语“neurod1核酸”是指分离的neurod1核酸分子并且涵盖具有与seq id no:1或seq id no:3中所示的dna序列具有至少70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高同一性的序列的分离的neurod1核酸、其补体或其片段,或者分离的核酸,如rna或dna分子,其具有在高严格性杂交条件下与如seq id no:1或seq id no:3所示的核酸杂交的序列、其补体或其片段。关于neurod1核酸分子的术语“分离的”指示所述分子不在其在所述位置的neurod1启动子的控制下所源自的生物体的基因组中。
204.seq id no:3的核酸是具有在高严格性杂交条件下与seq id no:1中所示的核酸杂交的序列的分离的dna分子的实例。
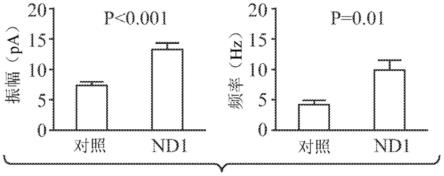
205.neurod1核酸的片段是在本公开的各方面中可操作的neurod1核酸的任何片段,包含neurod1核酸。
206.能够与靶neurod1 rna或dna分子,如mrna或cdna杂交的核酸探针或引物可以用于检测和/或量化编码neurod1蛋白的rna或dna,如mrna或cdna。核酸探针可以是长度为至少10个、15个、30个、50个或100个核苷酸的寡核苷酸,并且足以在严格条件下与neurod1 rna或dna,如mrna或cdna或其互补序列特异性地杂交。核酸引物可以是长度为至少10个、15个或20个核苷酸的寡核苷酸,并且足以在严格条件下与rna或dna,如mrna或cdna或其互补序列特异性地杂交。
207.术语“互补体”和“互补”是指核苷酸之间的沃森-克里克碱基配对(watson-crick base pairing)并且具体地是指彼此氢键键合的核苷酸,其中胸腺嘧啶或尿嘧啶残基通过两个氢键与腺嘌呤残基连接并且胞嘧啶和鸟嘌呤残基通过三个氢键连接。通常,核酸包含描述为与指定的第二核苷酸序列具有“百分比互补性”的核苷酸序列。例如,核苷酸序列可以与指定的第二核苷酸序列具有80%、90%或100%互补性,这表明序列的10个核苷酸中的8个、10个核苷酸中的9个或10个核苷酸中的10个与指定的第二核苷酸序列互补。例如,核苷酸序列3'-tcga-5'与核苷酸序列5'-agct-3'是100%互补的。进一步地,核苷酸序列3'-tcga-与核苷酸序列5'-ttagctgg-3'的区域是100%互补的。
208.术语“杂交(hybridization)”和“杂交(hybridize)”是指互补核酸的配对和结合。杂交在两个核酸之间以不同程度发生,这取决于如核酸的互补程度、核酸的解链温度tm以及杂交条件的严格性等因素,如本领域中熟知的。术语“杂交条件的严格性”是指杂交介质相对于如甲酰胺和登哈特氏溶液(denhardt's solution)等特定常见添加剂的温度、离子强度和组成的条件。
209.与指定核酸相关的特定杂交条件的确定是常规的并且是本领域熟知的,例如,如在以下文献中所描述的:j.sambrook和d.w.russell,《分子克隆:实验室手册》,冷泉港实验室出版社;第3版,2001;以及f.m.ausubel编辑,《精编分子生物学实验指南》,《实验室指南》;第5版,2002。高严格性杂交条件是仅允许基本上互补的核酸杂交的那些条件。通常,具有约85-100%互补性的核酸被认为是高度互补的并且在高严格性条件下杂交。中间严格性
条件被例示为具有中间互补性、约50-84%互补性的核酸以及具有高互补性程度的核酸杂交的条件。相反,低严格性杂交条件是具有低互补性程度的核酸杂交的条件。
210.术语“特异性杂交(specific hybridization)”和“特异性杂交(specifically hybridize)”是指特定核酸与靶核酸的杂交,而不与样品中除了靶核酸之外的核酸发生实质性杂交。
211.杂交和洗涤条件的严格性取决于若干因素,包含探针和靶标的tm以及杂交和洗涤条件的离子强度,如本领域技术人员熟知的。例如在以下文献中描述了杂交和用于实现期望的杂交严格性的条件:sambrook等人,《分子克隆:实验室手册》,冷泉港实验室出版社,2001;以及ausubel,f.等人(编辑),《精编分子生物学实验指南》,威利出版公司(wiley),2002。
212.高严格性杂交条件的实例是长度超过约100个核苷酸的核酸在含有6x ssc、5x登哈特氏溶液、30%甲酰胺和100微克/ml变性鲑鱼精子的溶液中在37℃下杂交过夜,随后在0.1x ssc和0.1%sds的溶液中在60℃下洗涤15分钟。ssc是0.15m nacl/0.015m柠檬酸钠。登哈特氏溶液是0.02%牛血清白蛋白/0.02%ficoll/0.02%聚乙烯吡咯烷酮。在高严格性条件下,seq id no:1和seq id no:3将与基本上相同的靶标的补体杂交,而不与不相关的序列杂交。
213.以下实例说明了本发明组合物和方法的实施例。这些实例出于说明性目的提供,并且不认为是对本发明组合物和方法的范围的限制。
214.实例
215.材料和方法
216.小鼠闭锁性头部损伤模型
217.从杰克逊实验室(jackson laboratories)购买野生型(wt)c57bl/6j和fvb/n-tg(gfap::gfp)14mes/j转基因小鼠。将小鼠在12小时光/暗循环下圈养,并且供应充足的食物和水。此实例中使用了年龄为4-6个月的雌雄成年小鼠(25-35g)。
218.将小鼠通过腹膜内(ip)注射用氯胺酮/甲苯噻嗪(120mg/kg氯胺酮;8mg/kg甲苯噻嗪)麻醉。完全麻醉之后,将每只小鼠转移到立体定位设备上,并且将头部固定在形状匹配的泡沫上。泡沫由柔软的塑料材料制成以吸收多余的冲击以及稳定动物的头部。沿着中线切开,以完全暴露颅骨上的冲击部位,所述部位位于小鼠运动皮层上方,坐标为前囟前方1.0mm和中线外侧1.5mm。在进行冲击诱导之前,去除耳棒以避免耳道损伤。电磁控制装置impactor one购自leica用于tbi诱导。避免大于5.0米/秒的冲击力以预防颅骨骨折和死亡。
219.以5米/秒的速度、200毫秒的停留时间和1.0mm的冲击深度使用直径为2mm的冲击器尖端,以造成局灶性闭锁性头部损伤。调整冲击器尖端的底面以使其与颅骨上的冲击部位相切,以便将冲击力均匀地递送到颅骨,并降低颅骨骨折的风险。有明显颅骨骨折的动物被排除在实验之外,并立即实施安乐死。
220.在冲击传递和切口缝合之后,将动物从立体定位设备中取出,放置在加热垫上,并立即以每分钟3-5升o2的速率施用创伤后氧气,直到恢复深呼吸和均匀呼吸。将动物放在加热垫上观察,直到其从程序中恢复,并且然后在手术后每天进行监测,持续至少7天。在冲击后的前3天,每天给予两次丁丙诺啡(0.05mg/kg)以缓解疼痛。
221.病毒注射
222.在闭锁性头部损伤后第7天,随机选择小鼠以用于注射施用编码neurod1的病毒或对照病毒。将小鼠通过腹膜内注射用氯胺酮/甲苯噻嗪(120mg/kg氯胺酮;8mg/kg甲苯噻嗪)麻醉并放置在立体定位设备中。带有鼻梁支架的柔化辊和两个耳棒用于固定头部。在进行中线切口之后,在冲击部位中心的颅骨上钻一个~1mm的小孔(坐标:前卤前方1.0mm,前卤左侧1.5mm)。将所选的病毒,1.5μl(aav9)hgfap::gfp或(aav9)hgfap::neurod1 gfp或3μl携带neurod1-gfp或gfp对照的逆转录病毒,使用带有33号针头的5μl汉密尔顿牌玻璃注射器的电动微型泵注射器以0.15微升/分钟的速度注射到损伤的脑区域中持续10分钟。注射后,将针头在完全拔出之前在原位再保持3分钟。手术后,将小鼠在加热垫上恢复,直到观察到自由运动。将小鼠单独圈养,并且每天仔细监测持续至少一周或直至处死。
223.通过病毒或染料进行的神经投射追踪
224.为了进行顺行追踪,将腺相关病毒(aav)与hsyn::cre+cag::flex-mcherry-p2a-mcherry一起注射到丘脑中(坐标:前囟后方2.0mm,前囟左侧1.1mm;颅骨表面腹侧2.8mm)。为了进行逆行追踪,将与647荧光探针(ctb-647)融合的霍乱毒素b亚单位注射到损伤部位对侧的皮层中(坐标:前囟前方1.0mm,前囟右侧1.5mm,颅骨表面腹侧1.6mm)。7天后处死动物并收集脑样品用于分析。
225.aav载体构建
226.质粒paav-gfap-hchr2(h134r)-mcherry获自addgene(质粒#27055;rrid:addgene_27055)。为了构建paav-hgfap::gfp和paav-hgfap::neurod1-p2a-gfp载体,通过pcr使用guo等人,《细胞干细胞(cell stem cell)》14,188-202,2014中详细描述的逆转录病毒构建体来产生编码gfp或neurod1的cdna。将gfp基因或者与p2a-gfp基因融合的neurod1亚克隆到paav-gfap-hchr2(h134r)-mcherry载体中,其中在kpni与bsrgi位点之间切除hchr2(h134r)-mcherry。对于paav-突触蛋白::cre的质粒,通过pcr从hgfap-cre(addgene质粒#40591)中获得cre基因,并将其插入到kpni与bmti位点之间的aav phsyn(s)-flpo-bghpa(addgene质粒#51669)中,其中flpo被替换以产生paav-hsyn:cre载体。paav-flex-mcherry-p2a-mcherry载体根据在chen等人,《分子疗法(mol ther.)》,2020年1月8日;28(1):217-234中的详细描述构建。对质粒构建体进行测序以用于验证。
227.aav病毒产生
228.重组aav9在293aav细胞(美国加利福尼亚州圣地亚哥cell biolabs公司(cell biolabs,san diego,ca,usa))中产生。聚乙烯亚胺(pei,线性,mw 25,000)用于转染三个质粒:paav表达载体、paav9-rc(美国加利福尼亚州圣地亚哥cell biolabs公司)和phelper(美国加利福尼亚州圣地亚哥cell biolabs公司)。转染后72小时,将细胞在其培养基中刮下,并通过将其交替地置于干冰或乙醇和37℃水浴中进行离心、冷冻和解冻四次。通过用beckman sw55ti转子在不连续的碘克沙醇梯度中以54,000rpm离心1小时来纯化aav粗裂解物。提取含有病毒的层,并且通过millipore amicon超离心过滤器浓缩病毒。通过quicktiter aav定量试剂盒(美国加利福尼亚州圣地亚哥cell biolabs公司)测定,hgfap::gfp的病毒滴度为2.2
×
10
11
个基因组拷贝每毫升(gc/ml),hgfap::nd1-gfp的病毒滴度为2.3
×
10
11
个gc/ml,hsyn::cre的病毒滴度为4.6
×
10
11
个gc/ml,cag::flex-mcherry-p2a-mcherry的病毒滴度为1.6
×
10
12
个gc/ml。
229.逆转录病毒产生
230.如先前所述(guo等人,《细胞干细胞》,14:188-202(2014))构建pcag-neurod1-ires-gfp和pcag-gfp。为了包装逆转录病毒颗粒,将无gpg辅助hek细胞与目标质粒连同水泡性口炎病毒g蛋白(vsv-g)载体一起转染以产生表达neurod1或gfp的逆转录病毒。转染hek细胞后测定的逆转录病毒颗粒的滴度为约107个颗粒/ml。
231.免疫组织化学
232.如在guo等人,《细胞干细胞》14,188-202,2014)中详细描述的那样收集小鼠脑。简而言之,给动物注射2.5%三溴乙醇用于麻醉。用人工脑脊液(acsf)进行穿心灌注以全身洗去血液。然后,将脑解剖出来并在4℃下在4%多聚甲醛(pfa)中后固定过夜。固定后,使用leica-1000振动切片机将脑组织切成40μm的切片。用磷酸盐缓冲盐水(pbs)洗涤脑切片3次,随后在含2%triton x-100的pbs中透化10分钟。然后在含5%正常驴血清和0.3%triton x-100的pbs中阻断脑切片2小时。将一级抗体添加到阻断缓冲液中并与脑切片在4℃下温育过夜。将一级抗体用pbs冲洗3次,随后将二级抗体在室温(rt)下温育2小时。在用pbs洗涤之后,用防褪色封固溶液(英杰公司(invitrogen))将脑切片固定在载玻片上。用共焦显微镜(olympus fv1000或zeiss lsm800)获取图像。为了确保抗体特异性,仅使用二级抗体进行免疫染色作为并列对照,其中未检测到明显的信号。
233.转轮运动和c-fos检测
234.在闭锁性头部损伤(chi)后注射neurod1病毒后第28天,将动物放置在转轮中。积极奔跑三十分钟后,将小鼠放回居住笼中。一小时后,将其处死并灌注以进行c-fos免疫染色。
235.电生理学
236.如在guo等人,《细胞干细胞》14,188-202,2014;wu等人,《自然通信(nat commun)》5,4159,2014中详细描述的那样进行脑切片记录。在病毒注射后第7天、第14天、第28天和第56天,用2.5%三溴乙醇麻醉小鼠,并且然后用在ph 7.3-7.4下、在300mosm下的含有(以mm单位)以下的基于nmdg的切削液灌注小鼠:93nmdg、93hcl、2.5kcl、1.25nah2po4、30nahco3、20hepes、15葡萄糖、12n-乙酰-l-半胱氨酸、5抗坏血酸钠、2硫脲、3丙酮酸钠、7mgso4和0.5cacl2,并且用95%o2/5%co2鼓泡。在室温下,用振动切片机(德国莱卡vt1200s(vt1200s,leica,germany))在aav注射的皮层区域周围切割300μm厚的冠状切片。收集切片,并在含氧的nmdg切削液中在33.0
±
1.0℃下温育10-15分钟。然后,将切片转移到具有连续95%o2/5%co2鼓泡并含有以下的(以mm为单位)保持溶液中:92nacl、2.5kcl、1.25nah2po4、30nahco3、20hepes、15葡萄糖、12n-乙酰-l-半胱氨酸、5抗坏血酸钠、2硫脲、3丙酮酸钠、2mgso4和2cacl2。在室温下,在保持溶液中恢复至少0.5小时后,将单个切片转移到记录室中,在33.0
±
1.0℃下,用通过95%o2/5%co2饱和的标准acsf(人工脑脊液)连续灌注。标准acsf含有以下(以mm为单位):124nacl、2.5kcl、1.25nah2po4、26nahco3、10葡萄糖、1.3mgso4和2.5cacl2。为了检测neurod1-gfp感染的神经元中的动作电位发放,用含有以下(以mm为单位)的移液管溶液进行全细胞记录:135k-葡萄糖酸盐、10kcl、5na-磷酸肌酸、10hepes、2egta、4mgatp和0.3na2gtp,用koh调节ph 7.3,280
–
290mosm。在电流钳模型下,注射去极化电流以激发动作电位。为了记录自发兴奋性突触后电流(sepsc)和自发抑制性突触后电流(sipsc),移液管溶液含有以下(以mm为单位):120cs-甲磺酸钠、10kcl、10na-磷酸
肌酸、10hepes、5qx-314、1egta、4mgatp和0.3na2gtp,用koh调节ph 7.3,280
–
290mosm。为了标记经记录的神经元,将0.5%生物胞素(西格玛(sigma),目录b4261)添加到移液管溶液中。对于sepsc记录,将细胞膜电位保持在-70mv(gabaa受体的反转电位),并且对于sipsc记录,将细胞膜电位保持在0mv(离子移变的谷氨酸受体的反转电位)。用multiclamp 700a放大器收集数据,并用pclamp 9.0和clampfit10.6软件(分子装置(molecular devices))进行分析。
237.共焦成像和分析
238.损伤区域定义。
239.将中线外侧750μm到2250μm损伤部位周围的皮层区域定义为总损伤区域以进行分析。将距离冲击中心宽度小于600μm并且深度小于450μm的浅层定义为损伤核心。将距离冲击中心宽度为600-1000μm并且深度为450-900μm的中间层定义为损伤周围区域。
240.细胞密度分析。
241.免疫染色后,将小鼠脑的切片通过z-stack和olympus fv-1000的平铺功能用40
×
油透镜成像。将z-stack的范围设置为5层,其中安装切片的中心面周围的步长大小为1.5μm。在每个切片中,在损伤核心或损伤周围区域内选择3个正方形的z-stack图像(分辨率:512
×
512,0.621μm/像素)以进行量化。
242.细胞转化和亚型比率分析。
243.选择了三个在损伤和感染范围内的切片。一个切片靠近损伤和感染的中心。其它两个切片相对地位于感染区域前半部或后半部的中间位置。每个脑切片的单层共焦图像通过olympus fv-1000用40
×
油透镜进行量化。
244.数据分析和统计
245.prism 6graphpad软件用于统计分析和条形图。
246.为了比较两个数据集,进行了斯图登氏t检验(student’s t-test)。为了比较3个数据集,进行单向或双向方差分析(anova),随后进行事后检验。将统计显著性设定为p《0.05。数据表示为平均值
±
sem。
247.结果
248.局灶性闭锁性头部损伤模型的建立和损伤部位中神经元和胶质细胞的病理学。
249.在此实例中,如在图1a左图中图解地示出,电磁控制装置leica impactor one用于将精确控制的chi(一种类型的tbi)诱导到小鼠运动皮层上方暴露的颅骨上,参见图1a右图。
250.chi后,在不同时间点研究病理结果,参见图1b。病理学的研究集中在星形胶质细胞和神经元。初步实验证明,在模型中,chi后的原发性和继发性脑损伤主要集中位于冲击部位下方。
251.图2a、2b和2c证明了chi后损伤部位处的神经元死亡和变性。
252.如在图2a中所示出的,靠近冲击中心的3个脑区域被视为损伤核心,主要位于由虚线所限定的最小半圆区域内。损伤核心紧挨的5个区域被视为损伤周围区域,主要位于由虚线所限定的较大半圆形区域内。虚线所限定的虚线矩形框内的所有区域被视为用于分析的所关注的区域(roi)。
253.与假tbi组相比,在损伤后第7天、第14天和第28天,neun信号明显减少,并且gfap
信号显著增加,参见图1c。对损伤部位、对侧和假tbi对照的neun+或gfap+细胞的密度进行量化。结果表明,与假tbi组相比,损伤侧和对侧的neun+细胞较少,参见图1d和图1e,而gfap+细胞较多,参见图1f。损伤核心经历了最严重的神经元损失,参见图1d,这表明chi后存在神经元死亡和星形胶质细胞再激活。
254.为了确认chi后损伤核心周围的神经元死亡,收集并测定了chi后早期时间点,如损伤后第6个小时和第4天的脑样品,以检测细胞凋亡的生物标志物-末端脱氧核苷酸转移酶dutp缺口末端标记tunel。结果示出,在靠近损伤核心的浅层中,许多神经元具有强的tunel和混乱的neun信号,从而指示其是垂死细胞。进一步地,即使在损伤区域下方的深层中,与其它相邻神经元相比,一些神经元也示出了累积的tunel信号和微弱的neun信号,参见图2b。基于其形态,这些细胞可能是深皮层中的锥体神经元。因此,在机械力引起的原发性损伤或随后的继发性损伤中,chi会破坏细胞并诱导凋亡。在其它脑区域中,像远离冲击部位的同一半球中的区域或对侧,未检测到tunel信号。
255.为了进一步研究chi对神经元突起的影响,对来自chi后1周的动物的脑样品进行免疫染色以检测髓鞘碱性蛋白(mbp)和高(200kd)分子量神经丝蛋白(nf200)。这两种标志物均表示神经元突起的形态并且反映了皮层的健康状态。通过比较损伤侧与对侧,在损伤侧发现了许多具有强烈mbp信号的扩大轴突末梢,参见图2c,顶部图像),这可以表示形成“回缩球”的损伤轴突。nf200染色还指示chi导致冲击部位周围的细胞骨架断裂,参见图2c,中间图像。这与其它tbi模型中的结果一致。
256.与非损伤侧或假组相比,随着神经元变性,损伤核心周围的星形胶质细胞变得极具反应性,参见图1c和图1f。进一步地,通过在chi后的不同时间点对细胞增殖标志物ki67进行染色,发现星形胶质细胞的增殖率在损伤后第4天达到峰值并且在损伤后第7天停止,参见图1g和图1h。通过iba1染色标志的小胶质细胞群,参见图1g,在损伤后第1天似乎具有较早达到峰值的增殖曲线,参见图1h。
257.在小鼠新皮层闭锁性头部损伤后,通过neurod1在原位进行星形胶质细胞到神经元的转化。
258.为了向小鼠皮层星形胶质细胞提供外源性neurod1,构建了aav载体,重组血清型aav9以在人gfap启动子的直接控制下在小鼠皮层星形胶质细胞中表达neurod1与作为表达的指标的增强型绿色荧光蛋白(gfp),所述构建体被命名为hgfap::neurod1-p2a-gfp(也称为(aav)gfap::nd1-gfp)。图3a、3b、3c、3d、3e、3f、3g和3h示出了在小鼠新皮层闭锁性头部损伤后,通过neurod1(nd1)在原位进行星形胶质细胞到神经元的转化。
259.如在图3a和图3b中图解地示出,在chi后第7天,将表达neurod1的aav表达载体(aav)gfap::nd1-gfp或对照表达载体(aav)gfap::gfp注射到损伤部位中。在施用这些载体后,对细胞进行检查以确定哪些细胞被每种病毒感染以及哪些细胞在gfap启动子的控制下表达经编码的基因。图3c是一组示出了在注射aav-gfap::gfp病毒(对照组,左图)或注射aav-gfap::nd1-gfp病毒(nd1组,右图)后第7天的损伤的皮层的代表性图像。
260.通过将gfp荧光与病毒注射后第7天的对照组的脑样品中的不同细胞亚型标志物的免疫染色进行比较,确定了经标记的星形胶质细胞(gfap)、少突胶质细胞(olig2)、小胶质细胞(iba1)、神经元(neun)以及干细胞(dcx)的百分比,参见图3d。结果表明,大多数表达gfp的细胞是星形胶质细胞,一些是少突胶质细胞,少数是神经元,极少数是小胶质细胞并
且几乎没有干细胞,参见图3g。这证实了nd1组中经转化的神经元来源于星形胶质细胞。此时,nd1组中的大多数gfp+细胞仍然是具有gfap的胶质细胞,参见图3e-2。然而,neurod1染色表明这些细胞内部具有高表达的neurod1,参见图3e,这是与对照的根本区别。
261.在多个时间点,如病毒注射后的第4/7/14/28天,对来自“nd1组”中的动物(即注射了(aav)gfap::nd1-gfp的动物)的脑样品进行分析,以示出星形胶质细胞到神经元转化的过程。在非常早期的时间点,如注射后第4天(dpi),几乎所有的gfp+细胞都是gfap+和neun-,通过免疫染色没有可见的neurod1(nd1)表达,参见图3f-第4天,即4dpi)。然而,一些星形胶质细胞在此时间点开始转化。约5%的gfp+细胞具有neun信号。其中一些甚至在同一时间仍具有gfap信号,这被称为过渡阶段,参见图4a。图4a、4b、4c和4d示出了星形胶质细胞到神经元的转化的过渡阶段,经转化的神经元的成熟,以及由携带neurod1的逆转录病毒所诱导的转化。之后随着更多的nd1在细胞内累积,参见图3f-第7天,即7dpi,越来越多的gfp+细胞失去星形细胞标志物(gfap)并获得神经元标志物(neun),参见图3f和图3h。对来自nd1组中的动物的脑切片进行未成熟神经元标志物tuj1和成熟神经元标志物map2的共免疫染色,参见图4b。大多数经转化的神经元在早期时间点示出了较高的tuj1和较低的map2,但在后期时间点示出了较低的tuj1和较高的map2。这可能反映了经转化的神经元将经历一个成熟过程,这可能与神经干细胞的发育阶段相似。
262.进一步地,使用逆转录病毒载体证实了星形胶质细胞到神经元的转化,所述逆转录病毒载体将特异性地感染分裂细胞并且可以排除泄漏问题。构建质粒以在cag启动子的控制下表达nd1,如先前在guo等人,《细胞干细胞》,14:188-202(2014)所描述的。在注射逆转录病毒七天后,与仅表达gfp的对照相比,在“nd1逆转录病毒”组中施用表达nd1和gfp的逆转录病毒的小鼠的脑中发现了许多具有神经元形态的neun+和gfp+细胞,参见图4c和图4d。
263.经转化的神经元可以发育成具有皮层特性的不同亚型。
264.在已经示出胶质细胞转化为神经元后,研究了经转化的神经元是否获得与内源性神经元相同的分子谱。对于此项研究,对细胞进行免疫染色以检测前脑标志物叉头框-g1(foxg1)和前脑神经元标志物t-脑-1(tbr1)。在小鼠脑中,foxg1是一种广泛分布于来源于端脑所有区域的转录因子。tbr1参与小鼠的神经元分化和迁移,特别是在谷氨酸能神经元中。图5a、5b、5c和5d示出了经转换的神经元可以获得与局部微环境一致的皮层特性。
265.结果示出了几乎所有经转化的神经元都是foxg1+(88.0%
±
6.0%,n=3只小鼠),并且大多数经转化的神经元是tbr1+(59.9%
±
10.0%,n=3只小鼠),参见图5a和图5d。进一步地,对细胞进行免疫染色以检测皮层浅层标志物cux1和深层标志物ctip2,参见图5b和图5c。在nd1处理后,这两个标志物仍具有与未损伤的皮层相同的分布,参见图5b和图5c。总共有24.6%
±
6.8%的gfp+和neun+细胞示出了cux1信号的共定位。在ctip2的情况下,共定位百分比为11.0%
±
1.5%,参见图5d。
266.分析经转化的神经元以确定其是兴奋性神经元还是抑制性神经元。图6a、6b和6c示出了经转化的神经元可以分化成不同的亚型。
267.通过共免疫染色检测gaba和gad67,确定了23.6%
±
3.5%的gfp+和neun+细胞对gaba和gad67两者均呈免疫阳性,参见图6a和图6c。通过免疫染色检测主要的gaba能神经元标志物,如小清蛋白(pv)、钙网膜蛋白(cr)、神经肽y(npy)、生长抑素(sst)、胆碱乙酰化转
移酶(chat)和酪氨酸羟化酶(th)来进行另外的研究以确定经转化的gaba能神经元的亚型,参见图6b。之前的研究示出了正常小鼠皮层主要有pv、cr、npy和sst,没有chat或th。在此实例中,量化示出了pv+经转化的神经元的百分比达到了19.2%
±
2.3%,cr+达到了9.1%
±
0.7%,npy+达到了7.8%
±
1.1%,sst+达到了5.3%
±
3.3%,参见图6c。在与chat或th共定位的皮层中未发现经转化的神经元。总之,这些结果指示经转化的神经元分化成与局部微环境一致的不同的亚型。
268.经转化的神经元在功能上是成熟的。
269.作为脑神经网络的基本功能单元,每个单个神经元均通过接收、整合和传输电信号来发挥作用。因此,在病毒注射后第4周,研究了经转化的神经元的电生理学特性。图7a、7b、7c、7d、7e、7f和7g示出了经nd1转化的神经元在功能上是成熟的。
270.通过全细胞记录评估了经转化的神经元发放动作电位(ap)的能力,并通过注射生物素的免疫染色评估了经转化的神经元的形态。发现了三种主要的发放ap模式以及不同的形态,参见图7a和图7b。第一种模式代表了约60%的记录的gfp+神经元,参见图7c。结合具有第一种发放模式的神经元的代表性形态,参见图7a,这些神经元可能是皮层中的pv+中间神经元。模式2代表了约20%的经转化的神经元,这些神经元可能是其它中间神经元。具有模式3的经转化的神经元明显是锥体神经元。其具有长的尖端树突延伸到浅层,并且具有规则的ap发放模式,参见图7a和图7b。
271.然后研究经转化的神经元的另外的电生理特性,包含自发兴奋性突触后电流(sepsc)和自发抑制性突触后电流(sipsc)。经转化的神经元中的sepsc/sipsc被认为反映了细胞能够从局部神经网络接收兴奋性/抑制性刺激并给予反馈。在nd1处理后第4周,在大多数修补的gfp+神经元中记录sepsc和sipsc,分别参见图7d和图7e。比较nd1组与对照gfp病毒组之间sepsc/sipsc的振幅和频率。nd1组与对照gfp病毒组之间的sepsc振幅存在显著差异(p《0.001),其分别为13.3
±
1.1pa和7.4
±
0.6pa,参见图7f。nd1中的sepsc的频率为6.0
±
1.0hz并且对照组中的sepsc的频率为2.6
±
0.4hz,其中nd1组与对照组之间存在显著差异(p=0.01),参见图7f。在sipsc方面,两组之间的振幅(nd1:19.4
±
1.8pa,对照:20.4
±
2.4pa)和频率(nd1:1.2
±
0.3hz,对照:1.0
±
0.2hz)均无显著差异,参见图7g。由于sepsc在经转化的神经元与对照之间示出了明显差异,因此在更多时间点,包含病毒注射后的第1周、第2周、第4周和第8周(注射后周,wpi),对经转化的神经元的电生理学特性进行评估,并与对照进行比较。经转化的神经元中的sepsc的频率在早期时间点(1wpi、2wpi和4wpi)较高,然后在8wpi时下降,参见图8a。sepsc的振幅在1wpi时较低,然后在2wpi和4wpi时升高,并且然后在8wpi时下降,参见图8b。在随后的时间点,8wpi时,sepsc的频率和振幅两者与对照相当,参见图8a和图8b。sepsc的频率反映了其它神经元对经转化的神经元的兴奋性神经支配的强度。sepsc的振幅可以由经转化的神经元的突触后膜上的谷氨酸受体的密度决定。这些结果指示经转化的神经元经历了类似于神经干细胞中发生的结构和功能成熟过程。
272.经转化的神经元可以整合到局部神经网络中
273.基于对经转化的神经元的功能分析,其能够与局部神经网络中的其它神经元,包含内源性神经元和其它经转化的神经元进行通信。因此,对细胞进行免疫染色以检测突触标志物:指示兴奋性突触的vglut1、指示抑制性突触的vgat以及指示突触传递的突触素(sp1)和突触小泡蛋白(sv2)。图9a、9b、9c、9d、9e、9f和9h示出了经nd1转化的神经元整合到
本地和远程神经网络中。
274.在4wpi时,发现相当多的经转化的神经元在胞体上具有vglut1或vgat斑点,这表明其可以接收来自其它神经元的兴奋性或抑制性输入,参见图9a。进一步地,经转化的神经元在胞体内具有sp1和sv2的表达,特别是位于膜旁边,这指示了与其它神经元进行突触传递的能力,参见图9b。
275.接下来,在动物在轮子上奔跑后1小时,在小鼠运动皮层中进行cfos免疫染色以检查经转化的神经元是否参与运动功能。成像数据示出了一些经转化的神经元具有高cfos表达,这与周围的内源性神经元相当,参见图9c。
276.众所周知,神经元不仅接收来自周围其它神经元的神经投射,还接收来自远程上游脑区域中的神经元的神经投射。为了进一步研究经转化的神经元是否建立了这些远程神经连接,进行了顺行和逆行追踪。
277.对于顺行追踪,将病毒aav突触蛋白::cre+aav-cag::flexmcherry(标记神经元)注射到小鼠丘脑中以可视化其轴突投射,参见图9d。一周后,经转化的神经元周围的神经投射和突触扣结被可视化。发现许多经转化的神经元在其胞体上的突触扣结增大,这不仅示出了顺行追踪标志物的信号,还示出了gfp的信号,参见图9e和图9f,从而证明了这些神经元可以接收来自远程丘脑神经元的神经支配和来自其它经转化的神经元的局部神经支配两者。
278.对于逆行追踪,在损伤运动皮层的对侧注射缀合有荧光团的霍乱毒素b亚单位(ctb-647),参见图8c。七天后,收集并检查了小鼠脑,揭示了在损伤侧中一些经转化的神经元的胞体内具有ctb-647,参见图9g。这指示与内源性神经元一样,经转化的神经元也向下游脑区域发送遥远的神经投射。这些实验在不同的时间点重复,包含nd1病毒注射后的第14天、第28天和第42天。通过分析成像数据,计算了经转化的神经元内的ctb-647的平均信号强度,参见图9h。对于绝对ctb-647信号强度,gfp+神经元(第14天:185
±
17,第28天:249
±
45,第42天:353
±
50,p=0.01)中存在显著差异,但gfp+胶质细胞在不同时间点(第14天:180
±
61,第28天:131
±
15,第42天:150
±
71,p=0.81)不存在显著差异。以gfp+胶质细胞中的ctb-647信号为背景,计算gfp+神经元中的相对ctb-647信号强度,其在第14天为1.0
±
0.1,在第28天为1.9
±
0.3并且在第42天为2.3
±
0.3,显著性差异为p=0.004。结果反映了随着时间的推移,从经转化的神经元到其下游脑区域的神经支配强度增加。
279.图8d是一组展示在对侧注射neurod1病毒和注射ctb-647后第7天在经转化的神经元的胞体中突触标志物(vgat)与gfp和neun的共定位的图像;在胞体上也观察到来自对侧的ctb信号。
280.图8e是一组展示在对侧注射neurod1病毒和注射ctb-647后第7天在经转化的神经元的胞体中突触小泡标志物(sv2)与gfp和neun的共定位的图像;在胞体上也观察到来自对侧的ctb信号。
281.实施例
282.实施例1.一种治疗创伤性脑损伤(tbi)的方法,所述方法包括通过向受试者的脑的受损区域中的至少一个反应性星形胶质细胞提供外源性神经源性分化因子1(neurod1)来将反应性星形胶质细胞转化为功能神经元。
283.实施例2.根据实施例1所述的方法,其中所述tbi是闭锁性头部损伤。
284.实施例3.根据实施例1或2所述的方法,其中由于所述tbi,所述脑的所述受损区域包括非功能神经元和反应性星形胶质细胞。
285.实施例4.根据实施例3所述的方法,其中所述非功能神经元选自由死亡神经元和垂死神经元组成的组。
286.实施例5.根据实施例3或4所述的方法,其中所述非功能神经元是通过功能mri(fmri)检测的。
287.实施例6.根据实施例3到5中任一项所述的方法,其中所述受损区域中的非功能神经元和反应性星形胶质细胞的存在的主要原因不是所述受损区域中的出血。
288.实施例7.根据实施例3到6中任一项所述的方法,其中所述受损区域中的非功能神经元和反应性星形胶质细胞的存在的主要原因不是所述受损区域中的缺血。
289.实施例8.根据实施例1到7中任一项所述的方法,其中提供所述外源性neurod1包括向所述受试者施用重组表达载体,其中所述重组表达载体包括编码neurod1的核酸序列。
290.实施例9.根据实施例1到7中任一项所述的方法,其中提供所述外源性neurod1包括向所述受试者施用重组表达载体,其中所述重组表达载体是包括编码neurod1的核酸序列的病毒表达载体。
291.实施例10.根据实施例1到8中任一项所述的方法,其中提供所述外源性neurod1包括向所述受试者施用重组表达载体,其中所述重组表达载体是重组腺相关病毒表达载体,并且其中所述重组腺相关病毒载体包括编码neurod1的核酸序列。
292.实施例11.根据实施例8到10中任一项所述的方法,其中所述编码neurod1的核酸序列与启动子可操作地连接。
293.实施例12.根据实施例11所述的方法,其中所述启动子是胶质细胞特异性启动子。
294.实施例13.根据实施例12所述的方法,其中所述胶质细胞特异性启动子是胶质纤维酸性蛋白(gfap)启动子。
295.实施例14.根据实施例13所述的方法,其中所述gfap启动子是人gfap(hgfp)启动子。
296.实施例15.根据实施例1到14中任一项所述的方法,其中除neurod1外,没有向所述至少一个反应性星形胶质细胞提供外源性转录因子。
297.实施例16.根据实施例1到15中任一项所述的方法,其中所述受试者是人类。
298.实施例17.根据实施例1到16中任一项所述的方法,其中提供所述外源性neurod1包括在所述创伤性脑损伤后约两天到约十天范围内的第一治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
299.实施例18.根据实施例1到17中任一项所述的方法,其中所述创伤性脑损伤引起所述受损区域中一定时间段的星形胶质细胞增生,并且其中提供所述外源性neurod1包括在所述星形胶质细胞增生时间段期间或在所述星形胶质细胞增生时间段后4周内的第一治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
300.实施例19.根据实施例18所述的方法,其中提供所述外源性neurod1包括在所述第一治疗时间之后且在所述星形胶质细胞增生时间段期间或在所述星形胶质细胞增生时间段后4周内的第二治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
301.实施例20.根据实施例19所述的方法,其中提供所述外源性neurod1包括在所述第
二治疗时间之后且在所述星形胶质细胞增生时间段间或在所述星形胶质细胞增生时间段后4周内的第三治疗时间向所述至少一个反应性星形胶质细胞提供外源性neurod1。
302.实施例21.根据实施例1到20中任一项所述的方法,其中所述neurod1包括选自由以下组成的组的氨基酸序列:seq id no:2、seq id no:4、seq id no:2的功能片段、seq id no:4的功能片段、与seq id no:2具有至少85%同一性的氨基酸序列以及与seq id no:4具有至少85%同一性的氨基酸序列。
303.实施例22.根据实施例21所述的方法,其中所述neurod1由包括seq id no:1的核酸序列、与seq id no:1具有至少85%同一性的核酸序列、包括seq id no:3的核酸序列或者与seq id no:3具有至少85%同一性的核酸序列编码。
304.实施例23.根据实施例1到22中任一项所述的方法,其中提供所述外源性neurod1包括注射到所述脑的所述受损区域中。
305.实施例24.根据实施例8到23中任一项所述的方法,其中所述编码neurod1的核酸序列存在于病毒颗粒中。
306.实施例25.根据实施例24所述的方法,其中提供所述外源性neurod1包括向所述受试者的所述受损脑区域施用约107到约10
14
个病毒颗粒。
307.实施例26.一种包括神经源性分化因子1(neurod1)的组合物在制造药物中的用途,所述药物用于在受试者的脑的受损区域中将反应性星形胶质细胞转化为功能神经元,其中由于创伤性脑损伤(tbi),所述脑的所述受损区域包括非功能神经元和反应性星形胶质细胞。
308.实施例27.根据实施例26所述的用途,其中所述非功能神经元选自由死亡神经元和垂死神经元组成的组。
309.实施例28.根据实施例26或27所述的用途,其中所述创伤性脑损伤是闭锁性头部损伤。
310.实施例29.根据实施例26到28中任一项所述的用途,其中所述neurod1由包括与seq id no:1具有至少85%同一性的核酸序列的核酸序列编码。
311.实施例30.根据实施例26到29中任一项所述的用途,其中所述编码neurod1的核酸包括与seq id no:3具有至少85%同一性的核酸序列。
312.实施例31.根据实施例26到30中任一项所述的用途,其中所述neurod1包括选自由以下组成的组的氨基酸序列:seq id no:2、seq id no:4、seq id no:2的功能片段、seq id no:4的功能片段、与seq id no:2具有至少85%同一性的氨基酸序列以及与seq id no:4具有至少85%同一性的氨基酸序列。
313.序列
314.seq id no:1-编码人neurod1蛋白的人neurod1核酸序列-1071个核苷酸,包含终止密码子
[0315][0316]
seq id no:2-由seq id no::1编码的人neurod1氨基酸序列-356个氨基酸
[0317][0318]
seq id no:3-编码小鼠neurod1蛋白的小鼠neurod1核酸序列-1074个核苷酸,包含终止密码子
[0319][0320]
seq id no:4-由seq id no::3编码的小鼠neurod1氨基酸序列-357个氨基酸
[0321][0322]
seq id no:5-lcn2启动子
[0323]
[0324][0325]
seq id no:6-人gfap启动子
[0326][0327]
seq id no:7-小鼠aldh1l1启动子
[0328][0329]
seq id no:8-人ng2启动子
[0330]
[0331][0332]
seq id no:9-cag::neurod1-ires-gfp
[0333]
[0334]
[0335]
[0336]
[0337][0338]
本说明书中提到的任何专利或出版物均通过引用并入本文,其程度如同每个单独的出版物被具体且单独地指示通过引用并入。
[0339]
本文所述的组合物和方法目前是优选实施例的代表,是示例性的而不意欲作为对本发明范围的限制。本领域的技术人员将想到其中的变化和其它用途。可以在不脱离如在权利要求书中所示的本发明范围的情况下进行此类改变和其它用途。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1