用于疼痛疾患的米氮平和替扎尼定组合的制作方法
用于疼痛疾患的米氮平和替扎尼定组合
1.本发明涉及化学和制药行业以及医药,并且涉及包含米氮平和替扎尼定或其药学上可接受的盐的药物组合用于治疗疼痛疾患的新用途,所述新用途的特征在于米氮平的日剂量范围为15至60mg,并且替扎尼定的日剂量范围为6至24mg;本发明还涉及包含米氮平和替扎尼定的所述组合以及至少一种药学上可接受的载体的药物组合物,以及涉及用于治疗疼痛疾患的方法。
2.疼痛是各种专科医生在日常实践中最常遇到的主诉。
3.各种制剂用于治疗和预防疼痛综合征,诸如:
[0004]-影响前列腺素合成的制剂(非麻醉性镇痛药、对乙酰氨基酚、非甾体抗炎药-nsaid)
[0005]-用于降低p物质浓度的制剂(基于辣椒的局部制剂
–
辣椒素,辣椒辣素(capsin)等);
[0006]-局部麻醉剂;
[0007]-阿片类药;
[0008]-作用于gaba能(gabaergic)结构的制剂,诸如巴氯芬、松得乐(sirdalud)、加巴喷丁;
[0009]-抗惊厥药(卡马西平、丙基戊酸类(valproates)、苯二氮卓类药物等);
[0010]-α-2肾上腺素能受体激动剂;
[0011]-血清素再摄取抑制剂,例如阿米替林;
[0012]-抗抑郁药。
[0013]
为了开发更有效的疼痛消除和预防方法,人们尝试将各组制剂组合。然而,到目前为止,仅发现了少数此类组合。特别地,在组合作用期间这是与各种副作用的发展相关联的。
[0014]
存在用于治疗头痛的已知组合,其包含对乙酰氨基酚或非甾体抗炎药(nsaid)或其药学上可接受的盐或溶剂化物和米氮平或其药学上可接受的盐或溶剂化物,任选地与一种或多种药学上可接受的载体组合[1]。该方案适用范围较窄,即旨在用于治疗头痛。
[0015]
已知包含米氮平和唑尼沙胺的组合,其用于治疗疾患,诸如抑郁、精神分裂症、焦虑症、睡眠相关呼吸障碍、失眠、偏头痛、慢性tth、潮热、腰痛;神经性疼痛和功能性躯体综合征[8]。在这些病例中,米氮平和唑尼沙胺组合用于减少米氮平的一种或多种副作用,诸如白天过度嗜睡、镇静和体重增加。
[0016]
然而,唑尼沙胺具有典型的各种不良反应,诸如肝酶水平短暂升高、体重变化、血液系统疾患、神经/精神疾患(诸如失眠、激动和易怒)、泌尿系统和心血管系统的不利作用[3],这在治疗与痛性肌痉挛或骨骼肌痉挛相关的疼痛疾患中几乎是不可接受的。
[0017]
米氮平是四环类抗抑郁药,主要表现出镇静作用。它是中枢神经系统中突触前α-2肾上腺素能受体的拮抗剂,并增强神经冲动的中枢去甲肾上腺素能和血清素能传递。并且血清素能传递仅通过血清素5-ht1受体增强,因为米氮平抑制血清素5-ht2受体和5-ht3受体。认为两种米氮平对映异构体均具有抗抑郁活性,s(+)对映异构体抑制α-2肾上腺素能受
体和血清素5-ht2受体,并且r(-)对映异构体抑制血清素5-ht3受体。米氮平的镇静特性取决于其对h1-组胺受体的拮抗活性。实际上,米氮平不具有m胆碱抑制活性,并且在治疗剂量下,对心血管系统的作用有限(例如,直立性低血压)。
[0018][0019]
米氮平公开于美国专利[4]。米氮平作用于两种神经递质系统的双重机制将其定义为去甲肾上腺素能和特异性血清素能抗抑郁药。由于其作用,米氮平能够相当快地中和焦虑表现,即使在治疗首日也是如此。现有数据有理由假设米氮平在治疗伴有焦虑和失眠的抑郁方面优于安慰剂。与安慰剂相比,接受米氮平的患者在研究的第1、2、4、6周和治疗结束时的焦虑症状显著减轻(p《0.05)。许多比较研究表明,在快速减轻焦虑症状方面,米氮平优于其他抗抑郁药,诸如西酞普兰、氟西汀、帕罗西汀[5]。
[0020]
已证明米氮平对治疗创伤后应激诱导疾患也有效。超过半数患者在接受医生询问和自我测试时表现出焦虑成分减少的积极动态。米氮平可有效治疗患有伴有广泛性焦虑疾患的抑郁。例如,一项为期8周的探索性研究显示抑郁和焦虑症状明显减少。米氮平的特定特征是它不抑制细胞色素p-450[6]。
[0021]
已知米氮平已在镇痛作用方面进行了研究,可用于治疗慢性神经性疼痛病症、紧张型头痛和其他疼痛疾患[7-11]。
[0022]
在疼痛综合征中,痛性痉挛可能发生在彼此基本不同的两个疾病组中:
[0023]
神经系统疾病;
[0024]
关节和脊柱的退行性营养不良性损伤,诸如骨软骨病、脊椎病、脊椎关节病、四肢关节病。
[0025]
上述两种病理彼此基本不同。在神经系统疾病期间,当引起疼痛刺激时,发生痛性肌痉挛或肌纤维的强直性张力。
[0026]
痛性肌痉挛疼痛的特点如下:
[0027]
它在痉挛的肌肉范围内具有局部特征;
[0028]
它是由受损肌肉的刺激引起的;
[0029]
在触诊肌纤维时发现剧烈疼痛;
[0030]
肌张力大。
[0031]
退行性营养不良性损伤疼痛或肌筋膜疼痛综合征的主要特征是:
[0032]
牵涉性或局部性疼痛总是远离痉挛的肌肉;
[0033]
触诊疼痛肌肉期间疼痛显著增强;
[0034]
急性弥漫性肌痉挛,其中包含起触发作用的硬结区域,当这些区域被按压时,肌肉和远离肌肉的地方出现非常强烈的疼痛[12]。
[0035]
存在仅作用于第一疾病组或第二疾病组(例如仅作用于cns疾病或结缔组织系统
疾病)的肌肉松弛剂。
[0036]
替扎尼定是中枢肌肉松弛剂。通过刺激突触前α-2受体,它抑制刺激n-甲基-d-天冬氨酸受体(nmda受体)的兴奋性氨基酸释放。因此,兴奋突触后传递在脊髓中间神经元水平受到抑制。由于正是这种机制导致过度肌张力,因此,当它被抑制时,肌张力减少。除了肌肉松弛特性外,替扎尼定还提供中枢适度明显的镇痛作用。
[0037][0038]
在脊柱和脑源性慢性痉挛病症的病例中,替扎尼定可放松骨骼肌,消除急性痛性肌痉挛和阵挛性惊厥。它降低被动运动时的肌抵抗并增强随意肌肉收缩的力量。
[0039]
肌肉松弛剂制剂降低病理性肌肉过度紧张。因此,疼痛减轻(可以打破“疼痛-肌痉挛-疼痛”的恶性循环),增加活动量。替扎尼定的使用剂量为4-6mg/天,可能逐渐增加至12mg/天。这种效应在治疗首周即显现[13]。肌肉松弛剂的使用不仅从活动的而且还从潜在的触发点释放肌肉,即通过减少肌筋膜疼痛综合征(mps)的复发来改善长期预后。
[0040]
已知一种组合,其包含浓度能有效实现治疗效果的α-2受体激动剂和浓度能有效增强α-2受体激动剂治疗效果的α-2肾上腺素能受体拮抗剂[14]。给药这种组合的病症可能是疼痛、高血压、青光眼。通过将α-2肾上腺素能受体激动剂与α-2肾上腺素能受体拮抗剂组合来增强α-2肾上腺素能受体激动剂的镇痛作用并减少其不利副作用的任务正在得到解决。同时,米氮平和替扎尼定在申请中仅作为大量的基本可能的α-2肾上腺素能受体激动剂和拮抗剂中的一部分;因此,该文件并未指导本领域技术人员选择确切地使用米氮平和替扎尼定作为α-2肾上腺素能受体拮抗剂和激动剂,并且,相应地,没有给本领域技术人员任何理由认为当选择米氮平作为α-2肾上腺素受体拮抗剂并且选择替扎尼定作为α-2肾上腺素受体激动剂时可以实现过度累积(协同)镇痛作用。相反,如该来源所提供的体内研究结果证实,仅在可乐定和阿替美唑的组合中存在镇痛特性(实施例3)。通过创建这种组合来解决的任务是防止副作用和对α-2肾上腺素能受体激动剂治疗的耐受性,诸如可乐定的镇静作用,以及由于使用超低剂量的α-2肾上腺素能受体拮抗剂引起的成瘾。以1:1000、1:10,000、1:100,000或1:1,000,000的定量比选取的包含α-2肾上腺素能受体拮抗剂和α-2肾上腺素能受体激动剂的具体实例被提供作为α-2肾上腺素能受体激动剂和超低剂量α-2肾上腺素能受体拮抗剂的组合的优选实例。
[0041]
本发明最接近的现有技术是用于治疗疼痛疾患的口服给药固体剂型的药物组合,其特征在于它包含5-50mg的米氮平、0.5-6mg的替扎尼定(它们的比率为20:1-5:1)和药学上可接受的载体[15]。该文件提供了一种用于预防和治疗疼痛疾患的有效药剂,患者对其耐受性良好。该药物组合以片剂形式提供,包含20mg的米氮平和1mg的替扎尼定(比率为20:1)。但是该来源未公开给药该组合的剂量。在本发明的框架内,当米氮平与替扎尼定联合使用(以另一定量比(即2.5:1)服用)时,出乎意料地提供了实现协同作用的可能性,并且这种作用优于依照原型的米氮平/替扎尼定比率实现的作用。
[0042]
在开始临床前和临床研究后,发明人出乎意料地发现,当米氮平的日剂量为15至60mg时,并且替扎尼定的每日剂量为6至24mg(比率为2.5:1)时,包含米氮平和替扎尼定或其药学上可接受的盐的药物组合或药物组合物的使用分别导致与痛性肌痉挛或骨骼肌痉挛有关的疼痛疾患的最有效治疗,减少所用组合组分的急性毒性及其成瘾性,有利于改善患有稳定型疼痛综合征的患者的生活质量,减轻疼痛感和伴随疼痛感的抑郁病症。本发明还扩大了具有组合(肌肉松弛剂和镇痛剂)效果的药剂的范围。
[0043]
本发明的目的是开发具有提高治疗和/或预防疼痛疾患的有效性的药剂,包括与痛性肌痉挛或骨骼肌痉挛有关的疼痛疾患,提供组合(肌肉松弛剂和镇痛剂)效果,具有增加的安全性和耐受性特征。技术效果如下:
[0044]-米氮平与替扎尼定联合使用时具有协同作用;
[0045]-提高安全性和耐受性;
[0046]-扩大提供组合(肌肉松弛剂和镇痛剂)效果的药剂的范围;
[0047]-改善稳定型疼痛综合征患者的生活质量。
[0048]
上述目的和技术效果的实现是由于使用用于治疗疼痛疾患的包含米氮平和替扎尼定或其药学上可接受的盐的药物组合或药物组合物,其特征在于,米氮平的日剂量为15至60mg,并且替扎尼定的日剂量为6至24mg,比率为2.5:1。
[0049]
根据优选的实施方式,上述技术效果的实现还由于以下:
[0050]-米氮平的日剂量为15至45mg,并且替扎尼定的日剂量为6至18mg;
[0051]-米氮平的日剂量为15至30mg,并且替扎尼定的日剂量为6至12mg;
[0052]-米氮平的日剂量为30至45mg,并且替扎尼定的日剂量为12至18mg;
[0053]-米氮平/替扎尼定重量比为2.5:1;
[0054]-米氮平的日剂量为60mg,并且替扎尼定的日剂量为24mg;
[0055]-米氮平的日剂量为45mg,并且替扎尼定的日剂量为18mg;
[0056]-米氮平的日剂量为30mg,并且替扎尼定的日剂量为12mg;
[0057]-米氮平的日剂量为15mg,并且替扎尼定的日剂量为6mg;
[0058]-药物组合以固体剂型提供,用于口服给药;
[0059]-用于口服给药的固体剂型包含至少一种佐剂;
[0060]-用于口服给药的固体剂型是片剂;
[0061]-片剂是双层片剂;
[0062]-双层片剂是长效片剂;
[0063]-双层片剂包括包含米氮平或其药学上可接受的盐的层,和包含替扎尼定或其药学上可接受的盐并具有替扎尼定延迟释放的层;
[0064]-提供替扎尼定延迟释放的包含替扎尼定或其药学上可接受的盐的层,包含聚合物缓释剂;并且该聚合物缓释剂是亲水性聚合物缓释剂;
[0065]-替扎尼定亲水性聚合物缓释剂可以是聚乙烯醇、聚乙烯吡咯烷酮、聚环氧乙烷、卡波姆、藻酸盐、丙烯酸或其酯的聚合物、纤维素衍生物或其混合物、甲基丙烯酸铵共聚物、羟丙基甲基纤维素、甲基纤维素、乙基纤维素或丙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基乙基纤维素、羧甲基纤维素、乙酸纤维素或邻苯二甲酸纤维素、羟丙基甲基纤维素邻苯二甲酸酯、乙酸纤维素琥珀酸酯或乙基纤维素琥珀酸酯;
[0066]-米氮平从米氮平层立即释放;
[0067]-替扎尼定延迟释放层包含6mg的替扎尼定,并且米氮平立即释放层包含15mg的米氮平;
[0068]-替扎尼定药学上可接受的盐是盐酸替扎尼定;
[0069]-替扎尼定延迟释放层还包含润滑剂;
[0070]-替扎尼定层包含0.5-30wt%的量的盐酸替扎尼定、0.5-99wt%的量的亲水性聚合物缓释剂和0.5-2.5wt%的量的润滑剂;
[0071]-替扎尼定层中的润滑剂选自硬脂酸及其盐,诸如硬脂酸钙和硬脂酸镁、滑石、胶体二氧化硅、硬脂富马酸钠及其混合物;
[0072]-米氮平层包含米氮平、填充剂、崩解剂和润滑剂;
[0073]-米氮平层包含5-35wt%的量的米氮平、70-95wt%的量的填充剂、1-10wt%的量的崩解剂和0.5-5wt%的量的润滑剂;
[0074]-米氮平层中的润滑剂选自硬脂酸及其盐,诸如硬脂酸钙和硬脂酸镁、滑石、胶体二氧化硅、硬脂富马酸钠及其混合物;
[0075]-填充剂选自甘露醇、山梨糖醇、异麦芽酮糖醇、微晶纤维素、淀粉、磷酸钙、碳酸钙、乳糖、蔗糖、葡萄糖、硅酸及其混合物;
[0076]-崩解剂选自交聚维酮、羧甲基纤维素钠、琼脂、碳酸钙、马铃薯、玉米、豌豆或木薯淀粉、海藻酸、复合硅酸盐、碳酸钠及其混合物;
[0077]-该组合还包含以0.5-5wt%的量的粘结剂,该粘结剂选自羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、阿拉伯胶及其混合物;替扎尼定层包含以下比率(wt%)的盐酸替扎尼定和赋形剂:
[0078]
盐酸替扎尼定(以替扎尼定计)-0.5-30;
[0079]
硬脂酸
–
0.5-2.0;
[0080]
羟丙基甲基纤维素
–
30.0-50.0;
[0081]
甲基丙烯酸铵共聚物
–
40.0-75.0;
[0082]
胶体二氧化硅
–
0.5-2.0。
[0083]-替扎尼定层包含以下比率(wt%)的盐酸替扎尼定和赋形剂:
[0084]
盐酸替扎尼定(以替扎尼定计)
–
3.81;
[0085]
硬脂酸
–
1.11;
[0086]
羟丙基甲基纤维素(k100m)-40.28;
[0087]
甲基丙烯酸铵共聚物,a型
–
20.835;
[0088]
甲基丙烯酸铵共聚物,b型
–
33.33;
[0089]
胶体二氧化硅(aerosil 200)
–
0.635。
[0090]-替扎尼定层通过直接压制生产;
[0091]-米氮平层包含以下比率(wt%)的米氮平和赋形剂:
[0092]
米氮平
–
1.0-35.0;
[0093]
甘露醇
–
20.0-40.0;
[0094]
微晶纤维素
–
40.0-60.0;
[0095]
聚乙烯吡咯烷酮
–
0.5-5.0;
[0096]
交聚维酮
–
0.5-5.0;
[0097]
胶体二氧化硅
–
0.5-2.5;
[0098]
硬脂酸镁
–
0.5-2.5;
[0099]-米氮平层包含以下比率(wt%)的米氮平和赋形剂:
[0100]
米氮平(微粉化)
–
10.0;
[0101]
甘露醇
–
33.13;
[0102]
微晶纤维素
–
51.34;
[0103]
聚乙烯吡咯烷酮(k30)
–
1.0;
[0104]
交聚维酮
–
3.0;
[0105]
胶体二氧化硅(aerosil 200)
–
0.53;
[0106]
硬脂酸镁
–
1.0;
[0107]-米氮平层通过湿法制粒生产;
[0108]-疼痛疾患是痛性肌痉挛或骨骼肌痉挛;
[0109]-痛性肌痉挛与静止性和功能性脊柱疾病有关;
[0110]-脊柱疾病是颈椎或腰椎综合征;
[0111]-痛性肌痉挛与手术干预有关;
[0112]-骨骼肌痉挛与神经系统疾病有关;
[0113]-神经系统疾病选自包括以下的组:多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫。
[0114]
进一步地,通过生产用于治疗疼痛疾患的药物组合物,达到设定的目的并实现技术效果,该药物组合物包含米氮平和替扎尼定或其药学上可接受的盐的组合以及至少一种药学上可接受的载体,以游离碱计,米氮平/替扎尼定的质量比为2.5:1,并且该药物组合物旨在以15至60mg的米氮平的日剂量和6至24mg的替扎尼定日剂量使用。
[0115]
用于治疗疼痛疾患的药物组合物,其包含米氮平和替扎尼定的组合,可以包含药学上可接受的佐剂。如本领域技术人员所知,根据假定的给药方法和剂型选择特定佐剂。合适的药物载体、填充剂和它们的组合物描述于例如:雷明顿:药学科学与实践1995,由e.w.martin编辑,mack出版公司,第19版,伊斯顿,宾夕法尼亚州。
[0116]
药学上可接受的佐剂可以选自由以下组成的组:药学上可接受的和药理学相容的填充剂、溶剂、稀释剂、载体、赋形剂和分配剂、递送剂(诸如防腐剂)、稳定剂、填充剂、崩解剂、润湿剂、乳化剂、悬浮剂、增稠剂、甜味剂、增味剂、芳香剂、抗菌剂、杀真菌剂、润滑剂、延长释放校正剂,其选择和比率取决于活性物质的类型、给药方法和剂量。悬浮剂的实例是乙氧基化异硬脂醇、聚氧乙烯、山梨糖醇和山梨糖醇酯、微晶纤维素、羟基氧化铝、膨润土、琼脂和黄芪胶,及其混合物。可以通过使用各种抗细菌剂和抗真菌剂诸如例如对羟基苯甲酸酯、氯丁醇、山梨酸和类似化合物来提供抗微生物保护。该组合物还可以包含等渗剂,例如糖、氯化钠等。使用减缓活性成分吸收的试剂可以确保组合物的延迟作用,诸如,例如,单硬脂酸铝、明胶、纤维素衍生物或亲水性聚合物缓释剂,该亲水性聚合物缓释剂是聚乙烯醇、聚乙烯吡咯烷酮、聚环氧乙烷、卡波姆、藻酸盐、丙烯酸或其酯的聚合物、纤维素衍生物或其混合物、甲基丙烯酸铵共聚物、羟丙基甲基纤维素、甲基纤维素、乙基纤维素或丙基纤维素、羟乙基纤维素羟丙基纤维素、羟丙基乙基纤维素、羧甲基纤维素、乙酸纤维素或邻苯二甲酸
纤维素、邻苯二甲酸羟丙基甲基纤维素、琥珀酸乙酸纤维素、琥珀酸乙基纤维素或其混合物。崩解剂可以选自交聚维酮,羧甲基纤维素钠,琼脂,碳酸钙,马铃薯、玉米、豌豆或木薯淀粉,海藻酸,复合硅酸盐,碳酸钠及其混合物。粘结剂可以选自羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、阿拉伯胶及其混合物。合适的载体、溶剂、稀释剂和递送剂的实例是水、乙醇、多元醇及其混合物、植物油(诸如橄榄油)和注射用有机酯(诸如油酸乙酯)。填充剂的实例是乳糖、蔗糖、葡萄糖、柠檬酸钠、碳酸钙、磷酸钙、微晶纤维素、甘露醇、淀粉、硅酸等。崩解剂和分配剂的实例是淀粉、海藻酸及其盐、硅酸盐。润滑剂的实例是硬脂酸镁、硬脂酸钙、硬脂酸、月桂基硫酸钠、滑石和高分子聚乙二醇、胶体二氧化硅、硬脂富马酸钠及其混合物。用于口服、舌下、经皮、肌内、静脉内、皮下、局部或直肠给药的活性成分(一种或与另一种活性成分组合)的药物组合物可以以标准给药形式(即与常规药物载体混合)向动物和人给药。合适的标准给药形式包括口服形式,诸如片剂,明胶胶囊,丸剂,散剂,颗粒剂,咀嚼胶和口服溶液或混悬剂,舌下和经颊给药形式,气雾剂,植入物,局部、经皮、皮下、肌内、静脉内、鼻内或眼内给药形式以及直肠给药形式。
[0117]
用于口服给药的固体剂型包括但不限于胶囊、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性成分与以下至少一种混合:(a)一种或多种惰性赋形剂(或载体),诸如两次取代的磷酸钙;(b)填充剂或稀释剂,诸如淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(c)粘结剂,诸如羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、蔗糖和阿拉伯胶;(d)润湿剂,诸如甘油;(e)崩解剂,诸如琼脂,碳酸钙,马铃薯、玉米或木薯淀粉,海藻酸,一些复合硅酸盐和碳酸钠;(f)稀释缓释剂,诸如石蜡,或亲水性聚合物缓释剂;(g)吸收促进剂,诸如季铵化合物;(h)润湿剂,诸如鲸蜡醇和单硬脂酸甘油酯;(i)吸附剂,诸如高岭土和膨润土;(j)润滑剂,诸如滑石、硬脂酸钙、硬脂酸镁、硬脂酸、固体聚乙二醇、十二烷基硫酸钠或其混合物。胶囊剂、片剂和丸剂的剂型还可以包含缓冲剂。
[0118]
根据优选的实施方式,所述技术效果的实现还由于以下:
[0119]-每日米氮平剂量为15至45mg,并且每日替扎尼定剂量为6至18mg;
[0120]-每日米氮平剂量为15至30mg,并且每日替扎尼定剂量为6至12mg;
[0121]-每日米氮平剂量为30至60mg,并且每日替扎尼定剂量为12至24mg;
[0122]-每日米氮平剂量为60mg,并且每日替扎尼定剂量为24mg;
[0123]-每日米氮平剂量为45mg,并且每日替扎尼定剂量为18mg;
[0124]-每日米氮平剂量为30mg,并且每日替扎尼定剂量为12mg;
[0125]-每日米氮平剂量为15mg,并且每日替扎尼定剂量为6mg;
[0126]-组合物以固体剂型生产,用于口服给药;
[0127]-用于口服给药的固体剂型是片剂;
[0128]-片剂是双层片剂;
[0129]-双层片剂是长效片剂;
[0130]-双层片剂包括包含米氮平的层,和具有替扎尼定延迟释放的包含替扎尼定的层;
[0131]-具有替扎尼定延迟释放的替扎尼定层包含替扎尼定或其药学上可接受的盐和聚合物缓释剂,该聚合物缓释剂是亲水性聚合物缓释剂;
[0132]-具有延迟释放替扎尼定的替扎尼定层还包含润滑剂;
[0133]-替扎尼定层包含0.5-30wt%的量的盐酸替扎尼定、0.5-99wt%的量的亲水性聚
合物缓释剂和0.5-2.5wt%的量的润滑剂;
[0134]-替扎尼定的药学上可接受的盐是盐酸盐;
[0135]-替扎尼定的亲水聚合物缓释剂可以是聚乙烯醇、聚乙烯吡咯烷酮、聚环氧乙烷、卡波姆、藻酸盐、丙烯酸或其酯的聚合物、纤维素衍生物或其混合物、甲基丙烯酸铵共聚物、羟丙基甲基纤维素、甲基纤维素、乙基纤维素或丙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基乙基纤维素、羧甲基纤维素、乙酸纤维素或邻苯二甲酸纤维素、羟丙基甲基纤维素邻苯二甲酸酯、乙酸纤维素琥珀酸酯、乙基纤维素琥珀酸酯或其混合物;
[0136]-替扎尼定层中的润滑剂选自硬脂酸及其盐,诸如硬脂酸钙和硬脂酸镁、滑石、胶体氧化硅、硬脂富马酸钠及其混合物;
[0137]-米氮平从米氮平层立即释放;
[0138]-米氮平层包含米氮平、填充剂、崩解剂和润滑剂;
[0139]-米氮平层包含5-35wt%的量的米氮平、70-95wt%的量的填充剂、1-10wt%的量的崩解剂和0.5-5wt%的量的润滑剂;
[0140]-米氮平层中的润滑剂选自硬脂酸及其盐,诸如硬脂酸钙和硬脂酸镁、滑石、胶体二氧化硅、硬脂富马酸钠及其混合物;
[0141]-填充剂选自甘露糖醇、山梨糖醇、异麦芽酮糖醇、微晶纤维素、淀粉、磷酸钙、碳酸钙、乳糖、蔗糖、葡萄糖、硅酸及其混合物;
[0142]-崩解剂选自交聚维酮、羧甲基纤维素钠、琼脂、碳酸钙、马铃薯、玉米、豌豆或木薯淀粉、海藻酸、复合硅酸盐、碳酸钠及其混合物;
[0143]-该组合物还包含以0.5-5wt%的量的粘结剂,该粘结剂选自羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、阿拉伯胶及其混合物;
[0144]-替扎尼定层包含以下比率(wt%)的盐酸替扎尼定和赋形剂:
[0145]
盐酸替扎尼定(以替扎尼定计)-0.5-30;
[0146]
硬脂酸
–
0.5-2.0;
[0147]
羟丙基甲基纤维素
–
30.0-50.0;
[0148]
甲基丙烯酸铵共聚物
–
40.0-75.0;
[0149]
胶体二氧化硅
–
0.5-2.0;
[0150]-替扎尼定层包含以下比率(wt%)的盐酸替扎尼定和赋形剂:
[0151]
盐酸替扎尼定(以替扎尼定计)
–
3.81;
[0152]
硬脂酸
–
1.11;
[0153]
羟丙基甲基纤维素
–
40.28;
[0154]
甲基丙烯酸铵共聚物
–
54.165;
[0155]
胶体二氧化硅
–
0.635。
[0156]-替扎尼定层通过直接压制生产;
[0157]-具有延迟释放的替扎尼定层包含6mg的替扎尼定;-米氮平层包含以下比率(wt%)的米氮平和赋形剂:
[0158]
米氮平
–
1.0-35.0;
[0159]
甘露醇
–
20.0-40.0;
[0160]
微晶纤维素
–
40.0-60.0;
[0161]
聚乙烯吡咯烷酮
–
0.5-5.0;
[0162]
交聚维酮
–
0.5-5.0;
[0163]
胶体二氧化硅
–
0.5-2.5;
[0164]
硬脂酸镁
–
0.5-2.5;
[0165]-米氮平层包含以下比率(wt%)的米氮平和赋形剂:
[0166]
米氮平
–
10.0;
[0167]
甘露醇
–
33.13;
[0168]
微晶纤维素
–
51.34;
[0169]
聚乙烯吡咯烷酮
–
1.0;
[0170]
交聚维酮
–
3.0;
[0171]
胶体二氧化硅
–
0.53;
[0172]
硬脂酸镁
–
1.0;
[0173]-米氮平层通过湿法制粒生产;
[0174]-具有立即释放的米氮平层包含15mg的米氮平;-该组合物旨在每天给药1-4次;
[0175]-该组合物旨在每天给药1-3次;
[0176]-该组合物旨在每天给药1-2次;
[0177]-该组合物旨在每天给药2-4次;
[0178]-替扎尼定的药学上可接受的盐是盐酸替扎尼定;
[0179]-替扎尼定层包含以下比率(wt%)的盐酸替扎尼定和赋形剂:
[0180]
盐酸替扎尼定(以替扎尼定计)
–
3.81;
[0181]
硬脂酸
–
1.11;
[0182]
羟丙基甲基纤维素(k100m)-40.28;
[0183]
甲基丙烯酸铵共聚物,a型
–
20.835;
[0184]
甲基丙烯酸铵共聚物,b型
–
33.33;
[0185]
胶体二氧化硅(aerosil 200)
–
0.635;
[0186]-替扎尼定层通过直接压制生产;
[0187]-米氮平层包含以下比率(wt%)的米氮平和赋形剂:
[0188]
米氮平(微粉化)
–
10.0;
[0189]
甘露醇
–
33.13;
[0190]
微晶纤维素
–
51.34;
[0191]
聚乙烯吡咯烷酮(k30)
–
1.0;
[0192]
交聚维酮
–
3.0;
[0193]
胶体二氧化硅(aerosil 200)
–
0.53;
[0194]
硬脂酸镁
–
1.0;
[0195]-米氮平层通过湿法制粒生产。
[0196]-疼痛疾患是痛性肌痉挛或骨骼肌痉挛;
[0197]-痛性肌痉挛与静止性和功能性脊柱疾病有关;
[0198]-脊柱疾病是颈椎或腰椎综合征;
[0199]-痛性肌痉挛与手术干预有关;
[0200]-骨骼肌痉挛与神经系统疾病有关;
[0201]-神经系统疾病可以选自包括多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫的组。
[0202]
通过生产用于治疗疼痛疾患的米氮平和替扎尼定或其药学上可接受的盐的药物组合,达到设定的目的并实现技术效果,以游离碱计,米氮平与替扎尼定的质量比为2.5:1,其特征在于,以游离碱计,米氮平以每天15至60mg的剂量使用,并且以游离碱计,替扎尼定以每天6至24mg的剂量使用。
[0203]
根据优选的实施方式,所述技术效果的实现还由于以下:
[0204]-米氮平的日剂量为15至45mg,并且替扎尼定的日剂量为6至
[0205]
18mg;
[0206]-米氮平的日剂量为15至30mg,并且替扎尼定的日剂量为6至
[0207]
12mg;
[0208]-米氮平的日剂量为45mg,并且替扎尼定的日剂量为18mg;
[0209]-米氮平的日剂量为60mg,并且替扎尼定的日剂量为24mg;
[0210]-米氮平的日剂量为30mg,并且替扎尼定的日剂量为12mg;
[0211]-米氮平的日剂量为15mg,并且替扎尼定的日剂量为6mg;
[0212]-药物组合以固体剂型生产,用于口服给药;
[0213]-用于口服给药的固体剂型包含至少一种佐剂;
[0214]-用于口服给药的固体剂型是片剂;
[0215]-片剂是双层片剂;
[0216]-双层片剂是长效片剂;
[0217]-双层片剂包括包含米氮平的层,和具有替扎尼定延迟释放的包含替扎尼定的层;
[0218]-米氮平从米氮平层立即释放;
[0219]-具有延迟释放的替扎尼定层包含6mg的替扎尼定,并且具有立即释放的米氮平层包含15mg的米氮平;
[0220]-替扎尼定的药学上可接受的盐是盐酸盐;
[0221]-具有延迟释放替扎尼定的替扎尼定层还包含润滑剂;
[0222]-替扎尼定层包含0.5-30wt%的量的盐酸替扎尼定、0.5-99wt%的量的亲水性聚合物缓释剂和0.5-2.5wt%的量的润滑剂;
[0223]-替扎尼定层中的润滑剂选自硬脂酸及其盐,诸如硬脂酸钙和硬脂酸镁、滑石、胶体二氧化硅、硬脂富马酸钠及其混合物;
[0224]-米氮平层包含米氮平、填充剂、崩解剂和润滑剂;
[0225]-米氮平层包含5-35wt%的量的米氮平、70-95wt%的量的填充剂、1-10wt%的量的崩解剂和0.5-5wt%的量的润滑剂;
[0226]-米氮平层中的润滑剂选自硬脂酸及其盐,诸如硬脂酸钙和硬脂酸镁、滑石、胶体二氧化硅、硬脂富马酸钠及其混合物;
[0227]-填充剂选自甘露糖醇、山梨糖醇、异麦芽酮糖醇、微晶纤维素、淀粉、磷酸钙、碳酸钙、乳糖、蔗糖、葡萄糖、硅酸及其混合物;
[0228]-崩解剂选自交聚维酮,羧甲基纤维素钠,琼脂,碳酸钙,马铃薯、玉米或木薯淀粉,
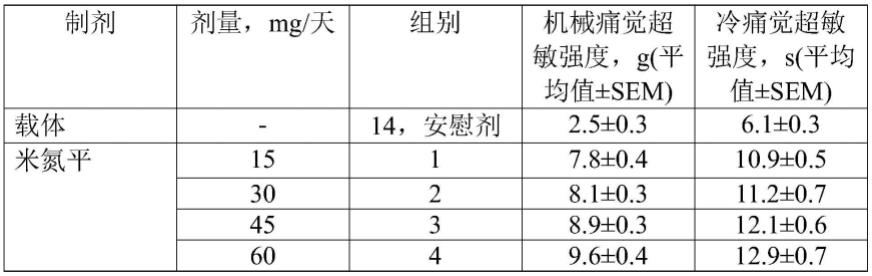
海藻酸,复合硅酸盐,碳酸钠及其混合物;
[0229]-该组合还包含以0.5-5wt%的量的粘结剂,该粘结剂选自羧甲基纤维素、藻酸盐、明胶、聚乙烯吡咯烷酮、阿拉伯胶及其混合物;
[0230]-替扎尼定层包含以下比率(wt%)的盐酸替扎尼定和赋形剂:
[0231]
盐酸替扎尼定(以替扎尼定计)-0.5-30;
[0232]
硬脂酸
–
0.5-2,0;
[0233]
羟丙基甲基纤维素
–
30.0-50.0;
[0234]
甲基丙烯酸铵共聚物
–
40.0-75.0;
[0235]
胶体二氧化硅
–
0.5-2.0;
[0236]-替扎尼定层包含以下比率(wt%)的盐酸替扎尼定和赋形剂:
[0237]
盐酸替扎尼定(以替扎尼定计)
–
3.81;
[0238]
硬脂酸
–
1.11;
[0239]
羟丙基甲基纤维素(k100m)-40.28;
[0240]
甲基丙烯酸铵共聚物,a型
–
20.835;
[0241]
甲基丙烯酸铵共聚物,b型
–
33.33;
[0242]
胶体二氧化硅(aerosil 200)
–
0.635;
[0243]-替扎尼定层通过直接压制生产;
[0244]-米氮平层包含以下比率(wt%)的米氮平和赋形剂:
[0245]
米氮平
–
1.0-35.0;
[0246]
甘露醇
–
20.0-40.0;
[0247]
微晶纤维素
–
40.0-60.0;
[0248]
聚乙烯吡咯烷酮
–
0.5-5.0;
[0249]
交聚维酮
–
0.5-5.0;
[0250]
胶体二氧化硅
–
0.5-2.5;
[0251]
硬脂酸镁
–
0.5-2.5;
[0252]-米氮平层包含以下比率(wt%)的米氮平和赋形剂:
[0253]
米氮平(微粉化)
–
10.0;
[0254]
甘露醇
–
33.13;
[0255]
微晶纤维素
–
51.34;
[0256]
聚乙烯吡咯烷酮(k30)
–
1.0;
[0257]
交聚维酮
–
3.0;
[0258]
胶体二氧化硅(aerosil 200)
–
0.53;
[0259]
硬脂酸镁
–
1.0;
[0260]-米氮平层通过湿法制粒生产;
[0261]-疼痛疾患是痛性肌痉挛或骨骼肌痉挛;
[0262]-痛性肌痉挛与静止性和功能性脊柱疾病有关;
[0263]-脊柱疾病是颈椎或腰椎综合征;
[0264]-痛性肌痉挛与手术干预有关;
[0265]-骨骼肌痉挛与神经系统疾病有关;
[0266]-神经系统疾病选自包括多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫的组。
[0267]
通过疼痛疾患的治疗方法也达到设定的目的并实现技术效果,该方法包括:使用包含米氮平和替扎尼定或其药学上可接受的盐的药物组合用于治疗疼痛疾患,该组合的特征在于,米氮平的日剂量为15至60mg,并且替扎尼定的日剂量为6至24mg;或向有需要的患者给药用于治疗疼痛疾患的药物组合物,该组合物包含米氮平和替扎尼定或其药学上可接受的盐的组合以及至少一种药学上可接受的载体,以游离碱计,米氮平与替扎尼定的质量比为2.5:1,并且旨在使用的米氮平的日剂量为15至60mg和替扎尼定的日剂量为6至24mg;或米氮平和替扎尼定或其药学上可接受的盐的药物组合用于治疗疼痛疾患,以游离碱计,米氮平与替扎尼定的质量比为2.5:1,该组合的特征在于以游离碱计,米氮平以每日15至60mg的剂量使用,并且以游离碱计,替扎尼定每日以6至24mg的剂量使用。
[0268]
包含米氮平和替扎尼定或其药学上可接受的盐的药物组合和旨在用于治疗疼痛疾患的临床剂量,或包含米氮平和替扎尼定或其药学上可接受的盐的组合以及根据本发明的至少一种药学上可接受的载体的药物组合物用于治疗疼痛疾患的临床剂量可以在患者中进行调整,这取决于治疗有效性和在体内的生物利用度、它们的代谢和从体内排泄的速度,以及取决于年龄、性别和患者的疾病阶段。根据医生或药剂师的指示,这些制剂可以在一定时间内服用数次(优选地,一次至四次)。
[0269]
以下提供了本发明说明书中使用的术语的定义。
[0270]
疼痛可以是多态性疾患。在本发明中,术语“疼痛”意指所有类型的疼痛,包括急性和持续性疼痛。优选地,但不限于,该术语意指慢性疼痛,但不限于:纤维肌痛、生长发育疾患、关节痛、癌症、颈椎痛、臂痛、脊柱痛、头痛、紧张型头痛、偏头痛、糖尿病性神经病、疱疹性神经痛、残端幻痛、中枢性疼痛、牙痛、内脏痛、手术操作疼痛、术后疼痛、骨源性疼痛、灼伤疼痛(包括日光灼伤)、泌尿生殖系统疼痛(包括膀胱炎)、扁桃体炎。
[0271]“药剂(药物)”意指制备成剂型的物质(或药物组合物形式的物质混合物),并且旨在用于恢复、纠正或改变人和动物的生理功能,以及用于治疗和预防疾病、诊断、麻醉、避孕、美容等。
[0272]“药物组合物”意指包含有效量的米氮平和替扎尼定或其药学上可接受的盐和选自由以下组成的组的至少一种组分的组合物:药学上可接受和药理学相容的填充剂、溶剂、稀释剂、载体、佐剂、递送溶媒(诸如防腐剂)、稳定剂、填充剂、润湿剂、乳化剂、悬浮剂、增稠剂、甜味剂、增味剂、芳香剂、抗菌剂、杀菌剂、延迟递送校正剂,其选择和比率取决于性质、给药方法和剂量。
[0273]“药学上可接受的盐”意指本发明要求保护的酸和碱的相对无毒的有机和无机盐。这些盐可以在化合物的合成、分离或提纯过程中原位制备,或特别生产。特别地,碱的盐可以特别地由要求保护的化合物的纯化游离碱和合适的有机或无机酸制备。由此生产的盐的实例是盐酸盐、氢溴酸盐、硫酸盐、硫酸氢盐、磷酸盐、硝酸盐、乙酸盐、草酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、硼酸盐、苯甲酸盐、乳酸盐、甲苯磺酸盐、柠檬酸盐、富马酸盐、琥珀酸盐、酒石酸盐、甲磺酸盐、丙二酸盐、水杨酸盐、丙酸盐、乙磺酸盐、苯磺酸盐、氨基磺酸盐等(这些盐的详细描述在[16]中提供)。要求保护的酸的盐也可以通过纯化的酸和合适的碱之间的反应来特别生产,其中可以合成金属和胺的盐。金属盐包括钠盐、钾盐、钙
盐、钡盐、锌盐、镁盐、锂盐和铝盐,最优选为钠盐和钾盐。适用于生产金属盐的无机碱是氢氧化钠、碳酸盐、碳酸氢盐和氢化物、氢氧化钾和碳酸氢盐、钾碱、氢氧化锂、氢氧化钙、氢氧化镁、氢氧化锌。作为适用于制备要求保护的酸的盐的有机碱,选择具有足以形成稳定盐的碱度并且适用于医疗目的的胺和氨基酸(特别是它们应该具有低毒性)。此类胺包括氨、甲胺、二甲胺、三甲胺、乙胺、二乙胺、三乙胺、苯胺、二苯胺、二环己胺、哌嗪、乙基哌啶、三(羟甲基)氨基甲烷等。此外,四烷基氢氧化铵,例如胆碱、四甲基铵、四乙基铵等。作为氨基酸,可以使用碱性氨基酸,诸如赖氨酸、鸟氨酸和精氨酸。
[0274]
术语“治疗有效量”意指活性物质的量,其(1)可以治疗或预防特定疾病、病症或疾患;(2)减轻、改善或消除特定疾病、病况或疾患的一种或多种症状,或(3)预防或延迟本说明书中描述的特定疾病、病症或疾患的一种或多种症状的发作。
[0275]
术语“药学上可接受的”意指使用该术语的给定物质或组合物,从化学和/或毒理学的角度来看,应与制剂中包括的其他成分相容,并且对接受该物质或组合物治疗的任何人均具有安全性。
[0276]
术语“包含(comprising、comprises)”意指所述组合、组合物和集合包括列出的组分,但不排除包括其他组分。
[0277]
本发明的主题是用于治疗疼痛疾患的药物组合物,其包含米氮平和替扎尼定或其药学上可接受的盐以及至少一种药学上可接受的载体,按游离碱计,米氮平与替扎尼定的质量比为2.5:1,即包含15至60mg的米氮平和6至24mg的替扎尼定。
[0278]
更优选的是特征在于替扎尼定的药学上可接受的盐是盐酸盐的药物组合物。
[0279]
更优选的是特征在于其包含15至45mg的米氮平和6至18mg的替扎尼定的药物组合物。
[0280]
更优选的是特征在于包含15至30mg的米氮平和6至12mg的替扎尼定的药物组合物。
[0281]
更优选的是特征在于包含30至45mg的米氮平和12至18mg的替扎尼定的药物组合物。
[0282]
更优选的是特征在于其包含60mg的米氮平和24mg的替扎尼定的药物组合物。
[0283]
更优选的是特征在于其包含45mg的米氮平和18mg的替扎尼定的药物组合物。
[0284]
更优选的是特征在于其包含30mg的米氮平和12mg的替扎尼定的药物组合物。
[0285]
更优选的是特征在于其包含15mg的米氮平和6mg的替扎尼定的药物组合物。
[0286]
更优选的是特征在于其包含至少一种佐剂的药物组合物。
[0287]
更优选的是特征在于疼痛疾患是痛性肌痉挛或骨骼肌痉挛的药物组合物。
[0288]
更优选的是特征在于痛性肌痉挛与静止性和功能性脊柱疾病有关的药物组合物。
[0289]
更优选的是特征在于脊柱疾病是颈椎或腰椎综合征的药物组合物。
[0290]
更优选的是特征在于痛性肌痉挛与手术干预有关的药物组合物。
[0291]
更优选的是特征在于骨骼肌痉挛与神经系统疾病有关的药物组合物。
[0292]
更优选的是特征在于神经系统疾病选自包括多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫的组的药物组合物。
[0293]
此外,本发明的主题是用于治疗疼痛疾患的药物组合,其包含米氮平和替扎尼定或其药学上可接受的盐以及至少一种药学上可接受的载体,按游离碱计,米氮平与替扎尼
定的质量比为2.5:1,即包含15至60mg的米氮平和6至24mg的替扎尼定。
[0294]
更优选的是特征在于替扎尼定的药学上可接受的盐是盐酸盐的药物组合。
[0295]
更优选的是特征在于其包含15至45mg的米氮平和6至18mg的替扎尼定的药物组合。
[0296]
更优选的是特征在于其包含15至30mg的米氮平和6至12mg的替扎尼定的药物组合。
[0297]
更优选的是特征在于包含30至45mg的米氮平和12至18mg的替扎尼定的药物组合。
[0298]
更优选的是特征在于其包含60mg的米氮平和24mg的替扎尼定的药物组合。
[0299]
更优选的是特征在于其包含45mg的米氮平和18mg的替扎尼定的药物组合。
[0300]
更优选的是特征在于其包含30mg的米氮平和12mg的替扎尼定的药物组合。
[0301]
更优选的是特征在于其包含15mg的米氮平和6mg的替扎尼定的药物组合。
[0302]
更优选的是特征在于其包含至少一种佐剂的药物组合。
[0303]
更优选的是特征在于疼痛疾患是痛性肌痉挛或骨骼肌痉挛的药物组合。
[0304]
更优选的是特征在于痛性肌痉挛与静止性和功能性脊柱疾病有关的药物组合。
[0305]
更优选的是特征在于脊柱疾病是颈椎或腰椎综合征的药物组合。
[0306]
更优选的是特征在于痛性肌痉挛与手术干预有关的药物组合。
[0307]
更优选的是特征在于骨骼肌痉挛与神经系统疾病有关的药物组合。
[0308]
更优选的是特征在于神经系统疾病选自包括多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫的组的药物组合。
[0309]
此外,本发明的主题是一种用于治疗疼痛疾患的药剂,该药剂包含本发明的药物组合物或本发明的药物组合和至少一种佐剂。
[0310]
更优选的是特征在于至少一种佐剂选自由以下组成的组的药剂:纤维素衍生物或其混合物,诸如甲基纤维素、乙基纤维素或丙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基乙基纤维素、羧甲基纤维素、乙酸纤维素或邻苯二甲酸纤维素、羟丙基甲基纤维素、羟丙基甲基纤维素邻苯二甲酸酯、乙酸琥珀酸纤维素、琥珀酸乙基纤维素和微晶纤维素、甲基丙烯酸铵共聚物、胶体二氧化硅、甘露醇、山梨糖醇、异麦芽酮糖醇、淀粉、磷酸钙、碳酸钙、乳糖、蔗糖、葡萄糖、硅酸、聚乙烯吡咯烷酮、交聚维酮、聚乙烯醇、聚环氧乙烷、卡波姆、藻酸盐、丙烯酸或其酯、硬脂酸及其盐(诸如硬脂酸钙和硬脂酸镁)的聚合物、滑石、硬脂富马酸钠。
[0311]
更优选的是特征在于每日米氮平剂量为15至45mg,并且每日替扎尼定剂量为6至18mg的药剂。
[0312]
更优选的是特征在于每日米氮平剂量为15至30mg,并且每日替扎尼定剂量为6至12mg的药剂。
[0313]
更优选的是特征在于每日米氮平剂量为30至60mg,并且每日替扎尼定剂量为12至24mg的药剂。
[0314]
更优选的是特征在于每日米氮平剂量为60mg,并且每日替扎尼定剂量为24mg的药剂。
[0315]
更优选的是特征在于每日米氮平剂量为45mg,并且每日替扎尼定剂量为18mg的药剂。
30.0-50.0;甲基丙烯酸铵共聚物-40.0-75.0;胶体二氧化硅-0.5-2.0。
[0337]
更优选的是特征在于替扎尼定层包含以以下比率(wt%)的盐酸替扎尼定和赋形剂的药剂:
[0338]
盐酸替扎尼定(以替扎尼定计)-3.81;硬脂酸-1.11;羟丙基甲基纤维素-40.28;甲基丙烯酸铵共聚物-54.165;胶体二氧化硅-0.635。
[0339]
更优选的是特征在于替扎尼定层通过直接压制生产的药剂。
[0340]
更优选的是特征在于具有延迟释放的替扎尼定层包含6mg替扎尼定的药剂。
[0341]
更优选的是特征在于米氮平层包含以以下比率(wt%)的米氮平和赋形剂的药剂:米氮平-1.0-35.0;甘露醇-20.0-40.0;
[0342]
微晶纤维素-40.0-60.0;聚乙烯吡咯烷酮-0.5-5.0;
[0343]
交聚维酮-0.5-5.0;
[0344]
胶体二氧化硅-0.5-2.5;
[0345]
硬脂酸镁-0.5-2.5。
[0346]
更优选的是特征在于米氮平层包含以以下比率(wt%)的米氮平和赋形剂的药剂:
[0347]
米氮平-10.0;
[0348]
甘露醇-33.13;
[0349]
微晶纤维素-51.34;
[0350]
聚乙烯吡咯烷酮-1.0;
[0351]
交聚维酮-3.0;
[0352]
胶体二氧化硅-0.53;
[0353]
硬脂酸镁
–
1.0。
[0354]
更优选的是特征在于米氮平层通过湿法制粒生产的药剂。
[0355]
更优选的是特征在于具有立即释放的米氮平层包含15mg米氮平的药剂。
[0356]
更优选的是特征在于疼痛疾患是痛性肌痉挛或骨骼肌痉挛的药剂。
[0357]
更优选的是特征在于痛性肌痉挛与静止性和功能性脊柱疾病有关的药剂。
[0358]
更优选的是特征在于脊柱疾病是颈椎或腰椎综合征的药剂。
[0359]
更优选的是特征在于痛性肌痉挛与手术干预有关的药剂。
[0360]
更优选的是特征在于骨骼肌痉挛与神经系统疾病有关的药剂。
[0361]
更优选的是特征在于神经系统疾病选自包括多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫的药剂。
[0362]
此外,本发明的主题是本发明的药物组合物、本发明的药物组合或本发明的药剂用于治疗疼痛疾患的用途,其特征在于,米氮平的日剂量为15至60mg和替扎尼定的剂量为6至24mg,它们的比率为2.5:1。
[0363]
更优选的是特征在于米氮平的日剂量为15至45mg和替扎尼定的日剂量为6至18mg的用途。
[0364]
更优选的是特征在于米氮平的日剂量为15至30mg和替扎尼定的日剂量为6至12mg的用途。
[0365]
更优选的是特征在于米氮平的日剂量为30至45mg和替扎尼定的日剂量为12至18mg的用途。
[0366]
更优选的是特征在于米氮平的日剂量为60mg和替扎尼定的日剂量为24mg的用途。
[0367]
更优选的是特征在于米氮平的日剂量为45mg并且替扎尼定的日剂量为18mg的用途。
[0368]
更优选的是特征在于米氮平的日剂量为30mg和替扎尼定的日剂量为12mg的用途。
[0369]
更优选的是特征在于米氮平的日剂量为15mg和替扎尼定的日剂量为6mg的用途。
[0370]
更优选的是特征在于疼痛疾患是痛性肌痉挛或骨骼肌痉挛的用途。
[0371]
更优选的是特征在于痛性肌痉挛与静止性和功能性脊柱疾病有关的用途。
[0372]
更优选的是特征在于脊柱疾病是颈椎或腰椎综合征的用途。
[0373]
更优选的是特征在于痛性肌痉挛与手术干预有关的用途。
[0374]
更优选的是特征在于骨骼肌痉挛与神经系统疾病有关的用途。
[0375]
更优选的是特征在于神经系统疾病选自包括多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫的组的用途。
[0376]
更优选的是特征在于上述药物组合物、药物组合物或药剂旨在每天给药1-4次的用途。
[0377]
更优选的是特征在于上述药物组合物、药物组合物或药剂旨在每天给药1-3次的用途。
[0378]
更优选的是特征在于上述药物组合物、药物组合物或药剂旨在每天给药1-2次的用途。
[0379]
更优选的是特征在于上述药物组合物、药物组合物或药剂旨在每天给药2-4次的用途。
[0380]
更优选的是特征在于上述药剂以用于口服给药的固体剂型生产的用途。
[0381]
更优选的是特征在于用于口服给药的固体剂型包含至少一种佐剂的用途。
[0382]
更优选的是特征在于用于口服给药的固体剂型是片剂的用途。
[0383]
更优选的是特征在于片剂为双层片剂的用途。
[0384]
更优选的是特征在于双层片剂为长效片剂的用途。
[0385]
更优选的是特征在于以下的用途:双层片剂包含米氮平或其药学上可接受的盐的层,和替扎尼定或其药学上可接受的盐的层,其具有延迟释放的替扎尼定。
[0386]
更优选的是特征在于以下的用途:包含替扎尼定或其药学上可接受的盐的层(具有延迟释放的替扎尼定)包含聚合物缓释剂,并且聚合物替扎尼定缓释剂是亲水性聚合物缓释剂。
[0387]
更优选的是特征在于以下的用途:替扎尼定亲水性聚合物缓释剂可以是聚乙烯醇、聚乙烯吡咯烷酮、聚环氧乙烷、卡波姆、藻酸盐、丙烯酸或其酯的聚合物、纤维素衍生物或其混合物、甲基丙烯酸铵共聚物、羟丙基甲基纤维素、甲基纤维素、乙基纤维素或丙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基乙基纤维素、羧甲基纤维素、乙酸纤维素或邻苯二甲酸纤维素、羟丙基甲基纤维素邻苯二甲酸酯、乙酸纤维素琥珀酸酯或乙基纤维素琥珀酸酯。
[0388]
更优选的是特征在于米氮平从米氮平层立即释放的用途。
[0389]
更优选的是特征在于具有延迟释放的替扎尼定层包含6mg的替扎尼定,并且具有立即释放的米氮平层包含15mg的米氮平的用途。
[0390]
更优选的是特征在于替扎尼定的药学上可接受的盐是盐酸替扎尼定的用途。
[0391]
更优选的是特征在于替扎尼定层包含以以下比率(wt%)的盐酸替扎尼定和赋形剂的用途:
[0392]
盐酸替扎尼定(以替扎尼定计)
–
3.81;
[0393]
硬脂酸
–
1.11;
[0394]
羟丙基甲基纤维素
–
40.28;
[0395]
甲基丙烯酸铵共聚物
–
54.165;
[0396]
胶体二氧化硅
–
0.635。
[0397]
更优选的是特征在于替扎尼定层通过直接压制生产的用途。
[0398]
更优选的是特征在于米氮平层包含以以下比率(wt%)的米氮平和赋形剂的用途:
[0399]
米氮平
–
10.0;
[0400]
甘露醇
–
33.13;
[0401]
微晶纤维素
–
51.34;
[0402]
聚乙烯吡咯烷酮
–
1.0;
[0403]
交聚维酮
–
3.0;
[0404]
胶体二氧化硅
–
0.53;
[0405]
硬脂酸镁
–
1.0。
[0406]
更优选的是特征在于米氮平层通过湿法制粒生产的用途。
[0407]
此外,本发明的主题是一种疼痛疾患的治疗方法,其特征在于其包括本发明的上述用途或向有需要的患者给药本发明的药物组合物、本发明的药物组合或本发明的药剂。
[0408]
更优选的是特征在于疼痛疾患是痛性肌痉挛或骨骼肌痉挛的治疗方法。
[0409]
更优选的是特征在于痛性肌痉挛与静止性和功能性脊柱疾病有关的治疗方法。
[0410]
更优选的是特征在于脊柱疾病是颈椎或腰椎综合征的治疗方法。
[0411]
更优选的是特征在于痛性肌痉挛与手术干预有关的治疗方法。
[0412]
更优选的是特征在于骨骼肌痉挛与神经系统疾病有关的治疗方法。
[0413]
更优选的是特征在于神经系统疾病选自包括多发性硬化症、慢性脊髓病、退行性脊柱疾病、脑循环疾患的后果和婴儿脑瘫的组的治疗方法。
[0414]
更优选的是特征在于上述药物组合物、药物组合或药剂旨在每天给药1-4次的治疗方法。
[0415]
更优选的是特征在于上述药物组合物、药物组合或药剂旨在每天给药1-3次的治疗方法。
[0416]
更优选的是特征在于上述药物组合物、药物组合或药剂旨在每天给药1-2次的治疗方法。
[0417]
更优选的是特征在于上述药物组合物、药物组合或药剂旨在每天给药2-4次的治疗方法。
[0418]
更优选的是特征在于上述药剂以用于口服给药的固体剂型生产的治疗方法。
[0419]
更优选的是特征在于用于口服给药的固体剂型包含至少一种佐剂的治疗方法。
[0420]
更优选的是特征在于用于口服给药的固体剂型是片剂的治疗方法。
[0421]
更优选的是特征在于片剂是双层片剂的治疗方法。
[0422]
更优选的是特征在于双层片剂是长效片剂的治疗方法。
[0423]
更优选的是特征在于以下的治疗方法:双层片剂包含米氮平或其药学上可接受的盐的层,和替扎尼定或其药学上可接受的盐的层,其具有延迟释放的替扎尼定。
[0424]
更优选的是特征在于以下的治疗方法:包含替扎尼定或其药学上可接受的盐的层(具有延迟释放的替扎尼定)包含聚合物缓释剂,并且聚合物替扎尼定缓释剂是亲水性聚合物缓释剂。
[0425]
更优选的是特征在于以下的治疗方法:替扎尼定亲水性聚合物缓释剂可以是聚乙烯醇、聚乙烯吡咯烷酮、聚环氧乙烷、卡波姆、藻酸盐、丙烯酸或其酯的聚合物、纤维素衍生物或其混合物、甲基丙烯酸铵共聚物、羟丙基甲基纤维素、甲基纤维素、乙基纤维素或丙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基乙基纤维素、羧甲基纤维素、乙酸纤维素或邻苯二甲酸纤维素、羟丙基甲基纤维素邻苯二甲酸酯、乙酸纤维素琥珀酸酯或乙基纤维素琥珀酸酯。
[0426]
更优选的是特征在于米氮平从米氮平层立即释放的治疗方法。
[0427]
更优选的是特征在于具有延迟释放的替扎尼定层包含6mg的替扎尼定,并且具有立即释放的米氮平层包含15mg的米氮平的治疗方法。
[0428]
更优选的是特征在于替扎尼定的药学上可接受的盐是盐酸替扎尼定的治疗方法。
[0429]
更优选的是特征在于替扎尼定层包含以以下比率(wt%)的盐酸替扎尼定和赋形剂的治疗方法:
[0430]
盐酸替扎尼定(以替扎尼定计)
–
3.81;
[0431]
硬脂酸
–
1.11;
[0432]
羟丙基甲基纤维素
–
40.28;
[0433]
甲基丙烯酸铵共聚物
–
54.165;
[0434]
胶体二氧化硅
–
0.635。
[0435]
更优选的是特征在于替扎尼定层通过直接压制生产的治疗方法。
[0436]
更优选的是特征在于替扎尼定层包含以以下比率(wt%)的米氮平和赋形剂的治疗方法:
[0437]
米氮平
–
10.0;
[0438]
甘露醇
–
33.13;
[0439]
微晶纤维素
–
51.34;
[0440]
聚乙烯吡咯烷酮
–
1.0;
[0441]
交聚维酮
–
3.0;
[0442]
胶体二氧化硅
–
0.53;
[0443]
硬脂酸镁
–
1.0。
[0444]
更优选的是特征在于米氮平层通过湿法制粒生产的治疗方法。
[0445]
以下,描述了本发明的示例性实施方式,其说明但未涵盖本发明的所有可能的实施方式并且不限制本发明。
[0446]
实施例1.评估米氮平和替扎尼定组合用于治疗与静止性和功能性脊柱疾病有关的疼痛综合征的有效性。
[0447]
为了评估制剂用于治疗与静止性和功能性脊柱疾病有关的疼痛综合征(例如颈椎
和腰椎综合征)的有效性,切断大鼠三个坐骨神经分支中的两个的模型[17-19]。
[0448]
大鼠:实验中使用体重为250-330g的成年雄性sprague-dawley大鼠98只。将大鼠保持在温控箱中(平均温度为21℃),每箱五只动物,在12小时昼夜循环下,并提供足够量的水和饲料。
[0449]
模型描述:在模拟功能性或静止性脊柱疾病的大鼠神经切断手术后10天,在出现疼痛综合征的背景下,研究大鼠给药用于治疗这种疼痛综合征的测试制剂的有效性。
[0450]
手术操作:用异氟醚(sigma,usa)麻醉大鼠。切开大鼠大腿侧面的皮肤,然后在二头肌上切口,以提供坐骨神经及其三个末端分支:腓肠神经、腓总神经和胫神经的通路。仅对胫神经和腓总神经进行切断和结扎,而腓肠神经保持完整。用丝线结扎神经并从结扎点向远端切断,留下2+4mm大小的神经残端。肌肉和皮肤分别缝合。
[0451]
研究组的形成:将大鼠随机分为组成相同的14组(每组7只),但给药的制剂类型和剂量不同。
[0452]
给药的制剂和剂量:针对4种制剂类型进行研究(米氮平、替扎尼定、本发明的比率为2.5:1的米氮平+替扎尼定和比率为5:1的米氮平+替扎尼定(最接近的现有技术)),在手术后十天和进行行为测试前30分钟以规定的剂量和组合口服给药:
[0453]
米氮平:15mg/天(第1组)、30mg/天(第2组)、45mg/天(第3组)、60mg/天(第4组);
[0454]
替扎尼定:6mg/天(第5组)、12mg/天(第6组)、18mg/天(第7组)、24mg/天(第8组);
[0455]
本发明的比率为2.5:1的米氮平+替扎尼定:米氮平,15mg/天+替扎尼定,6mg/天(第9组);米氮平,30mg/天+替扎尼定,12mg/天(第10组);米氮平,45mg/天+替扎尼定,18mg/天(第11组);米氮平,60mg/天,替扎尼定,24mg/天(第12组);
[0456]
比率为5:1的米氮平+替扎尼定(最接近的类似物):米氮平,30mg/天+替扎尼定,6mg/天(第13组)。
[0457]
仅接受载体的大鼠组(第14组,安慰剂)作为对照。所有剂量均表示等效于人。
[0458]
行为测试:不同组动物的疼痛强度通过使用两个修复冷或机械痛觉超敏的发展的测试进行评估。在术后第10天,在引入所研究的制剂后30分钟内对动物进行测试。
[0459]
机械痛觉超敏。将动物放入高出地面的丙烯酸室(15
×
15
×
15cm)中,底部带有金属丝网。在开始测试之前,将动物留在室内5-10分钟以适应环境。然后,用von frey校准的细丝(或毛发)(bioseb,usa)刺激动物爪子的足底表面。细丝是一组10根直径增加的标准塑料毛发。在这样的校准中,毛发的硬度(表示为弯曲头发所需的最小力)以对数方式增加,绝对值从0.6g至26g。每只大鼠的敏感阈值通过每只爪子的轮次重复三次来确定(总共触摸6次,每根细丝间隔10秒;用不同细丝连续触摸之间的间隔为2分钟)。用弯曲毛发所需的力戳足底表面的中部,并将毛发保持在该位置6-8秒。如果动物在触摸过程中急剧缩回爪子,则记录阳性反应。敏感阈值由引起缩爪反射反应的最小压力确定(6次触摸的4次)。
[0460]
冷痛觉超敏。为了评估冷痛觉超敏,使用带有热/冷板的特殊测试室(ugo basile,意大利)。测试在具有30cm高度的丙烯酸壁的室中在冷却至0℃的30
×
30cm尺寸的金属板上进行。健康动物能够长时间承受这种温度,四肢均放在冷却的地板上,而如果神经受损,与冷板接触的时间显著减少。为了定量评估这个参数,动物在测试室中将四肢悬吊1分钟的时间。测试在术后第10天进行;每只动物测试3次,测量间隔为5分钟;获得的值被平均。获得的值用于计算在相应测试中收到的平均评分和参与研究的每组中每10个值的平均值的标准
误差。如果р值小于0.05,则认为组间差异具有统计学意义。
[0461]
结果:所得结果示于下表1中。
[0462]
表1.米氮平和替扎尼定单独或联合使用对模拟静止性和功能性脊柱疾病的疼痛综合征大鼠行为的影响。
[0463][0464][0465]
*本发明的米氮平+替扎尼定组合(比率2.5:1)与最接近的类似物(米氮平+替扎尼定,比率为5:1)在治疗大鼠疼痛综合征方面的有效性的可靠差异(显著性水平p《0.05)。
[0466]
结论:在接受本发明的比率为2.5:1的米氮平与替扎尼定组合的组中,机械和冷痛觉超敏指标显著降低,证明其用于治疗功能性和静止性脊柱疾病的有效性。但是,此外,在所有测试的剂量中均发现了这种组合行动的协同作用,这在统计学上显著高于最接近的类似物的治疗效果。此外,如下表所示,最接近的类似物的效应是相似剂量的米氮平和替扎尼定的叠加效应。
[0467]
实施例2.评估米氮平和替扎尼定组合用于治疗损伤和手术干预后疼痛综合征的有效性。
[0468]
在大鼠术后疼痛模型上评估了治疗损伤和手术干预后疼痛综合征(例如关于椎间盘突出或髋关节骨软骨病)的制剂的有效性,该模型由切断后爪足部穿过皮肤、筋膜和肌肉而形成[20-21]。
[0469]
大鼠:实验中使用体重为250-330g的成年雄性sprague-dawley大鼠98只。将大鼠保持在温控箱中(平均温度为21℃),每箱五只动物,在12小时昼夜循环下,并提供足够量的
水和饲料。
[0470]
模型说明:在切断后爪足的手术(这导致大鼠出现疼痛综合征)后3天,研究用于治疗这种疼痛综合征的测试制剂的给药有效性。
[0471]
手术操作:用异氟醚(sigma,usa)麻醉大鼠。用10%聚维酮碘溶液处理后爪的足底部分。然后,切1cm纵向切口穿过皮肤和筋膜,在脚趾方向上比脚跟的近端低0.5cm处开始。将足底肌肉抬起并沿纵向切开。肌肉附着点保持完整。使用尼龙线和针在伤口上进行两条褥式缝合。伤口用抗生素混合物处理。手术后,动物们在笼里恢复健康。手术后约30小时内在麻醉下拆除缝线。伤口通常在5-6天内闭合。
[0472]
研究组的形成:将大鼠随机分为组成相同的14组(每组7只),但给药的制剂类型和剂量不同。
[0473]
给药的制剂和剂量:针对4种制剂类型进行研究(米氮平、替扎尼定、本发明的比率为2.5:1的米氮平+替扎尼定和比率为5:1的米氮平+替扎尼定(最接近的类似物)),在手术后三天和进行行为测试前30分钟以实施例1的剂量和组合口服给药。仅接受载体的大鼠组(第14组,安慰剂)作为对照。所有剂量均按照人计提供。
[0474]
行为测试:为了评估疼痛行为,使用带有细丝的von frey测试(表现为机械痛觉超敏)。除了将细丝仅推到受伤的爪子之外,如上述实施例1中进行测试。如果显著性水平为p《0.05,则认为组间差异具有统计学意义。
[0475]
结果示于下表2中。
[0476]
表2.米氮平和替扎尼定单独或联合使用对手术干预后疼痛综合征大鼠行为的影响。
[0477]
[0478][0479]
*本发明的米氮平+替扎尼定组合(比率2.5:1)与最接近的类似物(米氮平+替扎尼定,比率为5:1)在治疗大鼠疼痛综合征方面的有效性的可靠差异(显著性水平p《0.05)。
[0480]
结论:在接受米氮平和替扎尼定组合的组中,机械痛觉超敏指数显著降低,这证明在手术干预后使用它们治疗疼痛综合征的有效性。此外,该实验还显示米氮平和替扎尼定的行动的协同作用,其在统计学上显著高于最接近的类似物的治疗效果。此外,如下表所示,最接近的类似物的效应是相似剂量的米氮平和替扎尼定的叠加效应。
[0481]
实施例3.评估米氮平和替扎尼定组合用于治疗神经系统疾病骨骼肌痉挛的有效性。
[0482]
在切断大鼠脊髓骶部(尾肌痉挛的形成)的模型上研究用于治疗神经系统疾病(例如多发性硬化症、慢性脊髓病、退行性疾病)中骨骼肌痉挛的制剂的有效性[22-24]。
[0483]
大鼠:实验中使用体重为250-330g的成年雄性sprague-dawley大鼠98只。将大鼠保持在温控箱中(平均温度为21℃),每箱五只动物,在12小时昼夜循环下,并提供足够量的水和饲料。
[0484]
模型描述:脊髓骶部切断手术后第15天,在电刺激下对清醒动物尾肌痉挛进行评估。
[0485]
研究组的形成:将大鼠随机分为组成相同的14组(每组7只),但给药的制剂类型和剂量不同。
[0486]
给药的制剂和剂量:针对4种制剂类型进行研究(米氮平、替扎尼定、本发明的比率为2.5:1的米氮平+替扎尼定和比率为5:1的米氮平+替扎尼定(最接近的类似物)),以实施例1中的剂量和组合口服给药。仅接受载体的大鼠组(第14组,安慰剂)作为对照。所有剂量均按照人计提供。
[0487]
手术操作:在实验中,在无菌条件下,在麻醉(异氟醚,sigma,usa)下在s2水平切断脊髓的骶部[22-24]。简言之,切除脊柱背侧的软组织,在腰椎l2水平进行椎板切除术。将按大小选择的拉钩置于被剪刀完全剪断的脊髓下,同时避免损伤静脉和动脉。软组织层与脊髓紧密缝合。
[0488]
尾巴痉挛评估:将大鼠放入有机玻璃圆柱体中,使鼠尾留在外面并且可以在垂直方向上自由移动。手动刺激鼠尾如下:左手抓住鼠尾根部,并用拇指和食指夹住鼠尾,右手从根部快速从鼠尾末端滑过鼠尾,紧贴在鼠尾并在完成动作后放开鼠尾。该过程重复了三
次。这有助于实现尾部纵向拉直。这种刺激的反应是尾卷曲及其在大鼠身体下方的运动(或者,在损伤更严重的大鼠中,在背侧方向)。为了评估鼠尾的痉挛状态,使用以下量表。
[0489]
0-1分:尾端对拉伸的反应非常小或不明显的卷曲(角度小于90
°
,持续时间仅为数秒),肌张力差或无肌张力,无阵挛,对皮肤或毛发的轻微触摸没有反应。
[0490]
2-3分:鼠尾对拉伸刺激反应产生强烈痉挛(弯曲),末端以180-360
°
的角度弯曲,持续时间为3-10秒。鼠尾反复卷曲和阵挛持续超过10分钟,过度紧张,对轻触的敏感性高。
[0491]
4-5分:与前次评估类似,但鼠尾屈曲和弯曲更频繁,导致鼠尾经常出现s形形状,其中鼠尾的近端部分在大鼠下方弯曲,远端部分向相反的方向弯曲;更明显的阵挛、过度紧张和左右运动。
[0492]
给每只大鼠分配尾痉挛量表的评分;然后在一组内平均评分。如果显著性水平为p《0.05,则认为组间差异具有统计学可靠性。
[0493]
结果:所得结果示于下表3中。
[0494]
表3.米氮平和替扎尼定单独或联合使用对大鼠骨骼肌痉挛引起疼痛行为的影响。
[0495][0496]
*本发明的米氮平+替扎尼定组合(比率2.5:1)与最接近的类似物(米氮平+替扎尼定,比率为5:1)在治疗大鼠疼痛综合征方面的有效性的可靠差异(显著性水平p《0.05)。
[0497]
结论:接受米氮平和替扎尼定组合的动物尾部痉挛程度最弱,这证明使用该组合用于治疗神经系统疾病骨骼肌痉挛的可能性。该实验还显示米氮平和替扎尼定组合的行动的协同作用,其在统计学上显著高于最接近的类似物的治疗效果。此外,如下表所示,最接近的类似物的效应是相似剂量的米氮平和替扎尼定的叠加效应。
[0498]
实施例4.生产包含米氮平的立即释放层。
[0499]
初步测试表明,如果使用湿法制粒法,可以获得最佳结果。
[0500]
样品按照以下步骤生产:
[0501]-称量米氮平和佐剂并通过筛子校准;
[0502]-混合米氮平、甘露醇和微晶纤维素;
[0503]-使用聚乙烯吡咯烷酮k30(pvp k30)将混合物造粒;
[0504]-颗粒材料与交聚维酮、氧化硅和植物硬脂酸镁混合。
[0505]
在制备颗粒材料期间,在批次2中获得良好的结果(表4)。
[0506]
表4.米氮平层混合物的定性和定量组成。
[0507][0508]
实施例5.生产包含替扎尼定的延迟释放层。
[0509]
为了生产长效替扎尼定剂型(每天给药一次),测试几种不同浓度的释放控制剂。以表5中所示的三种不同组合物的形式生产三个不同批次的6mg替扎尼定片剂。
[0510]
作为具有亲水性基质(亲水性聚合物缓释剂)羟丙基甲基纤维素、乙基纤维素的系统中的释放控制剂。使用kollidon(聚乙酸乙烯酯和聚乙烯吡咯烷酮聚合物的比率为8:2的混合物,通过喷雾干燥进行干燥)和甲基丙烯酸铵。
[0511]
羟丙基甲基纤维素(hpmc)常常用于控释制剂。在这种情况下,使用k100m等级。高分子hpmc是各种释放调节剂;它们与非离子聚合物有关,并可与高剂量和低剂量的可溶性和不溶性药剂一起使用。
[0512]
所有批次的生产过程均相同并包括以下步骤。
[0513]
首先,将原料通过网孔为0.610mm的不锈钢筛网,并在不添加硬脂酸的情况下手动混合5分钟。初步混合后,将硬脂酸加入混合物中并手动混合5分钟。在旋转压片机中生产片剂。
[0514]
所有片剂具有相似重量(180mg
±
5%)和相似强度(15
±
3kg
·
f),以评估聚合物对药物释放的影响;在受溶出介质作用的相同表面积下,释放曲线仅受不同聚合物浓度和基质本身形成的影响。
[0515]
表5.替扎尼定层混合物的定性和定量组成。
[0516][0517]
在这种情况下,发明人未能通过使用疏水释放阻滞剂获得可接受的释放特性和混合工艺参数。
[0518]
结果表明,为了制备替扎尼定延迟释放层,可以使用亲水性聚合物缓释剂,其中甲基丙烯酸铵共聚物和hpmc(批次3)的混合物具有最有效的延迟释放药物的特性。
[0519]
实施例6.生产包含有效量的米氮平和替扎尼定的双层片剂。
[0520]
根据实施例4中获得的与用于生产米氮平层的湿法制粒工艺有关的有希望的结果,选择批次2生产双层片剂的临床前批次。
[0521]
批次2表现出良好的工艺性能;为此,使用该制粒材料用于米氮平层和如实施例5中生产的替扎尼定批次(批次3)生产一批双层片剂。
[0522]
这项工作的目的是生产形状如双层330mg片剂的组合口服剂型,包含两种选定的活性物质,组成如下:
[0523]
包含15mg的米氮平的150mg立即释放层;
[0524]
包含6mg的替扎尼定的180mg延迟释放层。
[0525]
双层片剂的开发基于在实施例4和5中获得的结果。
[0526]
使用配备有十个直径为9mm的平冲头的旋转压片机生产双层片剂。最终组成如表6所示。双层片剂的工艺特性如表7所示。
[0527]
表6.双层片剂层的定性和定量组成。
[0528][0529]
表7.双层片剂的工艺特点。
[0530]
特点tfr15012平均重量,mg333.0
±
1.9厚度,mm4.792
±
0.0091强度,kg
·
f9.31
±
0.33脆碎度,%0.27
[0531]
实施例7.本发明的米氮平+替扎尼定制剂对脊髓神经结扎所致神经性疼痛模型大鼠机械痛觉超敏的影响研究。
[0532]
脊神经结扎(snl)引起的神经性疼痛模型被广泛用于神经性疼痛机制的各种研究工作和新型镇痛制剂开发的筛选试验中。结扎通过紧密结扎大鼠的一根(l5)或两根(l5和l6)节段脊神经进行。手术导致机械痛觉超敏、热痛觉过敏、冷痛觉超敏和持续疼痛的长期行为特征[25]。
[0533]
实验中使用体重为250-330g的成年雄性sprague-dawley大鼠。将大鼠保持在温控箱中(平均温度为21℃),在12小时昼夜循环下,并提供足量的水和饲料。
[0534]
将五十只sprague-dawley大鼠随机分配至组成相同的五组(n=10),这些组因给药的制剂类型而异:载体(安慰剂);15mg的米氮平;6mg的替扎尼定;本发明的米氮平+替扎尼定制剂,长效片剂,15mg+6mg(比率为2.5:1);米氮平+替扎尼定的比较制剂,比率为5:1,30mg+6mg(最接近的类似物)。所有制剂均在手术后三天口服给药,然后在整个研究期间每天一次。剂量按照人计提供。
[0535]
通过腹腔注射戊巴比妥钠对动物进行麻醉,并剪掉背部的毛发。然后,将每只动物以卧式放在手术平台上,并用胶带固定四肢。在无菌条件下,在基底椎和骶骨(从l5椎骨的
尾部至第一骶椎)的水平上切口(长度约3cm,两侧距离中线5mm)。切口定位由位于髂嵴喙端水平的l5椎骨的位置决定。通过使用钝头小剪刀,从l5椎骨至骶骨的水平分离和切除椎旁肌。
[0536]
为了评估疼痛行为,在术后第1、5、10和15天使用von frey细丝进行测试(出现机械痛觉超敏)。在每只爪子上轮流确定每只大鼠的敏感阈值,重复三次(总共推动6次,每个细丝的间隔为10秒;不同细丝的连续推动之间的间隔为2分钟)。用长丝末端以弯曲毛发所需的力推动爪足底表面的中部,并将毛发保持在该位置6-8秒。如果动物在推动期间急剧缩回爪子,则记录阳性反应。敏感阈值由引起缩爪反射反应的最小压力确定(6次推动中的4次)。
[0537]
对于每个研究组(n=10),计算每个测试中给出的平均评分和每个值的平均值的标准误差。当显著性水平p低于0.05时,组间差异被认为具有统计学意义。
[0538]
所得结果示于下表8中。
[0539]
表8.米氮平+替扎尼定制剂,长效片剂,15mg+6mg(比率2.5:1)对脊神经结扎引起的疼痛综合征大鼠行为的影响。
[0540][0541]
*本发明的比率为2.5:1的米氮平+替扎尼定的组合与最接近的现有技术(比率为5:1的米氮平+替扎尼定)治疗大鼠疼痛综合征的可靠差异(显著性水平p《0.05)。
[0542]
接受米氮平和替扎尼定组合15mg+6mg(比率为2.5:1)组的机械痛觉超敏指数显著降低,这证明它们用于治疗脊神经结扎引起的疼痛综合征的有效性(卒中后慢性疼痛模型)。该实验还显示米氮平和替扎尼定组合的协同作用,其在统计学上显著高于最接近的类似物的治疗效果。此外,如下表所示,最接近的类似物的效应是相似剂量的米氮平和替扎尼定的叠加效应。
[0543]
实施例8.急性毒性研究。
[0544]
进行米氮平+替扎尼定制剂长效片剂15mg+6mg与替扎尼定修饰释放胶囊6mg和米氮平薄膜包衣片剂30mg比较通过灌胃引入(每日间断引入)用于两性远交大鼠的急性毒性研究。
[0545]
根据获得的毒理学数据,确定研究中制剂的平均致死剂量(ld
50
),mg/kg:
[0546]
米氮平
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
324.0;
[0547]
替扎尼定
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
230.9;
[0548]
米氮平+替扎尼定,15+6mg,
ꢀꢀꢀꢀꢀꢀꢀꢀ
465.3。
[0549]
为了使用固定组合的急性毒性参数确定相互作用类型,使用根据finney[26]的可加性规则。
[0550]
组合制剂的假设平均致死剂量(ld
50
)(由组分相加相互作用的假设计算得出)为:
[0551]
1/ld
50 hyp.=6/(21*324.0)+15/(21*230.9)=0.003975;相应地,ld
50
hyp.=251.5mg/kg(根据活性物质的总和)。
[0552]
假设的(计算的)ld
50 hyp.与实验获得的组合ld
50
之间的关系为:251.5/465.3=0.54
[0553]
可加性原理在一般毒理学中用作几种毒剂联合作用的基线假设。并且假设固定组合的预测效应是组合中几个组分的效应之和。根据finney[26],可加性方程构成了旨在使用固定组合的急性毒性参数确定相互作用类型的分析技术的基础。
[0554]
取决于组合ld
50
的假设值之间的关系,根据其各个组分的ld
50
计算得出,以及通过实验确定的组合ld
50
的实际值,可以得出以下三个结论之一:
[0555]
1)没有毒理学相互作用。ld
50
(hyp.)和ld
50
(act.)之间的关系等于或接近1。可以加和组合组分的毒性,即它对应于加性协同作用的主要假设。
[0556]
2)拮抗型毒理学相互作用。ld
50
(hyp.)和ld
50
(act.)之间的关系等于或接近0.57,即组合组分的毒性降低是可能的。
[0557]
3)增强型毒理学相互作用。ld
50
(hyp.)和ld
50
(act.)之间的关系等于或接近1.75,即组合组分的毒性增加是可能的。
[0558]
从在大鼠中进行的研究中获得的0.54的值可能证明了拮抗型毒理学相互作用的趋势,即组合组分的毒性可能降低。
[0559]
从急性毒性指标判断,测试制剂和对比制剂可以参照hodge和sterner分类[27]中毒性物质第3类和gost 12.1.007-76[28]中毒性物质第iii类。
[0560]
本发明适用于医药、药理学、化学制药行业。
[0561]
文献
[0562]
1.申请ru 2002129356,27.03.2004;
[0563]
2.申请wo 2006055854,26.05.2006;
[0564]
3.lu y.,xiao z.,yu w.,xiao f.,xiao z.,hu y.,chen y.,wang x.:
[0565]
"efficacy and safety of adjunctive zonisamide in adult patients with refractory partial-onset epilepsy:a randomized,double-blind,placebo-controlled trial"//clinical drug investigation,v.31,no.4,2011,pp.221-229;
[0566]
4.专利us4,062,848,13.12.1977;
[0567]
5.fawcett j.,barkin r.l.:"аmeta-analysis of eight randomized,double-blind,controlled clinical trials of mirtazapine for the treatment of patients with major depression and symptoms of anxiety"//journal of clinical psychiatry,v.59,no.3,1998,pp.123-127;
[0568]
6.goodnick p.j.,jimenez i.,kumar a.:"sertraline in diabetic neuropathy:preliminary results"//annals of clinical psychiatry,v.9,no.4,1997,pp.255-257;
[0569]
7.muth-selbach u.,hermanns h.,driehsen c.,lipfert p.,freynhagen r.:"racemic intrathecal mirtazapine but not its enantiomers acts anti-neuropathic afterchronic constriction injury in rats"//brain research bulletin,v.79,no.1,2009,pp.63-68;
[0570]
8.arnold p.,vuadens p.,kuntzer t.,gobelet c.,deriaz o.:"mirtazapine decreases the pain feeling in healthy participants"//the clinical journal of pain,v.24,no.2,2008,pp.116-119;
[0571]
9.freynhagen r.,muth-selbach u.,lipfert p.,stevens m.f.,zacharowski k.,tolle t.r.,von giesen h.j.:"the effect of mirtazapine in patients with chronic pain and concomitant depression"//current medical research and opinion,v.22,no.2,2006,pp.257-264;
[0572]
10.bomholt s.f.,mikkelsen j.d.,blackbum-munro g.:"antinociceptive effects of the antidepressants amitriptyline,duloxetine,mirtazapine and citalopram in animal models of acute,persistent and neuropathic pain"//neuropharmacology,v.48,no.2,2005,pp.252-263;
[0573]
11.bendtsen l.,jensen r.:"mirtazapine is effective in the prophylactic treatment of chronic tension-type headache"//neurology,v.62,no.10,2004,pp.1706-1711;
[0574]
12.travell j.g.,simons d.g.:"myofascial pain".in 2v.//medicine publishers,v.1,1989,256pp.;
[0575]
13.alexeyev v.v.:"handbook of polyclinic physician"//consilium medicum,v.1,no.1,2001;
[0576]
14.申请us no.2008020076,24.01.2008;
[0577]
15.专利ru2509560,20.03.2014;
[0578]
16.berge s.m.,bighley l.d.,monkhouse d.c.:"pharmaceutical salts"//journal of pharmaceutical sciences,v.66,no.1,1977,pp.1-19;
[0579]
17.bennett g.j.,xie y.k.:"аperipheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man"//pain,v.33,no.1,1988,pp.87-107;
[0580]
18.decosterd i.,woolf c.j.:"spared nerve injury:an animal model of persistent peripheral neuropathic pain"//pain,v.87,no.2,2000,pp.149-158;
[0581]
19.kim s.h.,chung j.m.:"an experimental-model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat"//pain,v.50,no.3,1992,pp.355-363;
[0582]
20.brennan t.j.,vandermeulen e.p.,gebhart g.f.:"characterization of a rat model
[0583]
of incisional pain"//pain,v.64,no.3,1996,pp.493-501;
[0584]
21.pogatzki e.m.,niemeier j.s.,brennan t.j.:"persistent secondary hyperalgesia after gastrocnemius incision in the rat"//european journal of pain,v.6,no.4,2002,pp.295-305;
[0585]
22.bennett d.j.,sanelli l.,cooke c.l.,harvey p.j.,gorassini m.a.:
[0586]
"spastic long-lasting reflexes in the awake rat after sacral spinal cord injury"//journal of neurophysiology,v.91,no.5,2004,pp.2247-2258;
[0587]
23.li y.,gorassini m.a.,bennett d.j.:"role of persistent sodium and calcium currents in motoneuron firing and spasticity in chronic spinal rats"//journal of neurophysiology,v.91,no.2,2004,pp.767-783;
[0588]
24.li x.,murray k.,harvey p.j.,ballou e.w.,bennett d.j.:"serotonin facilitates a 10 persistent calcium current in motoneurons of rats with and without chronic spinal cord injury"//journal of neurophysiology,v.97,no.2,2007,pp.1236-1246;
[0589]
25.chung j.m.,kim h.k.,chung k.:"segmental spinal nerve ligation model of neuropathic pain"//methods in molecular medicine,v.99,2004,pp.35-45;
[0590]
26."probit analysis:a statistical treatment of the sigmoid response curves"//by linney d.g.,2nd ed.,cambridge university press,1952,pp.131-140;
[0591]
27."clinical toxicology of commercial products"//acute poisoning,ed.iv,by hodge h.c.gosselin r.e.,smith r.p.,baltimore,1976,p.427;
[0592]
28.gost 12.1.007-76."occupational safety standards system.noxious substances.classification and general safety requirements"。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1