靶向人类CD47蛋白的单克隆抗体的制作方法
靶向人类cd47蛋白的单克隆抗体
相关申请的交叉引用
1.本技术要求2019年11月20日提交的美国临时申请第62/938,311号的优先权,该临时申请的公开内容以引用方式整体并入本文。序列表的合入
2.本技术包括正在通过efs-web以ascii格式提交的名为“avi105pct_st25.txt”的序列表,该序列表大小为28kb,并且创建时间为2020年11月20日。序列表的内容以引用方式整体并入本文。
背景技术:
3.当今可用的大多数癌症免疫疗法主要集中在针对适应性免疫应答。然而,先天性免疫系统的组成部分(诸如巨噬细胞和髓系免疫细胞)也为癌症治疗提供了非常有利可图的替代方案。
4.cd47是一种50kda多次跨膜蛋白,其可充当“自我标记”并且广泛表达在细胞表面上(也称为整合素相关蛋白)。cd47与髓系抑制性免疫受体sirp alpha(也称为cd172a或shps-1)相互作用。sirp alpha与cd47的这种相互作用控制了先天性免疫细胞的效应子功能,例如宿主细胞吞噬作用(steven e.kauder等人,2018)。cd47表达和/或活性与许多疾病和病症有关。因此,需要靶向cd47的疗法,以及实施此类疗法的更佳方法。
5.cd47-sirp-alpha相互作用向吞噬细胞发送“不要吃我”的信号。因此,用单克隆抗体阻断cd47-sirp-alpha相互作用可实现有效的抗癌治疗,如通过巨噬细胞提高针对cd47表达细胞的吞噬作用(综述于chao等人,2012curr opin immunol,24(2):225-32),用于通过宿主的免疫系统改善癌细胞的吸收和清除。这种机制对白血病、淋巴瘤和许多其他类型的实体肿瘤有效。另外,还表明这些cd47阻断抗体与肿瘤模型中的其他治疗性抗体(包括和)协同作用。巨噬细胞检查点抑制剂5f9(抗cd47抗体)联合利妥昔单抗在患有侵袭性淋巴瘤和惰性淋巴瘤的患者中显示出良好的活性(advani r等人,2018)。
6.各种研究发现,抗cd47抗体引发血小板聚集和红血细胞血凝反应。当抗cd47抗体与在其表面上表达cd47蛋白的细胞相互作用时,这些细胞趋于聚集,此类相互作用被称为同型相互作用。dorahy等人于1997年发表了cd47抗体b6h12直接引发一些目标受试者出现血小板聚集。同样,uno s、kinoshita y、azuma y等人于2007年发表了cd47抗体b6h12引发红血细胞血凝反应。因此,抗cd47抗体识别非癌性自身细胞是该疗法的主要缺点,未来的治疗方法需解决这一缺点。
7.目前获临床批准的靶向cd47的免疫疗法已显示出充满前景的临床结果。然而,仍需改进患者对这些获准药剂的应答率。因此,本领域需要识别高效的抗cd47抗体,当单独使用或作为联合治疗剂与任何给定组合的其他药物治疗方案一起使用时,该抗cd47抗体能够有效地作用于其靶标,尽最大程度地减少血凝反应和血小板聚集。
技术实现要素:
8.本公开提供了分离的单克隆抗体或其抗原结合部分,该分离的单克隆抗体或其抗原结合部分与人类cd47特异性结合并抑制它与sirp-alpha(信号调节蛋白)的相互作用,并且从而有利于先天性免疫。
9.根据一方面,本发明提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no:3的重链可变区cdr1;(b)包含seq id no:4的重链可变区cdr2;(c)包含seq id no:5的重链可变区cdr3;(d)包含seq id no:6的轻链可变区cdr1;(e)包含seq id no:7的轻链可变区cdr2以及(f)包含seq id no:8的轻链可变区cdr3;其中,所述抗体或部分与人类cd47特异性结合并抑制它与sirp-alpha(信号调节蛋白)的相互作用,从而有利于先天性免疫的巨噬细胞的吞噬功能。
10.根据另一方面,本发明提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no:19的重链可变区cdr1;(b)包含seq id no:20的重链可变区cdr2;(c)包含seq id no:21的重链可变区cdr3;(d)包含seq id no:22的轻链可变区cdr1;(e)包含seq id no:23的轻链可变区cdr2以及(f)包含seq id no:24的轻链可变区cdr3;其中,所述抗体或部分与人类cd47特异性结合并抑制它与sirp-alpha(信号调节蛋白)的相互作用,从而有利于先天性免疫的巨噬细胞的吞噬功能。
11.根据又一方面,本发明提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no:35的重链可变区cdr1;(b)包含seq id no:36的重链可变区cdr2;(c)包含seq id no:37的重链可变区cdr3;(d)包含seq id no:38的轻链可变区cdr1;(e)包含seq id no:39的轻链可变区cdr2以及(f)包含seq id no:40的轻链可变区cdr3;其中,所述抗体或部分与人类cd47特异性结合并抑制它与sirp-alpha(信号调节蛋白)的相互作用,从而有利于先天性免疫的巨噬细胞的吞噬功能。
12.根据又一方面,本发明提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no:51的重链可变区cdr1;(b)包含seq id no:52的重链可变区cdr2;(c)包含seq id no:53的重链可变区cdr3;(d)包含seq id no:54的轻链可变区cdr1;(e)包含seq id no:55的轻链可变区cdr2以及(f)包含seq id no:56的轻链可变区cdr3;其中,所述抗体或部分与人类cd47特异性结合并抑制它与sirp-alpha(信号调节蛋白)的相互作用,从而有利于先天性免疫的巨噬细胞的吞噬功能。
13.根据又一方面,本发明提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no:67的重链可变区cdr1;(b)包含seq id no:68的重链可变区cdr2;(c)包含seq id no:69的重链可变区cdr3;(d)包含seq id no:70的轻链可变区cdr1;(e)包含seq id no:71的轻链可变区cdr2以及(f)包含seq id no:72的轻链可变区cdr3;其中,所述抗体或部分与人类cd47特异性结合并抑制它与sirp-alpha(信号调节蛋白)的相互作用,从而有利于先天性免疫的巨噬细胞的吞噬功能。
14.在一些实施方案中,单克隆抗体或所述其抗原结合部分刺激抗肿瘤免疫应答。在一些实施方案中,单克隆抗体可以是嵌合抗体或人源化抗体。在一些实施方案中,抗cd47抗体抑制cd47蛋白与sirp-alpha(信号调节蛋白)的相互作用,从而有利于先天性免疫的巨噬细胞的吞噬功能。
15.根据另一方面,本发明涉及一种分离的抗cd47单克隆抗体或其抗原结合部分,包
括:(a)重链可变区,该重链可变区包含选自seq id no:1、seq id no:3、seq id no:4和seq id no:5的氨基酸序列;(b)轻链可变区,该轻链可变区包含选自seq id no:2、seq id no:6、seq id no:7和seq id no:8的氨基酸序列。
16.根据另一方面,本发明涉及一种分离的抗cd47单克隆抗体或其抗原结合部分,包括:(a)重链可变区,该重链可变区包含选自seq id no:17、seq id no:19、seq id no:20和seq id no:21的氨基酸序列;(b)轻链可变区,该轻链可变区包含选自seq id no:18、seq id no:22、seq id no:23和seq id no:24的氨基酸序列。
17.根据另一方面,本发明涉及一种分离的抗cd47单克隆抗体或其抗原结合部分,包括:(a)重链可变区,该重链可变区包含选自seq id no:33、seq id no:35、seq id no:36和seq id no:37的氨基酸序列;(b)轻链可变区,该轻链可变区包含选自seq id no:34、seq id no:38、seq id no:39和seq id no:40的氨基酸序列。
18.根据另一方面,本发明涉及一种分离的抗cd47单克隆抗体或其抗原结合部分,包括:(a)重链可变区,该重链可变区包含选自seq id no:49、seq id no:51、seq id no:52和seq id no:53的氨基酸序列;(b)轻链可变区,该轻链可变区包含选自seq id no:50、seq id no:54、seq id no:55和seq id no:56的氨基酸序列。
19.根据另一方面,本发明涉及一种分离的抗cd47单克隆抗体或其抗原结合部分,包括:(a)重链可变区,该重链可变区包含选自seq id no:65、seq id no:67、seq id no:68和seq id no:69的氨基酸序列;(b)轻链可变区,该轻链可变区包含选自seq id no:66、seq id no:70、seq id no:71和seq id no:72的氨基酸序列。
20.在优选的实施方案中,一种与人类cd47特异性结合的分离的单克隆抗体或其抗原结合部分,其中,所述抗体包括:选自seq id no:1、seq id no:17、seq id no:33、seq id no:49或seq id no:65的重链可变域,以及选自seq id no:2、seq id no:18、seq id no:34、seq id no:50或seq id no:66的轻链可变域。在一些实施方案中,单克隆抗体或其抗原结合部分刺激抗肿瘤免疫应答。
21.根据又一方面,本发明的抗体可以是例如全长抗体,例如igg1、igg2、igg3或igg4同种型。可选地,本公开抗体可以是抗体片段,例如fab片段、fab'片段和f(ab')2片段、双链抗体、三链抗体、四链抗体、单链可变区片段(scfv)、二硫键稳定性可变区片段(dsfv)和半抗体。
22.通过使免疫原性最小化的修饰,本公开发明的所述抗体可进一步工程改造为适合于人类治疗的形式。合适的抗体包括但不限于嵌合抗体和人源化抗体。可通过本领域技术人员已知的技术(诸如轻链改组)对本公开的抗体的亲和力、稳定性和特异性进行进一步优化。其他形式可涉及本公开抗体与其他功能蛋白寡聚(多价)、药物偶联、双特异性抗体和融合。
23.在又一方面,本发明提供了一种双特异性抗体,该双特异性抗体包含与pd-1、ctla-4或其他免疫检查点靶标、癌症相关靶标或免疫相关疾病靶标结合的抗体或部分以及与cd47结合的抗体或部分。在另一方面,双特异性抗体包含与ox40结合的抗体或部分。
24.在又一方面,还提供了一种药物组合物,该药物组合物包含分离的单克隆抗体或其抗原结合部分以及药学上可接受的载体。
25.在又一方面,本发明提供了一种使用本公开发明的抗cd47抗体来增强免疫应答的
方法。例如,在一个实施方案中,本公开发明提供了一种治疗需要治疗的受试者的方法,其中,所述应答通过活化肿瘤特异性效应子、记忆t细胞和增强靶向肿瘤的免疫应答指示,包括向受试者施用有效量的本公开发明的抗体或抗原结合部分的步骤。
26.在又一方面,本发明提供了一种治疗人类癌症的方法,包括向人类施用有效治疗所述癌症和传染病的量的本公开发明的抗体或抗原结合部分的步骤。
27.在又一方面,本发明提供了一种与人类cd47特异性结合的单克隆抗体或其抗原结合部分,其中,所述抗体包括:由包含seq id no:9、seq id no:11、seq id no:12和seq id no:13的核酸序列编码的重链可变域氨基酸序列;以及由包含seq id no:10、seq id no:14、seq id no:15和seq id no:16的核酸序列编码的轻链可变域氨基酸序列。在又一方面,本发明还提供了编码抗cd47抗体的重链和/或轻链或其抗原结合部分的核酸分子。
28.在又一方面,本发明提供了一种与人类cd47特异性结合的单克隆抗体或其抗原结合部分,其中,所述抗体包括:由包含seq id no:25、seq id no:27、seq id no:28和seq id no:29的核酸序列编码的重链可变域氨基酸序列;以及由包含seq id no:26、seq id no:30、seq id no:31和seq id no:32的核酸序列编码的轻链可变域氨基酸序列。
29.在又一方面,本发明提供了一种与人类cd47特异性结合的单克隆抗体或其抗原结合部分,其中,所述抗体包括:由包含seq id no:41、seq id no:43、seq id no:44和seq id no:45的核酸序列编码的重链可变域氨基酸序列;以及由包含seq id no:42、seq id no:46、seq id no:47和seq id no:48的核酸序列编码的轻链可变域氨基酸序列。
30.在又一方面,本发明提供了一种与人类cd47特异性结合的单克隆抗体或其抗原结合部分,其中,所述抗体包括:由包含seq id no:57、seq id no:59、seq id no:60和seq id no:61的核酸序列编码的重链可变域氨基酸序列;以及由包含seq id no:58、seq id no:62、seq id no:63和seq id no:64的核酸序列编码的轻链可变域氨基酸序列。
31.在又一方面,本发明提供了一种与人类cd47特异性结合的单克隆抗体或其抗原结合部分,其中,所述抗体包括:由包含seq id no:73、seq id no:75、seq id no:76和seq id no:77的核酸序列编码的重链可变域氨基酸序列;以及由包含seq id no:74、seq id no:78、seq id no:79和seq id no:80的核酸序列编码的轻链可变域氨基酸序列。
32.通过以下不应被解释为限制的说明书和各示例,本公开的其他特征和优点将显而易见。本技术中引用的所有参考文献、genbank条目、专利和已发布专利申请的内容通过引用明确并入本文。
附图说明
33.图1示出了本发明的特定抗人类cd47抗体的结合测定结果。
34.图2示出了本发明的特定抗人类cd47抗体的结合测定结果。
35.图3示出了本发明的特定抗人类cd47抗体的结合测定结果。
36.图4示出了本发明的特定抗人类cd47抗体的吞噬作用测定结果。
37.图5示出了本发明的特定抗人类cd47抗体的吞噬作用测定结果。
38.图6示出了本发明的特定抗人类cd47抗体的结合测定结果。
39.图7示出了本发明的抗人类cd47抗体在小鼠肿瘤模型的活体抗肿瘤功效。
具体实施方式
40.下面结合系统、组合物和方法对实施方案及其各方面进行描述和说明,这些系统、组合物和方法为示例性和说明性目的,而不是限制范围。
41.本公开涉及一种抑制cd47信号传导并且有利于增强先天性免疫的分离的单克隆抗体。在特定实施方案中,本公开发明的抗体来源于经鉴定的重链种系序列和轻链种系序列和/或包含经鉴定的结构特征,诸如包含经鉴定的氨基酸序列的cdr区。本公开提供了本公开发明的分离的抗体、制备此类抗体的方法及其抗原结合部分。本发明还涉及使用抗体的方法,诸如单独使用本公开发明的拮抗性cd47抗体或与其他免疫刺激抗体结合使用来增强靶向肿瘤的免疫应答。还可以使用根据本发明的抗体的各种其他变型形式,其中,该变型可以通过与使免疫原性最小化,使亲和力、稳定性和特异性最大化的适合于人类治疗的其他功能蛋白寡聚、药物偶联、双特异性抗体和融合来实现。因此,还提供了使用本公开发明的拮抗性cd47抗体的方法,例如,包括但不限于治疗人类癌症。
42.如本文所用的术语“表位”可包括能够与免疫球蛋白或t细胞受体特异性结合的任何蛋白质决定簇。表位决定簇通常由具有化学活性的分子表面基团组成,诸如氨基酸或糖侧链,并且通常具有特定的三维结构特征以及特定的电荷特征。当平衡解离常数≤1μm,优选地≤100nm,更优选地≤10nm,并且最优选地≤1nm时,抗体被称为特异性结合抗原。
43.如本文所用的术语“免疫应答”可以是指例如淋巴细胞、抗原呈递细胞、吞噬细胞、粒细胞以及由上述细胞或肝脏产生的可溶性大分子或有机小分子,诸如代谢物(包括抗体、细胞因子和补体)、先天性免疫系统的组成部分的作用或活化,该作用或活化会对有机体造成选择性损伤、破坏、阻塞或消除有机体中的入侵病原体、感染病原体的细胞或组织、分子内的相互作用、癌细胞或正常的机体细胞或组织(在自身免疫或病理炎症的情况下)。如本文所用的免疫应答是指与人类cd47蛋白特异性结合并且中和cd47与sirp(信号调节蛋白)之间的相互作用的抗cd47单克隆抗体之间的相互作用,从而在治疗上增强巨噬细胞针对癌症治疗的吞噬功能。
44.如本文所用的术语“抗体”可包括完整抗体、f(ab')2片段、双链抗体、三链抗体、四链抗体、双特异性抗体、单体抗体和任何抗原结合片段(即,“抗原结合部分”)或单链可变区片段(scfv)或其二硫键稳定性可变区片段(dsfv)。完整抗体是包括由二硫键相互连接的至少两条重(h)链和两条轻(l)链的糖蛋白。每条重链由重链可变区(本文缩写为vh)和重链恒定区组成。重链恒定区由三个域ch1、ch2和ch3组成。每条轻链由轻链可变区(本文缩写为vl)和轻链恒定区(cl)组成。轻链恒定区由一个域cl组成。vh区和vl区可进一步细分为高变区,称为互补决定区(cdr),中间散布着更保守的区域,称为框架区(fr)。每个vh和vl由三个cdr和四个fr组成,按以下顺序从氨基端到羧基端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链的可变区和轻链的可变区包含与抗原相互作用的结合域。抗体的恒定区可介导免疫球蛋白与宿主组织或宿主因子的结合,该宿主组织或因子包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(clq)。
45.如本文所用的术语抗体的“抗原结合部分”(或简称为“抗体部分”)可以是指抗体的保留与抗原特异性结合的能力的一个或多个片段(例如,ctla-4蛋白)。已经表明,抗体的抗原结合功能可由全长抗体的片段执行。涵盖在术语抗体的“抗原结合部分”内的结合片段
的示例包括(i)fab片段,由vl域、vh域、cl域和ch1域组成的单价片段;(ii)f(ab')2片段,一种包含在铰链区通过二硫键连接的两个fab片段的二价片段;(iii)fab'片段,其本质上是带有部分铰链区的fab(请参阅fundamental immunology(paul ed.,3.sup.rd ed.1993);(iv)由vh域和ch1域组成的fd片段;(v)由抗体单臂的vl域和vh域组成的fv片段,(vi)由vh域组成的dab片段(ward等人,(1989)nature 341:544-546);(vii)分离的互补决定区(cdr);和(viii)纳米抗体,包含单个可变域和两个恒定域的重链可变区。此外,虽然fv片段的两个域vl和vh由不同的基因编码,但是,通过使用重组方法,它们可由合成接头联结,合成接头使它们能够形成单个蛋白链,其中,vl区和vh区配对形成单价分子(称为单链fv(scfv);请参阅例如,bird等人(1988)science 242:423-426;和huston等人。(1988)proc.natl.acad.sci.usa 85:5879-5883)。此类单链抗体也旨在涵盖在术语抗体的“抗原结合部分”内。这些抗体片段是使用本领域技术人员已知的常规技术获得的,并且以与完整抗体相同的方式筛选这些片段以供使用。
46.如本文所用,“分离的抗体”可以是指基本上不含具有不同抗原特异性的其他抗体的抗体(例如,特异性结合cd47蛋白的分离的抗体可基本上不含特异性结合cd47蛋白以外的抗原的抗体)。然而,特异性结合人类cd47蛋白的分离的抗体可能与其他抗原(诸如来自其他物种的cd47蛋白)具有交叉反应性。此外,分离的抗体可基本上不含其他细胞材料和/或化学品。
47.如下文进一步论述,可以选择、克隆和进一步筛选产生抗cd47拮抗性抗体的细胞(例如,杂交瘤)以获得所需的特征,包括茁壮生长、高抗体产量和所需的抗体特征。在优选的实施方案中,通过将免疫人类cd47的小鼠脾细胞(balb/c株)与sp2/0-ag14细胞(atcc)进行电融合,产生了抗cd47抗体。从高度免疫购买获得的重组人类cd47蛋白的balb/c小鼠收集脾细胞。将融合细胞接种到96孔板中,并筛选培养基,以与抗原包被的磁珠结合。进一步扩增阳性孔,然后进行有限稀释以分离单克隆杂交瘤。纯化的抗体用于测试它们结合cd47以及中和与sirp的相互作用的能力。如本文所用的术语“单克隆抗体”或“单克隆抗体组合物”可以指单分子组合物的抗体分子的制剂。单克隆抗体组合物对特定表位表现出单一结合特异性和亲和力。本文中的单克隆抗体以人源化生物制剂、双特异性抗体和抗体融合蛋白的形式研制。
48.如本文所用的术语“重组人类抗体”可指通过重组方式制备、表达、产生或分离的所有人类抗体,诸如(a)从为人免疫球蛋白基因转基因或转染色体的动物(例如小鼠)或从其制备的杂交瘤(如下所述)分离的抗体,(b)从转化为表达人类抗体的宿主细胞分离的抗体,例如从转染瘤分离的抗体(c)从重组、组合人类抗体库中分离的抗体,以及(d)通过涉及将人免疫球蛋白基因序列剪接到其他dna序列的任何其他方式制备、表达、产生或分离的抗体。此类重组人类抗体具有可变区,其中,框架和cdr区来源于人种系免疫球蛋白序列。然而,在特定实施方案中,此类重组人抗体可经受体外诱变(或者,当使用人类ig序列的动物转基因时,经受体内体细胞诱变),因此重组抗体的vh区和vl区的氨基酸序列虽然来源于人类种系vh序列和vl序列并与之相关,但在自然条件下,可能不存在于体内人类抗体种系库中
49.术语“同种型”可指由重链恒定区基因编码的抗体类别(例如,igm或iggl)。
50.在本文中,短语“识别抗原的抗体”和“对抗原特异的抗体”可与术语“与抗原特异
性结合的抗体”互换使用。
[0051]“人源化抗体”具有通过一个或多个氨基酸置换、缺失和/或添加而不同于源于非人类物种的抗体的序列,使得当给人类受试者施用时,与非人类物种抗体相比,人源化抗体不太可能诱导免疫应答和/或诱导不太严重的免疫应答。在一个实施方案中,使非人类物种抗体的重链和/或轻链的框架和恒定域中的特定氨基酸产生突变以产生人源化抗体。可在人类框架序列内进行额外的框架区修饰。在另一个实施方案中,术语“人源化抗体”可以是指其中的来源于另一种哺乳动物物种(诸如小鼠)的种系的cdr序列已经移植到人类框架序列上的抗体。在另一个实施方案中,来自人类抗体的一个或多个恒定域与非人类物种的一个或多个可变域融合。在另一个实施方案中,改变非人类抗体的一个或多个cdr序列中的一个或多个氨基酸残基以降低非人类抗体施用于人类受试者时可能的免疫原性,其中,改变的氨基酸残基对于抗体与其抗原的免疫特异性结合不是关键的,或者对氨基酸序列所做的改变是保守的改变,使得人源化抗体与抗原的结合不会显著劣于非人类抗体与抗原的结合。有关如何制备人源化抗体的示例,请参阅美国专利第6,054,297号、第5,886,152号和第5,877,293号。
[0052]
术语“嵌合抗体”可以是指其中的可变区序列可来源于一个物种并且恒定区序列可来源于另一个物种的抗体,例如其中的可变区序列可来源于小鼠抗体并且恒定区序列可来源于人类抗体。
[0053]
如本文所用,“特异性结合人类cd47”的抗体可以是指与人类cd47蛋白(也可以是来自一种或多种非人类物种的cd47蛋白)结合并且可通过活化肿瘤特异性先天性免疫应答来增强靶向肿瘤的免疫应答的抗体。拮抗性cd47抗体可用作单一疗法或与其他免疫检查点疗法联合使用。优选地,抗体以“高亲和力”结合人类cd47蛋白,即kd为1x10-7 m或以下、更优选地5x10-8 m或以下、更优选地3x10-8 m或以下、更优选地1x10-8 m或以下、更优选地5x10-9 m或以下或甚至更优选地1x10-9
m或以下。
[0054]
术语对igg抗体具有“高亲和力”可以是指针对靶抗原的ec
50
为1x10-6 m或以下,优选地1x10-7 m或以下,甚至更优选地1x10-8 m或以下,甚至更优选地1x10-9
m或以下,甚至更优选地1x10-10 m或以下的抗体。然而,“高亲和力”结合可因其他抗体同种型而异。
[0055]
如本文所用,术语“抑制”是指例如特定作用、功能或相互作用的任何减少。例如,如果与参考状态(诸如在野生型状态或未施用药剂的状态的对照)相比,生物学功能(诸如蛋白质的功能和/或一种蛋白质与另一种蛋白质结合的功能)降低,则生物学功能受到抑制。例如,如果结合、信号传导和其他免疫效果因与药剂(诸如抗cd47抗体,与cd47蛋白不与药剂接触的情况相比)接触而降低,则cd47蛋白与它的配体中的一种或多种配体的结合,例如,和/或所产生的cd47信号传导和免疫效果降低。例如,通过在特定时间和/或地点施用药剂,可诱导此类抑制或缺陷,或者例如,通过连续施用,可持续出现此类抑制或缺陷。此类抑制或缺陷也可以是部分抑制或缺陷或完全抑制或缺陷(例如,与诸如野生型状态之类的对照的参考状态相比,基本上没有可测量的活性)。基本上,完全抑制或缺陷被称为阻断。
[0056]
术语“受试者”可以指任何人类或非人类动物。术语“非人类动物”包括所有脊椎动物,例如哺乳动物和非哺乳动物,诸如非人类灵长类动物、羊、狗、猫、牛、马、鸡、兔、小鼠、大鼠、两栖动物和爬行动物,尽管优选哺乳动物,诸如非人类灵长类动物、羊、狗、猫、牛和马。
[0057]
本公开发明的抗体与cd47的结合可通过使用本领域中的一种或多种成熟技术进
行评估。例如,在优选的实施方案中,可通过各种生化测定(诸如elisa测定)对纯化的抗cd47抗体进行测试,例如通过评估与重组cd47蛋白的结合。其他合适的结合测定包括但不限于流式细胞术测定,其中,抗体与表达人类cd47的细胞系反应,诸如已转染以在其细胞表面上表达cd47(例如,人类cd47)的jurkat细胞。此外,可以在biacore结合测定等中测试抗体的结合,包括结合动力学(例如,kd值)。
[0058]
优选地,本公开发明的抗体结合ec
50
为5x10-8 m或以下的cd47蛋白,结合ec
50
为2x10-8 m或以下的cd47蛋白,结合ec
50
为2x10-8 m或以下的cd47蛋白,结合ec
50
为5x10-9 m或以下的cd47蛋白质,结合ec
50
为4x10-9 m或以下的cd47蛋白质,结合ec
50
为3x10-9 m或以下的cd47蛋白质,结合ec
50
为2x10-9 m或以下的cd47蛋白质,结合ec
50
为1x10-9 m或以下的cd47蛋白质。
[0059]
可分离表达针对抗原的抗体的b细胞或杂交瘤,并且可通过下一代测序获得编码重链可变域(vh)和轻链可变域(vl)的核酸序列。可从核酸序列中获得经编码的vh和vl的氨基酸序列。这些技术为本领域普通技术人员所熟知。
[0060]
克隆#6b8的vh氨基酸序列显示在seq id no:1中。克隆#6b8的vl氨基酸序列显示在seq id no:2中。克隆#6e12的vh氨基酸序列显示在seq id no:17中。克隆#6e12的vl氨基酸序列显示在seq id no:18中。克隆#6g7的vh氨基酸序列显示在seq id no:33中。克隆#6g7的vl氨基酸序列显示在seq id no:34中。克隆#6g10的vh氨基酸序列显示在seq id no:49中。克隆#6g10的vl氨基酸序列显示在seq id no:50中。克隆#1g4的vh氨基酸序列显示在seq id no:65中。克隆#1g4的vl氨基酸序列显示在seq id no:66中。
[0061]
因此,在一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包括包含seq id no:1的氨基酸序列的重链可变区;(b)包括包含seq id no:2的氨基酸序列的轻链可变区;其中,抗体与人类cd47特异性结合。
[0062]
在另一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包括包含seq id no:17的氨基酸序列的重链可变区;(b)包括包含seq id no:18的氨基酸序列的轻链可变区;其中,抗体与人类cd47特异性结合。
[0063]
在另一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包括包含seq id no:33的氨基酸序列的重链可变区;(b)包括包含seq id no:34的氨基酸序列的轻链可变区;其中,抗体与人类cd47特异性结合。
[0064]
在另一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包括包含seq id no:49的氨基酸序列的重链可变区;(b)包括包含seq id no:50的氨基酸序列的轻链可变区;其中,抗体特异性结合人类cd47。
[0065]
在另一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包括包含seq id no:65的氨基酸序列的重链可变区;(b)包括包含seq id no:66的氨基酸序列的轻链可变区;其中,抗体特异性结合人类cd47。
[0066]
在一些实施方案中,抗cd47单克隆抗体或其抗原结合部分刺激抗肿瘤免疫应答。在一些实施方案中,抗cd47单克隆抗体可以是双特异性抗体、抗体融合蛋白抗体、免疫偶联抗体、免疫毒素抗体和/或嵌合抗体。
[0067]
在另一方面,本公开提供了包含克隆#6b8的重链和轻链cdr1、cdr2和cdr3的抗体。克隆#6b8的vh cdr1的氨基酸序列显示在seq id no:3中。克隆#6b8的vh cdr2的氨基酸序
列显示在seq id no:4中。克隆#6b8的vh cdr3的氨基酸序列显示在seq id no:5中。克隆#6b8的vl cdr1的氨基酸序列显示在seq id no:6中。克隆#6b8的vl cdr2的氨基酸序列是lys-ile-ser,如seq id no:7所示。克隆#6b8的vl cdr3的氨基酸序列显示在seq id no:8中。
[0068]
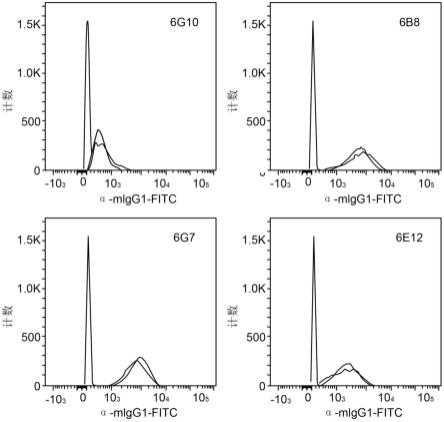
在另一方面,本公开提供了包含克隆#6e12的重链和轻链cdr1、cdr2和cdr3的抗体。克隆#6e12的vh cdr1的氨基酸序列显示在seq id no:19中。克隆#6e12的vh cdr2的氨基酸序列显示在seq id no:20中。克隆#6e12的vh cdr3的氨基酸序列显示在seq id no:21中。克隆#6e12的vl cdr1的氨基酸序列显示在seq id no:22中。克隆#6e12的vl cdr2的氨基酸序列是ser-ala-asn,如seq id no:23所示。克隆#6e12的vl cdr3的氨基酸序列显示在seq id no:24中。
[0069]
在另一方面,本公开提供了包含克隆#6g7的重链和轻链cdr1、cdr2和cdr3的抗体。克隆#6g7的vh cdr1的氨基酸序列显示在seq id no:35中。克隆#6g7的vh cdr2的氨基酸序列显示在seq id no:36中。克隆#6g7的vh cdr3的氨基酸序列显示在seq id no:37中。克隆#6g7的vl cdr1的氨基酸序列显示在seq id no:38中。克隆#6g7的vl cdr2的氨基酸序列是arg-val-asn,如seq id no:39所示。克隆#6g7的vl cdr3的氨基酸序列显示在seq id no:40中。
[0070]
在另一方面,本公开提供了包含克隆#6g10的重链和轻链cdr1、cdr2和cdr3的抗体。克隆#6g10的vh cdr1的氨基酸序列显示在seq id no:51中。克隆#6g10的vh cdr2的氨基酸序列显示在seq id no:52中。克隆#6g10的vh cdr3的氨基酸序列显示在seq id no:53中。克隆#6g10的vl cdr1的氨基酸序列显示在seq id no:54中。克隆#6g10的vl cdr2的氨基酸序列是lys-val-ser,如seq id no:55所示。克隆#6g10的vl cdr3的氨基酸序列显示在seq id no:56中。
[0071]
在另一方面,本公开提供了包含克隆#1g4的重链和轻链cdr1、cdr2和cdr3的抗体。克隆#1g4的vh cdr1的氨基酸序列显示在seq id no:67中。克隆#1g4的vh cdr2的氨基酸序列显示在seq id no:68中。克隆#1g4的vh cdr3的氨基酸序列显示在seq id no:69中。克隆#1g4的vl cdr1的氨基酸序列显示在seq id no:70中。克隆#1g4的vl cdr2的氨基酸序列显示在seq id no:71中。克隆#1g4的vl cdr3的氨基酸序列显示在seq id no:72中。
[0072]
可使用kabat系统划定cdr区域(kabat et al.(1991)sequences of proteins of immunological interest,fifth edition,u.s.department of health and human services,nih publication no.91-3242)。
[0073]
在另一方面,本公开提供了编码单克隆抗体克隆#6b8的重链可变域和轻链可变域的氨基酸序列(表1)。
[0074]
在另一方面,本公开提供了编码单克隆抗体克隆#6e12的重链可变域和轻链可变域的氨基酸序列(表1)。
[0075]
在另一方面,本公开提供了编码单克隆抗体克隆#6g7的重链可变域和轻链可变域的氨基酸序列(表1)。
[0076]
在另一方面,本公开提供了编码单克隆抗体克隆#6g10的重链可变域和轻链可变域的氨基酸序列(表1)。
[0077]
在另一方面,本公开提供了编码单克隆抗体克隆#1g4的重链可变域和轻链可变域
的氨基酸序列(表1)。
[0078]
在另一方面,本公开提供了编码单克隆抗体克隆#6b8的重链可变域和轻链可变域的多核苷酸序列(表2)。
[0079]
在另一方面,本公开提供了编码单克隆抗体克隆#6e12的重链可变域和轻链可变域的多核苷酸序列(表2)。
[0080]
在另一方面,本公开提供了编码单克隆抗体克隆#6g7的重链可变域和轻链可变域的多核苷酸序列(表2)。
[0081]
在另一方面,本公开提供了编码单克隆抗体克隆#6g10的重链可变域和轻链可变域的多核苷酸序列(表2)。
[0082]
在另一方面,本公开提供了编码单克隆抗体克隆#1g4的重链可变域和轻链可变域的多核苷酸序列(表2)。
[0083]
通过轻链改组并结合或不结合其重链可变域的随机诱变以及针对cd47的淘选,可使抗体亲和力成熟。可用轻链改组对本公开发明中提及的抗体的vl cdr1、vl cdr2和vl cdr3进行优化,以产生本公开发明的其他cd47结合分子。
[0084]
还可使用具有本文公开的vh序列和/或vl序列中的一种或多种的抗体作为起始材料来制备本公开发明的抗体,以对修饰的抗体进行工程改造,该修饰的抗体可具有不同于起始抗体的特性。通过修饰一个或两个可变区(即vh和/或vl)内(例如一个或多个cdr区和/或一个或多个框架区内)的一个或多个残基,可对抗体进行工程改造。另外或可选地,通过修饰一个或多个恒定区内的残基,从而例如改变抗体的一种或多种效应子功能,可对抗体进行工程改造。
[0085]
在特定实施方案中,cdr移植可用于对抗体的可变区进行工程改造。抗体主要通过位于六个重链互补决定区(cdr)和轻链互补决定区(cdr)中的氨基酸残基与靶抗原相互作用。因此,cdr内的氨基酸序列在单个抗体之间可能比cdr外的序列更加多样化。
[0086]
由于cdr序列可能负责大多数抗体-抗原相互作用,因此,可通过构建表达载体来表达模拟特定天然抗体的特性的重组抗体,该表达载体包括来自特定天然抗体的移植到来自具有不同特性的不同抗体的框架序列上的cdr序列(请参阅例如,riechmann et al.(1998)nature 332:323-327;jones et al.(1986)nature 321:522-525;queen et al.(1989)proc.natl.acad.请参阅u.s.a.86:10029-10033;美国专利第5,225,539号;第5,530,101号;第5,585,089号;第5,693,762号和第6,180,370号)。
[0087]
因此,本公开发明的另一个实施方案涉及分离的单克隆抗体或其抗原结合部分,包括包含cdr1序列、cdr2序列和cdr3序列的重链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:3、seq id no:4和seq id no:5的氨基酸序列,以及包含cdr1序列、cdr2序列和cdr3序列的轻链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:6、lys-ile-ser seq id no:7和seq id no:8的氨基酸序列。
[0088]
因此,本公开发明的另一个实施方案涉及分离的单克隆抗体或其抗原结合部分,包括包含cdr1序列、cdr2序列和cdr3序列的重链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:19、seq id no:20和seq id no:21的氨基酸序列,以及包含cdr1序列、cdr2序列和cdr3序列的轻链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:22、ser-ala-asn seq id no:23和seq id no:24的氨基酸序列。
[0089]
因此,本公开发明的另一个实施方案涉及分离的单克隆抗体或其抗原结合部分,包括包含cdr1序列、cdr2序列和cdr3序列的重链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:35、seq id no:36和seq id no:37的氨基酸序列,以及包含cdr1序列、cdr2序列和cdr3序列的轻链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:38、arg-val-asn seq id no:39和seq id no:40的氨基酸序列。
[0090]
因此,本公开发明的另一个实施方案涉及分离的单克隆抗体或其抗原结合部分,包括包含cdr1序列、cdr2序列和cdr3序列的重链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:51、seq id no:52和seq id no:53的氨基酸序列,以及包含cdr1序列、cdr2序列和cdr3序列的轻链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:54、lys-val-ser seq id no:55和seq id no:56的氨基酸序列。
[0091]
因此,本公开发明的另一个实施方案涉及分离的单克隆抗体或其抗原结合部分,包括包含cdr1序列、cdr2序列和cdr3序列的重链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:67、seq id no:68和seq id no:69的氨基酸序列,以及包含cdr1序列、cdr2序列和cdr3序列的轻链可变区,该cdr1序列、cdr2序列和cdr3序列分别包含seq id no:70、seq id no:71和seq id no:72的氨基酸序列。
[0092]
此类框架序列可从公共dna数据库或包括种系抗体基因序列的已发表参考文献中获得。例如,可使用imgt reference文库(lefranc,m.-p.and lefranc,g,the immunoglobulin facts book academic press,london,uk(2001))划定cdr区。
[0093]
通过使用本领域技术人员众所周知的被称为gapped blast的序列相似性搜索方法之一(altschul et al.(1997),supra),将抗体蛋白质序列与已编译的蛋白质序列数据库进行比较。当前本公开发明的组合物和方法不限于本文公开的示例性序列的变型,而是包括与本文公开的示例性序列具有至少90%、至少95%和至少99%序列同一性的序列。
[0094]
鉴于这些抗体fab中的每一者均可结合人类cd47,可将vh序列和vl序列“混合和匹配”以产生本发明的其他抗cd47结合分子。优选地,当vh链和vl链混合和匹配时,来自特定vh/vl配对的vh序列替换为结构相似的vh序列。同样,优选地,来自特定vh/vl配对的vl序列替换为结构相似的vl序列。
[0095]
因此,在一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no 1的氨基酸序列的重链可变区;(b)包含seq id no 2的氨基酸序列的轻链可变区;其中,抗体特异性结合人类cd47并抑制有利于增强先天性免疫的cd47信号传导。
[0096]
因此,在一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no 17的氨基酸序列的重链可变区;(b)包含seq id no 18的氨基酸序列的轻链可变区;其中,抗体特异性结合人类cd47并抑制有利于增强先天性免疫的cd47信号传导。
[0097]
因此,在一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no 33的氨基酸序列的重链可变区;(b)包含seq id no 34的氨基酸序列的轻链可变区;其中,抗体特异性结合人类cd47并抑制有利于增强先天性免疫的cd47信号传导。
[0098]
因此,在一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no 49的氨基酸序列的重链可变区;(b)包含seq id no 50的氨基酸序列的
轻链可变区;其中,抗体特异性结合人类cd47并抑制有利于增强先天性免疫的cd47信号传导。
[0099]
因此,在一方面,本公开提供了一种分离的单克隆抗体或其抗原结合部分,包括:(a)包含seq id no 65的氨基酸序列的重链可变区;(b)包含seq id no 66的氨基酸序列的轻链可变区;其中,抗体特异性结合人类cd47并抑制有利于增强先天性免疫的cd47信号传导。
[0100]
可从产生此类抗体的任何来源分离出编码抗cd47抗体或其部分的重链或整个轻链的核酸分子。在各种实施方案中,从b细胞或永生化细胞分离出核酸分子,该b细胞从免疫cd47的动物分离而出,该永生化细胞来源于表达抗cd47抗体的此类b细胞。对编码抗体的mrna进行分离的方法是本领域众所周知的。请参阅,例如,sambrook等人。mrna可用于产生用于抗体基因的聚合酶链式反应(pcr)或cdna克隆的cdna。在优选的实施方案中,从杂交瘤分离出核酸分子,该杂交瘤具有来自非人类转基因动物的产生人免疫球蛋白的细胞作为它的融合伴侣之一。在另一个实施方案中,可从非人类、非转基因动物分离出核酸。从非人类、非转基因动物分离出的核酸分子可用于例如人源化抗体。
[0101]
在另一方面,本公开提供了一种药物组合物,该药物组合物包含一种或多种本发明的与药学上可接受的载体一起配制的抗体。可选地,组合物可包含一种或多种额外的药物活性成分,诸如另一种抗体或药物。本公开发明的药物组合物在联合疗法中还可与例如另一种免疫刺激剂、抗癌剂、抗病毒剂或疫苗一起施用,使得抗cd47抗体增强由疫苗刺激的免疫应答。
[0102]
药物组合物可包含任何数量的赋形剂。可使用的赋形剂包括载体、表面活性剂、增稠剂或乳化剂、固体粘合剂、分散剂或悬浮助剂、增溶剂、着色剂、调味剂、包被、崩解剂、润滑剂、甜味剂、防腐剂、等渗剂以及它们的组合。gennaro,ed.,remington提供了有关选择和使用合适赋形剂的教导:the science and practice of pharmacy,20th ed。(lippincott williams&wilkins 2003),其公开内容通过引用并入本文。
[0103]
治疗组合物通常在制造和储存条件下必须无菌且稳定。组合物可配制成溶液、微乳液、分散剂、脂质体或其他适合于高药物浓度的有序结构。通过将所需量的抗-cd47抗体掺入适当的具有上文列举的成分中的一种或多种的溶剂中,然后,根据需要,进行过滤灭菌,可制备无菌可注射溶液。分散体通常是通过将活性化合物掺入含有基本分散介质以及选自上文列举的成分的其他所需成分的无菌运载体中制备而得。在使用无菌粉末制备无菌可注射溶液的情况下,优选的制备方法是真空干燥和冷冻干燥,真空干燥和冷冻干燥从其先前无菌过滤的溶液中产生活性成分以及任何所需的额外成分的粉末。例如,通过使用包被(诸如卵磷脂),通过在使用分散剂的情况下保持所需的粒度和通过使用表面活性剂,可保持溶液的适当流动性。通过在组合物中添加延迟吸收的试剂(例如,单硬脂酸盐和明胶),可实现延长可注射组合物的吸收。
[0104]
可通过本领域已知的多种方法施用本发明的抗体,尽管对于许多治疗应用,优选的施用途径/方式是皮下输注、肌肉内输注或静脉输注。如本领域技术人员将会理解,施用途径和/或方式将会根据所需结果而变化。
[0105]
在特定实施方案中,抗体组合物活性化合物可与将会保护抗体免于被快速释放的载体(诸如控释制剂,包括植入物、透皮贴剂和微囊化递送系统)一起制备。可使用可生物降
解的生物相容性聚合物,诸如乙烯醋酸乙烯酯、聚酸酐、聚乙醇酸、胶原、聚原酸酯和聚乳酸。用于制备此类制剂的许多方法已获得专利或通常为本领域技术人员所熟知。请参阅,例如,sustained and controlled release drug delivery systems(j.r.robinson,ed.,marcel dekker,inc.,new york,1978)。
[0106]
在特定实施方案中,本公开发明的抗cd47抗体可与例如惰性稀释剂或可同化的可食用载体一起口服施用。化合物(和其他成分,如果有需要)也可封装在硬壳或软壳明胶胶囊中,压制成片剂,或直接掺入受试者的饮食中。对于口服治疗施用,抗cd47抗体可与赋形剂结合并且以可摄取的片剂、含服片剂、片剂、锭剂、胶囊、酏剂、混悬剂、糖浆剂、晶片等形式使用。为了通过非肠道施用方式施用本公开发明的化合物,可能需要在化合物上包被一种材料或与材料共同施用,以防止其失活。
[0107]
也可将额外的活性化合物掺入本公开的组合物中。在特定实施方案中,本公开发明的抗cd47抗体与一种或多种额外的治疗剂共同配制和/或共同施用。这些药剂包括但不限于结合其他靶标的抗体(例如,结合一种或多种生长因子或细胞因子或其细胞表面受体的抗体,诸如抗pd-1抗体和抗ctla-4抗体)、抗肿瘤剂、抗癌剂、化疗剂、活化cd40的肽类似物、可溶性cd40l、一种或多种活化cd40的化学试剂、cpg寡脱氧核苷酸和/或本领域已知的可增强针对肿瘤细胞的免疫应答的其他药剂,例如,ifn-1、il-2、il-8、il-12、il-15、il-18、il-23、ifn-γ和gm-csf。此类联合疗法可能需要较低剂量的抗cd47拮抗剂抗体以及共同施用的药剂,从而避免与各种免疫疗法相关联的潜在毒性或并发症。目前获临床批准的靶向免疫检查点的免疫疗法(诸如pd-1和ctla-4)已显示出充满前景的临床结果。然而,患者对这些获批药剂的应答率仍无法令人满意。通过活化先天性免疫应答,包括cd47在内的新型免疫检查点靶点可增强靶向肿瘤的免疫应答。拮抗性cd47抗体可用作单一疗法或与其他免疫检查点疗法联合使用。
[0108]
本公开发明的抗cd47抗体以及包含它们的组合物也可联合其他治疗方案进行施用,尤其联合放射治疗进行施用。
[0109]
本公开发明的药物组合物可包括药学上可接受的盐。“药学上可接受的盐”可以是指保留所需的母体化合物的生物活性并且不产生任何不期望的毒理学效应的盐。此类盐的示例包括酸加成盐和碱加成盐。酸加成盐包括来源于无毒无机酸(诸如盐酸、硝酸、磷酸、硫酸、氢溴酸、氢碘酸、亚磷酸等)的酸加成盐,以及来源于无毒有机酸(诸如脂肪族单羧酸和二羧酸、苯基取代的链烷酸、羟基烷酸、芳香酸、脂肪族和芳香族磺酸等)的酸加成盐。碱加成盐包括来源于碱土金属(诸如钠、钾、镁、钙等)的碱加成盐,以及来源于无毒有机胺(诸如n,n'-二苄基乙二胺、n-甲基葡糖胺、氯普鲁卡因、胆碱、二乙醇胺、乙二胺、普鲁卡因等)的碱加成盐。
[0110]
对剂量方案进行调整,以实现最佳的所需应答(例如,治疗应答)。例如,可施用单次推注,可随时间推移施用多次分开的剂量,或者可根据治疗情况的紧急情况按比例减少或增加剂量。以剂量单位的形式配制非肠道组合物以便于施用和剂量的均匀性尤其有利。如本文所用的剂量单位形式是指适合作为待治疗受试者的单位剂量的物理离散单位;每个单位含有经计算可产生与所需的药物载体相关联的期望治疗效果的预定量的活性化合物。或者,抗体可作为缓释制剂施用,在这种情况下,可能需要较低的施用频率。
[0111]
在特定实施方案中,通过使免疫原性最小化并且使亲和力、稳定性和特异性最大
化的修饰,可进一步将抗体发展成适合人类治疗的形式。其他可能涉及寡聚、药物偶联和与其他功能性蛋白融合的形式。
[0112]
本公开发明的抗体或抗体部分的治疗或预防有效量的示例性非限制性范围是0.025mg/kg至50mg/kg,更优选地0.1mg/kg至50mg/kg,更优选地0.1mg/kg至25mg/kg、0.1mg/kg至10mg/kg和0.1mg/kg至3mg/kg。需要注意的是,剂量值可能会随着待缓解病症的类型和严重程度而变化。还应理解,对于任何特定受试者,应根据个体需要以及施用或监督组合物施用情况的人的专业判断,随时间推移对具体的剂量方案进行调整,并且还应理解,本文所述的剂量范围仅仅是示例性剂量范围且并非意在限制所要求保护的组合物的范围或实践。
[0113]
可通过多种方法(包括融合杂交瘤或连接fab'片段)产生双特异性抗体或抗原结合片段。请参阅,例如,songsivilai&lachmarm,clin.exp.immunol.79:315-321(1990),kostelny et al.,j.immunol.148:1547-1553(1992)。此外,双特异性抗体可形成为“双链抗体”或“janusins”。在一些实施方案中,双特异性抗体结合cd47的两个不同表位。在一些实施方案中,双特异性抗体具有来自单克隆抗体克隆#6b8的第一重链和第一轻链(表1),以及额外的抗体重链和轻链。在一些实施方案中,双特异性抗体具有来自单克隆抗体克隆#6e12的第一重链和第一轻链,以及额外的抗体重链和轻链。在一些实施方案中,双特异性抗体具有来自单克隆抗体克隆#6g7的第一重链和第一轻链,以及额外的抗体重链和轻链。在一些实施方案中,双特异性抗体具有来自单克隆抗体克隆#6g10的第一重链和第一轻链,以及额外的抗体重链和轻链。表1抗cd47抗体氨基酸序列表。表1抗cd47抗体氨基酸序列表。表2编码抗cd47抗体可变域的核酸序列。克隆#序列名称seq id no克隆#6b8重链v域(seq id no:9) 轻链v域(seq id no:10)克隆#6e12重链v域(seq id no:25) 轻链v域(seq id no:26)
克隆#6g7重链v域(seq id no:41) 轻链v域(seq id no:42)克隆#6g10重链v域(seq id no:57) 轻链v域(seq id no:58)克隆#1g4重链v域(seq id no:73) 轻链v域(seq id no:74)
[0114]
实施例1.抗cd47抗体的产生。
[0115]
通过将免疫人类cd47小鼠脾细胞(balb/c株)与sp2/0-ag14细胞(atcc)进行电融合,产生了抗体。从高度免疫购买获得的重组人类cd47蛋白的balb/c小鼠收集脾细胞。使用btx的标准方案进行了细胞融合。将融合细胞接种到96孔板中,并且进行了磁珠筛选,以识别含有与人类cd47蛋白相互作用的抗体的抗原结合磁珠。进一步扩增阳性孔,然后进行有限稀释以分离单克隆杂交瘤。纯化的抗体用于测试它们结合cd47以及中和与sirp-α的相互作用的能力。
[0116]
实施例2.抗cd47抗体结合测定
[0117]
使用1μg avi抗hcd47单克隆抗体(克隆6g7、克隆6b8、克隆6g10或克隆6e12)对1x10
6 h1299-hcd47的过表达细胞进行染色30分钟。进行洗涤之后,使用fitc偶联抗migg1(jackson immunoresearch)作为二级抗体检测了细胞表面上的小鼠抗hcd47抗体。使用cytek nl-3000进行流式细胞术,并且使用flowjo对数据进行了分析。图1所示的测定结果表明,这些抗hcd47单克隆抗体与细胞表面上的人类cd47结合。
[0118]
实施例3.抗cd47抗体结合测定
[0119]
用不同浓度的avi抗hcd47单克隆抗体(克隆6g7、克隆6b8、克隆6g10)对人类cd47偶联纳米颗粒或食蟹猴cd47偶联纳米颗粒进行染色2小时。进行洗涤之后,使用hrp偶联抗migg1(jackson immunoresearch)作为二级抗体检测了小鼠抗hcd47抗体。依次加入tmb底物溶液和终止溶液进行了单次检测。通过spectramax m2微孔板读取器(分子器件)对450nm处的光密度进行了测量。图2所示的测定结果表明,这些抗hcd47单克隆抗体与细胞表面上的人类cd47结合。
[0120]
实施例4.抗cd47抗体结合测定
[0121]
用不同浓度的avi抗hcd47单克隆抗体(克隆1g4)对人类cd47偶联纳米颗粒或食蟹猴cd47偶联纳米颗粒进行染色2小时。进行洗涤之后,使用hrp偶联抗migg1(jackson immunoresearch)作为二级抗体检测了小鼠抗hcd47抗体。依次加入tmb底物溶液和终止溶液进行了单次检测。通过spectramax m2微孔板读取器(分子器件)对450nm处的光密度进行了测量。图3所示的测定结果表明,克隆1g4单克隆抗体与人类cd47和食蟹猴cd47两者结合。
[0122]
实施例5.抗cd47抗体吞噬作用测定
[0123]
在完全rpmi培养基+10ng/ml gm-csf中培养单核细胞7天,以诱导巨噬细胞分化。通过在完全rpmi培养基+10-ng/ml gm-csf+20-ng/ml ifn-γ+100-ng/ml lps中培养24小时,巨噬细胞进一步极化为m1巨噬细胞。用5-mm cfse标记了raji细胞。m1巨噬细胞和cfse标记的raji细胞与各种浓度的抗hcd47抗体在96孔板中共同培养了2小时,以启动吞噬作用过程。巨噬细胞上的fcγ受体被人类trustain fcx抗体(biolegend)阻断。用抗cd11c、抗cd45、抗cd80和pi(biolegend)对巨噬细胞进行进一步染色。将cd11c-/cd45
+
用作标识巨噬
细胞的标志物。用cfse+巨噬细胞的百分比来衡量吞噬作用指数。使用cytek nl-3000进行流式细胞术,并且使用flowjo对数据进行了分析。图4所示的测定结果表明,克隆6b8、克隆6g7、克隆6g10和克隆6e12抗体可增强巨噬细胞的吞噬作用。
[0124]
实施例6.抗cd47抗体吞噬作用测定
[0125]
在完全rpmi培养基+10ng/ml gm-csf中培养单核细胞7天,以诱导巨噬细胞分化。通过在完全rpmi培养基+10-ng/ml gm-csf+20-ng/ml ifn-γ+100-ng/ml lps中培养24小时,巨噬细胞进一步极化为m1巨噬细胞。用5-mm cfse标记了raji细胞。m1巨噬细胞和cfse标记的raji细胞与各种浓度的抗hcd47抗体在96孔板中共同培养了2小时,以启动吞噬作用过程。巨噬细胞上的fcγ受体被人类trustain fcx抗体(biolegend)阻断。用抗cd11c、抗cd45、抗cd80和pi(biolegend)对巨噬细胞进行进一步染色。将cd11c-/cd45
+
用作标识巨噬细胞的标志物。用cfse+巨噬细胞的百分比来衡量吞噬作用指数。使用cytek nl-3000进行流式细胞术,并且使用flowjo对数据进行了分析。图5所示的测定结果表明,克隆6b8、克隆6g7和克隆1g4抗体可增强巨噬细胞的吞噬作用。
[0126]
实施例7.抗cd47抗体结合测定
[0127]
使用1μg avi抗hcd47人源化mab(克隆6b8或克隆6g7)对1x106h1299-hcd47的过表达细胞进行染色30分钟。进行洗涤之后,使用fitc偶联抗人igg(jackson immunoresearch)作为二级抗体检测了细胞表面上的小鼠抗hcd47抗体。使用cytek nl-3000进行流式细胞术,并且使用flowjo对数据进行了分析。图6所示的测定结果表明,抗hcd47人源化mab(克隆6b8和克隆6g7)保留了与细胞表面上人类cd47结合的能力。
[0128]
实施例8.抗cd47抗体体内抗肿瘤测定
[0129]
使用nci-h82(atcc,1.25x106细胞/小鼠)肺癌细胞系在7周龄雌性nsg小鼠(杰克逊实验室)皮下建立了异种移植瘤。当肿瘤体积达到50mm3时,开始了抗体治疗。用10mg/kg抗体对小鼠进行每周三次的治疗。通过腹膜内注射施用抗体3周。治疗开始之后,使用卡尺对肿瘤大小的两种尺寸进行每周两次的测量,并且使用以下公式以mm3为单位表示体积:v=0.5a
×
b2,其中,a和b分别是肿瘤的长尺寸和短尺寸。图7所示的测定结果证明,人源化克隆6b8和克隆6g7具有体内抗肿瘤功效。
[0130]
尽管为了清楚地理解,已经通过图示和示例的方式对上述本发明进行了一些详细说明,但是对于本领域的技术人员显而易见的是,可实施特定更改和修改。因此,描述和示例不应被解释为限制本公开发明的范围。
[0131]
本文通过标识引用提及的所有出版物、专利、专利申请和已发布的专利申请的公开内容据此通过引用方式整体并入本文。本文中的所有公开刊物均以引用方式并入,其程度与每个单独公开刊物或专利申请被明确且单独地指示以引用方式并入的程度相同。以下描述包括可能有助于理解本发明的信息。并非承认本文提供了的任何信息是现有技术或与当前要求保护的发明有关,或者任何明确或隐含引用的任何公开刊物是现有技术。
[0132]
本文所述的多核苷酸/肽序列的序列表包括在本文的附录中,其通过引用方式整体并入本文。参考文献
[0133]
advani等人,“cd47 blockade by hu5f9-g4 and rituximab in non-hodgkin’s lymphoma”。n engl j med.2018nov 1;379(18):1711-1721。
[0134]
bird等人,“single-chain antigen-binding proteins”.science.1988oct,242(4877):423-6.
[0135]
gennaro,ed.,“remington:the science and practice of pharmacy”。20th edition.lippincott williams&wilkins.2003。
[0136]
huston等人,“protein engineering of antibody binding sites:recovery of specific activity in an anti-digoxin single-chain fv analogue produced in escherichia coli”。proc natl acad sci u s a.1988aug;85(16):5879
–
5883。
[0137]
j.r.robinson ed.,“sustained and controlled release drug delivery systems”.marcel dekker,inc.,new york,1978。
[0138]
jones等人,“replacing the complementarity-determining regions in a human antibody with those from a mouse”。nature.1986;4,321(6069):522-5。
[0139]
kabat等人,“sequences of proteins of immunological interest”,fifth edition,u.s.department of health and human services,1991;nih publication no.91-3242
[0140]
kostelny等人,“formation of a bispecific antibody by the use of leucine zipper”。j immunol.1992mar 1;148(5):1547-53。
[0141]
mahoney等人,2015.combination cancer immunotherapy and new immunomodulatory targets。nat rev drug discov 14:561
–
584。
[0142]
paul等人,“fundamental immunolog”。philadelphia:wolters kluwer health/lippincott williams&wilkins,2013。
[0143]
postow,等人,2015,"nivolumab and ipilimumab versus ipilimumab in untreated melanoma."n engl j med.2015;372(21):2006-17。
[0144]
queens等人,“a humanized antibody that binds to the interleukin 2receptor”。proc natl acad sci u s a.1989dec;86(24):10029
–
10033。
[0145]
sambrook j等人,“molecular cloning:a laboratory manual”,third edition,2000。
[0146]
songsivilai&lachmarm,“bispecific antibody:a tool for diagnosis and treatment of disease”。clin exp immunol.1990mar;79(3):315
–
321。
[0147]
wolchok等人,nivolumab plus ipilimumab in advanced melanoma.n engl j med2013;369:122
–
33。
[0148]“yervoy,ipilimumab(bms-734016)-product profile-biocentury”。biocentury online intelligence.biocentury publications。检索日期:2016年8月11日。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1