用于治疗视网膜母细胞瘤的药物组合物和制剂的制作方法
用于治疗视网膜母细胞瘤的药物组合物和制剂
1.本发明提供了用于治疗视网膜母细胞瘤的组合物、制剂和方法。
背景技术:
2.视网膜母细胞瘤是一种由于视网膜中rb1基因的基因突变导致视网膜上出现肿瘤块而发生的癌症,全球每年诊断出8000例新病例,导致约4000例相关死亡。该疾病出现在未成熟的视网膜中,导致儿童出现肿瘤和病变,这通常在两岁时被诊断出来。
3.视网膜母细胞瘤可以通过几种不同的方式(手术、化学疗法和放射疗法)进行治疗。对于进展期疾病,可以通过摘除来进行手术治疗,对于较小的肿瘤,可以通过激光光凝、温热疗法和冷冻疗法进行局部巩固措施。放射治疗可以通过近距离放射治疗或外射束放射治疗来进行。
4.视网膜母细胞瘤最常见的治疗方法是静脉内化疗,静脉内化疗与严重的副作用有关,最显著的是终生听力丧失、免疫系统损害和精神退化。儿童会遭受数月的急性影响,包括严重的中性粒细胞减少、严重的恶心、呕吐、萎靡和脱发。另一种替代方案是使用动脉内化疗。该过程包括将导管从腹股沟中的股动脉穿入到颈内动脉的眼神经,并将化疗药物直接递送到眼动脉,从而递送至肿瘤。在减少全身暴露于化疗药物的同时,这种高度侵入性过程有可能导致中风和眼动脉闭塞。替代方案是有局限性的,玻璃体内注射的对视网膜肿瘤的生物利用度较差,并且需要在视网膜毒性水平下的高药物浓度才能达到临床效果。目前的治疗报告了17%-45%的疾病复发率。治疗往往是昂贵的,需要专门的设施和经常住院,这限制了患者的可用性。
5.已经描述了通过多种途径改善视网膜母细胞瘤和眼部肿瘤治疗的方法。us7,259,180(wo2004/016214)描述了将治疗剂与叶黄素类胡萝卜素连接以产生前药并施用治疗有效量的该前药以治疗视网膜母细胞瘤、囊样黄斑水肿、渗出性年龄相关性黄斑变性、糖尿病性视网膜病变、糖尿病性黄斑水肿或炎性疾病。us7,432,357(wo2005/070967)描述了修饰的针对gd2的抗体,该抗体减少了与抗体依赖性的细胞介导的细胞毒性相关的补体结合,可用于治疗肿瘤,例如神经母细胞瘤、胶质母细胞瘤、黑色素瘤、小细胞肺癌、b细胞淋巴瘤、肾癌、视网膜母细胞瘤和其他神经外胚层起源的癌症。us8,837,675(wo2008/118198)描述了这样的方法:对目标区域如眼睛中的肿瘤进行放射治疗以将对眼睛外表面的辐射暴露减少到小于对目标肿瘤的剂量。us/8,470,785描述了使用nutlin-3或nutlin-3类似物治疗视网膜母细胞瘤。us10,117,947(wo2015/042325)描述了使用与光敏分子缀合的病毒样颗粒来诊断和/或治疗诸如眼部肿瘤等肿瘤的方法和组合物。将病毒样颗粒施用于玻璃体或静脉内施用,随后用红外激光辐照肿瘤的癌细胞。us10,767,182(wo2016/075333)描述了例如通过反义rna选择性抑制mdm4来治疗具有高mdm4蛋白水平的癌症,例如黑色素瘤、乳腺癌、结肠癌或肺癌、胶质母细胞瘤、视网膜母细胞瘤。
6.视网膜母细胞瘤治疗的现状导致复发率显著,是患者的一个重要关注点。因此,需要更有效的治疗方法来治疗视网膜母细胞瘤,防止癌症扩散并保持视力,同时复发和长期副作用最小。本发明提供了用于治疗视网膜母细胞瘤的新型活性剂组合物、制剂和施用方
法。
技术实现要素:
7.本发明提供用于治疗视网膜母细胞瘤肿瘤或病变的药物组合物和制剂,该药物组合物和制剂包含对视网膜母细胞瘤具有抑制活性的化合物。本发明还提供了用于治疗视网膜母细胞瘤肿瘤或病变的方法,该方法包括通过将组合物注射到接近或邻近肿瘤的眼部组织中来将药物组合物来施用至有需要的对象。药物组合物的施用可以放置在眼睛的肿瘤附近的空腔或间隙的区域的玻璃体腔、脉络膜上腔、睫状体上腔或眼球筋膜下(sub-tenon)腔中。施用可以使用针头、套针(trocar)、套管、导管或其组合通过递送或注射装置来进行,以进行药物组合物的微创局部眼部施用。因此,将药物组合物施用到接近或邻近肿瘤的眼部组织包括靠近视网膜母细胞瘤肿瘤或病变的部位。定位药物组合物提供了在肿瘤处的高浓度的活性剂并最大限度地减少对活性剂的全身暴露。
8.以抑制肿瘤生长和减小肿瘤大小为目标,药物组合物被设计成提供在治疗过程中安全治疗肿瘤所需的药物或治疗活性剂的剂量。在一些情况下,本发明的治疗可以辅助使用或与其他治疗联合使用,以根除或控制疾病,同时提高疗效和安全性。
9.药物组合物可以包含在流体中增溶、分散或悬浮的活性剂。活性剂的药物组合物可以与赋形剂一起制备为高粘度或半固体制剂。可选择地,活性剂的药物组合物可以配制成固体组合物。活性剂的药物组合物也可以作为颗粒分布在组合物中。活性剂的药物组合物也可以与赋形剂一起制备为胶体或胶束。
10.本发明的方法可以包括施用具有抗视网膜母细胞瘤细胞活性的治疗活性剂的组合物,该治疗活性剂包括dna损伤剂、hif抑制剂、有丝分裂抑制剂、dna合成抑制剂、bmi抑制剂、syk抑制剂、jak抑制剂、hdac抑制剂、mek抑制剂、拓扑异构酶抑制剂、bcl-2抑制剂或其组合。治疗可以包括将一种或多种活性剂分开、同时或随后施用至对象的眼睛。治疗方法还可以包括将拓扑异构酶抑制剂和bcl-2抑制剂分开、同时或随后施用至对象。可选地,该方法可以进一步包括施用dna损伤剂。合适的治疗方法可以包括14天周期或28天周期,可选地根据需要重复,例如在六个月期间里重复。
具体实施方式
11.本发明包括包含治疗活性剂的组合物或制剂,该组合物或制剂用于通过局部递送至眼睛来治疗视网膜母细胞瘤,其中将该组合物或制剂施用至接近或邻近视网膜母细胞瘤肿瘤或病变的部位。本发明包括包含拓扑异构酶抑制剂的组合物,该组合物用于通过局部施用至眼睛来治疗视网膜母细胞瘤,其中将该组合物的施用至邻近视网膜母细胞瘤肿瘤或病变的部位。本发明包括包含hdac抑制剂的组合物,该组合物用于通过局部施用至眼睛来治疗视网膜母细胞瘤,其中将该组合物的施用至邻近视网膜母细胞瘤肿瘤或病变的部位。本发明包括包含bcl-2抑制剂的组合物,该组合物用于通过局部施用至眼睛来治疗视网膜母细胞瘤,其中将该组合物的施用至邻近视网膜母细胞瘤肿瘤或病变的部位。本发明包括包含bcl-2抑制剂、hdac抑制剂和拓扑异构酶抑制剂中至少两种的组合的组合物,该组合物用于通过局部施用至眼睛来治疗视网膜母细胞瘤,其中将该组合物的施用至接近或邻近视网膜母细胞瘤肿瘤或病变的部位。可以将该组合物或制剂施用到眼睛中接近或邻近视网膜
母细胞瘤肿瘤的玻璃体腔、脉络膜上腔、眼球筋膜下腔或睫状体上腔。
12.合适地,递送装置可以以微创方法接近或邻近视网膜母细胞瘤肿瘤局部施用活性剂的组合物,以向肿瘤提供局部高浓度的活性剂并最大限度地减少对其他眼部组织的和全身性的与可能限制治疗的影响相关的暴露。递送装置可以是使用针头、套针、套管、导管或其组合以执行活性剂的微创局部眼部施用的注射装置。可以将组合物递送至接近或邻近肿瘤的区域中的玻璃体腔、眼球筋膜下腔或脉络膜上腔。
13.可以通过注射、输注或递送含有治疗活性剂的植入物来进行局部施用。局部施用可以通过多种装置进行,包括针头、套管或导管。接近或邻近肿瘤放置治疗活性剂的部位包括玻璃体腔、脉络膜上腔和眼球筋膜下腔。因此,所使用的眼部药物递送装置应适当地设计为精确地递送药物或治疗活性剂接近或邻近眼睛中癌症的具体部位。使用这样的装置允许以比现有治疗更小的侵入方式进行施用,对患者造成的身体创伤显著更少,并减轻癌症在患者体内扩散的可能性。这种用途进一步包括一种或多种上述活性剂在制备用于治疗视网膜母细胞瘤的药物中的用途,该药物通过用针头、套管或导管施用到接近或邻近视网膜母细胞瘤肿瘤或病变的间隙或区域中来治疗视网膜母细胞瘤。
14.特别地,脉络膜上腔覆盖视网膜并允许在间隙中操纵柔性套管或导管以到达覆盖视网膜母细胞瘤肿瘤或病变的位置。套管或导管随后可以将治疗组合物递送到接近或邻近目标肿瘤或病变的间隙中。可以将套管或导管的远末端引入脉络膜上腔或邻近的睫状体上腔中并推进和定位在脉络膜上腔中。可以将柔性套管或导管从前部区域(例如平坦部)放置在脉络膜上腔或睫状体上腔中,然后推进到脉络膜上腔中以将远端尖头靠近目标肿瘤而定位,以防止施用装置可能与肿瘤接触以及肿瘤细胞在无意中扩散。所描述的在脉络膜上腔中使用套管或导管使接近或邻近视网膜母细胞瘤施用治疗化合物成为可能,而没有与肿瘤和装置接触(例如来自肿瘤内注射)相关的肿瘤扩散或肿瘤扩展的风险。因此,将治疗剂施用到接近或邻近肿瘤的间隙中包括靠近视网膜母细胞瘤肿瘤或病变的部位。
15.提供了组合物用于通过施用至脉络膜上腔中来治疗视网膜母细胞瘤,该组合物包含bcl-2抑制剂。还提供了组合的组合物或制剂用于通过施用至脉络膜上腔中来治疗视网膜母细胞瘤,该组合的组合物或制剂包含用于分开、同时或依次施用的bcl-2抑制剂和拓扑异构酶抑制剂或bcl-2抑制剂和hdac抑制剂。
16.bcl-2抑制剂的实例包括但不限于tw-37、维奈托克、纳维托克(navitoclax)、abt-737、沙布托克(sabutoclax)、奥巴克拉(obatoclax)、abt-263、奥利默森(oblimersen)、at101、ss5746、apg-1252、apg-2575、s55746和ubx1967/1325。
17.拓扑异构酶抑制剂的实例包括但不限于拓扑替康、伊立替康、多柔比星、伊立替康、柔红霉素、sn-38、伏瑞洛辛(voreloxin)、贝洛替康和鬼臼毒素的半合成衍生物(依托泊苷)。
18.hdac抑制剂的实例包括但不限于伏立诺他、贝立司他、帕比司他、罗米地辛、恩替司他、莫西司他(mocetinostat)、cudc-101、泰克地那林或烟酰胺。
19.抗癌剂的实例包括但不限于2-甲氧基雌二醇。
20.dna损伤剂的实例包括但不限于六甲蜜胺、苯达莫司汀、白消安、卡铂、卡莫司汀、苯丁酸氮芥、顺铂、环磷酰胺、达卡巴嗪、放线菌素、异环磷酰胺、洛莫司汀、氮芥、美法仑、奥沙利铂、丙卡巴肼、链脲佐菌素、替莫唑胺、噻替派和曲贝替定。
21.本发明还提供了用于治疗视网膜母细胞瘤的包含bcl-2抑制剂、hdac抑制剂和拓扑异构酶抑制剂的试剂盒,其中bcl-2抑制剂、hdac抑制剂或拓扑异构酶抑制剂用于分开、同时或依次施用。
22.本发明还提供了用于治疗眼睛中视网膜母细胞瘤的试剂盒,该试剂盒包括包含至少一种治疗活性剂的组合物和套管或导管插入装置,其中至少一种治疗活性剂选自bcl-2抑制剂、hdac抑制剂或拓扑异构酶抑制剂,并且其中该套管或导管插入装置用于脉络膜上腔或睫状体上腔,可选地,药学上可接受的稀释剂也可以存在于该试剂盒中。
23.在一个实施方式中,本发明提供了bcl-2抑制剂、hdac抑制剂或拓扑异构酶抑制剂,它们抑制细胞生长、侵袭和血管生成或促进视网膜母细胞瘤细胞的凋亡。
24.在一个实施方式中,治疗是通过局部眼部施用进行14至28天的治疗周期,在六个月期间里重复周期。
25.治疗活性剂可以包括治疗活性剂中的一种或多种的持续释放制剂,以在一段时间内提供活性剂释放。可以定制持续释放制剂以在一段时间内提供治疗有效量的活性剂,从而定制治疗间隔或周期。
26.在本文所述的工作过程中已经确定了用于治疗视网膜母细胞瘤同时对正常细胞的毒性显著降低以提供治疗范围的合适的活性剂化合物。两种有前景的化合物进展到了体内视网膜母细胞瘤肿瘤兔模型。
27.tw-37是一种有效的小分子抑制剂,其减弱bcl-2激活并抑制多个bcl-2家族成员。bcl-2是抗凋亡和促血管生成蛋白,其被tw-37抑制有助于诱导癌细胞凋亡。
28.拓扑替康是细胞毒性生物碱喜树碱的半合成衍生物。拓扑替康抑制拓扑异构酶-i(一种参与dna复制的酶)。拓扑替康嵌插在拓扑异构酶-i裂解复合物的dna碱基之间,导致难以修复的双链断裂。
29.bcl-2抑制剂类化合物具有将受益于局部施用而增加化合物的肿瘤水平同时减少全身暴露的特性。还研究了这类化合物与dna损伤剂(顺铂)或拓扑异构酶抑制剂联合使用而产生协同或加成的癌症治疗效果。其他bcl-2抑制剂(维奈托克、纳维托克、abt-737、沙布托克、奥巴克拉、abt-263、奥利默森、at101、ss5746、apg-1252、apg-2575、s55746和ubx1967/1325)也可表现出类似于tw-37的治疗效果。
30.本发明提供(i)通过微创递送将药物产品递送至视网膜,即视网膜母细胞瘤部位;(ii)视网膜母细胞瘤的临床管理;(iii)减少治疗次数和相关副作用;(iii)降低疾病复发率;(iv)保护视力和避免眼球摘除。
31.根据本发明的任何方面使用的药物组合物可以包含药物成分、赋形剂和药学上可接受的稀释剂。药学上可接受的稀释剂可以包含盐以向用稀释剂制备的药物成分提供生理上可接受的渗透压和ph。药学上可接受的稀释剂可以含有重构助剂以促进干燥形式的药物成分的快速重构。使用的药物组合物可以以单位剂型提供。
32.治疗活性剂的制剂
33.活性剂可以在流体中增溶、分散或悬浮。活性剂可以与赋形剂一起制备为高粘度或半固体制剂。可选择地,活性剂可以配制成固体组合物。活性剂也可以作为颗粒分布在组合物中。活性剂也可以与赋形剂一起制备为胶体或胶束。
34.制剂可以包含液体、固体、半固体、胶体或胶束状活性剂组合物,该组合物包含本
文定义的治疗活性剂和赋形剂,使得该组合物旨在用于通过例如小号针头、套管或导管施用,例如,置入眼睛的玻璃体腔、脉络膜上腔、眼球筋膜下腔中。在本技术中,术语“活性剂”、“药物”、“治疗剂”、“治疗活性剂”和“治疗材料”可互换使用。在本技术的上下文中,半固体组合物是指在没有压力的情况下不流动并且在递送后立即保持定位于眼睛中的位置的材料。
35.如本文所述,在一个实施方式中,用于注射的半固体材料可以包含在半固体赋形剂或赋形剂混合物中的活性剂颗粒。在一个实施方式中,半固体材料可以包含在半固体赋形剂或赋形剂混合物中增溶的活性剂。特别地,半固体组合物包含活性剂;半固体组合物在注射压力下流动;半固体组合物在施用期间和施用后立即保持定位在接近或邻近视网膜母细胞瘤肿瘤的施用部位;以及半固体组合物随时间推移而溶解。
36.在一个实施方式中,活性剂或药物与可生物降解聚合物组合以形成含有活性剂的颗粒。可生物降解聚合物可以选自聚羟基丁酸酯、聚二恶烷酮、聚原酸酯、聚己内酯、聚己内酯共聚物、聚己内酯-聚乙二醇共聚物、聚乳酸、聚乙醇酸、聚乳酸-乙醇酸共聚物和/或聚乳酸-乙醇酸-环氧乙烷共聚物。
37.在另一个实施方式中,活性剂的存在量为生物可降解聚合物和活性剂组合物的0.5wt%至70.0wt%,合适地,为10.0wt%至60.0wt%,15.0wt%至50.0wt%,优选20.0wt%至40.0wt%。合适的活性剂如上文讨论。
38.在另一个实施方式中,活性剂组合物可以包含盐。盐可以选自钠盐、钾盐、钙盐和镁盐,包括磷酸盐、氯化物、碳酸盐、乙酸盐、柠檬酸盐、葡糖酸盐、碳酸盐、酒石酸盐及其组合。可以配制盐或盐的组合以提供生理上可接受的ph和渗透压。盐的组合也可以是磷酸盐缓冲盐水。
39.在一个实施方式中,治疗活性剂的制剂形成半固体组合物,该组合物在施加注射压力时流动,但一旦施用到组织中,则在递送位置形成半固体材料以将活性剂定位在目标治疗部位附近。通过使用提供粘弹性特性以促进注射期间流动的赋形剂有助于通过小号针头、套管或导管施用组合物的能力。合适的粘弹性赋形剂包括高分子量聚乙二醇、聚氧化乙烯、高分子量聚乙烯吡咯烷酮和生物聚合物如聚合脂质、透明质酸和硫酸软骨素。取决于聚合物选择和分子量,浓度范围为0.3wt%至50wt%、1wt%至40wt%、5wt%至30wt%、10wt%至20wt%的粘弹性赋形剂提供可注射组合物。在一个实施方式中,组合物与一种或多种治疗活性剂和包含粘弹性赋形剂和生理缓冲剂的赋形剂混合物一起配制。在一个实施方式中,组合物包含赋形剂,该赋形剂在注射后在玻璃体腔、脉络膜上腔或眼球筋膜下腔中经历溶解、生物降解或生物侵蚀。
40.在一个实施方式中,在模具中形成或挤出固体或半固体组合物并使其干燥以形成用于施用的所需尺寸的固体。形成的固体或半固体组合物的用于施用的理想形状是细长形状,其外径尺寸适于装进小直径套管或针头(20号或更小,对应于0.60mm(0.02英寸)直径或更小)的管腔内。在一个实施方式中,形成的固体或半固体组合物的外径尺寸适于装进25号或更小(对应于0.26mm(0.01英寸)直径或更小)的套管或针头的管腔内。在一个实施方式中,形成的固体或半固体组合物的外径尺寸适于装入27号或更小(对应于0.20mm(0.008英寸)直径或更小)的套管或针头的管腔内。
41.在一个实施方式中,活性剂组合物制备为产生含有或包封活性剂的胶体或胶束结
构的制剂。活性剂也可以与胶束外层或表面中的胶束缔合。在本技术中,与胶束一起包封、包含或缔合的活性剂的术语表示活性剂分配到胶束结构中。活性剂在胶束中的包封或缔合提供活性剂持续释放以延长用制剂治疗后的治疗效果。活性剂在胶束中的包封或缔合提供了对活性剂的保护,例如免于降解。可以通过使活性剂在有机溶剂或溶剂混合物中增溶以形成有机溶液来进行包封。使可形成胶束结构并充当胶束形成赋形剂的两亲化合物在水性溶剂中增溶以形成第二溶液。将两种溶液以适当的量组合并混合两种溶液导致活性剂与胶束形成赋形剂缔合,从而使活性剂包含在悬浮在水性溶剂中的胶束内或与悬浮在水性溶剂中的胶束缔合。通过缔合或包封将活性剂分配到胶束中导致大部分活性剂在胶束内和/或与胶束缔合,使得水相中的活性剂低于活性剂的溶解度极限以防止在水相中形成活性剂晶体。可以通过摇动含有组合物的容器、涡旋混合、高剪切混合或超声处理来进行混合以形成胶束。在一些制剂中,胶束可以通过相对低剪切混合或自组装形成。在一些制剂中,胶束形成需要更高的能量,例如高剪切混合或超声处理。胶束的大小和浓度由制剂的组成控制,包括成分的浓度、两亲赋形剂的分配和溶解特性、两亲赋形剂的浓度、活性剂的浓度、水溶液的离子强度和ph以及混合条件。
42.胶束制剂包含活性剂、胶束形成赋形剂、用于活性剂的溶剂或有机溶剂的混合物以及水溶液。可以制备组合物以提供最终的灭菌产品。使一种或多种活性剂在有机溶剂中增溶并过滤除菌后置于无菌容器中。使一种或多种胶束赋形剂在水性溶剂中增溶并过滤灭菌。一定体积的灭菌的活性剂溶液与灭菌的胶束赋形剂水溶液以适当的比例混合,以产生用于将活性剂和胶束形成赋形剂分配成悬浮在水溶液连续相中的胶束不连续相的环境。胶束可以通过混合容器、容器内的混合机构或通过组合物的超声处理来形成。随后可以将最终的胶束组合物无菌填充到无菌小瓶中。可选择地,可以将活性剂和胶束形成赋形剂无菌过滤并分配到无菌小瓶中,并将适量的水溶液无菌过滤并添加到小瓶中。胶束可以通过混合小瓶、对小瓶超声处理或通过搅拌而形成以促进胶束在使用前组装。
43.由于胶束制剂固有的物理不稳定性,适当的赋形剂和适当的活性剂化学计量对于胶束的适当稳定性是必要的以允许制造、运输和储存。当制剂参数相对于活性剂和胶束形成赋形剂的浓度和化学计量平衡时,包含聚合物或共轭聚合物的胶束形成两亲化合物可以提供增强的物理稳定性和持续释放特性。通过小号针头、套管和导管施用胶束制剂需要物理稳定性,这些小号针头、套管和导管可通过小管腔的流体剪切破坏胶束。合适的聚合物包括聚乙二醇共聚物和聚丙二醇共聚物。合适的共轭聚合物包括聚乙二醇共轭脂质、聚乙二醇共轭磷脂和聚乙二醇共轭甾醇。
44.在一个实施方式中,将活性剂溶解在一种或多种有机溶剂中以产生第一溶液。合适的溶剂包括dmso、二氯甲烷和乙酸乙酯。通过将两亲聚合物溶解在水性溶剂中制备第二溶液。合适的溶剂包括水、水性缓冲剂和亲水性聚合物的水性分散体。将一定体积的有机溶剂溶液与一定体积的水溶液合并。两种溶剂的混合产生胶束制剂,其中活性剂包封在胶束中或与胶束缔合作为悬浮在水性连续相中的不连续相。在形成含有活性剂的胶束之后,可以可选地除去有机溶剂或降低其浓度。可以干燥具有高物理稳定性的胶束,例如通过冻干或水性连续相与另一种水溶液交换以缓慢除去有机溶剂。
45.在一个实施方式中,将bcl-2抑制剂tw-37制备为胶束制剂。在有机溶剂中制备tw-37以使活性剂增溶。合适的溶剂包括dmso、二氯甲烷和乙酸乙酯。溶剂中tw-37的浓度制备
成范围为3mm至100mm的溶液浓度。第二溶液是用在水性溶剂中的聚乙二醇(peg)共轭脂质制备的。合适的peg共轭脂质包括共轭1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺(dmpe)、共轭1,2-二棕榈酰-sn-甘油-3-磷酰乙醇胺(dppe)、共轭1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺(dspe)、共轭1,2-二油酰-sn-甘油-3-磷酸乙醇胺(dope)。peg共轭脂质在水溶液中的浓度通常在5mm至100mm、20mm至80mm、30mm至60mm、40mm至50mm的范围内。共轭脂质中的peg可以具有不同的链长以定制共轭脂质的两亲性质,更长的链长产生与制剂的水性连续相的相互作用。peg链长可以为100至5000、200至4000、550至3000、1000至2000道尔顿的分子量不等。将一定体积的含有tw-37的溶液与一定体积的含有peg共轭脂质的水溶液以适当的比例混合,以产生用于将活性剂和胶束形成赋形剂分配成悬浮在水溶液连续相中的胶束不连续相的环境。通常,观察到稳定的制剂具有大约1:1的peg共轭脂质比tw-37的摩尔化学计量,或peg-脂质略微过量于1:1的化学计量。因此,胶束制剂可以具有3:1至1:3、2:1至1:2或3:2至2:3的peg-脂质比tw-37的化学计量比。在一个实施方式中,peg-脂质包含peg共轭磷脂,包括1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-550](18:0peg550 pe)、1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-1000](18:0peg1000 pe)或1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-1000](14:0peg1000 pe)。
[0046]
可以通过显微镜评估胶束制剂的物理稳定性以确定完整的球形胶束的存在。物理稳定性丧失的特征在于形成非球形颗粒、胶束聚集体或活性剂从胶束中逸出而在水相中形成晶体。胶束制剂的化学稳定性通过常规方法评估,例如通过hplc、lcms、nmr或光谱学进行的化学测定。制剂在施用前在储存条件下的稳定性对于运输制剂以提供患者治疗是必要的。制剂在生理条件下的稳定性对于提供足够的时间使活性剂渗透到目标肿瘤细胞中以提供治疗效果是必要的。
[0047]
发现胶束制剂的物理稳定性取决于胶束形成赋形剂的选择、赋形剂和活性剂的浓度,尤其是活性剂与赋形剂的比例。发现在3.75mm至15mm、5mm至10mm、7mm至8mm范围内的活性剂和在5mm至15mm、8mm至12mm范围内的赋形剂的最终制剂浓度促进胶束制剂的稳定性。通常,含活性剂溶液的可溶于有机溶剂的活性剂在水中的溶解度则较差。胶束物理稳定性的丧失导致活性剂从胶束中逸出并在制剂的水相中形成晶体。
[0048]
胶束制剂的化学稳定性取决于活性剂的性质。活性剂与胶束的缔合保护活性剂免于水解降解。可以将限制氧化降解的稳定剂添加到制剂中以提供对胶束中的活性剂的保护。合适的抗氧化剂包括α生育酚和α生育酚衍生物、丁基化羟基茴香醚和丁基化羟基甲苯。
[0049]
在一个实施方式中,组合物可以包含:bcl-2抑制剂、包含两亲聚合物的赋形剂、和水溶液,其中bcl-2抑制剂与以胶束形式悬浮在水溶液中的赋形剂缔合。两亲聚合物可以包含聚乙二醇共轭脂质。聚乙二醇共轭脂质可以选自聚乙二醇共轭1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺(dmpe)、聚乙二醇共轭1,2-二棕榈酰-sn-甘油-3-磷酰乙醇胺(dppe)、聚乙二醇共轭1,2-二硬脂酰-sn-甘油-3-磷酰乙醇胺(dspe)或聚乙二醇共轭1,2-二油酰-sn-甘油-3-磷酸乙醇胺(dope)。聚乙二醇共轭脂质中的聚乙二醇可以具有100至5000、200至4000、550至3000、1000至2000道尔顿范围的分子量。bcl-2抑制剂可以是tw-37。bcl-2抑制剂的浓度可以在1.5μm至50μm、5μm至40μm、10μm至30μm、15μm至20μm的范围内。共轭脂质的浓度范围为2.5μm至50μm、5mm至80mm、10mm至60mm、20mm至40mm。bcl-2抑制剂与两亲聚合物
的摩尔比在1:3至3:1、1:2至2:1或2:3至3:2的范围内。该组合物还可以包含拓扑异构酶抑制剂。在一个实施方式中,聚乙二醇共轭脂质中的共轭脂质为1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-1000]。
[0050]
为了使对患者的施用频率最小化,在一些实施方式中,组合物可以配置为提供药物的缓慢释放。胶体或胶束结构可以悬浮在粘弹性赋形剂中,以有助于通过小号针头、套管或导管递送时的流动特性。半固体或粘性赋形剂中颗粒和浓度的大小调整使得能够通过小号针头、套管或导管注射小体积。
[0051]
在一个实施方式中,将活性剂组合物干燥,例如通过冻干、喷雾干燥或空气干燥进行,有助于保质期稳定性,并且该活性剂组合物在施用前再水化。该组合物可以具有有助于重构的赋形剂,例如盐、糖、水溶性聚合物和表面活性剂。对于干燥的制剂,使用疏松剂,如蔗糖、甘露醇、甘氨酸、聚维酮或葡聚糖,有助于生产具有大通道或孔的松散干燥产品,以提高重构速度。在干燥之前,疏松剂在赋形剂混合物中的浓度范围可以是1.0wt%至20.0wt%、1.0wt%至10.0wt%。最终干燥的组合物可具有5wt%至50wt%、10wt%至40wt%、20wt%至30wt%范围内的填充剂。可以在干燥之前添加增强干燥组合物重构的赋形剂以充当重构助剂,例如表面活性剂、盐、糖或海藻糖。最终干燥的组合物可具有0.1wt%至45.0wt%、0.1wt%至20.0wt%、1.0wt%至15.0wt%或2.0wt%至10.0wt%范围内的重构助剂。该组合物可以在临用前用水或生理缓冲液重构。在一个实施方式中,该组合物可以另外包含加速重构的赋形剂,例如海藻糖。必须仔细平衡成分的组合以提供物理稳定性使组合物干燥而不会沉淀、聚集或降解,从而随后提供快速再水化和流动特性以用于通过小管腔施用。在一个实施方式中,该组合物配制成还提供生理上相容的渗透压和ph值,该渗透压通常在250mosm至450mosm的范围内,该ph值通常在7至8的范围内。
[0052]
在一个实施方式中,活性剂组合物可以适当地以基本上干燥的形式存在并且可以认为是不含水的。活性剂组合物可以使用任何通常方便的方法进行干燥,包括冻干和喷雾干燥。可以认为活性剂组合物在干燥后是无水的,但不排除可能存在少量残留水分。
[0053]
还提供了一种用于制备本发明组合物的方法,该方法包括:将bcl-2抑制剂与一种或多种有机溶剂混合以溶解bcl-2抑制剂;无菌过滤混合物;将有机溶剂混合物添加到一定体积的含有两亲聚合物赋形剂的无菌过滤的水溶液中;以及混合无菌配制的组合物以在水溶液中产生含有bcl-2抑制剂的胶束。bcl-2抑制剂可以是tw-37。两亲聚合物赋形剂可以是1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-1000]。有机溶剂可以是dmso。
[0054]
治疗活性剂的局部眼部施用装置
[0055]
在本发明的方法中,治疗活性剂的制剂通过递送装置注射施用至眼睛的玻璃体腔、脉络膜上腔或眼球筋膜下腔。用套管或导管将治疗活性剂施用至脉络膜上腔具有将套管或导管的远端尖头定位在目标肿瘤附近的间隙中以引导邻近目标肿瘤的一定体积的活性剂的特殊优势。根据本发明使用的合适装置的示例在wo2019/053465中进行了描述。此类装置允许通过装置中的套管或导管递送治疗活性剂的制剂,如下简要描述该装置。
[0056]
将套管或导管置入眼睛的脉络膜上腔或睫状体上腔提供了一种这样的方式:在远离肿瘤的区域使用装置进入眼睛,将套管或导管推进到脉络膜上腔中接近或邻近待治疗的肿瘤的位置并递送含有活性剂的组合物。套管或导管插入装置允许从前部组织进入部位
(例如平坦部)施用含有活性剂的组合物并引导该组合物朝向接近或邻近肿瘤的特定目标区域。可将柔性套管和导管引入组织间隙,例如脉络膜上腔、眼球筋膜下腔、睫状体上腔或玻璃体腔,并推进到所需的邻近目标肿瘤的位置。在脉络膜上腔、眼球筋膜下腔或睫状体上腔内,套管或导管可设计并制造为传导光,从而引导来自装置远端尖头的照明,以有助于装置尖头相对于目标肿瘤的位置进行外路(ab-externo)和/或内路(ab-interno)可视化。来自套管或导管的照明使得套管或导管的远末端的位置能够被调整到接近目标肿瘤而不接触肿瘤的位置。对包括轴和远端尖头在内的套管或导管的整个长度进行照明提供了对一定体积的治疗剂将从装置递送的方位的确认,以确保治疗剂相对于肿瘤的最佳位置。如果套管或导管远离肿瘤弯曲,尽管远端尖头接近或邻近肿瘤,所施用的一定体积的活性剂也将被引导远离肿瘤。对套管或导管的整个长度的照明允许调整套管或导管的尖头和轴的位置以将活性剂制剂导向目标肿瘤位置。
[0057]
小号尺寸的用于施用含有活性剂的组合物的套管或导管旨在微创地进入脉络膜上腔或睫状体上腔。小号套管或导管的外径优选为25号或更小(0.51mm)、27号或更小(0.41mm)、30号或更小(0.30mm),内径分别约为0.35mm、0.26mm、0.16mm。
[0058]
套管或导管插入装置的所描述的实施方式可以组合使用以将套管插入或将导管插入组织间隙并施用流体、半固体或固体,包括胶束或胶体制剂。在一个实施方式中,套管或导管插入装置的远端部分的构造包括用作针头远末端上的组织界面和远端密封件的远端元件。用于递送材料的套管或导管和储存器可配置用于从套管或导管施用流体、半固体、固体或植入物。在一些实施方式中,套管或导管的管腔也可以用作活性剂制剂的储存器或储存器的一部分。
[0059]
对于含有治疗活性剂的组合物的受控施用,从装置进行体积递送必须具有高的准确度和精确度。取决于肿瘤大小或待治疗肿瘤的集合,邻近肿瘤而递送的组合物的用于局部治疗的注射体积在10至100微升、20至90微升、40至70微升、50至60微升的范围内。该装置的注射速率、无效区、流动路径和机械公差被设计为具有至少20%、至少15%、至少10%或至少5%范围内的递送精度。流动路径和参数(例如注射速率)的设计可以根据用于施用的组合物的流动特性例如粘度和粘弹性来定制。流动路径也可以针对剪切敏感的活性剂制剂,例如含有活性剂的胶束悬浮液,来进行定制。
[0060]
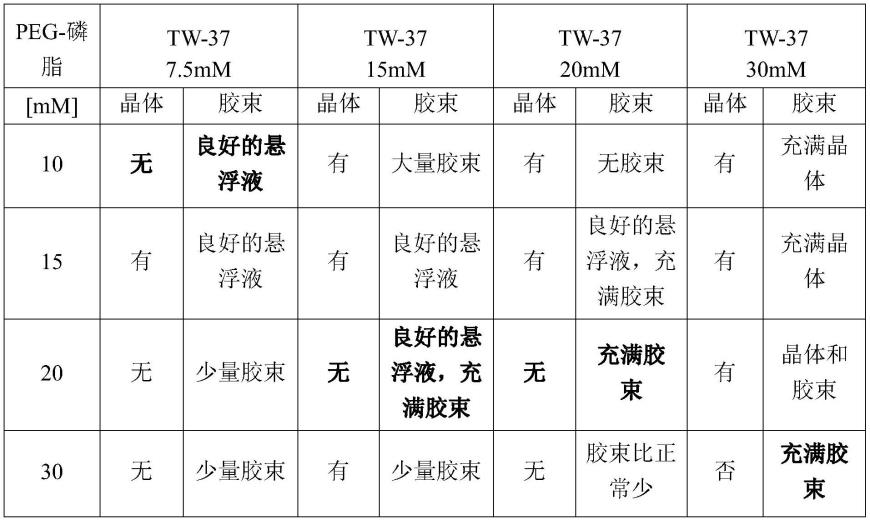
本发明的第二方面和后续方面的优选特征如对于第一方面作必要的修改。
[0061]
现将通过参考以下实施例和附图进一步描述本发明,这些实施例和附图仅用于说明目的。
[0062]
在实施例中,参考以下附图,其中:
[0063]
图1示出了用拓扑异构酶抑制剂(拓扑替康)进行的视网膜母细胞瘤细胞增殖抑制试验的结果。图1a示出了y79细胞系的结果。图1b示出了weri细胞系的结果。图1c示出了bj细胞系的结果。
[0064]
图2示出了用bcl-2抑制剂(tw-37)进行的视网膜母细胞瘤细胞增殖抑制试验的结果。图2a示出了y79细胞系的结果。图2b示出了weri细胞系的结果。图2c示出了bj细胞系的结果。
[0065]
图3示出了来自视网膜母细胞瘤治疗体内研究的眼睛的视网膜母细胞瘤细胞面积。图3a示出了h&e染色后组织切片的细胞面积。图3b示出了用抗人抗体染色后来自组织切
片的细胞面积。
[0066]
图4示出了来自视网膜母细胞瘤治疗体内研究的视网膜上的视网膜母细胞瘤细胞的组织学图像。箭头表示视网膜内层上视网膜母细胞瘤细胞增殖的证据。
[0067]
图5示出了使用拓扑异构酶抑制剂(拓扑替康)和bcl-2抑制剂(tw-37)的组合进行视网膜母细胞瘤细胞增殖抑制试验的结果。图5a示出了y79细胞系的结果。图5b示出了weri细胞系的结果。图5c示出了bj细胞系的结果。
[0068]
图6示出了在兔眼中脉络膜上腔施用tw-37的胶束制剂的眼部药代动力学结果。
[0069]
实施例1:使用bcl-2抑制剂和拓扑异构酶抑制剂的视网膜母细胞瘤细胞增殖抑制试验在基于细胞的试验中对候选化合物进行了测试以确定两种人视网膜母细胞瘤细胞系(y79和weri-rb1)的细胞抑制程度。使用正常的成纤维细胞系(bj)来鉴定选择性影响视网膜母细胞瘤的活性剂。在使用前对细胞进行支原体污染测试。将指数生长的细胞接种在组织培养处理(tissue culture treated)的384孔白色平底低边测定板中,并在37℃下在加湿的5%co2培养箱中孵育过夜。第二天,通过手动针转移(pin transfer),用50ss针将dmso抑制剂储备溶液添加到在0.25%dmso中最高终浓度为50μm以及3μm,然后以1/3稀释,每个稀释方案总共有10个测试浓度。结合起来,两种稀释方案捕获了从50μm至0.2nm的20个数据点。对于y79,将细胞接种到25微升完全培养基中,1000个细胞/孔。对于weri-rb-1,将细胞接种在25微升完全培养基中,2000个细胞/孔。对于bj,将细胞接种在30微升完全培养基中,1000个细胞/孔。添加候选化合物后,在72小时孵育期后使用cell titer glo reagent(promega,madison,wi)测定细胞数。在clariostar读板器(bmg labtech)上测量发光。测定终点从0%(仅dmso)到100%抑制进行标准化,并使用n=3技术重复和graphpad prism中的四参数可变斜率算法拟合成半对数图。实验由不同的操作员进行再次重复,以确保数据的可重复性。
[0070]
筛选了超过25种参与细胞生长和凋亡的细胞通路抑制剂,包括黑毛霉素、达普司他(daprodustat)、mk-8617、bay-85-3934(莫立司他)、bay-87-2243、2-甲氧基雌二醇、长春新碱-硫酸盐、骨化三醇、卡铂、美法仑、依托泊苷、利非西呱、nutlin-3、nutlin-3a、依达奴林(idasanutlin)、iox2、rv1162、ptc-209、赛度替尼(cerdulatinib)、伊达比星、卡巴他赛、罗米地辛、tw-37、夫拉平度(flavopirodol)、奥巴克拉、bay-61-3606、拓扑替康、多柔比星。细胞抑制和死亡曲线的评估提供了对50%细胞抑制的活性剂浓度(ec50)的估计。结果确定了化合物,所述化合物对视网膜母细胞瘤具有有希望的有效性且对正常细胞毒性较小以提供一定治疗范围的治疗。发现bcl-2抑制剂(tw-37,沙布托克)、拓扑异构酶抑制剂(托泊替康)和hdac抑制剂(伏立诺他)的疗效最高。
[0071]
拓扑替康通过在细胞周期的s期稳定拓扑异构酶i-dna共价复合物来抑制拓扑异构酶i的活性,从而抑制拓扑异构酶i介导的单链dna断裂的重新连接,并在遇到dna复制机器(dna replication machinery)时产生可能具有破坏性的双链dna断裂。拓扑替康在低μm浓度下对视网膜母细胞瘤细胞展示出显著的生长抑制作用,并且对正常细胞的毒性非常低(1μm时p<0.001)。拓扑替康显示对于y79细胞系的ec50为0.069μm,对于weri细胞系的ec50为0.039μm,对于bj细胞系的ec50>2.57μm。进行了两次重复测定,确认了结果(参见图1a、1b、1c)。
[0072]
tw-37与bcl-2的bh3(bcl-2同源结构域3)结合槽结合,并与促凋亡蛋白(如bid、
bim和bad)竞争,从而防止它们与bcl-2异二聚化,因此允许这些蛋白诱导细胞凋亡。tw-37在非常低的μm活性剂浓度下展现出显著的视网膜母细胞瘤细胞杀伤作用,并且对正常细胞的毒性非常低(在1μm时p<0.001)。tw-37显示对于y79细胞系的ec50为0.335μm,对于weri细胞系的ec50为0.278μm,对于bj细胞系的ec50>8.76μm。进行了两次重复测定,确认了结果(参见图2a、2b、2c)。
[0073]
伏立诺他抑制hdac活性并抑制i类和ii类hdac酶。由此产生的乙酰化组蛋白和乙酰化蛋白质的积累诱导了一些转化细胞的细胞周期停滞和凋亡。伏立诺他显示对于y79细胞系的ec50为2.84μm,对于weri细胞系的ec50为1.37μm,对于bj细胞系的ec50>54.4μm。
[0074]
沙布托克是一种泛bcl-2家族抑制剂,其可激活半胱天冬酶-3/7和半胱天冬酶9,并可调节bax、bim、puma和生存素的表达。该药剂提供由几种抗凋亡bcl-2家族蛋白介导的细胞凋亡的再激活。沙布托克显示对于y79细胞系的ec50为0.316μm,对于weri细胞系的ec50为0.211μm,对于bj细胞系的ec50>3.65μm。
[0075]
实施例2:使用bcl-2抑制剂和拓扑异构酶抑制剂处理的视网膜母细胞瘤体内模型
[0076]
使人视网膜母细胞瘤肿瘤细胞y79(htb-18)在由含有20%fbs、200mm l-谷氨酰胺(100x)、5000u/ml青霉素/链霉素和250μg/ml两性霉素b的rpmi1640组成的培养基中在t75瓶中的20ml培养基中生长至3x105个细胞/瓶的目标悬浮密度。通过玻璃体内注射将30μl无血清培养基中的200000个细胞接种到16只免疫抑制兔的32只眼的后视网膜表面。以4个组(每组8只眼)对动物进行了研究。两组在肿瘤细胞附近的玻璃体腔后部区域中通过29号针头玻璃体内注射施用了在30μl无菌盐水中制备的拓扑替康。一个拓扑替康组施用10μg剂量,第二组施用50μg剂量。拓扑替康组在肿瘤细胞接种后2、3和4周施用活性剂制剂。一组用10μg tw-37在30ul dmso中的溶液处理,通过29号针头在邻近肿瘤细胞的后视网膜附近注射到玻璃体腔中。tw-37组在肿瘤细胞接种后3周和4周施用活性剂制剂。第四组在肿瘤细胞接种后2、3和4周,通过29号针在肿瘤细胞附近的玻璃体后部区域中用30μl无菌盐水假注射处理。所有动物在5周时被拣选,以允许处理视网膜和视网膜上的视网膜母细胞瘤肿瘤细胞用于组织学检查。
[0077]
对铺片的视网膜的微距摄影记录了视网膜上的肿瘤细胞存活率,然后取出代表性切片进行固定并随后进行组织学处理。将所有样本以5μm进行切割并通过h&e染色,并且复制玻片用人线粒体标记抗体染色,以明确识别人视网膜母细胞瘤细胞。然后使用玻片扫描仪(histech或hamamatsu s360)扫描玻片,并使用caseviewer软件量化视网膜上的视网膜母细胞瘤细胞面积。对于两种剂量的拓扑替康处理和tw-37处理,与假处理组相比,来自h&e染色和抗体染色的视网膜母细胞瘤细胞面积均较小。与假处理组相比,高剂量拓扑替康处理展现出眼睛中视网膜母细胞瘤细胞的统计学显著减少,p<0.01。与假手术相比,高剂量tw-37处理展现出眼睛中视网膜母细胞瘤细胞的统计学显著减少,p<0.01。
[0078]
细胞面积结果如图3a和3b所示。代表性的组织学图像如图4所示,其中箭头指示视网膜上的视网膜母细胞瘤细胞。
[0079]
实施例3:使用bcl-2抑制剂和拓扑异构酶抑制剂组合的视网膜母细胞瘤细胞增殖抑制试验
[0080]
使用实施例1的细胞测定方法,检查了tw-37和拓扑替康的组合对细胞的抑制作用。tw37设置为0.662μm的恒定浓度,使用拓扑替康来滴定试验以进行该试验。研究了dmso
中0μm、0.0033μm、0.0264μm和0.1037μm的拓扑替康浓度。tw-37和拓扑替康的组合展现出对人视网膜母细胞瘤细胞系weri和y-79的额外抑制作用,并且对正常(bj)细胞仅有轻微毒性。结果如图5a、5b、5c所示。
[0081]
实施例4:bcl-2抑制剂与peg-磷脂的胶束制剂
[0082]
制备了tw-37的胶束制剂。tw-37溶液在dmso中制备,浓度为10mm至90mm。peg-磷脂溶液由浓度为5至45mm的溶解在去离子水中的1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-550](18:0peg550 pe)、1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-1000](18:0peg1000 pe)或1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-1000](14:0peg1000 pe)制备而成。将等体积(20μl)的mpeg溶液和tw-37溶液合并在eppendorf管中,并以2:1的tw-37与peg-磷脂的摩尔化学计量比进行短暂的涡旋混合。通过明场显微镜检查溶液中胶束的存在,以识别球形胶束和随时间的变化,例如胶束损失、非球形颗粒和聚集。分别使用5mm和15mm的18:0peg550 pe溶液(得到最终配方浓度为2.5mm和7.5mm)和10mm和30mm的tw-37溶液(得到最终配方浓度为5mm和15mm)一起制备的制剂展现出较差的胶束形成。分别使用5mm、15mm和45mm的18:0peg1000 pe溶液(得到最终配方浓度为2.5mm、7.5mm和22.5mm)和10mm、30mm和90mm的tw-37溶液(得到最终配方浓度为5mm、15mm和45mm)一起制备的制剂展现出胶束形成,其中在最高浓度下胶束数量更多。然而,胶束表现出有限的稳定性,活性剂从胶束中逸出,在室温下6天后在水相中形成晶体。分别使用5mm、15mm和45mm的14:0peg1000 pe溶液(得到最终配方浓度为2.5mm、7.5mm和22.5mm)和10mm、30mm和90mm的tw-37溶液(得到最终配方浓度为5mm、15mm和45mm)一起制备的制剂展现出具有大量胶束的良好的胶束制剂,并且没有观察到活性剂晶体。
[0083]
在类似的研究中,将等体积(20μl)的mpeg的去离子水溶液和tw-37的dmso溶液合并在eppendorf管中,并以1:2的tw-37与peg-磷脂的摩尔化学计量比进行短暂涡旋混合。通过明场显微镜检查溶液中胶束的存在,以识别球形胶束和随时间的变化,例如胶束损失、非球形颗粒和聚集。分别使用5mm、15mm和45mm的18:0peg1000 pe溶液(得到最终配方浓度为2.5mm、7.5mm和22.5mm)和2.5mm、7.5mm和22.5mm的tw-37溶液(得到最终配方浓度为1.25mm、3.75mm和11.25mm)一起制备的制剂展现出在最高浓度下胶束数量更多的胶束制剂。分别使用5mm、15mm和45mm的14:0peg1000 pe溶液(得到最终配方浓度为2.5mm、7.5mm和22.5mm)和2.5mm、7.5mm和22.5mm的tw-37(得到最终配方浓度为1.25mm、3.75mm和11.25mm)一起制备的制剂展现出具有大量胶束的良好的胶束制剂,并且没有观察到tw-37晶体。
[0084]
在另一项研究中,在去离子水中制备了10mm和15mm的18:0peg550 pe、18:0peg1000pe、14:0peg1000 pe。以3mm、5mm、7.5mm和10mm制备tw-37的dmso溶液。将等量的20μl溶液在eppendorf管中合并,并涡旋混合以促进胶束形成。明场显微镜显示接近1:1摩尔化学计量的14:0peg1000 pe和tw-37的制剂展现出最佳的胶束形成,其中具有更多的胶束并且没有晶体形成,这表明tw-37与胶束的高度缔合。
[0085]
实施例5:bcl-2抑制剂与peg-磷脂14:0peg1000 pe的胶束制剂
[0086]
tw-37的胶束制剂是用peg-磷脂14:0peg1000 pe作为胶束制剂赋形剂制备的。tw-37溶液在dmso中以7.5mm、10mm、15mm和20mm的浓度制备。peg-磷脂在去离子水中以10mm、15mm、20mm和30mm的浓度制备。将等量的20μl溶液在eppendorf管中合并,并涡旋混合以促进胶束形成。通过明场显微镜检查混合制剂中胶束的存在,以确定球形胶束和随时间的变
化,例如胶束损失、非球形颗粒、聚集和水相中的活性剂晶体形成(表明活性剂从胶束中逸出)。胶束制剂在室温下避光储存,并在3周通过显微镜进行检查。下表表征了3周时的制剂。
[0087]
两种最稳定的制剂是用10mm的peg-磷脂溶液和7.5mm的tw-37溶液(稀释后的最终制剂浓度为5mm和3.75mm)以及30mm的peg-磷脂溶液和20mm的tw-37溶液(稀释后的最终配方浓度为15mm和10mm)制备的。通常,观察到具有最大稳定性的制剂具有大约为1:1的peg-磷脂比tw-37的摩尔化学计量,或略大于1:1以相对于tw-37提供一些过量的peg-磷脂。
[0088][0089]
实施例6:bcl-2抑制剂的胶束制剂的稳定性
[0090]
制备具有等体积的30mm peg-磷脂14:0peg1000 pe和15mm tw-37的制剂,以产生15mm peg-磷脂和7.5mm tw-37的最终制剂。避光并在-80℃、-20℃、4℃和室温下储存制剂。在-80℃、-20℃和4℃下储存4周后,该制剂展现出大约完全恢复,表明了制剂的稳定性。室温样本在4周时显示tw-37含量为80.3%。
[0091]
实施例7:bcl-2抑制剂的药代动力学研究
[0092]
制备了tw-37的胶束制剂并将其施用到新西兰白兔的脉络膜上腔中。将等体积的4.8mm tw-37的dmso溶液加入到9.6mm peg-磷脂1,2-二肉豆蔻酰-sn-甘油-3-磷酸乙醇胺-n-[甲氧基(聚乙二醇)-1000](14:0peg1000 pe)的去离子水溶液中来制备胶束制剂,最终制剂具有2.9mm tw-37和4.8mm peg-磷脂。两种溶液通过无菌0.2微米尼龙注射器过滤器进入无菌小瓶中进行过滤灭菌以产生无菌制剂。将混合物涡旋混合以产生胶束悬浮液。将大约15μl体积的含有25μg tw-37剂量的制剂施用到12只兔子的24只眼的脉络膜上腔。4只兔子的八只眼睛在脉络膜上腔中施用了15μl溶媒对照,溶媒对照的制备与含有活性剂的制剂相同,但不含tw-37。将具有250微米od和140微米id的柔性导管通过手术在平坦部处引入眼睛的前部区域的脉络膜上腔。导管向后朝脉络膜上腔的后部区域推进。导管配置为传导光并提供导管尖头和轴的照明,以通过经巩膜可视化确定导管位置和配置。使用有照明的导管尖头将导管定位在脉络膜上腔的后部区域。使用有照明的导管轴来操纵和定位导管,以将注射液导向脉络膜上腔的后部区域。该研究由四个组组成,各组由施用了tw-37制剂的六只眼睛和施用了溶媒对照的两只眼睛组成。在安乐死前,在施用后1、3、7、14天的每个时间
点,在前段中通过狭缝灯以及在后段中通过间接检眼镜检查来检查眼睛。解剖眼睛,分离玻璃体、视网膜和脉络膜,并通过lcms处理tw-37组织浓度。tw-37在视网膜、脉络膜和玻璃体中的组织浓度如图6所示。
[0093]
脉络膜展现出最高水平的tw-37,而视网膜展现出较低水平的tw-37,这通常遵循脉络膜水平的药代动力学。结果表明,脉络膜上腔和脉络膜作为tw-37的储存器并且tw-37进入视网膜达到治疗水平。tw-37在3天时在脉络膜中达到峰值浓度,在14天时降至接近基线。tw-37在7天时在视网膜中达到峰值浓度,在14天时降至接近基线。单次施用在胶束制剂中的tw-37提供了tw-37组织暴露于目标视网膜14天。玻璃体显示出相对低水平的tw-37,表明对眼睛前部组织和全身性的低暴露。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1