酵母细胞膜封装的细菌及应用
1.本发明属于生物技术领域,涉及利用生物膜进行细菌封装或包裹,具体是涉及利用酵母细胞膜封装细菌及其应用。
背景技术:
2.人类肠道微生物组由100万亿种微生物和数千种细菌组成,它们在宿主的免疫调节,营养代谢,维持肠屏障结构完整性和抵抗病原体等方面发挥着至关重要的作用。基因测序技术和大数据分析的进步提供了越来越多的证据,证明肠道菌群的组成与宿主健康有关,并且还影响宿主对药物的反应。不幸的是,许多外部因素,例如饮食、抗生素和病原体入侵,可能会改变微生物生态,并导致肠道微生物组的组成和功能发生变化。据报道,微生物营养不良不仅与胃肠道疾病有关,例如肠屏障功能障碍、炎症性肠病和结肠直肠癌,而且还与多种肠外疾病有关,包括糖尿病、神经系统疾病、关节炎、肝癌和sars-cov-2感染。因此,在环境侵害下能够保持肠道菌群正常稳态的方法在人类健康中起着核心作用,并可能改变我们预防和治疗疾病的能力。
3.微生物群的可塑性创造了独特的机会,可以通过操纵外部影响因素来重塑肠道微生物结构和相关的生物输出。特定营养素、天然核酸和多种合成材料的引入已被用于减轻肠道微生物的营养不良。然而,产生实际效果需要长期补充。目前主要通过口服益生菌和粪菌移植重建肠道菌群稳态。然而口服益生菌的生物利用度和改善效果不佳。基于重建肠道微生物稳态的理念,在过去的十年中,粪菌移植在治疗炎症、自身免疫性疾病、代谢功能障碍和某些过敏性疾病等方面取得了一定进展。然而,通过鼻肠管或内窥镜等侵入性操作导致患者依从性普遍不佳,这在很大程度上限制了粪菌移植在临床的实践。除了依从性差,不确定的微生物组成还可能导致潜在并发症的发生,甚至可能造成患者死亡。因此肠道菌群的有效调节策略仍有待进一步探索。
4.免疫系统是塑造肠道菌群的关键因素之一。肠上皮细胞分泌的抗菌肽和模式识别受体都参与并介导肠道菌群的定殖。除了通过肠上皮细胞调节肠道菌群,固有免疫细胞还是微生物生态学的重要调节剂,它们通过分泌白介素,干扰素-γ和肿瘤坏死因子(tnf-α)等细胞因子来调节细菌组成。与先天免疫系统的功能相似,越来越多的证据表明适应性免疫系统在控制肠道菌群中也同样发挥着重要作用。尤其是b细胞产生分泌性免疫球蛋白a(secretory immunoglobulin a,siga)的可以促进致病菌的清除和调节肠道共生菌,从而维持肠道稳态。
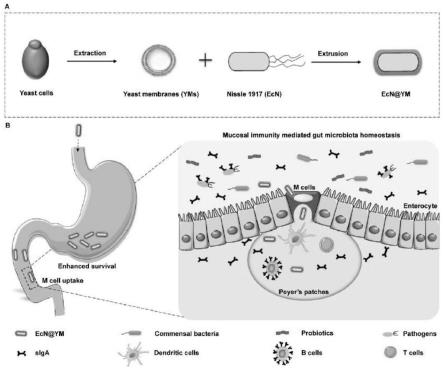
5.申请人通过诱导粘膜免疫反应从而实现对肠道菌群稳态的调节和维护(图1)。考虑到通过m细胞对肠腔抗原的摄取是启动粘膜免疫反应的主要途径。酵母细胞膜(yeast membranes,yms)上存在嵌入的β-葡聚糖,口服摄入后,酵母细胞膜包裹的细菌可以促进dectin-1受体介导的分布在肠上皮中的m细胞的吞噬作用。从而有效地将活细菌递送到淋巴滤泡中诱发强烈的粘膜免疫反应,表现为肠道中的siga,cd11c
+
树突状细胞,cd4
+
t细胞和iga
+
b细胞水平显着提高中。增强的免疫力有效地调节肠道菌群,特别是诸如沙门氏菌和埃
希氏菌-志贺氏菌等病原体被大大抑制。用yms伪装的细菌可有效缓解肠道屏障的损害,表现为在两种肠道屏障功能障碍的小鼠模型中,yms包裹的细菌干预小鼠的肠屏障通透性降低,细菌移位减少以及内毒素和炎性细胞因子向系统扩散被抑制,从而避免了全身性炎症的发生。
技术实现要素:
6.为了有效维护肠道菌群稳态并进一步预防肠屏障损伤,本发明利用酵母膜伪装的细菌,具体地,本发明使用了酵母细胞膜封装或包裹的细菌,所述yms具有β-葡聚糖,能够让所述细菌被粘膜免疫系统中的m细胞识别。
7.其中,所述酵母细胞膜通过物理挤出制成,从而β-葡聚糖的降解和保护细菌活性。
8.所述酵母细胞膜封装的细菌通过细菌与yms反复挤出制成,优选地,采用多孔聚碳酸酯膜物理挤出细菌和酵母细胞膜。
9.所述细菌为fda批准的大肠杆菌ecn。
10.本发明的另一方面涉及酵母细胞膜用于封装细菌以提高其在胃肠道的耐受性和口服里有度。
11.本发明涉及一种酵母细胞膜封装的细菌介导的改善肠道微生物稳态和/或改善肠道屏障功能的药物,包括酵母细胞膜封装的细菌,所述酵母细胞膜具有β-葡聚糖,以能够让所述细菌被粘膜免疫系统中的m细胞识别。
附图说明
12.图1是本发明通过口服将酵母细胞膜包封的益生菌经m细胞吞噬递送至派氏结(peyer’s patches,pps)诱导粘膜免疫介导的肠道菌群调节示意图。a.通过将提取的酵母细胞膜和益生菌ecn使用平均孔径为1μm的聚碳酸酯多孔膜挤出来制备ecn@ym。b.yms增强了益生菌对胃液的抵抗力,并通过m细胞将活菌传递到pps中,从而诱发了强大的粘膜免疫反应,达到调节和维护肠道菌群稳态的目的。
13.图2是ecn@ym的制备和特性。图2a为ecn@ym的激光扫描共聚焦显微镜(confocal laser scanning microscope,lscm)图像。红色通道表示表达mcherry的ecn,蓝色通道表示yms被卡尔科弗卢尔荧光增白剂染色。比例尺:20μm。图2b为ecn和ecn@ym的代表性透射电子显微镜(transmission,electron microscope,tem)图。比例尺:2μm。图2c为ecn,yms和ecn@ym的zeta电位。图2d和2e为ecn和ecn@ym的流式细胞仪分析结果。yms由fitc标记。误差棒代表标准偏差(sd,n=3)。**p《0.01。图2f为ecn和ecn@ym的细菌活力。通过使用cck-8分析以1小时为间隔测量光密度od450来评估细菌活性。图2g为在不同处理下yms上的β-葡聚糖水平,包括仅玻璃珠破碎(yms-bro),玻璃珠破碎加上模拟胃液(simulated gastric fluid,sgf)孵育1小时(yms-sgf-1h)或4小时(yms-sgf-4小时),玻璃珠打碎+模拟肠液(simulated intestinal fluid,sif)处理1小时(yms-sif-1h)或4小时(yms-sif-4h)。
14.图3是ecn@ym在胃肠道环境中的稳定性。图3a为在不同处理下,包括与sgf孵育1小时(ecn@ym-sgf-1h)或4小时(ecn@ym-sgf-4h)和sif孵育1次,ecn@ym上的β-葡聚糖水平1小时(ecn@ym-sif-1小时)或4小时(ecn@ym-sif-4小时)。图3b-d为用sgf(b),胆酸(c)或sif(d)(n=3)处理后,ecn(橙色圆圈)和ecn@ym(蓝色三角形)的存活率。图3e-h为在1
×
108cfu
的ecn或ecn@ym灌胃后的指定时间点胃(e),小肠(f),盲肠(g)和结肠(h)中的细菌计数(n=4)。图3i至l为灌胃后1小时(i),2(j),3(k)和4(l)小时胃肠道细菌总数。误差棒代表sd,*p<0.05。
15.图4为m细胞对ecn@ym的摄取。图4a和4b分别与m细胞共培养3(a)和6(b)小时后,从transwell插入物的顶端侧转移至基底外侧室中的ecn数量。麻醉小鼠,向含有pps的肠腔分别注入50μl pbs,1
×
108cfu ecn或ecn@ym。图4c在1.5小时后,pps中的ecn数量。图4d为腔注射1.5小时后收集的pps中表达mcherry(红色)荧光的ecn的代表性lscm图像。图4e到4g为灌胃4小时(e),7天(f)和3周(g)时pps中ecn的计数。每天给予小鼠5
×
107cfu的ecn或ecn@ym灌胃。误差棒代表sd(n=3-5),*p《0.05,**p《0.01。
16.图5为ecn@ym引起的粘膜免疫反应。图5a至5f为5
×
107cfu ecn或ecn@ym灌胃后4小时(a至c)和7天(d至f)时,代表性的小鼠活体成像ivis图像、肠系膜淋巴结(mesenteric lymph nodes,mln)的荧光强度和细菌计数。图5g为分别给予pbs,ecn,ecn@ym和yms灌胃后肠液中siga的水平。图5h和5i为分别给予pbs,ecn和ecn@ym灌胃后血浆中il-6(h)和tnf-α(i)的表达水平。图j至图q为流式细胞仪分析每天0.2ml pbs,5
×
107cfu ecn或ecn@ym灌胃,持续7天后,从pps提取的淋巴细胞中cd3
+
t细胞(j和k),cd4
+
t细胞(l和m),)cd11c
+
dc(n和o)以及iga
+
b细胞(p和q)的百分比。用抗cd3-percp-cy5.5/抗cd4-fitc/抗cd8-apc,抗cd11c-fitc/抗cd86-apc/抗cd80-pe和抗cd45r/b220-pe-cy7/抗cd138-apc/抗iga-pe进行细胞标记。误差棒代表sd(n=3-5),*p《0.05,**p《0.01。
17.图6为外部刺激下肠道菌群结构的变化。图6a为沙门氏菌感染的小鼠肠道菌群的菌门水平的主坐标分析(pcoa)和图6b为沙门氏菌感染的小鼠肠道菌群的菌门水平进行分类学分析的结果。ace反映了反映单个样本物种丰富度的alpha多样性和物种多样性,而pcoa或nmds分析了用于比较不同群体之间群落组成和结构物种多样性的beta多样性。小鼠每天用pbs,5
×
107cfu的ecn或ecn@ym预处理7天,然后感染5
×
107cfu的沙门氏菌。图6c和6d为肠道菌群中变形杆菌(c)和拟杆菌(d)的相对丰度。图6e为变形杆菌与拟杆菌的相对丰度比值。图6f到6h为小肠干扰术后小鼠的ace指数(f),nmds(g)和细菌分类学分析(h)的值。小鼠在手术前每天用pbs,5
×
107cfu ecn或ecn@ym预处理7天。误差棒代表sd(n=4),*p《0.05,**p《0.01。
18.图7为ecn@ym对沙门氏菌感染引起的肠屏障功能障碍的预防作用。图7a为动物实验技术路线图。小鼠适应性喂养7天后,每天用0.2ml pbs,5
×
107cfu ecn或ecn@ym灌胃7天,然后再给予20mg链霉素。沙门氏菌5
×
107cfu灌胃,感染后3天后收集样品。图7b为结肠组织的代表性h&e染色图像。图7c为结肠组织中杯状细胞的典型ab/pas染色图。图7d为上皮细胞损伤(粉红色),粘膜下水肿(灰色),炎性细胞浸润(橙色)和杯状细胞消耗(蓝色)之和的病理学评分。图7e血浆中的fitc-葡聚糖水平以评估肠屏障通透性。图7f至h为血浆中脂多糖(lipopolysaccharide,lps)(f),il-6(g)和tnf-α(h)的水平。图7i至l分别在pps(i),mln(j),脾脏(k)和肝脏(l)中的沙门氏菌计数。将组织样品匀浆,铺在lb琼脂平板上,在37℃下孵育过夜以进行细菌计数。比例尺:50μm。误差棒代表sd(n=3-6),*p《0.05,**p《0.01。
19.图8为ecn@ym对小肠干扰术导致的肠屏障功能障碍的预防作用。图8a动物实验技术路线图。小鼠适应性喂养7天后,每天用0.2ml pbs,5
×
107cfu的ecn或ecn@ym灌胃7天,然后进行小肠干扰术。手术24小时后收集样品。图8b为结肠组织的h&e染色图像。图8c为结肠
组织中杯状细胞的ab/pas染色图像。图8d为血浆中fitc-葡聚糖的水平以评估肠屏障通透性。图8e-g为(e)血浆中lps(e),il-6(f)和tnf-α(g)的水平。图8k-h为pp(h),mln(i),脾脏(j)和肝脏(k)中需氧菌的计数。图8l-o为分别在pp(l),mln(m),脾脏(n)和肝脏(o)中的厌氧菌数量。将样品组织匀浆,铺在血琼脂平板上,分别在有氧或厌氧条件下于37℃培养过夜以进行细菌计数。比例尺:50μm。误差棒代表sd(n=3-6),*p《0.05,**p《0.01。
具体实施方式
20.结合说明书附图和具体实施案例对本发明做进一步描述,以便于更好地处理本发明,但不能因此理解为限定本发明。
21.生物膜修饰的细菌,是利用分隔细胞器或外界的膜系统,隔绝外界周围环境,能够让细胞独立于外部环境存在,一般的生物膜由脂质组成,或者包含蛋白质或糖类等。本发明涉及的细菌,利用酵母细胞膜包裹或封装细菌,一方面隔离细菌表面的免疫源性物质或其他毒副作用物质,另外可以提高细菌的稳定性和靶向性,以用于医学应用。
22.本发明的具体实施案例中,yms来自于酵母菌,例如本技术的具体实施案例中采用物理挤压来制备(通过玻璃珠辅助等),以能够保证yms的完整性,即具有完整的膜结构、包含蛋白质或糖类等,例如β-葡聚糖。yms可以提高细菌在胃肠道内的生存性和稳定性,还可以基于其膜上的多糖和蛋白质诱导免疫反应;例如β-葡聚糖可以促进dectin-1受体介导诱导m细胞(肠道上皮)的吞噬作用,同时肠道内siga,cd11c
+
树突状细胞,cd4
+
t细胞和iga
+
b细胞水平也会显着提高,整体性提高粘膜免疫,从而提高肠道菌群稳态,有效降低环境刺激下肠道屏障功能障碍。
23.在制备过程中,将yms与细菌反复挤出制成,例如,利用多孔聚碳酸酯膜物理挤出细菌和yms而成。此处的细菌可以为大肠杆菌ecn、粪肠球菌(enterococcus faecalis)、金黄色葡萄球菌(staphylococcus aureus)、益生芽孢菌、丁酸梭菌、乳杆菌、双歧杆菌和放线菌中的一种或多种组合;本发明的实施案例中,细菌为有益菌或益生菌等,例如大肠杆菌、益生芽孢菌、丁酸梭菌、乳杆菌、双歧杆菌的一种或多种组合。在其他实施例中,细菌包括外源性标记物质或用于表达外源性物质的载体,外源性标记物质可以表达荧光用于定位或标记靶向的组织。另外地,细菌包括外源性或内源性毒素物质或分泌型抗菌物质,例如抗生素或抗菌多肽等,以用于局部杀菌,改善肠道微生物和/或改善肠道屏障功能。
24.下面结合具体的实施例对本技术做详细说明。
25.材料和菌种
26.ecn和鼠伤寒沙门氏菌购自中国普通微生物培养物保藏中心。caco-2和raji细胞系获自美国典型培养物保藏中心。baker酵母是从莱斯弗尔(lesaffre)获得的。mem,rpmi 1640,胎牛血清和抗生素/抗真菌溶液购自thermofisher。calcofluor白色染料购自sigma。β-葡聚糖测定试剂盒购自megazyme。facs抗体包括抗小鼠cd3-percp-cy5.5,cd4-fitc,cd8-apc,cd11c-fitc,cd80-pe,cd86-apc,cd45r/b220-pe-cy7和cd138-apc,购自ebioscience。iga-pe购自thermofisher。质粒pbbr1mcs2-tac-mcherry(卡那霉素抗性)和所有其他试剂均从国内供应商处购买并按原样使用。
27.yms准备
28.将baker酵母(20克)悬浮在300毫升1m氢氧化钠中。将其加热至80℃1.5小时,并以
3,000rpm离心10分钟。将沉淀物用去离子水冲洗两次,分散在ph 4的盐酸中,并在60℃孵育1.5小时。通过以3,000rpm离心10分钟收集样品,并用去离子水彻底清洗两次。随后,将沉淀用异丙醇漂洗4次,并用丙酮漂洗2次。通过离心收集酵母胶囊(yeast capsule,yc),并在室温下真空干燥。对于制备的yms,通过在室温下与玻璃珠(300-500nm)涡旋2小时来破坏10mg/ml的yc。
29.ecn@ym的制备
30.含有pbbr1mcs2-tac-mcherry质粒的ecn在含有卡那霉素抗生素的lb琼脂平板中于37℃以200rpm摇动生长4小时。通过7,000rpm离心10分钟收集细菌,并将其重悬于预冷的pbs中。将300μl yms和700μl ecn混合并在室温下以500rpm转速培养1小时。然后,使用脂质体挤出仪(avanti polar lipids,usa)将混合物通过孔径为1μm的聚碳酸酯多孔膜反复挤出21次。
31.实验动物
32.6-8周龄的雄性balb/c小鼠购自杰思捷实验室动物技术公司。该动物研究得到上海交通大学医学院动物保护与使用委员会的批准,并遵循上海医学实验动物护理的指导方针。
33.yms的稳定性
34.为了测量yms的稳定性,将ecn@ym(1
×
108cfu)在37℃下在sif中200rpm摇动培养。在预定时间点,将细菌以7,000rpm离心10分钟,然后重悬于500μl pbs中。然后,分别通过lscm和tem测量样品。为了促进lscm观察,yms用卡尔科弗卢尔荧光增白剂染色。
35.伪装益生菌的制备和特性
36.由于具有特异性结合,表面具有丰富的β-葡聚糖的酵母可被其膜上嵌入dectin-1的m细胞有效内化。yms输送的治疗剂,例如小干扰rna和纳米药物,可以改善口服生物利用度。细菌的修饰可以在细菌表面上附着功能性基团。申请人包裹了一层额外的膜,以产生具有可调节细菌行为的外源性特征的工程细菌。例如,包裹有自组装脂质体膜的益生菌对极端条件的抵抗力增强。为了利用m细胞介导的抗原识别的优势,申请人将ecn包裹于yms以增加口服后益生菌在pps中的积累。为了防止β-葡聚糖的降解,通过用玻璃珠机械性破碎来制备yms。简单地通过平均直径大小为1μm的多孔聚碳酸酯膜反复挤出将ecn与yms融合,就可以生成yms包裹的ecn(ecn@ym)。在lscm成像下,表达mcherry的ecn(红色)包裹于yms(蓝色),并用卡尔科弗卢尔荧光增白剂染色(图2a)。通过tem和扫描电子显微镜(sem)观察进一步证实了该涂层(图2b)。与未包裹的细胞相比,ecn@ym被额外的厚膜包围。用带负电荷的yms膜包裹后,ecn的zeta电位从-25.0
±
5.72增加到-13.1
±
1.77mv(图2c)。动态光散射(dynamic light scattering,dls)测量表明,ecn@ym的平均大小为1186.3nm,适合m细胞摄取。流式细胞仪分析表明,ecn@ym的平均荧光强度比未包裹的ecn高约10倍,验证了85.8%的包封效率(图2d和e)。这些结果表明,通过简单的物理挤出,ecn已成功高效地包裹了ym。细胞活性检测试剂盒(cck-8)检测结果显示,包裹后细菌活性未受影响,表明制备步骤和包裹本身对ecn活性的影响可以忽略不计(图2f)。同时,即使细菌数量增加到1
×
108cfu,ecn@ym对caco-2细胞未产生明显的毒性作用,考虑到β-葡聚糖对m细胞摄取的重要性,通过在指定的时间点用模拟胃肠道条件培养来监测相关的β-葡聚糖在yms上的稳定性。如图2g所示,即使孵育时间长达4小时,sgf和sif中的β-葡聚糖水平仍保持一致,这表明膜β-葡聚糖含量
不会受到胃肠道环境的影响。
37.ecn@ym在胃肠道中的稳定性和生存力
38.在到达m细胞之前,所输送的益生菌在口服后会遭受胃肠道环境的刺激,例如胃酸和胆汁酸,这可能会使细菌失活。申请人检测了sgf和sif中ecn@ym中的β-葡聚糖水平,以评估在不利环境下是否会降解yms表面上的β-葡聚糖。通过将nacl(32.0g)和胃蛋白酶(2g)溶解在1l去离子水中来制备sgf,并用稀hcl溶液将ph调节至2.0。通过将kh2po4(6.8g)溶解在250ml去离子水中,然后添加77ml 0.2m naoh,200ml去离子水和胰蛋白酶(10g)来制备sif。用稀naoh将混合物的ph调节至6.8。使用前,将sgf、sif和胆汁酸(0.3mg/ml)通过0.22μm膜过滤。等量的ecn和ecn@ym分别加入1ml的培养基中,其中包括sgf、sif和胆汁酸。样品在37℃下以200rpm摇动培养。在预定的时间点,将细菌以7,000rpm离心10分钟,然后重悬于100μl pbs中。通过在lb琼脂平板上以适当的稀释度培养样品来确定细菌数。β-葡聚糖的水平通过用于酵母细胞壁上β-葡聚糖特异性测定的试剂盒进行测定。在sgf和sif中分别孵育等量的纯yms和包裹于ecn上的ym。之后,将样品以3,000rpm离心15分钟,然后重悬于400μl 2m koh中。将样品在冰上温育30分钟。然后加入1.6ml的1.2m乙酸钠缓冲液(ph 3.8)和40μl glucazyme
tm
。将混合物在冰上进一步温育2分钟。然后将样品在40℃下孵育过夜。向每个试管中加入10ml去离子水,并将样品以3,000rpm离心10分钟。将100μl上清液加入4ml gopod试剂中。在40℃下孵育20分钟后,用酶标检测仪(biotek,美国),在510nm处读取光密度od值。
39.检测结果表面β-葡聚糖在胃液中能够保持稳定(图3a)。对于在sif中孵育的ecn@ym,观察到了相似的结果。申请人进一步检测了包裹层的稳定性以及yms对ecn活力的保护作用。将ecn@ym在sif中温育指定的时间点后,lscm和tem图像显示温育1小时后出现未包裹的ecn,并且包裹层的去除随着培养时间从2小时增加到6小时。如预期的那样,用ym包裹可以提高ecn在胃酸中的存活率,这与未包裹的细菌完全失活形成鲜明对比(图3b)。对于分别与胆汁酸和sif一起孵育的包裹的ecn,观察到了类似的保护效果(图3c和d)。在小鼠胃肠道中进一步评估了包裹细菌在体内胃肠道环境的耐受性。通过小鼠活体成像仪检测可见,与给予ecn灌胃的小鼠相比,ecn@ym灌胃的小鼠具有更高的荧光值。为了量化存活的ecn数量,分别从胃,小肠,盲肠和结肠中收集肠腔内容物进行涂板以进行细菌计数。图3e至h的结果表明,小鼠灌胃后1、2、3和4小时,ecn@ym中ecn的存活率均高于ecn。包裹有ym后,给药后1、2、3和4小时的益生菌口服利用度显著提高,证明了涂层在胃肠环境下对细菌具有保护作用(图3i至l)。这些结果表明,口服后,含有β-葡聚糖的yms是稳定的,包裹ym可以保护ecn免受胃肠道环境刺激,这将有利于益生菌向pp中的递送。
40.m细胞摄取yms伪装的益生菌
41.caco-2细胞在5%co2条件下于37℃在含有20%(v/v)胎牛血清和1%(v/v)抗生素/抗真菌溶液的mem培养基中培养。raji细胞在含有20%(v/v)胎牛血清和1%(v/v)抗生素/抗真菌溶液的rpmi 1640培养基中培养。分别向transwell的顶侧和基底外侧添加0.1ml和1.5ml mem。然后将transwell在co2培养箱中预培养30分钟。进一步将caco-2细胞(5
×
105)接种在transwell插入物的顶端(corning,1.12cm2,孔径:3μm),培养14天,每2天更换一次培养基。孵育14天后,将rpmi 1640/dmem(1:2)混合物中的raji细胞(5
×
105)添加到transwell板的基底外侧腔中,继续培养7天。通过ap活性检测对m细胞构建的有效性进行检
测。
42.为了验证ym包裹介导的向pp中的传递,在体外和体内均评估了m细胞对ecn的吞噬作用。在transwell细胞培养实验中,将等量的pbs、ecn和ecn@ym添加到插入物的顶腔中,共培养3小时和6小时后,对转移到基底外侧培养基中的ecn的数目进行计数。如图4a所示,在相同条件下孵育3小时后,发现ecn@ym组中转移的ecn数量是ecn组的5倍。随着培养时间延长至6小时,ecn@ym组移位的ecn数量比未包裹ym的ecn组进一步增加了约11倍(图4b)。在证实体外转运明显增强后,我们通过按照先前描述的方法进行样本肠腔注射,进一步检查了小鼠m细胞对ecn@ym的摄取。注射后1.5小时,收集pps并匀浆,在lb琼脂平板上进行培养以进行细菌定量。可以预期,从注射了pbs的小鼠中采集的pp并未检测出ecn(图4c)。值得注意的是,yms包裹显著提高了进入pps的细菌数量,ecn@ym组ecn检出量比未包裹yms的ecn组高出近2倍。如图4d所示,对于ecn@ym灌胃的小鼠收获的pps,观察到表达mcherry红色荧光ecn的数量增加。
43.口服后评估pps中ecn的富集度,进一步证实ym包裹层可以促进m细胞的吞噬作用。每天给予小鼠一次1
×
108cfu ecn@ym灌胃,并在指定的时间点处死。在灌胃后1、2、3和4小时,对小鼠进行活体成像,然后处死,并收集胃、小肠、结肠和盲肠在内的组织及其内容物制备悬浮涂布于lb板上。在37℃下孵育过夜用于细菌计数。结果表明,包裹ym的细菌灌胃,在第一次灌胃4小时后即可检出,而未接受未包裹ecn则未观察到该现象(图4e)。令人惊讶的是,随着灌胃频率延长至7天,ecn@ym组中的所有小鼠在pps中均可检测出ecn,而未包裹ym的ecn灌胃干预的小鼠pps中却没有细菌检出(图4f)。表明通过伪装可实现ecn在pps的富集,并且这种作用可以维持长达3周(图4g)。
44.ecn@ym诱导肠道粘膜免疫反应
45.用恩氟烷对balb/c小鼠(6-8周)进行吸入性麻醉,然后将50μl的pbs,ecn(1
×
108cfus)和ecn@ym(1
×
108cfus)分别注入含有pps的肠腔1.5小时后,处死小鼠并收集pps。一部分收集的pps用于细菌培养,另一部分用4%多聚甲醛固定并包埋于30%甘油,用于lscm观察进入pps中的ecn。为了进行体内益生菌摄取分析,分别给予小鼠0.2ml pbs,ecn(5
×
107cfu)和ecn@ym(5
×
107cfu)灌胃分别于灌胃1小时,2小时,3小时和4小时后处死小鼠,收集胃肠道和mln组织进行成像。收集pps和mln进行细菌培养与计数。
46.如离体组织活体成像结果所示,mln仅在灌胃4小时后即可检测出ecn(图5a)。这与pps中ecn的富集结果相一致(图5b)。定量分析进一步表明,ecn@ym组中mln中的ecn检出数量比ecn高出近8倍(图5c)。siga是肠道粘膜免疫最重要的组成部分,在维持肠道稳态方面起着多重作用,包括抵抗致病菌侵袭、抗炎、促进粘液分泌和调节紧密连接表达。通过m细胞摄取微生物抗原是诱导siga反应并进一步调节和维持肠道菌群稳态的关键步骤。
47.尽管某些益生菌能够刺激siga的产生,但胃肠道发育成熟后,siga的产生主要依赖于m细胞对微生物抗原的摄取,因此这种调节作用往往局限于婴幼儿时期。申请人检测了肠液中siga的水平(图5g),与pbs对照相比,ecn灌胃反而引起siga水平降低,这可能由于肠道中的siga与外来ecn结合而导致的siga消耗。值得注意的是,与ecn相比,单纯给予yms可以促进siga的产生,这可能源于yms的免疫佐剂作用。然而这种作用仅限于摄入后4小时内。令人兴奋的是,ecn@ym可以在给药后4小时诱导显著的粘膜免疫反应,表现为肠道中siga水平显著性升高。这种免疫强化作用可以归因于由m细胞摄取ecn增加引起更高水平的siga的
产生以及由于细菌表明抗原被yms包裹屏蔽而使siga与ecn的结合减少。此外,即使干预频率延长至7天,在所有干预的小鼠中,ecn@ym灌胃小鼠的siga水平和mln中ecn数量在所有干预小鼠中仍保持最高水平(图5d至g)。申请人进一步检测了与与siga产生相关的免疫细胞水平。每天给予小鼠一次5
×
107cfu ecn@ym灌胃7天后,pps和mln中cd11c
+
dc,cd3
+
t细胞,cd4
+
t细胞,cd8
+
t细胞和iga
+
b细胞的水平均升高(图5j至q)。这些免疫细胞的刺激伴随着cd11c
+
dc上活化标记cd80和cd86表达的增加。引起的免疫应答源于pps中ym富集的增加和yms的免疫佐剂作用。另外,值得注意的是,炎性细胞因子包括白介素6(il-6)和tnf-α,尽管在首次给药后会暂时增加(图5h和i),但可以恢复到正常水平,表明ecn@ym用作口服益生菌的副作用有限。
48.外部刺激下肠道菌群稳态的变化
49.为了ecn@ym对肠道菌群稳态抵抗外环境的影响,申请人分别采用致病菌感染和小肠手术对小鼠进行刺激。健康小鼠以及分别用pbs和ecn预处理的感染小鼠用作对照。小鼠适应性喂养7天后,每天用0.2ml pbs,5
×
107cfu ecn或ecn@ym喂食小鼠7天。小鼠禁食禁饮4小时后,每只小鼠给予20mg链霉素灌胃。链霉素处理后24小时,沙门氏菌在含有卡那霉素的lb中培养8小时,口服接种5
×
107cfu的沙门氏菌。感染后3天,处死小鼠并收集样品用于进一步分析。
50.如图6所示,未包裹的ecn预处理对肠道菌群稳态的维持作用可忽略不计,因为菌群组成与用pbs预处理过的沙门氏菌感染小鼠接近(图6a和b)。值得注意的是,用ecn@ym预处理的小鼠的肠道菌群结构更接近健康小鼠。特别是,包括多种病原体(50种),例如沙门氏菌和大肠埃希氏菌的变形杆菌减少了(图6c)。同时,由大多数共生细菌组成的拟杆菌的数量增加,这表明用ecn@ym预处理可以抵抗致病菌感染对肠道菌群稳态的干扰(图6d和e)。维持健康的肠道菌群结构可能源于ecn@ym灌胃引起的siga产生的增加。申请人进一步分析了小肠干扰术刺激对小鼠肠道菌群结构的影响。小肠干扰术导致菌群多样性明显下降(图6f)。同样,用未包裹的细菌进行预处理显示出维持菌群结构稳态的作用有限(图6g和h)。相反,ecn@ym灌胃能够维持健康的肠道菌群结构,即使进行小肠干扰术刺激,ecn@ym预处理小鼠的肠道菌群结构也几乎与健康的小鼠的菌群结构相同。这些数据验证了由通过增强粘膜免疫反应能够提高肠道菌群对不利环境的抗干扰能力。
51.预防肠道屏障功能障碍
52.众所周知,肠道菌群紊乱是许多难治性疾病的发病机制和疾病进一步发展的驱动力,例如肠屏障损伤。一旦肠屏障受损,大量肠腔抗原,炎性细胞因子和毒素进入血液循环系统,导致细胞因子风暴和难治性慢性炎症的发生。然而,目前临床上尚无针对肠屏障功能障碍的特异性防治手段。在免疫介导的肠道菌群稳态维护的研究基础上,申请人探索了ecn@ym预防肠屏障损伤的潜力。为此,诱导了两种肠屏障损伤小鼠模型以验证其效果。在诱导肠屏障损伤之前,将小鼠用pbs,ecn或ecn@ym预处理7天。健康小鼠作为对照。通过眼球摘除术取血,4℃下以5,000rpm转速离心10分钟来分离用于检测细胞因子的血浆。纵行打开小鼠腹腔并取出小肠,刮取粘液并用2ml预冷pbs冲洗。通过在4℃下以5,000rpm转速离心10分钟来收集用于检测siga的肠液。用elisa试剂盒检测il-6,tnf-α和siga的浓度。
53.如图7a所示,小鼠口服给予链霉素后,5
×
107cfu沙门氏菌灌胃。感染后3天,处死所有小鼠以取样。沙门氏菌感染对经pbs预处理小鼠的肠屏障造成了明显损害,表现为严重
的粘膜下水肿,杯状细胞缺失和肠屏障通透性增加(图7b至e)。lps和炎性细胞因子(包括il-6和tnf-α)的水平升高进一步表明,肠屏障损伤导致全身性炎症(图7f至h)。显然,在所有治疗组中,通过用ecn@ym预处理可以最有效地预防肠屏障损伤。显然,只有用ecn@ym进行治疗才能显著减少沙门氏菌的侵袭(图7d至l)。此外,与ecn相比,ecn@ym治疗甚至可以降低il-6,tnf-α的水平和组织病理评分(图7d,g和h)。同时,用ecn@ym预防可显著减少沙门氏菌向近端和远端器官的转移(图7i至l)。尽管未包裹和包裹ym的ecn都可减少沙门氏菌向远端器官(如脾脏和肝脏)的移位程度,与未包裹的细菌相比,ecn@ym预处理能够更有效地抵抗沙门氏菌向包括pps和mln在内的近端组织的移位,ecn@ym增强的肠屏障损伤预防作用可能源于ecn@ym引起更高水平的siga的产生。第二种小鼠肠屏障损伤模型是由小肠干扰术诱导(图8a),该操作不仅导致肠蠕动异常,还导致肠屏障功能障碍。小肠干扰术引起肌肉层中炎性细胞的浸润增加和杯状细胞的消耗,这伴随着肠屏障透性的增加(图8b至d)。用ecn进行的预处理不能抵抗小肠干扰术操作导致的损伤,而用ecn@ym进行的预防性干预则显著降低了肠屏障通透性以及lps的水平(图8d和e)。与ecn相比,ecn@ym治疗明显降低il-6和tnf-α水平(图8f和g)。我们进一步检测细菌移位以评估肠屏障受损程度。如图8h到o所示,小肠干扰术后需氧细菌和厌氧细菌的移位大大增加。除ecn以外,用ecn@ym预处理可显著降低pps,mln,脾脏和肝脏中需氧菌的转移(图8h至k)。更重要的是,与未包裹的ecn相比,ecn@ym的预防显示出对厌氧细菌移位的抵抗力(图8l至o)。这些结果表明,粘膜免疫介导的肠道菌群稳态能有效降低环境刺激导致的肠道屏障功能障碍。
54.申请人报告了粘膜免疫的启动可以通过将活的益生菌口服递送到pps中实现对肠道菌群稳态的调节和维护。受锚定在酵母表面的β-葡聚糖与m细胞膜上嵌入的dectin-1之间特异性结合的启发,设计并通过包裹ym涂层制备的口服益生菌。为了检查涂层益生菌是否可以在yms的帮助下通过m细胞传递到pps中,申请人首先确认yms是否可以保护包裹的ecn免受胃肠道环境的刺激。此外,为了确保将活细菌递送到pps中,在模拟胃肠道腔内微环境的条件下,证实了与m细胞摄取至关重要的β-葡聚糖在胃肠道环境中可以维持稳定性。为了测量m细胞摄取的效率,在体外进行带有或不带有ym涂层的ecn与m细胞共培养,并且包裹ym的细菌显示出更突出的m细胞内化。ecn在pps和mln中富集的提高进一步支持了m细胞摄取ecn的增强。如预期的那样,口服ym包被的ecn,肠液中的siga水平大大提高。引起的粘膜免疫可积极维护和调节肠道菌群稳态,增强肠道菌群对外部刺激的抵抗力。继而保护肠屏障免受致病菌感染和肠道干扰术的损害,从而减少细菌和lps移位以预防全身性炎症的发生。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1