疏水性高分子纳米胶囊
1.本发明属于生物医学纳米材料领域,具体涉及一类新型生物材料,即疏水性高分子纳米胶囊,及其在蛋白质递送方面的应用。
背景技术:
2.蛋白质在生物体内具有许多重要和独特的功能,如催化、信号传导、基因调控等。许多疾病都是由蛋白质的功能出现障碍而引起的。因此功能蛋白的生物体内递送在疾病治疗、成像和疫苗接种等生物领域具有非常重要的意义。然而,目前蛋白质递送的一个难点在于蛋白质穿越生物传输屏障的能力低下,这同时也是目前蛋白质疗法还未在临床大规模应用的一个主要原因。
3.生物体内大部分生物传输屏障均基于生物膜,如细胞膜、囊泡膜、细胞器膜等。由于这些生物膜的磷脂双分子层内是疏水性的,因此表面疏水性的材料能增强与生物膜的相互作用。然而,为了使纳米材料能够在生物体内的水环境中分散,目前传统的蛋白质递送载体在与生物体内递送屏障作用时均使用亲水性表面。即使如plga微球等本身为疏水性的载体,为了提高在水环境的分散性,也会通过表面接枝亲水性材料或包裹上表面活性剂等亲水化手段对材料进行表面亲水化处理,因此与生物环境接触时,这些载体材料表面仍为亲水性。
4.本发明创造性设计了一类新型生物材料,即疏水性高分子纳米胶囊,用于高效递送蛋白质。该纳米胶囊外壳为疏水性高分子,内核为蛋白质。在助溶剂的帮助下,疏水性高分子纳米胶囊能较好分散于水环境中。相比于传统亲水性高分子递送载体,疏水性高分子纳米胶囊利用其大疏水表面,直接与生物传输屏障作用,显著提高了生物传输屏障穿透力,进而提高了蛋白质的递送效率。
技术实现要素:
5.发明目的:本发明的目的是提供一类具有高效传输屏障穿透力的用于蛋白质递送的纳米载体材料。
6.技术方案:为实现上述目的,在本发明的第一方面提供了一类新型生物材料,即疏水性高分子纳米胶囊,所述纳米胶囊具有疏水性高分子的外壳和蛋白质的内核。所述纳米胶囊的部分高分子外壳上偶联有生物功能分子。
7.进一步的,所述疏水性高分子纳米胶囊分散于混合溶剂中。
8.进一步的,所述混合溶剂包括一种或更多种非水溶剂和水。
9.进一步的,所述混合溶剂中,非水溶剂包括但不仅限于二甲基甲酰胺、四氢呋喃、乙醇、丙醇、丁醇、丙酮、二甲基亚砜、乙酸乙酯、甲酸、甲酸、丙酸、丁腈、二甲基甲醇、离子液体等。
10.进一步的,所述混合溶剂中,非水溶剂在混合溶剂中所占体积百分比为0v/v%至100v/v%,较佳为0.5v/v%至10v/v%。
11.进一步的,所述蛋白质包括但不仅限于球形蛋白、抗体蛋白、酶蛋白、抗原蛋白。
12.进一步的,所述疏水性高分子包括但不仅限于聚乳酸、聚乳酸
‑
羟基乙酸共聚物、聚丙交酯、聚碳酸酯、聚醋酸乙烯酯、聚己内酰胺、聚四氟乙烯、聚苯乙烯、聚二甲基硅氧烷等疏水性的高分子。
13.进一步的,所述疏水性高分子纳米胶囊的疏水性外壳和蛋白质内核结构的制备方法包括但不仅限于原位聚合法、乳液聚合法、表面接枝法、溶剂蒸发法等。
14.进一步的,所述生物功能分子包括但不仅限于多肽、蛋白质、核酸、小分子等。
15.进一步的,所述偶联的形式包括:偶联剂作用、电荷作用、疏水作用、范德华力、氢键、肽键,或其组合。
16.进一步的,所述疏水性纳米胶囊表面偶联的功能分子数量为1
‑
10000的正整数,更佳为1
‑
10的正整数。
17.进一步的,所述疏水性高分子纳米胶囊的直径为1
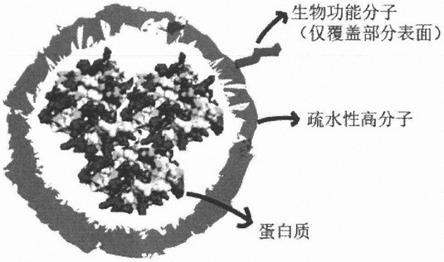
‑
1000nm,较佳为1
‑
100nm,更佳为1
‑
30nm。
18.在本发明的第二方面提供了所述疏水性高分子纳米胶囊产品的制法,包括如下步骤:
19.(1)制备纳米胶囊,所述纳米胶囊外壳为疏水性高分子,内核为蛋白质。
20.(2)将生物功能分子偶联至纳米胶囊的部分高分子表面,得到纳米胶囊
‑
生物功能分子偶联物。
21.(3)将步骤(2)所得纳米胶囊
‑
生物功能分子偶联物分散于混合溶剂中,获得所述疏水性高分子纳米胶囊。
22.在本发明的第三方面,提供了一种如本发明第一方面所述的疏水性高分子纳米胶囊的用途,与常规亲水性纳米递送载体相比,能显著改善穿透生物传输屏障的能力。
23.进一步的,所述生物传输屏障包括但不仅限于细胞膜、囊泡捕获、细胞器膜、皮肤、血脑屏障、血视网膜屏障、肿瘤组织等。
24.有益效果:与现有技术相比,本发明的疏水性高分子纳米胶囊,由于其外壳的疏水表面和有机助溶剂带来的出色的生物传输屏障穿透能力,可对提高蛋白质的递送效率有较大帮助。
25.本发明的疏水性高分子纳米胶囊,具有两种克服生物传输屏障的特征:(1)该纳米胶囊的大疏水表面协助穿透生物膜;(2)有机助溶剂协助穿透生物膜,且减少特异性蛋白质吸附。本发明的疏水性高分子纳米胶囊由于其出色的生物传输屏障穿透力,将能够被广泛应用于蛋白质治疗、透皮治疗、穿透血脑屏障、穿透血视网膜屏障、基因编辑、检测等领域。
附图说明
26.图1为所述疏水性高分子纳米胶囊的结构示意图。该纳米胶囊外壳为疏水性高分子,内核为蛋白质,该纳米胶囊的疏水性高分子的部分表面偶联有生物功能分子。
27.图2为实施例1中的步骤(2)所得的包裹牛血清白蛋白的疏水性高分子纳米胶囊(nbsa)的透射电子显微镜照片。
28.图3为实施例1中的步骤(2)所得的包裹牛血清白蛋白的疏水性高分子纳米胶囊(nbsa)的红外光谱图。如图3所示,nbsa的特征吸收峰1251.4cm
‑1为酯基的特征吸收峰,证实
了bsa表面的高分子膜为聚醋酸乙烯酯
‑
丙烯酸的共聚物。
29.图4为实施例1中的步骤(2)所得的包裹牛血清白蛋白的疏水性高分子纳米胶囊(nbsa)的水合动力学粒径图。图4表明,通过动态光散射粒径测量,bsa的直径约为8nm,而所制备的纳米胶囊nbsa的粒径约为70nm,进一步证明了该纳米胶囊结构的成功制备。
30.图5为实施例1中的步骤(2)所得的包裹牛血清白蛋白的疏水性高分子纳米胶囊(nbsa)在偶联tat前后的zeta电位图。zeta电位结果表明,偶联tat前,纳米胶囊表面带负电,这与纳米胶囊的高分子聚合物电性一致;偶联tat后,纳米胶囊的的表面电位变得更正,由于tat带正电,该结果证实了tat分子的成功偶联。
31.图6为n(bsa
‑
fitc)
‑
tat与骨髓间充质干细胞(bmsc)共培养6小时、12小时和24小时后,细胞内囊泡染料dir与n(bsa
‑
fitc)
‑
tat的荧光共定位效率图。图6表明,在n(bsa
‑
fitc)
‑
tat进细胞的早期阶段,dir与n(bsa
‑
fitc)
‑
tat存在着明显的共定位,共定位效率约为53%,表明该部分n(bsa
‑
fitc)
‑
tat被困在细胞内的囊泡中。而随着时间的推移,n(bsa
‑
fitc)
‑
tat在囊泡内的共定位程度逐渐降低,在12小时时,共定位效率约为18%,在24小时时,共定位效率仅为5%,这说明早期被囊泡捕获的n(bsa
‑
fitc)
‑
tat大部分从囊泡中逃逸出来了。
32.图7为n(bsa
‑
fitc)
‑
tat参与转胞吞运输的a、b、c三层细胞的细胞内荧光强度统计图。将n(bsa
‑
fitc)
‑
tat与a细胞共培养4h后a细胞内的平均荧光强度归一化为1。将摄取了n(bsa
‑
fitc)
‑
tat的a细胞与空白b细胞置于同一培养基中共培养20h后,b细胞中的平均荧光强度为0.61,这说明约有60%的n(bsa
‑
fitc)
‑
tat从a细胞中出来进入到b细胞。最后,将上述b细胞与空白c细胞置于同一培养基中共培养20h后,c细胞中的平均荧光强度为0.3,这说明约有50%的n(bsa
‑
fitc)
‑
tat从b细胞中出来进入到c细胞。结果表明了n(bsa
‑
fitc)
‑
tat的超强转胞吞运输能力。
33.图8为n(bsa
‑
fitc)
‑
fa与完全亲水的纳米胶囊在k562细胞中的摄取量统计图。由图可知疏水性的n(bsa
‑
fitc)
‑
fa大大提高了难转染细胞k562的摄取量,是完全亲水高分子纳米胶囊的近35倍。
具体实施方式
34.下面将结合具体实施例及附图对本发明中的技术方案做进一步详细的描述,显然,所描述的实施例仅是本发明的一部分实施例,而不是全部的实施例。这些实施例仅用于说明本发明而不用于限制本发明的范围。此外,应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
35.实施例1:一种包裹牛血清白蛋白的表面偶联tat的疏水性纳米胶囊(nbsa
‑
tat)的制备及表征
36.具体操作为:
37.(1)在牛血清白蛋白表面连接可以发生聚合的n
‑
丙烯酰氧基琥珀酰亚胺分子。
38.(2)在步骤(1)上述蛋白质溶液中加入醋酸乙烯酯单体、丙烯酸单体和交联剂乙二醇二甲基丙烯酸酯的表面活性剂溶液,其中亲水性单体丙烯酸的加样比例占总单体加样量的一小部分,如10%,以便于后续表面偶联功能分子。加入引发剂过硫酸铵和四甲基乙二
胺,氮气环境下反应。所得产物经过离心洗涤和透析除杂,即得包裹牛血清白蛋白的疏水性纳米胶囊(nbsa)。
39.(3)在二甲基甲酰胺(dmf)中通过1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edc)化学方法将具有核靶向的多肽tat偶联至nbsa表面。随后,将溶解于有机溶剂dmf中的偶联了tat的nbsa分散于水中,即得包裹牛血清白蛋白的表面偶联tat的疏水性纳米胶囊(nbsa
‑
tat)。
40.通过透射电子显微镜(tem)、傅里叶变换红外光谱(ftir)、动态光散射(dls)粒径、和zeta电位确认nbsa
‑
tat的成功制备。由于bsa在透射电子显微镜下的直径约为8nm,而图2的nbsa纳米胶囊的tem图像显示其直径约为35nm,证实了bsa表面包裹了一层高分子膜。同时,dls粒径结果与tem结果相近:单独的bsa的平均粒径约为8nm,nbsa的粒径约为70nm(图3)。图4所示的nbsa的特征吸收峰1251.4cm
‑1为酯基的特征吸收峰,证实了bsa表面的高分子膜为聚醋酸乙烯酯
‑
丙烯酸的共聚物。nbsa的表面zeta电位为负,这与本实例中参与反应的单体带负电的实事一致,另外,随着tat在nbsa表面的偶联,nbsa
‑
tat的表面zata变高,这与tat带正电荷的实事一致,证实了tat多肽在nbsa表面的成功偶联(图5)。
41.所制备的疏水性高分子纳米胶囊体系由于其大疏水表面和有机助溶剂,展现出了优异的传输屏障穿透力。有机溶剂的存在,一方面能够提高疏水纳米胶囊在水相环境的溶解度和胶体稳定性,另一方面也提高了纳米胶囊的穿膜能力。在实践中,为了降低细胞毒性,疏水性高分子纳米胶囊体系所使用有机助溶剂的比例通常为1%。
42.实施例2:n(bsa
‑
fitc)
‑
tat在活细胞中的囊泡逃逸
43.为了能够在活细胞内观察本发明所述纳米胶囊的递送情况,在实施例1中的bsa表面偶联绿色荧光分子异硫氰酸荧光素(fitc),再通过如实施例1所述步骤制备n(bsa
‑
fitc)
‑
tat。将n(bsa
‑
fitc)
‑
tat与骨髓间充质干细胞共培养,使用囊泡染料dir(亲脂性小分子标记脂质膜)进行共定位分析。共定位分析结果表明,在n(bsa
‑
fitc)
‑
tat进细胞的早期阶段,dir与n(bsa
‑
fitc)
‑
tat存在着明显的共定位,共定位效率约为53%,表明该部分n(bsa
‑
fitc)
‑
tat被困在细胞内的囊泡中。而随着时间的推移,n(bsa
‑
fitc)
‑
tat在囊泡内的共定位程度逐渐降低,在12小时时,共定位效率约为18%,在24小时时,共定位效率仅为5%,这说明早期被囊泡捕获的n(bsa
‑
fitc)
‑
tat大部分从囊泡中逃逸出来了(图6)。被细胞内囊泡捕获是大多数蛋白质采用tat肽递送时的最主要挑战,而本发明所述的疏水性高分子纳米胶囊克服了囊泡捕获的传输屏障,具有超强的囊泡逃逸能力。
44.实施例3:n(bsa
‑
fitc)
‑
tat的转胞吞运输研究
45.为了探究n(bsa
‑
fitc)
‑
tat的穿膜能力,本实施例使用n(bsa
‑
fitc)
‑
tat进行转胞吞运输,具体过程为:将n(bsa
‑
fitc)
‑
tat与u87mg细胞(a)共培养4小时后,在共聚焦显微镜下观察a细胞,同时将与n(bsa
‑
fitc)
‑
tat共培养了4小时的a细胞与空白u87mg细胞(b)共培养20小时;在共聚焦显微镜下观察b细胞,再将共培养后的b细胞与空白u87mg细胞(c)共培养20小时,在共聚焦显微镜下观察c细胞。
46.将n(bsa
‑
fitc)
‑
tat与a细胞共培养4h后a细胞内的平均荧光强度归一化为1。将摄取了n(bsa
‑
fitc)
‑
tat的a细胞与空白b细胞置于同一培养基中共培养20h后,b细胞中的平均荧光强度为0.61,这说明约有60%的n(bsa
‑
fitc)
‑
tat从a细胞中出来进入到b细胞。最后,将上述b细胞与空白c细胞置于同一培养基中共培养20h后,c细胞中的平均荧光强度为
0.3,这说明约有50%的n(bsa
‑
fitc)
‑
tat从b细胞中出来进入到c细胞。结果表明了n(bsa
‑
fitc)
‑
tat的超强转胞吞运输能力(图7)。
47.实施例4:n(bsa
‑
fitc)
‑
fa的疏水表面对细胞摄取能力的研究
48.为了进一步探究本发明所述的疏水性高分子纳米胶囊的传输屏障穿透力,本实施例选用难转染的悬浮细胞k562进行摄取实验。由于功能分子叶酸(fa)的受体在k562细胞高表达,故本实例中的疏水性高分子纳米胶囊中偶联的生物功能分子选用叶酸(fa)。n(bsa
‑
fitc)
‑
fa的制备方法类似于实施例2
‑
3中的n(bsa
‑
fitc)
‑
tat的制备方法,只需在制备过程中将功能分子换为叶酸即可。本实施例中用于对照的完全亲水性的高分子纳米胶囊的制备方法为原位聚合法。将疏水性高分子纳米胶囊和完全亲水性的高分子纳米胶囊与k562细胞在无血清培养基中共培养20小时,其中有机助溶剂浓度均为1%,通过流式细胞术定量统计k562细胞内的荧光强度。流式细胞术结果表明,与完全亲水性的高分子纳米胶囊相比,疏水性的n(bsa
‑
fitc)
‑
fa大大提高了k562的摄取量,是完全亲水高分子纳米胶囊的近35倍(图8)。这一结果表明,本发明疏水性高分子纳米胶囊的疏水性表面具有高效的穿膜能力,该结果再次强调了本发明体系在克服细胞内运输障碍方面的重要性。
49.上述实施例可见,本发明的疏水性高分子纳米胶囊,对于各种不同屏障如囊泡膜、细胞膜及细胞间运输屏障等都有超强的透过力,极大提高了蛋白质的递送效率,在蛋白质疗法、透皮治疗、穿透血脑屏障等领域的应用,将具有广阔应用前景。
50.上述公开的实施例使本领域专业技术人员能够实现或使用本发明,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其他实施例中实现。所属技术领域的技术人员应该明了,对本发明的任何改进、对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1