二氢黄酮苷衍生物在制备防治结肠炎的药物中的用途
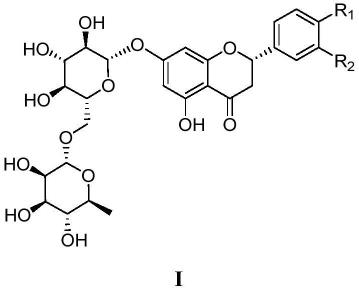
1.本发明属于药物技术,具体涉及二氢黄酮苷衍生物在制备防治结肠炎的药物中的用途。
背景技术:
2.溃疡性结肠炎(ulcerative colitis,uc)是一种病因尚不明确且易反复发作的慢性非特异性炎症性疾病,以结肠粘膜层和粘膜下层的连续性炎症为主要病理特征,常累及直肠,并可蔓延至全结肠甚至回肠末端。流行病学资料显示,uc在全世界范围,尤其是欧洲和北美等发达国家,具有较高的发病率和患病率。
3.uc临床表现多为腹泻、腹痛、黏液脓血便等,病理特征为结肠粘膜固有层内弥漫淋巴细胞、浆细胞、单核细胞等;活动期杯状细胞数目减少,大量中性粒细胞和嗜酸性粒细胞浸润,可发生隐窝炎和脓肿;长期慢性炎症可导致结肠结构和功能受损,增加罹患结直肠癌风险。uc的病程较长,反复发作,难以根治。随着疾病的发展,有些患者还伴有一定程度的肠外表现如皮肤、关节、黏膜炎症等,给患者造成了严重的疾病负担。临床上对于uc尚无特效的治疗方法,治疗的主要目标是缓解症状、防治并发症和预防癌变。目前针对uc的治疗药物主要包括氨基水杨酸类(柳氮磺吡啶和美沙拉嗪)、糖皮质激素类(地塞米松和布地奈德)、免疫抑制剂(环孢素和甲胺蝶呤)和生物制剂(英夫利昔单抗和阿达木单抗)等。虽然数量较多,但是其存在副作用大、易复发、易耐药和价格昂贵等不足。因此,临床迫切需要研发安全有效的治疗药物。
4.目前未见式i化合物或其药物组合物在防治溃疡性结肠炎应用的报道。
技术实现要素:
5.发明目的:针对上述现有技术,本技术提供了式i二氢黄酮苷衍生物在制备防治溃疡性结肠炎的药物中的用途。
6.技术方案:本技术公开了式i二氢黄酮苷衍生物在制备防治结肠炎的药物中的用途,
[0007][0008]
其中r1选自c
1-c4烷氧基;r2选自氢、c
1-c4烷氧基。
[0009]
作为优选技术方案,其中,r1为甲氧基。
[0010]
作为优选技术方案,r2选自氢、c
1-c3烷氧基。
[0011]
优选的,式i所述的二氢黄酮苷衍生物选自下列化合物:
[0012][0013]
上述化合物1提取自中药断血流。
[0014]
断血流药材提取物在制备防治结肠炎的药物中的用途也在本技术的保护范围内。
[0015]
本技术还公开了包含式i的活性成分的植物提取物在制备防治结肠炎的药物中的用途。
[0016]
本技术还公开一种药物组合物,其包含式i所述的二氢黄酮苷衍生物中的一种或多种作为活性成分,以及药物上可接受的载体、赋形剂、佐剂、辅料和/或稀释剂,用于防治溃疡性结肠炎。
[0017]
进一步的,本技术还公开了所述药物组合物在制备防治结肠炎的药物中的用途。
[0018]
有益效果:本技术提供了二氢黄酮苷衍生物在制备防治结肠炎的药物中的用途,通过实验验证本技术化合物能够明显降低结肠炎小鼠的dai评分、明显抑制结肠长度的缩短、明显降低结肠炎小鼠结肠组织mpo活力、明显缓解dss诱导的小鼠结肠组织病理损伤,并且效果显著优于二氢黄酮苷以及阳性对照,具有潜在的抗溃疡性结肠炎制药应用。
具体实施方式
[0019]
下面以结合具体实施例对本技术作出详细说明。
[0020]
实施例1:化合物1-5的制备方法
[0021]
化合物1的制备:
3.12(m,2h),2.78(dd,j=17.1,2.9hz,1h),1.33(t,j=7.0hz,3h),1.09(dd,j=2.5,6.2hz,3h).
[0029]
化合物4,产率为43%。esi-ms(m/z):[m-h]-=651.2(calcd:651.2)。1h nmr(500mhz,dmso-d6):δ12.05(s,1h),7.16(d,j=8.8hz,1h),7.08(d,j=9.0hz,1h),7.00(d,j=9.2hz,1h),6.16(s,2h),5.58(dd,j=9.4,3.0hz,1h),5.40(d,j=5.0hz,1h),5.20(dd,j=8.0,4.8hz,2h),5.02(d,j=7.8hz,1h),4.66(d,j=5.8hz,1h),4.60(d,j=5.2hz,1h),4.52(s,1h),4.46(d,j=5.4hz,1h),3.99(t,j=7.2hz,2h),3.81(s,1h),3.79(s,3h),3.60(s,1h),3.58-3.54(m,1h),3.46-3.40(m,4h),3.28-3.23(m,2h),3.18-3.14(m,2h),2.78(dd,j=17.1,3.0hz,1h),1.72-1.69(m,2h),1.09(d,j=6.1hz,3h),0.99(t,j=8.0hz,3h).
[0030]
化合物5,产率为48%。esi-ms(m/z):[m-h]-=651.2(calcd:651.2)。1h nmr(500mhz,dmso-d6):δ12.03(s,1h),7.20(d,j=9.6hz,1h),7.10(d,j=8.8hz,1h),7.01(d,j=8.8hz,1h),6.15(s,2h),5.62(dd,j=9.5,3.0hz,1h),5.40(d,j=4.8hz,1h),5.21(dd,j=7.2,5.2hz,2h),4.96(d,j=7.8hz,1h),4.79-4.76(m,1h),4.66(d,j=5.8hz,1h),4.60(d,j=4.2hz,1h),4.51(s,1h),4.48(d,j=6.4hz,1h),3.82(s,1h),3.78(s,3h),3.62(s,1h),3.57-3.53(m,1h),3.46-3.39(m,4h),3.29-3.20(m,2h),3.18-3.11(m,2h),2.78(dd,j=17.1,2.8hz,1h),1.32(d,j=7.0hz,6h),1.09(d,j=6.1hz,3h).
[0031]
实施例2:化合物1-5的抗溃疡性结肠炎活性测试
[0032]
uc是一种以结肠黏膜部位大量炎性细胞浸润为主要病变特征的慢性炎症性疾病,患者临床多见腹痛、腹泻、黏液脓血便和里急后重等症状。目前,uc模型动物的制备方法较多,主要包括化学诱导、过继性转移cd4
+
t淋巴细胞、基因敲除和转基因等。其中,化学诱导法因具有操作简单和费用低廉等优势,应用最为广泛。常用的化学诱导剂包括dss、乙酸、2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid solution,tnbs)和噁唑酮(oxazolone)等。相较于其它诱导剂,经dss诱导后建立的结肠炎模型小鼠症状和结肠病理特征均与人类uc最为相似。此外,该模型亦具有成功率高、重复性好和远端结肠病变均匀等优点。dss是一种由人工合成的肝素类多糖,具有抗凝属性,对存在于基底隐窝部位的肠上皮细胞具有明显的细胞毒性,破坏肠黏膜屏障的完整性,进而导致肠道内容物(如细菌及其代谢产物等)进入并穿透内部黏液层,激活肠固有层的免疫细胞和炎性细胞。活化后的免疫细胞和炎性细胞通过释放大量前炎因子、趋化因子、黏附分子和活性氧等物质,从而引起肠道的炎症反应。综上,本技术采用dss诱导的小鼠结肠炎模型,考察化合物1、2对小鼠结肠炎的抑制作用。
[0033]
实验材料
[0034]
实验试剂
[0035]
所用药物按上述实施例1制备,代号1-5;dss(mw 36,000-50,000)购于美国mp biomedicals公司;5-氨基水杨酸(5-aminosalicylic acid,5-asa)购于法国爱的发制药公司;髓过氧化物酶(myeloperoxidase,mpo)试剂盒购于南京建成生物工程研究所;邻甲苯胺购于上海晶纯生化科技股份有限公司;双氧水(h2o2)和冰醋酸购于南京化学试剂股份有限公司。
[0036]
实验动物
[0037]
雌性c57bl/6小鼠,6-8周龄,体重18-20g,购自南京市江宁区青龙山动物养殖场【生产许可证号:scxk(苏)2017-0001】。动物自由摄食和饮水,饲养于室温为22
±
2℃,湿度为45
±
10%的环境中。适应性饲养3天后,用于后续实验。
[0038]
实验方法
[0039]
小鼠结肠炎模型的建立与分组给药
[0040]
雌性c57bl/6小鼠,6-8周龄,体重18-20g,将小鼠按体重大小随机分为正常组、模型组、化合物1(1,2,4mg/kg)组、化合物2(1,2,4mg/kg)组、橙皮苷(10,20,40mg/kg)组和阳性对照药5-asa(200mg/kg)组。除正常组外,其余组小鼠均给予2.5%的dss溶液连续7天,随后换成单蒸水自由饮用3天。开始造模当天记为day 1,并灌胃给予化合物1、化合物2、橙皮苷和5-asa,每天1次,连续10天,给药体积为0.1ml/10g;正常组和dss组小鼠给予等体积的溶媒(0.5%cmc-na溶液)。
[0041]
疾病活动指数评分
[0042]
每天观察并记录小鼠体重、腹泻和隐血情况,进行疾病活动指数(disease activity index,dai)评分,dai=(体重评分+大便性状评分+大便出血评分/3)。具体评分标准如下:
[0043]
疾病活动指数评分准则
[0044][0045]
粪便隐血情况测定:收集小鼠粪便,并置于24孔培养板中,加入等体积的邻甲苯胺冰乙酸和3%过氧化氢溶液,2min内呈蓝褐色即判定为阳性。
[0046]
标本采集
[0047]
末次给药后1h,自眼底静脉丛采血,室温静置2h,3500rpm、4℃离心15-20min,分离血清,-20℃或-80℃保存。采血后处死小鼠,小心打开腹腔,于距离肛门1cm处取结肠,测量长度,观察形态变化,并进行拍照。随后,使用预冷的pbs溶液冲洗干净,自远心端量取0.4cm结肠组织,置于4%甲醛中性缓冲液中固定,待做病理检测,剩余结肠液氮冰藏。
[0048]
mpo活力测定
[0049]
髓过氧化物酶mpo,是白细胞入侵组织的重要标志之一。取各组小鼠结肠组织20mg,加入200μl预冷的pbs制备10%组织匀浆。4℃、1200rpm条件下离心5min,吸取上清。严格按照试剂盒说明书所述方法逐步加入试剂,于460nm波长处测定吸光度。mpo活力的计算公式:
[0050]
mpo活力(u/克湿重)=(测定管od值-对照管od值)/11.3
×
取样量(g)
[0051]
酶活力单位定义:每克湿重在37℃的反应体系中h2o2被分解1μmol为1个酶活力单位。
[0052]
结肠组织病理学测定
[0053]
取取浸泡于4%中性甲醛的小鼠远心端结肠组织,常规脱水后用石蜡包埋,苏木
精-伊红(hematoxylin-eosin staining,h&e)染色,封片固定,用于组织病理学检查。由专业病理检查人员在光学显微镜下观测粘膜层及粘膜下层病变程度、粘膜固有层炎性细胞浸润程度和隐窝损害程度,并对此3项指标进行评分。计算每只小鼠的总评分,评分标准如下:
[0054]
结肠组织病理学评分
[0055][0056]
将上述三项指标的评分分别乘以病变区域所占比例(参与比例)为最后得分。
[0057]
数据统计
[0058]
所有数据均以means
±
s.e.m.表示,组间统计学差异采用spss软件中one-way anona和dunnett’s检验。p值小于0.05被认为有显著性差异。
[0059]
实验结果
[0060]
对dai评分的影响
[0061]
如表1所示,dss组小鼠体重明显减轻,出现严重的腹泻和便血等症状,第1-8天dai评分持续升高,停用dss后dai评分稍有降低。化合物1(2,4mg/kg)、化合物2(2,4mg/kg)、橙皮苷(20,40mg/kg)和5-asa(200mg/kg)灌胃给药均明显降低结肠炎小鼠的dai评分,值得注意的是,化合物1和化合物2的作用比橙皮苷强10倍,比5-asa强100倍。
[0062]
表1.dai评分
[0063]
[0064][0065]
注:与normal组相比较
##
p《0.01;与dss组比较
*
p《0.5和
**
p《0.01.
[0066]
对结肠长度的影响
[0067]
如表2所示,与正常小鼠相比,dss组小鼠结肠长度明显缩短,化合物1(2,4mg/kg)、
化合物2(2,4mg/kg)、橙皮苷(20,40mg/kg)和5-asa(200mg/kg)灌胃给药明显抑制结肠长度的缩短。值得注意的是,化合物1和2的作用比橙皮苷强10倍,比5-asa强100倍。
[0068]
表2.结肠长度
[0069]
组别例数结肠长度(cm)normal67.73
±
0.14dss65.65
±
0.21
##
1(1mg/kg)65.72
±
0.121(2mg/kg)66.48
±
0.17
**
1(4mg/kg)67.10
±
0.24
**
2(1mg/kg)65.92
±
0.222(2mg/kg)66.55
±
0.11
**
2(4mg/kg)67.13
±
0.18
**
橙皮苷(10mg/kg)66.03
±
0.16橙皮苷(20mg/kg)66.30
±
0.20
*
橙皮苷(40mg/kg)66.97
±
0.19
**
5-asa(200mg/kg)66.67
±
0.25
**
[0070]
注:与normal组相比较
##
p《0.01;与dss组比较
*
p《0.5和
**
p《0.01.
[0071]
对结肠组织mpo活力的影响
[0072]
mpo为中性粒细胞所特有,每个细胞的含酶量固定,约占细胞干重的5%,具有还原过氧化氢的能力。依据mpo的此特点,通过分析酶活,可提示组织中性粒细胞的数量。如表3所示,与正常组比较,dss组小鼠结肠组织中mpo活力明显升高,化合物1(2,4mg/kg)、化合物2(2,4mg/kg)、橙皮苷(20,40mg/kg)和5-asa(200mg/kg)灌胃给药均明显降低结肠炎小鼠结肠组织mpo活力,且化合物1和2的作用比橙皮苷强10倍,比5-asa强100倍。
[0073]
表3.结肠组织mpo活力
[0074]
组别例数mpo活力(u/g tissue)normal60.79
±
0.06dss62.02
±
0.12
##
1(1mg/kg)61.95
±
0.111(2mg/kg)61.63
±
0.09
*
1(4mg/kg)61.34
±
0.14
**
2(1mg/kg)62.05
±
0.092(2mg/kg)61.55
±
0.14
**
2(4mg/kg)61.29
±
0.09
**
橙皮苷(10mg/kg)61.91
±
0.12橙皮苷(20mg/kg)61.62
±
0.13
*
橙皮苷(40mg/kg)61.28
±
0.10
**
5-asa(200mg/kg)61.45
±
0.09
**
[0075]
注:与normal组相比较
##
p《0.01;与dss组比较
*
p《0.5和
**
p《0.01.
[0076]
对结肠组织病理学改变的影响
[0077]
如表4所示,正常组小鼠结肠粘膜完整无缺损,上皮细胞排列整齐,无炎性细胞浸润,固有层内腺体结肠清晰,排列规则,杯状细胞丰富;dss组小鼠结肠组织发生严重病变,累及粘膜层及粘膜下层,粘膜上皮细胞坏死,表面无上皮覆盖,隐窝损坏严重,粘膜固有层巨噬细胞和中性粒细胞浸润明显。化合物1(2,4mg/kg)、化合物2(2,4mg/kg)、橙皮苷(20,40mg/kg)和5-asa(200mg/kg)灌胃给药均明显改善上述症状,缓解dss诱导的小鼠结肠组织病理损伤。
[0078]
表4.结肠组织病理评分
[0079][0080][0081]
注:与normal组相比较
##
p《0.01;与dss组比较
*
p《0.5和
**
p《0.01.
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1