用于多特异性抗体递送的细胞膜包覆型纳米适配子及应用
1.本发明涉及医药技术领域,特别是涉及一种用于多特异性抗体递送的细胞膜包覆型纳米适配子及应用。
背景技术:
2.从90年代起,单克隆抗体已经成为临床以及商业上成功的药物品类,可以用于多种疾病治疗,如肿瘤、炎症以及自身免疫疾病等。
3.单克隆抗体与其他小分子药物等相比,更具有特异性高、依从性好等特点。临床上已经发展了超过550种抗体,据预测到2020大约有70种单克隆抗体将进入市场治疗各种疾病。虽然单克隆抗体类药物展现了巨大的商业价值和广阔的临床应用前景,但是其中很多单克隆抗体存在临床响应率低、毒副作用大等问题。
4.为了进一步提高抗体药物的临床应用率,双特异性抗体/多特异性抗体被开发出来用于克服单克隆抗体不足的问题。双特异性抗体具有两个或者多个抗原结合片段,可以桥连效应细胞和靶细胞,也可以作用于多个靶标等,在治疗上既可以提高响应率,又可以降低毒副作用。例如,2014年fda批准用于b细胞前体急性淋巴性白血病治疗的blinatumomab是一种cd19/cd3双特异性抗体,其能够同时结合b淋巴母细胞表面的cd19和t细胞表面的cd3,桥接两种细胞同时激活t细胞杀伤肿瘤细胞。到目前为止,已有20多个不同的商业化技术平台可用于双特异性抗体的创建和开发,2种双特异性抗体已上市,超过85种用于临床发展。双特异性抗体/多特异性抗体在显著增效的同时也存在一些问题,生产过程复杂且成本高、对病灶部位主动靶向差等。
技术实现要素:
5.基于此,本发明的目的是提供一种可以快速、高效、可控地定向结合两种以上特异性抗体的细胞膜包覆型纳米抗体递送平台(以下称为纳米适配子)。
6.具体技术方案如下:
7.一种用于多特异性抗体递送的细胞膜包覆型纳米适配子(cell membrane-based nanoparticles,cmnp),其包括纳米颗粒和包覆所述纳米颗粒的细胞膜,所述细胞膜为表达fcγr的细胞膜(cell membrane,cm),所述fcγr能与所递送的特异性抗体结合,所述特异性抗体具有一种或多种。
8.本发明的另一目的是提供一种上述纳米适配子的制备方法,包括以下步骤:
9.(1)制备表达fcγr的细胞膜,再进行超声,得到表达fcγr的细胞膜囊泡;
10.(2)将步骤(1)所述细胞膜囊泡(cell membrane vesicles,cmv)与所述纳米颗粒混合,得到细胞膜包覆型纳米适配子。
11.本发明的另一目的是提供一种多特异性抗体递送系统(cmnp-igg),包括上述的细胞膜包覆型纳米适配子,以及特异性抗体。
12.本发明的另一目的是提供一种所述多特异性抗体递送系统的制备方法,包括以下
步骤:将上述的细胞膜包覆型纳米适配子与所述特异性抗体混合。
13.本发明的再一目的是提供一种上述的细胞膜包覆型纳米适配子或多特异性抗体递送系统在制备免疫治疗药物中的应用。
14.与现有技术相比,本发明具有以下有益效果:
15.本发明首次构建得到一种通用型的细胞膜包覆型纳米抗体递送平台(纳米适配子),其保留有结合抗体的天然连接基团fcγr,可以快速、高效、可控地定向结合于1种或多种类型的治疗性单克隆抗体的fc段,从而实现了纳米抗体的多价态、多特异性、多功能的特点,并具有良好的生物相容性和靶向性。本发明首次将这种细胞膜包覆型纳米抗体递送平台创造性地应用于为包括肿瘤、自身免疫疾病等多种疾病制备免疫治疗药物中,具有巨大的临床应用潜能。
16.本发明所述的细胞膜包覆型纳米抗体递送平台是通过受体配体相互作用的方式结合抗体,其不影响抗体药物fab段的结构和功能,制备简便,为联合抗体治疗的发展提供了一种全新思路的简便结构设计。
附图说明
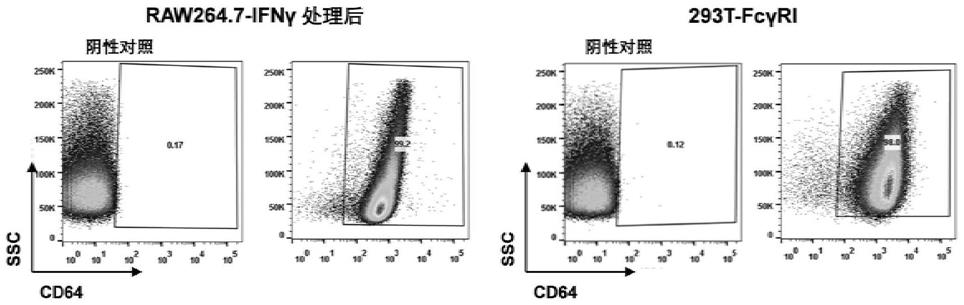
17.图1为流式表征ifn-γ处理的raw264.7细胞以及293t-fcγri细胞的fcγri表达情况;
18.图2为raw264.7细胞膜囊泡(raw264.7@cmv)以及293t-fcγri细胞膜囊泡(293t-fcγri@cmv)粒径以及分散情况;
19.图3为np
plga
以及cmnp
plga
的粒径以及分散情况;
20.图4为np
pcl
以及cmnp
pcl
的粒径以及分散情况;
21.图5为np
peg-pcl
以及cmnp
peg-pcl
的粒径以及分散情况;
22.图6为np
peg-pla
以及cmnp
peg-pla
的粒径以及分散情况;
23.图7为np
peg-plga
以及cmnp
peg-plga
的粒径以及分散情况;
24.图8为cmnp的电镜观察结构;
25.图9为共聚焦观测cmnp的功能性细胞膜的包覆情况;
26.图10为cmnp上细胞膜蛋白以及功能性蛋白的表征(a、sds-page电泳分析np
plga
、细胞膜以及cmnp的蛋白表达情况;b、western blot检测细胞、细胞膜以及cmnp的功能性蛋白cd64(fcγri)的表达情况);
27.图11为cmnp稳定性表征;
28.图12为cmnp与治疗性抗体结合的粒径以及分散情况;
29.图13为cmnp与治疗性抗体结合比例表征;
30.图14为激光共聚焦观察cmnp(αpd-1&αpd-l1)促进肿瘤细胞和t细胞相互作用观察图;
31.图15为hoechst 33342释放法检测cmnp(αpd-1&αpd-l1)促进t细胞杀伤肿瘤细胞。
具体实施方式
32.本发明下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用化学试剂,均为市售产品。
33.除非另有定义,本发明所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不用于限制本发明。
34.本发明的术语“包括”和“具有”以及它们任何变形,意图在于覆盖不排他的包含。例如包含了一系列步骤的过程、方法、装置、产品或设备没有限定于已列出的步骤或模块,而是可选地还包括没有列出的步骤,或可选地还包括对于这些过程、方法、产品或设备固有的其它步骤。
35.在本发明中提及的“多个”是指两个或两个以上。“和/或”,描述关联对象的关联关系,表示可以存在三种关系,例如,a和/或b,可以表示:单独存在a,同时存在a和b,单独存在b这三种情况。字符“/”一般表示前后关联对象是一种“或”的关系。
36.本实施方式提供一种多特异性抗体递送的纳米适配子(cell membrane-based nanoparticles,cmnp),其包括纳米颗粒和包覆所述纳米颗粒的细胞膜,所述细胞膜为表达fcγr的细胞膜(cell membrane,cm),所述fcγr能与所递送的特异性抗体结合,所述特异性抗体具有一种或多种。
37.基于细胞膜的生理结构和功能,本发明的细胞膜包覆型纳米颗粒不仅能增加药物的生物相容性以及延长药物半衰期,还可以有效增加药物的主动靶向性如肿瘤靶向性、炎性免疫细胞靶向性等。fc受体fcγr(亚型包括fcγri、fcγr
ⅱ‑
a、fcγr
ⅱ‑
b2、fcγr
ⅱ‑
b1、fcγrⅲ)是一类免疫细胞表面受体家族,可以特异性结合抗体的fc段,表达于免疫细胞包括单核细胞、巨噬细胞、中性粒细胞等表面。本发明的细胞膜包覆型纳米抗体递送平台(纳米适配子),其保留有结合抗体的天然连接基团fcγr,不影响抗体药物fab段的结构和功能,制备简便,实现了纳米抗体的多价态、多特异性、多功能的特点。
38.在一些实施方式中,本发明的细胞膜包覆型纳米适配子可以与1种或多种的特异性抗体进行结合。进一步地,所述细胞膜包覆型纳米适配子可以与至少2种的特异性抗体进行结合。
39.在其中一些实施例中,所述fcγr能与所递送的特异性抗体的fc段结合。
40.在其中一些实施例中,所递送的特异性抗体与所述fcγr能识别的fc段具有相同的种属来源,可以选自但不限于鼠源、羊源或人源。
41.在其中一些实施例中,所述fcγr包括亚型fcγri、fcγr
ⅱ‑
a、fcγr
ⅱ‑
b2、fcγr
ⅱ‑
b1或fcγrⅲ。
42.在其中一些实施例中,所述表达fcγr的细胞膜为表达fcγr的免疫细胞膜或表达fcγr的非免疫细胞膜。
43.在其中一些实施例中,所述表达fcγr的免疫细胞膜源自经细胞因子刺激后表达fcγr的免疫细胞。
44.在其中一些实施例中,所述免疫细胞膜优选为巨噬细胞膜。
45.在其中一些实施例中,所述表达fcγr的非免疫细胞膜为源自表达fcγr的病毒或质粒转染后表达fcγr的非免疫细胞。
46.本发明的术语“纳米颗粒”包括聚合物纳米颗粒、磁性纳米颗粒、贵金属纳米颗粒、半导体纳米颗粒、复合纳米颗粒、纳米凝胶(蛋白质纳米凝胶和核酸纳米凝胶)和其他用于生物医学应用的纳米颗粒(参见,例如keller,peter等人公开的美国专利申请us16/513566
中的纳米载体/纳米颗粒(nanocarrier/nanoparticles),值得注意的是,本发明中的纳米颗粒不需要与表达fcγr的细胞膜进行共价偶联,因此,纳米颗粒上可以不具有用于偶联的连接基团/接头)。
47.在一些实施方式中,纳米颗粒是合成的或天然存在的。
48.在一些实施方式中,纳米颗粒是可降解的,并且因此不是磁性的。生物可降解的纳米颗粒可以使用本领域已知的方法合成。例如复乳法、相分离法、喷雾干燥法等方法。
49.在一些实施方式中,聚合物纳米颗粒由一个或多个以随机方式排列的聚合物组成。可以用于形成生物可降解纳米颗粒的示例性合成聚合物包括,但不限于脂肪族聚酯、聚酐、聚氨酯,以及天然聚合物,如海藻酸盐或其他多糖,包括葡聚糖和纤维素、胶原蛋白及其化学衍生物。通常,这些材料通过在体内酶水解或者暴露于水体环境,通过表面或本体溶蚀降解。
50.在其中一些实施方式中,所述聚合物纳米颗粒为聚酯纳米颗粒。
51.在其中一些实施方式中,所述聚酯纳米颗粒的聚酯为脂肪族聚酯或聚乙二醇修饰的脂肪族聚酯。
52.在其中一些实施方式中,所述脂肪族聚酯为聚丙交酯(pla)、聚乙交酯(pga)、聚(乙交酯-co-丙交酯)(plga)和聚己内酯(pcl)中的至少一种。
53.在其中一些实施方式中,所述聚乙二醇修饰的脂肪族聚酯为聚乙二醇修饰的聚丙交酯(peg-pla)、聚乙二醇修饰的聚乙交酯(peg-pga)、聚乙二醇修饰的聚(乙交酯-co-丙交酯)(peg-plga)和聚乙二醇修饰的聚己内酯(peg-pcl)中的至少一种。
54.在其中一些实施方式中,所述聚丙交酯为左旋聚丙交酯(plla)、右旋聚丙交酯(pdla)或外消旋聚丙交酯(pdlla)。
55.在其中一些实施方式中,所述聚丙交酯的端基为酯基、羧基和羟基中的至少一种。
56.在其中一些实施方式中,所述的脂肪族聚酯的分子量范围为7200~1100000道尔顿。
57.在其中一些实施方式中,所述的脂肪族聚酯为聚(乙交酯-co-丙交酯),其la/ga的比例范围为95/5~50/50,具体可以为95/5、85/15、75/25、50/50或任意两个具体比例之间的范围。
58.在其中一些实施方式中,所述纳米颗粒的粒径范围为25~500nm,优选粒径范围为50~300nm。
59.本发明的还提供一种上述细胞膜包覆型纳米适配子的制备方法,包括以下步骤:
60.(1)制备表达fcγr的细胞膜,再进行超声,得到表达fcγr的细胞膜囊泡;
61.(2)将步骤(1)所述细胞膜囊泡与所述纳米颗粒混合,得到细胞膜包覆型纳米适配子。
62.在其中一些实施例中,步骤(1)所述表达fcγr的细胞膜的制备包括:构建表达fcγr的细胞,提取其细胞膜,得到表达fcγr的细胞膜。
63.在其中一些实施例中,所述表达fcγr的细胞膜为表达fcγr的免疫细胞膜或非免疫细胞膜。
64.在其中一些实施例中,所述非免疫细胞膜包括293t细胞膜。
65.在其中一些实施例中,所述表达fcγr的免疫细胞的构建方法包括:用细胞因子刺
激免疫细胞,得到表达fcγr的免疫细胞。
66.在其中一些实施例中,所述细胞因子选自但不限于ifn-α、ifn-γ或il-10。
67.在其中一些实施例中,表达fcγr的非免疫细胞的构建方法包括:表达fcγr的病毒或质粒转染非免疫细胞,得到表达fcγr的非免疫细胞。也可以用其他常规方法,只要能构建得到表达fcγr的细胞即可。
68.在其中一些实施例中,步骤(1)所述提取细胞膜的方法包括:在表达fcγr的细胞中加入低渗裂解缓冲液,重悬并破碎,(以3000~3400
×
g的离心力)离心并收集上清,在上清中加入蔗糖水溶液,(以1800~2200
×
g的离心力)离心并收集上清,再(以18000~22000
×
g的离心力)离心,所得沉淀物为表达fcγr的细胞膜。具体地,加入所述蔗糖水溶液至上清中蔗糖的终浓度为0.25
±
0.1mol/l。其也可以用本领域其他常规提取细胞膜的方法,只要能提取得到表达fcγr的细胞膜即可。
69.进一步地,所述低渗裂解缓冲液的组成为:20
±
0.2mm tris-hcl(ph=7.5)、10
±
0.2mm kcl、2
±
0.2mm mgcl2和100
±
2mm无edta的磷酸酶以及蛋白酶抑制剂。
70.在其中一些实施例中,步骤(2)所述纳米颗粒为聚酯纳米颗粒,所述聚酯纳米颗粒的制备方法包括以下步骤:将聚酯溶解于有机溶剂中,将所得聚酯溶液滴加至水中,得到聚酯纳米颗粒。进一步地,所述聚酯溶液的浓度为1~20mg/ml,进一步为1~15mg/ml,进一步为1~8mg/ml。具体地,所述有机溶剂可以为丙酮(acetone),但不限于此,还可以为二甲基甲酰胺、乙腈、dmso等。
71.在其中一些实施例中,步骤(3)所述混合为超声混合或反复挤压混合。具体地,所述超声混合的频率为40~45khz,功率为280~320w,所述超声混合的时间为1~8分钟。
72.在其中一些实施例中,步骤(1)所述超声的频率为40~45khz,功率为280~320w,所述超声混合的时间为1~10分钟。其可以获得粒径大小与纳米颗粒粒径大小相近的细胞膜囊泡。
73.在其中一些实施例中,所述表达fcγr的细胞膜囊泡与所述纳米颗粒的质量比为0.75:1~1.5:1,进一步为0.75:1~1:1。
74.本发明的另一目的是提供一种多特异性抗体递送系统(cmnp-igg),包括上述的细胞膜包覆型纳米适配子,以及特异性抗体。
75.在其中一些实施例中,所述特异性抗体包括一种或多种亚型。
76.在其中一些实施例中,所述多特异性抗体递送系统包括至少两种特异性抗体。
77.在其中一些实施例中,所述多特异性抗体递送系统的粒径范围为50nm~300nm,还可以为80nm~300nm。
78.本发明的另一目的是提供一种所述多特异性抗体递送系统的制备方法,包括以下步骤:将上述的细胞膜包覆型纳米适配子与所述特异性抗体混合。进一步地,所述混合的温度为0~8℃。
79.在其中一些实施例中,所述纳米适配子上细胞膜cm与特异性抗体的质量比为100/1~200/1,此时纳米适配子与特异性抗体的结合效率达到100%。
80.本发明的另一目的是提供一种上述的细胞膜包覆型纳米适配子或多特异性抗体递送系统在制备免疫治疗药物中的应用。
81.在其中一些实施例中,所述免疫治疗药物为肿瘤免疫治疗药物或自身免疫疾病治
疗药物。
82.以下结合具体实施例对本发明作进一步详细的说明。
83.实施例中所用原料来源:
84.pmsf:苯甲基磺酰氟,购于生工生物工程(上海)股份有限公司;
85.ripa裂解液:蛋白裂解缓冲液,购于生工生物工程(上海)股份有限公司;
86.edta:乙二胺四乙酸,购于sigma公司;
87.f-127:表面活性剂,购于sigma公司;
88.raw264.7巨噬细胞以及293t细胞,来源于atcc;
89.细胞因子ifn-γ,购于peprotech公司:
90.聚(乙交酯-co-丙交酯)聚合物:la/ga的比例为75/25,购自济南岱罡生物科技有限公司。
91.高表达cd64(fcγri)病毒质粒,购于vectorbuilder公司;
92.apc anti-mouse cd64(fcγri)流式抗体,货号127504,购于biolegend公司;
93.羊抗鼠的cd64(fcγri)抗体,货号为af2074-sp,购于r&d systems公司;
94.大鼠抗小鼠igg(αpd-1)抗体,购于rockland公司;
95.实施例中所用仪器型号及公司:
96.浴式超声仪:型号为kq-300de,昆山市超声仪器有限公司;
97.台式微量冷冻离心机:型号为microfuge 20r,美国beckman公司;
98.纳米粒度及zeta电位仪:型号为nano zse,英国malvern公司;
99.透射电子显微镜:型号为talos l120c,美国赛默飞世尔科技公司;
100.单光子激光共聚焦:型号为zeiss lsm880,蔡司公司;
101.bio-rad凝胶成像系统:型号chemidoc mp,美国伯乐公司。
102.实施例1、获得具有功能性细胞膜的细胞(高表达fcγri的细胞)
103.扩大培养raw264.7巨噬细胞,加入40ng/ml细胞因子ifn-γ,继续培养24小时,待细胞长满,收集刺激后raw264.7细胞。
104.包装高表达cd64(fcγri)病毒质粒,获得表达cd64(fcγri)病毒,感染293t细胞,获得高表达fcγri的293t细胞系(293t-fcγri),扩大培养293t-fcγri细胞系,待细胞长满,收集细胞。
105.利用流式抗体apc anti-mouse cd64(fcγri)标记收集的细胞,流式检测fcγri的表达;如图1所示,相对于阴性对照,收集的ifn-γ处理的raw264.7巨噬细胞和293t-fcγri细胞fcγri的表达阳性比例达到98%以上。
106.实施例2、高表达fcγri细胞膜的提取以及细胞囊泡制备
107.表达fcγri的raw264.7细胞膜(raw264.7@cm)的制备:待高表达fcγri的raw264.7细胞长满,收集细胞,pbs洗三次,离心收集细胞;在收集的细胞中加入由20mm tris-hcl(ph=7.5)、10mm kcl以及2mm mgcl2,以及加入100mm磷酸酶蛋白酶抑制剂的低渗裂解液(无edta),重悬,冰上放置15分钟;重悬并用杜恩斯匀浆器破碎细胞(约20次),3200
×
g离心5分钟,收集上清,沉淀再用杜恩斯匀浆器破碎细胞(约20次),3200
×
g离心5分钟,收集上清,合并上清。在上清中加入1mol/l的蔗糖水溶液,终浓度为0.25mol/l。2000
×
g离心10分钟,收集上清;20000
×
g离心30分钟,得到沉淀物,即表达fcγri的raw264.7细胞膜
(raw264.7@cm)。沉淀物可在10mm tris-hcl(ph=7.5)和1mm edta中洗一遍。
108.293t-fcγri细胞膜(293t-fcγri@cm)的制备方法参考上述的表达fcγri的raw264.7细胞膜的制备。
109.表达fcγri的raw264.7细胞膜囊泡(raw264.7@cmv)和293t-fcγri细胞膜囊泡(293t-fcγri@cmv)的制备:将提取的细胞膜沉淀物利用低渗裂解液重悬,置于42khz、300w超声2分钟,获得细胞膜囊泡。经动态光散射仪(dynamic light scattering,dls)检测细胞膜囊泡粒径,如图2a和2b所示,raw264.7@cmv和293t-fcγri@cmv的粒径分别约为219nm和289nm。
110.实施例3、聚合物纳米颗粒制备
111.聚(乙交酯-co-丙交酯)(plga)聚合物纳米颗粒的制备:称取聚(乙交酯-co-丙交酯)聚合物plga
10k
溶解于丙酮中,终浓度为4mg/ml。将250ul含有1mg聚(乙交酯-co-丙交酯)聚合物丙酮溶液逐步滴加至750ul的超纯水中,搅拌。使用透析袋透析除去丙酮,得到聚(乙交酯-co-丙交酯)聚合物纳米颗粒。经动态光散射仪(dynamic light scattering,dls)检测纳米颗粒粒径,如图3a所示,内核plga纳米颗粒(np
plga
)其粒径为114nm左右。
112.聚己内酯(pcl)聚合物纳米颗粒的制备:称取聚己内酯聚合物pcl
13.3k
溶解于丙酮中,终浓度为4mg/ml。将250ul含有1mg聚己内酯聚合物丙酮溶液逐步滴加至750ul含有0.3%f-127(w/v)的超纯水中,搅拌。使用透析袋透析除去丙酮,得到聚己内酯聚合物纳米颗粒溶液,进一步以20000
×
g离心2h收集纳米颗粒。经动态光散射仪(dynamic light scattering,dls)检测纳米颗粒粒径,如图4a所示,内核pcl纳米颗粒(np
pcl
)其粒径为114nm左右。
113.聚乙二醇修饰聚己内酯的(peg-pcl)聚合物纳米颗粒的制备:称取聚乙二醇修饰聚己内酯peg
5k-pcl
10.7k
溶解于丙酮中,终浓度为4mg/ml。将250ul含有1mg聚乙二醇修饰聚己内酯聚合物丙酮溶液逐步滴加至750ul含有0.3%f-127(w/v)的超纯水中,搅拌。使用透析袋透析除去丙酮,得到聚乙二醇修饰聚己内酯聚合物纳米颗粒。经动态光散射仪(dynamic light scattering,dls)检测纳米颗粒粒径,如图5a所示,内核peg-pcl纳米颗粒(np
peg-pcl
)其粒径为50nm左右。
114.聚乙二醇修饰的聚丙交酯(peg-pla)聚合物纳米颗粒的制备:称取聚乙二醇修饰的聚丙交酯聚合物peg
5k-pla
7.5k
溶解于丙酮中,终浓度为4mg/ml。将250ul含有1mg聚乙二醇修饰的聚丙交酯丙酮溶液逐步滴加至750ul的超纯水中,搅拌。使用透析袋透析除去丙酮,得到聚乙二醇修饰的聚丙交酯聚合物纳米颗粒。经动态光散射仪(dynamic light scattering,dls)检测纳米颗粒粒径,如图6a所示,内核peg-pla纳米颗粒(np
peg-pla
)其粒径为38nm左右。
115.聚乙二醇修饰的聚(乙交酯-co-丙交酯)(peg-plga)聚合物纳米颗粒的制备:称取聚乙二醇修饰的聚(乙交酯-co-丙交酯)聚合物peg
5k-plga
10k
溶解于丙酮中,终浓度为4mg/ml。将250ul含有1mg聚乙二醇修饰的聚(乙交酯-co-丙交酯)聚合物丙酮溶液逐步滴加至750ul的超纯水中,搅拌。使用透析袋透析除去丙酮,得到聚乙二醇修饰的聚(乙交酯-co-丙交酯)聚合物纳米颗粒。经动态光散射仪(dynamic light scattering,dls)检测纳米颗粒粒径,如图7a所示,内核peg-plga纳米颗粒(np
peg-plga
)其粒径为113nm左右。
116.实施例4、功能性细胞膜包覆型纳米适配子制备
117.raw264.7细胞膜包覆型纳米适配子(raw264.7@cmnp)的制备:将细胞囊泡分别与聚合物纳米颗粒np
plga
、np
pcl
、np peg-pcl
、np
peg-pla
以及np
peg-plga
以细胞膜囊泡质量与聚合物质量比为1:1的比例混合,置于42khz、300w冰浴超声5分钟,即得到功能性细胞膜包覆型纳米适配子(raw264.7@cmnp)。经动态光散射仪(dynamic light scattering,dls)检测cmnp的粒径,如图3b所示,cmnp
plga
的粒径为138nm左右。如图4b所示,cmnp
pcl
的粒径为158nm左右。如图5b所示,cmnp
peg-pcl
的粒径为82nm左右。如图6b所示,cmnp
peg-pla
的粒径为56nm左右。如图7b所示,cmnp
peg-plga
的粒径为131nm左右。
118.293t-fcγri细胞膜包覆型纳米适配子(293t-fcγri@cmnp)的制备:制备方法同raw264.7@cmnp的制备。
119.实施例5、功能性细胞膜包覆型纳米适配子的大小形貌表征
120.上述制备得到的raw264.7@cmnp,如图8所示,在透射电子显微镜(transmission electron microscopy,tem)下观察,raw264.7@cmnp为球体形貌,最外层被细胞膜包覆,电镜结果与dls结果基本一致。raw264.7@cmnp与np
plga
相比粒径从约114nm增加到约138nm。
121.利用did(细胞膜荧光探针)标记plga纳米颗粒,dii(细胞膜荧光探针)标记功能性细胞膜(264.7细胞膜(raw264.7@cm)),以膜表达gfp的细胞作为支架,以上述条件制备cmnp(raw264.7@cmnp)。如图9所示,在激光共聚焦下观察,荧光标记功能性细胞膜(cell membrane-dii)与荧光标记内核plga颗粒(plga core-did)共定位,说明功能性细胞膜成功包覆在内核plga颗粒上,形成细胞膜包覆型纳米适配子。
122.实施例6、功能性细胞膜包覆型纳米适配子的功能性蛋白表征
123.将合成的np
plga
、raw264.7细胞膜(raw264.7@cm)、raw264.7细胞膜包覆型纳米适配子(raw264.7@cmnp)、293t-fcγri细胞膜(293t-fcγri@cm)以及293t-fcγri细胞膜包覆型纳米适配子(293t-fcγri@cmnp)加入200μl ripa(含有pmsf)裂解液,置于冰上裂解10分钟、12000rpm离心,取上清。利用bca蛋白定量试剂盒进行蛋白定量,将蛋白调整到一致浓度,加入5
×
sds-page上样缓冲液,震荡混匀,置于金属浴中100℃加热5min使的蛋白变性,冷却后进行蛋白电泳:配置5%的聚丙烯酰胺浓缩胶以及10%sds聚丙烯酰胺分离胶,胶体凝固后置于电泳槽中,每孔加入30μg的蛋白样品。先用70v的电泳跑胶,待样品刚刚跑过浓缩胶时,将电压调至90v继续跑胶,当样品跑到最下面的时候,剥离出分离胶,利用考马斯亮蓝分离胶进行染色,染色后,将分离胶置于培养皿中,加入考马斯亮蓝脱色液进行脱色,然后拍照。
124.如图10a中sds-page结果显示,合成的raw264.7@cmnp以及293t-fcγri@cmnp上具有raw264.7细胞膜表面蛋白以及293t-fcγri细胞表面蛋白存在,证明cmnp具有功能性蛋白存在。
125.进一步,通过蛋白质印迹法(western blot)检测可以结合治疗性抗体的fcγri表达。在转膜后,以羊抗鼠的cd64(fcγri)作为一抗,以大鼠抗羊的hrp作为二抗,最后进行显影。如图10b中western blot结果显示,合成的raw264.7@cmnp以及293t-fcγri@cmnp样品组具有cd64蛋白条带,说明raw264.7@cmnp以及293t-fcγri@cmnp上具有功能性蛋白fcγri的存在,证明cmnp保留了fcγri蛋白功能。
126.实施例7、功能性细胞膜包覆型纳米适配子的稳定性表征
127.上述制备得到的raw264.7@cmnp,超纯水稀释至0.5mg/ml,分别将其加入或不加
pbs,密闭;37℃恒温摇床中孵育,如图11所示,分别在0h,1h,3h,6h,12h,24h,48h取出,经动态光散射仪(dynamic light scattering,dls)检测粒径,结果表明,在观察时间内,raw264.7@cmnp粒径没有显著的改变,且粒径分布没有巨大波动,说明本发明的细胞膜包覆型纳米适配子可以在48小时保持水化半径的稳定。
128.实施例8、cmnp与治疗性抗体结合表征
129.上述制备得到的raw264.7@cmnp,用超纯水稀释至2mg/ml、1mg/ml、0.5mg/ml等梯度浓度,并在2mg/ml、1mg/ml、0.5mg/ml等梯度浓度raw264.7@cmnp中加入大鼠来源igg抗体(治疗性的pd-1抗体,αpd-1)至5ug/ml,充分混匀后,4℃反应过夜。反应结束,利用动态光散射仪(dynamic light scattering,dls)检测粒径。如图12所示,raw264.7@cmnp-igg的粒径为167nm左右。raw264.7@cmnp-igg与cmnp相比粒径从约138nm增加到约167nm。
130.上述制备得到的raw264.7@cmnp和293t-fcγri@cmnp,用超纯水稀释至0.5mg/ml,并且对半梯度稀释,并在不同浓度cmnp中加入大鼠来源igg抗体至5ug/ml,充分混匀后,4℃反应过夜。反应结束后于4℃20000g
×
2h离心,取上清;通过酶联免疫吸附实验(enzyme-linked immunosorbent assay,elisa)检测上清中大鼠来源igg抗体的量,通过投料的总量减去离心后上清中残留的游离抗体,计算结合在颗粒上的抗体比例,如图13所示,cmnp上细胞膜cm与抗体igg比例为100/1~200/1时,结合效率达到100%,表明本发明的cmnp与治疗性抗体的结合效率高。
131.实施例9、激光共聚焦观察cmnp(αpd-1/αpd-l1)促进肿瘤细胞和t细胞相互作用观察图
132.我们选取了小鼠黑色素瘤细胞系(b16-f10)用于探究结合有治疗抗体的cmnp对细胞的相互作用的影响。对t细胞标记cfse后,与b16-f10细胞(表达mcherry荧光蛋白)共同培养,分别设置igg control、mix free(αpd-1&αpd-l1,[αpd-1]、[αpd-l1]各10μg/ml)、cmnp(1mg/ml)、cmnp
αpd-1&αpd-l1
([igg]=20μg/ml,[αpd-1]、[αpd-l1]各10μg/ml,对应cmnp=1mg/ml),四个实验组。分别加入对应颗粒(参考实施例8)或抗体组分,培养4h后,洗去未结合颗粒及未与肿瘤细胞作用的t细胞,如图14所示,cmnp
αpd-1&αpd-l1
相比其他组,更多的t细胞(绿色)与肿瘤细胞(红色)存在共定位现象,说明该颗粒能够促进两种细胞的相互作用。
[0133]
实施例10、hoechst 33342释放法检测cmnp(αpd-1/αpd-l1)促进t细胞杀伤肿瘤细胞
[0134]
我们构建了表达ova抗原的小鼠黑色素瘤细胞系(b16-f10-ova)用于探究结合有治疗抗体的cmnp促进t细胞杀伤肿瘤细胞的效果。利用cd3特异性活化从otⅰ小鼠脾脏中分离的t细胞,b16-f10-ova肿瘤细胞用hoechst 33342染色,将t细胞和b16-f10-ova(hoechst 33342)按照1:10的比例混合,设置pbs,mix free(αpd-1&αpd-l1,[apd-1]、[apd-l1]各25μg/ml),separate nps(cmnp
αpd-1
&cmnp
αpd-l1
,[apd-1]、[apd-l1]各25μg/ml,对应cmnp=2.5mg/ml),cmnp
αpd-1&αpd-l1
([igg]=50μg/ml,[apd-1]、[apd-l1]各25μg/ml,对应cmnp=2.5mg/ml),四个实验组,分别加入对应颗粒(参考实施例8或9制备方法)或抗体组分,孵育12h和24h,孵育结束后最大释放组加入triton x-100破坏细胞释放荧光染料,自然释放组只有肿瘤细胞,只有肿瘤细胞,
[0135]
如图15所示,cmnp
αpd-1&αpd-l1
在不同时间点均体现出显著的促进t细胞杀伤肿瘤细
胞的能力。
[0136]
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
[0137]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1