一种免疫药物及其在肿瘤免疫治疗中的应用
1.本发明涉及肿瘤免疫治疗药物技术领域,具体提供了一种介导t细胞靶向杀伤肿瘤细胞的新型免疫治疗药物、其制备方法及其在肿瘤免疫治疗中的应用。
背景技术:
2.癌症免疫治疗能激活患者的免疫系统,以防止癌症的免疫逃避,在长期减少癌症转移和复发方面有很大的潜力。与传统的化疗或放疗不同,肿瘤免疫治疗在肿瘤治疗中具有更高的选择性和更低的毒性,同时通过免疫记忆提供了长期的免疫。最近研究表明,t细胞可以通过结合肿瘤特异性抗原的双特异性分子来重新定向识别和消除肿瘤。其中由于双特异性t细胞接合(bispecific t
‑
cell engager,bite)抗体介导杀伤时能够绕过mhc限制选择性杀死肿瘤细胞等优势引起了人们的特别关注。bite本质为一个多肽链,包含两个不同抗体的单链(sc)fv结构域,其中一个单链抗体结构域用来识别任何t细胞上表达的cd3e,另一个单链抗体用来结合肿瘤细胞表达的肿瘤相关抗原。尽管它们取得了显著的成功,但由于bite属于蛋白类药物,用于治疗不同肿瘤细胞的bite必须依靠现有的dna序列进行基因工程改造,该过程不仅耗时耗力且其稳定性和活性无法得到保证。同时无法快速根据病人实际情况实现定制化医疗。此外,体内是多细胞环境,肿瘤细胞与正常细胞表面分子类型相同,仅有表达量的差异,目前由于bite结构组成固定,致使其免疫治疗过程中会杀伤正常细胞,存在一定的副作用。从这个角度来看,核酸适配体(aptamer)可以解决现有bite存在的问题。适配体被称为“化学抗体”,因其体积小,易于制备,且具有良好的靶向性,因此被认为是肿瘤靶向治疗的理想选择。以此扩大癌症治疗范围,加快药物生成研发过程。另外核酸适配体还能够依靠碱基互补配对原则与其他dna在试管中快速组装成dna纳米结构。dna纳米结构因其可编程性、易修饰性和高生物相容性广泛应用于生物医学领域。且其不同结构能结合不同数目的核酸适配体,从而能提高肿瘤识别能力,减少免疫治疗副作用。
3.因此本领域迫切需要开发出一种利用核酸识别肿瘤细胞表面分子的免疫药物,用于解决现有免疫疗法研发费时费力,治疗对象有限且有副作用的问题。
技术实现要素:
4.本发明中,用核酸适配体替代目前bite中一个抗体结构域用于识别肿瘤细胞表面分子,我们研发得到的抗体
‑
核酸嵌合体作为一种新型双特异性药物能够解决现有技术中的问题。
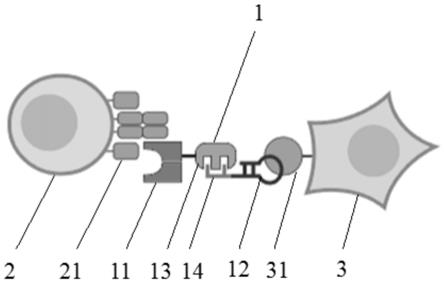
5.因此,本发明首先提供一种免疫药物,所述免疫药物为包含特异性结合蛋白(11)和核酸适配体(12)的双特异性免疫药物(1),且特异性结合蛋白(11)和核酸适配体(12)之间使用直接或间接的方式连接,所述特异性结合蛋白(11)本身为蛋白质结构,所述核酸适配体(12)本身为核酸结构,所述特异性结合蛋白(11)用于与免疫细胞受体或靶细胞受体特异性结合,相应地,所述核酸适配体(12)用于与靶细胞受体或免疫细胞受体特异性结合。
6.在一种具体的实施方式中,所述特异性结合蛋白(11)和核酸适配体(12)之间连接
有共价连接蛋白(13)和共价连接dna(14),所述共价连接蛋白(13)与特异性结合蛋白(11)连接,所述共价连接dna(14)直接或间接与核酸适配体(12)连接,且共价连接蛋白(13)和共价连接dna(14)之间共价结合。
7.在一种具体的实施方式中,所述共价连接dna(14)与核酸适配体(12)之间还连接有连接结构,所述连接结构同样由核苷酸构成。
8.在一种具体的实施方式中,所述共价连接蛋白(13)为huh家族蛋白,优选dcv蛋白。
9.在一种具体的实施方式中,所述免疫药物中含有一个核酸适配体(12)或多个相同或不同的核酸适配体(12),优选所述免疫药物中含有3~100个相同或不同的核酸适配体。
10.在一种具体的实施方式中,所述特异性结合蛋白(11)为αcd3。
11.在一种具体的实施方式中,所述核酸适配体(12)为sgc8、te02、syl3c、muc1以及c
‑
met中的一种或多种。
12.在一种具体的实施方式中,所述共价连接dna(14)的序列为aagtattaccagaaa。
13.本发明还提供一种如上所述免疫药物在肿瘤免疫治疗中的应用。
14.在一种具体的实施方式中,所述免疫药物在体内靶向抑制肿瘤细胞生长。
15.本发明还提供一种免疫药物的制备方法,所述免疫药物为包含特异性结合蛋白(11)和核酸适配体(12)的双特异性免疫药物(1),且特异性结合蛋白(11)和核酸适配体(12)之间间接连接,所述特异性结合蛋白(11)本身为蛋白质结构,所述核酸适配体(12)本身为核酸结构,所述特异性结合蛋白(11)用于与免疫细胞受体或靶细胞受体特异性结合,相应地,所述核酸适配体(12)用于与靶细胞受体或免疫细胞受体特异性结合;所述特异性结合蛋白(11)和核酸适配体(12)之间连接有共价连接蛋白(13)和共价连接dna(14),所述共价连接蛋白(13)与特异性结合蛋白(11)直接或间接连接,所述共价连接dna(14)直接或间接与核酸适配体(12)连接,且共价连接蛋白(13)和共价连接dna(14)之间共价结合;所述制备方法包括如下步骤,
16.步骤a:制备得到含有所述特异性结合蛋白(11)和共价连接蛋白(13)的融合蛋白;
17.步骤b:制备得到含有所述核酸适配体(12)和共价连接dna(14)的核酸结构;
18.步骤a和步骤b可以同时进行或者任意先后;
19.步骤c:将步骤a制备得到的融合蛋白和步骤b得到的核酸结构共同孵育,使得其中的共价连接蛋白(13)和共价连接dna(14)共价结合,得到所述免疫药物。
20.在一种具体的实施方式中,首先全基因合成所述融合蛋白的核酸序列并构建重组质粒,再通过大肠杆菌原核表达有活性的融合蛋白。
21.在一种具体的实施方式中,步骤a后,还包括纯化所得的融合蛋白。
22.在一种具体的实施方式中,步骤b中,所述核酸结构还包括用于连接核酸适配体(12)和共价连接dna(14)的连接结构,所述连接结构同样由核苷酸构成。
23.在一种具体的实施方式中,所述核酸结构包括单链适配体、y型dna纳米粒子和树枝状dna纳米粒子中的任意一种,其中所述单链适配体中包含1个核酸适配体(12),所述y型dna纳米粒子中包含2个核酸适配体(12),所述树枝状dna纳米粒子中包含3~100个核酸适配体(12),所述y型dna纳米粒子和所述树枝状dna纳米粒子中包含的核酸适配体(12)均相同或不同。
24.在一种具体的实施方式中,通过无酶自组装过程制备y型dna纳米粒子,通过聚合
链式反应体外合成所述树枝状dna纳米粒子。
25.在一种具体的实施方式中,所述孵育方法为将步骤a制备得到的融合蛋白和步骤b得到的核酸结构混合后在36~38℃的条件下孵育10分钟以上得到免疫药物,优选再将得到的免疫药物在2~8℃的条件下保存备用。
26.在一种具体的实施方式中,所述共价连接蛋白(13)为huh家族蛋白,优选dcv蛋白,所述共价连接dna(14)的序列为aagtattaccagaaa。
27.在一种具体的实施方式中,所述特异性结合蛋白(11)为αcd3。
28.在一种具体的实施方式中,所述核酸适配体(12)为sgc8、te02、syl3c、muc1以及c
‑
met中的一种或多种。
29.本发明至少具有如下所述的有益效果:
30.1)本发明利用抗体单链
‑
dcv融合蛋白与核酸适配体共价结合制备得到双特异性抗体
‑
核酸嵌合体,拓宽了免疫治疗药物的类型,由目前的双特异性抗体演化为dna参与的嵌合形式。
31.2)本发明利用抗体
‑
核酸嵌合体介导t细胞杀伤肿瘤细胞,该嵌合体的生成过程克服了传统双特异性抗体必须经过基因工程的缺点,缩短了免疫药物的合成制备时间,降低了生产成本。
32.3)本发明以核酸适配体作为靶细胞识别元件,依靠核酸适配体靶标多且能程序化组装为纳米结构的优势,该嵌合体肿瘤识别类型多样,提升了与肿瘤细胞结合的亲和力和特异性,扩大了不同肿瘤特异性识别的范围。
33.4)本发明基于碱基互补配对原则快速组装成特定结构和特定价态的dna纳米结构。不同的dna纳米结构与抗体单链形成的嵌合体能够实现不同的治疗效果。有成为定制化免疫试剂的可能。
附图说明
34.图1为本发明所述免疫药物与t细胞(即免疫细胞)和靶细胞(即肿瘤细胞)的结合示意图。
35.图2为细胞水平检测抗体
‑
sgc8适配体嵌合体对肿瘤杀伤的效果。
36.图3~图4均为验证抗体
‑
核酸嵌合体在免疫治疗领域应用的普适性。
37.图5~图8为抗体
‑
核酸嵌合体体内靶向杀伤肿瘤细胞示意图。其中,图5和图6为连续测量肿瘤大小统计结果,图7和图8为连续测量小鼠体重统计结果。
38.图1中:免疫药物1、特异性结合蛋白11、核酸适配体12、共价连接蛋白13、共价连接dna14、t细胞2、t细胞受体21、靶细胞3、靶细胞受体31。
39.通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
具体实施方式
40.为了便于理解本发明,下面将对本发明进行更全面的描述,并给出了本发明的较佳实施例。但是,本发明可以以许多不同组合方式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
41.本发明为肿瘤免疫治疗提供了一种新型免疫药物,该药物包括两个模块:蛋白模块和核酸模块,两个模块可以共价连接形成嵌合体,该嵌合体能够介导t细胞与靶细胞特异性识别,在体内外靶向抑制肿瘤细胞生长。所述抗体
‑
核酸嵌合体具有如图1所述结构。
42.本发明另一个目的是提供一种上述抗体
‑
核酸嵌合体的制备方法,包括以下步骤:抗体以dcv
‑
αcd3融合蛋白为例说明;
43.一)抗体的制备;
44.1)全基因合成含有抗体序列的重组质粒,如pet28a
‑
dcv
‑
αcd3。
45.2)原核表达有活性的dcv
‑
αcd3融合蛋白(即由特异性结合蛋白11和共价连接蛋白13连接形成的融合蛋白)。
46.优选地,所述dcv
‑
αcd3融合蛋白表达纯化方法如下:pet28a
‑
dcv
‑
αcd3重组质粒热激转化大肠杆菌bl21(de3)感受态,1mm iptg诱导其表达目的蛋白,收集菌液,超声破碎后,ni柱纯化6*his
‑
dcv
‑
αcd3融合蛋白。
47.二)核酸的制备;
48.核酸包括三种形式:单链适配体,y型dna纳米粒子和树枝状dna纳米粒子。
49.可选地,本发明所述单链适配体以sgc8适配体为例说明,其序列如下:
50.aagtattaccagaaaaaaaaaaaaaaaatctaactgctgcgccgccgggaaaatactgtacggttaga。其中所述aagtattaccagaaaaaaaaaaaaaaa为本发明中的共价连接dna(14)。
51.所述y型dna纳米粒子其连接的核酸适配体(aptamer)数目为2,dna纳米粒子可以相同或不同。本发明举例所述y型dna纳米粒子是用三条核酸链组装而成,其序列如下:
52.y1
‑
dcv:aagtattaccagaaa tttttgac cga tgg atg act tac gac gca caa gga gat cat gag;
53.y2
‑
sgc8:atctaactgctgcgccgccgggaaaatactgtacggttagatttttgaccga tgg atg acc tgt ctg cct aat gtg cgt cgt aag;
54.y3
‑
sgc8:atctaactgctgcgccgccgggaaaatactgtacggttagatttttgaccga tgg atg act cat gat ctc ctt tag gca gac agg。
55.其中所述aagtattaccagaaa为本发明中的共价连接dna(14)。
56.所述树枝型dna纳米粒子中连接的核酸适配体数目n小于100,具体数目n可以为任意整数,dna纳米粒子可以相同或不同。本发明举例所述用于组装树枝型dna纳米粒子结构是用五条核酸链组装而成,其序列如下:
57.h1:ttaacccacgccgaatcctagactcaaagtagtctaggattcggcgtgaaa aagtgagcacggacg;
58.h2:gacgtgcaggctgtttaaagtctaggattcggcgtgggttaacacgccga atcctagactactttg;
59.sgc8c
‑
sh2:cagcctgcacgtcatctaactgctgcgccgccgggaaaatactgtacggttaga;
60.dna1(c1)nc:cgtccgtgctcac;
61.dcv initiator(i):aagtattaccagaaaagtctaggattcggcgtgggttaa。
62.其中,上述序列aagtattaccagaaa为dcv蛋白靶向dna序列,即本发明中的共价连接dna(14),用于抗体与核酸结构共价连接,该序列即本发明中的共价连接dna(14)。
63.三)制备抗体
‑
核酸适配体嵌合体;
64.将步骤一)抗体与步骤二)核酸共同孵育,获得所述的抗体
‑
核酸嵌合体。
65.本发明还提供所述抗体
‑
核酸嵌合体在肿瘤免疫治疗中的应用。
66.在本发明其中一个实施例中体外检测双特异性抗体
‑
核酸嵌合体sgc8
‑
dcv
‑
αcd3介导t细胞杀伤肿瘤细胞的效果,细胞水平利用cck8方法检测其对ccrf
‑
cem人类急性淋巴细胞白血病细胞的靶向杀伤效果。结果:制备的sgc8
‑
dcv
‑
αcd3嵌合体具备介导t细胞杀伤肿瘤细胞能力,且随着sgc8
‑
dcv
‑
αcd3嵌合体药物浓度增加,杀伤效果逐步增强。
67.在本发明的一个实施例中,将上述实施例中sgc8更换为其他任意的核酸适配体(本实施案例使用te02,syl3c,muc1以及c
‑
met)制备的抗体
‑
核酸嵌合体,细胞水平利用cck8方法检测嵌合体介导t细胞对不同类型肿瘤细胞的杀伤效果。结果表明:连接不同核酸适配体的嵌合体均能介导t细胞杀伤肿瘤细胞,说明本发明在免疫治疗领域具有通用性。
68.在本发明的一个实施例中研究了抗体
‑
核酸适配体纳米结构嵌合体体外介导t细胞杀伤肿瘤细胞的效果。以抗体
‑
适配体纳米结构嵌合体为药物,细胞水平利用cck8方法检测其对mcf
‑
7人类的乳腺癌靶向杀伤效果。结果表明制备的抗体
‑
树枝型适配体纳米结构嵌合体介导t细胞杀伤肿瘤细胞效果最好,其次是抗体
‑
y型适配体纳米结构。抗体
‑
y型适配体纳米结构代表二价dna纳米粒子。除了本实施例中的y型结构,也可以是其他的连接确定数目核酸适配体的纳米结构。另外树枝型dna纳米结构代表通过聚合链式反应体外合成的dna纳米结构。
69.在本发明一个具体实施例中,利用裸鼠模型,进行体内抗体
‑
核酸嵌合体对裸鼠皮下荷瘤cem的靶向实验,以sgc8适配体为例,探究了不同结构的抗体
‑
核酸嵌合体肿瘤免疫治疗的效果。采用持续测量肿瘤大小和测量小鼠体重反映免疫治疗效果。结果表明注射抗体
‑
核酸嵌合体的实验组肿瘤显著小于对照组。在实验组中,注射抗体
‑
树枝型适配体纳米结构嵌合体能显著抑制肿瘤生长,其次是抗体
‑
y型适配体纳米结构嵌合体。通过构建不同结构的dna纳米粒子能够提升免疫治疗效果,也为肿瘤治疗提供了新思路。
70.总而言之,本发明提供的抗体
‑
核酸嵌合体是一种新型免疫治疗药物,首次应用于t细胞介导的免疫治疗。该药物包括抗体模块和核酸模块,抗体模块可以是任意能识别免疫细胞表面分子的抗体单链,核酸模块也可为任意一种能够识别肿瘤细胞表面分子的适配体。此外,本发明以抗体能与核酸形成嵌合体为基础,构建不同结构dna纳米粒子,将功能化dna纳米粒子应用于免疫治疗领域。dna纳米粒子包括连接有具体数目适配体的纳米结构(如y型结构的适配体数目n=2等)和通过聚合链式杂交(hcr)形成的多个适配体的纳米结构(如树枝状结构的适配体数目n<100),其中多价的dna纳米粒子,可以为相同的dna序列,也可以为不同的dna序列。
71.本发明中的双特异性免疫药物是指该免疫药物对t细胞(免疫细胞)和靶细胞(肿瘤细胞)都具有特异性。现有技术用于连接t细胞和靶细胞的双特异性免疫药物要么两个模块都是蛋白质,要么两个模块都是核酸,而本发明首先提出一种含一个蛋白质模块和一个核酸模块的双特异性免疫药物。
72.关于本发明所述免疫药物的制备方法:在2018年有文献报导共价连接蛋白13与共价连接dna14的共价结合,本发明按照文献所示制备出一种共价连接蛋白13,随后制备出特异性结合蛋白11与共价连接蛋白13的结合物,并将与共价连接蛋白13匹配的共价连接dna14与核酸适配体12先连接形成核酸结构(该核酸结构可以委托核酸厂家定制),然后利
用共价连接蛋白13和共价连接dna14的共价连接而得到整个包含特异性结合蛋白11、核酸适配体12、共价连接蛋白13和共价连接dna14的免疫药物,所述免疫药物的结构从一端至另一端依次包括特异性结合蛋白11、共价连接蛋白13、共价连接dna14和核酸适配体12。本发明中,共价连接蛋白13具体可以是huh蛋白,更具体可以是dcv蛋白,当然还可以是除huh以外的别的很多家族的蛋白,都能实现蛋白与dna的共价连接。
73.本发明中的特异性结合蛋白11可以与t细胞的受体结合,此时核酸适配体12与靶细胞的受体结合,也可以反过来,即核酸适配体12与t细胞的受体结合,而特异性结合蛋白11与靶细胞的受体结合。
74.本发明中的核酸适配体12不可或缺,核酸适配体的本质为核酸,普通的dna同样为核酸,但普通的dna因没有核酸适配体具有的特异性识别受体的能力,因而其不能用于本发明中。
75.此外,因普通的蛋白质与普通的核酸链之间较难直接连接,因而本发明中具体采用共价连接蛋白13和共价连接dna14使得特异性结合蛋白11和核酸适配体12连接,文献报导的共价连接蛋白13为huh家族的dcv蛋白,其属于鸭环病毒的蛋白成员,相较于其他类似蛋白,如:pcv(猪病毒),dcv与dna连接效率最高,因此,本发明中首先按文献所示表达出相应的dcv蛋白。
76.实施例1
77.本实施例为dna纳米粒子的制备。
78.一,单链适配体。
79.在已公布的适配体序列5’端添加dcv蛋白识别序列,命名为dcv
‑
aptamer。送至上海的核酸合成机构合成单链适配体。
80.二,制备y型dna纳米粒子。
81.1,订购三条核苷酸链:ya
‑
sgc8,yb
‑
dcv以及yc
‑
sgc8。
82.2,合成y型dna纳米粒子:通过无酶自组装过程制备y形dna大分子。首先制备y形连接支架(y
‑
dna)作为构建块。在实验中,上述三个寡核苷酸链含有适配体和dcv蛋白目标序列(ya
‑
sgc8,yb
‑
dcv,yc
‑
sgc8序列),以上序列用pbs
‑
mgcl2溶液(10mm,ph值7.4,包含150mmnacl和2mm mgcl2)溶解,其浓度为10mm。将dna混合溶液在沸水中加热5min,然后慢慢冷却至室温,4℃冰箱备用。
83.三,制备树枝状dna纳米粒子。
84.1,订购构建结构所需的五条核苷酸链,即如上文所述的h1、h2、sgc8c
‑
sh2、dna1(c1)nc和dcv initiator(i)。
85.2,将以上五条链用pbs
‑
mgcl2溶液溶解和稀释至其最终浓度为10mm,首先将h1,h2,sgc8c
‑
sh2以及dna1(c1)nc等量混合并稀释至终浓度为20μm,将dna混合溶液在沸水中加热5min,然后慢慢冷却至室温。待其冷却后向dna混合液中加入4μm的dcv initiator(i),放入37℃过夜反应。将组装好的dna纳米粒子置于4℃冰箱备用。
86.实施例2
87.本实施例为抗体
‑
核酸嵌合体的制备。
88.将dcv
‑
αcd3融合蛋白加入dcv
‑
sgc8核酸适配体等量混合,37℃培养15min。然后4℃保存,备用。
89.实施例3
90.本实施例为抗体
‑
核酸嵌合体体外、体内对肿瘤靶向杀伤应用检测。以dcv
‑
sgc8(人类急性淋巴细胞白血病的核酸适配体)制备“核酸适配体
‑
dcv
‑
αcd3嵌合体”为例。
91.一,细胞水平cck8法检测“核酸适配体
‑
dcv
‑
αcd3嵌合体”介导t细胞靶向杀伤作用。
92.1,提前饲养状态良好的ccrf
‑
cem细胞(5%fbs+1640)和pbmc细胞(5%fbs+1640+il2);
93.2,取上述cem细胞(2*104个细胞)与pbmc细胞(人外周血单核细胞)(1*105个细胞)和不同浓度的sgc8
‑
dcv
‑
αcd3在37℃孵化24小时。
94.3,利用cck
‑
8试剂盒(货号:c0039,碧云天)检测sgc8
‑
dcv
‑
αcd3介导t细胞靶向裂解cem细胞时细胞数目的减少量,以此来判断其杀伤效果。96孔板中每孔铺入ccrf
‑
cem人类急性淋巴细胞白血病。设置对照组包括仅t细胞和cem细胞(人类急性淋巴细胞白血病细胞)以及阴性细胞ramos。同时评估肿瘤细胞和效应细胞数目比率的影响,cem细胞(2*104个细胞)与不同数量的pbmc细胞(0,1*105,2*105)和100nm sgc8
‑
dcv
‑
αcd3嵌合体在37℃中孵化24小时。
95.4,24h后,每孔加入20ul cck
‑
8溶液。37℃孵育2小时后,用bio
‑
tek、synergymx测定570nm处的吸光度。细胞毒性计算方法为细胞杀伤率(%)=100(实验值
‑
实验低对照)/(高对照
‑
低对照)。
96.结果:通过以上方法制备的新型免疫药物(以sgc8
‑
dcv
‑
αcd3为例说明)具备介导t细胞杀伤肿瘤细胞的能力,且随着sgc8
‑
dcv
‑
αcd3浓度增加,杀伤效果逐步增强。如图2所示。图2中cem为人类急性淋巴细胞白血病细胞,ramos为阴性细胞。
97.图3和图4均为验证抗体
‑
核酸嵌合体在免疫治疗领域应用的普适性。其中,nc、sgc8、te02以及syl3c、muc1和c
‑
met都属于核酸适配体,而图4中的mcf
‑
7为人类乳腺癌细胞,hela为宫颈癌细胞,hepg2细胞为一种肝癌细胞,lo2为人正常肝细胞,sh
‑
sy5y为人神经母细胞瘤细胞。
98.二,活体水平检测sgc8
‑
dcv
‑
αcd3嵌合体对ccrf
‑
cem人类急性淋巴细胞白血病的靶向杀伤作用。
99.1,在第0天4
‑
6周龄雌性裸鼠皮下荷瘤ccrf
‑
cem,1*106个/只;
100.2,第7天时,将荷瘤裸鼠随机分为两组,甲组为pbs对照组,乙组为注射t细胞组,乙组再分为5组:空白对照组,dcv
‑
αcd3抗体对照组,sgc8
‑
dcv
‑
αcd3实验组,二价sgc8
‑
dcv
‑
αcd3实验组和多价sgc8
‑
dcv
‑
αcd3实验组。
101.3,实验全程,使用游标卡尺每2天测量一次肿瘤大小,并记录;
102.4,实验全程,记录荷瘤裸鼠体重;
103.5,直至32天结束实验。
104.实验结果如图5~8所示。其中,图5和图6为连续测量肿瘤大小统计结果,结果表明注射sgc8
‑
dcv
‑
αcd3实验组肿瘤显著小于仅注射蛋白实验组。同时表明多价sgc8
‑
dcv
‑
αcd3(树枝dna纳米结构)实验组肿瘤显著小于二价sgc8
‑
dcv
‑
αcd3(y型dna纳米结构)实验组和sgc8
‑
dcv
‑
αcd3(线性单链)实验组。价态的提升能够提高免疫治疗效果。图7和图8为连续测量荷瘤裸鼠体重统计结果,结果表明注射药物不影响荷瘤裸鼠生命活动。
105.综上所述,本发明构建的抗体
‑
核酸嵌合体作为药物能够介导t细胞靶向杀伤肿瘤。且通过体外搭建dna纳米结构能定制化调整免疫治疗效果。
106.以上内容是结合具体的优选实施方式对本发明作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演和替换,都应当视为属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1