一种眼表原位药物及其制备方法
1.本发明涉及药物制剂领域,特别是涉及一种眼表原位药物及其制备方法。
背景技术:
2.细菌性角膜炎(bacterial keratitis)和真菌性角膜炎(fungal keratitis)是眼科门诊常见的疾病之一,二者是由于细菌或真菌感染所致的角膜感染性疾病,属于眼科急症,且有危及患者视力的风险。而随着人们生活方式和生活环境的改变以及隐形眼镜的广泛使用,此类角膜感染的发病率呈现出了逐年上升的趋势。目前,在全世界范围内,发展中国家角膜感染及溃疡的发生率要高于发达国家,且细菌性和真菌性角膜感染已经成为了角膜性失明的最常见原因。
3.人眼具有十分复杂的多级保护结构,来避免其受到外界环境的刺激和伤害,它包括了结膜屏障、泪膜屏障、角膜屏障、血
‑
房水屏障和血
‑
视网膜屏障。但是这种保护性机制也同样限制了眼药水内的药物分子穿过眼部屏障到达治疗点。同时,由于鼻泪引流系统的存在,其泪液排出速率大约是角膜吸收泪液速率的500
‑
700倍,这使得作用在角膜前端的眼药水非常容易从眼球前端流失,最终的药物利用率只有不到5%。除此之外,泪膜最外部的油脂层不仅有防止泪液过量蒸发的作用,也会进一步阻止角膜和巩膜对药物分子的吸收。
4.目前,市面上和临床上通用的眼用制剂通常为药物溶液或膏剂,在治疗时由于对眼表的药物利用度低,因此需要频繁多次给药,不仅给患者带来很大的不便,而且还有可能因为短时间内在眼表和体内过高的药物浓度而产生毒副作用。且膏剂由于会模糊患者视力,因此只能在夜间使用。因此,找到一种能够持久有效的眼部药物缓释方法,对于角膜感染的治疗具有很大的意义。对于眼部药物缓释,目前有缓释型眼药水、角膜接触镜、眼内植入物、眼用凝胶等研究工作。研究表明,缓释型眼药水对眼表药物缓释的提升不是很大,很大一部分原因是分散在其中的载药微球可能会使药物提前释放;而药物缓释型角膜接触镜由于制备工艺的影响,往往会使得接触镜的关键参数(如透氧量、含水量、模量等)发生改变而不适合佩戴,此外,由于佩戴角膜接触镜导致的复发性感染或新感染往往会使得治疗性接触镜的使用复杂化。目前在研究的眼用原位凝胶通常包括ph触发型和温度触发型,温度触发型凝胶一般而言具有更小的眼部刺激性,其在室温状态下为低粘度的溶胶,达到临界温度后会迅速转变为凝胶状态,与眼表具有高亲和力,能大大延长药物作用时间,提高药物利用度。
5.pluronic f127(又称泊洛沙姆407,f127)是一种三嵌段共聚物,已经被美国食品和药品管理局批准可作为眼药水的添加物,具有较高的生物相容性。在生理条件下,当f127的浓度高于临界成胶浓度时,就可以快速发生凝胶化,形成原位凝胶。但是,这种凝胶也具有一些固有的缺陷,包括:(1)由于其分子量较低,单纯的f127凝胶机械强度差,在生理条件下不能留存较长时间;(2)由于成胶浓度较高,在成胶浓度以上的f127形成的凝胶粘度太高,无法均匀涂覆在眼表,从而影响使用者的视力;(3)f127在浓度过高时存在一定的细胞毒性,可能会对机体产生毒副作用,这也限制了f127在眼用药物中的应用。
6.透明质酸(ha)是细胞外基质的重要组成部分,是自然界中功能最丰富的天然高分子聚合物之一,由于其具有很高的生物活性和生物相容性,已被广泛用作组织工程学中具有生物相容性和可生物降解性的材料。但是,单纯的ha无法形成水凝胶。ha可以很容易地通过化学修饰方法将其分子链上的羟基和羧基进行官能化锈蚀,得到不同的透明质酸衍生物,以制备可用于组织工程、生物3d打印,或药物缓释的水凝胶系统。
7.需要说明的是,在上述背景技术部分公开的信息仅用于对本申请的背景的理解,因此可以包括不构成对本领域普通技术人员已知的现有技术的信息。
技术实现要素:
8.本发明的主要目的在于克服上述背景技术存在的缺陷,提供一种眼表原位药物及其制备方法。
9.为实现上述目的,本发明采用以下技术方案:
10.一种眼表原位药物,包括以pluronic f127,pluronic f68和甲基丙烯酸
‑
透明质酸(ha
‑
ma)为主要成分的具有温度响应特性的水凝胶体系,内含活性药物或包裹活性药物的纳米载药微球,实现在眼表温度下形成原位凝胶并延长药物释放时间。
11.进一步地:
12.所述水凝胶体系按照重量百分比计包括15
‑
20%pluronic f127(又称泊洛沙姆407,f127),0
‑
5%pluronic f68(又称泊洛沙姆188,f68),1
‑
3%甲基丙烯酸
‑
透明质酸(ha
‑
ma),0.05
‑
0.2%光引发剂irgacure 2959。
13.所述水凝胶体系中按如下成分配比:1ml水凝胶基体:3
‑
50mg活性药物;或者1ml水凝胶基体:10
‑
150mg的包裹活性药物的纳米载药微球。
14.所述活性药物包括抗生素、抗真菌药物和眼用消炎药物中的一种或几种;所述抗生素药物包括:头孢菌素类、糖肽类、氨基糖苷类、大环内酯类、氟喹诺酮类、磺胺类和盐酸三甲胺中的一种或多种;所述抗真菌药物包括:多烯类,唑类,棘白菌素类中的一种或多种;所述眼用消炎药物包括:双氯芬酸钠、地塞米松磷酸钠、氢化可的松、泼尼松龙磷酸钠、倍他米松、曲安奈德、氟米龙、倍他米松磷酸钠、甲基强的松龙、甲基泼尼松龙中的一种或多种。
15.所述纳米载药微球的基质材料为壳聚糖。
16.一种所述眼表原位药物的制备方法,包括如下步骤:
17.(1)将pluronic f127、pluronic f68和ha
‑
ma分别溶解于等渗的溶剂中,将光引发剂irgacure 2959溶解于去离子水中;
18.(2)将步骤(1)中的溶液按比例混合,并添加活性药物或包裹活性药物的纳米载药微球,在紫外光下交联,得到温度敏感的水凝胶体系。
19.所述溶剂为无菌pbs磷酸盐缓冲液或灭菌生理盐水。
20.还包括在步骤(1)之前制备所述ha
‑
ma,具体包括:室温下将3当量甲基丙烯酸酐(ma)滴加到1wt%透明质酸钠(ha)水溶液中,反应前期3
‑
4小时内用naoh调节ph至7.5
‑
8.5。溶液在室温下反应过夜后,再调节ph至中性;后续进行透析和冻干,收集产物;所述ha
‑
ma的修饰度为25%
‑
30%。
21.所述载药微球的基质材料为壳聚糖;制备方法为乳化法加离子交联法,交联剂为三聚磷酸钠(tpp);对于水溶性药物,所述载药微球的制备方法为单纯的离子交联法;对于
脂溶性药物,所述载药微球的制备方法为乳化法加离子交联法、
22.所述纳米载药微球的制备方法包括如下步骤:
23.(1)将壳聚糖在50℃下溶解于1%醋酸溶液中,浓度为0.1
‑
0.5%;
24.(2)将充分溶解后的壳聚糖
‑
醋酸溶液冷却至室温,加入活性药物,室温下搅拌至完全溶解,naoh调节ph值至5
‑
6;
25.(3)室温快速搅拌下加入tpp水溶液,交联反应2
‑
3小时,之后离心、洗涤、冻干,得到纳米载药微球。
26.或者,所述纳米载药微球的制备方法包括如下步骤:
27.(1)将壳聚糖和表面活性剂在50℃下溶解于1%醋酸溶液中,壳聚糖浓度为0.1
‑
1%;
28.(2)将活性药物溶于有机溶剂中,完全溶解后将上述溶液加入壳聚糖溶液中,于50℃条件下进行乳化反应,并用naoh调节ph值至5
‑
6,反应1.5
‑
2小时;
29.(3)快速搅拌下加入加入tpp水溶液,交联反应2
‑
3小时。
30.本发明具有如下有益效果:
31.本发明针对传统的pluronic f127温敏凝胶所存在的缺陷,通过结合高生物相容性和低细胞毒性的透明质酸衍生物ha
‑
ma,提出了一种全新的温度触发的眼用水凝胶缓释体系配方,以实现对眼表的药物缓释,达到对细菌性/真菌性角膜炎、结膜炎的治疗,同时降低材料的毒性,能够在治疗的同时促进角膜细胞的修复。
32.与现有技术相比,本发明具有以下优点:
33.(1)通过加入光交联的ha
‑
ma体系,可以极大地改善f127水凝胶的生物相容性。ha作为人体细胞外基质的组成成分之一,也普遍存在于人眼的角膜和玻璃体等组织内,ha
‑
ma的加入在赋予水凝胶体系高分子骨架之外,也大大提高了细胞存活率,改善了单纯f127凝胶生物相容性差的缺陷。体外细胞毒性试验表明其在24h内对人角膜细胞的生物相容性可达到94%以上,在7天内角膜细胞存活率达到85%以上。
34.(2)延长药物释放时间,促进角膜、结膜等眼表组织修复。ha
‑
ma体系的孔隙结构能够一定程度上阻止因为f127溶解和扩散作用引起的药物释放,体外药物释放实验表明,所述的水凝胶体系的有效药物释放时间可达到12h以上。同时,交联后的ha
‑
ma由于具有多孔的微观结构,也为角膜细胞的增殖和迁移提供了平台,从而促进眼表组织的修复。
35.(3)ha
‑
ma的加入能够改变f127水凝胶体系的粘度和机械强度。单纯的f127凝胶,其成胶机理为胶束聚合引起的相变,属于物理变化,且由于f127分子量较小,因此单纯的f127凝胶具有易碎、机械强度差、成胶后粘度过高等缺陷,无法在眼表均匀铺展。而ha
‑
ma的微米级高分子骨架能够与f127的胶体凝胶形成二元的骨架
‑
填充复合结构,改善水凝胶的机械性能和粘度特性,提高水凝胶的延展性,使其能够均匀覆盖在眼表。
附图说明
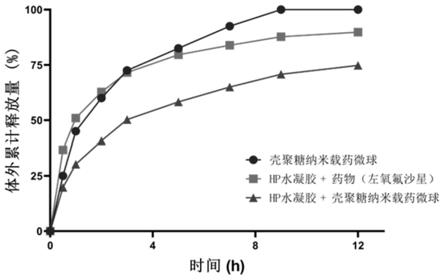
36.图1为本发明实施例对模型药物左氧氟沙星的体外累计释放曲线。
37.图2为本发明实施例对模型药物左氧氟沙星的体外释放速率曲线。
38.图3为本发明实施例制备的ha
‑
ma的红外光谱图。
39.图4为本发明实施例左氧氟沙星
‑
壳聚糖纳米载药微球的粒径分布曲线。
40.图5为本发明实施例药物缓释水凝胶对人角膜上皮细胞的细胞毒性实验结果(cck8法)。
具体实施方式
41.以下对本发明的实施方式作详细说明。应该强调的是,下述说明仅仅是示例性的,而不是为了限制本发明的范围及其应用。
42.参阅图1,在一种实施例中,一种眼表原位药物,包括以pluronic f127,pluronic f68和甲基丙烯酸
‑
透明质酸(ha
‑
ma)为主要成分的具有温度响应特性的水凝胶体系,内含活性药物或包裹活性药物的纳米载药微球,实现在眼表温度下形成原位凝胶并延长药物释放时间。
43.在优选的实施例中,所述水凝胶体系按照重量百分比计包括15
‑
20%pluronic f127(又称泊洛沙姆407,f127),0
‑
5%pluronic f68(又称泊洛沙姆188,f68),1
‑
3%甲基丙烯酸
‑
透明质酸(ha
‑
ma),0.05
‑
0.2%光引发剂irgacure 2959。f127和f68为水凝胶基体提供温敏特性,光交联后的ha
‑
ma改善水凝胶基体的机械强度、粘度特性和生物相容性。
44.在优选的实施例中,所述水凝胶体系中按如下成分配比:1ml水凝胶基体:3
‑
50mg活性药物;或者1ml水凝胶基体:10
‑
150mg的包裹活性药物的纳米载药微球。
45.所述活性药物可以包括抗生素、抗真菌药物和眼用消炎药物中的一种或几种;所述抗生素药物包括:头孢菌素类(包括头孢他啶、头孢唑啉、头孢曲松等),糖肽类(包括万古霉素),氨基糖苷类(包括妥布霉素、庆大霉素、丁胺卡那霉素、奈替米星等),大环内酯类(包括红霉素、阿奇霉素、克拉霉素和罗红霉素等),氟喹诺酮类(包括环丙沙星、氧氟沙星、左氧氟沙星、加替沙星、莫西沙星、贝西沙星、诺氟沙星等),磺胺类和盐酸三甲胺(包括磺胺醋酰、磺胺甲噁唑、甲氧苄啶等);所述抗真菌药物包括:多烯类(包括那他霉素、两性霉素b),唑类(包括克霉唑、酮康唑、咪康唑、氟康唑、伊曲康唑、伏立康唑、泊沙康唑等),棘白菌素类(包括阿尼芬净、卡泊芬净、米卡芬净);所述眼用消炎药物包括但不限于:双氯芬酸钠、地塞米松磷酸钠、氢化可的松、泼尼松龙磷酸钠、倍他米松、曲安奈德、氟米龙、倍他米松磷酸钠、甲基强的松龙、甲基泼尼松龙等。
46.在优选的实施例中,所述纳米载药微球的基质材料为壳聚糖。
47.一种所述眼表原位药物的制备方法,包括如下步骤:
48.(1)将pluronic f127、pluronic f68和ha
‑
ma分别溶解于等渗的溶剂中,将光引发剂irgacure 2959溶解于去离子水中;
49.(2)将步骤(1)中的溶液按比例混合,并添加活性药物或包裹活性药物的纳米载药微球,在紫外光下交联,得到温度敏感的水凝胶体系。
50.所述溶剂为无菌pbs磷酸盐缓冲液或灭菌生理盐水。
51.在优选的实施例中,还包括在步骤(1)之前制备所述ha
‑
ma,具体包括:室温下将3当量甲基丙烯酸酐(ma)滴加到1wt%透明质酸钠(ha)水溶液中,反应前期3
‑
4小时内用naoh调节ph至7.5
‑
8.5。溶液在室温下反应过夜后,再调节ph至中性;后续进行透析和冻干,收集产物。优选地,所述ha
‑
ma的修饰度为25%
‑
30%左右。
52.在优选的实施例中,所述载药微球的基质材料为壳聚糖;制备方法为乳化法加离子交联法,交联剂为三聚磷酸钠(tpp);对于水溶性药物,所述载药微球的制备方法为单纯
的离子交联法;对于脂溶性药物,所述载药微球的制备方法为乳化法加离子交联法、
53.在一种优选的实施例中,对于水溶性药物,所述纳米载药微球的制备方法包括如下步骤:
54.(1)将壳聚糖在50℃下溶解于1%醋酸溶液中,浓度为0.1
‑
0.5%;
55.(2)将充分溶解后的壳聚糖
‑
醋酸溶液冷却至室温,加入活性药物,室温下搅拌至完全溶解,naoh调节ph值至5
‑
6;
56.(3)室温快速搅拌下加入tpp水溶液,交联反应2
‑
3小时,之后离心、洗涤、冻干,得到纳米载药微球。
57.在另一优选的实施例中,对于脂溶性药物,所述纳米载药微球的制备方法包括如下步骤:
58.(1)将壳聚糖和表面活性剂在50℃下溶解于1%醋酸溶液中,壳聚糖浓度为0.1
‑
1%;
59.(2)将活性药物溶于有机溶剂中,完全溶解后将上述溶液加入壳聚糖溶液中,于50℃条件下进行乳化反应,并用naoh调节ph值至5
‑
6,反应1.5
‑
2小时;
60.(3)快速搅拌下加入加入tpp水溶液,交联反应2
‑
3小时。
61.本发明实施例中,以pluronic f127,pluronic f68和甲基丙烯酸
‑
透明质酸(ha
‑
ma)为主要成分的水凝胶体系,内含活性药物分子或包裹药物的纳米载药微球,实现在眼表温度下形成原位凝胶并延长药物释放时间。所述水凝胶基体可包含两种或三种高分子聚合物基质,具有温度响应特性,在室温下为溶胶状态,在眼表温度下可迅速转变为凝胶;所述纳米载药微球由壳聚糖基质包裹活性药物分子构成,具有初级缓释性能。所述的温度响应水凝胶基体中,f127为水凝胶的主要成分,为水凝胶基体提供温敏特性;f68改善水凝胶基体的临界成胶温度,使其凝胶化的临界温度接近眼表生理温度(34
‑
36℃);可光交联的ha
‑
ma改善水凝胶基体的机械强度、粘度特性和生物相容性,延长药物释放时间,促进角膜、结膜等眼表组织修复。
62.本发明实施例的药物形成具有温度响应特性的眼表原位药物缓释水凝胶体系,可用于细菌性角膜炎、结膜炎,真菌性角膜炎、结膜炎及相关炎症的治疗。所述药物缓释体系主要由具有温度响应特性的水凝胶基体,和分散在其中的活性药物或纳米载药微球组成。该水凝胶体系能够实现药物的可控释放。水凝胶基体由泊洛沙姆和可光交联的透明质酸衍生物甲基丙烯酸
‑
透明质酸组成,其能够在眼表温度下迅速发生溶胶
‑
凝胶转变,从而在眼表形成凝胶,防止眼表清洁作用对药物的清除,同时促进角膜组织的修复;纳米载药微球以壳聚糖为基体材料,通过离子交联法制备而来,其纳米级的尺度可保证微球在角膜表面的黏附效应,促进药物对角膜组织的渗透性,同时还具有药物缓释性能。通过将水凝胶与载药微球相结合得到的二级药物缓释体系,进一步改善了缓释特性,体外释放时间长达12h以上。本发明所述药物缓释体系具有优良的生物相容性、良好的粘膜黏附性和持久的药物缓释性能,可大大延长药物在眼表的停留时间,提高药物利用度,减少药物使用次数,降低药物的毒副作用。
63.以下进一步举例描述本发明具体实施例。
64.所述水凝胶基体的制备方法,包括以下步骤:
65.(1)先将pluronic f127、pluronic f68和ha
‑
ma预先在4℃下分别溶解于等渗的溶
剂中,浓度分别为40%、20%、6%,之后储存于4℃。光引发剂irgacure 2959溶解于去离子水中,浓度为1%。
66.(2)将上述溶液按比例混合,室温下于一定功率的365nm紫外光下预先交联10
‑
60s,得到温度敏感的水凝胶基体。
67.其中,等渗溶剂包括无菌pbs缓冲液和灭菌生理盐水。
68.其中,f127和f68均为生物医用级别。
69.ha
‑
ma的制备方法,其步骤包括:室温下将3当量甲基丙烯酸酐(ma)滴加到1wt%透明质酸钠(ha)水溶液中,反应前期3
‑
4小时内用naoh调节ph至7.5
‑
8.5。溶液在室温下反应过夜后,再调节ph至中性;后续进行透析、过滤和冻干,收集产物。
70.其中,ha
‑
ma的修饰度为25
‑
30%左右。
71.其中,ha溶液的溶剂为去离子水。
72.其中,反应时间为10
‑
12小时。
73.其中,透析是使用8000
‑
14000da的纤维素透析袋,透析时间为3天,其间换水4次。
74.其中,过滤是指将透析后的溶液使用0.22μm滤膜过滤。
75.其中,冻干是指将过滤后的溶液于
‑
80℃冰箱速冻后置于
‑
50℃冻干机中冻干,冻干机真空度为5
‑
20pa。
76.药物缓释水凝胶体系包含以下两种载药方式:(1)水凝胶基体+活性药物;(2)水凝胶基体+载药纳米微球。前者适合水溶性药物,后者同时适合水溶性和脂溶性药物。
77.缓释水凝胶体系的组分和比例为:
78.(1)1ml水凝胶基体+3
‑
50mg活性药物;
79.(2)1ml水凝胶基体+10
‑
150mg纳米载药微球。
80.对于水溶性药物,载药微球的制备方法为单纯的离子交联法;对于脂溶性药物,载药微球的制备方法为乳化法加离子交联法。
81.水溶性药物的载药微球的制备步骤包括:
82.(1)将壳聚糖在50℃下溶解于1%醋酸溶液中,浓度为0.1
‑
0.5%;
83.(2)将充分溶解后的壳聚糖
‑
醋酸溶液冷却至室温,加入活性药物,室温下搅拌至完全溶解,naoh调节ph值至5
‑
6;
84.(3)室温快速搅拌下加入tpp水溶液,交联反应2
‑
3小时,之后离心、洗涤、冻干,得到纳米载药微球。
85.其中,搅拌装置为磁力搅拌台或电动搅拌器,转速为1500
‑
2000rpm。
86.其中,tpp溶液的浓度为0.5
‑
1%,添加速率为1ml/min。
87.其中,离心装置为高速离心机,离心转速为12000
‑
15000rpm。
88.其中,洗涤溶液为去离子水。
89.其中,纳米载药微球的粒径为200
‑
1000nm。
90.其中,脂溶性药物的载药微球的制备步骤包括:
91.(1)将壳聚糖和表面活性剂在50℃下共同溶解于1%醋酸溶液中,壳聚糖浓度为0.1
‑
1%;
92.(2)将活性药物溶于有机溶剂中,完全溶解后将上述溶液加入壳聚糖醋酸溶液中,于50℃条件下进行乳化反应,并用naoh调节ph值至5
‑
6,反应1.5
‑
2小时;
93.(3)快速搅拌下加入加入tpp水溶液,交联反应2
‑
3小时;
94.(4)反应产物用旋转蒸发仪去除有机相,之后高速离心、洗涤、冻干,得到纳米载药微球。
95.其中,表面活性剂为非离子型表面活性剂,包括泊洛沙姆188、span 80、tween 80,及上述三种中其中两者或三者的混合物,浓度为0.01%。
96.其中,乳化步骤的反应装置为大功率超声探头或高速搅拌器,搅拌器转速为7000
‑
10000rpm。
97.其中,旋转蒸发仪的蒸发温度为40
‑
50℃。
98.其中,药物与壳聚糖的质量比为1:1
‑
1:10;tpp与壳聚糖的质量比为1:3
‑
1:8。
99.药物缓释水凝胶体系用于眼表组织的药物缓释,用于细菌性和真菌性角膜炎、结膜炎的治疗。
100.在一个具体实施例中,甲基丙烯酸修饰的透明质酸(ha
‑
ma)的制备方式为:室温下将3当量甲基丙烯酸酐(ma)滴加到1wt%透明质酸钠(ha)水溶液中,反应前期3
‑
4小时内用1m的naoh溶液调节ph至7.5
‑
8.5。溶液在室温下反应过夜后,再用naoh溶液调节ph至严格中性;将反应产物置于截留分子量为8000
‑
14000da的纤维素透析袋,透析时间为3天,其间换水4次;之后将透析后的产物溶液使用0.22μm滤膜过滤,于
‑
80℃冰箱速冻后置于
‑
50℃冻干机中冻干,冻干机真空度为5
‑
20pa。最终产物为白色絮状,溶于水后呈无色透明溶液。
101.ha
‑
ma的红外吸收光谱如图3所示,可以看出ha的衍生物在2850cm
‑1处出现了c
‑
h振动的吸收峰,在1600cm
‑1处出现了c=c振动的吸收峰,在1700
‑
1750处出现了酯基上c=o的伸缩振动的特征峰。
102.在一个具体实施例中,一种含可溶性药物的原位缓释水凝胶体系的制备方法,包括以下步骤:
103.(1)选用左氧氟沙星(lfx)作为模型药物,将其预先溶于磷酸盐缓冲液中,浓度为5%wt。将pluronic f127和制备得到的ha
‑
ma分别溶于磷酸盐缓冲液中,浓度分别为30%wt和3%wt,之后存放于4℃条件下;pluronic f127需在4℃下搅拌溶解。
104.(2)配制1ml含0.5%左氧氟沙星的水凝胶溶液,需加入左氧氟沙星预配溶液100μl,pluronic f127预配溶液567μl,ha
‑
ma溶液333μl,之后置于超声冰浴中混合均匀。
105.(3)加入100μl irgacure 2959光引发剂,于365nm的紫外灯下固化30s,得到含左氧氟沙星的原位缓释水凝胶体系。
106.在一个具体实施例中,一种含水溶性药物纳米微球的原位缓释水凝胶体系的制备方法,包括以下步骤:
107.(1)选用左氧氟沙星作为模型药物制备左氧氟沙星
‑
壳聚糖纳米载药微球,制备方法为:将25mg壳聚糖在50℃下溶解于20ml浓度为1%的醋酸溶液中,充分溶解后冷却至室温,加入10mg左氧氟沙星,室温下搅拌至完全溶解,用naoh调节ph值至5
‑
6;室温快速搅拌下加入5ml浓度为0.1%的tpp水溶液,添加速率为1ml/min,保持搅拌速率在1500rpm以上使其交联2
‑
3小时;之后在13000rpm,4℃条件下离心15分钟得到纳米微球沉淀,水洗两次后于
‑
80℃冻干,就得到负载左氧氟沙星的纳米微球。
108.(2)将pluronic f127和制备得到的ha
‑
ma分别溶于磷酸盐缓冲液中,浓度分别为30%wt和3%wt,之后存放于4℃条件下;pluronic f127需在4℃下搅拌溶解。
109.(3)配制1ml含左氧氟沙星
‑
壳聚糖纳米载药微球的水凝胶溶液,需加入制备好的纳米载药微球50mg,磷酸盐缓冲液100μl,pluronic f127预配溶液567μl,ha
‑
ma溶液333μl,之后置于超声冰浴中混合均匀。
110.(4)加入100μl irgacure 2959光引发剂,于365nm的紫外灯下固化30s,得到含左氧氟沙星纳米载药微球的原位缓释水凝胶体系。
111.图4为左氧氟沙星
‑
壳聚糖纳米载药微球的粒径分布曲线,其平均粒径为210nm。
112.在一个具体实施例中,一种含脂溶性药物纳米微球的原位缓释水凝胶体系的制备方法,包括以下步骤:
113.(1)选用红霉素作为模型药物制备红霉素
‑
壳聚糖纳米载药微球,其制备方法为:将10mg红霉素和5mg泊洛沙姆188溶于3ml丙酮,作为a液;将150mg壳聚糖于50℃下溶于50ml浓度为1%的醋酸溶液中,作为b液;在功率为700w,幅值40%的超声振头作用下,将a液逐滴加入b液,在50℃下保持反应2小时,使得乳化充分进行。得到的产物用旋转蒸发仪在恒温40℃条件下去除有机相,再置于13000rpm、4℃的高速离心机中离心15分钟,得到纳米微球沉淀,将沉淀水洗两次,离心后置于
‑
80℃条件下冷冻干燥,得到红霉素纳米微球。
114.(2)将pluronic f127和制备得到的ha
‑
ma分别溶于磷酸盐缓冲液中,浓度分别为30%wt和3%wt,之后存放于4℃条件下;pluronic f127需在4℃下搅拌溶解。
115.(3)配制1ml含红霉素
‑
壳聚糖纳米载药微球的水凝胶溶液,需加入制备好的纳米载药微球100mg,磷酸盐缓冲液100μl,pluronic f127预配溶液567μl,ha
‑
ma溶液333μl,之后置于超声冰浴中混合均匀。
116.(4)加入100μl irgacure 2959光引发剂,于365nm的紫外灯下固化30s,得到含红霉素纳米载药微球的原位缓释水凝胶体系。
117.眼部原位缓释凝胶的体外药物释放研究
118.将一定重量的左氧氟沙星眼部原位缓释凝胶装入离心管中,加入2ml的人工泪液作为释放介质,置于36℃的恒温振荡器中,设置震荡频率为100rpm,每隔一定时间更换人工泪液。将收集到的人工泪液用0.22μm滤膜过滤后,用紫外分光光度法测量其中的药物浓度,从而得到体外药物释放曲线。图1为左氧氟沙星眼部原位缓释凝胶的累计释放曲线,三条曲线分别代表左氧氟沙星壳聚糖纳米微球、含左氧氟沙星的眼部原位缓释水凝胶、含左氧氟沙星
‑
壳聚糖纳米微球的眼部原位缓释水凝胶的体外药物释放曲线。图2为三者的释放速率曲线,可以发现,左氧氟沙星眼部原位缓释凝胶的有效释药时间可以达到12小时。
119.眼部原位缓释凝胶的细胞毒性研究
120.在动物研究之前需进行细胞毒性研究,以评估水凝胶的可浸出提取物是否显示出任何细胞毒性。取1ml的眼部缓释水凝胶,置于装有10ml细胞培养基的离心管中,于37℃的无菌环境下浸泡24h,之后用0.22μm滤膜过滤,得到含水凝胶浸出物的细胞培养基。选用人角膜上皮细胞系(hcecs)作为实验对象,使用cck
‑
8法检测水凝胶对人角膜上皮细胞的细胞活性及细胞增殖的影响。将培养的人角膜上皮细胞用胰蛋白酶消化后,接种在96孔板内,每孔2000个细胞,将接种后的细胞置于5%二氧化碳培养箱内培养24小时,待其全部贴壁后,将普通培养基换成含水凝胶浸出物的细胞培养基,并分别在培养第1,3,5天后用cck
‑
8试剂测量细胞的增殖和存活比例,其结果如图5所示,发现5天之后细胞存活率依然大于70%,说明所述载药水凝胶具有良好的生物相容性。
121.眼部原位缓释凝胶的眼部刺激性研究
122.通过draize眼部刺激性实验探究所述缓释凝胶对眼部组织的刺激性。选用新西兰大白兔4只,雌雄不限,左眼为实验组于结膜囊内滴入50μl原位凝胶,右眼为对照组于结膜囊内滴入50μl生理盐水,给药后眼部被动闭合20s,之后分别于6h,12h,24h,48h,72h后观察,按照draize眼刺激性实验评分标准打分,对眼部原位缓释凝胶进行刺激性评价。给药6h后仅有一只实验组兔子的结膜呈现出轻度红肿的现象,除此之外均与对照组无差别,表明眼部原位凝胶无眼部刺激性。
123.本发明的背景部分可以包含关于本发明的问题或环境的背景信息,而不一定是描述现有技术。因此,在背景技术部分中包含的内容并不是申请人对现有技术的承认。
124.以上内容是结合具体/优选的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,其还可以对这些已描述的实施方式做出若干替代或变型,而这些替代或变型方式都应当视为属于本发明的保护范围。在本说明书的描述中,参考术语“一种实施例”、“一些实施例”、“优选实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。尽管已经详细描述了本发明的实施例及其优点,但应当理解,在不脱离专利申请的保护范围的情况下,可以在本文中进行各种改变、替换和变更。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1