一种二氢杨梅素在制备治疗口腔癌的药物中的应用
本发明涉及医药技术领域,具体涉及一种二氢杨梅素或其药学上可接受的盐在制备治疗口腔癌的药物中的应用。
背景技术:
口腔癌是指发生于口腔的恶性肿瘤。包括唇癌、牙龈癌、舌癌、软硬腭癌、颌骨癌、口底癌、口咽癌、涎腺癌和上颌窦癌以及发生于颜面部皮肤粘膜的癌症等。口腔癌是头颈部较常见的恶性肿瘤之一。口腔癌以男性多见。口腔癌病例中,以舌活动部癌最常见,其次为颊粘膜癌。口腔癌是我国高发恶性肿瘤之一,发病率为耳鼻咽喉恶性肿瘤之首。常见临床症状为鼻塞、涕中带血、耳闷堵感、听力下降、复视及头痛等。口腔癌大多对放射治疗具有中度敏感性,放射治疗是口腔癌的首选治疗方法。但是对较高分化癌,病程较晚以及放疗后复发的病例,手术切除和化学药物治疗亦属于不可缺少的手段。
细胞凋亡(apoptosis)是多细胞生物体内的一个重要生命现象,可分为凋亡提呈和凋亡实施两个连续过程。caspase被认为是凋亡的中心实施者,其执行凋亡的功能依赖于底物蛋白的酶解活性。细胞在各种生理病理因子的刺激下,经多因子多途径复杂的相互作用,caspase活化降解其作用底物产生终末效应事件,引起特征性形态学生物化学改变,完成细胞凋亡的过程。parp作为基因组监测和dna修复酶,是第一个被鉴定的在凋亡中由caspase-3和其他半胱氨酸蛋白酶降解,且最富特征性的蛋白酶解底物。因此,细胞中parp表达的变化是细胞凋亡的重要标志物。
细胞自噬(autophagy)是普遍存在于真核细胞中的细胞生物学行为,其本质是双层膜包裹细胞内一些受损伤的细胞器形成自噬小体,膜的来源目前尚不十分清楚,然后自噬小体与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物,从而实现细胞本身的代谢需要和某些细胞器的更新。目前部分学者认为细胞自噬对细胞存在一定的保护作用,尤其是对肿瘤细胞的存活有重大意义,可以使肿瘤细胞维持自身的代谢平衡、获取必须的蛋白质,及时更新受损的细胞器,是肿瘤耐药的重要机制之一。已有研究表明,通过自噬抑制剂或敲除自噬相关基因可以增加癌细胞对化疗药物的敏感性。
二氢杨梅素(dihydromyricetin,dhm),又名蛇葡萄素(ampelopsin)。提取自葡萄科蛇葡萄属植物藤茶的叶中,属黄酮类化合物,其分子式为c15h12o8。作为一种黄酮类化合物,显示出了较强的抗氧化和促进细胞生长的特性。有些实验表明,二氢杨梅素可以有效地缓解急性肝衰竭的肝脏组织坏死,并能促进肝细胞增殖,显著提高急性肝衰竭模型小鼠的存活率。但是,尚未发现二氢杨梅素用于预防或治疗口腔癌的报道。
技术实现要素:
本发明发现二氢杨梅素可以抑制口腔癌细胞的增殖,并且通过增加凋亡相关因子parp和cleaved-parp的表达促进口腔癌细胞凋亡,通过抑制自噬相关因子lc3b或atg-7表达而抑制口腔癌细胞自噬。将二氢杨梅素与自噬抑制剂巴夫洛霉素a1联用,进一步增强了二氢杨梅素对口腔癌细胞的增殖抑制作用,两者的组合能够起到协同抑制口腔癌细胞增殖的效果(p<0.01)。该结果证实了抑制自噬能够显著增强二氢杨梅素的增殖抑制活性。二氢杨梅素通过促进口腔癌细胞凋亡和自噬抑制机制发挥抗口腔癌的作用。
基于以上内容,本发明提供如下技术方案:
一方面,本发明提供一种二氢杨梅素或其药学上可接受的盐在制备预防和/或治疗口腔癌的药物中的应用。
进一步地,所述口腔癌选自面颊癌、唇癌、口腔鳞癌、涎腺癌、舌癌、牙龈癌、软硬腭癌、颌骨癌、口底癌、上颌窦癌以及发生于颜面部皮肤粘膜的癌症。所述口腔癌优先舌癌,更优选舌鳞状细胞癌。
进一步地,所述二氢杨梅素或其药学上可接受的盐通过上调口腔癌细胞凋亡相关蛋白parp的表达促进口腔癌细胞凋亡。
进一步地,所述二氢杨梅素或其药学上可接受的盐抑制口腔癌细胞的自噬。
进一步地,所述二氢杨梅素或其药学上可接受的盐通过降低自噬相关蛋白atg-7或lc3b的表达抑制口腔癌细胞的自噬。
另一方面,本发明提供一种二氢杨梅素或其药学上可接受的盐在制备自噬抑制剂中的用途。
进一步地,所述二氢杨梅素或其药学上可接受的盐降低口腔癌细胞中自噬相关蛋白atg-7或lc3b的表达。
第三方面,本发明提供一种二氢杨梅素或其药学上可接受的盐和自噬抑制剂的组合在制备预防和/或治疗口腔癌的药物中的用途。
进一步地,所述口腔癌选自面颊癌、唇癌、口腔鳞癌、涎腺癌、舌癌、牙龈癌、软硬腭癌、颌骨癌、口底癌、上颌窦癌以及发生于颜面部皮肤粘膜的癌症,所述口腔癌优先舌癌,更优选舌鳞状细胞癌。
进一步地,所述自噬抑制剂为巴夫洛霉素a1。
优选地,二氢杨梅素的有效浓度为20~60μm,自噬抑制剂的有效浓度为0.1μm。
药物组合物
本发明另一方面提供了一种药物组合物,其包含二氢杨梅素或其药学上可接受的盐以及一种或更多种药学上可接受的辅剂。考虑所有的给药方式,例如口服、直肠、肠胃外、局部、或通过静脉内、肌内、胸骨内或皮下注射、或以适于吸入的形式。只要合适,制剂可以方便地以个别剂量单位存在并可通过药学领域中熟知的任何方法进行制备。根据已知的和已确定的实践,所述化合物一般将与一种或多种药学上可接受的成分一起配制。因此,药物组合物可被配制成液体、粉末、可注射溶液、悬浮剂、栓剂等。
用于口服的制剂可被提供为片剂或硬胶囊,其中所述化合物与惰性固体稀释剂例如碳酸钙、磷酸钙或高岭土混合,或者提供为软明胶胶囊,其中活性成分与水或可混溶溶剂如丙二醇、peg和乙醇、或油质介质如花生油、液体石蜡或橄榄油混合。
对于在口中的局部给药,药物组合物可采取以常规方式配制的颊部或舌下片剂、滴剂或锭剂。
所述二氢杨梅素或其药学上可接受的盐可被配制,用于通过注射、便利的静脉内、肌内或皮下注射的肠胃外给药,例如通过弹丸注射或连续静脉输注。注射制剂可以单位剂型存在,例如,于加入防腐剂安瓿或多剂量容器中。药物组合物可采取这类形式,例如在水性载体中的悬浮剂、溶液或乳剂,且可含有配制剂,如悬浮剂、稳定剂和/或分散剂。可选地,所述化合物可以以粉末形式,用于在使用前与合适的载体如无菌无热源水一起构建。
对于鼻内给药,所述二氢杨梅素或其药学上可接受的盐可被使用,例如作为液体喷雾剂、作为粉末或以滴剂形式。
对于吸入给药,所述二氢杨梅素或其药学上可接受的盐可方便地以通过加压包装或喷雾器的气溶胶气雾剂包装的形式进行输送,并使用合适的推进剂,例如二氯二氟甲烷、三氯氟代甲烷、二氯四氟乙烷、四氟乙烷、七氟丙烷、二氧化碳或其它合适的气体。
含水悬浮液可包括药学上可接受的悬浮剂,例如羧甲基纤维素钠、羟丙基纤维素、藻酸钠、聚乙烯吡咯烷酮和阿拉伯树胶;分散或润湿剂例如天然存在的磷脂例如卵磷脂、或烯化氧与脂肪酸的缩合产物例如聚氧乙烯硬脂酸酯、环氧乙烷与长链脂肪醇的缩合产物如十七碳亚乙基-氧代十六醇、或环氧乙烷与衍生自脂肪酸和己糖醇的偏酯的缩合产物如聚氧乙烯山梨醇单油酸酯、或环氧乙烷与衍生自脂肪酸酐和己糖醇酐的偏酯的缩合产物如聚氧乙烯失水山梨糖醇单油酸酯。
附图说明
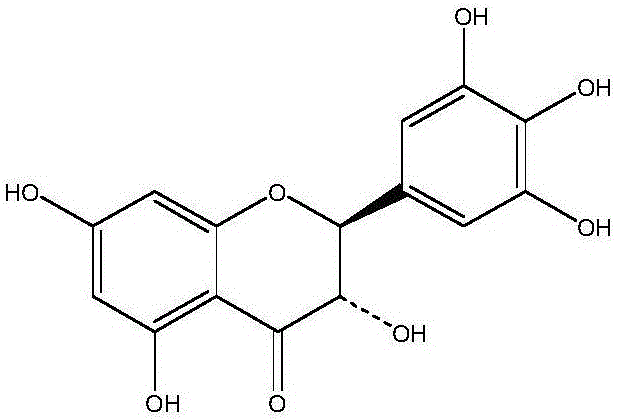
图1二氢杨梅素的化学结构
图2不同浓度dhm对ssc-4细胞的抑制率
图3不同浓度dhm对ssc-9细胞的抑制率
图4dhm处理24h后对ssc-4细胞凋亡相关因子的影响
图5dhm处理24h后对ssc-9细胞凋亡相关因子的影响
图6dhm处理24h后对ssc-4细胞自噬相关因子的影响
图7dhm处理24h后对ssc-9细胞自噬相关因子的影响
图8dhm和bafa1联用对ssc-4细胞的抑制率
图9dhm和bafa1联用对ssc-9细胞的抑制率
有益效果
本发明发现二氢杨梅素可以抑制口腔癌细胞的增殖,并且通过增加凋亡相关因子parp和cleaved-parp的表达促进口腔癌细胞凋亡,通过抑制自噬相关因子lc3b或atg-7表达而抑制口腔癌细胞自噬。将二氢杨梅素与自噬抑制剂巴夫洛霉素a1联用,进一步增强了二氢杨梅素对口腔癌细胞的增殖抑制作用,两者的组合能够起到协同抑制口腔癌细胞增殖的效果(p<0.01)。该结果证实了抑制自噬能够显著增强二氢杨梅素的增殖抑制活性。二氢杨梅素通过促进口腔癌细胞凋亡和自噬抑制机制发挥抗口腔癌的作用。
具体实施方式
在下文中更详细地描述了本发明以有助于对本发明的理解。
实施例1dhm对口腔癌细胞系增殖的影响
一、口腔癌细胞株体外培养
1.细胞来源
人舌鳞癌细胞系scc-4、scc-9均为实验室自有。
2.细胞培养与传代
scc-4、scc-9细胞均使用1640培养基(gibco)在细胞培养时向培养基中添加10%胎牛血清(fetalbovineserum,fbs,gibco)。在37℃,5%co2培养箱中培养,待细胞生长至占培养皿底部80~90%时,使用0.25%胰酶-edta消化并传代。
二、dhm对细胞增殖能力的影响
主要试验材料:二氢杨梅素(dihydromyrictin,dhm,sigma)溶解于二甲亚砜(dmso)中,配制成50mm浓缩液,-20℃保存,使用时分别稀释为1.25,2.5,5,10,20,40,80和160μm,即配即用;cellcountingkit(cck-8,beyotime),4℃保存,直接取用;胰酶(gibco);pbs;96孔板(corning)。
试验方法:将细胞消化,离心并重悬浮于相应培养液中,以5×103/孔的密度种植于96孔板,置于37℃,5%co2培养箱中培养24h后,移除原培养液,加入新鲜配制的,分别含有1.25,2.5,5,10,20,40,80和160μmdhm的培养液继续培养,分别于培养的24h,48h和72h终止培养,向每孔加入10μlcck-8,再重新置于37℃,5%co2培养箱中培养2h后,小心摇晃混匀后在酶标仪od450nm处检测各孔的吸光值。每个浓度设置三个重复组。
三、试验结果
在dhm处理24h后,1.25,2.5,5,10,20,40,80和160μm的dhm对ssc-4的抑制率分别为15.31%32.14%34.59%35.51%43.62%
43.16%49.75%49.36%,随着dhm浓度的增加抑制率变化不大。在dhm处理48h后,1.25,2.5,5,10,20,40,,80和160μm的dhm对ssc-4的抑制率分别为51.12%52.33%53.44%85.71%89.72%
85.49%88.72%78.11%,随着dhm浓度的增加,抑制率呈剂量依赖的方式增加。在dhm处理72h后,1.25,2.5,5,10,20,40,,80和160μm的dhm对ssc-4的抑制率分别为28.69%32.21%45.26%56.05%
91.95%93.66%93.96%93.95%,随着dhm浓度的增加,抑制率呈剂量依赖的方式增加(图2)。
自dhm处理24h后,40,80和160μm的dhm对ssc-9的抑制率分别为11.30%22.40%80.60%。自dhm处理48h后,40,80和160μm的dhm对ssc-9的抑制率分别为12.68%18.16%88.19%。自dhm处理72h后,40,,80和160μm的dhm对ssc-9的抑制率分别为2.49%
6.51%87.75%。dhm对scc-9细胞具有一定的剂量依赖效应,在dhm作用24h、48h、72h后,80μm开始对细胞抑制率超过80%(图3)
实施例2细胞凋亡相关因子表达wersternblotting检测
一、细胞培养与传代
人舌鳞癌细胞系scc-4、scc-9均为实验室自有,使用1640培养基(gibco),在细胞培养时向培养基中添加10%胎牛血清(fetalbovineserum,fbs,gibco)。细胞系在37℃,5%co2培养箱中培养,待细胞生长至占培养皿底部80~90%时,使用0.25%胰酶-edta消化并传代。
二、细胞凋亡相关因子的表达检测
主要试验材料:dhm,溶解于二甲亚砜(dmso)中,配制成50mm浓缩液,-20℃保存,使用时分别稀释为20和40μm,即配即用;ripa裂解液(beyotime);pmsf;bca蛋白浓度测定试剂盒(beyotime),兔抗人一抗(p53,parp,cleaved-parp,caspase3,actin);辣根过氧化物酶共轭的山羊抗兔二抗;丙烯酰胺,sds,亚硫酸铵,tris-base,pvdf膜,ecl发光液(gehealthcare)。
试验方法:将细胞消化成细胞悬液后,以合适的密度铺于60mm培养皿中,于37℃,5%co2培养箱中孵育约24h,待细胞生长至占培养皿底部60%左右时,移除原培养液,加入新鲜配制的,分别含有20μm和40μm浓度dhm的培养液继续培养,以不加dhm(0μm)的培养液为对照组。在加入dhm后24h终止培养,移除培养液并用pbs洗涤两次,加入含有1%pmsf的ripa裂解液裂解细胞。将裂解液4℃,12000×g/min离心10min,收集上清,测定蛋白浓度后,等蛋白量上样,10%sds-page电泳分离蛋白,转膜至pvdf膜上,5%脱脂奶粉封闭,tbst(含1%tween20)洗涤后一抗(p53,parp,cleaved-parp,caspase3,actin)4℃孵育过夜。tbst洗涤5次,每次5min,二抗室温孵育1h,tbst洗涤5次,每次5min,使用ecl发光液化学发光并在暗室曝光,分析相关蛋白表达趋势。
三、试验结果
scc-4细胞和ssc-9细胞在dhm处理24h时,随着dhm浓度的增加,p53,caspase3表达呈现递减趋势;parp和cleaved-parp的表达则呈现递增趋势,(图4、图5)。
以上结果表明,dhm能够增加ssc-4和ssc-9凋亡相关因子parp的表达,其可能通过活化parp促进ssc-4和ssc-9细胞凋亡。
实施例3细胞自噬相关因子表达wersternblotting检测
一、细胞培养与传代
人舌鳞癌细胞系scc-4、scc-9均为实验室自有,使用1640培养基(gibco),在细胞培养时向培养基中添加10%胎牛血清(fetalbovineserum,fbs,gibco)。细胞系在37℃,5%co2培养箱中培养,待细胞生长至占培养皿底部80~90%时,使用0.25%胰酶-edta消化并传代。
二、细胞自噬相关因子的表达检测
主要试验材料:dhm,溶解于二甲亚砜(dmso)中,配制成50mm浓缩液,-20℃保存,使用时分别稀释为20和40μm,即配即用;ripa裂解液(beyotime);pmsf;bca蛋白浓度测定试剂盒(beyotime),兔抗人一抗(atg-7,lc3b,actin);辣根过氧化物酶共轭的山羊抗兔二抗;丙烯酰胺,sds,亚硫酸铵,tris-base,pvdf膜,ecl发光液(gehealthcare)。
试验方法:将细胞消化成细胞悬液后,以合适的密度铺于60mm培养皿中,于37℃,5%co2培养箱中孵育约24h,待细胞生长至占培养皿底部60%左右时,移除原培养液,加入新鲜配制的,分别含有20μm和40μm浓度dhm的培养液继续培养,以不加dhm(0μm)的培养液为对照组。在加入dhm后24h终止培养,移除培养液并用pbs洗涤两次,加入含有1%pmsf的ripa裂解液裂解细胞。将裂解液4℃,12000×g/min离心10min,收集上清,测定蛋白浓度后,等蛋白量上样,10%sds-page电泳分离蛋白,转膜至pvdf膜上,5%脱脂奶粉封闭,tbst(含1%tween20)洗涤后一抗(atg-7,lc3b,actin)4℃孵育过夜。tbst洗涤5次,每次5min,二抗室温孵育1h,tbst洗涤5次,每次5min,使用ecl发光液化学发光并在暗室曝光,分析相关蛋白表达趋势。
三、试验结果
scc-4细胞在dhm处理24h后,随着dhm浓度的增加,atg-7表达呈现递减趋势;lc3b的表达则无明显变化(图6)。
scc-9细胞在dhm处理24h时,随着dhm浓度的增加,lc3b表达呈现递减趋势;atg-7的表达则无明显变化(图7)。
以上结果表明,dhm对人舌鳞癌细胞系具有自噬抑制作用,其可能通过自噬抑制机制阻止肿瘤细胞的自我修复。
实施例4dhm联合自噬抑制剂对细胞增殖能力的影响
一、口腔癌细胞株体外培养
1.细胞来源
人舌鳞癌细胞系scc-4、scc-9均为实验室自有。
2.细胞培养与传代
scc-4、scc-9细胞均使用1640培养基(gibco)在细胞培养时向培养基中添加10%胎牛血清(fetalbovineserum,fbs,gibco)。在37℃,5%co2培养箱中培养,待细胞生长至占培养皿底部80~90%时,使用0.25%胰酶-edta消化并传代。
二、dhm联合巴夫洛霉素a1对细胞增殖能力的影响
主要试验材料:二氢杨梅素(dihydromyrictin,dhm,sigma)溶解于二甲亚砜(dmso)中,配制成50mm浓缩液,-20℃保存,使用时分别稀释为1.25,2.5,5,10,20,40,80和160μm,即配即用;巴夫洛霉素a1(bafilomycina1,bafa1)配制成0.1μm,即配即用;cellcountingkit(cck-8,beyotime),4℃保存,直接取用;胰酶(gibco);pbs;96孔板(corning)。
试验方法:将ssc-4细胞消化,离心并重悬浮于相应培养液中,以5×103/孔的密度种植于96孔板,置于37℃,5%co2培养箱中培养24h后,移除原培养液,加入新鲜配制的,分别含有:a组20μmdhm;b组:0.1μmbafa1;c组20μmdhm和0.1μm的bafa1和d组空白培养液对照组的培养液继续培养,分别于培养的24h,48h和72h终止培养,向每孔加入10μlcck-8,再重新置于37℃,5%co2培养箱中培养2h后,小心摇晃混匀后在酶标仪od450nm处检测各孔的吸光值。每组设置三个重复组。
试验方法:将ssc-9细胞消化,离心并重悬浮于相应培养液中,以5×103/孔的密度种植于96孔板,置于37℃,5%co2培养箱中培养24h后,移除原培养液,加入新鲜配制的,分别含有:a组60μmdhm;b组:0.1μmbafa1;c组60μmdhm和0.1μm的bafa1和d组空白培养液对照组的培养液继续培养,分别于培养的24h,48h和72h终止培养,向每孔加入10μlcck-8,再重新置于37℃,5%co2培养箱中培养2h后,小心摇晃混匀后在酶标仪od450nm处检测各孔的吸光值。每组设置三个重复组。
三、试验结果
由于肿瘤自噬是导致许多肿瘤产生耐药性的重要机制,因此,我们进一步研究了dhm联合自噬抑制剂巴夫洛霉素a1对ssc-4和ssc-9增殖能力的影响。
结果表明:a组20μmdhm对ssc-4的抑制率为36.65%(24h)
83.65%(48h)59.35%(72h),b组单独使用0.1μmbafa1对ssc-4的抑制率<10%,与空白对照组d组相比没有显著性差异(p>0.05),20μmdhm+0.1μmbafa1联用对ssc-4的抑制率为56.73%(24h)92.69%(48h)83.30%(72h),与a组相比,具有显著性差异(p<0.05)。(图8)
a组60μmdhm对ssc-9的抑制率为51.25%(24h)62.96%(48h)61.66%(72h),b组单独使用0.1μmbafa1对ssc-4的抑制率<10%,与空白对照组d组相比没有显著性差异(p>0.05),60μmdhm+0.1μmbafa1联用对ssc-9的抑制率为78.46%(24h)94.67%(48h)96.21%(72h),与a组相比,具有极显著性差异(p<0.05)。(图9)
以上结果表明自噬抑制剂巴夫洛霉素a1能够增强dhm对舌鳞状细胞癌ssc-4、ssc-9的抑制作用,两者联用产生了协同增效作用。
以上描述了本发明优选实施方式,然其并非用以限定本发明。本领域技术人员对在此公开的实施方案可进行并不偏离本发明范畴和精神的改进和变化。
- 还没有人留言评论。精彩留言会获得点赞!