Napabucasin的制药用途的制作方法
napabucasin的制药用途
技术领域
1.本发明属于制药领域,提供napabucasin的制药用途。
背景技术:
2.感染性疾病是威胁人类生命和健康的重大疾病,滥用和过度使用抗生素造成的微生物耐药问题已成为人类共同面临的公共安全危机。全球每年约70万人死于耐药菌感染,多于癌症死亡人数,因此迫切需要探索和研发新型的抗感染药物。2017年2月,who首次发布世界上最具耐药性、最能威胁人类健康的“超级细菌”“12强”清单,用于指导和促进新型抗生素的优先研发。
3.幽门螺杆菌(helicobacter pylori,hp)是一种微氧革兰氏阴性菌,感染全球约一半的人口。hp感染是多种胃部疾病如慢性胃炎和胃、十二指肠溃疡发生的主要原因,同时与胃癌的发生发展密切相关。多个大规模流行病学干预研究表明,根除hp可以预防胃癌的发生。目前,世界卫生组织推荐的根除hp感染的治疗方案是三联或四联疗法,前者即质子泵抑制剂(奥美拉唑等)加两种抗生素(克拉霉素、阿莫西林、左氧氟沙星和甲硝唑等选二种),后者再添加铋剂(枸橼酸铋钾等)。但近年来随着抗生素在hp感染治疗中的广泛应用,hp的耐药问题日益严重,迫切需要对耐药幽门螺杆菌有效的新药。
4.念珠菌属是人体正常菌株之一,当全身或局部免疫力下降,如大量使用抗生素、糖皮质激素或免疫抑制剂等之后可引发念珠菌病。白色念珠菌是此病的主要病原菌,可引起皮肤、粘膜甚至全身感染。有研究指出这种严重的全身感染的致死率高达40%。除了常见的白色念珠菌感染的数量不断增多,一些少见或罕见真菌引起的感染也时有报道。研制高效低毒的抗真菌药提供给临床是当务之急。
5.napabucasin由美国波士顿生物制药技术公司(boston biomedical,bbi)开发,是为数不多的进入iii期临床的stat3抑制剂。napabucasin可用于治疗癌症干细胞,具有在多种肿瘤类型抑制癌细胞转移和防止癌症复发的潜力。
6.
技术实现要素:
7.解决的技术问题:本发明提供一种napabucasin的制药用途,可用于抗菌药物的制备。
8.技术方案:napabucasin在制备抗菌药物中的应用,上述菌为革兰氏阴性菌、革兰氏阳性菌或真菌。
9.优选的,上述革兰氏阴性菌为幽门螺杆菌、牙龈卟啉单胞菌、伴放线放线杆菌、具
核梭杆菌、空肠弯曲杆菌、淋病奈瑟菌、流感嗜血杆菌和卡他莫拉菌。
10.优选的,上述革兰氏阳性菌为金黄色葡萄球菌、溶血性葡萄球菌、表皮葡萄球菌、枯草芽孢杆菌、蜡样芽孢杆菌、单核细胞增生李斯特氏菌、肺炎链球菌、艰难梭菌和痤疮丙酸杆菌。
11.优选的,上述真菌为白色念珠菌、近平滑念珠菌、光滑念珠菌、克鲁斯念珠菌、葡萄牙念珠菌、热带念珠菌、新生隐球菌、烟曲霉、红色毛癣菌和马拉色菌。
12.napabucasin与质子泵抑制剂的组合物在制备抗耐药性或敏感性幽门螺杆菌药物中的应用。
13.上述质子泵抑制剂为奥美拉唑。
14.napabucasin在制备治疗耐药性或敏感性幽门螺杆菌感染导致的急、慢性胃炎、胃、十二指肠溃疡药物中的应用。
15.治疗幽门螺杆菌感染的药物,组分为napabucasin和奥美拉唑。
16.有益效果:napabucasin可用于制备抗菌感染的药物。本发明展示的napabucasin对浮游生长的和形成生物膜的幽门螺杆菌都有很好的杀灭作用,可用于治疗耐药性或敏感性幽门螺杆菌感染导致的急、慢性胃炎、胃、十二指肠溃疡等胃部疾病,而且毒副作用小,能有效缓解幽门螺杆菌耐药性问题。
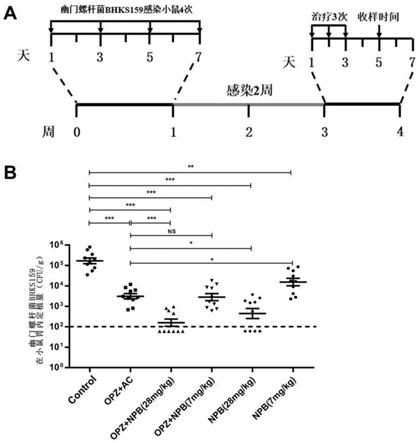
附图说明
17.图1.体外诱导检测幽门螺杆菌g27菌株对napabucasin的耐药性。
18.图2.利用阿莫西林诱导,显微镜下检测幽门螺杆菌g27菌株的球形变。a,阴性对照;b,g27球形菌株。
19.图3.napabucasin对幽门螺杆菌g27球形菌株的杀灭作用。a,1
×
mic浓度的各药物分别对g27球形菌株的杀灭作用;b,2
×
mic、4
×
mic或8
×
mic浓度的各药物在12小时处理后对g27球形菌株的杀灭作用。注:npb,napabucasin;mtz,甲硝唑;amx,阿莫西林;clr,克拉霉素;lvx,左氧氟沙星。“*”表示cfu在检测极限以下(10cfu/ml)。
20.图4.napabucasin抗幽门螺杆菌生物膜活性检测。a,结晶紫染色法测定napabucasin抑制生物膜形成的活性;b,结晶紫染色法测定napabucasin破坏成熟生物膜的活性;c,syto9
‑
pi双染色和荧光共聚焦检测napabucasin杀灭形成成熟生物膜的幽门螺杆菌的活性;d,平板菌落计数法检测napabucasin杀灭形成成熟生物膜的幽门螺杆菌的活性。注:npb,napabucasin;mtz,甲硝唑。*,p<0.05;**,p<0.01;***,p<0.001。
21.图5.napabucasin在小鼠体内对幽门螺杆菌nsh57菌株的杀灭作用。a,幽门螺杆菌感染小鼠构建急性胃炎动物模型和药物治疗流程图;b.不同治疗组治疗后幽门螺杆菌在小鼠胃粘膜定植量的检测结果。设溶剂对照组(control,0.5%羧甲基纤维素钠+0.2%吐温80)、三联治疗组(opz+ac)、奥美拉唑和napabucasin联用治疗组(opz+npb)。*,p<0.05;**,p<0.01。
22.图6.napabucasin在小鼠体内对幽门螺杆菌多重耐药菌株bhks159的杀灭作用。a,幽门螺杆菌感染小鼠构建急性胃炎动物模型和药物治疗流程图;b.不同治疗组治疗后幽门螺杆菌在小鼠胃粘膜定植量检测结果。设对照组(未感染小鼠)、bhks159感染后的溶剂对照组(control,0.5%羧甲基纤维素钠+0.2%吐温80)、三联治疗组(opz+ac)、奥美拉唑和
napabucasin联用治疗组(opz+npb)和napabucasin治疗组(npb)。opz+npb和npb治疗组分别有两组,npb的给药剂量分别为28mg/kg和7mg/kg。*,p<0.05;**,p<0.01;***,p<0.001。
23.图7.napabucasin对耐药幽门螺杆菌bhks159感染的小鼠炎症因子的抑制作用。用elisa方法分别检测了各处理组小鼠血清中il
‑
1β(a)、il
‑
6(b)和il
‑
8(c)的含量。设对照组(未感染小鼠)、bhks159感染后的溶剂对照组(control,0.5%羧甲基纤维素钠+0.2%吐温80)、三联治疗组(opz+ac)、奥美拉唑和napabucasin联用治疗组(opz+npb)和napabucasin治疗组(npb)。npb的给药剂量为28mg/kg。
24.图8.napabucasin对耐药幽门螺杆菌bhks159感染的小鼠胃粘膜炎症的修复作用。胃粘膜组织分别进行he染色和tunel染色,放大100倍。设对照组(未感染小鼠)、bhks159感染后的溶剂对照组(control,0.5%羧甲基纤维素钠+0.2%吐温80)、三联治疗组(opz+ac)、奥美拉唑和napabucasin联用治疗组(opz+npb)和napabucasin治疗组(npb)。npb的给药剂量为28mg/kg。
25.图9.napabucasin在小鼠体内对白色念珠菌sc5314菌株的杀灭作用。.不同治疗组治疗后白色念珠菌在小鼠肾脏(a)和脾脏(b)的定植量检测结果。设溶剂对照组(control,0.5%羧甲基纤维素钠+0.2%吐温80)、氟康唑治疗组(flc)和napabucasin治疗组(npb)。**,p<0.01。
具体实施方式
26.下面的实施例可使本专业技术人员可全面的理解本发明,但不以任何方式限制本发明。
27.一、napabucasin的抗幽门螺杆菌作用
28.实施例1 napabucasin体外抗幽门螺杆菌的活性测定
29.通过测定napabucasin对幽门螺杆菌的最低抑菌浓度(mic)来确定其抗幽门螺杆菌的活性。
30.(1)材料
31.①
化学品:napabucasin、甲硝唑、阿莫西林、克拉霉素和左氧氟沙星等购于mce公司。
32.②
菌株:幽门螺杆菌标准菌株26695和g27;其他临床菌株为南京医科大学附属第一医院和附属逸夫医院从临床患者胃粘膜样本中分离鉴定所得。
33.③
培养基和主要试剂:脑心浸液培养液(bhi)、哥伦比亚培养基、选择性抗生素(万古霉素、多粘菌素b、甲氧苄氨嘧啶)、小牛血清(fcs)和100%二甲基亚砜(dmso)。
34.④
主要仪器:binder cb160三气培养箱、紫外分光光度计、恒温摇床(thermo)、离心机、电子天平等。
35.⑤
耗材:ep管、离心管、tip头等。
36.(2)方法:采用肉汤稀释法检测napabucasin对幽门螺杆菌的最低抑菌浓度(mic,100μl体系)
37.①
分别配备1.6mg/ml的napabucasin和6.4mg/ml的甲硝唑(mtz)储存溶液,溶剂均为100%dmso。
38.②
菌液制备:取固体平板上对数期生长的幽门螺杆菌用bhi(含10%fcs)制作成菌
悬液,调整浓度od
600
为0.2(菌量浓度约为1
×
108cfu/ml),稀释10倍,菌量约为1
×
107cfu/ml,备用。
39.③
96孔板制备:第一孔先加bhi培养液(含10%fcs)178μl,再加2μl的napabucasin储存溶液,采用二倍稀释法稀释至第12孔;另外一排孔以同样方法加甲硝唑。
40.④
接种菌液:取10μl上述备用菌液加入上述每孔中(每孔菌量浓度约为1.0
×
106cfu/ml)内,napabucasin的浓度依次为16μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml、0.063μg/ml、0.031μg/ml、0.016μg/ml和0.008μg/ml。另外一排每孔分别加100μl bhi培养液(含10%fcs),作为无菌对照组;再一排每孔分别加90μl bhi培养液(含10%fcs)和10μl上述备用菌液,作为阳性对照组。放置三气培养箱培养。
41.⑤
结果判断:培养48或72h后判读结果,以在小孔内完全抑制细菌生长的最低药物浓度为mic。当阳性对照孔(即不含药物)内细菌明显生长以及无菌对照组无菌生长时,试验才有意义。重复3次试验。
42.(3)结果
43.结果见表1。
44.表1 napabucasin对幽门螺杆菌的最低抑菌浓度(μg/ml)
[0045][0046]
注:npb,napabucasin;mtz,甲硝唑;amx,阿莫西林;clr,克拉霉素;lvx,左氧氟沙星。
[0047]
从上表可知,napabucasin对15株幽门螺杆菌(包括2株标准菌株和13株临床耐药菌株)的mic范围为0.016~0.125μg/ml,表明napabucasin体外对幽门螺杆菌具有很强的抗菌活性,具有良好的开发前景。
[0048]
实施例2 napabucasin诱导幽门螺杆菌g27菌株产生耐药性的测定
[0049]
(1)材料
[0050]
如实施例1材料。
[0051]
(2)方法
[0052]
将幽门螺杆菌g27菌株从新鲜固体平板接种到5ml bhi(含10%fcs)中,调整菌液浓度至od
600
=0.2左右,再添加napabucasin至终浓度0.016μg/ml(1/2
×
mic),放置三气培养箱培养48小时,观察细菌生长情况,并取菌液传代,继续上述方法诱导耐药,如生长良好,则倍增napabucasin浓度,如生长缓慢或不生长,则维持现有napabucasin浓度。共进行15代耐药诱导,每代检测mic。对照组为甲硝唑,方法相同。
[0053]
(3)结果
[0054]
结果见图1。由图1所示,在连续传代期间,未观察到幽门螺杆菌对napabucasin耐药性的形成,而幽门螺杆菌在前5次传代后发展出对甲硝唑的抗性,导致mic增加了4倍。这些结果证明napabucasin在幽门螺杆菌中具有极低的诱导耐药性的趋势。
[0055]
实施例3 napabucasin体外对球形幽门螺杆菌的抗菌作用
[0056]
(1)材料
[0057]
如实施例1材料。
[0058]
(2)方法:采用平板菌落计数法检测napabucasin对球形幽门螺杆菌的抗菌活性。
[0059]
①
幽门螺杆菌球形菌株的诱导:将幽门螺杆菌g27菌株从新鲜固体平板接种到布鲁氏肉汤培养液(含2%fcs),调整菌液浓度至od
600
=0.4左右,再添加阿莫西林至终浓度0.063μg/ml,放置三气培养箱培养24小时,革兰氏染色镜检观察确定g27菌株全部转变为球形菌,而对照实验(未添加阿莫西林)中g27菌株为螺杆状(图2)。
[0060]
②
药物处理:离心球形菌株弃上清,添加布鲁氏肉汤培养液(含2%fcs)稀释100倍至菌量浓度约为1
×
106cfu/ml,然后分别加入1
×
mic、2
×
mic、4
×
mic和8
×
mic终浓度的阿莫西林、甲硝唑、克拉霉素、左氧氟沙星和napabucasin,放置三气培养箱培养。
[0061]
③
平板计数:在指定时间取出100μl菌液进行梯度稀释,并涂布于哥伦比亚培养血平板中,再放置三气培养箱培养4天进行菌落计数。
[0062]
(3)结果
[0063]
结果见图3。由图3所示,napabucasin体外对抗幽门螺杆菌球形菌有极强的杀灭作用,效率强于常用抗生素如阿莫西林、甲硝唑、克拉霉素和左氧氟沙星等,具有良好的开发前景。
[0064]
实施例4 napabucasin对已形成生物膜的幽门螺杆菌的杀灭作用
[0065]
(1)材料
[0066]
如实施例1材料。
[0067]
(2)方法:采用结晶紫染色、荧光共聚焦和平板菌落计数法检测napabucasin对幽门螺杆菌的抗生物膜活性。
[0068]
①
napabucasin对幽门螺杆菌生物膜形成的影响:将幽门螺杆菌g27菌株在添加10%fbs的布鲁氏菌肉汤中过夜培养,用上述新鲜培养基稀释至od
600
为0.15,并向其中加入不同浓度的napabucasin、甲硝唑(作为阳性对照)或等量的dmso(作为溶剂对照),然后铺在96孔板,置于三气培养箱中培养3天后,用结晶紫染色法检测生物膜的相对量。
[0069]
②
napabucasin对已形成生物被膜的破坏作用:将幽门螺杆菌g27菌株在添加10%fbs的布鲁氏菌肉汤中过夜培养,用上述新鲜培养基稀释至od
600
为0.15,然后铺在96孔板,置于三气培养箱中培养3天以形成生物膜后,弃去培养基,然后用pbs清洗平板两次。在新鲜布鲁氏菌肉汤中添加不同浓度的napabucasin、mtz(作为阳性对照)或等量的dmso(作为溶
剂对照),加入96孔板中继续培养24小时,用结晶紫染色法检测生物被膜的相对量。
[0070]
③
荧光共聚焦显微镜检测napabucasin对生物膜中细菌活性的影响。生物膜内的细菌活力通过使用live/dead baclight细菌活力试剂盒(invitrogen,美国)进行评估,该试剂盒由两种荧光染料syto9和碘化丙啶(pi)组成。如上制备幽门螺杆菌g27菌株生物膜,用不同浓度的napabucasin、mtz(作为阳性对照)或等量的dmso(作为溶剂对照)处理。在上述微氧条件下孵育24小时后,用pbs洗涤未黏附的生物膜3次,然后用两种荧光染料在室温下黑暗中染色30分钟。漂洗后,使用共聚焦激光扫描显微镜(lsm710;carl zeiss,德国)观察图像,并随机检查更多视野。syto9和pi区分活细胞(绿色细胞)和死亡细胞(红色细胞)。
[0071]
④
菌落计数法检测napabucasin对生物膜中细菌活性的影响。如上制备和处理幽门螺杆菌g27细胞的生物膜。并在微氧条件下处理24小时后,去除培养基,用pbs冲洗3次,然后向每孔中加入250μl bhi培养液。用200μl的移液器顶端在孔壁上刮15次,从而将生物膜剥离。然后反复吹吸使刮过的生物膜在溶液中均质。最后,均匀的生物被膜菌悬液进行倍比稀释,铺在哥伦比亚血液琼脂平板上,然后在37℃的微氧条件下培养4天。对平板上的活细菌菌落进行计数,并以每毫升菌落总数表示。
[0072]
(3)结果
[0073]
结果如图4。由图4a所示,napabucasin可抑制幽门螺杆菌生物膜的形成,由图4b所示,napabucasin具有破坏幽门螺杆菌成熟生物膜的能力,且抗生物膜活性强于甲硝唑。由图4c和4d所示,napabucasin可杀灭形成生物膜的幽门螺杆菌,其活性也强于甲硝唑。
[0074]
实施例5 napabucasin对小鼠胃内定植的幽门螺杆菌nsh57菌株的杀灭效果检测
[0075]
(1)材料
[0076]
菌株为幽门螺杆菌小鼠驯化菌株nsh57,小鼠为spf级别的6周龄雌性c57bl/6小鼠,其他如实施例1材料。
[0077]
(2)方法
[0078]
①
幽门螺杆菌nsh57菌株感染小鼠的体内模型构建:参考文章(huang y,hang x,jiang x,zeng l,jia j,xie y,li f,bi h.in vitro and in vivo activities of zinc linolenate,a selective antibacterial agent against helicobacter pylori.antimicrob agents chemother[j].2019;63(6):e00004
‑
19)。取10%小鼠胃组织检测幽门螺杆菌定植,定植量范围为1
×
105cfu/g以上认为定植成功,检测结果均有幽门螺杆菌定植,模型构建成功。
[0079]
②
分组:将造模成功的感染组平均分成3组,分别为奥美拉唑加napabucasin(给药量为14mg/kg)组、奥美拉唑加阿莫西林(给药量14mg/kg)和克拉霉素(给药量为7mg/kg)组(标准三联组)、溶剂对照组,每组7只;所有组中奥美拉唑的给药量为138.2mg/kg,未感染幽门螺杆菌的7只小鼠为阴性对照组。
[0080]
③
给药:采取灌胃给药法,奥美拉唑先于其他药物前30分钟给药,给药后禁食禁水4小时;小鼠体重按照平均20g/只计算,每天给药1次,连续3天;溶剂对照组给0.5%羧甲基纤维素钠+0.2%吐温80溶液,容量、次数与上相同。
[0081]
④
小鼠处理:最后一次给药48小时后进行安乐死,取胃组织进行幽门螺杆菌的分离培养和鉴定,并计算定植量。
[0082]
(3)结果
[0083]
结果如图5。由图5所示,奥美拉唑加napabucasin组对幽门螺杆菌菌的杀灭明显优于三联治疗组(奥美拉唑加阿莫西林和克拉霉素)(p<0.05)。
[0084]
实施例6 napabucasin对小鼠胃内定植的多重耐药幽门螺杆菌bhks159菌株的杀灭效果检测
[0085]
(1)材料
[0086]
菌株为幽门螺杆菌小鼠驯化菌株bhks159,小鼠为spf级别的6周龄雌性c57bl/6小鼠,其他如实施例1材料。
[0087]
(2)方法
[0088]
①
幽门螺杆菌bhks159菌株感染小鼠的体内模型构建:参考文章(huang y,hang x,jiang x,zeng l,jia j,xie y,li f,bi h.in vitro and in vivo activities of zinc linolenate,a selective antibacterial agent against helicobacter pylori.antimicrob agents chemother[j].2019;63(6):e00004
‑
19)。取10%小鼠胃组织检测幽门螺杆菌定植,定植量范围为1
×
105cfu/g以上认为定植成功,检测结果均有幽门螺杆菌定植,模型构建成功。
[0089]
②
分组:实验组将造模成功的感染组平均分成6组,分别为两组不同给药剂量的奥美拉唑加napabucasin(给药量分别为14和28mg/kg)联用组、两组不同给药剂量的napabucasin(给药量分别为14mg/kg和28mg/kg)组,奥美拉唑加阿莫西林(给药量28mg/kg)和克拉霉素(给药量为14mg/kg)组和溶剂对照组,每组10只;所有组中奥美拉唑的给药量为138.2mg/kg,未感染幽门螺杆菌的8只小鼠为阴性对照组。
[0090]
③
给药:采取灌胃给药法,奥美拉唑先于其他药物前30分钟给药,给药后禁食禁水4小时;每天给药1次,连续3天;溶剂对照组给0.5%羧甲基纤维素钠+0.2%吐温80溶液,容量、次数与上相同。
[0091]
④
小鼠处理:最后一次给药48小时后进行安乐死,眼眶取血离心提取血清,用elisa法检测各炎症因子的含量;取胃组织,一半组织进行幽门螺杆菌的分离培养和鉴定,计算定植量,另一半组织进行病理切片染色。同时每天进行小鼠称重并计算平均体重。
[0092]
(3)结果
[0093]
奥美拉唑加napabucasin联用组(28mg/kg)或napabucasin单药组(28mg/kg)对幽门螺杆菌的杀灭效果明显优于三联治疗组(奥美拉唑加阿莫西林和克拉霉素),如图6。奥美拉唑加napabucasin联用组(28mg/kg)或napabucasin单药组(28mg/kg)中小鼠外周血的炎症因子表达水平较三联治疗组明显下降,如图7,且这两组对小鼠胃粘膜损伤的修复能力也明显优于三联治疗组,如图8。
[0094]
二、napabucasin抗非幽门螺杆菌细菌的作用
[0095]
实施例7 napabucasin体外抗非幽门螺杆菌细菌的活性测定
[0096]
通过测定napabucasin对非幽门螺杆菌细菌的最低抑菌浓度(mic)来确定其抗菌活性。
[0097]
(1)材料
[0098]
①
药品和试剂:napabucasin、甲硝唑和万古霉素购于mce公司。
[0099]
②
菌株:金黄色葡萄球菌atcc 25923和usa300、溶血性葡萄球菌atcc29970、表皮葡萄球菌atcc12228、枯草芽孢杆菌168、蜡样芽孢杆菌atcc14579、单核细胞增生李斯特菌
egd
‑
e、肺炎链球菌atcc49619、粪肠球菌atcc29212、屎肠球菌atcc19434、艰难梭菌atcc700057、痤疮丙酸杆菌atcc11827、牙龈卟啉单胞菌atcc baa
‑
308、伴放线放线杆菌d7s
‑
1、具核梭杆菌atcc25586、空肠弯曲杆菌nctc11168、淋病奈瑟菌atcc19424、流感嗜血杆菌atcc49766、卡他莫拉菌atcc25238、大肠杆菌atcc25922、铜绿假单胞菌pao1、肺炎克雷伯氏菌atcc35657、鲍曼不动杆菌atcc19606、肠沙门氏菌肠亚种atcc14028为标准或模式菌株。
[0100]
③
培养基和主要试剂:mh培养液、mh培养基、脑心浸液培养液、哥伦比亚培养基和fcs。
[0101]
④
主要仪器:恒温培养箱、厌氧培养箱、紫外分光光度计、恒温摇床(thermo)、离心机、电子天平等。
[0102]
(2)方法
[0103]
采用肉汤稀释法检测napabucasin对非幽门螺杆菌细菌的最低抑菌浓度。检测所用培养基、培养液为mh培养基、培养液,菌液浓度约为1.0
×
105cfu/ml,结果判读的时间根据菌株差异选择24或48小时,其他均与实施例1中方法相似。
[0104]
(3)结果
[0105]
见表2。
[0106]
表2.napabucasin对非幽门螺杆菌细菌菌株的最低抑菌浓度(μg/ml)
[0107][0108]
注:“—”表明未检测。
[0109]
由上表所示,napabucasin对革兰氏阳性菌如金黄色葡萄球菌、溶血性葡萄球菌、表皮葡萄球菌、枯草芽孢杆菌、蜡样芽孢杆菌、单核细胞增生李斯特氏菌、肺炎链球菌、艰难梭菌和痤疮丙酸杆菌以及革兰氏阴性菌如牙龈卟啉单胞菌、伴放线放线杆菌、具核梭杆菌、空肠弯曲杆菌、淋病奈瑟菌、流感嗜血杆菌和卡他莫拉菌等,都有抑制生长的作用。
[0110]
三、napabucasin抗真菌的作用
[0111]
实施例8 napabucasin体外抗真菌的活性测定
[0112]
(1)材料
[0113]
①
化学品:napabucasin和两性霉素(amb)购于mce公司。
[0114]
②
菌株:烟曲霉af293、红色毛癣菌atcc mya
‑
4438、白色念珠菌sc5314和atcc14053、近平滑念珠菌atcc22019、光滑念珠菌atcc36583、克鲁斯念珠菌atcc6258、葡萄牙念珠菌atcc200950、热带念珠菌atcc750、新生隐球菌atcc mya
‑
4906和atcc 90112、合轴马拉色菌cbs7222、球形马拉色菌cbs7966、糠秕马拉色菌cbs1878和厚皮马拉色菌cbs1879为标准或模式菌株。其他临床菌株为南京医科大学附属第一医院和附属逸夫医院从临床样本中分离鉴定所得。
[0115]
③
培养基和主要试剂:rpmi1640培养液、沙保弱培养基、fcs、二甲基亚砜(dmso)。
[0116]
(2)方法:借助肉汤稀释法检测napabucasin对多种真菌菌株的最低抑菌浓度(mic,100μl体系)。
[0117]
①
分别配备6.4mg/ml的napabucasin、两性霉素b和氟康唑储存溶液,溶剂均为100%dmso。
[0118]
②
菌液制备:取固体平板上对数期生长的白色念珠菌用rpmi1640培养液制作成菌悬液,调整浓度od
530
为0.5(约1
×
106cfu/ml),稀释1000倍,约为1
×
103cfu/ml,备用。烟曲霉、毛癣菌以及马拉色菌(用加入橄榄油的特定培养基)需要进行显微计数调整菌液浓度;而新生隐球菌调整菌液od
530
为0.5后,稀释10000倍,备用。
[0119]
③
96孔板制备:第一孔先加rpmi1640培养液178μl,再加2μl的napabucasin储存溶液,采用二倍稀释法稀释至第12孔;另外两排孔以同样方法分别加两性霉素b和氟康唑。
[0120]
④
接种菌液:取10μl上述备用菌液加入上述每孔中(每孔菌量浓度约为1.0
×
102cfu/ml)内,药物浓度依次为64μg/ml、32μg/ml、16μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml、0.125μg/ml、0.063μg/ml和0.031μg/ml。另外一排每孔分别加100μlrpmi1640培养液,作为无菌对照组;再一排每孔分别加90μl rpmi1640培养液和10μl上述备用菌液,作为阳性对照组。放置恒温培养箱培养。
[0121]
⑤
结果判断:培养24或48小时后判读结果,以在小孔内完全抑制真菌生长的最低药物浓度为mic。当阳性对照孔(即不含药物)内真菌明显生长以及无菌对照组无菌生长时,试验才有意义。重复3次试验。
[0122]
(3)结果
[0123]
结果见表3。
[0124]
表3.napabucasin对真菌菌株的最低抑菌浓度(μg/ml)
[0125][0126]
注:“—”表明未检测。
[0127]
由上表所示,napabucasin对白色念珠菌、近平滑念珠菌、光滑念珠菌、克鲁斯念珠菌、葡萄牙念珠菌、热带念珠菌、新生隐球菌、烟曲霉、红色毛癣菌和马拉色菌等真菌,都有抑制生长的作用,其抑制活性与两性霉素b相当。
[0128]
实施例9 napabucasin对小鼠全身感染模型中的白色念珠菌sc5314菌株的杀灭作用
[0129]
(1)材料
[0130]
菌株为白色念珠菌sc5314,小鼠为spf级别的8周龄c57bl/6雌性小鼠,药品氟康唑购于mce公司,其他如实施例8材料。
[0131]
(2)方法
[0132]
①
动物造模:将白色念珠菌sc5314菌株在沙氏琼脂培养基中35℃培养24小时后,挑取菌落至rpmi1640培养基中,调整菌液浓度约为5
×
106cfu/ml,离心收集菌体后用等体积pbs重悬。经小鼠内眦静脉丛注射125μl菌液,白色念珠菌经血在小鼠体内扩散,造成小鼠全身感染。
[0133]
②
分组:将造模成功的感染小鼠平均分为3组,分别为溶剂对照组(0.5%羧甲基纤维素钠+0.2%吐温80)、氟康唑治疗组和napabucasin治疗组,每组10只小鼠。
[0134]
③
给药:实验组灌胃给药,感染当天在感染2小时后第1次给药,间隔10小时第2次给药。每天给药2次,连续3天。小鼠体重按照平均20g/只计算。氟康唑和napabucasin的给药量都为56mg/kg/天,对照组给予溶剂,容量、次数同上。
[0135]
④
小鼠处理:最后一次给药24小时后,进行安乐死,取脾和肾组织,进行白色念珠菌分离培养和鉴定,并计算定植量。
[0136]
(3)结果
[0137]
napabucasin和氟康唑均能显著降低白色念珠菌全身感染小鼠脾脏和肾脏中的真菌载量(p<0.01),且氟康唑治疗组和napabucasin治疗组的效果相当,如图9。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1