3,6’-二芥子酰基蔗糖在制备治疗2型糖尿病的药物中的应用
3,6
’‑
二芥子酰基蔗糖在制备治疗2型糖尿病的药物中的应用
技术领域
1.本发明涉及化合物的新的应用技术领域,具体而言,涉及3,6
’‑
二芥子酰基蔗糖在制备治疗2型糖尿病的药物中的应用。
背景技术:
2.糖尿病(diabetes mellitus,dm)是一种复杂的慢性内分泌代谢性疾病,它可能由自由基毒素、遗传因素、免疫功能紊乱、精神因素等各种致病因子作用于机体导致胰岛功能减退、胰岛素抵抗(insulin resistance,ir)等病变从而引发糖、蛋白质、脂肪、水和电解质等一系列代谢紊乱。现有技术一般将糖尿病分为了ⅰ型糖尿病(胰岛素依赖型糖尿病)、ⅱ型糖尿病(t2dm)、其他特殊类型糖尿病和妊娠糖尿病。而根据最新对t2dm的发病机制的研究认为,胰高血糖素的异常增加是t2dm发病的真正原因,通过调控胰高血糖素能够有效治疗t2dm。
3.鉴于此,特提出本发明。
技术实现要素:
4.本发明的目的在于提供3,6
’‑
二芥子酰基蔗糖在制备治疗2型糖尿病的药物中的应用。本发明实施例发现3,6
’‑
二芥子酰基蔗糖能够与胰高血糖素竞争结合胰高血糖素受体,继而能够有效抑制或者拮抗胰高血糖素的作用,继而可以治疗2型糖尿病。
5.本发明是这样实现的:
6.第一方面,本发明提供一种3,6
’‑
二芥子酰基蔗糖在制备治疗2型糖尿病的药物中的应用。该3,6
’‑
二芥子酰基蔗糖的结构式如下所示:
[0007][0008]
在可选的实施方式中,所述3,6
’‑
二芥子酰基蔗糖的制备包括:对远志进行提取,而后分离得到所述3,6
’‑
二芥子酰基蔗糖。该3,6
’‑
二芥子酰基蔗糖可以是从远志中提取也可以是从其他含有3,6
’‑
二芥子酰基蔗糖的天然产物中提取得到,也可以直接购买得到,或者采用化学合成的方法合成得到。
[0009]
在可选的实施方式中,所述3,6
’‑
二芥子酰基蔗糖的制备包括:将所述远志与溶剂混合在超声条件下进行提取,而后分离得到所述3,6
’‑
二芥子酰基蔗糖。从远志内提取3,6
’‑
二芥子酰基蔗糖可以采用上述超声进行提取,也可以采用其他提取方法。且分离纯化的
方法可以是柱层析分离、重结晶以及高效液相分离等现有常规的分离纯化方法,本发明实施例不再进行详述。
[0010]
在可选的实施方式中,提取条件为:超声时间为40
‑
50分钟,例如可以为40分钟、45分钟以及50分钟等40
‑
50分钟之间的任意数值;所述远志和所述溶剂的料液比为1:20
‑
40,例如可以为1:20、1:25、1:30、1:35、以及1:40等1:20
‑
40之间的任意比例;所述溶剂为醇
‑
水溶剂。
[0011]
在可选的实施方式中,超声时间为45分钟,所述远志和所述溶剂的料液比为1:30,所述溶剂为一元醇水溶剂;
[0012]
在可选的实施方式中,所述溶剂为甲醇水溶剂,除了采用甲醇水溶剂,还可以采用乙醇水溶剂等。
[0013]
在可选的实施方式中,所述溶剂为甲醇体积分数为50
‑
90%的甲醇水溶剂,优选为甲醇体积分数为90%的甲醇水溶剂。
[0014]
在可选的实施方式中,所述药物为拮抗胰高血糖素的药物。
[0015]
第二方面,本发明提供一种3,6
’‑
二芥子酰基蔗糖在制备拮抗胰高血糖素的拮抗剂中的应用。
[0016]
第三方面,本发明提供一种3,6
’‑
二芥子酰基蔗糖在制备胰高血糖素过高导致的疾病的药物中的应用。
[0017]
本发明具有以下有益效果:本发明实施例发现3,6
’‑
二芥子酰基蔗糖可以有效与胰高血糖素竞争结合胰高血糖素受体,继而能够有效抑制或者拮抗胰高血糖素的作用,继而可以治疗2型糖尿病,扩大了治疗2型糖尿病的活性成分的选择,也扩大了3,6
’‑
二芥子酰基蔗糖的应用范围。
附图说明
[0018]
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
[0019]
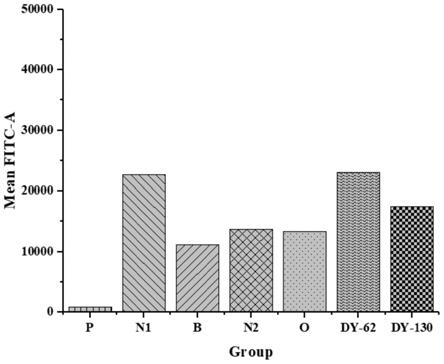
图1为本发明提供的实验例1的检测结果;
[0020]
图2为本发明提供的实验例2的5xez
‑
97v蛋白配体复合物的示意图;
[0021]
图3为本发明提供的实验例2的a链与97v结合情况及b链与97v结合情况示意图;
[0022]
图4为本发明提供的实验例2的5xez
‑
97v a链蛋白配体复合物的示意图;
[0023]
图5为本发明提供的实验例2的下载的97v与新计算的97v契合度示意图;
[0024]
图6为本发明提供的实验例2的dy
‑
130的分子对接的结果图;
[0025]
图7为本发明提供的实验例2的dy
‑
62的分子对接的结果图。
具体实施方式
[0026]
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产
品。
[0027]
以下结合实施例对本发明的特征和性能作进一步的详细描述。
[0028]
实施例1
[0029]
本发明实施例提供一种3,6
’‑
二芥子酰基蔗糖的制备方法,包括:
[0030]
将远志(过40目筛)1.0g,精密称定,置具塞锥形瓶中,精密加入70%甲醇(体积百分数)25ml,称定重量,超声1h(500w,40khz),静置冷却后,再称定重量,用70%甲醇补足减失的重量。摇匀,滤过,取续滤液经微孔滤膜过滤,即得3,6
‑
二芥子酰基蔗糖粗品。
[0031]
取上述制得的3,6
‑
二芥子酰基蔗糖粗品,在45
‑
50℃水浴下旋蒸40min左右,而后进行分离纯化得最终产品,在产品中加入甲醇定容至10ml。
[0032]
实验例1
[0033]
细胞:hek
‑
293细胞;
[0034]
实验药物:3,6
’‑
二芥子酰基蔗糖记为:dy
‑
130(购自成都德思特生物技术有限公司公司);穗花杉双黄酮记为dy
‑
62(购自成都德思特生物技术有限公司公司);
[0035]
质粒构建:pcr扩增出基因的cds区,使用2
×
accuproof hifi hotstart supermix试剂盒,体系条件如下表:
[0036][0037][0038]
使用omega gel extraction kit试剂盒将pcr产物琼脂糖凝胶电泳,并对目的条带切胶回收。
[0039]
pcdna3.1载体酶切反应,在37℃条件下保持3h,体系条件如下表:
[0040][0041]
使用omega gel extraction kit试剂盒将酶切产物琼脂糖凝胶电泳,并对目的条带切胶回收。
[0042]
重组反应:使用exonart seamless cloning and assembly kit试剂盒使载体和
基因重组。在50℃条件下保持20min,体系条件下表:
[0043][0044]
重组产物转化:使用xl2
‑
blue感受态进行转化。从液氮中取一支感受态放置冰上解冻;大约3min后加入步骤6中重组产物15μl,轻轻吹打2~3下后放置冰上孵育30min;用45℃金属浴热激45sec,马上静置冰上约3min,全部转入800μl soc培养基中37℃200rpm摇45~60min;将其全部或取部分涂板(含羧苄)置于37℃培养箱过夜。
[0045]
挑单菌落做菌落pcr检测阳性克隆:使用2
×
taq advanced pcr master mix试剂盒,体系条件如下表:
[0046][0047]
将菌落pcr产物电泳,选取阳性克隆送样测序,得到正确序列的质粒将其进行大肠杆菌质粒扩增得到所需数量,分装保存在
‑
20℃冰箱中备用(分装质粒是为了避免质粒反复冻存影响质粒效果)。
[0048]
细胞转染:
[0049]
(1)细胞换液:将预先孵育的6孔板细胞换液,换为不含血清不含双抗的培养基,因为在血清存在下可能会影响转染效率。
[0050]
(2)配制质粒转染试剂复合物:取250μl无血清无双抗培养基于ep管1中,加入4μg质粒,轻轻混匀;取250μl无血清无双抗培养基于ep管2管中,加入10μl转染试剂混匀。等待10min后将ep1和ep2混匀轻轻吹打,在室温下孵育30min。
[0051]
(3)转染:取出六孔板,将质粒转染试剂复合物均匀缓慢滴加至六孔板中,轻轻摇晃六孔板使其混匀,放入37℃,5%co2培养箱中培养,孔板中的对照组不做任何处理。
[0052]
(4)换液培养:培养4h后,吸出含有转染复合物的培养基,加入pbs洗一遍,吸出pbs后加入2ml含10%血清的培养基置于37℃,5%co2培养箱培养48小时。
[0053]
rna提取:
[0054]
样品的研磨和匀浆:
[0055]
(1)吸出六孔板中原培养基,加入pbs冲洗一遍;
[0056]
(2)加入1.5ml rnaiso plus,轻轻晃动六孔板;
[0057]
(3)将内含细胞的裂解液转移至离心管中,用移液枪反复吹吸直至裂解液中无明显沉淀;
[0058]
(4)室温(15
‑
30℃)静置5min,然后从核蛋白中分离rna。
[0059]
total rna的提取:
[0060]
(1)向上述的匀浆裂解液中加入氯仿(rnaiso plus的1/5体积量),盖紧离心管盖,混合至溶液乳化呈乳白色,静置5min;
[0061]
(2)1200r/min 4℃离心15min。从离心机中小心取出离心管,此时匀浆液分为三层,即:无色的上清液(含rna)、中间的白色蛋白层(大部分为dna)及带有颜色的下层有机相;
[0062]
(3)吸取上清液转移至另一新的离心管中(切勿吸出白色中间层);
[0063]
(4)向上清中加入0.5
‑
1倍rnaiso plus体积的异丙醇,上下颠倒离心管充分混匀后,室温下静置10min;
[0064]
(5)1200r/min 4℃离心10min,在离心后,试管底部会出现rna沉淀。
[0065]
rna沉淀的清洗:小心弃去上清,切勿触及沉淀,残留少量异丙醇没有关系。加入与rnaiso plus等量的75%乙醇,轻轻上下颠倒洗涤离心管管壁,7500r/min 4℃离心5min后小心弃去上清,切勿触及沉淀。
[0066]
rna的溶解:打开离心管盖,室温干燥沉淀几分钟。沉淀干燥后,加入适量的rnase
‑
free水溶解沉淀。
[0067]
荧光定量pcr检测:首先将经过trizol提取的rna用逆转录试剂盒逆转录为cdna;其次将已经逆转录的cdna用水稀释五倍后作为qpcr模板。其中,进行扩增的反应体系当中的所用试剂如下表所示。
[0068][0069]
荧光探针溶液配制:用无水dmso配制荧光探针,使其为终浓度为2mm的储备液,储备液避光
‑
20℃保存备用。使用前将储备液用hbss(无酚红,无钙镁)稀释为4μm的工作液备用,在探针溶液中加入pluronic f127,pluronic f127可以防止fluo
‑
4,am在hbss中聚合并能帮助其进入细胞。
[0070]
分组:(1)阴性对照组(n1)(已转染细胞只加入胰高血糖素,经fluo
‑
4am处理)3组:给药量分别为10μl的0.1μm、0.2μm、0.5μm;
[0071]
(2)阴性对照组(n2)(未转染细胞只加入胰高血糖素,经fluo
‑
4 am处理)3组:给药
量分别为10μl的0.1μm、0.2μm、0.5μm;
[0072]
(3)空白对照组1组(b)(经fluo
‑
4 am处理):已转染细胞不加胰高血糖素;
[0073]
(4)原始对照组1组(p)(不经fluo
‑
4 am处理):未转染细胞不加胰高血糖素;
[0074]
(5)阳性对照组(o)(已转染细胞,经fluo
‑
4 am处理)1组:同时加入已知的拮抗剂gra(0.1μm)10μl与胰高血糖素(0.1μm)10μl。
[0075]
(6)dy
‑
130组:0.5μm(10μl)dy
‑
130作为胰高血糖素的最佳实验给药量。
[0076]
(7)dy
‑
62组:0.5μm(10μl)dy
‑
62作为胰高血糖素的最佳实验给药量。
[0077]
所有组别均是在96孔板中进行,每孔接种3
×
104个细胞,再按照设置的组别分别给药,给药后在培养箱中孵育2
‑
4h。
[0078]
荧光探针装载:孵育完成后,吸除96孔板中的药物。
[0079]
(1)加入fluo
‑
4 am工作液(4μmol/l)至覆盖细胞,室温避光孵育30
‑
40min;
[0080]
(2)除去fluo
‑
4 am工作液,用hbss清洗细胞;
[0081]
(3)加入含10%血清hbss至覆盖细胞,室温避光孵育20
‑
30min。
[0082]
其中,fluo
‑
4 am的激发波长为494nm,发射波长为516nm,根据实际测试将激发波长调至484nm。
[0083]
检测荧光强度:将已经进行荧光探针装载的1x105的细胞放入1.5ml离心管中3000r/min离心5分钟,弃上清;加入facs缓冲液100μl悬浮细胞;将细胞悬液移入facs专用管中,准备进行仪器检测和分析,每组实验重复3次取其平均值。
[0084]
采用荧光检测的原理:胰高血糖素与胰高血糖素受体特异性结合,刺激钙离子通道打开从而促进细胞内钙离子浓度增加。当拮抗剂与胰高血糖素受体竞争性结合后,就会减少胞内钙离子浓度,拮抗胰高血糖素。用荧光值来表征胞内钙离子相对浓度,来实现化合物对胰高血糖素受体拮抗程度的评价。
[0085]
结果参见图1,根据图1可知,当样品组的荧光值低于n1组(阴性对照组)的荧光值,便可说明样品可以与胰高血糖素竞争结合胰高血糖素受体,样品组dy
‑
130的荧光值小于阴性对照组n1,对胰高血糖素有一定的拮抗效果;dy
‑
62的荧光值大于阴性对照组n1,对胰高血糖素无拮抗效果,揭示了3,6
’‑
二芥子酰基蔗糖可以作为胰高血糖素的拮抗剂,继而治疗2性糖尿病。
[0086]
实验例2
[0087]
采用autodock模拟分子对接,具体地:
[0088]
蛋白质gcgr的准备:
[0089]
(1)gcgr的pdb格式下载:将所需要的蛋白质gcgr从rcsb pdb网页中下载,其中蛋白质gcgr的pdb编号为5xez,在rcsb pdb网页中输入5xez搜索目标蛋白,下载其pdb格式备用。
[0090]
(2)gcgr蛋白修饰:将5xez的pdb文件导入到pymol软件中,由于下载的gcgr是蛋白与配体小分子的复合物结构(5xez
‑
97v),如图2,并且一个5xez受体蛋白分别在a链和b链结合一个97v分子。
[0091]
(3)a、b链氨基酸序列和97v结合的周围氨基酸比较:经过pymol中分别显示97v结合情况以及周边作用的氨基酸,发现a、b链中97v的结合环境几乎相同,如图3。为了加快运算速度,选择a链进行分子对接,如图4。在pymol将5xez进行蛋白修饰,删除不需要的链,留
下完整的a链进行计算,并且将小分子97v剔除,留出结合口袋,保存5xez a链为pdb格式,保存97v小分子为pdb格式。
[0092]
(4)gcgr结合口袋确定:在autodock tools中打开5xeza,去除水分子,加氢,补全其电荷,保存为pdbqt格式,将其设为目标蛋白;打开97v小分子,将97v补全电荷和氢原子,选为配体小分子,保存为pdbqt格式;将grid box的口袋中心设置为以小分子配体为中心(45.117,12.09,
‑
16.915),盒子大小为(40,40,40)。
[0093]
(5)验证盒子大小是否可用:由于autodock中的spacing为0.375,而计算软件vina的spacing为1,则需将autodock中的盒子大小乘以0.375放入vina中计算,于是盒子中心为(45.117,12.09,
‑
16.915),盒子大小为(15,15,15)。新下载一个97v分子进行计算与原复合物结合比较,发现契合度不够,于是稍微改变盒子大小和中心,最终得到与原配体契合度较高的计算结果(如图5),此时盒子中心为(45.117,12.483,
‑
15.686),盒子大小为(17,17,17),以此盒子中心和大小为最终对接数据。
[0094]
准备小分子dy
‑
130和dy
‑
62:从pubchem网站中下载小分子的sdf格式备用;将小分子sdf格式导入到chem 3d中另存为mol2格式;将小分子mol2格式导入到autodock tools中,添加电荷和氢原子,将小分子选中为配体,并且将小分子配体输出为pdbqt格式备用。
[0095]
分子对接:
[0096]“windows+r”打开电脑命令界面,输入cmd后确定进入命令界面;在桌面新建一个文件夹(docking)用于计算结果和所需配体的保存;将文件夹的位置复制,粘贴到命令窗口中后确定用以定位计算文件夹;将计算软件vina的位置复制下来,粘贴至命令窗口后确定以打开计算软件vina;在docking文件夹中创建一个名为conf的记事本文件,其中输入对接蛋白名称及格式,配体名称及格式,蛋白质中心位置和对接盒子大小并保存。开始分子对接,结束后输出结果在记事本中为txt格式,对接结果结构输出为pdbqt格式文件。
[0097]
对接结果参见下表和图6
‑
图7。
[0098]
[0099][0100]
根据上述结果可知,dy
‑
130与gcgr形成了9个氢键,其中dy
‑
130的o17,o19原子与arg346形成两个氢键,键长分别为o17,o19原子与lys405形成两个氢键,键长分别为o18原子与asn404形成氢键,键长为o2,o3,o4,o12原子与thr353形成四个氢键,键长分别为dy
‑
62与gcgr形成了4个氢键,其中dy
‑
62的o6,o7原子与lys405形成两个氢键,键长分别为o6原子与arg346形成氢键,键长为o7原子与leu403形成氢键,键长为说明dy
‑
130能够成功对接,且结合较为牢固,而dy
‑
62虽然能够对接,但是结合不牢固,不能在细胞里与以胰高血糖素竞争,不能拮抗胰高血糖素,进一步说明dy
‑
130能够拮抗胰高血糖素,继而治疗2型糖尿病。
[0101]
实验例3
[0102]
提取3,6
‑
二芥子酰基蔗糖的条件的研究;
[0103]
所涉及的变量以及对应变量设计的参数见下表。
[0104][0105][0106]
结果如下表:
[0107][0108]
注:k为同一水平提取率的平均值;r为极差
[0109]
由上述结果可知:超声法提取远志中3,6
‑
二芥子酰基蔗糖的九组实验的提取率,以提取率为指标进行极差分析,得出影响提取率的因素主次顺序为料液比>超声时间>甲醇的体积分数,三个因素各自所考察的3个水平中,最优水平分别为a2,b2,c3,三因素三水平的最优组合为a2b2c3。
[0110]
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1