丹参酮IIA磺酸钠注射液在制备抗病毒的药物中的应用
丹参酮iia磺酸钠注射液在制备抗病毒的药物中的应用
技术领域
1.本发明属于药学技术领域,具体涉及一种丹参酮iia磺酸钠注射液在制备抗病毒的药物中的应用。
背景技术:
2.新型冠状病毒(sars
‑
cov
‑
2)是一种正义单链rna病毒,属于冠状病毒科β冠状病毒属。sars
‑
cov
‑
2刺突蛋白(spike protein,s)是病毒感染细胞的关键蛋白,在病毒的宿主嗜性和毒力等方面发挥重要作用。s蛋白在宿主细胞蛋白酶的作用下裂解成s1和s2亚基,其中s1特异性识别与结合宿主细胞表面受体血管紧张素转化酶2(ace2),s2亚基介导病毒和细胞膜融合。因此,s蛋白抑制剂可以阻止病毒进入宿主细胞,s1和s2亚基可作为抗病毒药物筛选的靶点。日前,covid
‑
19仍无特效药物可以治疗,需继续探索新的治疗药物或手段。
3.丹参为唇形科植物丹参salviamiltiorrhiza bge.的干燥根及根茎,始载于《神农本草经》,历代本草均有收载。其味苦,性微寒,归心、肝二经。具祛瘀止痛,活血通经,清心除烦之功效。丹参为活血化瘀的中药,其常用制剂主要用于治疗心脑血管疾病。丹参的化学成分为水溶性酚酸和酯溶性二萜醌。丹参的酯溶性成分中含有丹参酮iia、隐丹酮及其它。其中丹参酮iia药理作用广泛,临床可用于治疗冠心病心绞痛、心肌梗塞、病毒性心肌炎、心律失常、脑血管病、肝炎、肺心病、支气管哮喘、肿瘤、肾炎、肾病综合征、肾功能不全、眼科疾病、高血压、骨折、烧伤、外科手术或白塞氏综合症等等病症的治疗。
4.目前国内已公布丹参酮iia磺酸钠注射液生产的国家标准,标准号为ws
‑
10001
‑
(hd
‑
1014)
‑
2002,规格为2ml:10mg,本品能增加冠脉流量,改善缺血区心肌的侧枝循环及局部供血。改善缺氧心肌的代谢紊乱,提高心肌耐缺氧能力,抑制血小板聚集及抗血栓形成,缩小实验动物缺血心肌梗死面积,在一定剂量下能增强心肌收缩力,用于冠心病、心绞痛。丹参酮iia磺酸钠注射液在抗病毒领域未曾被研究。
技术实现要素:
5.本发明目的在于提供一种新型的抗病毒的药物。
6.为了达到上述目的,本发明所采用的技术方案为:
7.本发明一方面提供了一种丹参酮iia或其药物可接受盐在制备抗病毒的药物中的应用。
8.本发明另一方面提供了一种丹参酮iia或其药物可接受盐在制备抑制病毒进入靶细胞的药物中的应用。
9.本发明再一方面提供了一种丹参酮iia磺酸钠注射液在制备抗病毒的药物中的应用。
10.本发明再一方面提供了一种丹参酮iia磺酸钠注射液和其他抗病毒药物联用在制备抗病毒的药物中的应用。
11.本发明再一方面提供了一种丹参酮iia磺酸钠注射液在制备抑制病毒进入靶细胞
的药物中的应用。
12.本发明再一方面提供了一种丹参酮iia磺酸钠注射液和其他抗病毒药物联用在制备抑制病毒进入靶细胞的药物中的应用。
13.进一步地,所述丹参酮iia磺酸钠注射液为丹参酮iia磺酸钠的灭菌水溶液,所述丹参酮iia磺酸钠的结构式为:
[0014][0015]
进一步地,所述病毒包括冠状病毒。
[0016]
进一步地,所述冠状病毒包括sars
‑
cov、sars
‑
cov
‑
2、mers
‑
cov。
[0017]
进一步地,所述冠状病毒为sars
‑
cov
‑
2。
[0018]
本发明具有以下有益效果:
[0019]
本发明首次发现丹参酮iia、丹参酮iia磺酸钠注射液在制备抗病毒的药物中的应用,提供存在慢性基础疾病的新冠感染者新的治疗手段,该应用扩大了丹参酮iia、丹参酮iia磺酸钠注射液的使用范围,且为病毒抑制,特别是在全球sars
‑
cov
‑
2流行的情况下,为治疗新冠病毒感染所致肺炎(covid
‑
19)提供新的药物。
[0020]
本发明丹参酮iia磺酸钠注射液、丹参酮iia作为抗病毒药物,实验表明:在体外培养细胞vero
‑
e6感染模型上,丹参酮iia磺酸钠注射液抗sars
‑
cov
‑
2活性的半数有效浓度ec
50
为13.36μg/ml;丹参酮iia磺酸钠注射液用于抑制sars
‑
cov
‑
2的进入阶段,可抑制sars
‑
cov
‑
2假病毒活性,ic
50
为14.99μg/ml;此外,丹参酮iia(tanshinone iia,t
‑
iia)抑制sars
‑
cov
‑
2的ec
50
为2.51μm。丹参酮iia及丹参酮iia磺酸钠注射液在有效浓度范围内未见其明显的细胞毒性。因此可用作抗sars
‑
cov
‑
2药物的制备,本发明具有较大临床应用价值。
附图说明
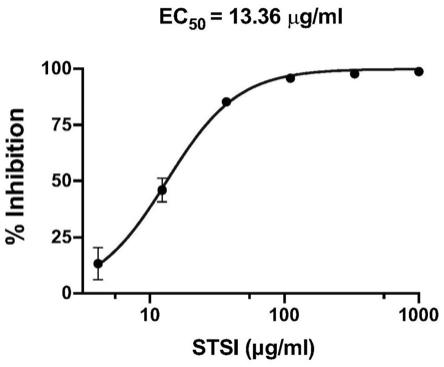
[0021]
图1为本发明实施例1中丹参酮iia磺酸钠注射液(stsi)剂量依赖性抑制sars
‑
cov
‑
2感染vero
‑
e6细胞的抑制率曲线图,其中横坐标代表丹参酮iia磺酸钠注射液浓度,纵坐标代表以溶剂组为对照,丹参酮iia磺酸钠注射液对sars
‑
cov
‑
2的抑制率,并根据抑制率计算求出丹参酮iia磺酸钠注射液抑制sars
‑
cov
‑
2的半数有效浓度ec
50
值。
[0022]
图2为本发明实施例2中丹参酮iia磺酸钠注射液(stsi)剂量依赖性抑制sars
‑
cov
‑
2假病毒入侵293t/ace2细胞的抑制率曲线图,其中横坐标代表丹参酮iia磺酸钠注射液浓度,纵坐标代表以溶剂组为对照,丹参酮iia磺酸钠注射液抑制sars
‑
cov
‑
2假病毒进入的抑制率,并求得丹参酮iia磺酸钠注射液抑制sars
‑
cov
‑
2假病毒进入的半数抑制浓度ic
50
值。
[0023]
图3为本发明实施例3中丹参酮iia(t
‑
iia)浓度依赖性抑制sars
‑
cov
‑
2感染vero
‑
e6细胞的ec
50
值曲线图,其中横坐标代表丹参酮iia浓度,纵坐标代表以溶剂组为对照,丹参
酮iia对sars
‑
cov
‑
2感染的抑制率,并根据抑制率计算求出丹参酮iia抑制sars
‑
cov
‑
2的半数有效浓度ec
50
值。
[0024]
图4为本发明实施例4中丹参酮iia磺酸钠注射液(stsi)对靶细胞vero
‑
e6细胞的存活率曲线图,其中横坐标代表丹参酮iia磺酸钠注射液浓度,纵坐标代表以溶剂组为对照、vero
‑
e6细胞在给予不同浓度丹参酮iia磺酸钠注射液后的细胞存活百分比。
[0025]
图5为本发明实施例4中丹参酮iia磺酸钠注射液(stsi)对靶细胞293t/ace2细胞的存活率曲线图,其中横坐标代表丹参酮iia磺酸钠注射液浓度,纵坐标代表以溶剂组为对照、293t/ace2细胞在给予不同浓度丹参酮iia磺酸钠注射液后的细胞存活百分比。
[0026]
图6为本发明实施例4中丹参酮iia(t
‑
iia)对靶细胞vero
‑
e6细胞的存活率曲线图,其中横坐标代表丹参酮iia浓度,纵坐标代表以溶剂组为对照、vero
‑
e6细胞在给予不同浓度丹参酮iia后的细胞存活百分比。
具体实施方式
[0027]
为了更好地理解本发明的内容,下面结合附图和具体实施方法对本发明内容作进一步说明,但本发明的保护内容不局限于以下实施例。
[0028]
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本发明说明书中所使用的术语只是为了描述具体的实施例的目的,不限制于本发明。
[0029]
以下实施例主要通过构建sars
‑
cov
‑
2活毒与sars
‑
cov
‑
2假病毒体外细胞感染模型,来评价丹参酮iia磺酸钠注射液、丹参酮iia的抗sars
‑
cov
‑
2感染活性,并确证丹参酮iia磺酸钠注射液、丹参酮iia具有抗sars
‑
cov
‑
2感染的能力,同时丹参酮iia磺酸钠注射液抑制sars
‑
cov
‑
2进入靶细胞的过程,提供一种丹参酮iia磺酸钠注射液、丹参酮iia在制备抗新型冠状病毒药物中的应用。
[0030]
本发明采用的vero
‑
e6、293t细胞购自美国atcc,稳定过表达人源sars
‑
cov
‑
2受体蛋白ace2的293t细胞由南方医科大学构建保存。
[0031]
本发明实施例中采用的细胞生长培养液组成为:dmem基础培养基,其中添加总体积10%的胎牛血清和总体积1%的氨苄霉素/链霉素,培养液于4℃储存,使用前37℃水浴预热。
[0032]
本发明实施例中采用的丹参酮iia磺酸钠注射液是由上海第一生化药业有限公司生产,每盒6支装,每只2ml 10mg(含丹参酮iia 10mg)。执行标准为国家食品药品监督管理局标准ws
‑
10001
‑
(hd
‑
1014)
‑
2002,国药准字h31022558。
[0033]
本发明实施例中采用的丹参酮iia购自上海陶素生化科技有限公司,纯度>99%。
[0034]
本发明实施例中采用的sars
‑
cov
‑
2由武汉病毒研究所于感染者体内分离并扩增保存。
[0035]
本发明实施例中假病毒包装质粒及其来源:假病毒包装骨架质粒pnl4
‑
3.luc.r
‑
e
‑
为南方医科大学鉴定保存,已公开的优化后的全长sars
‑
cov
‑
2s蛋白核心质粒pcdna3.1
‑
sars
‑
cov
‑2‑
sipke由上海复旦大学陆路教授惠赠。
[0036]
本发明实施例中采用的荧光素酶检测试剂盒购自美国promega公司,包括荧光素酶底物及细胞裂解液。
[0037]
本发明实施例中采用的takara minibest viral rna/dna extraction kit、takara primescripttm rt reagent kit with gdna eraser、takara tbpremix ex taq
tm iitlirnaseh plus均购自takara。
[0038]
药理实验部分
[0039]
实施例1丹参酮iia磺酸钠注射液体外抗sars
‑
cov
‑
2的活性检测
[0040]
1、方法:
[0041]
1)将对数生长期的vero
‑
e6细胞接种于48孔板,3*10^5个细胞/孔,37℃、5%co2过夜培养。
[0042]
2)药物预孵:采用含总体积2%胎牛血清的dmem培养基稀释药物。丹参酮iia磺酸钠注射液(stsi)初始浓度设置为1000μg/ml(溶剂为灭菌水),三倍倍比稀释药物,每个浓度药物设置3个复孔,共6个药物梯度(1000、333.33、111.11、37.04、12.35、4.12μg/ml)。设置溶剂灭菌水作为对照,对照组采用含总体积2%胎牛血清的dmem培养基稀释,给予药物同体积的灭菌水。去除细胞上清后1)中48孔板中的实验组每孔加入100μl稀释后的药物,对照组加入100μl稀释后的灭菌水,置37℃孵育1h。
[0043]
3)病毒感染:48孔板每孔加入5μl sars
‑
cov
‑
2病毒稀释液(感染复数moi=0.05),并置细胞于37℃继续孵育1h。
[0044]
4)换液:充分去除感染物上清,细胞用200μl pbs洗一遍。重新在每孔加入200μl含对应浓度药物的培养基,继续于37℃中培养24h后收取150μl细胞培养上清待测。采用qrt
‑
pcr测定上清中病毒的拷贝数,评价药物的抗sars
‑
cov
‑
2活毒的能力。
[0045]
5)病毒rna提取具体操作方法参照takara minibest viral rna/dna extraction kit(code no.9766):
[0046]
a)病毒的裂解:在150μl细胞培养上清中,加入50μl pbs(ph7.4)溶液补足至200μl。随后加入200μl的buffer vgb、20μl的proteinase k和1.0μl的carrier rna,充分混匀,于56℃水浴温浴10分钟充分裂解。向裂解液中加入200μl无水乙醇,充分吸打混匀。
[0047]
b)将spin column安置于collection tube上,溶液移至spin column中,12,000rpm离心2分钟,弃滤液。
[0048]
c)将500μl的buffer rwa加入至spin column中,12,000rpm离心1分钟,弃滤液。
[0049]
d)将700μl的buffer rwb加入至spin column中,12,000rpm离心1分钟,弃滤液。(buffer rwb中已经加入了指定体积的100%乙醇)。沿spin column管壁四周加入buffer rwb,这样有助于完全冲洗沾附于管壁上的盐份。
[0050]
e)重复操作步骤d。
[0051]
f)将spin column安置于collection tube上,12,000rpm离心2分钟。
[0052]
g)将spin column安置于新的1.5ml rnase free collection tube上,在spin column膜的中央处加入30μl的rnase free dh2o,室温静置5分钟。12,000rpm离心2分钟洗脱rna。
[0053]
6)病毒rna逆转录具体操作方法(参照takara primescripttm rt reagent kit with gdna eraser,code no.rr047a):
[0054]
a)去除基因组dna反应:按如下成分于冰上配制反应混合液
[0055][0056][0057]
将样品置于42℃反应2min。
[0058]
b)逆转录反应体系:冰上配置
[0059]
试剂体积(μl)步骤1的反应液10.0primescript rt enzyme mix i1.0rt primer mix1.05
×
primescript buffer 2(for real time)4.0rnase free dh2o补齐至20.0
[0060]
将样品置于37℃温育15min,然后置于85℃加热5sec。
[0061]
7)采用qpcr检测病毒拷贝数:参照takara tbpremix ex taq
tm ii(tlirnaseh plus,code no.rr820a)(采用标准曲线法:用已知拷贝数的rbd质粒做标准品,特异性引物靶向rbd)。按照如下成分于冰上配置反应液:
[0062]
试剂使用量(μl)tb green premix ex taq ii(tli rnaseh plus)(2x)10forward primer(10μm)1reverse primer(10μm)1rox reference dye(50x)0.4cdna模板1灭菌水6.6total volume20
[0063]
引物序列如下:
[0064]
rbd上游引物(forward primer):caatggtttaacaggcacagg(seq id no:1)
[0065]
rbd下游引物(reverse primer):ctcaagtgtctgtggatcacg(seq id no:2)
[0066]
根据两步法pcr扩增标准程序,在abi7500定量pcr仪上完成检测:
[0067]
stage 1:预变性、reps:1个循环、95℃,30s;
[0068]
stage 2:pcr反应、reps:40个循环、95℃,5s;
[0069]
退火:60℃,30~34秒。
[0070]
2、结果:如图1所示;
[0071]
根据标准曲线,计算出每个样品的拷贝数。以灭菌水组拷贝数作为参照,计算药物处理组抑制率。再根据不同浓度药物处理组抑制率,运用prism8.0软件,拟合出药物抑制率
曲线,并计算出丹参酮iia磺酸钠注射液作用于sars
‑
cov
‑
2活性的半数有效浓度ec
50
为13.36μg/ml。
[0072]
实施例2丹参酮iia磺酸钠注射液对sars
‑
cov
‑
2假病毒进入的抑制活性检测
[0073]
1、方法:
[0074]
1)sars
‑
cov
‑
2(pnl4
‑
3.luc.r
‑
e
‑
pcdna3.1
‑
sars
‑
cov
‑2‑
sipke)假病毒包装:
[0075]
对数生长期的hek
‑
293t细胞4*10^5个/ml,2ml每孔均匀接种于6孔板中。37℃、5%co2细胞培养箱中培养过夜。转染前1小时更换新鲜培养基,分别采用100μl空白dmem培养基配制质粒稀释液及转染试剂(polyjet)稀释液,每孔配制比例如下(质粒dna需采用去内毒素的提取试剂盒抽提):
[0076]
pnl4
‑
3.luc.r
‑
e
‑ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
1000ng
[0077]
pcdna3.1
‑
sars
‑
cov
‑2‑
sipke
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
500ng
[0078]
polyjet
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
6μl
[0079]
具体配制方法如下:pnl4
‑
3.luc.r
‑
e
‑
质粒与pcdna3.1
‑
sars
‑
cov
‑2‑
sipke质粒同时加入到100μl空白dmem培养基中混匀,polyjet采用100μl空白dmem培养基稀释混匀。将polyjet稀释液加入质粒稀释液中并混匀,室温孵育15分钟,均匀的添加至hek
‑
293t细胞中,37℃培养48小时后收集上清病毒液,4000rpm离心10分钟,0.45μm无菌滤头过滤,即得到sars
‑
cov
‑
2假病毒。
[0080]
2)假病毒抑制实验:
[0081]
药物与假病毒作用:取对数生长期过表达sars
‑
cov
‑
2受体ace2的293t细胞(293t/ace2),按1*10^4个/孔均匀铺于96孔细胞板中。37℃细胞培养箱中培养过夜。
[0082]
丹参酮iia磺酸钠注射液初始浓度设置为50μg/ml,给药前采用含总体积2%胎牛血清的dmem培养基2倍倍比稀释8个浓度梯度(50、25、12.5、6.25、3.13、1.57、0.78、0.39μg/ml),每孔60μl,每个浓度3个复孔,设置灭菌水溶剂对照组。将60μl假病毒加入稀释后的药物中,混匀室温作用30分钟,取100μl/孔添加至293t/ace2细胞中,37℃培养48小时。
[0083]
检测:去除培养基,200μl/孔无菌pbs(ph7.4)洗涤细胞一次,每孔加入40μl 1x细胞裂解液,室温震荡裂解15分钟。转移30μl/孔裂解上清到96孔白色酶标板中,按照单荧光素酶检测试剂盒说明书加等体积稀释后的荧光素酶底物,立即进行酶标仪检测荧光值,根据荧光值大小,判断丹参酮iia磺酸钠注射液抑制病毒吸附进入的活性。根据荧光值与药物浓度的对应关系计算抑制率,绘制曲线并计算丹参酮iia磺酸钠注射液的半数抑制浓度ic
50
。
[0084]
2、结果:如图2所示;
[0085]
以灭菌水溶剂组为对照,根据荧光值计算药物处理组的抑制率。再根据不同浓度药物处理组抑制率,运用prism8.0软件,拟合出药物抑制率曲线,并计算出丹参酮iia磺酸钠注射液(stsi)抑制sars
‑
cov
‑
2假病毒进入靶细胞的的半数有效抑制浓度ic
50
为14.99μg/ml。
[0086]
实施例3丹参酮iia体外抗sars
‑
cov
‑
2的活性检测
[0087]
1、方法:
[0088]
1)将对数生长期的vero
‑
e6细胞接种于48孔板,3*10^5个细胞/孔,37℃、5%co2过夜培养。
[0089]
2)药物预孵:采用含总体积2%胎牛血清的dmem培养基稀释药物。丹参酮iia(t
‑
iia)初始浓度设置为200μm(溶剂为dmso),三倍倍比稀释药物,每个浓度药物设置3个复孔,共6个药物梯度(200、66.67、22.22、7.41、2.47、0.82μm)。设置溶剂dmso作为对照,对照组采用含总体积2%胎牛血清的dmem培养基稀释,给予药物同体积的dmso。去除细胞上清后1)中48孔板中的实验组每孔加入100μl稀释后的药物,对照组加入100μl稀释后的灭菌水,置37℃孵育1h。
[0090]
3)、4)、5)、6)、7)同实施例1。
[0091]
2、结果:如图3所示;
[0092]
根据标准曲线,计算出每个样品的拷贝数。以dmso组拷贝数作为参照,计算药物处理组抑制率。再根据不同浓度药物处理组抑制率,运用prism8.0软件,拟合出药物抑制率曲线,并计算出丹参酮iia作用于sars
‑
cov
‑
2活性的半数有效浓度ec
50
为2.37μm。
[0093]
实施例4丹参酮iia磺酸钠注射液、丹参酮iia的细胞毒性检测
[0094]
1、方法:
[0095]
1)细胞接种:
[0096]
处于对数生长期的vero
‑
e6、293t/ace2细胞,调整细胞密度至1*10^4个/孔,分别以100μl/孔接种于96孔板,37℃细胞培养箱中培养过夜。
[0097]
2)药物浓度设计:
[0098]
给药前用含总体积2%胎牛血清的dmem培养基2倍倍比稀释8个浓度梯度。
[0099]
vero
‑
e6细胞:
[0100]
丹参酮iia磺酸钠注射液初始浓度设置为1000μg/ml(1000、333.33、111.11、37.04、12.35、4.12、1.37、0.46μg/ml),取每孔100μl稀释后的药物分别加入1)中96孔板中的vero
‑
e6细胞中,每孔终体积200μl。每个药物浓度设置3个复孔。以灭菌水溶剂处理组为空白对照;
[0101]
丹参酮iia初始浓度设置为200μm(200、66.67、22.22、7.41、2.47、0.82、0.27、0.09μm),取每孔100μl稀释后的药物分别加入1)中96孔板中的vero
‑
e6细胞中,每孔终体积200μl。每个药物浓度设置3个复孔。以dmso溶剂处理组为空白对照;
[0102]
293t/ace2细胞:
[0103]
丹参酮iia磺酸钠注射液初始浓度设置为200μg/ml(200、100、50、25、12.5、6.25、3.125、1.5625μg/ml),取每孔100μl稀释后的药物分别加入1)中96孔板中的293t/ace2细胞中,每孔终体积200μl。每个药物浓度设置3个复孔。以灭菌水溶剂处理组为空白对照。
[0104]
3)检测吸光度:
[0105]
孵箱中培养48h后,每孔加入10μl cck
‑
8工作液,培养箱继续孵育3小时。酶标仪测定450nm处吸光度。
[0106]
4)根据测得的od值,分别计算与对照组相比,在各个浓度的药物的作用下,vero
‑
e6、293t/ace2细胞的存活率。
[0107]
2、结果:如图4、5、6所示;
[0108]
丹参酮iia磺酸钠注射液(stsi)在有效浓度范围内对vero
‑
e6细胞(图4)、丹参酮iia磺酸钠注射液(stsi)在有效浓度范围内对293t/ace2细胞(图5)无明显毒性作用、丹参酮iia(t
‑
iia)在有效浓度范围内对vero
‑
e6细胞(图6)。
[0109]
以上所述仅为本发明的具体实施方式,不是全部的实施方式,本领域普通技术人员通过阅读本发明说明书而对本发明技术方案采取的任何等效的变换,均为本发明的权利要求所涵盖。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1