一种联苯化合物在抗临床耐药细菌中的应用及其制备方法
本发明涉及抗菌活性研究技术领域,具体涉及的是一种联苯化合物在抗临床耐药细菌中的应用及其制备方法。
背景技术:
植物在生存过程中若遭受环境中生物、化学、物理等不利因素的胁迫,其可通过启动体内化学防御体系进而产生化学防御物质,用于降低或避免自身受到伤害,使其呈现出一定抗逆性。例如,欧洲花楸(sorbusaucuparia)一旦感染火疫病原菌后,在发生病灶的周围区域可产生一类联苯类植物保护素抵制病原菌的侵袭。近期,我们以欧洲花楸悬浮细胞(s.pohuashanensissuspensioncell,spsc)为研究题材,通过筛选诱导子对其次级代谢产物的响应模式,发现酵母提取物能够显著的改变花楸悬浮细胞的次级代谢产物谱。此外,还发现酵母提取物刺激花楸悬浮细胞可诱导联苯类植物保护素的从头合成。因而,通过利用生物技术手段培养植物悬浮细胞,并通过生物胁迫诱导有助于发现更多抗菌活性天然产物,这对于植物资源的可持续利用具有重要的现实意义。
技术实现要素:
本发明的主要目的是提供一种联苯化合物在抗临床耐药细菌中的应用及其制备方法,本发明的两个联苯化合物在低浓度的情况下能有效抑制8株临床耐药细菌的生长,具有非常大的应用潜能。
本发明首先提供了式ⅰ所示化合物或其药学上可接受的盐在抗菌和/或制备抗菌剂中的应用;
式ⅰ中,r选自氢或碳原子数为1~10的烷基。
具体的,所述r选自氢或碳原子数为1~5的烷基;更为具体的,所述r为氢或甲基。
上述的应用中,所述菌为细菌;具体的,所述细菌为临床耐药细菌。
所述临床耐药细菌具体可为耐甲氧西林金黄色葡萄球菌(methicinllin-resistantstaphylococcusaureus)、耐碳青霉烯大肠埃希菌(carbapenems-resistantescherichiacoli)、耐碳青霉烯铜绿假单胞菌(carbapenems-resistantpseudomonasaeruginosa)、耐碳青霉烯鲍曼不动杆菌(carbapenems-resistantacinetobacterbaumannii)、多耐药性屎肠球菌(multidrug-resistantenterococcusfaecium)、多耐药性粪肠球菌(multidrug-resistantenterococcusfaecalis)、耐碳青霉烯肺炎克雷伯菌(carbapenems-resistantklebsiellapneumoniae)和多耐药性表皮葡萄球菌(multidrug-resistantstaphylococcusepidermidis)中的至少一种。
上述的应用中,所述式ⅰ所示化合物或其药学上可接受的盐在低浓度条件下能够有效抑制细菌的生长;
具体的,所述低浓度为3~100μg/ml;更具体可为3~50μg/ml、3~13μg/ml、3~6.5μg/ml或3.13μg/ml。
本发明还提供了一种式ⅰ所示化合物的制备方法,为如下(1)或(2):
所述式ⅰ所示化合物的结构式如下:
式ⅰ中,r选自氢或甲基;
(1)当r为甲基时,所述方法包括如下步骤:
1)取干燥的花楸悬浮细胞用甲醇提取,提取液浓缩得到浸膏;
2)所述浸膏用氯仿-甲醇混合液溶解后用硅胶吸附拌样,然后用正相硅胶柱色谱进行洗脱,得到11个组分,依次编号为a1-a11;
3)第5个组分a5用正相硅胶柱分离,被分成5个亚组分,依次编号为b1-b5;
4)第2个亚组分b2用正相硅胶柱纯化,得到所述式ⅰ所示化合物;
(2)当r为氢时,所述方法包括如下步骤:
a、取干燥的花楸悬浮细胞用甲醇提取,提取液浓缩得到浸膏;
b、所述浸膏用氯仿-甲醇混合液溶解后用硅胶吸附拌样,然后用正相硅胶柱色谱洗脱,得到11个组分,依次编号为a1-a11;
c、第5个组分a5用正相硅胶柱分离,被分成5个亚组分,依次编号为b1-b5;
d、第4个亚组分b4用sephadexlh-20柱色谱富集,再经高效液相色谱(hplc)纯化,得到所述式ⅰ所示化合物。
上述的制备方法,步骤1)和a)中,所述提取为室温下冷浸提取;所述提取的次数为1~10次;具体可为3~8次,更具体可为3~5次;每次提取的时间为24~72h;具体可为72h;
所述温室为本领域技术人员公知常识,一般为15~35℃;
所述甲醇的用量为每千克干燥的花楸悬浮细胞加入2l甲醇/每次;
所述浓缩为减压浓缩;具体的,所述减压浓度的温度为30~40℃,具体可为40℃;压力为0.01~0.10mpa,具体可为0.08mpa。
步骤2)和b)中,所述氯仿-甲醇的体积比为1:1;
所述浸膏和所述氯仿-甲醇的质量体积比为1:1~3kg/l,具体可为1:1kg/l;
所述吸附拌样用的硅胶和浸膏的质量比为1~3:1,具体可为1:1;
所述洗脱为先用石油醚洗脱,再依次用体积比为100:0、98:2、95:5、90:10、80:20、70:30、50:50、0:100的二氯甲烷/甲醇混合溶剂进行梯度洗脱;
步骤3)和c)中,所述分离为依次采用体积比为50:1、40:1、30:1、20:1、10:1、5:5、0:1的石油醚/丙酮混合溶剂进行梯度洗脱。
上述的制备方法,步骤4)中,所述纯化为用体积比4:1的石油醚/丙酮洗脱;
步骤d)中,所述富集的流动相为甲醇;
所述纯化的流动相为甲醇-水,洗脱条件为甲醇体积百分浓度30%→100%,洗脱时间为0min→30min,流速为5~10ml/min,收集时间为26.6min。
所述流速具体可为10ml/min。
本发明的第三个目的是提供一种抗菌剂,其活性成分为式ⅰ所示化合物或其药学上可接受的盐。
与现有技术相比,本发明的有益效果如下:
1)本发明提供的联苯化合物能够在低浓度的情况下有效抑制8株临床耐药细菌的生长;式1所示化合物对耐甲氧西林金黄色葡萄球菌、耐碳青霉烯大肠埃希菌、耐碳青霉烯铜绿假单胞菌、耐碳青霉烯鲍曼不动杆菌、多耐药性屎肠球菌、多耐药性粪肠球菌、耐碳青霉烯肺炎克雷伯菌和多耐药性表皮葡萄球菌这8株临床耐药细菌的最小抑菌浓度mic分别为3.13、100、6.25、100、6.25、12.5、100、6.25μg/ml;式2所示化合物对耐甲氧西林金黄色葡萄球菌、耐碳青霉烯大肠埃希菌、耐碳青霉烯铜绿假单胞菌、耐碳青霉烯鲍曼不动杆菌、多耐药性屎肠球菌、多耐药性粪肠球菌、耐碳青霉烯肺炎克雷伯菌和多耐药性表皮葡萄球菌这8株临床耐药细菌的最小抑菌浓度mic分别为12.5、50、12.5、50、6.25、50、100、12.5μg/ml。本发明的化合物在临床耐药细菌上具有非常大的应用潜能;
2)本发明还提供了两个联苯化合物的制备方法,能够快速准确高效的从spsc材料中制备获得。
附图说明
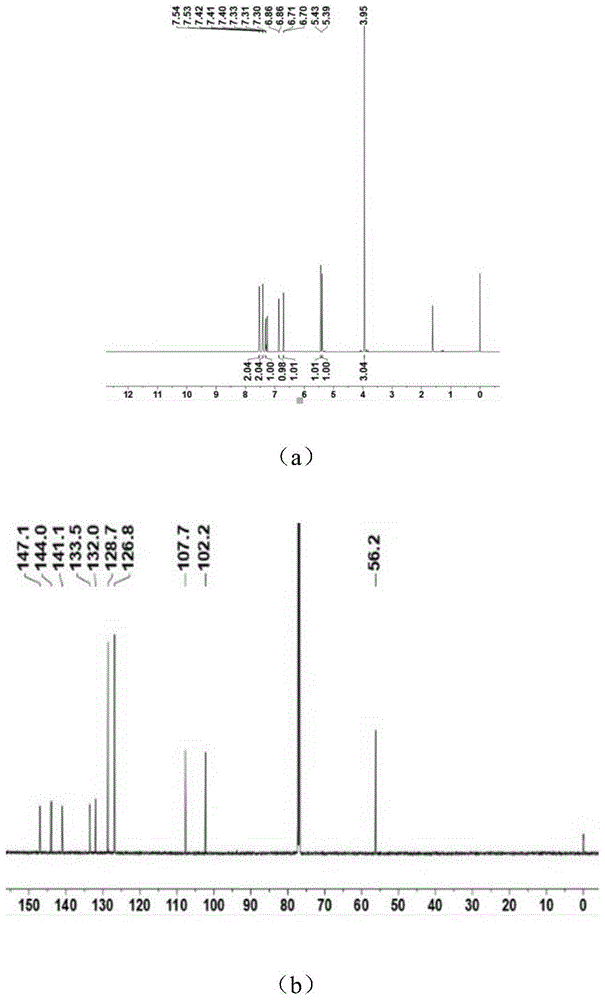
图1为化合物1的1hnmr图和13cnmr图;其中,图1中的a为1hnmr图,b为13cnmr图。
图2为化合物2的1hnmr图和13cnmr图;其中,图2中的a为1hnmr图,b为13cnmr图。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用的干燥的花楸悬浮细胞的制备方法,与下述文献中干燥的欧洲花楸悬浮细胞的制备方法一致,只是将其中的欧洲花楸替换为花楸(李佳兴,李慧梁,周良云,等.酵母诱导欧洲花楸悬浮细胞的化学成分及抑菌活性[j].天然产物研究与开发,2019,031(012):2071-2076.)。
下述实施例中的耐甲氧西林金黄色葡萄球菌(methicinllin-resistantstaphylococcusaureus)、耐碳青霉烯大肠埃希菌(carbapenems-resistantescherichiacoli)、耐碳青霉烯铜绿假单胞菌(carbapenems-resistantpseudomonasaeruginosa)、耐碳青霉烯鲍曼不动杆菌(carbapenems-resistantacinetobacterbaumannii)、多耐药性屎肠球菌(multidrug-resistantenterococcusfaecium)、多耐药性粪肠球菌(multidrug-resistantenterococcusfaecalis)、耐碳青霉烯肺炎克雷伯菌(carbapenems-resistantklebsiellapneumoniae)和多耐药性表皮葡萄球菌(multidrug-resistantstaphylococcusepidermidis)均记载在文献((±)-preisomide:anewalkaloidfeaturingararenaturallyoccurringtetrahydro-2h-1,2-oxazinskeletonfromanendophyticfunguspreussiaisomerabyusingosmacstrategy,hai-lichenetc.,fitoterapia,2020,141:104475)中,公众可从陆军军医大学获得,或者经陆军军医大学同意从中国中医科学院中药研究所(即申请人)处获得,上述生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的sephadexlh-20柱色谱购自gehealthcare,uppsala,sweden。
实施例1两个联苯化合物的制备
两个联苯化合物的制备方法具体如下:
1)取干燥的花楸悬浮细胞10kg,用甲醇在室温条件下冷浸提取5次,甲醇用量为20l/每次,提取时间为每次72h,合并提取液,40℃、0.08mpa下减压浓缩提取液,得到浸膏约6kg;
2)所得浸膏用氯仿/甲醇(1:1,v/v,6l)溶解后用100-200目硅胶(ca.6kg)吸附拌样,经正相硅胶柱色谱粗分,先用石油醚洗脱,后依次用体积比为100:0、98:2、95:5、90:10、80:20、70:30、50:50、0:100的二氯甲烷/甲醇混合溶剂梯度洗脱,得到11个组分,依次编号为a1–a11;
3)将第5个组分a5进一步用正相硅胶柱(填料为100-200目硅胶)分离,分离的条件为依次采用体积比为50:1、40:1、30:1、20:1、10:1、5:5、0:1的石油醚/丙酮混合溶剂进行梯度洗脱,分离得到5个亚组分,亚组分依次编号为b1–b5;
4)第2个亚组分b2经正相硅胶柱(填料为100-200目硅胶)纯化,纯化的条件为用体积比4:1的石油醚/丙酮洗脱,得到化合物1(4.0mg);
5)第4个亚组份b4经sephadexlh-20柱色谱(流动相为甲醇)进行目标化合物2的富集;再经hplc纯化(流动相为甲醇-水,洗脱条件为30%→100%(v/v),洗脱时间为0min→30min,流速为10ml/min,检测波长为280nm),得到化合物2(5mg,tr=26.6min)。
通过质谱和核磁确定了获得的单体化合物的结构,所得化合物的物理性状、分子式、1hnmr和13cnmr数据如下:
化合物1:白色无定型粉末,分子式为c13h12o3。1hnmr(cdcl3,600mhz)δh:7.54(2h,d,j=7.30hz,h-2',6');7.41(2h,t,j=7.62hz,h-3',5');7.31(1h,t,j=7.31hz,h-4');6.86(1h,d,j=1.76hz,h-2);6.70(1h,d,j=1.90hz,h-6);3.95(3h,s,3-och3);13cnmr(cdcl3,150mhz)δc:147.2(c-3),144.2(c-5),141.2(c-1'),133.7(c-4)132.1(c-1),128.8(c-3',5'),127.1(c-2',6'),127.0(c-4'),107.9(c-6),102.4(c-2),56.4(3-och3).
化合物2:白色无定型粉末,分子式为c12h13o3。1hnmr(cd3od,600mhz)δh:7.47(2h,dd,j=1.34,8.38hz,h-2',6');7.34(2h,t,j=7.37hz,h-3',5');7.22(1h,t,j=7.34hz,h-4');6.61(1h,d,j=1.57hz,h-2,6);13cnmr(cdcl3,150mhz)δc:147.5(c-3,5),144.3(c-1'),134.2(c-1),134.0(c-4),129.8(c-3',5'),127.6(c-4'),107.2(c-2,6).
化合物1的1hnmr图和13cnmr图见图1;化合物2的1hnmr图和13cnmr图见图2。化合物1的结构式为下述式1所示,化合物2的结构式为下述式2所示。
实施例2抗菌实验
将实施例1所得的两个联苯化合物对8株临床耐药细菌进行mic测定,采用二倍稀释法,具体步骤如下:
1)临床耐药细菌mic的测定:分别将所得到的2个化合物以及阳性对照药物环丙沙星用dmso配制成10mg/ml的溶液;将耐甲氧西林金黄色葡萄球菌(methicinllin-resistantstaphylococcusaureus)、耐碳青霉烯大肠埃希菌(carbapenems-resistantescherichiacoli)、耐碳青霉烯铜绿假单胞菌(carbapenems-resistantpseudomonasaeruginosa)、耐碳青霉烯鲍曼不动杆菌(carbapenems-resistantacinetobacterbaumannii)、多耐药性屎肠球菌(multidrug-resistantenterococcusfaecium)、多耐药性粪肠球菌(multidrug-resistantenterococcusfaecalis)、耐碳青霉烯肺炎克雷伯菌(carbapenems-resistantklebsiellapneumoniae)和多耐药性表皮葡萄球菌(multidrug-resistantstaphylococcusepidermidis)8株致病细菌作为测试菌株;配制lb培养基(具体操作为:配制1l培养基,在950ml水中加入10g胰蛋白胨、5g酵母提取物和10gnacl,混合均匀后,用5mol/lnaoh调ph至7.0),经过高压蒸汽灭菌并冷却后待用;取保存于-80℃冰箱的测试菌株100μl加入预先准备的装有lb培养基(15ml)的试管中,然后放入到37℃的恒温摇床中,160r/min培养12小时,得到细菌菌液;然后取100μl细菌菌液加入100ml的lb培养基中稀释;在96孔板的第一排加入198μl稀释后的菌液,第二至八排加入100μl稀释后的菌液;第一排每孔分别加入不同的单体化合物溶液(浓度为10mg/ml)2μl、阴性对照(dmso)2μl、阳性对照(环丙沙星,浓度为10mg/ml)2μl;将混合后的第一排溶液吸取100μl至第二排,然后再将混合后的溶液吸取100μl至第三排,直到第八排,第八排吸出的混合液打入含有酒精的废液缸中;此时第一排到第八排的样品浓度依次为100、50、25、12.5、6.25、3.12、1.56、0.78μg/ml。
将处理好的96孔板放置到37℃的恒温培养箱中培养,每隔两小时观察一次。如果某浓度的化合物具有活性,则在该浓度对应的孔是澄清的,反之浑浊;当阴性对照组完全浑浊时记录下其他组的情况,以此评估单体化合物的抗细菌活性浓度。
测试结果见表1。由表1可知,实施例1所得化合物1对耐甲氧西林金黄色葡萄球菌、耐碳青霉烯大肠埃希菌、耐碳青霉烯铜绿假单胞菌、耐碳青霉烯鲍曼不动杆菌、多耐药性屎肠球菌、多耐药性粪肠球菌、耐碳青霉烯肺炎克雷伯菌和多耐药性表皮葡萄球菌这8株临床耐药细菌的最小抑菌浓度mic分别为3.13、100、6.25、100、6.25、12.5、100、6.25μg/ml;化合物2对耐甲氧西林金黄色葡萄球菌、耐碳青霉烯大肠埃希菌、耐碳青霉烯铜绿假单胞菌、耐碳青霉烯鲍曼不动杆菌、多耐药性屎肠球菌、多耐药性粪肠球菌、耐碳青霉烯肺炎克雷伯菌和多耐药性表皮葡萄球菌这8株临床耐药细菌的最小抑菌浓度mic分别为12.5、50、12.5、50、6.25、50、100、12.5μg/ml。由此可见,所述的化合物1和化合物2在临床耐药细菌上具有非常大的应用潜能。
表1.化合物1和化合物2的抗临床耐药细菌活性(mic,μg/ml)
显然,上述实施例仅仅是为清楚地说明所作的实例,而并非对实施方式的限制。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而因此所引申的显而易见的变化或变动仍处于本发明创造的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!