用于牙槽骨缺损修复的聚氨基酸微载体及其制备方法
1.本发明涉及一种牙槽骨缺损修复材料及其制备方法,特别是涉及一种聚氨基酸微载体及其制备方法。
背景技术:
2.牙周疾病、创伤等因素是造成牙槽骨缺损和吸收的主要原因。临床上,拥有健康且骨量充足的牙槽骨对于牙科植入物的植入至关重要。为了恢复缺损区域的功能以及美学特征,目前临床上最常用的方法包括牵引成骨(do)以及将骨移植材料(bgm)直接移植到缺损部位,利用引导组织/骨再生技术(gtr/gbr)再生出丢失的骨组织。
3.其中牵引成骨(do)主要是在保留原有的骨组织以及软组织的前提下,通过牵引装置固定于原有骨的两端,以适当的速度和频率向所需方向进行牵引,利用牙槽骨具有高度可塑性的特点,从而实现在牙槽骨缺损的间隙中生成新的骨组织。然而这一技术的缺点在于整个修复周期过长,同时患者需持续佩戴牵引器,除了影响美观以及日常发音外口腔卫生无法得到保证而易引发感染。
4.但是对于不规则、小尺寸的牙槽骨缺损牵引成骨(do)则不适用,而利用骨移植材料(bgm)直接填补于牙槽骨缺损部位可以解决上述问题而被广泛应用于临床。根据原材料的不同,骨移植材料(bgm)可以分为自体骨、同种异体骨、异种骨以及合成的骨替代物。自体骨移植由于在骨愈合、塑形以及重塑过程中表现出极强的成骨特性以及无免疫原性特点,因此成为骨缺损重建的“金标准”。但是,骨的供应有限、需要额外的供体部位等问题是自体骨移植存在的明显缺陷。而同种异体骨移植材料虽然具有骨诱导性和骨传导性,但是由于缺乏活细胞,其成骨能力远不及自体骨移植。而异种骨移植材料来源广泛,例如bio
‑
oss(geistlieh ag,switzerland)是一种从小牛骨中处理得到的骨粉材料,其具有高度的多孔结构以及良好的骨传导性。虽然bio
‑
oss有利于血管的侵入以及成骨细胞的迁移,但是k
ü
bler等人研究发现,bio
‑
oss骨粉骨诱导性差,与其他替代品相比显示出对成骨细胞较低的增殖和分化能力而限制了其在临床上的应用。(k
ü
bler a,et al.growth and proliferation of human osteoblasts on different bone graft substitutes:an in vitro study[j].implant dent,2004,13:171
‑
179)对于合成的骨替代物(如聚甲基丙烯酸甲酯、聚乳酸、聚羟基乙酸等),其来源广泛且具有良好的组织相容性,但是这类材料往往只有骨传导性而没有骨诱导性,因此常需要与具有骨诱导作用的生物活性因子复合使用才能达到预期的效果。
[0005]
血管在骨修复过程中至关重要,它不仅是营养扩散,细胞增殖和新骨组织生长的营养传递器官,而且在调节参与骨再生的细胞和信号分子中起着关键作用。针对口腔这一特殊的环境,牙槽骨缺损修复过程中的抗菌性亦十分重要。因此临床上理想的牙槽骨缺损修复材料应当具有以下几种功能:促进骨组织再生、促进血管再生和抗菌功能。但是目前临床上具有上述几种功能于一体的牙槽骨缺损修复材料却未见报道。
技术实现要素:
[0006]
本发明的目的之一在于克服现有技术中存在的问题,提供一种用于牙槽骨缺损修复的聚氨基酸微载体。
[0007]
本发明的目的之二在于提供该微载体的制备方法。
[0008]
本发明通过化学接枝的方法将羟基磷灰石(ha)、羟基磷酸铜(cp)无机纳米粒子与聚氨基酸大分子(如,聚l
‑
谷氨酸苄酯(pblg)、聚l
‑
谷氨酸甲酯(pmlg)、聚l
‑
谷氨酸乙酯(pelg))复合,得到有机无机杂化的聚氨基酸大分子,大分子进一步与小分子药物淫羊藿苷(ica)按一定摩尔比共混,通过双乳液法获得聚氨基酸多功能微载体。
[0009]
首先以羟基磷酸铜(cp)和羟基磷灰石(ha)两种纳米粒子表面氨基化改性,分别引发γ
‑
苄基
‑
l
‑
谷氨酸
‑
n
‑
羧酸酐(blg
‑
nca)、l
‑
谷氨酸甲酯
‑
n
‑
羧基
‑
环内酸酐(ncas)和l
‑
谷氨酸乙酯
‑
n
‑
羧基
‑
环内酸酐开环聚合,分别得到化学接枝的cp
‑
g
‑
pblg、ha
‑
g
‑
pblg;cp
‑
g
‑
pmlg、ha
‑
g
‑
pmlg和cp
‑
g
‑
pelg、ha
‑
g
‑
pelg三组原料。再将三组原料分别与小分子药物淫羊藿苷(ica)按一定摩尔比通过双乳液法制备得到聚氨基酸多功能微载体。
[0010]
为达到上述发明创造目的,本发明采用如下技术方案:
[0011]
一种用于牙槽骨缺损修复的聚氨基酸微载体,其特征在于该微载体由有机无机杂化的聚氨基酸大分子和淫羊藿苷按1:1~1:5的摩尔比共混形成的混合物;所述的有机无机杂化的聚氨基酸大分子的结构式为:按1:1的摩尔比的混合物,其中x=2000~3000,y=2500~3500,r为:苄基、甲基或乙基;所述的淫羊藿苷的结构式分别为:
[0012][0013]
上述的聚氨基酸大分子的分子量分布pdi=1.25~1.32。
[0014]
上述的微载体尺寸为150~300μm,孔径和孔隙率的范围分别为25~45μm和87.5%
±
3.6%。
[0015]
一种制备上述的用于牙槽骨缺损修复的聚氨基酸微载体,其特征在于该方法的具体步骤为:
[0016]
a.羟基磷灰石ha和羟基磷酸铜cp的氨化得到cp
‑
nh2和ha
‑
nh2纳米粒子;
[0017]
b.将步骤a所得cp
‑
nh2和氨基酸按1:2~1:10的摩尔比溶于1,4
‑
二氧六环溶液中,在惰性气氛下,25~50℃下搅拌反应3~6d,通过无水乙醇进行沉降,经后处理后得到cp
‑
g
‑
聚氨基酸;
[0018]
c.将步骤a所得ha
‑
nh2和氨基酸按1:2~1:10的摩尔比溶于1,4
‑
二氧六环溶液中,在惰性气氛下,25~50℃下搅拌反应3~6d,通过无水乙醇进行沉降,经后处理后得到ha
‑
g
‑
聚氨基酸;
[0019]
d.将步骤b所得的cp
‑
g
‑
聚氨基酸、步骤c所得的ha
‑
g
‑
聚氨基酸和淫羊藿苷按1:1:1~1:1:5的摩尔比溶解到二氯甲烷中得到第一混合液体系;
[0020]
e.将1~10wt%的明胶水溶液与步骤d所得第一混合液体系按明胶:cp
‑
g
‑
聚氨基酸=1:1.2~1:2.4的摩尔比,乳化30~150s,得到第二混合体系;
[0021]
f.将0.1~1%的聚乙烯醇pva水溶液与步骤e所得的第二混合体系按聚乙烯醇:cp
‑
g
‑
聚氨基酸=1:0.1~1:0.5的摩尔比混合,以1000~2000r/min的转速搅拌直至混合体系中的二氯甲烷挥发完全;
[0022]
g.将步骤f所得的混合体系通过筛子过筛,得到聚氨基酸微载,再将得到的微载体置于37℃恒温摇床中,每过30分钟换一次水,重复洗涤多次直至微载体中的明胶被去除干净,冷冻、干燥保存,即得到用于牙槽骨缺损修复的聚氨基酸微载体。
[0023]
上述步骤a的氨化的具体步骤五为:
[0024]
a.将3
‑
氨基丙基三乙氧基硅烷加入到质量分数为75~100wt%的乙醇水溶液中,配制成浓度为0.03~0.06mol/l的溶液;
[0025]
b.分别将10~20mmol的羟基磷灰石ha和羟基磷酸铜cp溶于a中溶液,在25~50℃下搅拌3~6小时后,用氨水调节体系的ph值至9~12,再继续反应3~6小时,洗涤,去上层清液,冷冻干燥即得到cp
‑
nh2和ha
‑
nh2纳米粒子。
[0026]
本发明的微载体通过注射的方式填充到牙槽骨缺损部位(临界尺寸:5x6x10mm)。
[0027]
本发明的微载体实现了多种功能(促成骨、促血管化和抗菌)于一体,针对牙槽骨缺损特定的环境进行修复。其中聚氨基酸基材料作为一种主链由肽键相连接的高分子材料,具有独特的二级结构、良好的生物可降解性和生物相容性而被广泛应用于组织工程领域。微载体中的小分子药物ica和羟基磷灰石(ha)具有良好的骨诱导性和骨传导性;而微载体中羟基磷酸铜中的cu
2+
则可以刺激血管内皮细胞形成血管,同时赋予微载体抗菌性能。实验发现,本发明所制备的聚氨基酸微载体具有良好的促成骨、促血管以及抗菌作用,可加速兔子牙槽骨缺损的修复。
[0028]
本发明与现有技术相比较,具有如下显而易见的突出实质性特点和显著优点:
[0029]
1.本发明用于牙槽骨缺损修复的聚氨基酸多功能微载体,该微载体具有可注射的优势,用于牙槽骨的再生与重建;
[0030]
2.本发明将无机组分羟基磷酸铜(cp)和羟基磷灰石(ha)通过化学接枝的方式与聚氨基酸组分相结合,大大提高了无机组分的分散性以及与基体材料的结合力;
[0031]
3.本发明的聚氨基酸多功能微载体具有促成骨、促血管化以及抗菌多种功能于一体,符合口腔中牙槽骨缺损修复的特定微环境。
附图说明
[0032]
图1(a)为本发明实施例一cp
‑
g
‑
pblg的透射电子显微镜照片。
[0033]
图1(b)为本发明实施例一ha
‑
g
‑
pblg的透射电子显微镜照片。
[0034]
图2(a)为本发明实施例一聚氨基酸多功能微载体的扫描电子显微镜照片。
[0035]
图2(b)为本发明实施例一聚氨基酸多功能微载体中的无机物分布的能谱图。
[0036]
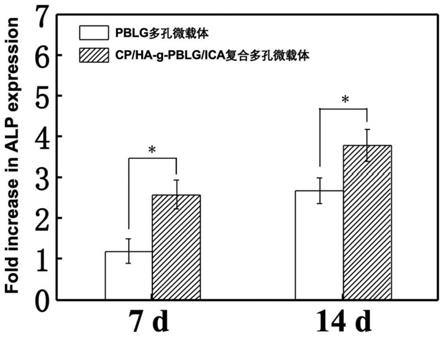
图3为本发明实施例一兔子骨髓间充质干细胞(bmscs)在聚氨基酸多功能微载体上培养7天和14天后细胞中碱性磷酸酶(alp)基因表达统计图(*p<0.05)。
[0037]
图4为本发明实施例一兔子骨髓间充质干细胞(bmscs)在微载体上培养7天和14天后细胞中血管内皮生长因子(vegf)基因表达统计图(*p<0.05)。
[0038]
图5(a)为本发明实施例一对金黄色葡萄球菌的抑菌环。
[0039]
图5(b)为本发明实施例一对金黄色葡萄球菌的抑菌率图。
[0040]
图6为本发明实施例一对兔牙槽骨缺损修复一个月的micro
‑
ct图像,其中(a)是空白对照组;(b)是用复合多孔微载体注射填充修复后的实验组。
具体实施方式
[0041]
以下结合具体的实施例子对上述方案做进一步说明,本发明的优选实施例详述如下:
[0042]
实施例一:
[0043]
在本实施例中,一种cp
‑
g
‑
pblg和ha
‑
g
‑
pblg的制备方法,包括如下步骤:
[0044]
a.将3
‑
氨基丙基三乙氧基硅烷加入到质量分数为75~100wt%的乙醇水溶液中,配制成浓度为:0.03~0.06mol/l的溶液;
[0045]
b.cp和ha的氨基化改性:用两个单口瓶取向上述的乙醇水溶液并分别加入0.5~3g的cp和0.4~4.0g的ha,在25~50℃下搅拌3~6小时后,用氨水调节体系的ph值至9~12,再继续反应3~6小时,洗涤,倒去上层清液,冷冻干燥即得到cp
‑
nh2和ha
‑
nh2纳米粒子,置于真空烘箱中保存。
[0046]
c.cp
‑
g
‑
pblg和ha
‑
g
‑
pblg的制备:将0.64~3.2g的cp
‑
nh2加入到8~16g的blg
‑
nca的400~600ml的1,4
‑
二氧六环溶液中,在n2气氛下,25~50℃下搅拌反应3~6d,通过无水乙醇进行沉降,过滤后洗涤两次,室温条件下干燥即可得cp
‑
g
‑
pblg;将0.32~1.6gha
‑
nh2加入8~16g的blg
‑
nca的1,4
‑
二氧六环溶液中,在n2气氛下,25~50℃下搅拌反应3~6d,通过无水乙醇进行沉降,过滤后洗涤两次,室温条件下干燥即可得ha
‑
g
‑
pblg。
[0047]
在本实施例中,一种聚氨基酸多功能微载体材料的制备方法,包括如下步骤:
[0048]
(1)分别取0.3~3mg的cp
‑
g
‑
pblg、100~300mg的ha
‑
g
‑
pblg和0.1~0.5mg的ica,溶解到10~30ml的二氯甲烷中得到第一混合液体系;
[0049]
(2)向所述步骤(1)中加入5~10ml 1~10wt%的明胶水溶液,并用乳化机乳化30~150s,得到第二混合体系;
[0050]
(3)将在步骤(2)中制备的第二混合体系迅速加入到500~1000ml浓度为0.1~1%的聚乙烯醇(pva)水溶液中,以1000~2000r/min的转速搅拌直至混合体系中的二氯甲烷挥发完全;
[0051]
(4)将在步骤(3)中的混合体系通过特定尺寸的筛子过筛,得到尺寸为150~300μm
的聚氨基酸多功能微载体,再将得到的微载体置于37℃恒温摇床中,每过30分钟换一次水,重复洗涤多次直至微载体中的明胶被去除干净,冷冻、干燥保存。
[0052]
在本实施例中,一中聚氨基酸多功能微载体的细胞实验,包括如下步骤:
[0053]
a.聚氨基酸多功能微载体的消毒:将0.1~0.5g的聚氨基酸多功能微载体通过γ射线照射6~12h进行消毒。
[0054]
b.兔子bmscs在聚氨基酸多功能微载体的接种:将兔子的bmscs按1x105~1x106的细胞密度接种到已消毒的聚氨基酸多功能微载体上,每隔3天对细胞进行换液。
[0055]
c.bmscs中基因的检测:分别取培养7天和14天的bmscs,通过pcr技术检测细胞中成骨特异性基因alp和血管化特异性基因vegf的表达。
[0056]
在本实施例中,一中聚氨基酸多功能微载体的抗菌实验,包括如下步骤:
[0057]
a.金黄色葡萄球菌悬液的配制:将金黄色葡萄球菌和液体培养基混合,配制成细菌浓度为1x107~1x109cfu/ml的金黄色葡萄球菌悬液。
[0058]
b.金黄色葡萄球菌的抑菌环检测:将pblg微载体和聚氨基酸多功能微载体分别置于直径为1cm的滤纸上,倒置与接种有金黄色葡萄球菌(5x105~1x108cfu/ml)的培养基上,37℃培养24h,测量抑菌环的尺寸。
[0059]
c.金黄色葡萄球菌的抑菌率检测:将1ml的微载体与1x107~1x109cfu/ml的金黄色葡萄球菌悬液共培养6~24小时后测定悬液的od值得到的。
[0060]
在本实施例中,一中聚氨基酸多功能微载体的动物实验,包括如下步骤:
[0061]
a.牙槽骨缺损模型的建立:将兔子第二颗下磨牙拔除后,利用手持机械磨成5x6x10mm的缺损,整个过程需不断用生理盐水冲洗,避免因摩擦造成温度过高。
[0062]
b.聚氨基酸多功能微载体的填充:将0.1~1g的聚氨基酸多功能微载体与生理盐水一同,利用注射器注射到牙槽骨缺损部位。
[0063]
c.牙龈缝合:将明胶海绵按压在填充聚氨基酸多功能微载体的上方,并用可吸收手术缝合线缝合剥离的牙龈组织,完成手术后用碘伏和75%的乙醇对伤口进行消毒。
[0064]
实验测试分析:
[0065]
对本实施例制备的聚氨基酸多功能微载体的细胞实验:将兔子bmscs分别接种到pblg微载体和聚氨基酸多功能微载体上,分别培养7天和14天后,通过pcr技术检测细胞中成骨特异性基因alp和血管化特异性基因vegf的表达。结果表明聚氨基酸多功能微载体能够促进兔子骨髓间充质干细胞的成骨向分化以及血管化的初期形成。
[0066]
对本实施例制备的复合多孔微载体的抑菌实验:将pblg微载体和聚氨基酸多功能微载体分别置于直径为1cm的滤纸上,倒置与接种有金黄色葡萄球菌(5x105cfu/ml)的培养基上,37℃培养24h,测量抑菌环的尺寸。而聚氨基酸多功能微载体的抑菌率是通过将1ml的微载体与1x108cfu/ml的金黄色葡萄球菌悬液共培养24小时后测定悬液的od值得到的。
[0067]
对本实施例制备的聚氨基酸多功能微载体的动物实验:将聚氨基酸多功能微载体注射到兔牙槽骨缺损部位(缺损尺寸:5x6x10mm),并用明胶海绵压实后,缝合牙龈。术后4周后,取出手术部位的牙槽骨进行micro
‑
ct分析。结果表明与空白对照组相比,实验组中有明显的新生骨形成,证明复合体系具有良好的骨再生能力,能够加速牙槽骨缺损的修复。
[0068]
图1为本实施例中制备得到的cp
‑
g
‑
pblg和ha
‑
g
‑
pblg纳米颗粒的透射电子显微镜照片。图1a和图1b分为cp
‑
g
‑
pblg和ha
‑
g
‑
pblg纳米颗粒tem图,如图所示,cp
‑
g
‑
pblg纳米颗
粒呈球状,尺寸为50~80nm,且无机物的外围可以明显看到一圈聚合物pblg的存在;而ha
‑
g
‑
pblg纳米颗粒呈棒状结构,尺寸为80~100nm,与cp
‑
g
‑
pblg相似外围亦明显看到一圈接枝物的存在。
[0069]
图2为本实施例制备的聚氨基酸多功能微载体的扫描电子显微镜照片和元素分布图。图2a为聚氨基酸多功能微载体的sem,由图可知微载体呈球形,尺寸为150~300μm且具有贯通的孔结构,孔径为25~45μm;图2b为聚氨基酸多功能微载体中ca、p、c和cu元素的分布以及含量的eds图,由图可知,无机物在微载体中的分布十分均匀。
[0070]
图3为本实施例分别用pblg微载体和聚氨基酸多功能微载体培养bmscs7天和14天,分别通过pcr检测细胞中的碱性磷酸酶(alp)基因的表达(*p<0.05)。结果显示,聚氨基酸多功能微载体能够促进bmscs中alp的表达,即多功能体系表现出良好的促成骨性能。
[0071]
图4为本实施例分别用pblg微载体和聚氨基酸多功能微载体培养bmscs7天和14天,分别通过pcr检测细胞中的血管内皮生长因子(vegf)基因的表达(*p<0.05)。结果显示,聚氨基酸多功能微载体能够促进bmscs中vegf的表达,即多功能体系表现出良好的促血管化性能。
[0072]
图5为本实施例中将pblg微载体和聚氨基酸多功能微载体分别置于直径为1cm的滤纸上,倒置与接种有金黄色葡萄球菌(5x105cfu/ml)的培养基上,37℃培养24h,测量抑菌环的尺寸。结果显示,聚氨基酸多功能微载体有明显的抑菌环产生,而对照组则没有抑菌环;而聚氨基酸多功能微载体的抑菌率是通过将1ml的微载体与1x108cfu/ml的金黄色葡萄球菌悬液共培养24小时后测定悬液的od值得到的,结果显示聚氨基酸多功能微载体能够明显的抑制细菌的增殖,抑菌率达到56%。所以可以证明聚氨基酸多功能微载体具有良好的抗菌性能。
[0073]
图6为本实施例中用聚氨基酸多功能微载体修复兔牙槽骨缺损4周后的micro
‑
ct图。其中图6a是空白对照组,图6b是用复合多孔微载体注射填充修复后的实验组。结果显示,聚氨基酸多功能微载体组中有大量新生骨存在,而对照组中则没有新骨的生成,表明聚氨基酸多功能微载体具有良好的促进牙槽骨缺损修复的能力。
[0074]
对本实施例用于牙槽骨缺损修复的聚氨基酸多功能微载体材料及其制备方法。该方法中通过对羟基磷酸铜(cp)和羟基磷灰石(ha)两种纳米粒子表面氨基化改性后,引发γ
‑
苄基
‑
l
‑
谷氨酸
‑
n
‑
羧酸酐(blg
‑
nca)开环聚合,分别得到了由化学接枝的cp
‑
g
‑
pblg和ha
‑
g
‑
pblg并与小分子药物淫羊藿苷(ica)按一定摩尔比通过双乳液法制备得到聚氨基酸多功能微载体。体外细胞实验以及体内动物实验发现,本施例所制备的聚氨基酸多功能微载体具有良好的促成骨、促血管以及抗菌作用,本实施例中制备的微载体能够促进牙槽骨缺损的修复。
[0075]
实施例二:
[0076]
本实施例与实施例一基本相同,特别之处在于:
[0077]
在本实施例中,cp
‑
g
‑
pblg和ha
‑
g
‑
pblg材料的制备方法与实施例一相同。
[0078]
在本实施例中,一种多功能的复合多孔微载体材料的制备方法,包括如下步骤:
[0079]
(1)分别取0.6mg的cp
‑
g
‑
pblg、150mg的ha
‑
g
‑
pblg和0.2mg的ica,溶解到10~30ml的二氯甲烷中得到第一混合液体系;
[0080]
(2)向所述步骤(1)中加入5~10ml 1~10wt%的明胶水溶液,并用乳化机乳化30
~150s,得到第二混合体系;
[0081]
(3)将在步骤(2)中制备的第二混合体系迅速加入到500~1000ml浓度为0.1~1%的聚乙烯醇(pva)水溶液中,以1000~2000r/min的转速搅拌直至混合体系中的二氯甲烷挥发完全;
[0082]
(4)将在步骤(3)中的混合体系通过特定尺寸的筛子过筛,得到尺寸为150~300μm的聚氨基酸多功能微载体,再将得到的微载体置于37℃恒温摇床中,每过30分钟换一次水,重复洗涤多次直至微载体中的明胶被去除干净,冷冻、干燥保存。
[0083]
实验测试分析:
[0084]
对本实施例用于牙槽骨缺损修复的聚氨基酸多功能微载体材料及其制备方法。该方法中通过对羟基磷酸铜(cp)和羟基磷灰石(ha)两种纳米粒子进行表面氨基化改性,分别得到两种表面具有大量氨基的cp
‑
nh2和ha
‑
nh2纳米颗粒;再分别引发γ
‑
苄基
‑
l
‑
谷氨酸
‑
n
‑
羧酸酐(blg
‑
nca)开环聚合,分别得到了由化学接枝的cp
‑
g
‑
pblg和ha
‑
g
‑
pblg两种原料;再将原料与小分子药物淫羊藿苷(ica)按一定摩尔比通过双乳液法制备得到聚氨基酸多功能微载体。体外细胞实验以及体内动物实验发现,本施例所制备的聚氨基酸多功能微载体具有良好的促成骨、促血管以及抗菌作用,本实施例中制备的微载体能够促进牙槽骨缺损的修复。
[0085]
实施例三:
[0086]
本实施例与前述实施例基本相同,特别之处在于:
[0087]
在本实施例中,cp
‑
g
‑
pblg和ha
‑
g
‑
pblg材料的制备方法与实施例一相同。
[0088]
在本实施例中,一种聚氨基酸多功能微载体材料的制备方法,包括如下步骤:
[0089]
(1)分别取0.9mg的cp
‑
g
‑
pblg、200mg的ha
‑
g
‑
pblg和0.3mg的ica,溶解到10~30ml的二氯甲烷中得到第一混合液体系;
[0090]
(2)向所述步骤(1)中加入5~10ml 1~10wt%的明胶水溶液,并用乳化机乳化30~150s,得到第二混合体系;
[0091]
(3)将在步骤(2)中制备的第二混合体系迅速加入到500~1000ml浓度为0.1~1%的聚乙烯醇(pva)水溶液中,以1000~2000r/min的转速搅拌直至混合体系中的二氯甲烷挥发完全;
[0092]
(4)将在步骤(3)中的混合体系通过特定尺寸的筛子过筛,得到尺寸为150~300μm的聚氨基酸多功能微载体,再将得到的微载体置于37℃恒温摇床中,每过30分钟换一次水,重复洗涤多次直至微载体中的明胶被去除干净,冷冻、干燥保存。
[0093]
实验测试分析:
[0094]
对本实施例用于牙槽骨缺损修复的聚氨基酸多功能微载体材料及其制备方法。该方法中通过对羟基磷酸铜(cp)和羟基磷灰石(ha)两种纳米粒子进行表面氨基化改性,分别得到两种表面具有大量氨基的cp
‑
nh2和ha
‑
nh2纳米颗粒;再分别引发γ
‑
苄基
‑
l
‑
谷氨酸
‑
n
‑
羧酸酐(blg
‑
nca)开环聚合,分别得到了由化学接枝的cp
‑
g
‑
pblg和ha
‑
g
‑
pblg两种原料;再将原料与小分子药物淫羊藿苷(ica)按一定摩尔比通过双乳液法制备得到聚氨基酸多功能微载体。体外细胞实验以及体内动物实验发现,本施例所制备的聚氨基酸多功能微载体具有良好的促成骨、促血管以及抗菌作用,本实施例中制备的微载体能够促进牙槽骨缺损的修复。
[0095]
实施例四:
[0096]
本实施例与前述实施例基本相同,特别之处在于:
[0097]
在本实施例中,cp
‑
g
‑
pblg和ha
‑
g
‑
pblg材料的制备方法与实施例一相同。
[0098]
在本实施例中,一种聚氨基酸多功能微载体材料的制备方法,包括如下步骤:
[0099]
(1)分别取1.2mg的cp
‑
g
‑
pblg、250mg的ha
‑
g
‑
pblg和0.4mg的ica,溶解到10~30ml的二氯甲烷中得到第一混合液体系;
[0100]
(2)向所述步骤(1)中加入5~10ml 1~10wt%的明胶水溶液,并用乳化机乳化30~150s,得到第二混合体系;
[0101]
(3)将在步骤(2)中制备的第二混合体系迅速加入到500~1000ml浓度为0.1~1%的聚乙烯醇(pva)水溶液中,以1000~2000r/min的转速搅拌直至混合体系中的二氯甲烷挥发完全;
[0102]
(4)将在步骤(3)中的混合体系通过特定尺寸的筛子过筛,得到尺寸为150~300μm的聚氨基酸多功能微载体,再将得到的微载体置于37℃恒温摇床中,每过30分钟换一次水,重复洗涤多次直至微载体中的明胶被去除干净,冷冻、干燥保存。
[0103]
实验测试分析:
[0104]
对本实施例用于牙槽骨缺损修复的聚氨基酸多功能微载体材料及其制备方法。该方法中通过对羟基磷酸铜(cp)和羟基磷灰石(ha)两种纳米粒子进行表面氨基化改性,分别得到两种表面具有大量氨基的cp
‑
nh2和ha
‑
nh2纳米颗粒;再分别引发γ
‑
苄基
‑
l
‑
谷氨酸
‑
n
‑
羧酸酐(blg
‑
nca)开环聚合,分别得到了由化学接枝的cp
‑
g
‑
pblg和ha
‑
g
‑
pblg两种原料;再将原料与小分子药物淫羊藿苷(ica)按一定摩尔比通过双乳液法制备得到聚氨基酸多功能微载体。体外细胞实验以及体内动物实验发现,本施例所制备的聚氨基酸多功能微载体具有良好的促成骨、促血管以及抗菌作用,本实施例中制备的微载体能够促进牙槽骨缺损的修复。
[0105]
实施例五:
[0106]
本实施例与前述实施例基本相同,特别之处在于:
[0107]
在本实施例中,cp
‑
g
‑
pblg和ha
‑
g
‑
pblg材料的制备方法与实施例一相同。
[0108]
在本实施例中,一种聚氨基酸多功能微载体材料的制备方法,包括如下步骤:
[0109]
(1)分别取1.5mg的cp
‑
g
‑
pblg、300mg的ha
‑
g
‑
pblg和0.5mg的ica,溶解到10~30ml的二氯甲烷中得到第一混合液体系;
[0110]
(2)向所述步骤(1)中加入5~10ml 1~10wt%的明胶水溶液,并用乳化机乳化30~150s,得到第二混合体系;
[0111]
(3)将在步骤(2)中制备的第二混合体系迅速加入到500~1000ml浓度为0.1~1%的聚乙烯醇(pva)水溶液中,以1000~2000r/min的转速搅拌直至混合体系中的二氯甲烷挥发完全;
[0112]
(4)将在步骤(3)中的混合体系通过特定尺寸的筛子过筛,得到尺寸为150~300μm的聚氨基酸多功能微载体,再将得到的微载体置于37℃恒温摇床中,每过30分钟换一次水,重复洗涤多次直至微载体中的明胶被去除干净,冷冻、干燥保存。
[0113]
实验测试分析:
[0114]
对本实施例用于牙槽骨缺损修复的聚氨基酸多功能微载体材料及其制备方法。该
方法中通过对羟基磷酸铜(cp)和羟基磷灰石(ha)两种纳米粒子进行表面氨基化改性,分别得到两种表面具有大量氨基的cp
‑
nh2和ha
‑
nh2纳米颗粒;再分别引发γ
‑
苄基
‑
l
‑
谷氨酸
‑
n
‑
羧酸酐(blg
‑
nca)开环聚合,分别得到了由化学接枝的cp
‑
g
‑
pblg和ha
‑
g
‑
pblg两种原料;再将原料与小分子药物淫羊藿苷(ica)按一定摩尔比通过双乳液法制备得到聚氨基酸多功能微载体。体外细胞实验以及体内动物实验发现,本施例所制备的聚氨基酸多功能微载体具有良好的促成骨、促血管以及抗菌作用,本实施例中制备的微载体能够促进牙槽骨缺损的修复。
[0115]
综上所述,其中用实施例一所获得的聚氨基酸多功能微载体进行了细胞实验、抗菌性实验以及动物实验,验证了聚氨基酸多功能微载体具有良好的成骨性、促血管化以及抗菌性,能够加速兔牙槽骨缺损的修复且具有良好的骨再生能力。本发明上述实施例用于牙槽骨缺损修复的聚氨基酸多功能微载体材料,预先通过3
‑
氨基丙基三乙氧基硅烷(aps)分别对羟基磷酸铜(cp)和羟基磷灰石(ha)两种纳米粒子进行表面氨基化改性,分别得到两种表面具有大量氨基的cp
‑
nh2和ha
‑
nh2纳米颗粒;再分别引发γ
‑
苄基
‑
l
‑
谷氨酸
‑
n
‑
羧酸酐(blg
‑
nca)开环聚合,分别得到了由化学接枝的cp
‑
g
‑
pblg和ha
‑
g
‑
pblg两种原料;于0~5℃反应条件下,将cp
‑
g
‑
pblg、ha
‑
g
‑
pblg和ica三种原料按一定摩尔比制备,利用双乳液法制备得到复聚氨基酸多功能微载体材料,作为牙槽骨缺损修复的填充材料;其中微载体中的cu
2+
能够促进bmscs中成骨特异性基因(alp)和血管化特异性基因(vegf)的表达,以及对金黄色葡萄球菌表现出明显的抑菌效果,使得整个体系对牙槽骨缺损的修复有明显的促进作用。
[0116]
上面对本发明实施例结合附图进行了说明,但本发明不限于上述实施例,还可以根据本发明的发明创造的目的做出多种变化,凡依据本发明技术方案的精神实质和原理下做的改变、修饰、替代、组合或简化,均应为等效的置换方式,只要符合本发明的发明目的,只要不背离本发明用于牙槽骨缺损修复的聚氨基酸多功能微载体材料及其制备方法的技术原理和发明构思,都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1