一种同时鉴别胚胎染色体结构异常和致病基因携带状态的方法与流程
一种同时鉴别胚胎染色体结构异常和致病基因携带状态的方法
1.本技术要求于2020年5月22日提交中国专利局,申请号为202010443663.6,发明名称为“一种同时鉴别胚胎染色体结构异常和致病基因携带状态的方法”的中国专利申请的优先权,其全部内容通过引用结合在本技术中。
技术领域
2.本发明属于基因诊断和人类辅助生殖领域,具体而言,涉及一种同时鉴别胚胎染色体平衡结构异常和致病基因携带状态的方法。
背景技术:
3.单基因遗传病是指单个或单对等位基因突变导致身体结构发育或生理功能异常的疾病,一般遵循孟德尔遗传规律。目前明确的单基因疾病的种类已经超过1万种,由于单基因疾病种类众多,人群总体发病率约为1%,给数千万家庭和患者带来巨大的经济及精神负担。在很长一段时间,受到检测技术的限制,单基因疾病既不能防也不能治。随着分子生物学技术的快速发展,很多单基因疾病已经可以通过产前诊断技术进行胎儿期的诊断,或通过辅助生殖技术进行胚胎期的诊断,以预防缺陷患儿的出生。但由于产前诊断对孕周的要求及引产带来的多种损伤,越来越多的家庭选择辅助生殖技术进行疾病阻断,即通过胚胎植入前遗传学检测(preimplantation genetic testing
‑
monogenic disease,pgt
‑
m)技术在胚胎期做出诊断后,选择不患病的胚胎进行移植。
4.pgt
‑
m检测方法主要包括一代测序法和单体型分析法,一代测序法应用较早,该方法可以直接对胚胎活检细胞进行突变位点的检测,但由于存在等位基因脱扣(allele drop
‑
out),会存在较高的误诊率。单体型分析法是指对致病基因上下游选取遗传标记,如短串联重复序列(short tandem repeats,str)或单核苷酸多态性(single nucleotide polymorphism,snp)位点,在有先证者的家系中通过连锁分析确定胚胎致病基因的携带状况。如果选用str位点,须针对每一种单基因疾病进行str设计,并且通过家系验证后才能用于pgd,该过程需要时间较长并且费用高,而且基因组中str遗传标记分布较少,有些致病基因附近没有足够的str用于单体型分析。snp遗传标记相比str含有更丰富的遗传信息,平均每300
‑
500个碱基就会有1个,近几年在单基因疾病的pgt
‑
m中应用较多。但传统单体型分析法由于技术的限制,在检测目标致病基因突变的同时,无法检测胚胎染色体的整倍体性,使通过pgt
‑
m检测后为基因非致病性的胚胎,仍有可能为染色体非整倍体(包括完全非整倍体和部分非整倍体),进而造成胚胎移植后出现流产或出生缺陷等不良结局,因此需要实验再次进行非整倍体检测。且要求必须要有先证者的存在,对于无先证者的病例难以通过常规辅助生殖技术阻断。
5.染色体结构异常又称染色体重排,是指染色体或染色单体经过断裂
‑
重换或互换机理产生的染色体畸变,临床上主要包括染色体平衡易位和染色体倒位,与不孕不育、复发性流产、死胎、死产、新生儿发育迟缓及其他先天畸形等不良妊娠结局密切相关,是导致不
孕不育症和早期复发性流产的重要原因。染色体平衡易位主要包括相互易位和罗伯逊易位,在人群中的发病率约为0.27%,在反复自然流产人群中发病率可高达3.81%。染色体倒位根据断裂点的位置是否包含着丝粒分为臂内倒位和臂间倒位,在我国生育障碍人群中致病性倒位的发病率约为0.22%。不经干预早期流产率可达90%以上,给女性患者造成反复的清宫手术、感染、宫腔粘连等,对育龄妇女的身体和精神方面的健康状态造成重大影响。这些人群很难自然妊娠,目前临床上主要通过辅助生殖技术胚胎植入前遗传学检测(preimplantation genetic testing
‑
structural rearrangements,pgt
‑
sr),筛选患者的染色体整倍体胚胎进行移植以改善妊娠结局,检测方法主要包括荧光原位杂交技术、实时荧光定量核酸扩增、基因芯片、二代测序等,pgt
‑
sr是这些夫妻的主要助孕方法,可以降低由染色体数目异常引起的出生缺陷问题。
6.但这些临床常用的pgt
‑
sr检测方法存在共同的局限性:仅可以检测胚胎染色体非整倍体,却不能检测胚胎的染色体结构异常,即不能进一步将整倍体胚胎中的染色体结构异常与结构正常两种类型胚胎进行区分。这就会造成传统pgt
‑
sr生育的新生儿中理论上有50%仍是染色体结构异常携带者,这部分新生儿到成年婚育时会发生与其父母相同的不孕不育、复发性流产等危害生殖健康的病症。因此,如何突破传统技术,在胚胎植入前同时检测出胚胎的染色体结构异常和染色体非整倍体,优先移植染色体整倍体和结构均正常的胚胎,从根本上阻断该遗传性疾病的遗传传递,同时解决患者自身目前的生育困难和下一代成年后潜在的生育风险。
7.近年来,国内外研究在染色体结构异常筛查方面有一些相关技术报道,但是这些方法存在较大的局限性:首先只能对胚胎的染色体结构异常和染色体非整倍体分别进行检测,需要多次检测实验操作;其次需要根据病人染色体的断裂点位置进行个体化设计,技术相对复杂、耗时长,不具有通用性,难以在生殖中心进行推广应用。而我们前期的研究创新性地避开了直接对胚胎断裂点检测的困难,通过家系样本收集,将患者夫妻双方和一位参照样本构建家系单体型,进行胚胎染色体非整倍体检测同时,通过连锁分析明确结构异常染色体的单体型和结构正常染色体的单体型,确立胚胎染色体结构异常检测模型,通过识别胚胎是否携带结构异常染色体单体型,来对胚胎染色体结构进行精准区分,即一次检测同时能完成染色体结构异常和染色体非整倍体的分析。
8.由于单基因疾病和染色体结构异常在人群中发病率均较高,同时携带这两类遗传病的患者在人群中有一定的比例,而且这些患者基本没有单基因疾病的先证者,由于检测技术的限制,截止目前未有对这类患者群体的辅助生殖治疗相关检测技术报道。本研究希望构建出一种新的检测技术方法,能够对同时携带单基因疾病致病突变和染色体结构异常的病例进行精准的胚胎植入前遗传学检测,即通过一次检测,同时在胚胎期检测出基因异常、染色体非整倍体和染色体结构的异常,移植基因和染色体均正常的胚胎,从根本上阻断向下一代的遗传,预防出生缺陷,是临床亟待解决的难题,是精准医学的要求,对提高人群生殖健康水平和降低出生缺陷具有重要意义。
技术实现要素:
9.针对上述现有技术中存在的空白,本发明以家系全基因组单体型分析模型为基础,构建出一种综合性的通用技术方法,该方法仅通过一次检测,不仅能检测出胚胎的致病
基因,也同时能检测出胚胎的染色体非整倍体和染色体结构异常,多种异常无需分别检测,为遗传病患者的胚胎精准诊断提供指导。
10.本发明的具体技术方案如下:
11.本发明提供一种用于鉴别胚胎染色体结构异常和/或致病基因携带状态的家系单体型中参照样本单体型的构建方法,包含以下步骤:
12.(1)样本基因分型:将以下对象进行大规模snp基因型检测:
13.a.染色体结构异常和/或致病基因携带者夫妇双方;和,
14.b.至少一名携带者亲属、携带致病基因的子代、或染色体异常的胚胎;
15.其中,携带者亲属可为与携带者具有相同染色体结构异常和/或致病基因的亲属,也可为染色体和/或基因正常的亲属;
16.将上述a和b称为参照样本;
17.(2)确定信息snps位点:
18.a.当参照样本中包含携带者亲属时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型,并且在携带者亲属中也是纯合型的snp位点为信息snps位点;
19.b.当参照样本中包含携带致病基因的子代或染色体异常的胚胎时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型的snp位点为信息snps位点;
20.(3)构建家系单体型中参照样本单体型:集合步骤(2)确定的信息snps位点通过家系连锁分析得到覆盖致病基因、致病基因所在染色体和与其相对应的等位基因所在的同源染色体、两处染色体结构异常断裂点区域、结构异常染色体整条染色体及其同源染色体的整条染色体的单体型,获得家系单体型中参照样本单体型。
21.本发明提供一种用于鉴别胚胎染色体结构异常和/或致病基因携带状态的家系单体型中参照样本单体型的构建系统,所述系统包含能够计算处理样本数据的软件、和用于承载上述软件的硬件,
22.(1)所述系统还包含储存有参照样本的大规模snp基因型检测的基因分型数据的硬件;所述参照样本为:a.染色体结构异常和/或致病基因携带者夫妇双方;和b.至少一名携带者亲属、携带致病基因的子代、或染色体异常的胚胎;其中,携带者亲属可为与携带者具有相同染色体结构异常和/或致病基因的亲属,也可为染色体和/或基因正常的亲属;
23.(2)所述软件根据下述规则确定信息snps位点:
24.a.当参照样本中包含携带者亲属时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型,并且在携带者亲属中也是纯合型的snp位点为信息snps位点;
25.b.当参照样本中包含携带致病基因的子代或染色体异常的胚胎时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型的snp位点为信息snps位点;
26.(3)所述软件依照下述原则构建家系单体型中参照样本单体型:集合步骤(2)确定的信息snps位点通过家系连锁分析得到覆盖致病基因、致病基因所在染色体和与其相对应的等位基因所在的同源染色体、两处染色体结构异常断裂点区域、结构异常染色体整条染色体及其同源染色体的整条染色体的单体型,获得家系单体型中参照样本单体型。
27.本发明提供一种用于鉴别胚胎染色体结构异常和/或致病基因携带状态的家系单
体型的构建方法,包含以下步骤:
28.(1)样本基因分型:将以下对象进行大规模snp基因型检测:
29.a.染色体结构异常和/或致病基因携带者夫妇双方;
30.b.至少一名携带者亲属、携带致病基因的子代、或染色体异常的胚胎;和,
31.c.a所述携带者夫妇的体外受精胚胎;
32.其中,携带者亲属可为与携带者具有相同染色体结构异常和/或致病基因的亲属,也可为染色体和/或基因正常的亲属;
33.将上述a和b称为参照样本;c称为待定样本;
34.(2)确定信息snps位点:
35.a.当参照样本中包含携带者亲属时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型,并且在携带者亲属中也是纯合型的snp位点为信息snps位点;
36.b.当参照样本中包含携带致病基因的子代或染色体异常的胚胎时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型的snp位点为信息snps位点;
37.(3)构建家系单体型:集合步骤(2)确定的信息snps位点通过家系连锁分析得到覆盖致病基因、致病基因所在染色体和与其相对应的等位基因所在的同源染色体、两处染色体结构异常断裂点区域、结构异常染色体整条染色体及其同源染色体的整条染色体的单体型,不同染色体单体型的集合称为家系单体型。
38.本发明提供一种用于鉴别胚胎染色体结构异常和/或致病基因携带状态的家系单体型的构建系统,所述系统包含能够计算处理样本数据的软件、和用于承载上述软件的硬件,
39.(1)所述系统还包含储存有参照样本和待定样本的大规模snp基因型检测的基因分型数据的硬件;所述参照样本为:a.染色体结构异常和/或致病基因携带者夫妇双方;和b.至少一名携带者亲属、携带致病基因的子代、或染色体异常的胚胎;所述待定样本为所述携带者夫妇的体外受精胚胎;其中,携带者亲属可为与携带者具有相同染色体结构异常和/或致病基因的亲属,也可为染色体和/或基因正常的亲属;
40.(2)所述软件根据下述规则确定信息snps位点:
41.a.当参照样本中包含携带者亲属时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型,并且在携带者亲属中也是纯合型的snp位点为信息snps位点;
42.b.当参照样本中包含携带致病基因的子代或染色体异常的胚胎时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型的snp位点为信息snps位点;
43.(3)所述软件依照下述原则构建家系单体型:每条染色体上依照上述标准选取的信息snps位点,通过家系连锁分析得到覆盖致病基因、致病基因所在染色体和与其相对应的等位基因所在的同源染色体、两处染色体结构异常断裂点区域、结构异常染色体整条染色体及其同源染色体的整条染色体的单体型,不同染色体单体型的集合称为家系单体型。
44.本发明所述方法或系统,其中所述染色体结构异常包括染色体平衡易位和染色体倒位;所述染色体平衡易位包括相互易位和罗伯逊易位。
45.本发明提供一种用于鉴别胚胎染色体结构异常和/或致病基因携带状态的方法,
包含以下步骤:
46.(1)样本基因分型:将以下对象进行大规模snp基因型检测:
47.a.染色体结构异常和/或致病基因携带者夫妇双方;
48.b.至少一名携带者亲属、携带致病基因的子代、或染色体异常的胚胎;和,
49.c.a所述携带者夫妇的体外受精胚胎;
50.其中,携带者亲属可为与携带者具有相同染色体结构异常和/或致病基因的亲属,也可为染色体和/或基因正常的亲属;
51.将上述a和b称为参照样本;c称为待定样本;
52.(2)确定信息snps位点:
53.a.当参照样本中包含携带者亲属时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型,并且在携带者亲属中也是纯合型的snp位点为信息snps位点;
54.b.当参照样本中包含携带致病基因的子代或染色体异常的胚胎时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型的snp位点为信息snps位点;
55.(3)构建家系单体型:集合步骤(2)确定的信息snps位点通过家系连锁分析得到覆盖致病基因、致病基因所在染色体和与其相对应的等位基因所在的同源染色体、两处染色体结构异常断裂点区域、结构异常染色体整条染色体及其同源染色体的整条染色体的单体型,不同染色体单体型的集合称为家系单体型;
56.(4)数据收集和分析:
57.1)当以染色体结构异常和/或致病基因携带者夫妇双方,和,与携带者具有相同染色体结构异常和/或致病基因的亲属为参照样本时:
58.a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息和携带者以及与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;当待定样本致病基因或染色体结构异常断裂点区域单体型信息与参照样本中结构异常和/或致病基因携带者单体型信息一致,但和与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息不一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;
59.b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
60.i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
61.ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反;
62.2)当以染色体结构异常和/或致病基因携带者夫妇双方,和,染色体正常的亲属为参照时:
63.a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息,与携带者及与携带者的染色体正常的亲属的单体型信息一致时,则待定样本判断为非致病基因携带或非染色体结构异常
携带胚胎;当待定样本致病基因或染色体结构异常断裂点区域单体型信息与参照样本中结构异常和/或致病基因携带者单体型信息一致,但和与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息不一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;
64.b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
65.i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
66.ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反;
67.3)当以携带致病基因的子代或染色体异常的胚胎为参照样本时:
68.a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息,与携带致病基因的子代或染色体异常的胚胎的单体型信息一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;当不一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;
69.b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
70.i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
71.ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反。
72.本发明提供一种用于鉴别胚胎染色体结构异常和/或致病基因携带状态的系统,所述系统包含能够计算处理样本数据的软件、和用于承载上述软件的硬件,
73.(1)所述系统还包含储存有参照样本和待定样本的大规模snp基因型检测的基因分型数据的硬件;所述参照样本为:a.染色体结构异常和/或致病基因携带者夫妇双方;和b.至少一名携带者亲属、携带致病基因的子代、或染色体异常的胚胎;所述待定样本为所述携带者夫妇的体外受精胚胎;其中,携带者亲属可为与携带者具有相同染色体结构异常和/或致病基因的亲属,也可为染色体和/或基因正常的亲属;
74.(2)所述软件根据下述规则确定信息snps位点:
75.a.当参照样本中包含携带者亲属时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型,并且在携带者亲属中也是纯合型的snp位点为信息snps位点;
76.b.当参照样本中包含携带致病基因的子代或染色体异常的胚胎时,在染色体结构异常和/或致病基因携带者中为杂合型,在其配偶中为纯合型的snp位点为信息snps位点;
77.(3)所述软件依照下述原则构建家系单体型:每条染色体上依照上述标准选取的信息snps位点,通过家系连锁分析得到覆盖致病基因、致病基因所在染色体和与其相对应的等位基因所在的同源染色体、两处染色体结构异常断裂点区域、结构异常染色体整条染色体及其同源染色体的整条染色体的单体型,不同染色体单体型的集合称为家系单体型;
78.(4)所述软件将待定样本中染色体结构异常断裂点区域的单体型信息和参照样本
的染色体单体型信息进行比对,判断规则如下:
79.1)当以染色体结构异常和/或致病基因携带者夫妇双方,和,与携带者具有相同染色体结构异常和/或致病基因的亲属为参照样本时:
80.a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息和携带者以及与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;当待定样本致病基因或染色体结构异常断裂点区域单体型信息与参照样本中结构异常和/或致病基因携带者单体型信息一致,但和与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息不一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;
81.b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
82.i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
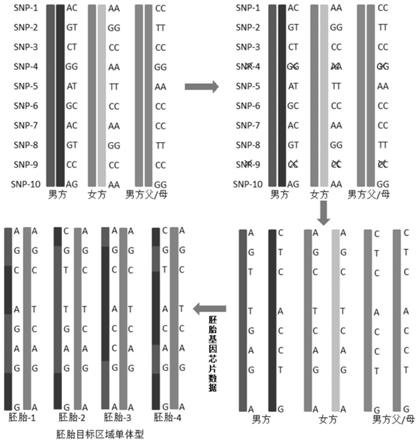
83.ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反;
84.2)当以染色体结构异常和/或致病基因携带者夫妇双方,和,染色体正常的亲属为参照时:
85.a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息,与携带者及与携带者的染色体正常的亲属的单体型信息一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;当待定样本致病基因或染色体结构异常断裂点区域单体型信息与参照样本中结构异常和/或致病基因携带者单体型信息一致,但和与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息不一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;
86.b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
87.i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
88.ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反;
89.3)当以携带致病基因的子代或染色体异常的胚胎为参照样本时:
90.a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息,与携带致病基因的子代或染色体异常的胚胎的单体型信息一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;当不一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;
91.b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
92.i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
93.ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域
的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反。
94.本发明所述大规模snp基因型检测覆盖23对染色体;大规模snp基因型检测方法优选基因芯片或基因测序。
95.本发明所述胚胎活检,胚胎发育至第3
‑
7天时,活检获取1
‑
10个细胞作为所述待定样本的检测样本;优选来源于胚胎卵裂球活检或囊胚滋养外胚层活检的细胞。将活检获取的细胞裂解,进行全基因组扩增;全基因组扩增方法可选自mda方法、malbac方法、或其他全基因组扩增方法。
96.本发明所述参照样本的检测样本来源为体细胞,优选外周血。
97.本发明所述方法或系统,确定信息snps位点时,选择覆盖致病基因、致病基因所在染色体和与其相对应的等位基因所在的同源染色体、染色体结构异常断裂点、结构异常染色体和与其相对应的正常的同源染色体上的信息snps;染色体每mb范围内至少选择1个信息snp;在覆盖断裂点区域,信息snps从断裂点上下游1
‑
30mb范围内选择;优选的,覆盖染色体结构异常断裂点区域,所述信息snps从染色体结构异常断裂点上下游2
‑
4mb范围内选择,优选从染色体结构异常断裂点上下游2mb范围内选择。
98.本发明所述方法或系统,确定信息snps位点时,染色体每mb范围内至少选择1、2、3、4、5、6、7、8、9或10个信息snps。
99.本发明所述方法或系统,信息snps从断裂点上下游1
‑
5mb、或5
‑
30mb范围内选择。
100.本发明所述同时鉴别胚胎染色体结构异常和致病基因携带状态的方法具有如下优势:
101.(1)本发明所述方法不仅适用于同时具有染色体病和单基因病的患者,也适用于只具有染色体病或单基因病的患者,且多种不同异常只需要一次检测,不需要分别进行,是一种综合性的通用技术;
102.(2)本发明所述方法仅通过一次检测,能同时完成对胚胎致病基因、染色体非整倍体和染色体结构异常的精准检测,且无需预实验;
103.(3)本发明所述方法能构建患者家系的全基因组单体型,具有通用性,因此不需要个体化设计,适用于所有类型的单基因疾病和染色体结构异常患者;
104.(4)本发明所述方法创新性的通过间接的单体型连锁分析对胚胎基因和染色体进行检测分析,有效地避开了难以直接对有限胚胎细胞进行致病基因突变位点和断裂点检测的技术壁垒。
105.(5)本发明所述方法对于胚胎单基因疾病致病基因的检测,可以无先证者。
106.(6)本发明所述方法检测耗时短,在2
‑
3天能够完成全部的实验和分析,适用于临床推广应用。
107.(7)实现患者的精准治疗,阻断单基因疾病给子代带来的病痛,同时阻断染色体结构异常给子代带来的潜在生育障碍困扰,真正实现优生优育,提高子代的健康水平。
附图说明
108.图1.囊胚培养、活检及全基因组扩增流程图。
109.图2.检测分析模型图。
110.图3.本发明检测方法的有效性验证流程图。
111.图4.胚胎活检细胞全基因组扩增后的dna产物qpcr质控位点结果:a表示样本检测结果为阳性;b表示样本检测结果为阴性;c表示阳性对照样本的结果;d表示阴性对照样本的结果。
112.图5.完成促排卵6个病例的家系图。
113.图6.析结果中检测分析模型和胚胎单体型结果(以病例
‑
6为例)。
114.图7.胚胎非整倍体检测结果(以病例
‑
6为例)。
具体实施方式
115.1、病例纳入和家系样本收集
116.纳入夫妻双方同时携带致病基因突变和染色体结构异常(夫妻双方均为染色体结构异常的概率很低,一般为夫妻一方)携带的病例,病例夫妇双方的父母分别进行致病基因突变和染色体核型分析,以明确该病例夫妇双方致病基因突变和染色体结构异常的来源,即明确为新发变异或家系遗传。收集夫妻双方及夫妻双方各自父母的外周血样本,构建基本家系,为构建分析模型奠定基础。在患者父母样本已经无法获得(如去逝)的情况下,可采集患者兄弟姐妹的外周血替代,但不建议采集除父母和兄弟姐妹以外的亲属样本。
117.2、胚胎检测分析模型的构建
118.(1)三种家系单体型分析模型
119.对家系样本使用全基因组snp芯片进行snp分型,定义信息snp(informative snp)选择标准,将家系信息snp遗传标记进行家系单体型连锁分析,通过单体型分析区分患者等位基因或同源染色体的两条单体型,通过连锁分析明确携带致病基因和非携带致病基因的单体型,同时明确结构异常染色体的单体型和结构正常染色体的单体型,构建胚胎检测分析模型。
120.单体型分析区域大小的选择:在分析断裂点区域时,要满足有足够的遗传标记用于结构异常断裂点区域的连锁分析;在分析整条染色体单体型时,注意识别生殖细胞减数分类过程中发生的同源重组情况,避免由于同源重组引起的误诊。同时注意遗传标记分布的均匀性,保证分析的区域存在有效的遗传标记。
121.根据不同的参照样本,可以构建不同的分析模型,不同的分析模型对信息snp选择标准不同,以下提供三种不同的分析模型。基于孟德尔遗传定律判断每个有效信息snp的染色体来源,并根据参照样本的基因型确定同相(in phase)与异相(out of phase)(在每个有效位点,根据每个胚胎遗传自染色体异常和/或致病基因携带者的染色体是否与参照亲属/子代的染色体相同,如果相同,则为同相;如果不相同,则为异相)。
122.(1
‑
a)当以携带致病基因或染色体结构异常的父母一方作为参照时,要求同时满足在患者中为杂合,在患者配偶及参照中为纯合的snps;(1
‑
b)当以不携带致病基因或染色体正常的父母一方作为参照时,要求同时满足在患者中为杂合,在患者配偶及参照中为纯合的snps。如下表所示,男方为携带者,以男方父亲或男方母亲为参照亲属,有效位点信息如下表。(若女方为携带者,以女方父亲或母亲为参考,原理类似。)a代表一条染色体上致病基因或染色体的某snp型,b代表另外一条同源染色体上a的相对应的等位基因型。
[0123][0124]
(1
‑
c)当以携带致病基因的子代或染色体异常的胚胎作为参照时,要求同时满足在患者中为杂合,在患者配偶中为纯合的snps;如男方为携带者,以不平衡胚胎或子代为参考,有效位点信息如下表。(若女方为携带者,原理类似。)
[0125][0126]
(2)单体型辅助cnv分析:分别使用不同的颜色代表不同的单体型
[0127]
1)重复区段
‑
来自两条染色体:如果重复来自母亲的同源染色体或父亲的同源染色体,则该区段中的有效位点交叉分布在同源染色体上,导致分型结果出现混合的两种颜色。若重复来源于母亲,体现为母亲的分型结果颜色交叉分布;同样,若来源于父亲,体现为父亲的分型结果颜色交叉分布。
[0128]
2)重复区段
‑
来自一条染色体的两个拷贝:如果重复来自母亲或父亲的一条链的多个拷贝,则该区段中的有效位点不变,颜色分布不变。
[0129]
3)缺失区段:假设缺失来源于母亲链,若以子代为参考,则该区段中父源有效位点(父亲为ab)不变,父亲链的颜色分布不变;母源有效位点(母亲为ab)无效,体现为母亲链的颜色交叉分布。若以女方父母为参考,由于母源有效位点无效,则该区段中体现为无点。
[0130]
4)嵌合缺失与嵌合重复:虽然嵌合缺失与嵌合重复导致位点的baf分布趋势与常规不同,但低比例的嵌合改变不了基因型,所以嵌合区段的单体型颜色分布没有异常。
[0131]
此外,当父母外周血染色体核型均为正常时,染色体结构异常为新发变异,此时只能选取不平衡胚胎作为参照建立家系(如上述(1
‑
b));当父母一方外周血染色体核型为相同的结构异常时,染色体结构异常为遗传性,其父母(如上述(1
‑
a))和不平衡胚胎(如上述(1
‑
b))均可作为参照建立家系。
[0132]
3、胚胎植入前遗传学筛查
[0133]
(1)通过促排卵,对体外正常授精的胚胎在显微镜下进行活检取得胚胎外胚层细
胞,在进行全基因组扩增后使用相同snp基因芯片对样本进行植入前遗传学检测,通过snp等位基因频率进行染色体非整倍体的检测,即挑选整倍体胚胎,且该方法可以检测出胚胎的三倍体和单亲二倍体(uniparental disomy,upd);同时利用胚胎检测分析模型,通过识别胚胎致病基因附近的单体型信息,对待测胚胎致病基因的基因型进行诊断;同时通过识别胚胎重排断裂点附近的单体型信息,对待测胚胎进行染色体结构异常和结构正常的区分。
[0134]
(2)分别以结构异常染色体的两个断裂点区域的单体型分析胚胎染色体状况,比较两个不同染色体断裂点区域单体型检测结果的一致性。
[0135]
(3)探讨分别使用(1
‑
a)与病例具有相同携带致病基因或染色体结构异常的父母、(1
‑
b)非携带致病基因或染色体结构异常的父母、(1
‑
c)携带致病基因的子代或染色体异常的胚胎进行分析模型构建时,比较在不同参照样本下构建的模型对胚胎检测结果的一致性。
[0136]
4、胚胎移植随访、模型有效性的验证
[0137]
在已经完成检测的胚胎对移植后,进行随访,对孕中期的孕妇进行胎儿羊水穿刺产前诊断,确认胎儿羊水细胞的致病突变基因型和染色体核型,对检测分析模型的有效性进行评估。同时随访至胎儿出生后,对胎儿的重要生理指标进行监测记录。
[0138]
若无特殊说明,本发明中使用的具体技术手段均为本领域技术人员所能够掌握的常规技术手段。本发明实施例并不作为对本发明实施的具体限制。
[0139]
实施例1:囊胚培养、活检及全基因组扩增方法
[0140]
在患者经促排卵、胞浆内单精子注射及囊胚活检后,将活检细胞置于装有碱性变性缓冲液(koh)的pcr管中进行细胞裂解,然后进行全基因组扩增,囊胚培养、活检采用临床常规方法进行。将由pg级别的基因组dna至少扩增成为ng级别以进行后续实验。用荧光pcr和毛细管电泳检验dna扩增效率,流程详见图1。
[0141]
(一)mda法单细胞全基因组扩增
[0142]
1、准备两个0.2ml进口ep管,分别加入2.5μl和4μl水,作为体积对照管备用。
[0143]
2、将样本离心1min,检查液体体积,与对照管进行比对,拍照保存将比对结果记录在册,做到样本体积可追溯。
[0144]
3、如果样本体积少于4μl,使用pbs补足到4μl;若样本体积大于4μl,需及时上报,待确认可继续实验后,再进行mda扩增。
[0145]
4、准备buffer d2(下表给出的buffer d2体积足够12个反应,一次实验未完全用完可储存于
‑
20℃,但储存时间不能超过3个月)。
[0146]
组分体积dtt,1m3μlreconstituted buffer dlb33μl总体积36μl
[0147]
5、在每个样本管中加入3μl buffer d2,轻弹管壁混匀并短暂离心收集于管底,离心结束的样品管放入pcr冰盒中。
[0148]
注意:请确保管内液体没有粘附在管壁上,请勿使用移液器吹打,避免细胞样本粘附到移液器的吸头上。
[0149]
6、打开pcr仪,设置pcr程序如下:65℃10min;4℃hold(热盖温度:105℃)。
[0150]
7、把样本管放置在pcr仪中进行裂解反应,pcr反应结束后,迅速加入3μl stop solution,轻弹管壁混匀并短暂离心。下步反应混合液准备好之前请将样本置于冰盒上。
[0151]
8、准备反应混合液:
[0152]
组分体积h2o sc9μlrepli
‑
g sc reaction buffer29μlrepli
‑
g sc dna polymerase2μl总体积40μl
[0153]
9、立即将40μl反应混合液加入到准备好的10μl dna样本中(第4.2.7步),充分振荡混匀并短暂离心收集。
[0154]
10、把上述样本放入到pcr仪内,进行单细胞扩增反应,pcr程序如下:
[0155]
30℃59min59s 8cycles;65℃3min;4℃hold(热盖温度:70℃)
[0156]
11、扩增产物
‑
20℃保存备用。
[0157]
(二)扩增产物浓度测定
[0158]
1、用qubit定量:mda扩增产物无核酸酶水稀释10倍后进行浓度测定。
[0159]
2、浓度质检合格要求:所有样本测定后浓度≥300ng/μl。若浓度低于此范围,则不进行后续实验。
[0160]
(三)mda扩增产物质检
[0161]
1、实验前准备
[0162]
1)个人防护:根据实验室安全防护相关程序内容,更换实验服、戴帽子、口罩、鞋套进入实验室。
[0163]
2)紫外消毒:打开超净工作台内的紫外灯,杀菌30min,关闭紫外灯,打开风机,3级风,通风10min。
[0164]
3)打印相关材料:实验操作记录单、条码等。
[0165]
4)仪器准备:检查设备是否正常,包括掌上三管离心机,微量台式离心机,qpcr仪等。
[0166]
5)试剂准备:包括qpcr试剂,无核酸酶水,检查试剂盒中各组分是否齐全完好且在效期内,并放置冰盒上溶解备用。
[0167]
6)耗材准备:包括各种规格滤芯吸头,1.5ml进口ep管,2ml进口ep管,qpcr专用八连管及管盖,双面板,冰盒。
[0168]
7)样本准备:核实样本姓名与编号是否一致,核实一致后将样本放置冰盒上备用。
[0169]
2、引物准备
[0170]
质检引物设计时,考虑到单细胞扩增产物完整性及不同扩增子扩增效率存在差异,尽量满足扩增产物分布在不同的染色体上,且扩增产物长度有不同。
[0171]
具体引物对应扩增产物dna序列如下:
[0172]
mq1:
[0173]
gcctgcccagacctagtaattgctgtagtcttttccttttggattcctagcagtggatgcttgaatacaaataccaagtgggctccagccagtgagggtaatagtgtacagcagtaaactgtctgttagctgatgcttacatttca
gacaaattgaggaggttgtcaaaggcattagcttctatcctttccagggaatcaatctgagagatttcactagggaagagaggagggggaaaaagagaaagaaacatgaaagaaatgaccgtgtctgcatgattatgagctatgtgtgtgacccaacaactggggacaccactgtgtccccctgaaaagaacaaagatgtgcaagttgtccccaaatcatacagtgctaacatctccctttaggagcactgatgggca
[0174]
mq2:
[0175]
ttggaggaagcagataacattgctagtatcccacttgaacctggaaaagagcagcaactaaaagaaaagcttgagcaagtcaaggtaattttattttctcaaatcccccagggcctgcttgcataaagaagtatatgaatctattttttaattcaatcattggttttctgcccattaggttattca
[0176]
mq3:
[0177]
tttcgacatggaggccactggcttgcccttctcccagcccaaggtcacggagctgtgcctgctggctgtccacagatgtgccctggagagcccccccacctctcaggggccacctcccacagttcctccaccaccgcgtgtggtagacaagctctccctgtgtgtggctccggggaaggcctgcagccctgcagccagcgagatcacaggtctgagcacagctgtgctggcagcgcatgggcgtcaatgttttgatgacaacctggccaacctgctcctagccttcctgcggcgccagccacagccctggtgcctggtggcacacaatggtgaccgctacgacttccccctgctccaagcagagctggctatgctgggcctcaccagtgctctggatggtgccttctgtgtggatagcatcactgcgctgaaggccctggagcgagcaagcagcccctcagaacacggcccaaggaagagctatagcctaggcagcatctacactcgcctgtatgggcagtcccctccagactcgcacacggctgagggtgatgtcctggccctgctcagcatctgtcagtggagaccacaggccctgctgcggtgggtggatgctcacgccaggcctttcggcaccatcaggcccatgtatggggtcacagcctctgctaggaccaagccaagaccatctgctgtcacaaccactgcacacctggccacaaccaggaacactagtcccagcct
[0178]
mq4:
[0179]
gggttgtcccctggatataggaggggtgaggtgggtcagagggtgccgggaggggcctggatcagcacttcaaaaggtgggtgcccgccacccaggggtggccccaaggagaggagaggagctggccatgtgcagagatggggccctgtgatgcagacacacctcggtaccagttgcgcagggaggtcatgacgaagaagcggatggcctggttcgagccctgcttcaggacagtggctgtgaggccctggtacgtccccttcagccctgcgggaaggcaggcacggggttaccctgcagcctctcaggccccggttgggaattggtgtgtgtggggggtgggtgttgcacaaagcccaaggcaggatgggaggtgcaggcccttcccaccctggcccaggtccctgagccctatcaggaaggtcgagtggctcaccttgttcccgcacaatctccctaaccccgtggaagaatcctctgtacttggggtttggggaggtctggtcgtggatgaactt
[0180]
mq5:
[0181]
tcaagtttcctctcacctttattctacttcctcattaacaagtcatcggtttgatacattaatcatggcaaaaaaatcacagaggaagcactaatctgtcatttttttctgtgacctgcagactctttgacacccggtacagcatccgggagaatgggcagctcctcaccatcctgagtgtggaagacagtgatgatggc
[0182]
mq6:
[0183]
gcgatcgatgcagtggacatggtactcatgggaacaaggtagtttacgaagtttgttgccttctgtatattctgtaatgcaaacactacaggtttttaatgcatcattttcaccaaaacttctcattgccaagttgtcaatctgttctttggtgagtcctctaggttggtcatcatcatcctcatttaagaggaaaaactgagccaggctaaggaagggcaaagagccactttcatcaaatgtgactggggccctatgtcgaccctctcgcctggcacctgatgagcctgatgatgagcttccttcattactgccttcaaataaatctgagctagtttctgaactttcaccaccggaactggaactaggactggaactggaacttgaactggaactggaactcgaactggaactggaactcgaactggaaccagaactactaccaccaccagaacctcctcttccactccgtgactctgccctttccatatttcgatttgagactgagccagtaggctctgagtcgctatc
actgtacataaaatagcttaactcaccaaaacctgtcattatctgccttaacatggtctgaattgcaacagatgtagtctcacttaaaccagtatttaagattctacgaatgggaattctgatggtact
[0184]
mq7:
[0185]
ctcaagacgtggaggcatctgggcttagctgaggtcacactactagtgggacctacagaaaaacccaggtgtgtcaccagcagggcgggcaccatctctgcagccgacaccagcttccccaacctccagacaggagaaagcatgagggtccccactgaaattctggctcacagagtcacctcctatgctgtggcttttttcaatcccagagtttgtccagcgaggcaaagacctggtcacggcgtctctggctcaccaggtggagggaacggcaaaactcacgctggcccaagaggaggaacagagaagcttcctggctgaggcccagccgactgctgacccggaaaagtttctcgaggtgactcacatccccagcctctgcacatgtgggtgagccagttgtagctctgttcccgtgactgagcacgggacgccggaggtattcatcaggcatgaggttatctgcctacttcccatgtgtcag
[0186]
mq8:
[0187]
gtgctccagatctgatggaactgagccggcctggggctgggtgggcctgaggggtggtggggctcaccggatggtgccgctgaagaggacggggtcctgcaggatgatggagaggcgtgagcgcagggtgtgcagcggcagtttggcgatgtcaatgccatcaatgatgatgtgccctgcatgg
[0188]
1)将8对引物干粉12,000rpm离心1min,加无核酸酶水稀释至100μm母液,
‑
20℃长期保存;使用时取少量母液稀释至2μm的工作液,
‑
20℃保存备用。
[0189][0190][0191]
2)引物选择:一般情况下使用全部8对或部分引物进行mda扩增产物进行质检验证,验证覆盖全面、可信度高。
[0192]
3、模板准备
[0193]
1)mda扩增产物:将定量后符合要求的mda扩增产物用无核酸酶水稀释10倍,作为qpcr反应模板。
[0194]
2)阳性质控:混合的人外周血或人细胞系基因组dna,浓度≈50ng/μl。
[0195]
3)阴性质控:无核酸酶水。
[0196]
4、配置pcr反应体系
[0197]
下表为qpcr反应体系。
[0198]
试剂名称单管体系(20ul)备注kapa sybr mix 2
×
10μl含sybr荧光染料的mix模板dna2μl注:mda产物需稀释10倍引物f,2μm3μl 引物r,2μm3μl high rox0.4μl注:根据不同仪器选用ddh2o1.6μl [0199]
5、pcr循环参数如下表所示
[0200][0201]
6、结果分析
[0202]
1)判断标注:
[0203]
a.阳性结果:扩增产物熔解峰单一尖锐,tm值预期范围固定;扩增曲线成典型s型,且一般ct值≤28(不能>30)。
[0204]
即同时满足4个条件(熔解峰单一尖锐、tm值范围固定、s型曲线、ct值≤28)则为阳性;若其中有条件不满足(尤其ct值和熔解峰型),则为阴性或弱阳性。
[0205]
b.阴性结果:扩增产物熔解峰多个,或无单一尖锐主峰,tm值不在预期范围;扩增曲线不成典型s型,一般ct值>30。
[0206]
即上述4个条件存在任何一个,则为阴性或弱阳性;尤其是ct值>30必为阴性、熔解峰多个且无主峰必为阴性。
[0207]
2)结果分析流程:
[0208]
a.按照“判定标准”原则,首先分析阳性质控和阴性质控,确保阳性质控结果为阳性,阴性质控结果为阴性。若阴阳性质控结果不正确,说明操作不当或试剂质量有问题,需排除原因重新验证。
[0209]
b.在阴阳性质控结果正确无误后分析mda扩增产物,按照“判定标准”原则,对比阳性、阴性结果,逐一分析每个mda扩增产物。
[0210]
c.分析结果整理汇总,保留质检记录。
[0211]
实施例2:构建检测分析模型
[0212]
对家系样本进行全基因组snp分型,定义信息snp选择标准,将信息snp遗传标记进行单体型连锁分析,通过单体型分析区分患者致病基因等位基因和同源染色体的不同单体
型,通过连锁分析明确携带致病基因和非携带致病基因的单体型,明确结构异常染色体的单体型和结构正常染色体的单体型,构建胚胎检测分析模型。
[0213]
将待测胚胎全基因组snp数据代入检测分析模型,通过snp等位基因频率(b allele frequency)对胚胎染色体非整倍体进行分析,通过检测分析模型确定胚胎的单体型,通过分析胚胎是否携带致病基因和结构异常染色体断裂点的单体型及断裂点区域是否发生了同源重组,对胚胎致病基因和染色体携带状态进行检测。详见检测分析模型图图2(以男方为携带者为例)。
[0214]
1)当以染色体结构异常和/或致病基因携带者夫妇双方,和,与携带者具有相同染色体结构异常和/或致病基因的亲属为参照样本时:
[0215]
a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息和携带者以及与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;当待定样本致病基因或染色体结构异常断裂点区域单体型信息与参照样本中结构异常和/或致病基因携带者单体型信息一致,但和与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息不一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;
[0216]
b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
[0217]
i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
[0218]
ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反;
[0219]
2)当以染色体结构异常和/或致病基因携带者夫妇双方,和,染色体正常的亲属为参照时:
[0220]
a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待定样本致病基因或染色体结构异常断裂点区域单体型信息,与携带者及与携带者的染色体正常的亲属的单体型信息一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;当待定样本致病基因或染色体结构异常断裂点区域单体型信息与参照样本中结构异常和/或致病基因携带者单体型信息一致,但和与携带者具有相同染色体结构异常和/或致病基因的亲属的单体型信息不一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;
[0221]
b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
[0222]
i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
[0223]
ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反;
[0224]
3)当以携带致病基因的子代或染色体异常的胚胎为参照样本时:
[0225]
a.若待定样本的致病基因或染色体结构异常断裂点区域没有发生同源重组,当待
定样本致病基因或染色体结构异常断裂点区域单体型信息,与携带致病基因的子代或染色体异常的胚胎的单体型信息一致时,则待定样本判断为致病基因携带或染色体结构异常携带胚胎;当不一致时,则待定样本判断为非致病基因携带或非染色体结构异常携带胚胎;
[0226]
b.若待定样本的致病基因或染色体结构异常断裂点区域发生了同源重组:
[0227]
i.若染色体结构异常为染色体平衡易位,则判断标准与a相反;
[0228]
ii.若染色体结构异常为染色体倒位,则判断标准为,当只有其中1个断裂点区域的一端或两端发生同源重组,则判断规则与a相同;当2个断裂点区域中均仅有一端发生同源重组,则判断规则与a相同;当2个断裂点区域的两端均发生同源重组,则判断结果与a相反。
[0229]
实施例3:胚胎检测及妊娠结局随访
[0230]
通过检测分析模型分析后,对胚胎进行诊断:
[0231]
(1)对于只携带夫妇双方一方致病基因单体型的胚胎,诊断为该致病基因携带胚胎;
[0232]
(2)对于同时携带夫妇双方致病基因单体型的胚胎,诊断为异常患病胚胎;
[0233]
(3)对于不携带夫妇双方致病基因单体型的胚胎,诊断为该致病基因正常胚胎;
[0234]
(4)对于不携带夫妇染色体结构异常单体型的胚胎,诊断为染色体结构正常胚胎;
[0235]
(5)对于携带夫妇染色体结构异常单体型的胚胎,诊断为染色体结构异常胚胎;
[0236]
(6)对于染色体不平衡易位或染色体非整倍体胚胎,直接诊断为异常胚胎。
[0237]
综合考虑胚胎的致病基因、染色体结构和非整倍体检测结果,根据检测结果胚胎可分为三类,分别为不可移植(例如上述(2)、和/或(6))、可移植和可优先移植,优先考虑移植均不携带的胚胎(例如上述(3)、和/或(4))。对移植后成功妊娠的家系,随访妊娠中期胎儿的羊水细胞致病基因基因型和染色体核型结果,与检测分析模型结果进行比对,分析本检测方法的有效性(或称为“效度”),具体方法详见流程图图2。
[0238]
羊水细胞染色体制备方法(原位法)
[0239]
a.细胞培养
[0240]
1).将羊水(约20ml)转移到无菌的离心管中,1000rpm离心10分钟;
[0241]
2).去除上清液,用于其它分析,保留细胞悬液约0.5~1ml,用培养基混匀到2~2.5ml左右;
[0242]
3).将细胞悬液平分到2~4只chromslide培养皿中;
[0243]
4).培养24/48小时后,向每只chromslide培养皿中加入约2.5ml羊水培养基;
[0244]
5).培养第5~6天后,对细胞生长状况进行观察,更换新的培养基;
[0245]
6).1~2天后观察细胞的生长状况,如果细胞克隆数足够,向培养皿中加入秋水仙素,收获细胞,处理时间根据秋水溶液浓度确定。
[0246]
b.染色体制备
[0247]
1).倾斜chromslide细胞培养皿,完全去除培养基;
[0248]
2).加入3~4ml低渗液到每个培养皿中,室温处理10分钟;
[0249]
3).直接向低渗液中加入0.5~0.7ml固定液,室温处理5分钟;
[0250]
4).去除上清液,加入3~4ml新鲜的固定液,室温处理;
[0251]
5).重复第四步1~2次;
[0252]
6).去除固定液,在maxchrome染色体分散仪(设定适当的参数)中进行染色体分散过程;
[0253]
7).玻片干燥后,老化,显带。
[0254]
外周血染色体制备方法如下:
[0255]
1、细胞培养
[0256]
1).采血:酒精消毒皮肤,肘静脉采血,将注射针直接穿过培养瓶的橡胶塞,向10ml培养基中注入30
‑
40滴全血,轻摇匀后置37℃恒温箱培养。
[0257]
2).培养:时间为68小时。培养期间,定期轻摇匀,使细胞充分接触培养基。
[0258]
3).秋水仙素处理:终止培养前2
‑
4小时,在培养液中加入秋水仙碱(用1ml注射器5号针尖滴加2滴,使终浓度为0.07μg/ml)。
[0259]
以上步骤均需无菌操作。
[0260]
2、染色体制备
[0261]
1).收集细胞:将培养物全部转入洁净离心管中,以1000rpm离心8
‑
10分钟,弃上清液。
[0262]
2).低渗处理:向刻度离心管中加入预温37℃的低渗液8ml,用滴管混匀,置37℃恒温水浴中低渗15
‑
25分钟。
[0263]
3).预固定:低渗后加入0.5ml固定液,轻轻混匀后1000rpm离心8
‑
10分钟。
[0264]
4).一固定:弃上清液,加入5ml固定液,轻轻混匀,静置20分钟。1000rpm离心,弃上清液。
[0265]
5).二固定、三固定:同一固定。
[0266]
6).制悬液:弃上清液后,视细胞数量多少加入适量固定液制成细胞悬液。
[0267]
7).滴片:吸取细胞悬液自10
‑
20cm高滴在一张干燥洁净的载玻片上,轻吹散,气干。
[0268]
8).染色:1:10giemsa染色5
‑
10分钟,细水洗去多余染液,气干。
[0269]
9).镜检:低倍镜下寻找分散良好、染色适中的分裂相,油镜下观察染色体形态并计数。
[0270]
实施例4:6个实际病例的分析结果
[0271]
1、该研究已经通过复旦大学附属妇产科医院伦理委员会审核通过,已经纳入6例符合纳入标准的病例家系。纳入标准为:需满足夫妇双方同时携带有某致病基因和夫妇一方携带染色体结构异常(夫妇双方均为染色体结构异常的概率很低,一般为夫妇一方)的病例。所述6例符合纳入标准的家系所涉及的染色体结构异常和致病基因分别为:
[0272]
家系编号染色体结构异常致病基因146,xy,t(6;14)(q22;q13)pah246,xx,inv(3)(p26q21)ush2a346,xx,t(4;16)(q25;q13)slc25a13446,xx,t(13;18)(q21;q12)tyr546,xx,t(6;18)(p23;q23)gjb2645,xx,der(14;15)(q10;q10)slc26a4
[0273]
目前均已经完成促排卵、受精及囊胚细胞活检,并均顺利完成了单细胞扩增。胚胎
活检细胞全基因组扩增后的dna产物进行qpcr质控位点结果如图4所示,结果判断标准为:
[0274]
(1)阳性结果:扩增产物熔解峰单一尖锐,tm值预期范围固定;扩增曲线呈典型s型,且一般ct值≤25。上述条件有任一不符合,则为阴性或弱阳性(ct值在25~30之间,则为弱阳性)。
[0275]
(2)阴性结果:扩增产物熔解峰多个,或无单一尖锐主峰,tm值不在预期范围;扩增曲线不呈典型s型,一般ct值>30。
[0276]
2、已经完成促排卵6个病例的家系图,如图5所示:
[0277]
3、6个病例均成功构建了检测分析模型,并完成了胚胎检测。分析结果中检测分析模型和胚胎单体型结果如图6所示(以病例
‑
6为例),其中图3左侧表示患者家系胚胎单基因遗传病致病基因单体型结果,右侧表示患者家系胚胎结构异常染色体的单体型结果。
[0278]
4、以病例
‑
6为例,图7表示胚胎非整倍体检测结果,1号胚胎的结果为4p16.3q24*3;4q24q35.2*1;12*1;16p13.3q12.2*1;16q12.2q24.3*3,4号胚胎的结果为整倍体,9号胚胎的结果为4p16.3q24*1;16p13.3q12.2*3,10号胚胎的结果为整倍体。
[0279]
综合胚胎的非整倍体检测和单体型检测结果可以判断,1号胚胎和9号胚胎为不平衡易位的非整倍体胚胎,4号胚胎和9号胚胎均为染色体结构异常携带胚胎。
[0280]
5、该6个病例已经完成移植及成功妊娠,经过随访,这6个病例的胚胎检测分析结果与产前诊断结果一致,如表1所示,证实本发明所述分析方法结果准确,适于临床应用。
[0281]
表1.胚胎检测结果及移植后产前诊断结果比较
[0282]
[0283]
[0284]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1