一种用于治疗脓毒症的制剂的制作方法
1.本发明属于生物医药领域,具体地涉及用于治疗脓毒症的包含细胞悬液和/或囊泡悬液的制剂。
2.
背景技术:
3.脓毒症是宿主对感染产生的免疫系统失调及不可控炎症反应,并造成危及生命的器官功能障碍。全球每年约有4890万脓毒症病例,其中有1100万脓毒症死亡病例,死亡率达到22.5%。目前全球范围内尚无特异性治疗脓毒症的上市药物,常规的治疗手段效果有限,主要包括:液体复苏,抗生素的使用,手术去除感染源,以及“对症治疗”。
4.液体复苏是通过早期目标导向治疗(early, goal-directed therapy, egdt)给予患者晶体液等液体,使患者的中心静脉压等一些生理指标达到相应的标准,以降低脓毒症患者的病死率。该方法的缺点是用量难以确定,用量的窗口较窄。有不少临床研究表明,egdt并不能降低脓毒症死亡率,而且液体过量容易对肾脏、心脏等器官造成损伤。
5.抗生素用于脓毒症治疗有两种方式。一是脓毒症前期直接使用广谱抗生素,该方法缺点是容易产生耐药性细菌,并且对人体的副作用较大。二是通过细菌培养,获取生物证据,再针对性用抗生素治疗。后者的缺点很明显,脓毒症需要尽早用药,但微生物培养时间长,且培养的结果并不一定有阳性。两种方式共有的缺点是抗生素容易进一步加剧免疫系统的失调。
6.脓毒症若是外科感染引起可通过手术清除病灶或引流来治疗,但该方法的缺点是难以确定感染源。脓毒症的“对症治疗”指的是对患者的并发症状进行治疗,例如使用糖皮质激素控制血压,使用胰岛素控制血糖,患者缺氧就进行输氧等。该方法的主要依据是患者的生理指标低于或高于一定的警戒值给予相应药物处理或仪器处理进行调控,对脓毒症的治疗效果欠佳,只能作为辅助的治疗手段。
7.目前有一些研究表明,脓毒症常常伴随线粒体功能障碍,可是,脓毒症与线粒体功能障碍的关系究竟是相关性还是因果联系并不清楚。虽然有一些研究表明,靶向线粒体的抗氧化剂能够改善线粒体功能,但是对于是否可以改善脓毒症的预后并无研究。线粒体移植一般指的是将从细胞中分离出来的线粒体注射到体内用于治疗疾病,目前常用的注射部位是病变部位本身,例如心肌梗塞注射到心脏,中风注射到脑部。但是,移植分离的线粒体操作繁琐,分离过程中会损失部分线粒体,而且分离的线粒体特别容易失活,难以低温保存。对于脓毒症这样的急重症而言,尽快给药对于治疗效果至关重要,而分离的线粒体无法长期保存,则大大制约了它在治疗脓毒症中的应用。
8.
技术实现要素:
9.因此,本发明的目的在于开发一种用于治疗脓毒症的基于细胞治疗的安全便利的
新方法。具体地,本发明提供了一种用于治疗脓毒症的制剂,所述制剂包含细胞悬液或囊泡悬液及其组合。另一方面,本发明提供了细胞悬液或囊泡悬液及其组合在制备用于治疗脓毒症的药物制剂中的用途。
10.在根据本发明的制剂或用途中,所述细胞悬液中细胞的体积比、囊泡悬液中囊泡的体积比或组合悬液中细胞加囊泡的体积比为0.001%-99.9%。细胞悬液中的细胞为含有线粒体的单细胞、多细胞或其组合。囊泡悬液中的囊泡为由细胞的膜结构包裹、直径在100nm以上、含有线粒体且无完整细胞活性的囊泡,有或无细胞核。
11.进一步地,所述细胞悬液或囊泡悬液的来源为组织或者血液。
12.进一步地,所述细胞悬液或囊泡悬液的来源为体外培养的细胞。
13.进一步地,所述细胞悬液或囊泡悬液的来源为自体、同种异体或异种异体及其组合。
14.进一步地,所述细胞悬液或囊泡悬液的来源为生殖细胞和/或体细胞。
15.进一步地,所述细胞悬液或囊泡悬液的来源为干细胞、非干细胞及其组合。
16.进一步地,所述细胞悬液或囊泡悬液的来源为肿瘤细胞、非肿瘤细胞或其组合。
17.进一步地,所述细胞悬液或囊泡悬液的来源包括神经细胞、胶质细胞、表皮细胞、骨细胞、软骨细胞、心肌细胞、肝细胞、脾细胞、胰细胞、肾细胞、肾上腺细胞、脂肪细胞、肌肉细胞、白细胞、血小板或其组合。
18.进一步地,所述细胞悬液或囊泡悬液的来源包括神经组织、皮肤、骨、软骨、心脏、肝脏、脾脏、肾脏、胰腺、肺脏、血管、睾丸、卵巢、口腔组织、食道、胃、小肠、大肠、脂肪、肌肉、血液或其组合。
19.进一步地,所述细胞悬液或囊泡悬液是新鲜制备的或者冻存的。
20.在一个实施方案中,所述制剂是细胞悬液制剂。优选地,所述细胞悬液是由心脏、肝脏、脾脏、肾脏、肌肉或其组合制备的细胞悬液。
21.在另一个实施方案中,其中所述制剂是囊泡悬液制剂。优选地,所述囊泡悬液是由脑组织制备的囊泡悬液。在一个实施方案中,所述囊泡是无完整细胞活性的细胞囊泡。
22.进一步地,根据本发明的治疗脓毒症的制剂还包括生理盐水、白蛋白、细胞培养基、缓冲液、血液、血浆、血清、组织液、冷冻保护剂及其组合。
23.进一步地,根据本发明的治疗脓毒症的制剂的给药方式包括但不限于静脉注射、动脉注射、肌肉注射、皮下注射、皮内注射、腹腔注射、雾化吸入、舌下含服、鼻腔给药和口服。
24.本发明的创新点在于:施用包含含有活性线粒体的细胞或细胞囊泡悬液的制剂,用于治疗脓毒症。
25.本发明的用于治疗脓毒症的制剂具有以下优点:1、细胞来源广泛,可以不做任何修饰,很容易得到大量的细胞。
26.2、细胞可以从患者体内获得,通过体外培养,注射回患者体内几乎不会产生免疫排斥反应。
27.3. 分离的线粒体除了其dna之外,其余部分在体内难以复制,其移植的效果维持时间较短,而施用细胞悬液后,细胞可以在体内存活较长时期,并且可以源源不断地合成并提供新的线粒体给受体,其效果维持时间更长。
28.4. 相对于分离的线粒体,细胞或者囊泡中的线粒体在常温下或者冻存条件下维持活性的时间都更长。冷冻保存的细胞可以迅速解冻后直接输送给患者,通过尽早给药来提高疗效。
29.5、无需使用干细胞。干细胞的来源受限,能够分裂的代数有限,且需要更严格的培养条件,所以能够回输体内的细胞数目更少。而如果不需要使用干细胞的话,可以获得的细胞数目会更多,培养更为简单,能够输入的细胞数目也大大增加。
30.附图说明
31.图1:293t细胞灭活前(a)和灭活后(b)用mitotracker red染色的结果。灭活前可见明显的被mitotracker red标记的线粒体,灭活后整个细胞呈现出非特异性弱阳性的染色,说明293t细胞内的线粒体已经被成功灭活。
32.图2:293t细胞悬液作为脓毒症小鼠心脏和脑的线粒体供体。293t细胞内的线粒体由绿色荧光蛋白mneongreen标记。a1为心脏的mitotracker red染色,a2为绿色荧光信号,显示mneongreen标记的线粒体,a3为a1和a2的重叠,可见心肌内有mneongreen标记的线粒体,说明来自于293t细胞的线粒体已经转入脓毒症小鼠的心肌内。b1为脑组织的mitotracker red染色,b2为绿色荧光信号,显示mneongreen标记的线粒体,b3为b1和b2的重叠,可见脑细胞内有mneongreen标记的线粒体,说明来自于293t细胞的线粒体已经转入脓毒症小鼠的脑组织内。
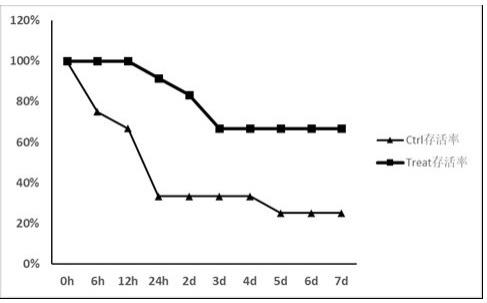
33.图3:10%的肾脏细胞悬液尾静脉注射治疗脓毒症小鼠的生存曲线图。
34.图4:25%的肝细胞悬液尾静脉注射治疗脓毒症小鼠的生存曲线图。
35.图5:20%的肌肉细胞悬液腹腔注射治疗脓毒症小鼠的生存曲线图。
36.图6:10%的冻存的脑细胞囊泡悬液尾静脉注射治疗脓毒症小鼠的生存曲线图。
37.图7:bnl-cl2(小鼠胚胎肝细胞)治疗脓毒症小鼠的生存曲线图。
38.图8:bv2(小鼠神经胶质细胞)治疗脓毒症小鼠的生存曲线图。
39.具体实施方案
40.脓毒症小鼠模型的构建实验小鼠选用昆明小鼠,通过腹腔注射大肠杆菌或者内毒素(lps)诱导脓毒症小鼠模型。大肠杆菌用tb肉汤培养基培养过夜后离心取菌泥,按照20%大肠杆菌菌泥(m/v):30%甘油(v/v):50%tb液体培养基(v/v)的比例,添加相应体积的甘油以及tb肉汤培养基,充分混匀后-80℃冰箱冻存备用。大肠杆菌冻存液解冻后,用1
×
pbs进行稀释,以大约6h内杀死半数昆明小鼠的大肠杆菌的剂量腹腔注射给昆明小鼠构建脓毒症模型。lps法为腹腔注射1mg/ml的lps(sigma l7261)溶液0.1ml/10g。
41.小鼠组织细胞悬液的制备颈椎脱臼法处死昆明小鼠,取心脏、肝脏、脾脏、肾脏、大腿肌肉等组织,剪碎后,加入5-10倍体积的1
×
pbs溶液,以不同的匀浆条件使不同的组织在维持细胞状态完整的情况下尽可能地分散成单个细胞,再通过多次离心的方法获得细胞悬液,最后悬浮的介质为含
有7
×
psa(细胞培养所用的三抗,含有青霉素g钠盐700u/ml, 硫酸链霉素700μg/ml, 两性霉素b 1.75μg/ml)的deme高糖培养基。其中肝脏细胞悬液的分离条件为1100 rpm匀浆2min后50g离心1min,取上清, 220g离心4min弃上清,加pbs重悬浮,200g离心4min弃上清,获得单细胞沉淀;肌肉组织细胞悬液的分离条件为7000rpm匀浆1min后200g离心3min取上清,再1000g离心4min弃上清,加pbs重悬浮,1000g离心4min弃上清,获得单细胞沉淀;肾脏细胞悬液的分离条件为为1100 rpm,匀浆2min后50g离心2min取上清,再200g离心4min弃上清,加pbs重悬浮,200g离心4min弃上清,获得单细胞沉淀。通过用mitotracker red染色的方法检测细胞悬液的分散情况及细胞的活性,若能看见明显的线粒体染色则为有活性的细胞悬液。最后以含有7
×
psa的deme高糖培养基配成所需浓度的细胞悬液。
42.脑组织囊泡悬液的制备颈椎脱臼法处死昆明小鼠,取脑组织加入5-10倍体积的1
×
pbs,电动匀浆器1100 rpm匀浆2min后,200g离心2min,取上清,再1500g离心5min后弃上清,再加入适量1xpbs重悬浮,再1500g离心5min后弃上清,沉淀即为脑组织囊泡。沉淀以含有7
×
psa的deme高糖培养基稀释得到脑组织囊泡悬液。
43.鼠源细胞细胞悬液的制备将鼠源的细胞按常规方法培养,贴壁细胞胰酶消化,吹打至单细胞悬液,悬浮细胞直接吹打至单细胞悬液,计数后离心收集细胞,再用含有7
×
psa的deme溶液配成所需密度的细胞悬液。
44.细胞悬液、囊泡悬液灭活处理在获得细胞或细胞囊泡沉淀后,按照细胞或囊泡密度为1g/ml的方法计算出体积,加入5倍体积pbs,以总体积50%的量加入75%乙醇混匀,室温下放置5min,再1000g离心10分钟去上清,加入细胞体积10倍的pbs重悬浮,室温孵育10分钟后,再1000g离心10分钟去上清,再加入细胞体积10倍的pbs重悬浮,室温孵育10分钟后,再1000g离心10分钟去上清,即获得灭活的细胞或囊泡沉淀,根据重量用含有7
×
psa的deme溶液重悬浮获得所需要质量分数的灭活细胞或囊泡悬液。
45.脓毒症小鼠的治疗在构建小鼠脓毒症模型2小时后使用细胞和/或囊泡悬液进行给药,给药的方式包括腹腔注射、皮下注射、尾静脉注射以及肌肉注射等,给药的剂量通常为5%-25%质量分数的细胞悬液和/或囊泡悬液。细胞悬液的来源可以从不同组织或培养的鼠源细胞获得,不同的组织包括心脏、肝脏、脾脏、肾脏、脑部组织以及肌肉组织等。
46.构建的脓毒症小鼠分为对照组(ctrl)和治疗组(treat)。对照组给药灭活的细胞悬液或囊泡悬液,治疗组以相同的剂量给药有活性的细胞悬液或囊泡悬液,两组的给药方式相同。一周内观察两组脓毒症小鼠的存活情况。
47.试验例1颈椎脱臼法处死昆明小鼠,取其心脏、肝脏、脾脏、肾脏、脑组织、大腿肌肉等组织,按照上文的方法得到细胞悬液或囊泡悬液,或者体外培养的293t细胞制成细胞悬液,取部分细胞悬液或囊泡悬液,按照上文的灭活方法进行灭活后,使用mitotracker red染色(稀释倍数1:5000),leica sp8 confocal成像观察。293t细胞灭活的结果示于图1中,活性的细胞用mitotracker red染色后有很多亮红色的点,说明细胞里面的线粒体有活性,而灭活的
细胞用mitotracker red染色后几乎不可见有红色的亮点,只有均匀的非特异性染色信号,说细胞里面的线粒体已经丧失活性。
48.试验例2293t细胞转染质粒pcdna3.1-mneongreen-fis1.mts以用绿色荧光蛋白mneongreen标记线粒体外膜,2天后将转染后的细胞配成500万/ml的细胞悬液。lps腹腔注射昆明小鼠诱导脓毒症,1小时后,将转染的293t细胞悬液以0.05ml/10g的剂量尾静脉注射入脓毒症小鼠,3小时后颈椎脱臼法处死,取内脏,以mitotracker red染色,leica sp8 confocal成像观察。如图2中所示,发现心脏和脑组织内部分线粒体为绿色,说明293t细胞里面mneongreen标记的线粒体已经转入小鼠的心肌和神经细胞内。
49.实施例1取48只健康的雄性的昆明小鼠,体重范围在22-32g,将其随机分成对照组和治疗组,每一对对照组小鼠和治疗组小鼠体重相差不超过1g。取冻存的大肠杆菌菌液解冻后,用1
×
pbs溶液配制成20mg/ml大肠杆菌稀释液,按照小鼠的体重,每10g腹腔注射0.1ml大肠杆菌稀释液,构建小鼠脓毒症模型。按照上文的方法制备从肾脏获取的活性细胞悬液及灭活的细胞悬液,细胞悬液根据沉淀质量配成10%(m/v)的浓度,在构建小鼠脓毒症模型2h后单次给药,对照组尾静脉注射0.05ml/10g灭活的细胞悬液,治疗组尾静脉注射0.05ml/10g活性的细胞悬液,连续7天观察小鼠存活情况。结果示于图3中,可见2天后治疗组比对照组的存活率平均提高20%左右。
50.实施例2取24只健康的雄性的昆明小鼠,体重范围在22-32g,将其随机分成对照组和治疗组,每一对对照组小鼠和治疗组小鼠体重相差不超过1g。取冻存的大肠杆菌菌液解冻后,用1
×
pbs溶液配制成20mg/ml大肠杆菌稀释液,按照小鼠的体重,每10g腹腔注射0.1ml大肠杆菌稀释液,构建小鼠脓毒症模型。按照上文的方法制备从肝脏获取的活性细胞悬液及灭活的细胞悬液,细胞悬液根据沉淀质量配成25%(m/v)的浓度,在构建小鼠脓毒症模型2h后单次给药,对照组尾静脉注射0.05ml/10g灭活的细胞悬液,治疗组尾静脉注射0.05ml/10g活性的细胞悬液,连续7天观察小鼠存活情况。结果示于图4中,可见治疗组比对照组的存活率平均提高18%左右。
51.实施例3取24只健康的雌性的昆明小鼠,体重范围在22-32g,将其随机分成对照组和治疗组,每一对对照组小鼠和治疗组小鼠体重相差不超过1g。取冻存的大肠杆菌菌液解冻后,用1
×
pbs溶液配制成20mg/ml大肠杆菌稀释液,按照小鼠的体重,每10g腹腔注射0.1ml大肠杆菌稀释液,构建小鼠脓毒症模型。按照上文的方法制备从大腿肌肉组织获取的活性细胞悬液及灭活的细胞悬液,细胞悬液根据沉淀质量配成10%(m/v)的浓度,在构建小鼠脓毒症模型2h后单次给药,对照组尾静脉注射0.05ml/10g灭活的细胞悬液,治疗组尾静脉注射0.05ml/10g活性的细胞悬液,连续7天观察小鼠存活情况。结果示于图5中,可见治疗组比对照组的存活率平均提高30%左右。
52.实施例4取24只健康的雌性的昆明小鼠,体重范围在22-32g,将其随机分成对照组和治疗组,每一对对照组小鼠和治疗组小鼠体重两两相近,相差不超过1g。取冻存的大肠杆菌菌液
解冻后,用1
×
pbs溶液配制成20mg/ml大肠杆菌稀释液,按照小鼠的体重,每10g腹腔注射0.1ml大肠杆菌稀释液,构建小鼠脓毒症模型。按照上文的方法制备从大脑组织获取的有活性或者灭活的细胞囊泡,冻存于-80度。2周后取冻存的囊泡,配成10%的浓度,在构建小鼠脓毒症模型4h后单次给药,对照组尾静脉注射0.05ml/10g灭活的细胞囊泡,治疗组尾静脉注射0.05ml/10g活性的细胞悬液,连续7天观察小鼠存活情况。结果示于图6中,可见治疗组比对照组的存活率平均提高18%左右。
53.实施例5取24只健康雄性昆明小鼠,体重范围在16-22g,将其随机分成对照组和治疗组,每一对对照组小鼠和治疗组小鼠体重相差不超过1g。按0.1ml/10g的剂量对小鼠腹腔注射1mg/ml的lps溶液,构建小鼠脓毒症模型。按上述方法将体外培养的bnl-cl2细胞(小鼠胚胎肝细胞),配成2000万/ml的有活性或灭活的细胞悬液。在构建小鼠脓毒症模型2小时后,按0.3ml/10g的剂量颈部皮下注射2000万/ml的bnl-cl2细胞悬液。对照组注射灭活的细胞悬液,治疗组注射有活性的细胞悬液,连续7天观察小鼠存活情况。结果示于图8中,可见单次注射细胞悬液治疗组比对照组的存活率提高42%左右。
54.实施例6取24只健康雄性昆明小鼠,体重范围在16-22g,将其随机分成对照组和治疗组,每一对对照组小鼠和治疗组小鼠体重相差不超过1g。按0.1ml/10g的剂量对小鼠腹腔注射的1mg/ml的lps溶液,构建小鼠脓毒症模型。按上述方法将体外培养的bv2细胞(小鼠胶质细胞)配成2000万/ml的有活性或灭活的细胞悬液。在构建小鼠脓毒症模型2小时后,按0.3ml/10g的剂量颈部皮下注射2000万/ml的bv2细胞悬液。对照组注射灭活的细胞悬液,治疗组注射有活性的细胞悬液,连续7天观察小鼠存活情况。结果示于图8,可见单次颈部皮下注射细胞悬液治疗组比对照组的存活率在前5天提高18%左右。
55.以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1