一种改善免疫抑制微环境的胰腺癌靶向外泌体疫苗
1.本发明属生物技术领域,具体涉及一种改善免疫抑制微环境的胰腺癌靶向外泌体疫苗及其制备方法。
背景技术:
2.据报道,胰腺导管腺癌(pdac)是目前较凶险的癌症之一,其主要特点为早期诊断难、化疗耐药率高,大多患者在确诊时已为肿瘤晚期阶段或发生肿瘤转移,难以实现手术切除,患者五年生存率不足6%。由于常规治疗获益有限,治标不治本,因此迫切需要寻找新的治疗措施以延长患者的生存率。
3.近来,pd-1、pd-l1、ctla-4抗体等药物在白血病、黑色素瘤中取得巨大突破,免疫疗法,包括肿瘤疫苗、免疫检查点抑制剂、过继性细胞治疗(例如car-t)等成为了大众关注的焦点。与其他干预治疗方式相比,免疫疗法通过增强人体本身的免疫反应,以达到抑制肿瘤生长的目的。虽然在实体瘤中取得了一定的疗效,由于丰富的pdac肿瘤基质、高间质压力、低血管增生、低血流灌注,免疫疗法在治疗pdac患者中少有成功案例。此外,pdac肿瘤形成过程中伴随着大量免疫抑制性白细胞的浸润,逐渐构成肿瘤免疫抑制微环境,为免疫疗法提供障碍。另外,干预治疗有关肿瘤的难点在于pdac肿瘤环境中抑制肿瘤生长的细胞毒性t淋巴细胞数量不足,因此,招募更多的抗肿瘤活性的免疫细胞、改善pdac肿瘤免疫抑制微环境迫在眉睫。
4.有研究公开了纳米疫苗在免疫治疗中广泛应用于快速诱导强大的靶向免疫应答。肿瘤疫苗接种的关键点在于树突状细胞(dc细胞),作为主要的抗原提呈细胞,dc细胞可捕获和呈递肿瘤抗原,表达共刺激分子并分泌细胞因子以激活适应性和先天性免疫应答,使其成为癌症免疫疗法的理想候选者。然而,研究表明,免疫抑制细胞tregs表面受体如ccr4、ccr8等可与dc分泌的趋化因子ccl17、ccl22作用,也即dc可通过ccr4/ccl22通路募集treg细胞至肿瘤部位,诱导免疫抑制。因此,在降低dc诱导免疫抑制的同时获得增强的肿瘤免疫抑制效果仍是本领域中的一个挑战。
5.基于现有技术的现状,本技术的发明人拟提供一种改善免疫抑制微环境的胰腺癌靶向外泌体疫苗及其制备方法。
技术实现要素:
6.为解决上述问题,本发明的目的在于提供一种改善免疫抑制微环境的胰腺癌靶向外泌体疫苗及其制备方法。
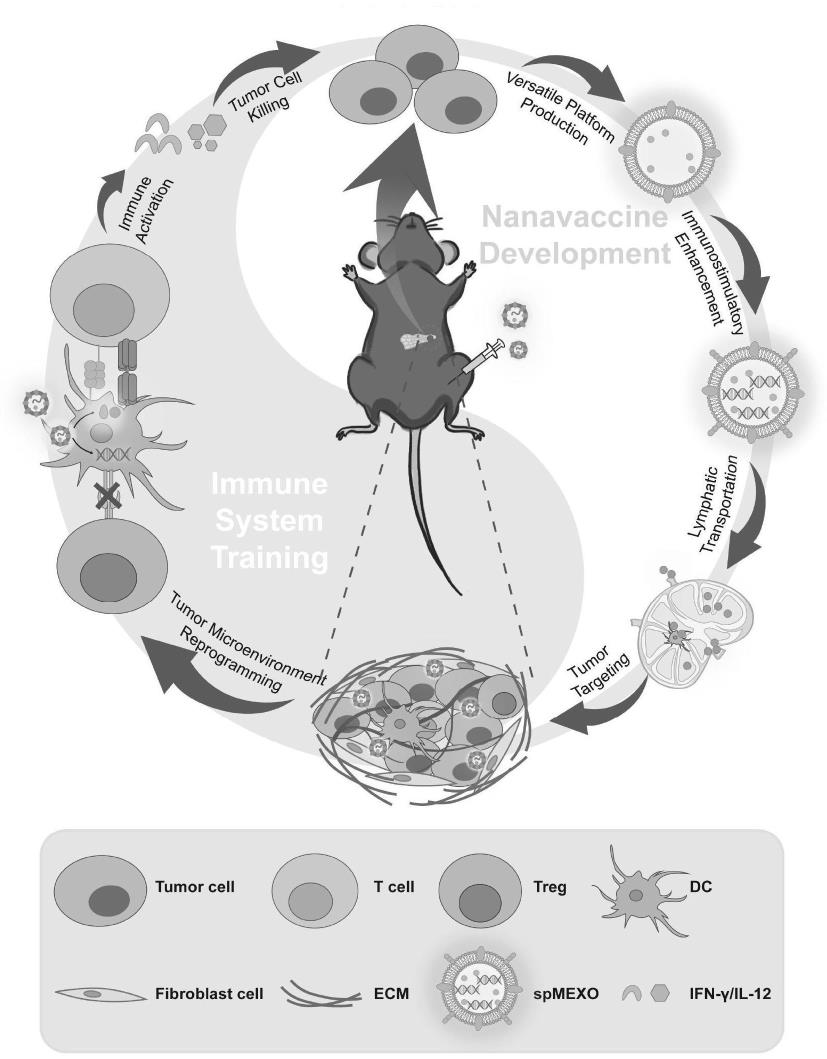
7.具体的,本发明提供一种将处于免疫原性凋亡状态的胰腺肿瘤细胞分泌的外泌体转化为多功能胰腺癌疫苗及其方法。
8.本发明的胰腺癌靶向外泌体疫苗由三个部分组成:抗原、佐剂和药物递送系统。
9.本发明中,外泌体来源于胰腺癌细胞panc-02,与肿瘤细胞表达相同的蛋白,自身即可成为免疫抗原。
10.本发明中,经低剂量米托蒽醌(mtx)处理后,panc-02细胞分泌的外泌体高表达免疫刺激信号(如钙网蛋白及高迁移率族蛋白b1),经注射后可激活体内dc细胞,增强免疫。本发明中外泌体作为新型的药物载体,可进一步通过电转包载基因药物ccl22 sirna,用于阻断ccr4/ccl22通路,以减少肿瘤部位免疫抑制性细胞的募集。为促进所述疫苗疗效,本发明中外泌体表面修饰mart-1肽(序列:elagigiltv,其具有免疫原性,可促进特异性抗肿瘤免疫反应)以激活肿瘤部位t淋巴细胞;由于与肿瘤同源,该外泌体疫苗spmexo经肌肉注射后,能实现pdac微环境靶向,激活特异性抗肿瘤反应,同时改善肿瘤免疫抑制微环境,发挥抗肿瘤疗效。
11.本发明中,提供了一种装载多肽及基因药物的外泌体递送系统,其包括外泌体、多肽及基因药物,所述纳米疫苗粒径约为100~120纳米。
12.本发明中,所用药物递送材料为经米托蒽醌处理后的panc-02胰腺癌细胞来源外泌体。
13.本发明中,所述多肽药物为一段免疫激活肽mart1-cp05(命名为cm多肽,序列:elagigiltv-crhsqmtvtsrl),通过cp05与外泌体表面蛋白cd63结合,实现载药。
14.本发明中,所述基因药物为ccl22 sirna
15.(5
’‑
gcgugguguugcuaaccuutt-3’),~109外泌体通过电转基因载药量为0.502
±
0.038μg。
16.本发明中,所述外泌体肿瘤疫苗可高效靶向肿瘤部位。
17.本发明中,所述肿瘤疫苗可显著延缓肿瘤生长。
18.本发明中,所述肿瘤疫苗抑制肿瘤生长的机理为:一是通过mart-1多肽激活细胞毒性t细胞,促进肿瘤部位免疫应答;二是通过ccl22 sirna阻断树突状细胞dc与免疫抑制性调节性t细胞treg之间的ccr4/ccl22信号通路,减少肿瘤部位treg的募集,改善免疫抑制微环境。
19.本发明中,所述肿瘤疫苗联用一线化疗药物吉西他滨和白蛋白紫杉醇可显著抑制肿瘤生长。
20.本发明中,所述肿瘤疫苗没有明显的系统毒性。
21.更具体的,
22.第一方面,本发明提供了一种外泌体提取、纯化的方法,包括以下步骤:
23.(1)用含10μm米托蒽醌的dmem完全培养基培养胰腺癌panc-02细胞系12小时。
24.(2)收集的细胞培养上清前处理操作如下:800g离心5-10分钟;2000g离心20分钟;15000g离心30分钟,0.22μm滤膜过滤。
25.(3)随后上清进行超速离心处理提取外泌体,步骤如下:150000g离心2小时,4℃。
26.(4)进一步使用含碘克沙醇的蔗糖梯度液纯化外泌体:将500μl步骤(3)中用pbs 7.4重悬的外泌体加入到蔗糖梯度液(5-40%碘克沙醇,0.25mm蔗糖溶液,ph 7.4)中,100000g离心16小时,4℃;取第6、7毫升液体,150000g离心2小时,用pbs 7.4重悬,得到纯化后的外泌体mexo。
27.第二方面,本发明提供了一种外泌体装载sirna的方法,包括以下步骤:
28.(1)通过超速离心将109外泌体重悬液替换为电转缓冲液(1.15mm磷酸钾ph 7.2,25mm氯化钾,21%碘克沙醇)。
29.(2)向上述电转缓冲液中加入1μg ccl22 sirna。
30.(3)电转:400v,125μf,∞ω。
31.(4)通过超速离心除去游离sirna并用pbs 7.4重悬,得到载sirna的外泌体smexo。
32.第三方面,本发明提供了一种外泌体装载多肽的方法,包括以下步骤:
33.(1)精密称取1mg cm多肽,溶于100μl二甲亚砜溶液中。
34.(2)将上述溶液加入到500μl外泌体溶液中,室温孵育1小时。
35.(3)使用琼脂糖凝胶柱除去游离cm多肽,得到载cm多肽的外泌体spmexo。
36.本发明的优点与效果:
37.1.采用外泌体作为药物载体,使用单一生物材料作为载体,生物相容性好,方便制备,同时实现了肿瘤的靶向药物递送,增加了药物在肿瘤部位的积蓄,且可避免基因药物在循环过程中降解。
38.2.采用肿瘤来源的外泌体,保留了肿瘤细胞膜上的免疫调节蛋白、共刺激分子和粘附分子,可作为抗原激活机体免疫反应
39.3.低剂量米托蒽醌能诱导胰腺癌肿瘤细胞发生免疫原性凋亡,表现为肿瘤细胞在细胞膜表面上调钙网蛋白(crt)的表达,同时增加高迁移率族蛋白b1(hmgb1)的释放,收集到的经米托蒽醌处理后的胰腺癌细胞外泌体也同样增加了crt及hmgb1的表达,可作为免疫佐剂促进免疫应答。
40.4.采用米托蒽醌处理后的胰腺癌细胞外泌体制备多肽及sirna共载药的纳米疫苗,粒径为100nm左右,肌肉注射后可通过淋巴循环迅速到达肿瘤部位,诱导肿瘤部位免疫应答,解除免疫抑制,从而实现抗肿瘤治疗。
附图说明
41.图1:一种改善免疫抑制微环境的胰腺癌靶向外泌体疫苗的制备及机制示意图。
42.图2:spmexo的表征结果,其中,
43.a)spmexo的制备流程;
44.b)crt和c)hmgb1在panc-02细胞或经mtx处理后的panc02细胞中的表达(放大倍数=200);
45.d)western印迹法检测hmgb1和crt在外泌体中的表达;e)western印迹法检测外泌体的生物标志物结果;
46.f)纳米流式检测cm多肽修饰外泌体的结果;
47.g)透射电镜观察到的外泌体形态的代表性图像(外比例尺:200nm;内比例尺:50nm);
48.h)纳米流式测定spmexo粒径结果。
49.图3:spmexo的细胞摄取和体外免疫激活作用考察结果,其中,
50.a)纳米疫苗spmexo的作用机制示意图,
51.b)dc细胞对slipo(lipo6000转染ccl22 sirna组)和spmexo的细胞摄取结果(放大倍数=200),
52.c)western印迹法检测不同组别dc细胞中ccl22的表达结果,
53.d)激光扫描共聚焦显微镜拍摄cm多肽与dc细胞膜共定位结果(放大倍数=200),
54.不同制剂处理后e)mhc ii+dc细胞的免疫荧光和f)facs结果(绿色:mhc ii;蓝色:dapi;放大倍数=200),
55.经不同处理的dc细胞与t细胞共培养后的g)cd8+t细胞、h)cd4+t辅助细胞和i)treg细胞的测定结果(n=3),
56.j)不同处理后dc和t细胞共培养液中细胞因子il-12p70和ifn-γ的含量测定结果(n=4),(*p《0.05,**p《0.01,***p《0.001,****p《0.0001)。
57.图4:spmexo体内靶向性考察结果,其中,
58.a)荷瘤小鼠静脉注射游离荧光探针bodipy(λex/em=650/665nm)和bodipy标记的spmexo后24小时的活体ivis成像结果(白色箭头指示肿瘤植入的位置),
59.b)注射bodipy或bodipy-spmexo后4h、12h和24h处死的荷瘤小鼠淋巴结、肿瘤和胰腺离体组织ivis图像,
60.c)离体组织成像荧光半定量结果,
61.d)静脉注射游离bodipy和bodipy标记的spmexo,肌肉注射游离bodipy和bodipy标记的spmexo后48小时和72小时荷瘤小鼠活体ivis成像结果(白色箭头指示肿瘤植入的位置),
62.e)给药72小时后主要器官和肿瘤离体组织的荧光半定量结果,
63.f)给药48小时荷瘤小鼠离体淋巴结的荧光图像及各组的半定量结果,
64.g)不同方式给药后bodipy标记的外泌体在肿瘤组织中的分布结果(蓝色:dapi;绿色:cd31;红色:bodipy标记的外泌体;比例尺:100μm),(*p《0.05,**p《0.01,***p《0.001)。
65.图5:spmexo体内免疫激活作用及肿瘤抑制作用,其中,
66.a)c57bl/6小鼠模型的药物治疗时间表(n=8),
67.b)spmexo对b)体内dc成熟以及c)血液中细胞因子il-12p70和ifn-γ含量的影响,
68.d)肿瘤疫苗spmexo治疗时间表(n=8)。e)肿瘤生物发光信号,
69.f)存活率,
70.肿瘤组织中g)成熟dc细胞、h)cd8+t细胞、l)treg细胞流式细胞仪测定结果,
71.i)肿瘤组织中cd8+t细胞和胶原蛋白1分布结果(蓝色:dapi;绿色:胶原蛋白1;红色:cd8;比例尺:20μm)。k)肿瘤组织中treg分布结果(蓝色:dapi;绿色:treg;比例尺:100μm)。j)western印迹法检测不同治疗方法对肿瘤组织中ccl22表达的影响,
72.m)肿瘤组织中细胞因子il-12p70、ifn-γ和il-10的表达(n=4),(*p《0.05,**p《0.01,***p《0.001,**p《0.0001)。
73.图6:spmexo与化疗药物联合给药的抗肿瘤效果考察结果,其中,
74.a)荷瘤小鼠模型的药物治疗时间表(n=8),b)肿瘤生物发光信号,c)存活率。d)体重。e)肿瘤组织中成熟dc、f)cd8+t细胞和cd4+t细胞、g)treg细胞流式细胞仪测定结果(n=3),h)western印迹法检测肿瘤组织中ccl22表达的结果,i)肿瘤部位tunel免疫荧光结果(蓝色:dapi;绿色:tunel;比例尺:100μm)。(*p《0.05,**p《0.01,***p《0.001,****p《0.0001)。
75.图7:panc-02细胞中hmgb1释放和crt表达的western印迹分析结果。
76.图8:western印迹法检测外泌体的生物标志物结果。
77.图9:ccl22 sirna体外定量结果,其中,a)酶标法测定cy5标记ccl22 sirna的标准
曲线:λex/em=650/670nm,b)用酶标仪定量sirna含量。
78.图10:新鲜提取的骨髓dc细胞经20ng/ml gm-csf和10ng/ml il-4培养10天后的免疫荧光结果。
79.图11:western免疫印迹法检测dcs中ccl22表达的结果。
80.图12:荷瘤小鼠给药4h、12h和24h后主要器官(心、肝、脾、肺和脾)的典型ivis成像结果。
81.图13:荷瘤小鼠尾静脉注射或肌肉注射bodipy标记的spmexo或游离bodipy(作为对照)后不同时间点的体内制剂荧光和肿瘤生物发光图像。
82.图14:bodipy标记的外泌体在肿瘤组织中的分布(蓝色:dapi;绿色:cd31;红色:bodipy或bodipy标记的外泌体;比例尺:100μm)。
83.图15:spmexo体内抗肿瘤效果考察。第7、14、21、28天ivis实时ivis测定结果,其中,在第-21、-14、-7天用不同肿瘤疫苗接种c57bl/6小鼠。
84.图16:荷瘤小鼠主要脏器(心、肝、脾、肺、脾)的h&e染色。放大倍数=200。
85.图17:肿瘤切片cd8免疫荧光染色结果(红色:cd8;绿色:cd31;蓝色:dapi;比例尺:20μm)。
86.图18:肿瘤切片中cd4免疫荧光染色结果(绿色:cd4;蓝色:dapi;比例尺:100μm)。
87.图19:肿瘤切片中treg细胞(foxp3+)的免疫荧光染色结果(绿色:foxp3;蓝色:dapi;比例尺:100μm)。
具体实施方式
88.以下通过具体实施方式详细说明本发明的技术方案,应理解以下的具体实施方案仅为示例性,任何改动或变化只要不脱离本发明的技术方案设计,都应在本发明权利的要求保护范围之内。
89.实施例1
90.外泌体提取、纯化的方法,包括以下步骤:
91.(1)用含10μm米托蒽醌的dmem完全培养基培养胰腺癌panc-02细胞系12小时。
92.(2)收集的细胞培养上清前处理如下:800g离心5-10分钟;2000g离心20分钟;15000g离心30分钟,0.22μm滤膜过滤。
93.(3)随后上清进行超速离心处理提取外泌体,步骤如下:150000g离心2小时,4℃。
94.(4)进一步使用含碘克沙醇的蔗糖梯度液纯化外泌体:将500μl步骤(3)中用pbs 7.4重悬的外泌体加入到蔗糖梯度液(5-40%碘克沙醇,0.25mm蔗糖溶液,ph 7.4)中,100000g离心16小时,4℃;取第6、7毫升液体,150000g离心2小时,用pbs 7.4重悬,得到纯化后的外泌体。
95.实施例2
96.外泌体装载sirna包括以下步骤:
97.(1)通过超速离心将109外泌体重悬液替换为电转缓冲液(1.15mm磷酸钾ph 7.2,25mm氯化钾,21%碘克沙醇)。
98.(2)向上述电转缓冲液中加入1μg ccl22 sirna。
99.(3)电转:400v,125μf,∞ω。
100.(4)通过超速离心除去游离sirna并用pbs 7.4重悬,得到载sirna的外泌体。
101.实施例3
102.外泌体装载多肽包括以下步骤:
103.(1)精密称取1mg cm多肽,溶于100μl二甲亚砜溶液中。
104.(2)将上述溶液加入到500μl外泌体溶液中,室温孵育1小时。
105.(3)使用琼脂糖凝胶柱除去游离cm多肽,得到载cm多肽的外泌体。
106.本发明进行了动物实验,经低剂量米托蒽醌(mtx)处理后,panc-02细胞分泌的外泌体高表达免疫刺激信号(如钙网蛋白及高迁移率族蛋白b1),经注射后可激活体内dc细胞,增强免疫。本发明中外泌体作为药物载体,通过电转包载基因药物ccl22 sirna,用于阻断ccr4/ccl22通路,能减少肿瘤部位免疫抑制性细胞的募集。本发明的外泌体表面修饰mart-1肽,序列:elagigiltv,其具有免疫原性,能促进特异性抗肿瘤免疫反应,以激活肿瘤部位t淋巴细胞;本发明的外泌体疫苗spmexo经肌肉注射后,能实现pdac微环境靶向,激活特异性抗肿瘤反应,同时改善肿瘤免疫抑制微环境,发挥抗肿瘤疗效。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1