稳定的低浓度阿托品眼用制剂及其制备方法与用途与流程
1.本发明属于眼用药物制剂领域,具体涉及一种稳定的低浓度阿托品眼用制剂及其制备方法与用途。
背景技术:
2.近年来,由于电子设备的普及、生活节奏的加快等因素,导致近视患者的数量呈现日益增多的趋势,特别是青少年儿童近视发病率增长尤其突出。对于近视的防治,除了医疗手术之外,目前大部分多采用药物治疗。
3.有大量研究表明,阿托品或其硫酸盐作为毒蕈碱拮抗剂,对减缓近视进展有效,并在部分国家或地区应用于临床。开始,使用的是高浓度制剂(例如,0.1%~1%),但随着研究的深入逐渐发现,高浓度制剂的副作用较为严重,会出现散瞳作用强、畏光、视力模糊等现象,甚至发生过敏性结膜炎、过敏性睑缘炎等不良事件,容易引起患者较大的不适感。
4.因而,后面逐渐转为采用低浓度制剂(例如,0.001%~0.05%),并取得良好的进展和效果,例如:新加坡国家眼科中心低浓度阿托品治疗近视的研究结果表明,使用低的浓度,大大降低了高浓度所造成的瞳孔扩大、近物视物不清、畏光、结膜炎等副作用,并且停止用药后的反弹效应明显降低,更适合近视的控制和防治。
5.但是,随之而来也出现了新的挑战:阿托品低浓度制剂的稳定性问题。有多篇专利文献指出,与高浓度制剂相比,阿托品低浓度制剂的稳定性显著降低,在制备、生产、储存等过程中容易发生变质,托品酸等杂质含量明显增加。
6.对于阿托品低浓度制剂的稳定性问题,目前尚没有很好的解决方案。即使是,少数可行的办法也都存在这样那样的问题,例如:(1)现配现用,便捷性较差,而且容易受操作手法的影响而导致产品质量波动较大;(2)美国专利us9421199b2采用氘化水来替代h2o,以提高低浓度阿托品滴眼液的稳定性,然而同位素的引入,对产品的安全性必然产生影响,且对产品的生产及质量控制方面的要求也更高,不利于产品的推广应用;(3)调节至更低的ph值以满足制剂稳定的要求,但同时其刺激性也会大幅度增加,这不仅会影响患者用药的顺应性,而且还会因刺激引发泪液的分泌从而降低阿托品的生物利用度(参见:wo2020063320a1、cn 110934816 a、cn109675038a、cn107456440a、cn110917133a等)。
7.有鉴于此,特提出本发明。
技术实现要素:
8.针对现有技术存在的问题和/或不足,本发明的目的在于提供一种稳定的低浓度阿托品眼用药物组合物(眼用制剂),托品酸含量、总杂含量两项关键指标,随储存时间延长而增加的少(主要解决的技术问题是:低浓度的阿托品药物组合物在储存期间因托品酸和/或总杂的含量增加而导致的不符合质量标准的问题,即:稳定性问题),同时其ph值也能够稳定的保持在5.2~5.8范围内,对眼睛的刺激性小,大大地改善和提高了患者用药的顺应性和治疗效果(在解决稳定性问题的基础上,还进一步解决了药物的刺激性大、顺应性不好
的问题)。
9.本发明提供的技术方案如下:
10.一种药物组合物,包括以下组分:
11.毒蕈碱拮抗剂0.001wt%~0.05wt%(例如:0.002wt%、0.003wt%、0.004wt%、0.005wt%、0.006wt%、0.007wt%、0.008wt%、0.009wt%、0.01wt%、0.012wt%、0.015wt%、0.02wt%、0.03wt%、0.04wt%等);
12.粘度调节剂0.01wt%~0.6wt%(例如:0.02wt%、0.025wt%、0.03wt%、0.035wt%、0.04wt%、0.05wt%、0.08wt%、0.1wt%、0.12wt%、0.15wt%、0.2wt%、0.3wt%、0.4wt%、0.5wt%等);
13.缓冲剂0.05wt%~2.5wt%(例如:0.1wt%、0.15wt%、0.2wt%、0.3wt%、0.4wt%、0.5wt%、0.8wt%、1%、1.1wt%、1.2wt%、1.3wt%、1.4wt%、1.5wt%、1.6wt%、1.7wt%、1.8wt%、1.9wt%、2wt%等);
14.溶剂为水(优选注射用水或纯化水)。
15.进一步的,
16.在上述任一技术方案(药物组合物)中,所述的药物组合物还包括:渗透压调节剂0.2wt%~0.9wt%(例如:0.25wt%、0.3wt%、0.35wt%、0.4wt%、0.45wt%、0.5wt%、0.55wt%、0.6wt%、0.65wt%、0.7wt%、0.75wt%、0.8wt%、0.85wt%等);和/或,螯合剂0.005wt%~0.05wt%(例如:0.008wt%、0.012wt%、0.015wt%、0.02wt%、0.03wt%、0.04wt%等)。
17.进一步的,
18.在上述任一技术方案(药物组合物)中,所述的组分至少满足以下条件之一:
19.①
所述的毒蕈碱拮抗剂为阿托品或其药学上可接受的盐,优选为硫酸阿托品;
20.②
所述的粘度调节剂选自玻璃酸钠、纤维素衍生物、聚乙烯醇、聚乙二醇、交联聚乙烯醇吡咯烷酮、聚乙烯吡咯烷酮中的一种或两种以上;其中,所述的纤维素衍生物选自羟丙基甲基纤维素、甲基纤维素、羧甲基纤维素、羟丙基纤维素、羟丙基甲基纤维素中的一种或两种以上;
21.优选的,所述的粘度调节剂为玻璃酸钠和/或纤维素衍生物;
22.更优选的,所述的粘度调节剂为玻璃酸钠,或者,所述的粘度调节剂为羟丙基甲基纤维素;
23.③
所述的缓冲剂为氨基己酸、磷酸盐、醋酸盐或氨基酸;
24.其中,氨基酸是指含有氨基和羧基的有机化合物,化学式是rchnh2cooh;通常包括:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、甲硫氨酸(蛋氨酸)、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、苯丙氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸、组氨酸等;
25.④
所述的渗透压调节剂选自氯化钠、氯化钾、氯化钙、氯化镁、丙二醇、甘油、甘露醇、山梨醇中的一种或两种以上;
26.优选的,所述的渗透压调节剂为氯化钠和/或氯化钾;
27.⑤
所述的螯合剂为乙二胺四乙酸或其盐,优选为乙二胺四乙酸二钠。
28.进一步的,
29.在上述任一技术方案(药物组合物)中,所述的药物组合物还包括:ph调节剂,用于将药物组合物的ph值调节为5.2~5.8(例如:5.3、5.4、5.5、5.6、5.7等)或5.5
±
0.2或5.5
±
0.1;
30.优选的,所述的ph调节剂包括酸和碱;
31.更优选的,所述的酸为醋酸或盐酸,所述的碱为氢氧化钠或氢氧化钾。
32.进一步的,
33.在上述任一技术方案(药物组合物)中,所述的药物组合物包括以下组分:硫酸阿托品0.001wt%~0.05wt%;玻璃酸钠0.01wt%~0.6wt%;氨基己酸0.05wt%~2.5wt%;渗透压调节剂0.2wt%~0.9wt%;乙二胺四乙酸二钠0.005wt%~0.05wt%;ph调节剂;溶剂为水;其中,所述的渗透压调节剂包含氯化钠和/或氯化钾,所述的ph调节剂包含盐酸和/或氢氧化钠;
34.优选的,
35.所述的药物组合物包括以下组分:硫酸阿托品0.004wt%~0.02wt%;玻璃酸钠0.03wt%~0.3wt%;氨基己酸0.1wt%~0.5wt%;渗透压调节剂0.5wt%~0.9wt%;乙二胺四乙酸二钠0.008wt%~0.02wt%;ph调节剂;溶剂为水;
36.更优选的,
37.所述的药物组合物包括以下组分:硫酸阿托品0.01wt%;玻璃酸钠0.03wt%~0.3wt%;氨基己酸0.2wt%;氯化钾0.15wt%;氯化钠0.72wt%;乙二胺四乙酸二钠0.01wt%;ph调节剂;溶剂为水。
38.进一步的,
39.在上述任一技术方案(药物组合物)中,所述的药物组合物包括以下组分:硫酸阿托品0.001wt%~0.05wt%;玻璃酸钠0.01wt%~0.6wt%;磷酸盐0.05wt%~2.5wt%;氯化钠0.2wt%~0.9wt%;乙二胺四乙酸二钠0.005wt%~0.05wt%;ph调节剂;溶剂为水;其中,所述的磷酸盐包含磷酸二氢钾和/或磷酸氢二钾,所述的ph调节剂包含盐酸和/或氢氧化钠;
40.优选的,
41.所述的药物组合物包括以下组分:硫酸阿托品0.004wt%~0.02wt%;玻璃酸钠0.03wt%~0.3wt%;磷酸盐0.2wt%~1.2wt%;氯化钠0.2wt%~0.5wt%;乙二胺四乙酸二钠0.008wt%~0.02wt%;ph调节剂;溶剂为水;
42.更优选的,
43.所述的药物组合物包括以下组分:硫酸阿托品0.01wt%;玻璃酸钠0.03wt%~0.3wt%;磷酸二氢钾0.88wt%;磷酸氢二钾0.224wt%;氯化钠0.35wt%;乙二胺四乙酸二钠0.01wt%;ph调节剂;溶剂为水。
44.进一步的,
45.在上述任一技术方案(药物组合物)中,所述的药物组合物包括以下组分:硫酸阿托品0.001wt%~0.05wt%;粘度调节剂0.01wt%~0.6wt%;醋酸盐0.05wt%~2.5wt%;氯化钠0.2wt%~0.9wt%;乙二胺四乙酸二钠0.005wt%~0.05wt%;ph调节剂;溶剂为水;其中,所述的粘度调节剂为玻璃酸钠和/或纤维素衍生物,所述的醋酸盐为醋酸钠,所述的ph调节剂包含醋酸和/或氢氧化钠;
46.优选的,
47.所述的药物组合物包括以下组分:硫酸阿托品0.004wt%~0.02wt%;粘度调节剂0.03wt%~0.5wt%;醋酸钠0.5wt%~1.5wt%;氯化钠0.2wt%~0.9wt%;乙二胺四乙酸二钠0.008wt%~0.02wt%;ph调节剂;溶剂为水;
48.更优选的,
49.所述的药物组合物包括以下组分:硫酸阿托品0.01wt%;粘度调节剂0.03wt%~0.5wt%;醋酸钠0.6wt%~1.3wt%;;氯化钠0.4wt%~0.6wt%;乙二胺四乙酸二钠0.01wt%;ph调节剂;溶剂为水。
50.进一步的,
51.在上述任一技术方案(药物组合物)中,所述的药物组合物包括以下组分:硫酸阿托品0.001wt%~0.05wt%;玻璃酸钠0.01wt%~0.6wt%;氨基酸0.05wt%~2.5wt%;氯化钠0.2wt%~0.9wt%;乙二胺四乙酸二钠0.005wt%~0.05wt%;ph调节剂;溶剂为水;其中,所述的氨基酸为低分子量氨基酸(是指分子量小于200的氨基酸),所述的ph调节剂包含盐酸和/或氢氧化钠;
52.优选的,
53.所述的药物组合物包括以下组分:硫酸阿托品0.004wt%~0.02wt%;玻璃酸钠0.03wt%~0.3wt%;氨基酸1.2wt%~2wt%;氯化钠0.2wt%~0.9wt%;乙二胺四乙酸二钠0.008wt%~0.02wt%;ph调节剂;溶剂为水;其中,所述的氨基酸的分子量小于250、小于200、小于150或小于100;
54.更优选的,
55.所述的药物组合物包括以下组分:硫酸阿托品0.004wt%~0.01wt%;玻璃酸钠0.03wt%~0.3wt%;氨基酸1.5wt%~1.8wt%;氯化钠0.2wt%~0.5wt%;乙二胺四乙酸二钠0.01wt%;ph调节剂;溶剂为水;其中,所述的氨基酸为甘氨酸。
56.进一步的,
57.在上述任一技术方案(药物组合物)中,
58.在温度40℃
±
2℃、相对湿度75%
±
5%的条件下储存6个月内,所述药物组合物的托品酸含量≤3%,和/或,所述药物组合物的总杂≤5%;
59.或者,
60.在温度25℃
±
2℃、相对湿度60%
±
10%的条件下储存6个月内,所述药物组合物的托品酸含量≤3%,和/或,所述药物组合物的总杂≤5%。
61.进一步的,
62.在上述任一技术方案(药物组合物)中,所述药物组合物的储存温度为2~25℃;优选2~8℃。
63.进一步的,
64.在上述任一技术方案(药物组合物)中,所述的药物组合物为眼用制剂(例如:滴眼剂、洗眼剂、眼内注射溶液等);优选的,所述的药物组合物为滴眼剂或滴眼液。
65.此外,
66.本发明还提供了上述任意一项所述药物组合物的制备方法,包括以下步骤:将粘度调节剂加入到注射用水中(通常取总量的80%或以上),于50℃~60℃下搅拌至溶液澄
清,冷却至室温,再加入缓冲剂、渗透压调节剂和螯合剂,使其完全溶解,之后用ph调节剂将药物组合物的ph值调节为5.2~5.8或5.5
±
0.2或5.5
±
0.1,然后加入毒蕈碱拮抗剂,补足注射用水,使其完全溶解,过滤,即得。
67.进一步的,
68.根据实际需要,本发明药物组合物的制备方法,还可以包括灭菌和/或分装的步骤。
69.此外,本发明还提供了上述任意一项所述药物组合物在制备治疗和/或预防近视的药物(例如:滴眼剂等眼用制剂)中的用途。
70.本发明的有益效果是:通过调整药物组合物(眼用制剂)的粘度调节剂、缓冲剂与毒蕈碱拮抗剂等条件,意外地使得低浓度制剂的稳定性也得到了显著的改善(主要考察指标:托品酸含量、总杂含量),同时其ph值也能够稳定的保持在5.2~5.8范围内,对眼睛的刺激性小,大大改善和提高了患者用药的顺应性和治疗效果。
71.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
具体实施方式
72.下面将结合具体实施例对本发明进行清楚、完整的描述,本领域技术人员将会理解,下面所述的实施例是本发明一部分实施例,而不是全部的实施例,仅用于说明本发明,而不应视为对本发明保护范围的限制。
73.本发明中,未注明具体条件者,按照常规条件或制造商建议的条件进行,所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
74.其中,原料药硫酸阿托品的总杂含量≤0.25%。
75.关于本发明中使用术语的定义,除非另有说明,本文中术语提供的初始定义适用于全文中的该术语;对于本文没有具体定义的术语,应当根据公开内容和/或上下文,给出本领域技术人员能够给予它们的含义。
76.实施例1
77.滴眼液的各组分及其含量:硫酸阿托品0.01wt%、玻璃酸钠(粘度调节剂)0.03wt%、氨基己酸(缓冲剂)0.2wt%、氯化钾(渗透压调节剂)0.15wt%、氯化钠(渗透压调节剂)0.72wt%、乙二胺四乙酸二钠(也可表示为edta-2na,螯合剂)0.01wt%,盐酸/氢氧化钠(ph调节剂)调节溶液的ph值=5.5
±
0.1,溶剂为注射用水。
78.制备方法:取约为总量80%的注射用水,于50℃~60℃(例如:55℃)下,加入粘度调节剂,搅拌至溶液澄清;冷却至20℃~30℃,依次加入缓冲剂、渗透压调节剂和螯合剂,使其完全溶解,混匀;测量溶液的ph值,并用酸(例如:盐酸、冰醋酸等)和/或碱(例如:氢氧化钠等)调节溶液的ph值=5.5
±
0.1;最后加入硫酸阿托品,补足注射用水,使其完全溶解,通过0.22μm的pes过滤器过滤后,装入ldpe(low density polyethylene,低密度聚乙烯)瓶中。
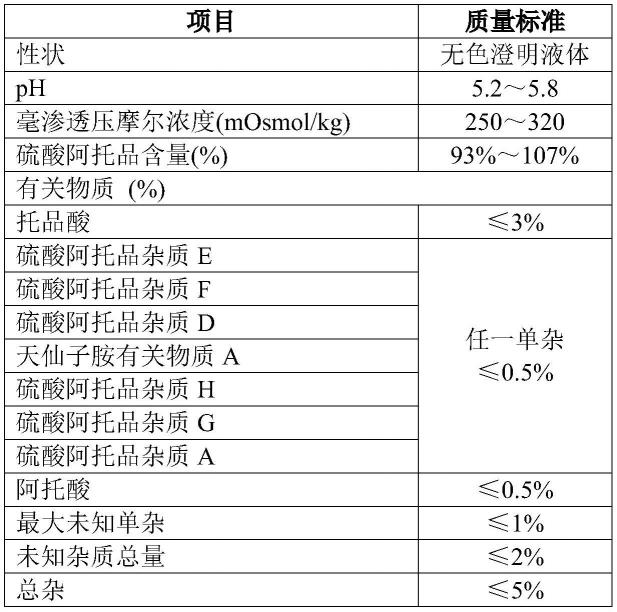
79.滴眼液制备好之后,按照表1的各项指标要求立即进行检测,作为起始数据。
80.表1、滴眼液的各项质量指标要求
[0081][0082]
其中,硫酸阿托品杂质e(7-hydroxyhyoscyamine)、杂质f(scopolamine)、杂质d(6-hydroxyhyoscyamine)、杂质h、杂质g(littorine)、杂质a(apoatropine),参见:欧洲药典7.0(european pharmacopoeia 7.0,可缩写为ep 7.0)第1429-1430页的atropine sulfate;天仙子胺有关物质a(hydroxyhyoscyamine related compound a)cas号537-29-1。
[0083]
并参照《中国药典》2015年版四部第354-356页:9001制剂稳定性试验指导原则,进行滴眼液的稳定性试验,两组条件加速试验:1、温度40℃
±
2℃、相对湿度75%
±
5%;2、温度25℃
±
2℃、相对湿度60%
±
10%;时间均为6个月。
[0084]
温度40℃、相对湿度75%条件下的加速试验结果,见表2。
[0085]
表2、温度40℃、相对湿度75%条件下的加速试验结果
[0086]
[0087][0088]
其中,nd(not detected)表示未检测到。
[0089]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,托品酸含量接近质量标准要求,总杂含量略超出质量标准要求。
[0090]
温度25℃、相对湿度60%条件下的加速试验结果,见表3。
[0091]
表3、温度25℃、相对湿度60%条件下的加速试验结果
[0092]
[0093][0094]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,各项指标满足质量标准要求。
[0095]
实施例2
[0096]
滴眼液的各组分及其含量:硫酸阿托品0.01wt%、玻璃酸钠(粘度调节剂)0.03wt%、磷酸二氢钾(缓冲剂)0.88wt%、磷酸氢二钾(缓冲剂)0.224wt%、氯化钠(渗透压调节剂)0.35wt%、乙二胺四乙酸二钠(螯合剂)0.01wt%,盐酸/氢氧化钠(ph调节剂)调节ph值=5.5
±
0.1,溶剂为注射用水。
[0097]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0098]
温度40℃、相对湿度75%条件下的加速试验结果,见表4。
[0099]
表4、温度40℃、相对湿度75%条件下的加速试验结果
[0100][0101]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,托品酸含量接近质量标准要求。
[0102]
温度25℃、相对湿度60%条件下的加速试验结果,见表5。
[0103]
表5、温度25℃、相对湿度60%条件下的加速试验结果
[0104][0105]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,各项指标满足质量标准要求。
[0106]
实施例3
[0107]
滴眼液的各组分及其含量:硫酸阿托品0.01wt%、玻璃酸钠(粘度调节剂)0.03wt%、醋酸钠(缓冲剂)0.62wt%、氯化钠(渗透压调节剂)0.55wt%、乙二胺四乙酸二钠(螯合剂)0.01wt%,醋酸/氢氧化钠(ph调节剂)调节ph值=5.5
±
0.1,溶剂为注射用水。
[0108]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0109]
温度40℃、相对湿度75%条件下的加速试验结果,见表6。
[0110]
表6、温度40℃、相对湿度75%条件下的加速试验结果
[0111]
[0112][0113]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,各项指标满足质量标准要求。
[0114]
温度25℃、相对湿度60%条件下的加速试验结果,见表7。
[0115]
表7、温度25℃、相对湿度60%条件下的加速试验结果
[0116]
[0117][0118]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,各项指标满足质量标准要求。
[0119]
实施例4
[0120]
滴眼液的各组分及其含量:硫酸阿托品0.01wt%、玻璃酸钠(粘度调节剂)0.03wt%、甘氨酸(缓冲剂)1.5wt%、氯化钠(渗透压调节剂)0.25wt%、乙二胺四乙酸二钠(螯合剂)0.01wt%,盐酸/氢氧化钠(ph调节剂)调节ph值=5.5
±
0.1,溶剂为注射用水。
[0121]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0122]
温度40℃、相对湿度75%条件下的加速试验结果,见表8。
[0123]
表8、温度40℃、相对湿度75%条件下的加速试验结果
[0124][0125]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,各项指标均能很好地满足质量标准要求。
[0126]
温度25℃、相对湿度60%条件下的加速试验结果,见表9。
[0127]
表9、温度25℃、相对湿度60%条件下的加速试验结果
[0128][0129]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,各项指标都能够满足质量标准要求。
[0130]
实施例5
[0131]
滴眼液的各组分及其含量:硫酸阿托品0.01wt%、玻璃酸钠(粘度调节剂)0.03wt%、甘氨酸(缓冲剂)0.5wt%、谷氨酸(缓冲剂)0.13wt%、组氨酸(缓冲剂)0.15wt%、氯化钠(渗透压调节剂)0.55wt%、乙二胺四乙酸二钠(螯合剂)0.01wt%,盐酸/氢氧化钠(ph调节剂)调节ph值=5.5
±
0.1,溶剂为注射用水。
[0132]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0133]
温度40℃、相对湿度75%条件下的加速试验结果,见表10。
[0134]
表10、温度40℃、相对湿度75%条件下的加速试验结果
[0135]
[0136][0137]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,硫酸阿托品杂质g、最大未知单杂、未知杂质总量、总杂等指标不能满足质量标准要求。
[0138]
温度25℃、相对湿度60%条件下的加速试验结果,见表11。
[0139]
表11、温度25℃、相对湿度60%条件下的加速试验结果
[0140]
[0141]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,最大未知单杂、未知杂质总量等指标不能满足质量标准要求。
[0142]
实施例6
[0143]
滴眼液的各组分及其含量:硫酸阿托品0.01wt%、玻璃酸钠(粘度调节剂)0.03wt%、谷氨酸(缓冲剂)0.05wt%、组氨酸(缓冲剂)0.15wt%、氯化钠(渗透压调节剂)0.75wt%、乙二胺四乙酸二钠(螯合剂)0.01wt%,盐酸/氢氧化钠(ph调节剂)调节ph值=5.5
±
0.1,溶剂为注射用水。
[0144]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0145]
温度40℃、相对湿度75%条件下的加速试验结果,见表12。
[0146]
表12、温度40℃、相对湿度75%条件下的加速试验结果
[0147][0148]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,硫酸阿托品杂质g、最大未知单杂、未知杂质总量、总杂等指标不能满足质量标准要求。
[0149]
温度25℃、相对湿度60%条件下的加速试验结果,见表13。
[0150]
表13、温度25℃、相对湿度60%条件下的加速试验结果
[0151][0152]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,硫酸阿托品杂质g、最大未知单杂、未知杂质总量等指标不能满足质量标准要求。
[0153]
实施例7
[0154]
滴眼液的各组分及其含量:硫酸阿托品0.01wt%、玻璃酸钠(粘度调节剂)0.03wt%、组氨酸(缓冲剂)0.2wt%、l-天冬氨酸(缓冲剂)0.1wt%、氯化钠(渗透压调节剂)0.75wt%、乙二胺四乙酸二钠(螯合剂)0.01wt%,盐酸/氢氧化钠(ph调节剂)调节ph值=5.5
±
0.1,溶剂为注射用水。
[0155]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0156]
温度40℃、相对湿度75%条件下的加速试验结果,见表14。
[0157]
表14、温度40℃、相对湿度75%条件下的加速试验结果
[0158]
[0159][0160]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,托品酸含量、硫酸阿托品杂质g、最大未知单杂、未知杂质总量、总杂等指标不能满足质量标准要求。
[0161]
温度25℃、相对湿度60%条件下的加速试验结果,见表15。
[0162]
表15、温度25℃、相对湿度60%条件下的加速试验结果
[0163]
[0164][0165]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,硫酸阿托品杂质g、最大未知单杂、未知杂质总量等指标不能满足质量标准要求。
[0166]
实施例8
[0167]
滴眼液的各组分及其含量:硫酸阿托品0.004wt%、玻璃酸钠(粘度调节剂)0.1wt%、甘氨酸(缓冲剂)1.8wt%、氯化钠(渗透压调节剂)0.25wt%、乙二胺四乙酸二钠(螯合剂)0.01wt%,盐酸/氢氧化钠(ph调节剂)调节ph值=5.5
±
0.1,溶剂为注射用水。
[0168]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0169]
温度40℃、相对湿度75%条件下的加速试验结果,见表16。
[0170]
表16、温度40℃、相对湿度75%条件下的加速试验结果
[0171][0172]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,各项指标满足质量标准要求。
[0173]
温度25℃、相对湿度60%条件下的加速试验结果,见表17。
[0174]
表17、温度25℃、相对湿度60%条件下的加速试验结果
[0175]
[0176][0177]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,各项指标满足质量标准要求。
[0178]
实施例9
[0179]
滴眼液的各组分及其含量:硫酸阿托品0.01wt%,羟丙基甲基纤维素(粘度调节剂)0.5wt%,醋酸钠(缓冲液)1.24wt%,氯化钠(渗透压调节剂)0.5wt%,乙二胺四乙酸二钠(螯合剂)0.01wt%,醋酸/氢氧化钠(ph调节剂)ph=5.5
±
0.1,溶剂是注射用水。
[0180]
按照与实施例1相同的方法进行制备,以及进行稳定性试验。
[0181]
温度40℃、相对湿度75%条件下的加速试验结果,见表18。
[0182]
表18、温度40℃、相对湿度75%条件下的加速试验结果
[0183]
[0184][0185]
结果表明,该配方的滴眼液在温度40℃、相对湿度75%条件下加速试验6个月,各项指标满足质量标准要求。
[0186]
温度25℃、相对湿度60%条件下的加速试验结果,见表19。
[0187]
表19、温度25℃、相对湿度60%条件下的加速试验结果
[0188][0189]
结果表明,该配方的滴眼液在温度25℃、相对湿度60%条件下加速试验6个月,各项指标满足质量标准要求。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1