一种含酵母基因工程细胞的3D仿生植入体的制备与应用的制作方法
一种含酵母基因工程细胞的3d仿生植入体的制备与应用
技术领域
1.本发明属组织工程领域,更具体地说,本发明涉及一种新型基因工程细胞的3d仿生植入体的应用。
2.
背景技术:
3.生物大分子药物涵盖了重组蛋白、抗体、疫苗、细胞治疗、核酸药物、基因治疗等。重组蛋白质或核酸类药物在重大疾病治疗中发挥极其重要的作用,多用于治疗肿瘤、艾滋病、心脑血管病、肝炎等重大疾病,被认是为21世纪药物研究开发中最有前景的领域之一。目前市售的化学药物、中药等传统药物往往存在水溶性差、易被人体快速清除、生物相容性差、体内分布不理想和向细胞渗透能力低等缺陷,而重组蛋白质或核酸类等生物药物如蛋白质药物也存在易被降解、难以穿透细胞膜、免疫原性、稳定性低等问题,使得许多良好靶点的潜在生物大分子药物的成药率极低。如何提高生物大分子药物的生物利用度,最大程度地保留其生物活性、降低其免疫原性并将其传递至靶部位及靶细胞,也是实现生物大分子药物高效化传递亟待解决的关键问题。
4.近年,大分子药物的研发模式已经由传统的新药创制开发模式逐渐转变为包括药物传送系统(drugdeliverysystem,dds)齐头并进的创新模式。美国fda批准的新药成品中,约一半属创新型药物传送系统制剂。传统的重组的蛋白(肽)药物体内易被酶降解、半衰期短、免疫原性以及重组核酸类不易被细胞摄取等特点大大限制了应用。近年的细胞外泌体技术已被较多应用于药物运载研究,尤其在生物大分子药物方面显示了巨大的优势。细胞外泌体是通过保守的生物过程特异性分泌的膜泡,具有脂质双层膜结构,其产生的主要过程可概括为:(1)细胞质膜凹陷形成细胞内小泡;(2)细胞内小泡进一步发展形成多泡小体;(3)多泡小体与细胞质膜融合释放外泌体,受体细胞对外泌体的接收可以通过配体-受体相互作用、胞饮/吞噬或膜融合来实现。根据其产生过程可以看出,外泌体是细胞膜成分的囊泡,其可携带包括脂质、蛋白质、rna和dna等多种成分,在较好地保护其包裹成分的同时,也能随血液输送至特定靶向细胞或组织,因此在体内以外泌体传递重组生物药物是一种很好细胞间递送系统。外泌体复杂的组成、可由多种细胞分泌、普遍存在于体液中,使得外泌体发挥着极其重要的生物学效应,也使得人们产生了将这种细胞天然产生的外泌体作为药物包载系统的想法。因此,如何高效地获得包载目标蛋白、核酸的外泌体亟待研究突破。本实验室已发现经转入囊泡类基因的粘红酵母可大量生产外泌体,且在细胞质中重组质粒形成产生的药物分子可被包入外泌体内。
5.外泌体作为药物载体进行药物运输有独特的优势,主要体现在:(1)当使用自源外泌体时,外泌体引起的有害免疫反应极低;(2)外泌体在人血液中的稳定性好;(3)向细胞转运“货物”的效率高;(4)外泌体运载药物时具有一定的靶向性;(5)外泌体直径在40~100nm之间,因此可以很好地利用增强渗透滞留(epr)效应,有选择性地渗入到肿瘤或炎症组织部位。目前已经尝试用外泌体携带sirna,化学小分子药物等进行基因治疗和肿瘤治疗等研
究。
6.利用天然外泌体携带核酸、脂质、蛋白质等物质的特性,可将外泌体作为一种载带核酸、多肽、蛋白质类药物的优良载体。其中外泌体载带rna类药物的文献目前报道较多,如外泌体载带mir-26a、长非编码rna(lncrna)-h19、mir-200b等用于抗肿瘤、糖尿病性创伤、肠纤维化治疗等研究,证明载带rna的外泌体给药系统有希望成为多种疾病的基因治疗手段。蛋白质类药物主要包括酶、多肽及细胞因子等,因具有特殊的药理活性而成为治疗疾病的一类重要药物,但分子量大、稳定性差等缺点限制其临床应用。近年来,研究显示外泌体作为药物载体可以载带多种蛋白质,实现靶向给药和稳定酶活性等目的。sterzen-bach等构建载带cre重组酶的外泌体递送系统并实现跨越血-脑屏障的脑部靶向给药,该研究利用分子开关机制实现外泌体装载外源性cre重组酶,为构建载带外源性蛋白质外泌体递送系统提供了新思路。yuan等利用天然巨噬细胞分泌的外泌体载带脑源性神经营养因子,实现了脑部炎症病变下的主动靶向给药,为脑部炎症治疗及大脑营养提供了新方法。虽然最初的研究以实现中枢神经系统疾病靶向治疗多见,但近年来非脑部靶向给药的研究也逐渐增多。如malhotra等构建了载带转铁蛋白和乳清铁蛋白的外泌体递送系统,并实现了全身给药的肿瘤靶向药物递送。
7.外泌体不仅可以通过内源内含物对受体细胞起到治疗作用,也可以通过装载外源物质对受体细胞起到治疗的作用。目前利用外泌体装载药物的方式中较为成熟、应用较多的包括两种,一是将药物与外泌体来源细胞共培养,使细胞分泌出的外泌体内自然包含有药物;二是通过化学方法(如脂质体转染法)转染外泌体来源细胞,使其携带药物。外泌体是用于递送生物分子的有吸引力的载体。然而,将功能分子加载到外泌体的机制是相对未被阐明的。但目前对外泌体装载药物的研究较为片面,未系统地解决蛋白、多肽、核酸等多种大分子药物给药途径复制、困难的问题。因此,本研究拟系统地构建外泌体产药的基因工程细胞,通过同源重组导入sec1基因以高效产生外泌体并同时转入药物蛋白表达质粒(如vmip表达质粒)的基因工程细胞,此细胞可以外泌体的方式释放脂质体-药物蛋白,以实现重组蛋白质药物的高效化和靶向性传递。
8.相较于传统的注射和口服给药途径,以外泌体形式包裹目的药物靶向给药不仅可以改善药物吸收,提高生物利用度;还可以通过靶向给药,改善药物的体内分布,提高药物的组织特异性浓度与药物的靶向性;延长药物的体内循环时间,增强药物疗效。随着美国的3d打印药物spritam2016年上市以来,3d生物打印的载药植入体已崭露头角,尤其对重组生物药物起到变革作用。本项目的进一步研究可作为3d生物打印载药植入体的植入细胞,此类载药植入体可通过非注射的途径释放药物进入人体,在体内长效地控制药物释放,并将药物输送到靶向器官的体系。
9.此类基因工程细胞适用于大多数有明确药物靶点的可表达蛋白,这一生物大分子药物递送体系将为重组蛋白药物的体内高效应用提供良好的技术平台。
技术实现要素:
10.本发明主要目的是构建一种新型的3d仿生载药植入体,其内载入可产生含药外泌体的活体基因工程细胞,植入体内后(如皮下埋置)以外泌体方式持续分泌所表达的重组蛋白、重组肽或重组核酸等生物药物分子。对于3d仿生载药植入体的外层材料,我们拟采用
fda认证的聚对二氧环已酮(ppdo)材料,制成纳米级多孔膜管。生物相容性好,无抗原性,体内降解生成水和co2(约8个月降解),载入细胞分泌的含目的生物药物的脂质外泌体直径为200nm左右,网孔一般在500nm左右,可使内载入细胞不能外逃,且免疫细胞不能进入,保证内载入的产药工程细胞无免疫反应。我们拟采用搭载细胞的水凝胶作为3d仿生载药植入体的内层材料,并可添加细胞培养的营养成分。目前生物3d打印常用甲基丙烯酸化水凝胶(gelma),材料具有细胞粘附位点,易被生物降解(约6个月降解)、无抗原性,生物相容性良好本发明使用高表达sec1囊泡运输基因的粘红酵母作为植入体的载入细胞。我们将粘红酵母gm4通过同源重组方法将其基因组中的胸苷酸合成酶ts敲低,以及增强cct酶脂质合成基因重组改造,获得了可将胞浆中脂质分泌到胞外并运载多肽类药物的gm4-δts-pgk1-cct重组粘红酵母菌株,且该重组菌株在体内不再增殖,仅作为安全、可控的多肽药物载体。
11.本发明中的3d仿生植入体,作为一种平台型技术,除了可搭载上述vmip蛋白外,后期可以搭载多种其他生物大分子药物,重组蛋白,重组多肽等,从而对不同病症起到治疗与预防作用。与现有技术相比,这款3d仿生基因工程细胞植入体不仅增加了药物在体内的持续作用性,起到了良好的预防作用,而且通过使用活细胞分泌外泌体的方式产药,增加了药物在体内的稳定性,降低了免疫原性。
12.附图说明
13.图1酿酒酵母总rna琼脂糖凝胶电泳分析。(m为dl5000 dna marker;左图泳道1为酿酒酵母总rna;右图泳道1为sec1电泳泳道(2175bp))图2重组质粒ppicz-pgk1-cct/sec1菌落pcr检测与双酶切鉴定(左:m为dl2000 dna marker;泳道1为sec1基因pcr产物。右:泳道1为重组质粒ppicz-pgk1-cct/sec1;泳道2为ppicz-pgk1-cct质粒)图3重组菌株gm4-δts-cct/sec1中目的蛋白的sds-page检测(注:泳道1为转入ppicz-pgk1-cct(空质粒)的菌株;泳道2为转入ppicz-pgk1-cct/sec1的菌株)图4western blot检测重组sec1/munc18蛋白(注:1为对照组;2为重组菌株gm4-δts-cct/sec1)。
14.图5质粒pmd18-t-kex2-ek菌落pcr(左)及双酶切鉴定(右)图。(注:左:m:dl500 dna marker;泳道1:转染pmd18-t-kex2-ek质粒的菌株;泳道2:转染pmd18-t载体的菌株。右:m1:dl4500 dna marker;m2:dl500 dna marker;泳道1:pmd18-t-kex2-ek质粒;泳道2:pmd18-t质粒)。
15.图6重组质粒ppiczα-vmip
‑ⅱ
菌落pcr检测(左)和双酶切鉴定(右)。(注:左:m为dl2000 dna marker;泳道1为kex2+vmip
‑ⅱ
基因pcr产物;右:m为dl15000 dna marker;泳道1为重组质粒ppiczα-vmip
‑ⅱ
双酶切;泳道2为ppiczα质粒双酶切)图7ppiczα-vmip
‑ⅱ
转入gm4-δts-cct/sec1细胞后sds-page检测目标蛋白的表达。(注:m为蛋白质marker;泳道1为vmip
‑ⅱ
标准品;泳道2为不含的信号肽的ppiczα-vmip
‑ⅱ
质粒转入组;泳道3为含信号肽的ppiczα-vmip
‑ⅱ
质粒转入组;泳道4为ppiczα质粒转入组)。
16.图8 3d仿生植入体示意图。
17.图9外泌体粒径qnano分析图。
具体实施方式
18.以下结合实施例,对本发明进行进一步详细说明。
19.实施例重组蛋白或核酸药物以外泌体分泌表达的细胞体系研究1营养缺陷型粘红酵母高产脂质-外泌体的基因工程细胞(gm4-δts-cct/sec1)改造前期将我们发现的粘红酵母gm4通过同源重组方法将其基因组中的胸苷酸合成酶ts敲低,以及增强cct酶脂质合成基因重组改造,获得了可将胞浆中脂质分泌到胞外并运载多肽类药物的gm4-δts-pgk1-cct重组粘红酵母菌株,且该重组菌株在体内不再增殖,仅作为安全、可控的多肽药物载体。因此,本研究在此重组菌株基础上作进一步改造。
20.(1)酿酒酵母总rna的提取在正常生长有酿酒酵母的ypd培养基上挑取一单菌落至新鲜的ypd培养基中,30℃过夜培养,按1:100稀释过夜培养菌液,加入1mmol/l的l-苯丙氨酸,培养至od
600
达到0.8~1.0时,收集菌体进行总rna的提取,具体步骤根据文献中的热酚法进行操作。
21.(2)酿酒酵母囊泡运输基因sec1的克隆根据genbank中已报道的酿酒酵母囊泡运输基因sec1序列比对结果,设计出相应的克隆引物。提取得到的总rna按照takara prime scripttm rt-pcr kit操作说明进行酿酒酵母cdna第一链的合成,然后以设计好的引物pf_sec1和pr_sec1,以合成的cdna 为模板进行pcr扩增,反应体系如下:94℃预变性5min,94℃变性30s,62℃退火30s,72℃延伸2min 10s,35个循环后在72℃延伸10min,4℃保存。pcr反应产物用0.75%的琼脂糖凝胶电泳分析结果。pcr扩增目的基因后,凝胶电泳分离纯化pcr产物,胶回收目的基因。将目的基因连接到pmd-t载体上,转化大肠杆菌dh5α,通过质粒电泳和酶切筛选鉴定阳性克隆,选取阳性重组子进行序列测定,将测序结果和所报道的序列用bioedit软件进行序列比对分析。pcr扩增引物如下所示:pf-sec1:5
’‑
atgtctgatttaattgaattacaga-3’;pr-sec1:5
’‑
tcatttatcatggtgagattttctt-3’。
22.(3)gm4-δts-cct/sec1菌株(细胞)的构建重组质粒ppicz-pgk1-cct/sec1由生工生物工程(上海)股份有限公司(sangon biotech(shanghai)co.,ltd.)构建,将重组质粒电转化至gm4
‑△
ts菌株,即获得gm4-δts-cct/sec1重组菌株。通过对重组菌株gm4-δts-cct/sec1进行菌落pcr和酶切筛选从而确定阳性克隆。
23.(4)gm4-δts-cct/sec1菌株中目的蛋白的诱导表达与验证gm4-δts-cct/sec1重组菌株按照1%的接种量接入含相同浓度胸苷酸抗性的ypd液体培养基中进行扩培,37℃恒温培养直至od600达到0.6后,加入终浓度为0.6mmol/l的iptg(异丙基-β-d硫代半乳糖苷)在20℃条件下诱导表达。取1ml培养液,于12000rpm离心收集菌体,并将菌体悬浮于ph为7.0的100μl 1
×
sds加样缓冲液。将菌体放置超声破碎仪中进行破碎,收集上清液用于下一步的蛋白纯化和sds-page分析。蛋白纯化使用ni-nta his-bindtm resin进行,步骤按照qiagen公司的产品目录说明。将iptg诱导表达的菌体及破菌后上清和沉淀的样品经sds-page电泳转移至pvdf膜后,用sec1(yd-19)抗体作为一抗,磷酸
酶(ap)标记的羊抗豚鼠igg作为二抗,进行western blotting印迹分析。
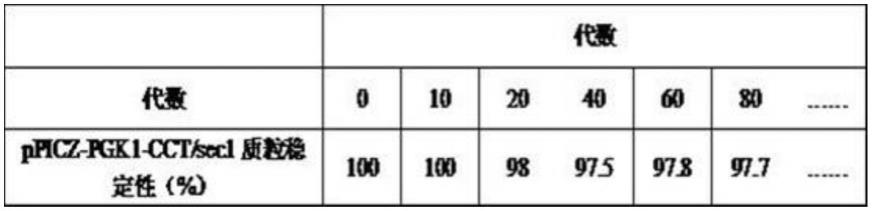
24.(5)gm4-δts-cct/sec1菌株在传代过程中质粒及表达稳定性从含胸苷酸抗性(50μg/ml)的ypd平板上挑取单克隆,接种至含胸苷酸抗性(50μg/ml)的ypd液体培养基中,37℃培养至菌密度为5
×
109,稀释1
×
104倍后,接种至非选择性ypd培养基,生长20代(12h)后,转接ypd培养基,继续培养20代,依此类推。每隔20代均取培养物涂非选择性ypd平板,37℃生长过夜后,从每个平板上挑取100个菌落分别至含胸苷酸抗性(50μg/ml)、卡那霉素的ypd平板,37℃培养,计数长出的菌落数。从上述ypd平板上挑取单菌落,进行小规模表达试验。
25.2.分泌信号肽的设计、合成与构建(1)分泌信号肽kex2-ek的设计信号肽kex2切割位点序列改造是提高外源蛋白分泌效率的常见策略之一。kex2蛋白酶是酵母自身编码的具有ca
2+
依赖性丝氨酸蛋白酶,属枯草杆菌蛋白酶家族,其加工蛋白前体、切除信号肽的特异性酶切位点为lys-arg/arg-arg/pro-ar。基于酿酒酵母的α-因子前原前导引子最常用作分泌信号,因此,我们将酿酒酵母α-因子分泌信号(lekr)的羧基末端作为目的蛋白的引导肽,其含有kex2切割位点,然后是间隔肽(eeaeaeaepk),最后与目的蛋白链接。
26.分泌信号肽序列如下所示:leu glu lys arg glu glu ala glu ala glu ala glu pro lys ctc gag aag aga gaa gaa gct gaa gct gaa gct gaa cca aag gag ctc ttc tct ctt ctt cga ctt cga ctt cga ctt ggt ttc(2)kex2-ek的合成将设计好的kex2-ek肽段送至大连宝公司进行合成。
27.(3)质粒pmd18-t-kex2-ek的构建与鉴定在合成的kex2-ek片段两端引入ecorⅰ/ecorv,并通过同源重组将其克隆至pmd18-t中,以构建pmd18-t-kex2-ek质粒。
28.3原核细胞表达的药物表达载体构建vmip
‑ⅱ
表达质粒ppiczα-vmip
‑ⅱ
的构建ppiczα-vmip
‑ⅱ
为本实验室构建。构建方法为:按照引物设计原则,采用引物设计软件primer5.0,设计引物如下表:引物名称序列vmip
‑ⅱ
fp5'accatgggtgacaccctgggtgc3'vmip
‑ⅱ
rp5'gcgagcggtaaccggcagt 3'5'aox15'gactggttccaattgacaagc 3'3'aox15'gcaaa t ggca t tct gaca tcc3'pcr反应体系为:10
×
buffer 8μl,25mmol/l mgso
4 4μl,10mmol/l dntp 8μl,20μmol/l vmip
‑ⅱ
fp 2μl,20μmol/l vmip
‑ⅱ
rp 2μl,kod-plus聚合酶4μl,加水至80μl。pcr反应条件如下:94℃变性5min后,进行30个循环,程序为:94℃变性30s,55℃退火30s和72℃延伸80s。从琼脂糖凝胶上切下含目的片段的电泳条带,按胶回收试剂盒说明书进行回收。质粒提取、酶切、连接反应、cacl2法转化及重组子鉴定按参考文献进行,在含有25μg/ml zeocine的lb培养基平板上筛选重组子。用菌液pcr法进行重组子鉴定,将鉴定为正确的克
隆送擎科生物公司测序。
29.参照酵母醋酸锂转化法制备粘红酵母gm4-δts-cct/sec1感受态细胞。取80μl感受态细胞分别与10μl(5~10μg)xha i线性化的重组表达质粒ppiczα-vmip
‑ⅱ
混合,于bio-rad gene pluser电转仪下电转化(电压:1500v;电容:25μf;时间参数:5.4ms),涂布于含50μg/ml胸苷酸和100μg/ml zeocin的ypd抗性选择平板上筛选重组酵母菌。
30.4.可高效分泌药物外泌体的细胞构建(1)目的药物载体转染gm4-δts-cct/sec1细胞参照酵母醋酸锂转化法制备粘红酵母gm4-δts-cct/sec1感受态细胞。取80μl感受态细胞分别与10μl(5~10μg)验证正确的表达vmip
‑ⅱ
蛋白的ppic-vmip
‑ⅱ
(zeocin)、表达胰岛素的pet-28a-pi(卡那霉素)、表达mir377的pyes2-mir377(氨苄青霉素amp)混合,于bio-rad gene pluser电转仪下电转化(电压:1500v;电容:25μf;时间参数:5.4ms),分别涂布于含胸苷酸和相应抗性的ypd抗性选择平板上筛选重组酵母菌。再按照1%的接种量接入含胸苷酸(50μg/ml)和相应抗性的ypd液体培养基中进行扩培,37℃恒温培养直至od
600
达到0.6后,加入终浓度为0.6mmol/l的iptg在20℃条件下诱导表达。取1ml培养液,于12000rpm离心收集菌体,并将菌体悬浮于ph为7.0的100μl 1
×
sds加样缓冲液。将菌体放置超声破碎仪中进行破碎,收集上清液用于sds-page分析。
31.从含胸苷酸抗性(50μg/ml)和相应抗性的ypd平板上挑取单克隆,分别接种至含胸苷酸抗性(50μg/ml)和相应抗性的ypd液体培养基中,37℃培养至菌密度为5
×
109,稀释1
×
104倍后,接种至非选择性ypd培养基,生长20代(12h)后,转接ypd培养基,继续培养20代,依此类推。每隔20代均取培养物涂非选择性ypd平板,37℃生长过夜后,从每个平板上挑取100个菌落分别至含胸苷酸抗性(50μg/ml)和相应抗性的ypd平板,37℃培养,计数长出的菌落数。
32.(2)胞外检测载药外泌体的含量和目的蛋白表达量a、转化质粒后的gm4-δts-cct/sec1细胞外泌体的提取分离如前所述,通过修饰(chutkan et al.,2013)从电转化质粒的gm4-δts-cct/sec1菌株中纯化外泌体。简而言之,待转化后的gm4-δts-cct/sec1菌株生长至对数期(od600≈0.5~06)时,通过在4℃下以10000
×
g离心10min收集无菌体上清液。将该上清液通过0.45μm过滤器进一步过滤,并通过在beckman nvttm65转子中在4℃下以400000
×
g超速离心1.5小时来沉淀外泌体。除去上清液后,用将外泌体重悬于300μl无菌pbs中。配制8%、30%、45%、60%质量分数的蔗糖溶液,在离心管中依次加入不同浓度蔗糖溶液,最后缓慢加入重悬液于8%蔗糖溶液之上
[12-15]
,36000rpm离心1.5h,合并收取上两层条带并加水稀释,再进行离心除掉蔗糖,用pbs重悬沉淀。
[0033]
、转染后ips-rab27a细胞外泌体的提取分离收集转染不同药物表达载体后的第3代人ips-rab27a细胞的培养上清,采用高速超速离心法提取外泌体
[15]
,具体步骤简述如下:
①
通过“饥饿”预处理收集第3代转染后的人ips-rab27a细胞培养上清液200ml;
②
4℃、300
×
g低速离心10min;
③
4℃、2000
×
g离心10min;
④
将收集的上清液重新分装,按离心参数(10000
×
g、30min、4℃)离心,收集上清液;
⑤
4℃、100000
×
g条件下超速离心70min,弃去上清,即可获得外泌体,重悬于pbs中,-80℃保存备用。
[0034]
、透射电镜检测外泌体形态用移液枪各吸取外泌体悬液约10μl,缓慢滴于200目载样铜网上,在室温下静置2min;用薄型滤条干燥载样铜网一侧的液体,然后在同一片载样铜网上滴加20μl 0.1%的磷钨酸,室温下负染5min;使用细长滤纸条从载样铜网侧面吸干负染液,在白炽灯下烤干,把载样铜网放到透射电镜下,以80kv电压观察悬浮的颗粒物形态,确定外泌体的大小。
[0035]
、qnano测外泌体粒径分布安装纳米孔板,调试仪器至纳米孔板内无任何气泡。取1μl标准颗粒,加专用buffer 1ml以稀释1000倍,用0.22μm滤器过滤后备用;各取5μl外泌体,加pbs 45μl以稀释10倍,0.22μm滤器过滤,即可加样上机测试,每次上样量为30μl,测试粒子数量400个左右,即可点击停止按钮,待仪器自动处理数据并生成粒径分布图。
[0036]
、bca法测定外泌体和蛋白浓度bca工作液根据待测孔数按a液:b液=50:1的比例配制;将蛋白标准品浓度稀释到0.5g/l,按0、1、2、4、8、12、16和20μl的量将标准品加入对应的孔中,加标准品稀释液到20μl;每孔加2μl待测样品,加标准品稀释液到20μl;每孔加200μl bca工作液,37℃孵育30min;用酶标仪测出各孔的a562,绘制标准曲线,计算蛋白量。
[0037]
、激光共聚焦检测细胞与外泌体分布情况待ips-rab27a细胞生长至80%左右,将外泌体用pkh-26进行细胞膜红色荧光标记后与ips-rab27a细胞共培养24h,加入dapi为ips-rab27a细胞进行细胞核蓝色荧光标记,洗涤后即可进行荧光共聚焦显微镜检测。
[0038]
、外泌体及细胞总rna的提取和cdna合成将提取分离收集得到的外泌体或转染后的细胞移去培养基,加入1ml trizol试剂裂解细胞,按照试剂说明书提取外泌体或细胞总rna。取1μg总rna按照iscript cdna合成说明书进行逆转录反应。
[0039]
、实时荧光定量pcr检测mir377的表达水平通过bio-rad cfx96 real-time pcr检测系统进行。30μl反应体系:2
×
sybr green master mix 15ml,10μmol/l基因特异性引物各1μl,cdna模版2μl,以ddh2o补至30μl。pcr循环条件:95℃预变性10min,95℃变性10s,60℃退火/延伸60s,共进行40个循环。目标药物蛋白/核酸在细胞样本中的表达水平以β-actin作为内参基因,在外泌体中的表达水平以u6作为内参基因进行均一化,目标药物蛋白/核酸的相对定量检测使用2
‑△△
ct
法计算。检测引物由擎科公司合成。
[0040]
、western blot检测外泌体的表面蛋白和目的蛋白表达水平各取外泌体20μl进行sds-page分离蛋白,电转至pvdf膜上,5%脱脂奶粉封闭液封闭非特异性抗原结合位点后,加入anti-cd63抗体(ab216130)、anti-tsg101抗体(ab70974)、vmip
‑ⅱ
单克隆抗体、anti-insulin抗体及相应hrp标记的ⅱ抗,ecl进行显色,暗室x胶片显影,拍照后进行条带灰度分析。
[0041]
5.可载基因工程细胞的3d仿生植入体的构建(1)纳米多孔膜管外层材料的选择和制备对于3d仿生载药植入体的外层材料,我们拟采用fda认证的聚对二氧环已酮(ppdo)材料,制成纳米级多孔膜管。生物相容性好,无抗原性,体内降解生成水和co2(约8个
月降解),载入细胞分泌的含目的生物药物的脂质外泌体直径为200nm左右,网孔一般在500nm左右,可使内载入细胞不能外逃,且免疫细胞不能进入,保证内载入的产药工程细胞无免疫反应。
[0042]
ppdo制备纳米级多孔结构拟通过三种方式:a.静电纺丝:在持续滚动的内层水凝胶材料表面进行静电纺丝,为内层材料包裹纳米纤维膜。
[0043]
b.同轴3d打印:内层为水凝胶材料,外层为溶解的ppdo和致孔剂的混合物,打印后形成外层多孔结构。
[0044]
c.水凝胶灌注:用颗粒烧结法或相分离法等方式制备空心状外层ppdo多孔圆桶,再灌注内层水凝胶。
[0045]
通过核磁共振、红外光谱、x射线衍射研究材料的化学性质,通过力学测试、体内降解测试、溶胀测试研究材料的物理表征。
[0046]
(2)水凝胶内层基质的材料选择和制备我们拟采用搭载细胞的水凝胶作为3d仿生载药植入体的内层材料,并可添加细胞培养的营养成分。目前生物3d打印常用甲基丙烯酸化水凝胶(gelma),材料具有细胞粘附位点,易被生物降解(约6个月降解)、无抗原性,生物相容性良好。
[0047]
在低温3d打印平台上进行琼脂糖细胞-gelma的水凝胶打印,研究不同反应体系对成胶条件的要求。通过活细胞染色、western bolt等检测细胞生长和药用分子的表达情况,研究使细胞存活良好的细胞/胶比例,以保证载入细胞在植入体中存活时间长且分泌作用良好。
[0048]
6.外泌体型基因工程细胞的体内药效学研究用sd大鼠,将构建的3d仿生基因工程细胞植入体埋入颈部皮下,不同时间处死动物。
[0049]
(1)不同时间动物血清中药物的释放浓度
①
.外泌体检测通过超速离心提取外泌体,并检测粒径(电镜)、脂质染色(粘红酵母外泌体)指标,以确定植入前后外泌体产生的变化。
[0050]
②
.药物生物分子的血药浓度检测在不同时间抽取大鼠血液以检测血清中的药物浓度,通过动物体内的药物释放曲线,计算出3d仿生基因工程细胞植入体在体内的治疗半衰期、auc、kd及代谢动力学特征等。
[0051]
(2)3d仿生基因工程细胞植入体的组织相容和降解特性对埋入的3d仿生基因工程细胞植入体进行解剖学、组织学染色及免疫组化染色方法,了解其在体内的组织相容性。降解特性主要通过分辨率高、对样品不造成损伤的micro-ct扫描进行无创性观测样品内部结构,以了解植入体观测区域的体积和形态特征。
[0052]
实验结果1.gm4-δts-cct/sec1菌株的构建与鉴定(1)酿酒酵母囊泡运输基因的克隆首先提取了酿酒酵母的总rna,其检测结果如图1(左)所示,rna提取效果良好,能明显看到28s rna和18s rna条带,测定所得rna在a260/a280的比值为1.79,说明提取的总
rna比较完整,质量好。把总rna反转录为cdna,利用引物pf-sec1和pr-sec1进行pcr扩增,结果如图1(右)所示,泳道1的条带与marker相比较,pcr产物与预计产物大小(2175bp)相近;将2175bp左右的条带切下后进行回收,再将回收获得产物与克隆载体相连接,转化至大肠杆菌中,挑取阳性克隆测序;在确定无因pcr而引起突变的情况下,获得了酿酒酵母囊泡运输基因sec1的全序列。
[0053]
(2)重组质粒ppicz-pgk1-cct/sec1的鉴定重组质粒ppicz-pgk1-cct/sec1由生工生物工程(上海)股份有限公司(sangon biotech(shanghai)co.,ltd.)构建。将上述构建的ppicz-pgk1-cct/sec1表达载体通过电转化至粘红酵母gm4
‑△
ts感受态细胞中,经过菌落pcr得到一个2175bp左右的基因,大小和genbank上报道的sec1基因大小相等(图2)。同时对该重组质粒进行双酶切鉴定,如图3所示。
[0054]
(3)重组菌株gm4-δts-cct/sec1的sec1表达分析对构建成功的阳性重组表达菌株gm4-δts-cct/sec1进行诱导表达,表达产物经sds-page分析,电泳检测结果如图4所示,与对照相比均出现了一条目的条带,与预测的蛋白大小一致,分别约为65kda,表明酿酒酵母sec1囊泡运输基因在粘红酵母gm4
‑△
ts感受态细胞中进行独立表达时获得成功。在45kda处均出现条带,表明cct酶也表达了。
[0055]
将纯化后的胰岛素原蛋白样品经sds-page电泳转移至pvdf膜后,分别以sec1(yd-19)抗体作为一抗,磷酸酶(ap)标记的羊抗豚鼠igg作为二抗进行western blot印迹分析。如图4所示,蛋白质免疫印迹的pvdf膜的有明显的条带,这表明重组sec1/munc18蛋白可以与抗体杂交,因此纯化得到的sec1/munc18蛋白具有免疫活性。
[0056]
(4)gm4-δts-cct/sec1菌株在传代过程中质粒的稳定性传代20、40、60、80代菌液测定结果表明:按每12h传代20次计算,在表达菌传代80代后,两个重组质粒的稳定性仍然分别可达到97.7%、95.1%,传代过程中质粒的稳定性好,符合基因工程菌的要求。
[0057]
表1重组质粒菌株在传代时的质粒稳定性2.分泌信号肽的合成与鉴定将人工合成的kex2-ek肽段克隆至pmd18-t载体,以构建质粒pmd18-t-kex2-ek,如上所述进行重组质粒的鉴定,菌落pcr发现,泳道1处有个约40bp左右的片段,而对照组转染空质粒的菌株泳道2处无目的条带(图5左),进一步的,双酶切结果表明kex2-ek肽段被成功克隆至pmd18-t载体中(图5右)。
[0058]
3.原核细胞表达的药物表达载体构建与鉴定表达vmip
‑ⅱ
蛋白的ppiczα-vmip
‑ⅱ
质粒的构建与鉴定重组质粒ppiczα-vmip
‑ⅱ
由生工生物工程(上海)股份有限公司(sangon biotech
(shanghai)co.,ltd.)构建。将上述构建的ppiczα-vmip
‑ⅱ
表达载体通过电转化至大肠杆菌dh5α感受态细胞中,经过菌落pcr得到一个330bp左右的基因,大小与kex2(41bp)+vmip
‑ⅱ
(285bp)基因大小相等(图6左)。同时对该重组质粒进行双酶切鉴定,如图6右所示。
[0059]
4目的蛋白药物在gm4-δts-cct/sec1细胞中的表达情况ppiczα-vmip
‑ⅱ
转入gm4-δts-cct/sec1细胞将vmip
‑ⅱ
蛋白表达质粒ppiczα-vmip
‑ⅱ
电转化转入gm4-δts-cct/sec1细胞,对转入后的细胞进行扩培,发酵上清经sds-page分析,可见含信号肽和不含信号肽的转入质粒均有相对分子质量约8.5kda的特异蛋白条带,与vmip
‑ⅱ
标准蛋白大小一致,而转入ppiczα载体的菌液未见此条带,见图7。经bandscan软件分析,纯化后的目标蛋白纯度达98.1%。
[0060]
5.可载基因工程细胞的3d仿生植入体的构建本研究构建的“3d仿生基因工程细胞植入体”——即具有多孔膜管结构的线性产药植入体(直径3-5mm,长度5-10mm),外层为具有纳米孔隙的膜壁,内载可长效释放药物的活体细胞,通过模拟血管中营养物质向组织扩散的仿生原理,高效长时地产药释药。载入的产药细胞选用粘红酵母,并经同源重组导入sec1基因以高效产生外泌体,同时转入表达质粒以产生重组蛋白或重组肽或重组核酸,在缺氧条件下可以外泌体的方式释放脂质体-药物分子。如图8所示,这种新型的产药植入体,植入人体后持续分泌脂质体包裹的生物分子药物,通过外层纳米孔膜扩散至周围组织缓释入血,以实现重组生物药物的体内长效释药和细胞靶向性递送。该线型3d仿生基因工程细胞植入体除了长时产药缓释入血特点,还有隔离免疫细胞作用,其外泌体也使生物分子逃脱酶解和免疫原性。
[0061]
6.外泌体的检测使用qnano法测外泌体粒径。分布安装纳米孔板,调试仪器至纳米孔板内无任何气泡。取1μl标准颗粒,加专用buffer 1ml以稀释1000倍,用0.22μm滤器过滤后备用;各取5μl外泌体,加pbs 45μl以稀释10倍,0.22μm滤器过滤,即可加样上机测试,每次上样量为30μl,测试粒子数量400个左右,即可点击停止按钮,待仪器自动处理数据并生成粒径分布图9。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1