CCA-CD共组装体在制备大分子毒素解毒药物中的应用的制作方法
cca
‑
cd共组装体在制备大分子毒素解毒药物中的应用
技术领域
1.本发明属于纳米超分子材料技术领域,涉及超分子共组装体,尤其是利用两亲杯芳烃cca和两亲环糊精cd的纳米超分子共组装体通过杂多价作用,与富含碱性氨基酸和疏水氨基酸的大分子毒素实现强键合,可以被用于这类大分子毒素的解毒。
背景技术:
2.中毒是急诊和重症监护室的主要病因之一,对于严重的中毒,目前的治疗方法主要有洗胃、灌肠、透析等,参见:1)megarbane,b.;oberlin,m.;alvarez,j.c.;et al.ann.intensive care 2020,10,157.2)mokhlesi,b.;leiken,j.b.;murray,p.;et al.chest 2003,123,577
‑
592.近年来备受关注的一种治疗方法是注射解毒剂阻断有毒物质的生物活性。这一方法对于毒素的要求较少(例如毒素的分布范围,分子量,与血清中蛋白的亲和力等等),因此具有广阔的应用空间,参见:leroux,j.c.nat.nanotechnol.2007,2,679
‑
684.超分子化学目前已经在生物医药领域取得了令人瞩目的成绩,参见:1)pan,y.
‑
c.;hu,x.
‑
y.;guo,d.
‑
s.angew.chem.int.ed.2020,60,2768
‑
2794.2)ma,x.;zhao,y.chem.rev.2015,115,7794
‑
7839.3)chen,y.;huang,z.;zhao,h.;et al.acsappl.mater.interfaces 2017,9,8602
‑
8608.4)zheng,z.;geng,w.c.;xu,z.;et al.isr.j.chem.2019,59,913
‑
927.5)geng,w.
‑
c.;huang,q.;xu,z.;et al.theranostics 2019,9,3094
‑
3106.超分子解毒策略,即设计合成人工受体,实现对有毒物质的强络合,阻断其与生物体内的靶点作用从而缓解其毒性,拥有众多的优势,例如高识别原子经济性、高批次重现性、高化学稳定性和热稳定性,以及不容易引起免疫反应等,参见:1)deng,c.l.;murkli,s.l.;isaacs,l.d.chem.soc.rev.2020,49,7516
‑
7532.2)yin,h.;zhang,x.;wei,j.;et al.theranostics 2021,11,1513
‑
1526.目前,环糊精作为罗库溴铵的解毒剂,已经正式上市(布瑞亭)。
3.然而,目前超分子解毒的底物局限于小分子。这是因为只有小分子能够被超分子主体有效的包结并阻碍其与生物靶点的作用。除了小分子毒素之外,还有很多生物大分子也有很强的毒性,例如鹅膏毒素和蜂毒肽等,参见:1)diaz,j.h.wild.environ.med.2018,29,111
‑
118.2)habermann,e.science 1972,177,314
‑
322.但是设计超分子主体,实现对这些生物大分子的选择性强键合是一个巨大的挑战,这是因为这些大分子具有较大的尺寸,灵活的构象和复杂多样的位点,参见:1)hossain,m.a.;schneider,h.
‑
j.j.am.chem.soc.1998,120,11208
‑
11209.2)wright,a.t.;anslyn,e.v.;mcdevitt,j.t.j.am.chem.soc.2005,127,17405
‑
17411.
技术实现要素:
4.本发明的目的是解决对大分子毒素的特异性强键合,从而有效缓解它们的毒性的问题。主要利用两亲杯芳烃cca和两亲环糊精cd构筑了多价识别共组装体cca
‑
cd,cca
‑
cd能够选择性强络合蜂毒肽(melittin)、蜘蛛毒肽(latarcin 1)和蛇毒肽(crotalicidin),并
成功缓解了这些大分子毒素的细胞毒性。以蜂毒肽为例,进一步验证了cca
‑
cd能够抑制蜂毒肽与细胞膜的作用,缓解蜂毒肽的溶血毒性,并提高蜂毒肽中毒小鼠的存活率。
5.本发明利用两亲羧基杯芳烃cca和两亲β环糊精cd作为构筑单元,在水溶液中共存的条件下通过一定的方式使其能够形成共组装囊泡cca
‑
cd。囊泡表面富集了杯芳烃和环糊精的空腔。杯芳烃对碱性氨基酸,如精氨酸和赖氨酸,有强键合,环糊精对疏水氨基酸,如酪氨酸、色氨酸和苯丙氨酸,有强键合。蜂毒肽等能够破坏细胞膜的毒性大分子通常富含这些氨基酸,与共组装体有杂多价作用,因而共组装体对它们实现了极强的键合,从而抑制了它们与细胞膜的作用,拥有了治疗这些大分子毒素中毒的潜力。
6.实现本发明的技术方案为:
7.利用羧基修饰的两亲杯芳烃cca和两亲环糊精cd的纳米超分子共组装体cca
‑
cd,络合蜂毒肽缓解其细胞毒性和溶血毒性,可以用于制备蜂毒肽解毒药物。
8.cca
‑
cd构筑单元cca化学式为c
100
h
150
o
15
,cd化学式为c
182
h
350
o
56
s7,两者物质的量摩尔比为1:1,超分子组装体的构筑是通过弱的π
‑
π相互作用,疏水相互作用,其尺度为纳米级,形貌为球形的囊泡。cca和cd结构式如下:
[0009][0010]
制备步骤如下:
[0011]
(1)将cca和cd按计量比分别溶解于氯仿中,分别配制成1
‑
5毫摩尔每升的cca和cd氯仿溶液(母液)。
[0012]
(2)取500微升cca氯仿溶液和500微升cd氯仿溶液充分混合后,置于真空干燥器内真空干燥。4
‑
5小时后,有机溶剂完全蒸发,在容器壁上得到一层均匀的cca和cd混合物膜。
[0013]
(3)在容器中加入5毫升缓冲水溶液,置于75
‑
80℃超声仪中超声2
‑
4个小时,可见溶液变澄清,用激光笔照射有明显的丁达尔效应,此时已经形成了cca
‑
cd超分子共组装体。
[0014]
本发明同时保护一种两亲杯芳烃gca和两亲环糊精cd纳米超分子共组装体在制备蜘蛛毒肽解毒药物中的应用。
[0015]
本发明同时保护一种两亲杯芳烃gca和两亲环糊精cd纳米超分子共组装体在制备蛇毒肽解毒药物中的应用。
[0016]
本发明cca
‑
cd的解毒原理:
[0017]
多个杯芳烃和环糊精富集在cca
‑
cd共组装体的表面,为复杂的生物大分子,如多肽和蛋白,的识别提供了多价作用。此外,cca和cd能够识别不同的氨基酸,使得cca
‑
cd能够进一步通过杂多价作用识别生物大分子,捕获生物大分子上更多的位点,从而获得更强的作用力;
[0018]
蜂毒肽、蜘蛛毒肽和蛇毒肽富含正电荷的和疏水的氨基酸,而cca能够有效包结正
电荷的氨基酸,cd能够有效包结疏水的氨基酸,共组装体cca
‑
cd对蜂毒肽的杂多价识别使得两者之间有极强的相互作用。cca
‑
cd对蜂毒肽、蜘蛛毒肽和蛇毒肽的强络合使得蜂毒肽、蜘蛛毒肽和蛇毒肽不能和细胞膜作用,从而保护了细胞膜不被破坏,缓解了蜂毒肽、蜘蛛毒肽和蛇毒肽的细胞毒性和溶血毒性。此外,cca
‑
cd具有良好的生物相容性,这使得cca
‑
cd具有被临床应用的可能。
[0019]
本发明的优点和有益效果是:
[0020]
共组装体cca
‑
cd能够有效络合蜂毒肽、蜘蛛毒肽和蛇毒肽,缓解它们的细胞毒性,具有治疗这些毒性大分子中毒的潜力。cca
‑
cd各组成成分化学结构明确、批次重现性好,cca
‑
cd具有很高的化学稳定性和热稳定性,且不影响生物体内重要蛋白的活性,具有良好的生物相容性。
附图说明
[0021]
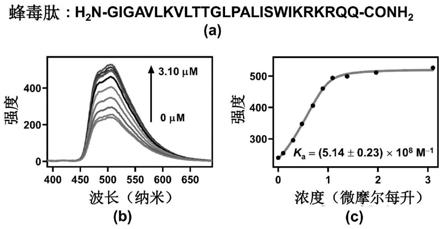
图1为蜂毒肽氨基酸序列和荧光滴定测定共组装体cca
‑
cd对蜂毒肽的络合作用。其中(a)为蜂毒肽氨基酸序列,(b)为荧光滴定图,(c)为荧光滴定数据拟合曲线及结果。
[0022]
图2为蜘蛛毒肽氨基酸序列和荧光滴定测定共组装体cca
‑
cd对蜘蛛毒肽的络合作用。其中(a)为蜘蛛毒肽氨基酸序列,(b)为荧光滴定图,(c)为荧光滴定数据拟合曲线及结果。
[0023]
图3为蛇毒肽氨基酸序列和荧光滴定测定共组装体cca
‑
cd对蛇毒肽的络合作用。其中(a)为蛇毒肽氨基酸序列,(b)为荧光滴定图,(c)为荧光滴定数据拟合曲线及结果。
[0024]
图4为cck
‑
8实验测定共组装体cca
‑
cd对蜂毒肽、蜘蛛毒肽和蛇毒肽细胞毒性的缓解作用,及cca
‑
cd自身的细胞毒性。其中(a)为cca
‑
cd对蜂毒肽细胞毒性的缓解效果,(b)为cca
‑
cd对蜘蛛毒肽细胞毒性的缓解效果,(c)为cca
‑
cd对蛇毒肽细胞毒性的缓解效果,(d)为cca
‑
cd自身的细胞毒性。显著性差异分析结果表示为:*p<0.05,**p<0.01,***p<0.001。
[0025]
图5为乳酸脱氢酶泄露实验验证共组装体cca
‑
cd对蜂毒肽与细胞膜的作用的抑制效果。显著性差异分析结果表示为:***p<0.001。
[0026]
图6为溶血实验验证共组装体cca
‑
cd对蜂毒肽溶血毒性的缓解作用。显著性差异分析结果表示为:***p<0.001。
[0027]
图7为蜂毒肽中毒小鼠在不同时间注射cca
‑
cd作为解毒剂24小时内的存活率。其中(a)为注射蜂毒肽后立即注射cca
‑
cd解毒情况下小鼠的存活率,(b)为注射蜂毒肽后间隔10分钟、20分钟或40分钟再注射cca
‑
cd解毒情况下小鼠的存活率。显著性差异分析结果表示为:**p<0.01。
[0028]
图8为蜂毒肽中毒小鼠注射cca
‑
cd解毒或不解毒的血常规结果。其中(a)为白细胞数目,(b)为淋巴细胞数目,(c)为中性粒细胞数目,(d)为红细胞数目,(e)为血红蛋白含量,(f)为红细胞积压。显著性差异分析结果表示为:**p<0.01,***p<0.001。
[0029]
图9为蜂毒肽中毒小鼠注射cca
‑
cd解毒或不解毒的血生化结果。其中(a)为天门冬氨酸氨基转移酶含量,(b)为丙氨酸氨基酸转移酶含量,(c)为碱性磷酸酶含量,(d)为总蛋白含量,(e)为肌酐含量,(f)为α
‑
羟丁酸脱氢酶含量,(g)为乳酸脱氢酶含量,(h)为肌酸激酶mb型同工酶含量。显著性差异分析结果表示为:*p<0.05,**p<0.01,***p<0.001。
[0030]
图10位蜂毒肽中毒小鼠注射cca
‑
cd解毒或不解毒的组织病理切片结果。
具体实施方式
[0031]
下面通过具体实施例对本发明作进一步详述,以下实施例只是描述性的,不是限定性的,不能以此限定本发明的保护范围。
[0032]
一种能够实现杂多价识别的共组装体cca
‑
cd,具有治疗蜂毒肽等大分子毒素中毒的潜力。以羧基修饰的两亲杯芳烃cca和两亲环糊精cd为杂多价识别平台的构筑单元,
[0033]
其中,cca化学式为c
100
h
150
o
15
,cd化学式为c
182
h
350
o
56
s7,两者物质的量摩尔比为1:1,超分子组装体的构筑是通过弱的π
‑
π相互作用,疏水相互作用,其尺度为纳米级,形貌为球形的囊泡。cca和cd结构式如下:
[0034][0035]
制备步骤如下:
[0036]
(1)将cca和cd按计量比分别溶解于氯仿中,分别配制成1
‑
5毫摩尔每升的cca和cd氯仿溶液(母液)。
[0037]
(2)取500微升cca氯仿溶液和500微升cd氯仿溶液充分混合后,置于真空干燥器内真空干燥。4
‑
5小时后,有机溶剂完全蒸发,在容器壁上得到一层均匀的cca和cd混合物膜。
[0038]
(3)在容器中加入5毫升缓冲水溶液,置于75
‑
80℃超声仪中超声2
‑
4个小时,可见溶液变澄清,用激光笔照射有明显的丁达尔效应,此时已经形成了cca
‑
cd超分子共组装体。
[0039]
cca
‑
cd能够实现对来自蜜蜂、蜘蛛和蛇的三种有毒多肽的强键合,具有缓解这三种有毒多肽的细胞毒性的作用。
[0040]
cca
‑
cd与有毒多肽的键合常数测定:选择光泽精为荧光探针,光泽精可以被cca包结,同时淬灭其荧光,当多肽与cca络合后,光泽精被替换出cca空腔,荧光恢复。通过光泽精的荧光变化,我们能够定量的知道键合在cca
‑
cd表面的多肽的量。此外,当多肽上的疏水氨基酸与cd键合后,会拉近带正电的氨基酸与cca的距离,促进这些氨基酸替换cca空腔中的光泽精,因此疏水氨基酸与cd的相互作用同样可以被光泽精的荧光变化所表示。石英池子中加入光泽精和cca
‑
cd的混合溶液。配制含有和石英池子里相同浓度的光泽精和cca
‑
cd,以及高浓度多肽的混合溶液。将该溶液滴加到石英池子中,记录滴加之前和每一次滴加之后的荧光变化(激发波长为368纳米)。利用竞争拟合公式对507纳米处的荧光变化进行拟合,参见:1)d.
‑
s.guo,v.d.uzunova,x.su,y.liu,w.m.nau,chem.sci.2011,2,1722
‑
1734.2)g.ghale,a.g.lanctot,h.t.kreissl,m.h.jacob,h.weingart,m.winterhalter,w.m.nau,angew.chem.int.ed.2014,53,2762
‑
2765.利用同样的方法,测定了gca
‑
cd对一些干扰蛋白,如血清白蛋白,的络合情况。cca
‑
cd共组装体对三种多肽具有极强的键合(图1
‑
3),其键合常数超过其他测定的蛋白至少2个数量级。
[0041]
cca
‑
cd对三种多肽的细胞毒性的缓解作用:将293ft细胞(人肾上皮细胞系)置于
96孔板中培养。贴壁后,将多肽(蜂毒肽为5微摩尔每升,另外两种多肽为40微摩尔每升)或多肽(蜂毒肽为5微摩尔每升,另外两种多肽为40微摩尔每升)与不同浓度的cca
‑
cd的混合溶液加入细胞培养基中。在37℃培养24小时后弃掉孔中的培养基,加入cck
‑
8(细胞增殖检测试剂盒)溶液,在37℃继续培养2小时。用酶标仪测定450纳米处的吸光度,根据吸光度计算每个孔中细胞的存活率。用没有用多肽孵化过的细胞作为控制组,细胞存活率记为100%。cca
‑
cd的存在显著缓解了这三种有毒多肽的细胞毒性,而cca
‑
cd本身几乎没有毒性(图4)。
[0042]
以蜂毒肽为例,进一步研究了cca
‑
cd抑制蜂毒肽与细胞膜的作用、缓解其溶血毒性,治疗蜂毒肽中毒小鼠的效果。
[0043]
cca
‑
cd对蜂毒肽破坏细胞膜的抑制作用:当蜂毒肽与细胞膜作用时,会破坏细胞膜,导致细胞内物质的外流。我们通过检测细胞内的乳酸脱氢酶的泄露,来测定蜂毒肽对细胞膜的破坏。将293ft细胞置于96孔板中培养,贴壁后,将多肽(5微摩尔每升)或多肽(5微摩尔每升)与不同浓度的cca
‑
cd的混合溶液加入细胞培养基中。在37℃培养24小时后,按照乳酸脱氢酶检测试剂盒说明书依次加入试剂盒内提供的各种试剂。用酶标仪测定440纳米处的吸光度,计算乳酸脱氢酶的泄露量。cca
‑
cd的存在显著缓解了蜂毒肽处理过的细胞乳酸脱氢酶的泄露,说明cca
‑
cd有效抑制了蜂毒肽对细胞膜的破坏,而cca
‑
cd自身并不会导致乳酸脱氢酶的泄露(图5)。
[0044]
cca
‑
cd对蜂毒肽溶血毒性的缓解作用:将健康balb/c小鼠的血液置于抗凝管中,并用生理盐水稀释。1500rpm离心10分钟,收集离心管下层的红细胞,并用生理盐水清洗四次。随后,将红细胞用生理盐水稀释50倍备用。将29.4微升蜂毒肽或蜂毒肽与cca
‑
cd的混合溶液加入700微升上述红细胞中,在37℃孵化1.5小时。2000rpm离心10分钟。将上层清液转移到石英皿中,用紫外分光光度计测定545纳米处的吸光度,计算红细胞的溶血程度。cca
‑
cd的存在显著缓解了蜂毒肽的溶血毒性,而cca
‑
cd本身不会引起红细胞溶血(图6)。
[0045]
cca
‑
cd对蜂毒肽中毒小鼠的治疗效果:将60只5
‑
6周的雌性balb/c小鼠分成5组,每组12只。第一组的小鼠尾静脉注射50微升蜂毒肽(600微摩尔每升,4.30毫克每千克)。第二组小鼠尾静脉注射50微升蜂毒肽(600微摩尔每升,4.30毫克每千克)后立即注射150微升cca
‑
cd(200微摩尔每升,7.25毫克每千克)。第三至五组小鼠尾静脉注射50微升蜂毒肽(600微摩尔每升,4.30毫克每千克),分别间隔10分钟、20分钟和40分钟后注射150微升cca
‑
cd(200微摩尔每升,7.25毫克每千克)。注射完成后将小鼠放回笼中,检测24小时。24小时后,处死第一组和第二组的所有活着的小鼠,收集它们的血液进行血常规和血生化检测,收集它们的主要器官(心、肝、脾、肺、肾)进行组织病理分析。第一组小鼠的死亡率超过50%,而其余四组小鼠的死亡率均低于30%(图7),说明cca
‑
cd对蜂毒肽有很好的活体解毒效果。血常规结果显示第一组小鼠白细胞数目,淋巴细胞数目,中性粒细胞数目,红细胞数目,血红蛋白和红细胞积压均显著上升,而第二组小鼠这些指标明显下降(图8),说明cca
‑
cd成功缓解了蜂毒肽引发的炎症。血生化结果显示注射cca
‑
cd显著缓解了中毒小鼠血液中天门冬氨酸氨基转移酶,丙氨酸氨基转移酶,碱性磷酸酶,总蛋白,肌酐,α
‑
羟丁酸脱氢酶,乳酸脱氢酶和肌酸激酶mb型同工酶的异常含量(图9),说明cca
‑
cd缓解了蜂毒肽引发的肝、肾和心脏的损伤。组织病理分析的结果也支持这一结论(图10)。
[0046]
以上所述的仅是本发明的优选实施方式,应当指出,对于本领域的普通技术人员
来说,在不脱离发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1