一种滴眼给药防治干性黄斑病变和视网膜光损伤的眼用制剂的制作方法
1.本发明属于眼用药物领域,具体涉及一种滴眼给药防治干性黄斑病变和预防视网膜光损伤的眼用制剂。
背景技术:
2.眼底疾病患者众多,仅中国患者数量已逾数千万,随着社会日益老龄化,电子产品的普及,发病率将会逐年上升;常见的眼底疾病有糖尿病性黄斑水肿、糖尿病性视网膜病变、年龄相关性黄斑病变、视网膜静脉阻塞、病理性近视、地图样萎缩、眼部肿瘤、非感染性眼内炎等,可能导致视力下降甚至失明,严重影响人们生活质量。
3.年龄相关性黄斑病变(amd)分为干性和湿性,干性amd以地图样萎缩为特征,湿性amd以脉络膜新生血管(cnv)为主要特征。在对amd的治疗探索中,chen等人分析了68205位糖尿病人13年的病例(中国台湾,2001~2013 年),发现口服二甲双胍(metformin,cas号:657
‑
24
‑
9)的2型糖尿病人发生amd的风险显著低于不服用二甲双胍的病人;服用二甲双胍剂量越高,降低amd风险越明显(yu
‑
yen chen et al.,association between metformin anda lower risk of age
‑
related macular degeneration in patients with type 2 diabetes,journal of ophthalmology,volume 2019,article id 1649156,9pages)。 brown等人跟踪分析了7788位糖尿病人7年的病例(美国佛罗里达州)发现口服二甲双胍可能对amd的发生或发展有治疗作用;还发现与不服用二甲双胍的病人比较,大剂量服用组(2年>1110g二甲双胍)可最大程度(25%)降低开角型青光眼的发生(emily e.brown et al.,the common antidiabetic drugmetformin reduces odds of developing age
‑
related macular degeneration, iovs,april 2019,vol.60(5):1470
‑
77)。多西环素(又称强力霉素,doxycycline, cas号:564
‑
25
‑
0)作为广谱抗菌药物已在临床使用多年,通常口服剂量为 100mg/天。近年来多项研究表明低剂量强力霉素(20
‑
40mg/天)对慢性炎症如酒糟鼻(rosacea)等有明显作用(r.d.caprio et al.,anti
‑
inflammatory propertiesof low and high doxycycline doses:an in vitro study,mediators ofinflammation,vol.2015,article id 329418,10pages)。一项随机,双盲,安慰剂对照的三期临床试验(toga;nct01782989)表明,商品名为 (40mg doxycycline)的多西环素胶囊,每天一次,服用24个月,对眼底地图样萎缩的干性年龄相关性黄斑病变的改善也有明显作用。
4.视网膜光化学损伤可致感光细胞凋亡和视网膜变性,严重者导致视力丧失。xu等人研究了注射二甲双胍是否对动物眼有保护作用,在做光照破坏试验之前给小鼠玻璃体腔注射二甲双胍(最高500mg/kg/天,持续7天)几乎可以完全保护光损伤,明显地保护了视网膜结构和感光细胞。研究结果表明二甲双胍在眼局部激活视网膜上的ampk(adenosine mono
‑
phosphate
ꢀ‑
activated protein kinase,腺苷酸活化蛋白激酶)对保护感光细胞和视网膜色素上皮细胞病变很重要(xu et al.,stimulation of ampk prevents degeneration ofphotoreceptors and the retinal pigment epithelium,pnas,2018,
115(41): 10475
–
10480)。
5.上述研究结果证明了二甲双胍、硫辛酸(lipoic acid,cas号:62
‑
46
‑
4)、白藜芦醇(resveratrol,cas号:501
‑
36
‑
0)、多西环素等药物对amd的治疗、预防视网膜光损伤的有效性,但均涉及口服给药或玻璃体注射等给药方式。
6.目前的临床眼科给药通常有3种途径:
⑴
结膜囊给药(滴眼):药物通过角膜进入前房水后可以扩散分布到虹膜、睫状体,但晶状体和玻璃体膜的屏障作用,使药物难以进入晶状体和玻璃体;
⑵
眼部注射给药:包括结膜下注射、眼前房注射、玻璃体注射、眼球后注射和眼眶注射,注射给药可以使药物直接抵达治疗部位,但注射是创伤性的,存在潜在危险,如前房注射产生疼痛,畏光,流泪,前房浑浊,出血,角膜内皮细胞损害,外伤性白内障等;玻璃体注射会出现晶状体浑浊,玻璃体机化,视网膜/视神经损害等;
⑶
全身给药包括口服给药,静脉给药:药物在体内一般大多聚集在肝脏,肾脏或肺脏,受到血
‑
视网膜屏障(blood retinal barrier,brb)的阻碍,抵达眼球组织的浓度较低,同时全身尤其是主要脏器承受了不必要的毒副作用。尤其是口服多西环素可能引起全身副作用,包括皮肤并发症(包括光敏反应和皮肤损伤)、胃肠道副作用(呕吐、腹泻、消化不良)、影响骨和牙齿生长等不良反应。
7.目前临床上为了使药物穿过眼屏障,通常采用的是眼球玻璃体注射、或玻璃体植入(眼内插入)等技术手段,把药物输送到患者玻璃体,治疗眼后段疾病(凌沛学主编《眼科药物与制剂学》,中国轻工业出版社,2010,p3; wang et.al.,mediators of inflammation,vol.2013,article id 780634; luaces
‑
rodr
í
guez et al.,pharmaceutics,2018,10,66)。但药物玻璃体注射或玻璃体植入操作是创伤性给药,需要经过专门培训的眼科医师在手术室等无菌环境下操作;因为操作有创伤性可能会出现并发症,如高眼压、白内障、医源性感染性眼内炎、玻璃体出血、视网膜损伤等;操作条件及操作环境要求高,必须在有条件的医院进行;生物药眼用注射剂生产成本和使用成本高;同时亦存在治疗时机上因为医疗条件限制而延误治疗的情况发生,调整给药方案灵活性差(m.hata et al.,retina,37:1320
–
1328,2017)。
8.可见,相比于现有技术中采用玻璃体注射、植入、口服等手段用药治疗干性黄斑病变和预防视网膜光损伤的方式,结膜囊给药是最方便、最安全的眼部给药方式,将对amd的治疗、预防视网膜光损伤有效的药物如二甲双胍、硫辛酸(lipoic acid,cas号:62
‑
46
‑
4)、白藜芦醇(resveratrol,cas 号:501
‑
36
‑
0)、多西环素等开发成低浓度的特殊滴眼液应用于眼局部,并将其直接输送到眼底,可避免对患者造成创伤,能够大幅降低用药剂量,减少对人体产生的毒副作用,对治疗amd以及视网膜的保护具有特别重要的意义。
9.但是,眼角膜有多层结构,从外至内大致分为:富含脂质体的上皮层、富含水性成分的基质层和富含脂质体的内皮层,滴眼液在滴眼后首先接触眼表泪水层,继而需要跨过上皮层、基质层和内皮层才可能到达眼后段。在此过程中,由于泪液的稀释、角膜、结膜的眼表屏障和晶状体、玻璃体的屏障,滴眼液往往在眼前段的组织中浓度高,很难进入眼后段并达到有效的治疗浓度。因此,结膜囊给药的方式虽然安全,但是药物输送性差,难以达到有效治疗眼底疾病的目的。
10.综上,现有治疗干性黄斑病变等眼底疾病主要给药方法均难以兼顾安全和有效。寻找一种有效且安全的治疗眼底疾病的制剂或方法是本领域研究人员一直孜孜以求的奋
斗目标。
技术实现要素:
11.滴眼给药的方式相比于静脉注射、玻璃体注射具有安全、方便的显著优势,发明能将药物输送到眼后段治疗干性黄斑病变的眼科制剂是临床实践中亟待解决的技术问题,非常具有临床治疗价值和社会意义。
12.本发明的目的在于提供一种滴眼给药的眼用制剂,能够将治疗眼病的活性成分递送到眼后段,防治干性黄斑病变和视网膜光损伤。
13.本发明提供了一种滴眼给药的眼用制剂,它是由治疗眼病的活性成分和眼用制剂载体或辅料组成的制剂;
14.所述治疗眼病的活性成分为腺苷酸活化蛋白激酶激活剂和/或抗炎症类药物;
15.所述眼用制剂载体或辅料含有如下成分:表面活性剂、离子型高分子和溶剂。
16.进一步地,上述的眼用制剂的载体或辅料中表面活性剂、离子型高分子的质量比为:(1~100):(0.1~50);所述表面活性剂与溶剂的比例为:每100ml 溶剂含5~3000mg表面活性剂;
17.优选的,所述眼用制剂的载体或辅料中表面活性剂、离子型高分子的质量比为:(1~30):(3.5~6);所述表面活性剂与溶剂的比例为:每100ml溶剂含 50~2500mg表面活性剂;
18.更进一步地,上述表面活性剂为非离子表面活性剂;
19.优选的,所述非离子表面活性剂为司盘类、聚山梨酯、泊洛沙姆、烷基葡萄糖苷、维生素e聚琥珀酸乙二醇酯、蔗糖硬脂酸酯或氮酮;
20.更优选的,所述非离子表面活性剂为司盘类、聚山梨酯、泊洛沙姆、烷基葡萄糖苷、蔗糖硬脂酸酯。
21.进一步地,上述离子型高分子选自羧甲基纤维素及其盐、羟基乙酸淀粉钠、透明质酸及其盐、黄原胶、海藻酸及其盐、二乙酸聚乙二醇peg
‑
(cooh)2中的至少一种。
22.进一步地,上述眼用制剂的载体或辅料中的溶剂为极性溶剂,优选为水。
23.进一步地,上述眼用制剂的载体或辅料中还含有如下成分:增粘剂和/ 或助溶剂。
24.更进一步地,上述增粘剂为聚乙二醇、卡波姆、泊洛沙姆、聚维酮、羟丙基纤维素、甲基纤维素、羟乙基纤维素、聚乙烯醇、黄原胶、聚氧乙烯脂肪醇类、透明质酸及其盐或羟丙基甲基纤维素中的至少一种,所述助溶剂为丙二醇、丙三醇、液态聚乙二醇或蓖麻油;增粘剂和表面活性剂的质量比为 1:(0.1~100),助溶剂和表面活性剂的质量比为(1~10):1;
25.优选的,所述增粘剂和表面活性剂的质量比为1:(0.1~6.25),助溶剂和表面活性剂的质量比为(4.2~10):1;
26.进一步地,上述表面活性剂和治疗眼病的活性成分的质量比为 (1~30):(1~2)。
27.进一步地,上述腺苷酸活化蛋白激酶激活剂为硫辛酸、硫辛酸立体异构体、硫辛酸盐、硫辛酸立体异构体的盐、二甲双胍、二甲双胍的盐、白藜芦醇、白藜芦醇的盐中的至少一种;所述抗炎症类药物为多西环素、多西环素的盐、四环素、四环素的盐中的至少一种。
28.更进一步地,上述二甲双胍的盐为盐酸二甲双胍,所述多西环素的盐为多西环素盐酸盐,所述四环素的盐为四环素盐酸盐。
29.进一步地,上述眼用制剂的载体或辅料含有纳米小体,所述纳米小体由眼用制剂的载体或辅料的成分自组装形成;所述纳米小体中包裹有治疗眼病的活性成分。
30.更进一步地,上述纳米小体为球形,其粒径为1~100nm;优选地,所述纳米小体粒径为5~30nm。
31.更进一步地,上述制剂中还含有纳米小球,所述纳米小球为球形,其粒径为10~2000nm;所述纳米小球是纳米小体自组装形成的;优选地,所述纳米小球粒径为100~2000nm。
32.本发明还提供了一种制备上述制剂的方法,包括以下步骤:
33.(1)将表面活性剂和/或增粘剂加入溶剂中配制成溶液;
34.(2)将治疗眼病的活性成分和/或助溶剂分散在步骤(1)得到的溶液中,再加入离子型高分子或其溶液,分散混合得到初悬液;
35.(3)将步骤(2)得到的初悬液搅拌分散或均质分散,即得;
36.优选地,步骤(2)所述治疗眼病的活性成分用有机溶剂溶解后分散在步骤(1)得到的溶液中。
37.进一步地,步骤(2)中所述分散选自机械搅拌分散、磁力搅拌分散、涡旋振摇分散、剪切分散、均质分散、研磨分散、超声分散中的至少一种。
38.本发明还提供了上述的制剂在制备防治眼底疾病的药物中的用途。
39.进一步地,上述防治眼底疾病的药物是防治干性黄斑病变的药物;
40.或,所述防治眼底疾病的药物是防治光照对眼感光细胞或视网膜损伤的药物。
41.现有技术已证明盐酸二甲双胍对视网膜结构和眼感光细胞有保护作用,但却需要通过注射的方式给药,难以通过滴眼给药的方式在眼后段达到有效治疗剂量。本发明制备的滴眼给药的眼用制剂,性状稳定,易于储存,实验证明其能够有效将二甲双胍等治疗眼病的活性成分递送到眼后段,在眼底达到有效(预期)浓度,因而可以通过滴眼给药的方式实现对眼底疾病如干性黄斑病变、光照对眼感光细胞或视网膜损伤的治疗和预防。本发明克服了现有玻璃体注射、玻璃体注射植入剂,口服给药和全身注射给药存在的问题,解决眼内出血、疼痛等严重的并发症问题,极大降低眼底疾病患者的痛苦,增加医从性、改善患者及其家庭的生活质量,或避免全身给药带来的全身毒副作用。
42.本发明可以避免眼局部注射或植入带来的并发症。
43.本发明开发的制剂给药量小,毒副作用小,不仅可以作为治疗药物,还可以作为眼科疾病防控。
44.本发明的制剂可以满足临床上长期给药的需求。
45.本发明的滴眼给药治疗系统,有效成分可以采用已在临床使用且作用机理明确的小分子药物,质量可控,产品使用方便,病人顺应性好,医师可根据患者病情灵活调整给药方案。
46.本发明所指的纳米小体是:眼用制剂的载体或辅料的成分在溶剂中自组装形成的纳米级的球形聚集体。
47.本发明所指的纳米小球是:纳米小体在溶剂中自组装形成的球形自组装结构。
48.本发明所指的溶剂是:能溶解眼用制剂的载体或辅料的成分的液体。
49.本发明所指表面活性剂是:能够显著降低液体表面张力的物质;本发明所指非离
子型表面活性剂是指在水中不解离的表面活性剂。
50.本发明所指离子型高分子是:带有阳离子或阴离子的高分子聚合物。
51.本发明所指的“治疗眼病的活性成分”是:可以用于治疗眼病的活性物质,即目前已经作为眼科用药使用的活性物质,以及作用机理、作用靶点表明其能够治疗眼病,但目前暂没有作为眼科用药使用的活性物质(activepharmaceutical ingredient,api)。
52.本发明所述滴眼给药是:将药液滴入眼内的一种给药方法,属于角膜给药途径。
53.显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
54.以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
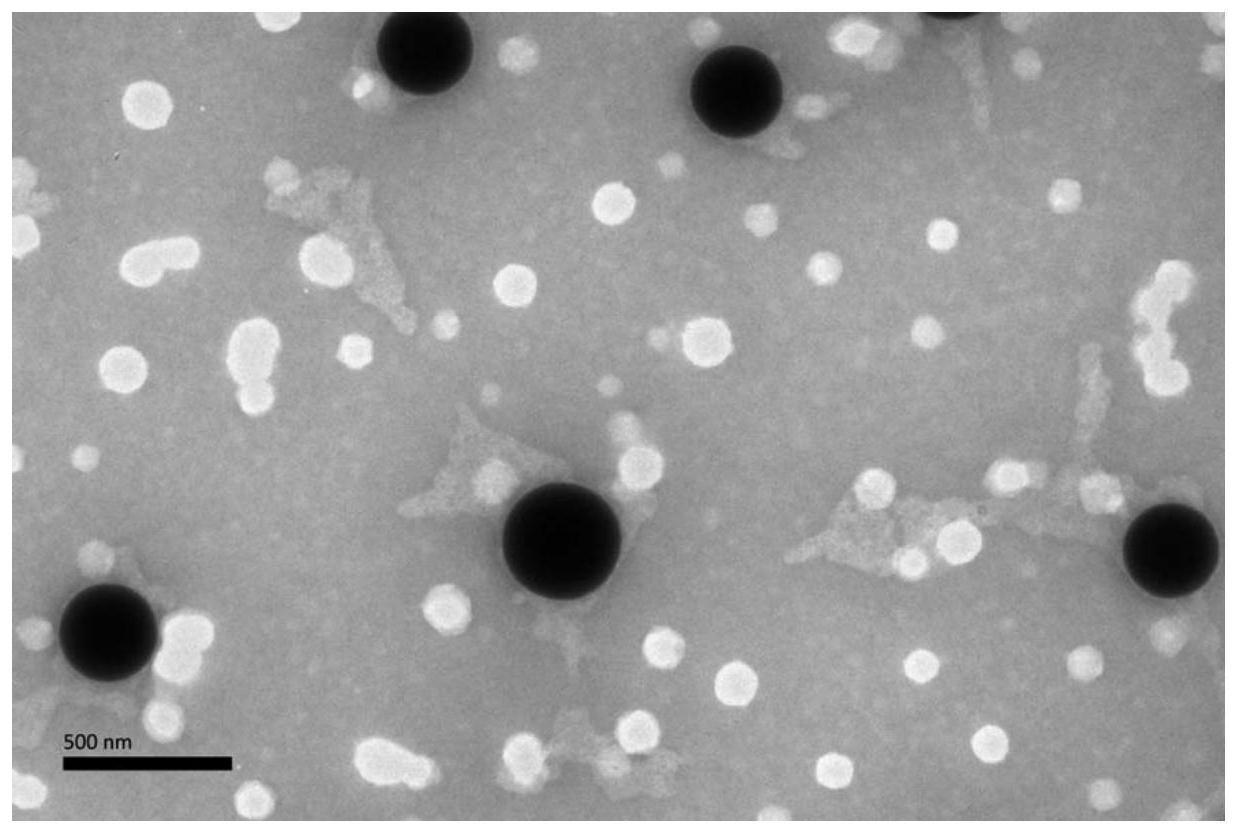
55.图1为实施例2制得的样品的透射电镜图(标尺为500nm)。
56.图2为实施例9制得的样品染色后的透射电镜图(标尺为100nm)。
57.图3为实施例2的hplc谱图。
58.图4为实施例5的hplc谱图。
59.图5为实施例14的hplc谱图。
60.图6为对照组、干性黄斑病变模型组、本发明制剂治疗的治疗组大鼠的眼球组织切片he染色结果。
具体实施方式
61.本发明所用试剂或仪器可以通过市售购买获得,未注明具体条件的,按照常规条件或制造商建议的条件使用。
62.部分仪器设备如下:
63.es225sm
‑
dr(e)电子分析天平,precisa公司(瑞士);
64.df
‑
101s集热式恒温加热磁力搅拌器,巩义市英峪高科仪器厂(河南,中国);
65.wh
‑
2微型涡旋混合仪,上海沪西分析仪器厂有限公司(上海,中国);
66.分散机:t25 easy clean digital,ika公司(德国);
67.kq
‑
500型超声清洗仪,昆山市超声波仪器有限公司(昆山,中国);
68.jp
‑
010t型超声清洗仪,深圳市洁盟清洗设备有限公司;
69.ah
‑
nano plus高压均质机,安拓思纳米技术(苏州)有限公司(中国);
70.pm
‑
dk2行星式球磨机,卓的仪器设备(上海)有限公司(上海,中国);
71.mettler toledo fe20 ph meter,梅特勒
‑
托利多公司(瑞士);
72.ns
‑
90纳米粒度分析仪,珠海欧美克仪器有限公司(珠海,中国);
73.安捷伦1100hplc高效液相色谱仪,安捷伦科技有限公司(美国);
74.api 4000三重四极杆质谱仪(美国applied biosystems公司);
75.sty
‑
1a渗透压测定仪,天津市天大天发科技有限公司(天津,中国)。
76.本发明制剂的性质检测方法如下
77.粒径检测方法:
78.将1ml实施例或对比例制备得到的样品转移至样品池中,检测温度设置为40℃,将样品池放入ns
‑
90纳米粒度分析仪,开始检测。每个样品重复检测3次,取3次检测结果的平均值为该样品检测结果为粒度(以光强分布,及占比%)和多分散指数(pdi,polydispersity index)表示。
79.渗透压检测方法:
80.测量溶液的冰点下降来测定其渗透压摩尔浓度。操作:清洗sty
‑
1a渗透压测定仪探头:取三份100μl蒸馏水至3只样品管中,待仪器预热后,将装有100μl蒸馏水的样品管旋上仪器探头,选择清洗3次,点击“清洗”,重复三次。检测:在仪器信息表中填入样品信息后,点击“测试”;用移液枪移取100μl样品至样品管中,轻轻旋上仪器,点击“启动”检测。重复检测三次,取3次检测结果的平均值为检测结果。
81.ph值检测方法:
82.fe20型酸度计分别用ph缓冲溶液(ph分别为4.00、6.86和9.18)校准,电极用纯净水冲洗后,用无纤维纸吸去多余水份,浸入待检测液体样品中按读数键开始测量,在读数稳定后所得数据,即为样品ph值。
83.检测得到的溶液若ph<5,或>9,则需要用酸或碱调节至ph6~8,常用的ph调节剂为naoh和hcl,磷酸和磷酸盐(如磷酸二氢钠、磷酸氢二钠),柠檬酸和柠檬酸盐(如柠檬酸钠),硼酸和硼砂;检测所得液体的渗透压如未达到等渗,则添加适量氯化钠,使其达到或接近等渗。
84.递送药物到达眼后段的效果验证方法:
85.试验仪器设备:高效液相色谱仪,型号:lc
‑
20ad(日本岛津);质谱仪:型号:api4000三重四极杆质谱仪(美国applied biosystems公司);色谱柱:fortis pace c18 5μm,2.1x30mm(英国fortis公司)。
86.选用健康成年sprague dawley(sd)大鼠,分为受试剂组和对照组,每组6只眼,受试剂组滴加本发明实施例制备的眼用制剂,对照组滴加2mg药物/5ml生理盐水的混悬液(使用前涡旋振摇均匀),每只眼睛20μl。给药后于0.5小时或1小时后安乐死处理动物,迅速采集玻璃体,玻璃体样品匀浆处理后,于
‑
80℃保存。取10μl玻璃体匀浆,加入90μl 95%乙醇,超声2 分钟,涡旋混合1分钟,得玻璃体匀浆液;取50μl匀浆液,加入175μl甲醇,涡旋混合3min,4℃12000rpm离心10min,取上清液用0.45μm的针头式过滤器过滤,滤液用于lc/ms/ms(正离子模式,mrm scan)分析。
87.实施例1、本发明眼用制剂的制备
88.制备方法:按照表1称取60mg cmc
‑
na(羧甲基纤维素钠,离子型高分子)加到含有10ml纯净水的玻璃三角瓶中,开启磁力搅拌2小时,得溶液 1;分别称取0.3g聚山梨酯80(表面活性剂)和0.12g hpc(低取代羟丙基纤维素,增黏剂)加到含有20ml纯净水的玻璃三角瓶中,开启磁力搅拌、水浴加热40℃左右1.5小时,得溶液2;称取15mg盐酸二甲双胍投入到溶液2,继续加热搅拌30分钟,加入溶液1,搅拌30分钟,得混合液;将混合液用分散机在转速9500转分散5分钟,停机待泡沫消失后,用布氏漏斗减压过滤,得分散液;将分散液转移至高压均质机,控制温度15
±
5℃,在压力 400bar左右均质3分钟,然后提高压力至>800bar均质25分钟,减压至300bar 均质2分钟后排出,得到无色澄明溶液,进一步减压过滤除菌并除去
机械杂质得到除杂后的无色澄明溶液。
89.ph调节方法:用0.1n naoh调节ph6.5。
90.hplc检测:column:zorbax eclipse plus c18,4.6x100mm,3.5μm;流动相a:40mm醋酸铵(ph5.0),b:甲醇;梯度洗脱,0~2':100%a,20~ 22':60%a
‑
40%b,temp.:35℃,检测波长:233nm,flowrate:0.8ml/min;进样体积:10μl;检测结果:97.4%。粒径11.8nm(71.6%),pdi:0.519;室温避光放置1个月,外观及含量无明显变化。
91.实施例2、本发明眼用制剂的制备
92.制备方法参照实施例1,原料及用量如表1所示,得到除杂后的无色澄明溶液。
93.ph和渗透压调节:用1n柠檬酸钠溶液调节至ph6.5,加氯化钠调节渗透压至:297mosmol/kg。
94.hplc检测:column:zorbax 300sb
‑
cn,2.1x150mm,5μm;流动相: 40mm kh2po4(ph4.5):甲醇(75:25)等度洗脱,temp.:35℃,检测波长: 233nm,flowrate:0.8ml/min;检测结果:99.1%。
95.粒径21.6nm(94.4%),pdi:0.206;室温避光放置1个月,外观及含量无明显变化。
96.滴眼后1小时大鼠玻璃体api浓度为:39.8
±
16.6ng/g。
97.实施例3、本发明眼用制剂的制备,
98.制备方法参照实施例1,原料及用量如表1所示,得到除杂后的无色澄明溶液。ph检测结果:6.9,接近等渗,无需调节。
99.hplc检测方法同实施例1,检测结果:98.6%。
100.粒径16.6nm(98.6%),pdi:0.227,室温避光放置1个月,外观及含量无明显变化。
101.实施例4、本发明眼用制剂的制备
102.制备方法参照实施例1,原料及用量如表1所示,得到除杂后的无色澄明溶液。ph检测结果:6.5,接近等渗,无需调节。
103.hplc检测方法同实施例1,检测结果:97.8%。
104.粒径17.1nm(55.5%),513(36.3%),pdi:0.795,室温避光放置1个月,外观及含量无明显变化。
105.实施例5、本发明眼用制剂的制备
106.制备方法:称取60mg cmc
‑
na加到含有15ml纯水的玻璃三角瓶中,开启磁力搅拌2小时,得溶液1;分别称取0.24g聚山梨酯80和0.12g hpmc (增黏剂)加入到含有15ml纯水的另一个玻璃三角瓶中,开启磁力搅拌、水浴加热40℃左右3小时,得溶液2;称取15mg硫辛酸和1ml丙三醇(相当于表面活性剂用量的5.25倍(w/w))投入到溶液2,继续加热搅拌30分钟后,加入溶液1,搅拌30分钟,得混合液;将混合液用分散机在转速11,000 转分散3分钟,停机后待溶液泡沫消失后转入高压均质机均质处理(条件参照实施例1)得到无色澄明溶液,然后减压过滤除菌并除去机械杂质,得到除杂后的无色澄明溶液;
107.ph和渗透压调节方法:用0.1n柠檬酸钠溶液调节至ph6.3,加氯化钠调节渗透压至:294mosmol/kg;
108.hplc检测:column:zorbax eclipse plus c18,4.6x100mm 3.5μm;流动相a:0.1%磷酸(ph3.0),b:甲醇
‑
乙腈(1:1)。temp.:35℃,检测波长: 215nm,flowrate:0.8ml/min;梯度洗脱程序:0
‑5’
:60%a
‑
40%b,28
‑
30’: 40%a
‑
60%b;检测结果:97.4%。粒度检测结果:
17.8nm(98.6%),pdi:0.222; 3~8℃避光放置1个月外观和含量无变化。
109.滴眼后0.5小时大鼠玻璃体api浓度为:52.6
±
17.9ng/g。
110.对照组滴加2mg硫辛酸/5ml生理盐水的混悬液(使用前涡旋振摇均匀),每只眼睛20μl,对照组滴眼后0.5小时动物玻璃体中未检测到硫辛酸(低于检测限,<1ng/g)。
111.实施例6、本发明眼用制剂的制备
112.制备方法及ph、渗透压调节方法参照实施例1,原料及用量如表1所示,得到除杂后的无色澄明溶液。
113.hplc检测方法同实施例1,hplc检测结果:98.4%
114.检测结果:粒径348nm(85%),pdi:0.422。
115.室温避光放置1个月外观和含量无变化,1个月无明显变化,2个月后出现少量沉淀。
116.实施例7、本发明眼用制剂的制备
117.制备方法和ph、渗透压调节方法参照实施例5,原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的6.2倍(w/w)。
118.hplc检测方法同实施例5,检测结果:98.1%;粒径25.8nm(87.4%), pdi:0.317,3~8℃避光放置1个月,外观和含量无变化。
119.实施例8、本发明眼用制剂的制备
120.制备方法和ph、渗透压调节方法参照实施例5,原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的8.9倍(w/w)。
121.hplc检测方法同实施例5,检测结果:95.2%;粒径31.5nm(82.9%),pdi:0.347。3~8℃避光放置1个月,外观和含量无变化。
122.实施例9、本发明眼用制剂的制备
123.制备方法参照实施例1,原料及用量如表1所示,得到除杂后的微黄色澄明溶液。
124.ph、渗透压调节:用0.1n naoh调节至ph6.3,加氯化钠调节渗透压至: 297mosmol/kg;
125.hplc检测波长280nm,其余检测方法同实施例1,检测结果:97.3%;粒径16.7nm(98.1%),pdi:0.225;室温避光放置1个月,外观和含量无变化。
126.滴眼后0.5小时大鼠玻璃体api浓度为:66.5
±
18.1ng/g。
127.对照组滴加2mg多西环素/5ml生理盐水的混悬液(使用前涡旋振摇均匀),每只眼睛20μl,对照组滴眼后0.5小时动物玻璃体中未检测到多西环素(低于检测限,<1ng/g)。
128.实施例10、本发明眼用制剂的制备
129.制备方法和ph、渗透压调节方法参照实施例9,原料及用量如表1所示,得到除杂后的微黄色澄明溶液。
130.hplc检测方法同实施例9,hplc含检测结果:98.2%;粒径17.2nm (97.9%),pdi:0.208;室温避光放置1个月,外观和含量无变化。
131.实施例11、本发明眼用制剂的制备
132.制备方法和ph、渗透压调节方法参照实施例9,助溶剂的加入是:称取 1.5ml丙二醇(相当于表面活性剂的10倍(w/w))与表面活性剂一起加入介质水中,磁力搅拌,水浴加热溶解得到溶液2,得到除杂后的微黄色澄明溶液,原料及用量如表1所示。
133.hplc检测方法同实施例9,检测结果:95.2%;粒径29.7nm(89.3%), pdi:0.382;3~8℃避光放置1个月,有絮状物出现。
134.实施例12、本发明眼用制剂的制备
135.制备方法和ph、渗透压调节方法参照实施例5,原料及用量如表1所示。
136.hplc检测方法参照实施例5,检测结果:0.486mg/ml(二甲双胍)、 0.481mg/ml(硫辛酸);粒径18.9nm+302.1nm,pdi:0.529;3~8℃避光放置 1个月,外观和含量无变化。
137.滴眼后0.5小时动物玻璃体api浓度为:86.5ng/g硫辛酸,69.5ng/g二甲双胍。
138.实施例13、本发明眼用制剂的制备
139.制备方法和ph、渗透压调节方法参照实施例5,原料及用量如表1所示。
140.hplc检测方法参照实施例5,检测结果:0.487mg/ml(多西环素)、 0.478mg/ml(硫辛酸);粒径20.2nm+251.6nm,pdi:0.701,3~8℃避光放置 1个月,外观和含量无变化。
141.滴眼后0.5小时大鼠玻璃体api浓度为:57.3ng/g硫辛酸,68.4ng/g二甲双胍。
142.实施例14、本发明眼用制剂的制备
143.制备方法参照实施例5;原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的4.5倍(w/w),ph为6.5,接近等渗,无需调节。
144.hplc检测方法:column:zorbax eclipse plus c18,4.6x100mm 3.5μm;流动相a:0.1%磷酸,b:乙腈(80:20),等度洗脱;temp.:35℃,检测波长: 306nm,flowrate:0.8ml/min;检测结果:95.7%;
145.粒径27.5nm(77.9%),pdi:0.328;3~8℃避光放置1个月,外观和含量无明显变化。
146.滴眼后0.5小时大鼠玻璃体api浓度为:20.3
±
9.3ng/g。
147.实施例15、本发明眼用制剂的制备
148.制备方法参照实施例14,原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的4.5倍(w/w),得到除杂后的无色澄明溶液。
149.ph为6.6,无需调节ph;渗透压调节:加氯化钠调节渗透压至:293 mosmol/kg;
150.hplc检测方法参照实施例14,检测结果:96.1%;
151.粒径24.5nm(85.5%),pdi:0.253;3~8℃避光放置1个月,外观和含量无明显变化。
152.实施例16、本发明眼用制剂的制备
153.制备方法参照实施例14,原料及用量如表1所示,其中助溶剂丙三醇的用量为表面活性剂的4.5倍(w/w),得到除杂后的无色澄明溶液。
154.ph为6.4,无需调节ph;渗透压调节:加氯化钠调节渗透压至305 mosmol/kg;
155.hplc检测方法参照实施例14,检测结果:94.7%;
156.粒径26.2nm(75.2%),pdi:0.325;3~8℃避光放置1个月,外观和含量无明显变化。
157.实施例17、本发明眼用制剂的制备
158.制备方法参照实施例14,原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的4.5倍(w/w),得到除杂后的无色澄明溶液。
159.ph、渗透压调节:用0.2n naoh调节至ph6.2,加氯化钠调节渗透压至: 305mosmol/
kg;
160.hplc检测方法参照实施例14,检测结果:95.3%;
161.粒径22.7nm(83.4%),pdi:0.372;3~8℃避光放置1个月,外观和含量无明显变化。
162.实施例18、本发明眼用制剂的制备
163.制备方法参照实施例9,原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的5倍(w/w),得到除杂后的无色澄明溶液。
164.ph、渗透压调节:用0.1n naoh调节至ph6.3,加氯化钠调节渗透压至: 290mosmol/kg;
165.hplc检测方法参照实施例5,检测结果:96.1%;
166.粒径23.7nm(84.2%),pdi:0.323;室温避光放置1个月,外观和含量无明显变化。
167.滴眼后0.5小时大鼠玻璃体api浓度为:62.5ng/g。
168.实施例19、本发明眼用制剂的制备
169.制备方法参照实施例5,原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的4.2倍(w/w),得到除杂后的无色澄明溶液。
170.ph、渗透压调节:用0.1n naoh调节至ph6.3,加氯化钠调节渗透压至: 288mosmol/kg;
171.hplc检测方法参照实施例5,检测结果:95.6%;粒径24.1nm(81.5%), pdi:0.357;室温避光放置1个月,外观和含量无明显变化。
172.实施例20、本发明眼用制剂的制备
173.制备方法参照实施例5,原料及用量如表1所示,其中助溶剂丙二醇的用量为表面活性剂的5.2倍(w/w),得到除杂后的无色澄明溶液。
174.ph、渗透压调节:用0.2n naoh调节至ph6.3,加氯化钠调节渗透压至: 310mosmol/kg;
175.hplc检测方法参照实施例5,检测结果:97.2%;粒径27.5nm(79.6%), pdi:0.364;室温避光放置1个月,有可见微粒。
176.实施例21、本发明眼用制剂的制备
177.制备方法参照实施例9,原料及用量如表1所示,得到除杂后的淡黄色澄明溶液。
178.ph、渗透压调节:用0.1n柠檬酸钠溶液调节至ph7.0,加氯化钠调节渗透压至:302mosmol/kg。
179.hplc检测:column:zorbax 300sb
‑
cn,2.1x150mm,5μm;流动相: 0.1m醋酸銨水溶液
‑
10mm三乙胺(ph8.5):乙睛(84:16),等度洗脱,temp.: 30℃,检测波长:350nm,flowrate:0.8ml/min;检测结果:98.5%;粒径13.4nm (89.5%),pdi:0.201;室温避光放置1个月,外观及含量无明显变化。
180.滴眼后0.5h大鼠玻璃体api浓度为:54.8
±
19.2ng/g。
181.通过滴眼给药后大鼠玻璃体内api浓度的测定结果,说明本发明眼用制剂可以携载治疗眼病的活性成分穿过眼球结构的屏障,通过结膜囊给药(滴眼给药)的方式即可把有效剂量的药物递送到玻璃体,避免玻璃体注射等侵入性给药方式,还大幅度减少总的药物量,减少药物在全身的吸收,避免产生毒副作用。
182.对比例1、聚维酮辅料制备的制剂
183.参照实施例5的制备方法,以15mg硫辛酸为药物,将离子型高分子替换为聚维酮k12(pvp k12),以聚维酮k30(pvp k30)替代增粘剂;以peg300 作为助溶剂,peg300的质量为聚维酮k12的22倍,按照表1所示用量制备得到。
184.对比例2、聚维酮替代离子型高分子制备的制剂
185.参照实施例2的制备方法,以15mg盐酸二甲双胍为药物,将离子型高分子替换为聚维酮k12(pvp k12),以peg300作为助溶剂,peg300的质量为表面活性剂的4倍,按照表1所示用量制备得到。
186.对比例3、聚乙二醇代替离子型高分子制备的制剂
187.参照实施例15的制备方法,将离子型高分子替换为peg4000;以peg300 作为助溶剂,p300的质量为表面活性剂的3倍,按照表1所示用量制备得到。
188.表1、
189.[0190][0191][0192]
以下通过实验例证明本发明滴眼给药的药物制剂的有益效果。
[0193]
实验例1、本发明载体的透射电镜观察结果
[0194]
透射电子显微镜(jem
‑
2100plus,日本jeol公司)
[0195]
吸取1滴实施例2制备的液体样品于铜质样品网,静置5分钟后吸去多余的液体样品后,自然放干,放置于电镜样品室作检测;样品染色:吸取1 滴液体样品于铜质样品网,在除去样品网上多余的样品后,加1滴2%磷钼酸,静置5分钟后吸去多余的液体,自然放干,样品网放置于电镜作检测。结果见图1。同样方法观察实施例9制备的样品,结果见图2。可以观察到 1~100nm的球形结构(纳米小体)以及纳米小体构成的100~2000nm的球形结构(纳米小球)。
[0196]
实验例2、粒径、含量及稳定性检测
[0197]
1、实验方法
[0198]
将1ml实施例和对比例制备得到的样品转移至样品池中,检测温度设置为40℃,将样品池放入ns
‑
90钠米粒度分析仪,开始检测。每个样品重复检测3次,取3次检测结果的平均值为该样品检测结果为粒度(以光强分布,及占比%)和多分散指数(pdi,polydispersity index)表示。检测后避光保存,观察外观变化并再次检测粒径。
[0199]
采用安捷伦1100高效液相色谱仪检测本发明制得的眼用制剂样品的 hplc含量。
[0200]
2、实验结果
[0201]
见下表:
[0202]
表2.
[0203]
[0204]
[0205][0206]
上述结果可以看出,本发明制备的药物制剂粒径小,hplc检测活性成分含量高,长时间放置形态和含量均稳定;说明本发明制剂包封率高,稳定性好。而使用与本发明的辅料原料不同的对比例制得的制剂,稳定性很差,短时间就会出现沉淀或变质现象。
[0207]
实验例3、本发明眼用制剂通过滴眼给药的方式治疗干性黄斑病变的效果验证
[0208]
1、实验方法
[0209]
将9只140
‑
160克体重sd鼠分为对照组(3只),模型组(3只)和治疗组(3只)。模型组和治疗组经鼠尾静脉注射1%碘酸钠(20mg/kg)构建干性黄斑变性大鼠模型,其囊括了干性黄斑变性的病理学特征,是评估干性黄斑变性新疗法的有效工具之一。
[0210]
治疗组于注射后24小时开始,双眼下眼结膜囊每次滴入本发明实施例9 的制剂20ul,每天3次,连续6天,模型组和对照组大鼠除生理盐水滴眼外,其他处理与治疗组一致,于最后一次滴眼后12小时,安乐死大鼠,摘除眼球, 4%多聚甲醛固定,常规石蜡切片、he染色。
[0211]
2、实验结果
[0212]
光学显微镜下观察,对照组大鼠视网膜层次清晰,细胞排列整齐,外核层和内核层细胞结构无异常。模型组大鼠视网膜萎缩,外核层细胞减少,内核层细胞减少,细胞排列紊乱。治疗组与模型组比较,视网膜病变程度改善,外核层细胞数增加,内核层细胞数增加,且细胞排列相对整齐(见图6)。
[0213]
上述实验结果表明本发明滴眼剂对干性黄斑变性有预防/治疗作用。
[0214]
综上,本发明提供了一种滴眼给药制剂,能够通过滴眼给药的方式,携载(包裹)腺苷酸活化蛋白激酶激活剂和/或抗炎症类活性成分穿过眼前段,输送到眼后段发挥治疗作用。实现了通过滴眼给药防治干性黄斑病变和视网膜光损伤的目标,解决了本领域一直期
限亟待解决但未解决的技术问题,具有极为优良的临床使用价值和非常积极的社会意义。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1