负载蛋白的生物活性磷酸钙纳米颗粒及其制备方法
1.本发明属于纳米材料合成技术领域,具体涉及一种无机离子与生物活性蛋白共沉淀合成,具有生物活性的纳米颗粒,即负载蛋白的生物活性磷酸钙纳米颗粒及其制备方法。
背景技术:
2.过去数十年中,许多研究证明了多种生长因子具有高生物活性及生物特异性,在组织修复和再生等生命活动中起重要作用。然而,与大部分蛋白质相似,生长因子在体内大多不稳定,且半衰期短。因此,具有生物活性的蛋白纳米载体在能够保护蛋白活性的同时,还能延长其半衰期,有效地避免反复注射、口服等引起的不良反应。然而,仍然有两个问题限制了蛋白纳米载体的实现:如何有效保护蛋白活性;如何实现蛋白的有效负载及释放。目前研究较多的蛋白纳米载体材料有:氧化石墨烯、磁性纳米颗粒、金纳米颗粒、脂质体颗粒和聚合物纳米颗粒等。其中,磷酸钙纳米颗粒备受关注。
3.脊椎动物钙化组织内的主要无机成分即为磷酸钙类矿物。人工合成的磷酸钙材料组成结构与生物体内结构相似,并且都具有良好的化学稳定性、生物活性、可降解性及一定的吸附能力。此外,体外实验表明,磷酸钙材料具有良好的生物相容性,其生物毒性远远低于硅基、量子点、碳纳米管磁性颗粒等。其在ph>4.2的环境中能够稳定存在,具有良好的稳定性。并且,纳米级磷酸钙类材料与体内骨组织磷酸钙的形式高度一致,能够改善骨组织的增殖,促进成骨细胞黏附,在种植体表面改性中得到广泛应用。
4.目前,基于磷酸钙纳米颗粒制备的生物蛋白活性载体可见以下报道:
5.《材料科学:医学材料》(j mater sci:mater med,2010年第21卷1875
‑
1880页)报道了利用化学沉淀的方法合成羟基磷灰石纳米颗粒,在ph=12的体系中缓慢混合硝酸钙和磷酸氢二铵,可产生大量沉淀;然后将反应体系煮沸10min,最后离心保留沉淀,冷冻干燥。将冻干后的沉淀溶解于5毫升bmp
‑
2溶液中37℃搅拌反应30min,通过吸附作用负载生长因子bmp
‑
2。反应结束后,离心去除上清,沉淀冻干保存。该方法中生长因子与磷酸钙纳米颗粒仅通过吸附作用结合,易导致蛋白突释。
6.《先进健康材料》(adv.healthcare mater.,2013年第2卷682
‑
686页)报道了一种在温和的极性环境中,不采用任何有毒表面活性剂微波协同合成多空磷酸钙的方法。由于没有引入有毒物质,所以合成出的材料可以直接应用于生物体内而不需要任何后处理过程。同时该纳米材料表现出良好的蛋白负载和缓释的特性。作者进一步基于表征讨论了其存在的潜在机理。该方法的反应高温环境会影响蛋白活性,且蛋白突释明显,2h内大部分蛋白已经完全释放。
技术实现要素:
7.针对现有技术中的不足,本发明的目的之一是提供一种负载蛋白的生物活性磷酸钙纳米颗粒的制备方法。
8.本发明的目的之二是提供上述负载蛋白的生物活性磷酸钙纳米颗粒。
9.本发明的原理:利用化学沉淀的方法,在合成磷酸钙颗粒的过程中加入蛋白,在制备磷酸钙纳米颗粒的同时将蛋白实现有效地包覆。
10.为达到上述目的之一,本发明的解决方案是:
11.将蛋白溶解在tris
‑
hcl缓冲溶液中,逐滴加入氯化钙溶液、氯化镁溶液及磷酸氢二钠溶液,混合均匀后可见大量沉淀,高速离心,收集沉淀用双蒸水反复清洗,沉淀冷冻干燥,冰箱冷冻保存。具体地,
12.一种负载蛋白的生物活性磷酸钙纳米颗粒的制备方法,其包括如下步骤:
13.(1)、将蛋白溶解在三羟甲基氨基甲烷盐酸盐(tris
‑
hcl)的缓冲溶液中,得到第一混合液;
14.(2)、在第一混合液内加入氯化钙溶液,得到第二混合液;
15.(3)、在第二混合液内加入氯化镁溶液,得到第三混合液;
16.(4)、在第三混合液内加入磷酸氢二钠溶液,离心去除上清液,得到沉淀物;
17.(5)、将沉淀物清洗多次,冷冻干燥,得到负载蛋白的生物活性磷酸钙纳米颗粒。
18.作为本发明的一种优选实施例,步骤(1)中,蛋白包括生长因子和模式蛋白。
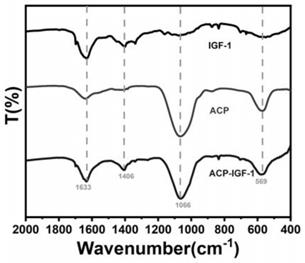
19.作为本发明的一种优选实施例,生长因子为胰岛素样生长因子
‑
1(igf
‑
1)。
20.作为本发明的一种优选实施例,模式蛋白为牛血清白蛋白或者细胞色素c。
21.作为本发明的一种优选实施例,步骤(1)中,蛋白的浓度为0.1
‑
2mg/ml。
22.作为本发明的一种优选实施例,步骤(4)中,离心的转速为5000
‑
8000rpm,离心的时间为10
±
0.1min。
23.作为本发明的一种优选实施例,步骤(5)中,冷冻干燥的时间大于10h。
24.作为本发明的一种优选实施例,步骤(5)中,负载蛋白的生物活性磷酸钙纳米颗粒的平均粒径为10
‑
100nm。
25.作为本发明的一种优选实施例,步骤(5)中,负载蛋白的生物活性磷酸钙纳米颗粒的平均粒径为40.23nm。
26.为达到上述目的之二,本发明的解决方案是:
27.一种负载蛋白的生物活性磷酸钙纳米颗粒,其由上述的制备方法得到。
28.由于采用上述方案,本发明的有益效果是:
29.第一、本发明的方法通过简单地混合蛋白及无机盐成分,在敞开环境下快速反应制备具有生物活性的磷酸钙纳米颗粒,该方法避免了高温高压等苛刻条件,不引入其他有毒成分、操作简单、反应快速,能够有效保护生长因子活性,并且实现生长因子的有效负载及释放的优点,为后续的用于临床应用提供基础。
30.第二、本发明的生物活性磷酸钙纳米颗粒尺寸为40nm左右,生物相容性较好,可以有效地保留生长因子活性,促进细胞的增殖、分化。
附图说明
31.图1为本发明的负载生长因子igf
‑
1的磷酸钙纳米颗粒的透射电镜图(bar=100nm)。
32.图2为本发明的负载生长因子igf
‑
1的磷酸钙纳米颗粒的扫描电镜图(bar=300nm)。
33.图3为本发明的负载生长因子igf
‑
1的磷酸钙纳米颗粒的傅立叶
‑
近红外光谱(ftir)图。
34.图4为本发明以牛血清白蛋白(bsa)为模式蛋白的检测缓释曲线图(纵坐标released amount为释放量)。
35.图5为本发明以细胞色素c为模式蛋白,不同ph的tris
‑
hcl缓冲液中合成的磷酸钙纳米颗粒的蛋白释放图(纵坐标released amount为释放量)。
36.图6为本发明以细胞色素c为模式蛋白,不同蛋白浓度合成样本光学照片及对应负载量图。
37.图7为本发明以细胞色素c为模式蛋白,不同蛋白浓度合成的磷酸钙纳米颗粒的蛋白释放图(纵坐标released amount为释放量)。
38.图8为本发明以细胞色素c为模式蛋白检测圆二色谱(cd)图(cytochrome c为细胞色素c)。
39.图9为本发明本发明的纳米颗粒与mc3t3
‑
e1细胞共培养示意图。
40.图10为本发明负载生长因子igf
‑
1的纳米颗粒与mc3t3
‑
e1共培养示意图(t0:未负载igf
‑
1的纳米颗粒;ti:负载igf
‑
1的纳米颗粒)。
具体实施方式
41.本发明提供了一种负载蛋白的生物活性磷酸钙纳米颗粒及其制备方法。
42.<负载蛋白的生物活性磷酸钙纳米颗粒的制备方法>
43.本发明的负载蛋白的生物活性磷酸钙纳米颗粒的制备方法包括如下步骤:
44.(1)、将蛋白溶解在三羟甲基氨基甲烷盐酸盐(tris
‑
hcl)的缓冲溶液中,磁力搅拌混匀,使生长因子(或模式蛋白)溶液平衡,得到第一混合液;
45.(2)、在第一混合液内加入氯化钙溶液,磁力搅拌混匀,得到第二混合液;
46.(3)、在第二混合液内加入氯化镁溶液,继续吹打混匀,得到第三混合液;
47.(4)、在第三混合液内加入磷酸氢二钠溶液,混匀可见大量沉淀产生,将反应体系离心去除上清液,得到沉淀物;
48.(5)、沉淀物中加入双蒸水反复洗涤3次,冷冻干燥过夜,得到负载蛋白的生物活性磷酸钙纳米颗粒。
49.其中,在步骤(1)中,生长因子为胰岛素样生长因子
‑
1(igf
‑
1),模式蛋白为牛血清白蛋白(bsa)或者细胞色素c。因模式蛋白与生长因子均为蛋白,具有相似的蛋白活性特点,因此本发明前期为验证方法的可实施性,利用模式蛋白bsa或细胞色素c等进行合成,并检测释放功能。
50.在步骤(1)中,蛋白的浓度为0.1
‑
2mg/ml。
51.在步骤(4)中,离心的转速为5000
‑
8000rpm,离心的时间为10
±
0.1min。
52.在步骤(5)中,冷冻干燥的时间大于10h。
53.在步骤(5)中,负载蛋白的生物活性磷酸钙纳米颗粒的平均粒径为10
‑
100nm,优选为40.23nm。
54.<负载蛋白的生物活性磷酸钙纳米颗粒>
55.由上述的制备方法得到本发明的负载蛋白的生物活性磷酸钙纳米颗粒。如图1所
示,该生物活性磷酸钙纳米颗粒的形貌均一,粒径约为40.23nm(bar=100nm)。如图2所示,该生物活性磷酸钙纳米颗粒的颗粒形貌均一(bar=300nm)。如图3所示,acp未负载生长因子的蛋白磷酸钙颗粒未表现蛋白特征峰,而acp
‑
igf
‑
1负载了生长因子的磷酸钙颗粒可见蛋白特征峰,该生物活性磷酸钙纳米颗粒证实颗粒中生长因子的有效负载。
56.如图4所示,900h内该纳米颗粒持续进行蛋白释放。
57.其中,缓释过程为:离心管中将已负载bsa的纳米颗粒样品按照浓度为1mg/ml的浓度溶解在磷酸盐缓冲液(pbs,ph=7.2
‑
7.4)中,之后放置在37℃、120
‑
200rpm的恒温摇床中反应;在特定时间点离心收集上清液置于
‑
20℃冰箱保存,并加入等量的pbs缓冲液,在恒温摇床中继续反应;当各时间点上清均收集后,利用bca蛋白浓度检测试剂盒测量上清液中蛋白浓度并计算绘图。
58.以下结合实施例对本发明作进一步的说明。
59.实施例1:
60.本实施例的负载蛋白的生物活性磷酸钙纳米颗粒的制备方法包括如下步骤:
61.(1)、称取适量蛋白,溶解在ph=8.0的tris
‑
hcl缓冲溶液中,搅拌混匀后,配成浓度为1mg/ml的第一混合液。
62.(2)、在第一混合液内逐滴加入氯化钙溶液至终浓度25mmol/l,继续搅拌,得到第二混合液;
63.(3)、在第二混合液内逐滴加入氯化镁至终浓度25mmol/l,搅拌均匀,得到第三混合液;
64.(4)、在第三混合液内逐滴加入磷酸氢二钠至终浓度15mmol/l,产生大量沉淀,在8000rpm下高速离心10min,去除上清液,得到沉淀物;
65.(5)、将收集到的沉淀物用双蒸水反复洗涤3次,冷冻干燥至少10h,得到负载蛋白的生物活性磷酸钙纳米颗粒,并进行理化性质检验和生物学性能检测。
66.实施例2:
67.改变实施例1中tri
‑
hcl的ph值,得到不同蛋白负载量的磷酸钙纳米颗粒。研究证实其负载量超过10%,约为15.64%。
68.如图5所示,不同ph的tris
‑
hcl缓冲液中合成的磷酸钙纳米颗粒的蛋白释放图,ph越大,负载量越高,释放值越低。ph=8.0时,负载量为13.79%;ph=9.0时,负载量为15.64%。
69.缓释过程:离心管中将已负载细胞色素c的纳米颗粒样品按照浓度为1mg/ml的浓度溶解在不同ph的pbs缓冲液中(ph=4.1、6.1、7.2),之后放置在37℃、120
‑
200rpm的恒温摇床中反应;在特定时间点离心收集上清液置于
‑
20℃冰箱保存,并加入等量的pbs缓冲液,在恒温摇床中继续反应;当各时间点上清均收集后,利用bca蛋白浓度检测试剂盒测量上清液中蛋白浓度并计算绘图。
70.实施例3:
71.改变实施例1中蛋白浓度分别为0.1mg/ml、1mg/ml和2mg/ml,得到不同蛋白负载量的磷酸钙纳米颗粒。
72.如图6所示,不同蛋白浓度合成样本光学照片及对应负载量,浓度越大,负载量越高。
73.材料负载量检测方法为:称取1mg材料溶解在1ml的1%乳酸中,充分溶解后,高速离心(10000rpm,10min),吸取上清后bca试剂盒检测蛋白浓度。
74.如图7所示,不同蛋白浓度合成的磷酸钙纳米颗粒的蛋白释放图,浓度越小,释放量越高,但结果无统计学差异。
75.缓释过程:离心管中将不同蛋白浓度(浓度为0.1mg/ml、1mg/ml、mg/ml)制备的负载细胞色素c纳米颗粒样品按照浓度为1mg/ml的浓度溶解在pbs缓冲液中(ph=7.2
‑
7.4),之后放置于37℃、120
‑
200rpm的恒温摇床中反应;在特定时间点离心收集上清液置于
‑
20℃冰箱保存,并加入等量的pbs缓冲液,在恒温摇床中继续反应;当各时间点上清均收集后,利用bca蛋白浓度检测试剂盒测量上清液中蛋白浓度并计算绘图。
76.图8显示缓释出的蛋白空间结构与标准蛋白基本一致,证实蛋白活性得以保存。
77.图9显示该纳米颗粒的生物相容性较好。计算好mc3t3
‑
e1细胞数目后,接种在细胞培养皿中;24h后,待细胞完全贴壁,将材料加入细胞培养液进行共培养,3天后利用cck
‑
8检测试剂盒测量细胞增殖能力。
78.图10显示负载了生长因子的纳米颗粒较未负载的可显著促进细胞增殖。计算好mc3t3
‑
e1细胞数目后,接种在细胞培养皿中;24h后,待细胞完全贴壁,将材料加入细胞培养液进行共培养,1天和3天后利用cck
‑
8检测试剂盒测量细胞增殖能力。
79.综上,本发明利用简单的化学沉淀反应,实现了蛋白与磷酸钙颗粒的有效结合,该反应时间短,且无有毒成分,在尽可能保存蛋白活性的基础上,实现了生长因子的有效负载。研究证实其负载量超过10%,约为15.64%;缓释时间较长,可达900h左右;由于反应时间短且条件温和,蛋白活性得到了最大程度保留。生物实验结果证实制备的生物活性纳米颗粒的生物相容性较好,并且可以显著促进细胞增殖。
80.上述对实施例的描述是为了便于该技术领域的普通技术人员能理解和使用本发明。熟悉本领域技术人员显然可以容易的对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中,而不必经过创造性的劳动。因此,本发明不限于上述实施例。本领域技术人员根据本发明的原理,不脱离本发明的范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1