C-JUNN末端激酶抑制剂SU3327的用途的制作方法
c
‑
jun n末端激酶抑制剂su3327的用途
技术领域
1.本发明涉及一种c
‑
jun n末端激酶(jnk)抑制剂su3327的用途。
背景技术:
2.抗生素是人类从土壤以及各种微生物的代谢产物中发现的可以治疗细菌 感染的最有效的药物。随着抗生素的滥用,开始有细菌出现对抗生素的耐药 性,变成耐药细菌,提升了医治人类以及动物疾病的难度。我国于2019年发 布了饲料“禁抗”令(第194号公告),明确禁止在养殖业中使用含有促生长 类药物饲料添加剂,积极推进养殖业实现饲料“禁抗”、养殖“减抗”、产品
ꢀ“
无抗”的发展方向,鼓励研发安全高效的新型研发抗菌药物以替代传统抗 生素。只要能研发出新型的抗生素就能够杀死耐药细菌,但是抗生素的研发 需要在土壤及其中微生物的各种产物中进行筛选,这一过程需要高昂的成本 和十分漫长的时间,细菌耐药性的增长速度远快于新抗生素的研发速度。
3.su3327,是一种c
‑
jun n末端激酶(jnk)抑制剂,可用于糖尿病治疗。 其分子式为c5h3n5o2s3,分子量261.313结构式如图1所示。
4.公开su3327,作为糖尿病治疗的临床前研究药物的参考文献如下:
5.j med chem期刊(2009apr 9),标题为design,synthesis,andstructure
‑
activity relationship of substrate competitive,selective, and in vivo active triazole and thiadiazole inhibitors of the c
‑
junn
‑
terminal kinase,主要内容:文章中称su3327为化合物9,是一种人工合 成的jnk抑制剂。蛋白激酶占哺乳动物基因组的2%,并催化atp的γ
‑
磷酰 基向特定蛋白底物的转移。c
‑
jun n末端激酶(jnk)是促分裂原活化蛋白激 酶(mapk)家族的一系列丝氨酸/苏氨酸蛋白激酶。jnk活性的上调与许多疾 病相关联,如类型
‑
2型糖尿病,肥胖,癌症,和中风。jnk抑制剂能抑制jnk 的活性,因此,jnk抑制剂具有对抗多种疾病效果。
6.acta pharmacol sin期刊(2014mar),标题为tnf
‑
αinduces cxcl1 chemokine expression and release in human vascular endothelial cellsin vitro via two distinct signaling pathways,主要内容:文章发现tnf
‑ꢀ
α(2,5ng/ml)以浓度和时间依赖性方式诱导细胞中cxcl1的释放和mrna 表达。tnf
‑
α会导致jnk,p38 mapk,pi3k和akt活化,而用jnk抑制剂 (sp600125和su3327),p38 mapk抑制剂(sb202190)或pi
‑
3k抑制剂 (ly294002)预处理可显着抑制tnf
‑
α
‑
诱导cxcl1从细胞释放,此文献中将 su3327作为jnk抑制剂使用。
7.microvasc res期刊(2012sep),标题为post
‑
transcriptionalregulation of placenta growth factor mrna by hydrogen peroxide,主 要内容:诸如过氧化氢这类的氧化应激源会激活多种激酶途径,从而影响转 录,rna稳定性和翻译过程。激酶途径有助于过氧化物诱导的plgf mrna水平 增加,su3327作为一种jnk抑制剂,可以显著抑制过氧化物诱导的plgf mrna 水平的升高。
8.redox biol期刊(2015dec),标题为critical role of c
‑
jun n
‑
terminal
protein kinase in promoting mitochondrial dysfunction and acute liverinjury,主要内容:文章主要研究c
‑
jun n末端蛋白激酶(jnk)在促进线粒 体功能障碍和急性肝损伤中的关键作用。文章把su3327处理过的小鼠作为对 照,即jnk活性被抑制,由此发现在su3327预处理的条件下显著降低ccl4 暴露小鼠中p
‑
jnk,线粒体磷蛋白和肝损伤的水平。
技术实现要素:
9.本发明提供一种c
‑
jun n末端激酶(jnk)抑制剂su3327的用途,例如 所述c
‑
jun n末端激酶抑制剂su3327用于不同动物和人类物种的杀菌、抑菌 作用。
10.进一步的:所述c
‑
jun n末端激酶抑制剂su3327作用于人或/和动物体 内分离或是临床上从感染者体内分离之后进行培养得来的菌株,进行杀菌、 抑菌。
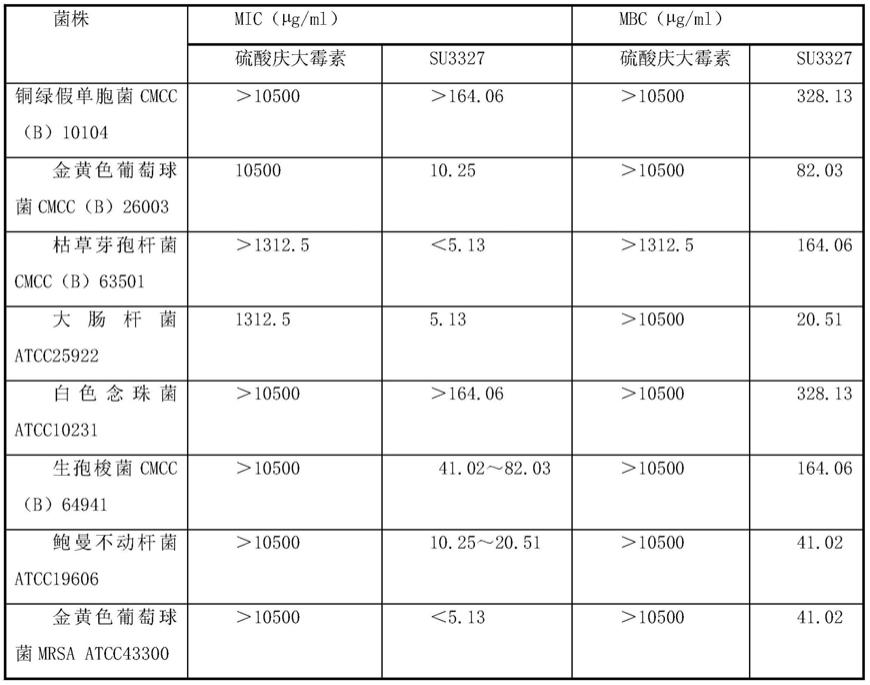
11.在一些实施例方案中,所述su3327对多种细菌具有杀菌能力,所述多种 细菌包括大肠杆菌atcc25922,金黄色葡萄球菌cmcc(b)26003,金黄色葡 萄球菌mrsa atcc43300,鲍曼不动杆菌atcc19606,生孢梭菌cmcc(b)64941, 枯草芽孢杆菌cmcc(b)63501,白色念珠菌atcc10231。而且,所述su3327 与硫酸庆大霉素这一种氨基糖苷类广谱抗生素相比,su3327具有更好的抑菌 效果。
12.上述大肠杆菌atcc25922,金黄色葡萄球菌cmcc(b)26003,金黄色葡 萄球菌mrsa atcc43300,鲍曼不动杆菌atcc19606,生孢梭菌cmcc(b)64941, 枯草芽孢杆菌cmcc(b)63501,白色念珠菌atcc10231均来源于人或/和动物 体内分离或是临床上从感染者体内分离之后进行培养得来的菌株。
13.上述的多种细菌还包括奶牛乳房炎分离链球菌(奶牛乳房炎分离链球菌 包括无乳链球菌和停乳链球菌)、猪链球菌、胸膜肺炎放线杆菌、副猪嗜血杆 菌、产气荚膜梭菌,以及鸡支原体(所述鸡支原体包括鸡滑液支原体和鸡毒 支原体),均从来源于人或/和动物体内分离或是临床上从感染者体内分离之 后进行培养得来的菌株。
14.上述细菌的菌株均保存在中国农业大学国家兽药安全评价中心。
附图说明
15.图1是本发明所述n末端激酶抑制剂su3327的结构式;
16.图2是本发明所述n末端激酶抑制剂su3327的制备过程的结构式。
具体实施方式
17.本发明基于深度学习技术,从已有的或者正在临床试验阶段的安全药物 数据库中,模型自主的找出了潜在的新型抗生素。经过细菌药敏实验明确了 su3327具有广谱抗生素的活性。本发明提供一种新型抗生素,进而给医药领 域带来重要影响。
18.一、利用细菌药敏实验确定su3327对大肠杆菌atcc25922,金黄色葡萄 球菌cmcc(b)26003,金黄色葡萄球菌mrsa atcc43300,鲍曼不动杆菌 atcc19606,生孢梭菌cmcc(b)64941,枯草芽孢杆菌cmcc(b)63501,白 色念珠菌atcc10231的最小抑菌浓度(mic)和最低杀菌浓度(mbc)。从实验 结果可知,su3327具有良好的抑菌能力,可以作为广谱抗生素使用,有效降 低病原菌感染后患者的病死率。
19.下面主要介绍su3327对多种细菌的药敏实验,即最小抑菌浓度(mic) 与最小杀菌
浓度(mbc)的测定,用于解释本发明。应当指出,下述具体试验 方案仅为示例性说明的目的,而非具体限制本发明的范围。
20.下述试验中,所述使用的试验方案如无特殊说明,均为常规方法。
21.下述试验中,所用的材料、试剂等,如无特殊说明,均为从商业途径得 到。
22.1,菌种培养与浓度调整
23.挑取培养18
‑
24h的纯菌溶液均匀溶解于2
‑
5ml无菌生理盐水中,调节其 浊度与0.5麦氏比浊管等浊。
24.2,最小抑菌浓度(mic)与最小杀菌浓度(mbc)的测定
25.(1)实验器材
26.96孔板、试管、5ul
‑
50ul微量移液器、100ul
‑
1000ul微量移液器、以 及配套的枪头、10ml离心管、麦氏比浊管、超净工作台、高压灭菌锅、鼓风 干燥箱、生化培养箱、mh肉汤培养基、pbs缓冲液、无菌水。
27.(2)实验方法
28.步骤一:将配置好的mh培养基、pbs缓冲液、无菌水、配套枪头、离心 管放入高压灭菌锅中灭菌,121℃杀菌25min。试管一起放入鼓风干燥箱中灭 菌.170℃杀菌2h。96孔板在超洁净工作台上紫外杀菌30min以上。
29.步骤二:从冰箱取出需要测试的菌种活化0.5h后,加入5ml的pbs缓冲 液将斜面上,在手掌上轻轻振打80次,使菌株完全冲下,倒入试管中轻轻摇 匀;吸取1ml的菌液加入到4ml的pbs缓冲液中,再吸取1ml稀释的菌悬液 依次进行5倍梯度稀释,选择108cfu/ml左右的菌悬液或106cfu/ml左右的孢 子悬浮液(对比0.5麦氏比浊管),将选好的菌悬液十倍系列稀释后选第二 支试管(即浓度约为106cfu/ml左右的菌悬液或104cfu/ml左右的孢子悬浮 液),再吸取0.5ml加入到4.5mlmh培养基中,用枪头吹匀待用。
30.步骤三:使用二甲基亚砜配置浓度为10.5mg/ml的su3327药液;利用 试管二倍稀释法将su3327药液、菌液及mh肉汤培养基加入96孔培养板中过 夜培养,不同浓度的药液组别均为三个平行,确保实验数据的可信度。将96 孔培养板置于37℃培养箱内孵育16h,观察孔内液体浑浊情况,以能够完全 抑制细菌生长的最低浓度为mic值。从每孔中取出100μl培养物倍比稀释涂 布固体培养基,37℃培养箱中过夜培养后,观察菌落生长情况,以细菌完全 被杀死的最低浓度为mbc值。
31.上述实验的实验结果见表1,如表1所示,su3327对实验所用菌种的抑 菌效果与杀菌效果都要好于硫酸庆大霉素。
32.需要注意的是:
33.1、在测定细菌mic值的二倍稀释法可以用纸片扩散法代替,即将沾染了 一定浓度药液的纸片放置在细菌培养基上,测量培养基上细菌生长区域与纸 片之间形成的抑菌圈来确定细菌的药敏mic值;
34.2、上述mh肉汤培养基可以替换为其他培养基,如琼脂培养基;
35.3、上述测定mbc值二倍稀释法可以用基内接种法替换。
36.表1.su3327与硫酸庆大霉素对不同菌株的mic值与mbc值
[0037][0038]
上表1所示,su3327对革兰氏阴性致病菌与革兰氏阳性致病菌的抑菌效 果与杀菌效果都要好于硫酸庆大霉素。
[0039]
二、利用细菌药敏实验确定su3327对奶牛乳房炎分离链球菌(奶牛乳房 炎分离链球菌包括无乳链球菌和停乳链球菌)、猪链球菌、胸膜肺炎放线杆菌、 副猪嗜血杆菌、产气荚膜梭菌,以及鸡支原体(所述鸡支原体包括鸡滑液支 原体和鸡毒支原体)的最小抑菌浓度(mic)和最低杀菌浓度(mbc)。
[0040]
从以下实验结果可知,su3327具有良好的抑菌能力,可以作为广谱抗生 素使用,有效降低病原菌感染后患者的病死率。
[0041]
下面主要介绍su3327对多种细菌的药敏实验,即最小抑菌浓度(mic) 与最小杀菌浓度(mbc)的测定,用于解释本发明。应当指出,下述具体试验 方案仅为示例性说明的目的,而非具体限制本发明的范围。
[0042]
下述试验中,所述使用的试验方案如无特殊说明,均为常规方法。
[0043]
下述试验中,所用的材料、试剂等,如无特殊说明,均为从商业途径得 到。
[0044]
1、受试菌株:奶牛乳房炎分离链球菌(无乳链球菌和停乳链球菌各10 株)、猪链球菌、胸膜肺炎放线杆菌、副猪嗜血杆菌、产气荚膜梭菌,上述菌 株各20株,以及鸡支原体10株(鸡滑液支原体和鸡毒支原体各5株),均从 临床分离鉴定。所有菌株均保存在中国农业大学国家兽药安全评价中心。
[0045]
2、培养基及试剂:本实验采用微量肉汤稀释法测定tmf、aptm两种化合 物对病原菌的mic。参考clsi的技术指导原则及相关文献报道,根据测试细 菌的培养特征,选取不同的培养基进行各种测试细菌的复苏、mic测定。详见 表2。
[0046]
表1不同细菌复苏、传代及mic测定所用培养基
[0047][0048][0049]
3、培养基与试剂配制:
[0050]
酵母提取物溶液:准确称取酵母提取物粉末10g,加入5ml无菌水中, 充分溶解后继续添加无菌水定容至10ml,0.22μm无菌滤膜过滤除菌后4℃ 保存。
[0051]
添加剂(酵母浓缩物)溶液:准确称取酵母浓缩物粉末10g,加入5ml 无菌水中,充分溶解后继续添加无菌水定容至10ml,0.22μm无菌滤膜过 滤除菌后4℃保存。
[0052]
0.0025%nadh:准确称取nadh粉末2.5mg,加入50ml无菌水,充分溶 解后继续添加无菌水定容至100ml,0.22μm无菌滤膜过滤除菌后
‑
20℃保 存。
[0053]
1%酚红:称取酚红粉末0.2g研磨,加入1mol/l的氢氧化钠至600μl, 充分溶解后加去离子水至20ml,0.22μm无菌滤膜过滤除菌后避光保存。
[0054]
2%arg溶液:称取精氨酸0.2g,加入5ml的无菌水中,充分溶解后定 容至10ml,0.22μm无菌滤膜过滤除菌后在
‑
20℃保存。
[0055]
1%cys溶液:称取半胱氨酸0.1g,加入加入5ml的无菌水中,充分溶解 后定容至10ml,0.22μm无菌滤膜过滤除菌后在
‑
20℃保存。
[0056]
1%nad:称取辅酶i 0.1g,加入5ml的无菌水中,充分溶解后定容至 10ml,0.22μm无菌滤膜过滤除菌后
‑
20℃保存。
[0057]
100万iu/ml青霉素溶液:准确称取1.2g青霉素,加入1ml无菌水中, 充分溶解后定容至2ml,0.22μm无菌滤膜过滤除菌后
‑
20℃保存。
[0058]
改良fm
‑
4基础液:准确称取2.5g nacl、0.2g kcl、0.8g na2hpo4·
12h2o、 0.1g mgso4·
7h2o、0.05g kh2po4、5.0g葡萄糖、2.5g水解乳蛋白(difco)、 2.5g酵母浸粉,加去离子水400ml,105℃高压灭菌20分钟min,4℃ 保存备用。
[0059]
改良fm
‑
4液体培养基:在400ml改良fm
‑
4基础液里加入灭活的胎牛血 清80ml、dmem高糖80ml、青霉素(100万iu/ml)0.5ml、酚红(1%)1ml。 为了保障鸡滑液支原体更容易生长,需添加4ml 1%的arg溶液、4ml1%cys 溶液和4ml1%的nad溶液。
[0060]
改良基础琼脂:向改良fm
‑
4基础液中加入1.2%的琼脂,煮沸充分溶解, 用1mol/l naoh调ph至8.0(
±
0.2),于105℃高压蒸汽灭菌20分钟,4℃ 保存备用。因为反复冻融可能
会使基础琼脂营养成分丢失,故建议现配现用。
[0061]
改良fm
‑
4固体培养基:将改良fm
‑
4基础液换成改良fm
‑
4基础琼脂,其 余成分与液体培养基相同。
[0062]
4、各种细菌菌液制备:冻干保存菌或甘油冻存菌取出后,用相应肉汤溶 解冻干粉或待甘油冻存菌解冻,吸取20μl加入相应的肉汤中,置于需氧或 厌氧培养箱及摇床中按相应的条件培养18
‑
20h,待澄清的肉汤变浑浊则判定 为细菌复苏成功。取复苏的菌液在相应琼脂上划线培养2
‑
3代使其活力恢复。 挑取已传2
‑
3代的单菌落接种于相应肉汤中,在37℃、220r/min摇床上 振荡培养5
‑
6h至对数生长期(培养菌液使用比浊仪测试其浊度需达到 1
‑2×
108cfu/ml),即可进行药敏试验。培养菌液也可置于4
‑
8℃冰箱保存24 h备用,但需保证细菌处于对数生长期,否则弃去不用。
[0063]
测定细菌mic时,需将原菌液使用相应肉汤稀释至106cfu/ml,作为测 试菌液。
[0064]
5、各种细菌最小抑菌浓度(mic)和最小杀菌浓度(mbc)测定
[0065]
5.1各种细菌的mic测定
[0066]
采用clsi(vet08,2018)推荐的微量肉汤稀释法测定su3327对各种细 菌的mic。
[0067]
测试各种菌的mic时,先将su3327储备液用相应的肉汤稀释至256μg/ml 作为测试药液。吸取200μl测试药液加入到96孔板第1列孔,吸取100μl 相应的肉汤分别加入96孔板的第2
‑
10列孔。从第1列孔中吸取100μl测 试药液加入到第2列孔,混匀后吸取100μl加入到第3列孔,按上述操作 依次进行到第10列孔,混匀后从10列孔中吸取100μl弃去。如此经二倍 稀释后,第1
‑
10孔的药物浓度依次为256μg/ml、128μg/ml、64μg/ml、 32μg/ml、16μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml、0.5μg/ml。 于96孔板的第1
‑
10列孔中分别加入100μl稀释好的测试菌液混匀,此时 第1
‑
10孔的药物浓度依次为128μg/ml、64μg/ml、32μg/ml、16μg/ml、 8μg/ml、4μg/ml、2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml。最 后在第11列孔加入200μl稀释好的测试菌液作为阳性对照(有菌无药), 在第12列孔加入200μl相应的肉汤作为阴性对照(无菌无药)。加样完毕, 放好板盖用无菌医用胶带密封96孔板,置于37℃培养箱中(其中胸膜肺炎 放线杆菌需5%co2,产气荚膜梭菌需厌氧培养)静置培养20h观察结果。每 次测试设3个重复,以保证试验结果的可靠性。如果初测的mic结果不在上 述药物浓度范围内,则需要重新稀释储备液至合适的药物浓度再次进行mic 测定直至mic结果在稀释的药物浓度范围。
[0068]
结果判定:培养20h后,取出微孔板在衬有黑底板的光线下观察,有细 菌生长孔的肉汤呈弥散状浑浊或u形底部有圆形或丝网状沉淀,无细菌生长 孔的肉汤则澄清透亮。当测试菌的阳性对照孔肉汤有细菌生长,阴性对照孔 肉汤无细菌生长判定测定有效,记录孔内无测试菌生成的最低药物浓度,即 为su3327对测试菌的mic。
[0069]
如果出现单个跳孔,应记录最高的mic值,当出现一个以上跳孔时则结 果无效,需重新试验,直到得到有效结果。每次测定mic时均须同时测定质 控菌株对质控药物的mic,只有测定mic在质控范围内,结果才可信。
[0070]
5.2细菌mbc测定[4,5]
[0071]
mbc的测定:mic结果出来后,吸取mic孔及后面两孔中的液体各100μl 均匀涂布于相应的琼脂平板上,37℃静置培养(其中胸膜肺炎放线杆菌需 5%co2,产气荚膜梭菌需厌氧培养),24h后观察结果。肉眼判断琼脂板上是 否有细菌生长(必要时对细菌进行鉴定),
以板子上无待测目标细菌生长所对 应的药物浓度,作为该细菌的mbc。为保证试验结果的可靠性,试验需进行3 个平行。
[0072]
5.3支原体最小抑菌浓度(mic)和最小杀菌浓度(mbc)测定
[0073]
5.3.1支原体的mic测定
[0074]
参考文献报道[2,3],本试验选用肉汤稀释法测定su3327对支原体的mic。
[0075]
利用改良fm
‑
4肉汤将tmf或aptm储备液稀释至256μg/ml,作为测试 药液。吸取200μl测试药液加入到96孔板第1列孔,吸取100μl改良fm
‑
4 肉汤分别加入96孔板的第2
‑
10列孔。从第1列孔中吸取100μl测试药液 加入到第2列孔,混匀后吸取100μl加入到第3列孔,按上述操作依次进 行到第10列孔,混匀后从10列孔中吸取100μl弃去。如此经二倍稀释后, 第1
‑
10孔的药物浓度依次为256μg/ml、128μg/ml、64μg/ml、32μg/ml、 16μg/ml、8μg/ml、4μg/ml、2μg/ml、1μg/ml、0.5μg/ml。于96 孔板的第1
‑
10列孔中分别加入100μl稀释好的测试菌液混匀,此时第1
‑
10 孔的药物浓度依次为128μg/ml、64μg/ml、32μg/ml、16μg/ml、8μg/ml、 4μg/ml、2μg/ml、1μg/ml、0.5μg/ml、0.25μg/ml。最后在第11 列孔加入200μl稀释好的测试菌液作为阳性对照(有菌无药),在第12列 孔加入200μl改良fm
‑
4肉汤作为阴性对照(无菌无药)。加样完毕,放好 板盖用无菌医用胶带密封96孔板,置于37℃培养箱中培养5d观察结果。 每次测试设3个重复,以保证试验结果的可靠性。如果初测的mic结果不在 上述药物浓度范围内,则需要重新稀释储备液至合适的药物浓度再次进行mic 测定直至mic结果在稀释的药物浓度范围。
[0076]
结果判读:当测试菌的阳性对照孔肉汤变黄,且阴性对照孔肉汤颜色未 发生变化时,记录该测试菌未发生颜色变化孔的最小药物浓度,即为su3327 对支原体的mic。
[0077]
5.3.2支原体的mbc测定
[0078]
mbc的测定:待96孔板培养至颜色不发生变化时从培养箱中取出,移入 无菌操作台,吸取高于mic药物浓度的3个梯度各100μl转入改良fm
‑
4琼 脂平板涂板,37℃,5%co2培养3
‑
7d在倒置显微镜下进行细菌计数。为保证 试验结果的可靠性,试验需进行3个平行。
[0079]
结果判读:以96孔板中培养物颜色不发生变化的最低药物浓度作为mic; 以琼脂板上支原体不能生长的最低药物浓度作为mbc。
[0080]
5.4副猪嗜血杆菌
[0081]
表3 su3327对20株副猪嗜血杆菌的mic和mbc测试结果
[0082][0083][0084]
5.5乳房炎链球菌
[0085]
表4 su3327对20株乳房炎链球菌的mic和mbc测试结果
[0086][0087][0088]
表4中前10株(2jl08
‑
1ldy02)为无乳链球菌,后10株(2wel3
‑
2wey08) 为停乳链球菌。
[0089]
5.6胸膜肺炎放线杆菌
[0090]
表5 su3327对20株胸膜肺炎放线杆菌的mic和mbc测试结果
[0091][0092][0093]
5.7产气荚膜梭菌
[0094]
表6 su3327对20株产气荚膜梭菌的mic和mbc测试结果
[0095][0096][0097]
5.8猪链球菌
[0098]
表7 su3327对20株猪链球菌的mic和mbc测试结果
[0099][0100][0101]
5.9鸡支原体(鸡毒支原体、鸡滑液支原体)
[0102]
表8 su3327对10株鸡支原体的mic和mbc测试结果
[0103][0104][0105]
表8中前5株(1g
‑1‑
2h)为鸡滑液支原体,后5株(m2
‑
m10)为鸡毒支 原体。
[0106]
5.10对副猪嗜血杆菌的体外抑杀菌活性
[0107]
mic测定结果显示(表3),su3327对20株副猪嗜血杆菌的mic范围为 2
‑
16μg/ml,mic
50
和mic
90
的值分别为4μg/ml和16μg/ml。su3327对20 株副猪嗜血杆菌的mbc范围为4
‑
128μg/ml,mbc
50
和mbc
90
的值分别为8μg/ml 和128μg/ml。临床上治疗副猪嗜血杆菌感染的常用抗菌药物有β
‑
内酰胺 类、大环内酯类、四环素类、氟喹诺酮类等[6,7]。黄啸等[8]报道达氟沙星 对143株临床分离副猪嗜血杆菌的mic
50
和mic
90
的值分别为4μg/ml和16 μg/ml。米坤等[9]报道头孢喹肟对131株副猪嗜血杆菌的mic
50
和mic
90
的值 分别为0.125μg/ml和1μg/ml。吴佳琪等[10]报道泰地罗新对74株副猪 嗜血杆菌的mic范围为0.06
‑
8μg/ml,mic
50
为0.5μg/ml,mic
90
为2μg/ml。 zhang等[11]通过微量肉汤稀释法测定了8种常用抗菌药物对244株从健康猪 鼻样本中分离出来的副猪嗜血杆菌的抗菌活性,mic范围显示,阿莫西林/克 拉维酸(浓度比为2:1):0.03
‑
4μg/ml(mic
50
为0.25μg/ml,mic
90
为1 μg/ml);头孢噻呋:0.008
‑
2μg/ml(mic
50
为0.008μg/ml,mic
90
为0.25 μg/ml);恩诺沙星:0.008
‑
16μg/ml(mic
50
为0.25μg/ml,mic
90
为2μg/ml); 氟苯尼考:0.12
‑
32μg/ml(mic
50
为0.5μg/ml,mic
90
为1μg/ml);红霉 素:0.06
‑
256μg/ml(mic
50
为2μg/ml,mic
90
为16μg/ml);替米考星: 0.06
‑
256μg/ml(mic
50
为4μg/ml,mic
90
为64μg/ml);强力霉素: 0.03
‑
16μg/ml(mic
50
为0.5μg/ml,mic
90
为4μg/ml)和四环素: 0.06
‑
32μg/ml(mic
50
为1μg/ml,mic
90
为16μg/ml)。brogden等[12]通 过微量肉汤稀释法测定了24种抗菌药物对来自德国不同地区的124株副猪嗜 血杆菌的抗菌活性。药敏试验显示各种抗菌素(例如新霉素,链霉素,四环 素,泰妙菌素,替米考星,甲氧苄啶/磺胺甲恶唑(浓度比为:1:19)和土拉 霉素)的mic值分布广泛。结果显示,氨苄西林:
0.03
‑
128μg/ml(mic
50
为0.12μg/ml,mic
90
为8μg/ml);阿莫西林/克拉维酸(浓度比为 2:1):0.03
‑
4μg/ml(mic
50
为0.12μg/ml,mic
90
为0.25μg/ml);头孢噻 呋:0.03
‑
0.5μg/ml(mic
50
为≦0.03μg/ml,mic
90
为0.06μg/ml);头孢 喹诺:0.015
‑
1μg/ml(mic
50
为≦0.015μg/ml,mic
90
为0.06μg/ml);头 孢哌酮:0.06
‑
4μg/ml(mic
50
为≦0.06μg/ml,mic
90
为0.12μg/ml);头 孢噻肟:0.015
‑
0.25μg/ml(mic
50
为≦0.015μg/ml,mic
90
为≦0.015μg/ml); 头孢菌素:0.06
‑
8μg/ml(mic
50
为0.5μg/ml,mic
90
为2μg/ml);环丙沙 星:0.008
‑
0.06μg/ml(mic
50
为≦0.008μg/ml,mic
90
为0.015μg/ml); 多粘菌素:0.03
‑
0.5μg/ml(mic
50
为0.12μg/ml,mic
90
为0.12μg/ml); 强力霉素:0.06
‑
4μg/ml(mic
50
为0.25μg/ml,mic
90
为1μg/ml);恩诺 沙星:0.008
‑
4μg/ml(mic
50
为≦0.008μg/ml,mic
90
为0.015μg/ml); 氟苯尼考:0.12
‑
1μg/ml(mic
50
为0.25μg/ml,mic
90
为0.5μg/ml);庆 大霉素:0.12
‑
128μg/ml(mic
50
为1μg/ml,mic
90
为4μg/ml);亚胺培南: 0.015
‑
0.12μg/ml(mic
50
为0.06μg/ml,mic
90
为0.12μg/ml);马波沙星: 0.008
‑
8μg/ml(mic
50
为0.015μg/ml,mic
90
为0.06μg/ml);萘啶酸: 0.12
‑
128μg/ml(mic
50
为1μg/ml,mic
90
为4μg/ml);新霉素:0.25
‑
128 μg/ml(mic
50
为4μg/ml,mic
90
为16μg/ml);青霉素:0.015
‑
64μg/ml (mic
50
为0.25μg/ml,mic
90
为8μg/ml);链霉素:0.5
‑
1024μg/ml(mic
50
为16μg/ml,mic
90
为512μg/ml);泰妙菌素:0.03
‑
32μg/ml(mic
50
为2 μg/ml,mic
90
为8μg/ml);四环素:0.12
‑
64μg/ml(mic
50
为05μg/ml, mic
90
为16μg/ml);替米考星:0.12
‑
64μg/ml(mic
50
为1μg/ml,mic
90
为4μg/ml);甲氧苄啶/磺胺甲恶唑(浓度比为1:19):0.015
‑
64μg/ml(mic
50
为1μg/ml,mic
90
为16μg/ml)和土拉霉素:0.12
‑
32μg/ml(mic
50
为1 μg/ml,mic
90
为4μg/ml)。
[0108]
据报道:副猪嗜血杆菌对替米考星的耐药折点值为16μg/ml[13];氟沙 星对副猪嗜血杆菌的耐药折点值为16μg/ml,泰乐菌素对副猪嗜血杆菌的耐 药折点值为64μg/ml[14]。通过与临床常用药物的抗菌活性,以及副猪嗜血 杆菌对常用药物的耐药折点值与su3327对副猪嗜血杆菌的mic值,可判断 su3327对副猪嗜血杆菌的体外抗菌作用不好,抗菌效果要比氟喹诺酮、头孢 类和氨基糖苷类等常用抗菌药物差,即副猪嗜血杆菌对su3327不敏感。从 su3327对副猪嗜血杆菌的mbc值可知,su3327对部分副猪嗜血杆菌表现出明 显的高浓度杀菌作用,对部分菌株杀菌作用比较差,需要高浓度的药物才能 将菌株杀死。
[0109]
5.12对乳房炎链球菌(无乳链球菌、停乳链球菌)的体外抑杀菌活性
[0110]
mic测定结果显示(表4),su3327对20株乳房炎链球菌的mic范围为 4
‑
32μg/ml,mic
50
和mic
90
的值均为16μg/ml。su3327对20株乳房炎链球 菌的mbc范围为32
‑
256μg/ml,mbc
50
和mbc
90
的值均为128μg/ml。临床上 治疗猪链球菌的主要抗菌药物有β
‑
内酰胺类、氟喹诺酮类、大环内酯类等 [15,16]。bolte等[17]研究了德国北部58个奶牛场的临床乳腺炎病例中常见 乳腺炎病原体对常规使用抗菌药物的敏感性,结果显示:常见抗菌药物对51 株临床分离无乳链球菌的mic范围分别为:头孢喹诺:≦0.06
‑
0.125μg/ml; 头孢哌酮:0.125
‑
0.5μg/ml;头孢匹林:0.25
‑
0.5μg/ml;青霉素: ≦0.06
‑
0.125μg/ml;氯唑西林:1
‑
2μg/ml;奥沙西林:0.5
‑
1μg/ml; 阿莫西林/克拉维酸(浓度比为4:1):0.25
‑
1μg/ml;头孢氨苄/卡那霉素(浓 度比为2:1):均为4μg/ml。对54株临床分离停乳链球菌的mic范围分别 为:头孢喹诺:≦0.06
‑
2μg/ml;头孢哌酮:0.125
‑
16μg/ml;头孢匹林: ≦0.06
‑
2μg/ml;青霉素:≦0.06
‑
8μg/ml;氯唑西林:≦0.06
‑
32μg/ml; 奥沙西林:≦0.06
‑
32μg/ml;阿莫西林/克拉维酸(浓度比为4:1):≦0.06
‑
4 μg/ml;头孢氨苄/卡那霉素(浓度比为2:1):0.25
‑
4μg/ml,此外50株临 床分离乳腺炎链球菌中只有少数1、2分别对头孢皮林和头孢氨苄/卡那霉
素 (浓度比为2:1)的mic值达到>32μg/ml,其余的菌株的mic值均保持相对 较低的水平,主要集中在≦0.06
‑
4μg/ml。garch等[18]通过微量肉汤稀释 法测定了常见抗菌药物对208株临床分离乳房链球菌的mic范围,结果显示, 阿莫西林、阿莫西林/克拉维酸(浓度比为2:1)、氨苄西林对乳腺炎链球菌比 较敏感,mic范围为≦0.03
‑
1μg/ml,对头孢唑林、头孢氨苄、头孢皮林和 头孢喹诺mic
50
范围为0.06
‑
0.5μg/ml,mic
90
范围为0.06
‑
0.5μg/ml。对 达氟沙星、诺氟沙星和马波沙星的mic
50
和mic
90
范围分别是0.5
‑
1μg/ml和 1
‑
2μg/ml。对红霉素、泰乐菌素的mic较高,对红霉素的mic
50
和mic
90
分别 是0.06μg/ml和>64μg/ml,对泰乐菌素的mic
50
和mic
90
分别为1μg/ml 和>64μg/ml。
[0111]
2018版clsi推荐标准[1],猪链球菌对氨苄西林的耐药折点为2μg/ml; 对青霉素g的耐药折点为1μg/ml;对头孢噻呋的耐药折点为8μg/ml;对 恩诺沙星的耐药折点为2μg/ml;对氟苯尼考的耐药折点为8μg/ml;对四 环素的耐药折点为2μg/ml;据报道猪链球菌对头孢喹肟耐药临界值为1 μg/ml[19]。通过与临床常用药物的抗菌活性,以及乳房炎链球菌对常用药 物的耐药折点值与su3327对乳房炎链球菌的mic值,可判断su3327对乳房 炎链球菌的体外抗菌作用不好,抗菌效果要比氟喹诺酮、头孢类和β-内酰 胺类等常用抗菌药物差,即乳房炎链球菌对su3327不敏感。从su3327对乳 房炎链球菌的mbc值可知,su3327对部分乳房炎链球菌表现出明显的高浓度 杀菌作用,对部分菌株杀菌作用比较差,需要高浓度的药物才能将菌株杀死。
[0112]
5.13对胸膜肺炎放线杆菌的体外抑杀菌活性
[0113]
mic测定结果显示(表5),su3327对20株胸膜肺炎放线杆菌的mic范围 为0.25
‑
8μg/ml,mic
50
和mic
90
的值分别为1μg/ml和2μg/ml。su3327 对20株胸膜肺炎放线杆菌的mbc范围为0.25
‑
16μg/ml,mbc
50
和mbc
90
的值 分别为1μg/ml和4μg/ml。临床上治疗胸膜肺炎放线杆菌感染的常用抗菌 药有氨基糖苷类、大环内酯类、林可霉素类、喹恶啉类、β
‑
内酰胺类、林可 霉素类、截短侧耳素等[20,21]。据[10]报道泰地罗新对39株胸膜肺炎放线 杆菌的mic范围为2
‑
32μg/ml,mic
50
为4μg/ml,mic
90
为16μg/ml。sun 等[45]通过微量肉汤稀释法测定了头孢噻呋对135株临床分离胸膜肺炎放线 杆菌的抗菌活性,其mic范围是0.0075
‑
2μg/ml,mic
50
为0.015μg/ml, mic
90
为0.5μg/ml。blondeau等[22]报道了恩诺沙星,头孢噻呋,氟苯尼考, 替米考星和土拉霉素对67株临床分离胸膜肺炎放线杆菌的抗菌活性。结果显 示上述5种抗菌药物对胸膜肺炎放线菌的mic范围是:恩诺沙星: ≦0.016
‑
0.063μg/ml(mic
50
为≦0.016μg/ml,mic
90
为0.031μg/ml); 头孢噻呋:均为≦0.016μg/ml(mic
50
和mic
90均
为≦0.016μg/ml);氟苯尼 考:0.25
‑
1(mic
50
和mic
90均
为0.5μg/ml);替米考星:1
‑
8(mic
50
为2μg/ml, mic
90
为4μg/ml);土拉霉素:0.5
‑
8(mic
50
为1μg/ml,mic
90
为2μg/ml)。 vilar
ó
等[23]报道了10种常用抗菌药物对162株临床分离胸膜肺炎放线杆菌 的抗菌活性,mic范围依次为阿莫西林:0.063
‑
8μg/ml(mic
50
为0.25μg/ml, mic
90
为16μg/ml);头孢噻呋:0.063
‑
0.125μg/ml(mic
50
为0.06μg/ml, mic
90
为0.06μg/ml);强力霉素:0.031
‑
4μg/ml(mic
50
为1μg/ml,mic
90
为4μg/ml);恩诺沙星:0.125
‑
16μg/ml(mic
50
为0.06μg/ml,mic
90
为 1μg/ml);氟苯尼考:0.063
‑
8μg/ml(mic
50
为0.25μg/ml,mic
90
为0.25 μg/ml);磺胺甲恶唑/甲氧苄啶(浓度比为19:1):0.063
‑
8μg/ml(mic
50
为0.125μg/ml,mic
90
为2μg/ml);泰妙菌素:1
‑
64μg/ml(mic
50
为16 μg/ml,mic
90
为16μg/ml);泰地罗新:2
‑
32μg/ml(mic
50
为4μg/ml, mic
90
为8μg/ml);替米考星:8
‑
64μg/ml(mic
50
为8μg/ml,mic
90
为16 μg/ml)和土拉霉素:4
‑
64μg/ml(mic
50
为32μ
g/ml,mic
90
为64μg/ml)。
[0114]
2018版clsi推荐标准[1],胸膜肺炎放线杆菌对氨苄西林的耐药折点值 为2μg/ml;胸膜肺炎放线杆菌对头孢噻呋的耐药折点值分别为8μg/ml。 胸膜肺炎放线杆菌对替米考星的耐药折点值为32μg/ml;胸膜肺炎放线杆菌 对氟苯尼考的耐药折点值为8μg/ml。通过与临床常用药物的抗菌活性,以 及胸膜肺炎放线杆菌对常用药物的耐药折点值与su3327对乳房炎链球菌的 mic值,可判断su3327对胸膜肺炎放线杆菌的体外抗菌作用较好,抗菌效果 要比大环内酯类(比如泰妙菌素、土拉霉素、泰地罗新)等常用抗菌药物好, 即胸膜肺炎放线杆菌对su3327比较敏感。可判断su3327对胸膜肺炎放线杆 菌有较好的体外抗菌作用,即胸膜肺炎放线杆菌对su3327很敏感。从su3327 对胸膜肺炎放线杆菌的mbc值可知,su3327对胸膜肺炎放线杆菌表现出明显 的低浓度杀菌作用,对菌株杀菌作用比较好,在较低的药物浓度下就能将菌 株杀死。
[0115]
5.14对产气荚膜梭菌的体外抑杀菌活性
[0116]
mic测定结果显示(表6),su3327对20株产气荚膜梭菌的mic范围为 0.125
‑
0.25μg/ml,mic
50
和mic
90
的值分别为0.125μg/ml和0.25μg/ml。 su3327对20株产气荚膜梭菌的mbc范围为0.25
‑
1μg/ml,mbc
50
和mbc
90
的 值分别为0.25μg/ml和0.5μg/ml。临床上治疗产气荚膜梭菌感染的常用 抗菌药物有β
‑
内酰胺类、林可酰胺类、氟喹诺酮类、多肽类、磺胺类[24,25]。 张娜[26]报道羊源产气荚膜梭菌对磺胺异恶唑的平均mic值为438.81 μg/ml,多西环素的平均mic值为1.31μg/ml,氟苯尼考的平均mic值为 11.31μg/ml,庆大霉素的平均mic值为57.44μg/ml,替米考星的平均mic 值为38.97μg/ml,阿维拉霉素的平均mic值为0.89μg/ml。li等[27]通 过微量肉汤稀释法测定了27种抗菌药物对322株产气荚膜梭菌(鸡源60株, 猪源262株)的敏感性,药敏试验显示mic
50
和mic
90
的值分别为:青霉素:0.5 μg/ml和4μg/ml;奥沙西林:1μg/ml和4μg/ml;阿莫西林/克拉维酸: ≦0.06μg/ml和1μg/ml;头孢西丁:1μg/ml和8μg/ml;头孢噻呋: 2μg/ml和16μg/ml;四环素:4μg/ml和32μg/ml;强力霉素:2μg/ml 和8μg/ml;氟苯尼考:2μg/ml和4μg/ml;红霉素:4μg/ml和>256μg/ml; 替米考星:4μg/ml和128μg/ml;泰妙菌素:2μg/ml和64μg/ml;庆 大霉素:64μg/ml和>2048μg/ml;氧氟沙星:0.5μg/ml和8μg/ml; 恩诺沙星:0.12μg/ml和4μg/ml;磺胺异恶唑:>512μg/ml和>512μg/ml; 甲氧苄氨嘧啶/磺胺甲恶唑(浓度比为1:19):>16μg/ml和>16μg/ml;万 古霉素:≦0.25μg/ml和0.5μg/ml;克林霉素:1μg/ml和128μg/ml; 利奈唑胺:1μg/ml和4μg/ml;吉他霉素:1μg/ml和16μg/ml;黄霉 素:>512μg/ml和>512μg/ml;恩拉霉素:0.12μg/ml和32μg/ml;喹 烯酮:1μg/ml和16μg/ml;诺西肽:0.06μg/ml和0.25μg/ml;阿维 拉霉素:0.12μg/ml和1μg/ml;维吉尼霉素:0.25μg/ml和8μg/ml和 杆菌肽:≦4μg/ml和8μg/ml。wei等[28]报道了17种抗菌药物对162株 鸡产气荚膜梭菌的抗菌活性,其mic
50
和mic
90
分别为青霉素:≤0.06和0.25 μg/ml;氨苄西林:≤0.12和0.25μg/ml;奥沙西林:≤0.25和≤0.25μg/ml; 庆大霉素:≥16和≥16μg/ml;大观霉素:≥128和≥128μg/ml;四环素: 4和≥16μg/ml;泰乐菌素:≤2和≥16μg/ml;红霉素:4和≥16μg/ml; 氟苯尼考:1和2μg/ml;杆菌肽:1和32μg/ml;恩诺沙星:1和≥32μg/ml; 克林霉素:2和≥8μg/ml;维吉尼霉素:4和8μg/ml;莫能菌素:1和2μg/ml; 盐霉素:0.25和0.25μg/ml;马杜拉霉素:0.25和0.5μg/ml;甲氧苄啶 /磺胺甲恶唑(浓度比为1:19):4/76和4/76μg/ml。
[0117]
据报道猪产气荚膜梭菌对阿维拉霉素的耐药折点值为0.25μg/ml[29]; 鸡产气荚
膜梭菌对阿维拉霉素的耐药折点值为0.25μg/ml[30];兔产气荚膜 梭菌对沃尼妙林的耐药折点值为0.25μg/ml[31]。通过与临床常用药物的抗 菌活性,以及产气荚膜梭菌对常用药物的耐药折点值与su3327对产气荚膜梭 菌的mic值,可判断su3327对产气荚膜梭菌的体外抗菌作用较好,抗菌效果 要比头孢类、大环内酯类、磺胺类等常用抗菌药物好,即胸膜肺炎放线杆菌 对su3327比较敏感。可判断su3327对胸膜肺炎放线杆菌有较好的体外抗菌 作用。从su3327对产气荚膜梭菌的mbc值可知,su3327对产气荚膜梭菌表现 出明显的低浓度杀菌作用,对菌株杀菌作用比较好,在较低的药物浓度下就 能将菌株杀死。
[0118]
5.15对猪链球菌的体外抑杀菌活性
[0119]
mic测定结果显示(表7),su3327对20株猪链球菌的mic范围为2
‑
32 μg/ml,mic
50
和mic
90
的值分别为8μg/ml和16μg/ml。su3327对20株猪 链球菌的mbc范围为2
‑
128μg/ml,mbc
50
和mbc
90
的值分别为8μg/ml和32 μg/ml。临床上治疗猪链球菌的主要抗菌药物有β
‑
内酰胺类、氟喹诺酮类、 大环内酯类等[32]。芮萍等[33]报道了几种常用抗菌药物对34株猪链球菌的 mic
50
和mic
90
的值分别为阿莫西林:0.25μg/ml和4μg/ml;头孢噻呋:1 μg/ml和4μg/ml;泰乐菌素:64μg/ml和256μg/ml;替米考星:16μg/ml 和256μg/ml;环丙沙星:0.5μg/ml和64μg/ml;诺氟沙星:8μg/ml 和256μg/ml;恩诺沙星:1μg/ml和64μg/ml;磺胺甲恶唑:均为1024 μg/ml。hout等[34]通过微量肉汤稀释法测定了15种抗菌药物对1163株临 床分离猪链球菌的抗菌药物敏感性,其mic
50
和mic
90
分别为:阿莫西林/克拉 维酸(浓度比为2:1):为≤0.25和≦0.25μg/ml;氨苄西林:≤0.0625和 ≤0.0625μg/ml;头孢吡肟:≤0.5和≤0.5μg/ml;头孢噻呋:≤0.25和 ≦0.25μg/ml;克林霉素:≦0.25和≥8μg/ml;恩诺沙星:≦0.25和0.5 μg/ml;红霉素:≤0.125和16μg/ml;氟苯尼考:≦2和≦2μg/ml;新 霉素:16和≧32μg/ml;奥沙西林:≤0.25和≦0.25μg/ml;青霉素: ≤0.0625和≤0.0625μg/ml;磺胺甲恶唑:≧1024和≥1024μg/ml;甲氧 苄啶/磺胺甲恶唑(浓度比为1:19):0.25和0.5μg/ml;四环素:16和≧32 μg/ml和替米考星:32和≧64μg/ml。holmer等[35]报道了常用抗菌药物 对152株猪链球菌的mic值,其mic范围为四环素:0.5
‑
64μg/ml(mic
50
为4μg/ml,mic
90
为>32μg/ml);氯霉素:2
‑
8μg/ml(mic
50
为4μg/ml, mic
90
为4μg/ml);氟苯尼考:1
‑
4μg/ml(mic
50
为2μg/ml,mic
90
为2μg/ml); 青霉素:0.06
‑
1μg/ml(mic
50
为≦0.06μg/ml,mic
90
为0.125μg/ml); 甲氧苄啶:0.5
‑
64μg/ml(mic
50
为≦0.5μg/ml,mic
90
为8μg/ml);磺胺 甲氧苄啶:0.25
‑
32μg/ml(mic
50
为≦0.25μg/ml,mic
90
为2μg/ml);红 霉素:0.25
‑
32μg/ml(mic
50
为≦0.25μg/ml,mic
90
为>16μg/ml);链霉 素:4
‑
128μg/ml(mic
50
为16μg/ml,mic
90
为>648μg/ml);大观霉素: 16
‑
512μg/ml(mic
50
为≦16μg/ml,mic
90
为>256μg/ml)和泰妙菌素:0.25
‑
64 μg/ml(mic
50
为≦2μg/ml,mic
90
为32μg/ml)。
[0120]
2018版clsi推荐标准[1],猪链球菌对氨苄西林的耐药折点为2μg/ml; 对青霉素g的耐药折点为1μg/ml;对头孢噻呋的耐药折点为8μg/ml;对 恩诺沙星的耐药折点为2μg/ml;对氟苯尼考的耐药折点为8μg/ml;对四 环素的耐药折点为2μg/ml;据报道猪链球菌对头孢喹肟耐药临界值为1 μg/ml[19]。通过与临床常用药物的抗菌活性,以及猪链球菌对常用药物的 耐药折点值与su3327对猪链球菌的mic值,可判断su3327对猪链球菌的体 外抗菌作用不好,抗菌效果要比头孢类、大环内酯类、氟喹诺酮类等常用抗 菌药物差,即猪链球菌对su3327不敏感。从su3327对猪链球菌的mbc值可 知,su3327对大部分猪链球菌表现出高浓度杀菌作用。
c5h4n5o2s3(m+h)261.9522,found261.9515。
[0129]
上述技术方案中的参考文献如下:
[0130]
[1]clsi.performancestandardsforantimicrobialdiskanddilutionsusceptibilitytestsforbacteriaisolatedfromanimals,approvedstandard—4thedition.clsidocumentvet
‑
08wayne,pa:clinicalandlaboratorystandardsinstitute;2018.
[0131]
[2]郭伟娜.鸡毒霉形体不同菌株的药敏实验及耐药机制的研究[d].华中农业大学,2007.
[0132]
[3]gautier
‑
bouchardonav.antimicrobialresistanceinmycoplasmaspp[j].microbiolspectr,2018,6(4).
[0133]
[4]yilmazmt.minimuminhibitoryandminimumbactericidalconcentrationsofboroncompoundsagainstseveralbacterialstrains[j].turkishjournalofmedicalsciences,2012,42(9):1423
‑
1429.
[0134]
[5]takamasa,watanabe,yoshiaki,etal.systematicanalysisofselectivebactericidalactivityoffattyacidsagainststaphylococcusaureuswithminimuminhibitoryconcentrationandminimumbactericidalconcentration[j].journalofoleoscience,2019.
[0135]
[6]guol,zhangj,xuc,etal.molecularcharacterizationoffluoroquinoloneresistanceinisolatedfrompigsinsouthchina[j].journalofantimicrobialchemotherapy,2011,66(3):p.539
‑
542.
[0136]
[7]nedbalcov
á
k,zouharov
á
m,d.thedeterminationofminimuminhibitoryconcentrationsofselectedantimicrobialsforporcinehaemophilusparasuisisolatesfromtheczechrepublic[j].actaveterinariabrno,2017,86(2):175
‑
181.
[0137]
[8]黄啸,徐紫慧,黄玲利,等.副猪嗜血杆菌对达氟沙星的耐药判定标准研究[c]//中国畜牧兽医学会兽医药理毒理学分会第十五次学术讨论会.2019.
[0138]
[9]米坤,孙达,郝海红,等.副猪嗜血杆菌对头孢喹肟耐药判定标准的建立[c]//中国畜牧兽医学会兽医药理毒理学分会第十五次学术讨论会.2019.
[0139]
[10]吴佳琪.泰地罗新注射液对猪自然感染呼吸道疾病的临床药效试验[d].华南农业大学,2018.
[0140]
[11]zhangp,zhangc,aragonv,etal.investigationofhaemophilusparasuisfromhealthypigsinchina[j].veterinarymicrobiology,2019,231:40
‑
44.
[0141]
[12]asb,aap,brt,etal.antimicrobialsusceptibilityofhaemophilusparasuisisolatesfromgermanybyuseofaproposedstandardmethodforharmonizedtesting
‑
sciencedirect[j].veterinarymicrobiology,2018,217:32
‑
35.
[0142]
[13]张朋.副猪嗜血杆菌对替米考星野生型折点和药效学折点研究[d],华中农业大学,2015.
[0143]
[14]徐紫慧.副猪嗜血杆菌对达氟沙星和泰乐菌素的耐药判定标准研究[d],华中农业大学,2018.
[0144]
[15]hillertoncje,mrcvseabb,.themanagementandtreatmentofenvironmentalstreptococcalmastitis[j].veterinaryclinicsofnorthamerica:foodanimalpractice,2003,19(1):157
‑
169.
[0145]
[16]vgu
é
rin
‑
faubl
é
e,tardyf,bouveronc,etal.antimicrobialsusceptibilityofstreptococcusspeciesisolatedfromclinicalmastitisindairycows[j].internationaljournalofantimicrobialagents,2002,19(3):219
‑
226.
[0146]
[17]bolte,zhang,wente,etal.invitrosusceptibilityofmastitispathogensisolatedfromclinicalmastitiscasesonnortherngermandairyfarms[j].veterinarysciences,2020,7(1):10.
[0147]
[18]garchfe,youalam,simjees,etal.antimicrobialsusceptibilityofnineudderpathogensrecoveredfrombovineclinicalmastitismilkineurope2015
–
2016:vetpathresults[j].veterinarymicrobiology,2020,245:108644.
[0148]
[19]李梅.猪链球菌对头孢喹肟耐药判定标准研究[d],华中农业大学,2018.
[0149]
[20]张玉果,付亚峰.氟苯尼考治疗猪传染性胸膜肺炎放线杆菌的临床应用[j].今日畜牧兽医,2013,000(011):13
‑
14.
[0150]
[21]孔兴旺.猪传染性胸膜肺炎放线杆菌鉴定与耐药性试验[j].兽医导刊,2017.
[0151]
[22]blondeaujm,fitchsd,singerac.mutantpreventionandminimuminhibitoryconcentrationdrugvaluesforenrofloxacin,ceftiofur,florfenicol,tilmicosinandtulathromycintestedagainstswinepathogensactinobacilluspleuropneumoniae,pasteurellamultocidaandstreptococcussuis[j].plosone,2019,14(1).
[0152]
[23]vilar
ó
a,novelle,enrique
‑
taranc
ó
nv,etal.antimicrobialsusceptibilitypatternofporcinerespiratorybacteriainspain.[j].antibiotics(basel),2020,9:undefined.
[0153]
[24]devriesela,daubeg,hommezj,etal.invitrosusceptibilityofclostridiumperfringensisolatedfromfarmanimalstogrowth
‑
enhancingantibiotics.[j].journalofappliedmicrobiology,2010,75(1):55
‑
57.
[0154]
[25]walkerhn,liewkc,adamsv,etal.necrotisingenterocolitiscausedbyclostridiumperfringens:alife
‑
threateningmanifestationofacommonfoodborneinfection[j].themedicaljournalofaustralia,2020.
[0155]
[26]张娜.羊源产气荚膜梭菌的分离鉴定及耐药性分析[d].西北农林科技大学,2019.
[0156]
[27]lijy,zhouyq,yangdw,etal.prevalenceandantimicrobialsusceptibilityofclostridiumperfringensinchickensandpigsfrombeijingandshanxi,china[j].vetmicrobiol,2020,252:108932.
[0157]
[28]weib,chasy,zhangjf,etal.antimicrobialsusceptibilityandassociationwithtoxindeterminantsinclostridiumperfringensisolatesfromchickens[j].microorganisms,2020,8(11):1825.
[0158]
[29]罗迅.猪产气荚膜梭菌对阿维拉霉素和安普霉素的敏感性折点研究[d],华中农业大学,2018.
[0159]
[30]房诗薇.鸡产气荚膜梭菌对阿维拉霉素的耐药判定标准研究[d],华中农业大学,2019.
[0160]
[31]taomt,zhouyf,sunj,etal.establishmentofvalnemulinsusceptibilitybreakpointagainstclostridiumperfringensinrabbits.[j].anaerobe,2017:s1075996417301658.
[0161]
[32]martela,baelem,devriesela,etal.prevalenceandmechanismofresistanceagainstmacrolidesandlincosamidesinstreptococcussuisisolates.[j].veterinarymicrobiology,2001,83(3):287
‑
297.
[0162]
[33]芮萍,陈翠珍,段玲欣,等.猪链球菌河北分离株对常用抗菌药物的耐药性[j].中国兽医杂志,2012,48(002):75
‑
77.
[0163]
[34]houtjv,heuvelinka,gonggrijpm.monitoringofantimicrobialsusceptibilityofstreptococcussuisinthenetherlands,2013
–
2015[j].veterinarymicrobiology,2016,194:5
‑
10.
[0164]
[35]nanz,xiaomeiy,yuzhiw,etal.determinationofthemutantselectionwindowandevaluationofthekillingofmycoplasmagallisepticumbydanofloxacin,doxycycline,tilmicosin,tylvalosinandvalnemulin[j].plosone,2017,12(1):e0169134.
[0165]
[36]隋兆峰,张侃吉,徐建义,等.山东地区鸡毒支原体分离鉴定及耐药性监测[j].中国家禽,2016,38(014):51
‑
54.
[0166]
[37]emamm,hashemym,el
‑
haririm,etal.detectionandantibioticresistanceofmycoplasmagallisepticumandmycoplasmasynoviaeamongchickenflocksinegypt[j].veterinaryworld,13(7).
[0167]
[38]jongad,youalam,kleinu,etal.minimalinhibitoryconcentrationofsevenantimicrobialstomycoplasmagallisepticumandmycoplasmasynoviaeisolatesfromsixeuropeancountries[j].avianpathology,2020:1
‑
28.
[0168]
[39]王淑歌.鸡毒支原体对达氟沙星的耐药判定标准研究[d],华中农业大学,2019.
[0169]
[40]黄安雄.鸡毒支原体对泰乐菌素的耐药判定标准研究[d],华中农业大学,2019.
[0170]
本发明虽然以较佳实施例公开如上,但其并不是用来限定本发明,任何本领域技术人员在不脱离本发明的精神和范围内,都可以做出可能的变动和修改,因此本发明的保护范围应当以本发明权利要求所界定的范围为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1