一种无细胞翻译体系、方法及产物
1.本技术属于分子生物学领域,尤其涉及一种无细胞翻译体系、方法及产物。
背景技术:
2.基因表达的最终产物除了非编码rna之外主要以蛋白质的形式存在,现有的蛋白质表达技术主要有原核细菌表达,真核昆虫细胞表达、人源工程化细胞表达。本发明发明人发现:原核细胞表达的主要优势是成本低廉,但很多蛋白在原核中不能表达;真核细胞表达效率较高,但目前存在成本高昂,时间周期较长的问题;现有细胞外翻译技术由于存在活性低、效率低、经济性差等问题。
技术实现要素:
3.本发明研究人员通过研究发现,5'端“帽子”结构作用:
4.(1)稳定mrna的一级结构,防止mrna被5'
‑
核酸外切酶所水解;
5.(2)为mrna识别核糖体提供信号,使mrna较快地与核糖体结合,以提高mrna对蛋白质的合成效率;
6.3'端polya尾巴结构的功能
7.(1)有助于mrna从细胞核向细胞质转移;
8.(2)对蛋白质的合成速度有影响;
9.(3)与保护mrna的稳定性和维持mrna的二级结构有关。
10.进一步地,本发明研究人员通过研究发现,真核细胞mrna在细胞外翻译存在效率较低问题,主要受制于酶体系:mrna翻译需要复杂的酶体系,人工组合酶体系往往难以完全切合细胞内真实体系组成,因而制约细胞外翻译效率。
11.进一步地,本发明研究人员通过研究发现,真核细胞mrna在细胞外翻译存在效率较低问题,主要还受制于供能体系:使用真核细胞裂解液提供全酶体系下使用常用atp,依然无法获得较高翻译效率,其原因在于真核细胞mrna翻译供能和原核生物不同,除了atp外还需要鸟苷三磷酸和磷酸肌酸等供能物质。
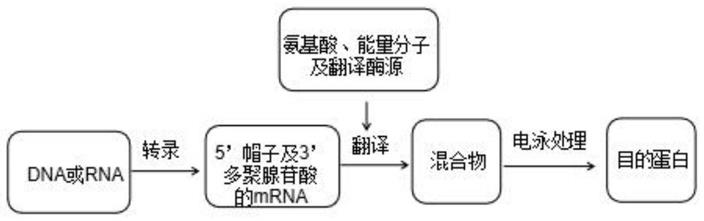
12.本发明实施方式的目的在于提供一种无细胞翻译体系,包含:5’帽子及3’多聚腺苷酸的mrna、氨基酸混合物、能量分子、mrna翻译酶源;所述能量分子包含磷酸肌酸。
13.所述能量分子还包括atp和鸟苷三磷酸(gtp)。
14.优选的,所述mrna翻译酶源包含真核细胞裂解上清液;所述氨基酸混合物包含丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的混合物。
15.优选的,所述mrna翻译酶源包含真核细胞裂解上清液。
16.一种无细胞翻译方法,包含以上翻译体系,包含以下步骤:
17.步骤(1)转录具有5’帽子及3’多聚腺苷酸的mrna;
18.步骤(2)向反应容器内加入所述mrna、氨基酸混合物、能量分子及mrna翻译酶源,反应制得含有目的蛋白的混合溶液一;
19.步骤(3)将所述混合溶液一处理得目的蛋白。
20.优选的,所述能量分子包括atp、磷酸肌酸和鸟苷三磷酸(gtp);优选的,所述mrna翻译酶源包含真核细胞裂解上清液,所述真核细胞裂解上清液由真核细胞裂解离心制得。
21.优选的,所述步骤(2)所述反应条件为温度35
‑
39℃下反应10
‑
120min。
22.优选的,所述步骤(3)处理方法包括凝胶电泳分析。
23.优选的,下述实施例中所有操作均应在低温下进行,除步骤(2)反应之外的其他操作尽量在冰上进行。
24.一种无细胞翻译产物,由上述翻译体系及上述翻译方法制备。
25.rna反应体系包含a、u、c、g核糖酸单体、atp、相应的dna双链和rna聚合酶。
26.优选的,加入必要的缓冲液。
27.有益效果包括:
28.本发明提供一种无细胞翻译体系、方法及产物,具有以下特点:1.采用细胞外翻译技术克服了原核细胞表达部分基因不能表达问题;2.采用细胞外翻译技术克服了真核细胞表达周期长效率低问题;3.采用添加磷酸肌酸等能量小分子的策略优化了原有细胞外翻译技术的活性低、效率差问题;4.采用5’帽子及3’多聚腺苷酸的mrna增强稳定性和与受体结合速度及整体翻译速度。
附图说明
29.图1为无细胞翻译方法流程图;
30.图2为实施例5无细胞翻译产物电泳分析图;
31.图3为实施例3无细胞翻译产物数量分析图;
32.图4为对比例2无细胞翻译产物数量分析图;
33.图5为对比例3无细胞翻译产物数量分析图。
具体实施方式
34.下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护范围。
35.一种无细胞翻译体系,包含:5’帽子及3’多聚腺苷酸的mrna、氨基酸混合物、能量分子及mrna翻译酶源的混合物;所述能量分子包含磷酸肌酸。
36.所述能量分子还包括atp和鸟苷三磷酸(gtp)。
37.优选的,所述mrna翻译酶源包含真核细胞裂解上清液;包含丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酰胺、谷氨酸、甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的混合物。
38.一种无细胞翻译方法,包含以上翻译体系,包含以下步骤:
39.步骤(1)转录具有5’帽子及3’多聚腺苷酸的mrna;
40.步骤(2)向反应容器内加入所述mrna、氨基酸混合物、atp及mrna翻译酶源,反应制
得含有目的蛋白的混合溶液一;
41.步骤(3)将所述混合溶液一处理得目的蛋白。
42.优选的,步骤(2)还需加入鸟苷三磷酸(gtp);所述mrna翻译酶源包含真核细胞裂解上清液,所述真核细胞裂解上清液由真核细胞裂解离心制得。
43.优选的,所述步骤(2)所述反应条件为温度35
‑
39℃下反应10
‑
120min。
44.优选的,所述步骤(3)处理方法包括凝胶电泳分析。
45.一种无细胞翻译产物,由上述翻译体系及上述翻译方法制备。
46.rna反应体系包含a、u、c、g核糖酸单体、atp、相应的dna双链和rna聚合酶。
47.优选的,加入必要的缓冲液
48.为了更好地说明所述无细胞翻译产物的有益效果,本实施例还公开了一种原核细胞内基因导入技术,所述方法为逆转录病毒为载体介导转染方法,选用一种噬菌体病毒用于原核细胞基因基因转入。
49.为了更好地说明所述无细胞翻译产物的有益效果,本实施例还公开了一种真核核细胞内基因导入技术,所述方法为逆转录病毒为载体介导转染方法,选用噬菌体病毒或相应动植物病毒用于真核细胞基因基因转入。
50.为了更好地说明所述无细胞翻译产物的有益效果,本实施例还公开了一种电泳分析蛋白方法,sds
‑
聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进sds(十二烷基磺酸钠),sds能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还原剂的sds溶液中,与sds分子按比例结合,形成带负电荷的sds
‑
蛋白质复合物,这种复合物由于结合大量的sds,使蛋白质丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间天然的电荷差异,由于sds与蛋白质的结合是按重量成比例的,因此在进行电泳时,蛋白质分子的迁移速度取决于分子大小。sds电泳的成功关键之一是电泳过程中,待别是样品制备过程中蛋白质与sds的结合程度,具体操作如下:
51.(1)将玻璃板用蒸馏水洗净晾干,准备2个干净的锥形瓶;
52.(2)把玻璃板在灌胶支架上固定好固定玻璃板时,两边用力一定要均匀,防止夹坏玻璃板;
53.(3)按比例配好分离胶,用移液管快速加入,大约5厘米左右,之后加少许蒸馏水,静置40分钟;
54.(4)凝胶配制过程要迅速,催化剂temed要在注胶前再加入,否则凝结无法注胶,注胶过程最好一次性完成,避免产生气泡;
55.(5)水封的目的是为了使分离胶上延平直,并排除气泡,凝胶聚合好的标志是胶与水层之间形成清晰的界面;
56.(6)倒出水并用滤纸把剩余的水分吸干,按比例配好浓缩胶,连续平稳加入浓缩胶至离边缘5mm处,迅速插入样梳,静置40分钟;
57.(7)样梳需一次平稳插入,梳口处不得有气泡,梳底需水平;
58.(8)拔出样梳后,在上槽内加入缓冲液,没过锯齿时可拆去底端的琼脂糖;
59.(9)要使锯齿孔内的气泡全部排出,否则会影响加样效果;
60.(10)加样三个,1)取10μl标准蛋白溶解液于ep管内,再加入10μl 2倍样品缓冲液,
上样量为20μl;2)取10μl样品1溶液,再加入10μl 2倍样品缓冲液,上样量分别为5μl和10μl;
61.(11)用微量注射器距槽底三分之一处进样,加样前样品在沸水中加热3分钟,去掉亚稳态聚合;注射器不可过低,以防刺破胶体,也不可过高,在样下沉时会发生扩散;
62.(12)为避免边缘效应,最好选用中部的孔注样,电泳槽中加入缓冲液,接通电源,进行电泳,开始电流恒定在10ma,当进入分离胶后改为20ma,溴酚蓝距凝胶边缘约5mm时,停止电泳;
63.(13)凝胶板剥离与染色:电泳结束后,撬开玻璃板,将凝胶板做好标记后放在大培养皿内,加入染色液,染色1小时左右;
64.(14)脱色,染色后的凝胶板用蒸馏水漂洗数次,再用脱色液脱色,直到蛋白质区带清晰;剥胶时要小心,保持胶完好无损,染色要充分;
65.(15)实验结果分析。
66.在一些可选的实施例,采用细胞外翻译技术克服了原核细胞表达部分基因不能表达问题;
67.在一些可选的实施例,采用细胞外翻译技术克服了真核细胞表达周期长效率低问题;
68.在一些可选的实施例,采用添加磷酸肌酸等能量小分子的策略优化了原有细胞外翻译技术的活性低、效率差问题;
69.在一些可选的实施例,采用5’帽子及3’多聚腺苷酸的mrna增强稳定性和与受体结合速度及整体翻译速度。
70.实施例1
71.在已公开实施例基础上,公开了一种无细胞翻译体系,包含:5’帽子及3’多聚腺苷酸的mrna、氨基酸混合物、atp及mrna翻译混合物。
72.所述翻译体系,还包括鸟苷三磷酸(gtp)。
73.优选的,所述5’帽子及3’多聚腺苷酸的mrna结构为:
74.优选的,所述mrna翻译包含真核细胞裂解上清液;所述氨基酸混合物为已经公开的20种氨基酸混合物。
75.本实施例还公开了一种无细胞翻译方法,包含以上翻译体系,包含以下步骤:
76.步骤(1)转录具有5’帽子及3’多聚腺苷酸的mrna;
77.步骤(2)向反应容器内加入所述mrna、氨基酸混合物、atp、鸟苷三磷酸(gtp)及mrna,反应制得含有目的蛋白的混合溶液一;
78.步骤(3)将所述混合溶液一处理得目的蛋白。
79.所述mrna翻译酶源包含真核细胞裂解上清液,所述真核细胞裂解上清液由真核细胞裂解离心制得。
80.所述步骤(2)所述反应条件为温度35℃下反应10min。
81.所述步骤(3)处理方法包括凝胶电泳分析。
82.本实施例还公开了一种无细胞翻译产物,由上述翻译体系及上述翻译方法制备。
83.rna反应体系包含a、u、c、g核糖酸单体、atp、相应的dna双链和rna聚合酶。
84.优选的,加入必要的缓冲液。
85.在一些可选的实施例,采用细胞外翻译技术克服了原核细胞表达部分基因不能表达问题;
86.在一些可选的实施例,采用细胞外翻译技术克服了真核细胞表达周期长效率低问题;
87.在一些可选的实施例,采用添加磷酸肌酸等能量小分子的策略优化了原有细胞外翻译技术的活性低、效率差问题;
88.在一些可选的实施例,采用5’帽子及3’多聚腺苷酸的mrna增强稳定性和与受体结合速度及整体翻译速度。
89.实施例2
90.在已公开实施例基础上,公开了一种无细胞翻译体系,包含:5’帽子及3’多聚腺苷酸的mrna、氨基酸混合物、atp及mrna翻译酶源的混合物。
91.所述翻译体系,还包括鸟苷三磷酸(gtp)。
92.优选的,所述5’帽子及3’多聚腺苷酸的mrna结构为:
93.优选的,所述mrna翻译酶源包含真核细胞裂解上清液;所述氨基酸混合物为所述氨基酸混合物为已经公开的20种氨基酸混合物。
94.本实施例还公开了一种无细胞翻译方法,包含以上翻译体系,包含以下步骤:
95.步骤(1)转录具有5’帽子及3’多聚腺苷酸的mrna;
96.步骤(2)向反应容器内加入所述mrna、氨基酸混合物、atp、鸟苷三磷酸(gtp)及mrna翻译酶源,反应制得含有目的蛋白的混合溶液一;
97.步骤(3)将所述混合溶液一处理得目的蛋白。
98.所述mrna翻译酶源包含真核细胞裂解上清液,所述真核细胞裂解上清液由真核细胞裂解离心制得。
99.所述步骤(2)所述反应条件为温度39℃下反应120min。
100.所述步骤(3)处理方法包括凝胶电泳分析。
101.本实施例还公开了一种无细胞翻译产物,由上述翻译体系及上述翻译方法制备。
102.rna反应体系包含a、u、c、g核糖酸单体、atp、相应的dna双链和rna聚合酶。
103.优选的,加入必要的缓冲液。
104.在一些可选的实施例,采用细胞外翻译技术克服了原核细胞表达部分基因不能表达问题;
105.在一些可选的实施例,采用细胞外翻译技术克服了真核细胞表达周期长效率低问题;
106.在一些可选的实施例,采用添加磷酸肌酸等能量小分子的策略优化了原有细胞外翻译技术的活性低、效率差问题;
107.在一些可选的实施例,采用5’帽子及3’多聚腺苷酸的mrna增强稳定性和与受体结合速度及整体翻译速度。
108.实施例3
109.在已公开实施例基础上,公开了一种无细胞翻译体系,包含:5’帽子及3’多聚腺苷酸的mrna、氨基酸混合物、atp及mrna翻译酶源的混合物。
110.所述翻译体系,还包括鸟苷三磷酸(gtp)。
111.优选的,所述5’帽子及3’多聚腺苷酸的mrna结构为:
112.优选的,所述mrna翻译酶源包含真核细胞裂解上清液;所述氨基酸混合物为所述氨基酸混合物为20种氨基酸混合物。
113.本实施例还公开了一种无细胞翻译方法,包含以上翻译体系,包含以下步骤:
114.步骤(1)转录具有5’帽子及3’多聚腺苷酸的mrna;
115.步骤(2)向反应容器内加入所述mrna、氨基酸混合物、atp、鸟苷三磷酸(gtp)及mrna翻译酶源,反应制得含有目的蛋白的混合溶液一;
116.步骤(3)将所述混合溶液一处理得目的蛋白。
117.所述mrna翻译酶源包含真核细胞裂解上清液,所述真核细胞裂解上清液由真核细胞裂解离心制得。
118.所述步骤(2)所述反应条件为温度37℃下反应30min。
119.所述步骤(3)处理方法包括凝胶电泳分析。
120.本实施例还公开了一种无细胞翻译产物,由上述翻译体系及上述翻译方法制备。
121.rna反应体系包含a、u、c、g核糖酸单体、atp、相应的dna双链和rna聚合酶。
122.优选的,加入必要的缓冲液。
123.在一些可选的实施例,采用细胞外翻译技术克服了原核细胞表达部分基因不能表达问题;
124.在一些可选的实施例,采用细胞外翻译技术克服了真核细胞表达周期长效率低问题;
125.在一些可选的实施例,采用添加磷酸肌酸等能量小分子的策略优化了原有细胞外翻译技术的活性低、效率差问题;
126.在一些可选的实施例,采用5’帽子及3’多聚腺苷酸的mrna增强稳定性和与受体结合速度及整体翻译速度。
127.实施例4
128.在已公开实施例基础上,公开了一种体外制备含有帽结构的mrna实施例(本示例用gfp mrna),选用t7转录酶系统,用如下反应体系制备mrna:
129.t7 rna转录反应体系
130.选用a、u、c、g核糖酸单体、前端t7启动子区末端46
‑
58a的dna双链、t7 rna聚合酶,在37摄氏度反应30分钟,得到目的mrna;
131.制备细胞裂解液
132.选用大量常用培养的细胞,取500g细胞离心5min法收集后裂解细胞,离心处理并收集上清液;
133.目的蛋白合成
134.在裂解液中加入目的mrna(gfp mrna),加入必要的缓冲液和atp以及氨基酸,
135.37摄氏度反应1小时,得到目的蛋白;
136.目的蛋白的分析
137.反应结束后离心管中可看到肉眼可见的绿色;如图3所示凝胶电泳分析目的蛋白。
138.实施例5
139.在已公开实施例基础上,公开了一种体外制备含有帽结构萤火虫荧光素酶的实施
例,具体制备方法如实施例3所示。如图2所示,电泳分析结果显示,大量目的蛋白显色反应。
140.实施例6
141.在已公开实施例基础上,公开了一种体外制备含有帽结构绿色荧光蛋白的实施例,具体制备方法如实施例3所示。
142.对比例1
143.在已公开实施例基础上,公开了一种原核细胞培养制备萤火虫荧光素酶的实施例,具体操作为将萤火虫荧光素酶对应基因转移至大肠杆菌原核细胞内并按照已经公开的方法培养分离目的蛋白。
144.试验结果显示:目的蛋白对应基因在原核细胞内无法表达,采用电泳分析相应分析手段几乎未收集到目的蛋白,原因是因为原核细胞和真核细胞表达方式差异,导致对应基因无法在原核细胞内表达。
145.对比例2
146.在已公开实施例基础上,公开了一种真核细胞培养制备萤火虫荧光素酶的实施例,具体操作为将萤火虫荧光素酶对应基因转移至真核细胞内并按照已经公开的方法培养分离目的蛋白。
147.试验结果显示:如图3/4所示,目的蛋白对应基因在真核核细胞内培养在30min内仅获得102浓度,而采用本文公开的一种无细胞翻译技术目的蛋白可以达到107浓度。
148.对比例3
149.在已公开实施例基础上,公开了一种现有技术细胞外翻译mrna制备萤火虫荧光素酶的实施例,具体操作为将萤火虫荧光素酶对应基因mrna进行细胞外培养,未添加能量分子磷酸肌酸,分离目的蛋白。
150.试验结果显示:如图3/5所示,目的蛋白对应基因在真核核细胞内培养在30min内仅获得12
‑
14浓度,而采用本文公开的一种无细胞翻译技术目的蛋白可以达到107浓度。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1