一种复合纳米药物及其制备方法和应用
1.本发明涉及纳米生物医学领域,尤其涉及一种复合纳米药物及其制备方法和应用。
背景技术:
2.金属有机框架(mof)因具有较大的比表面积、可调节的多孔结构等优点,从而被广泛的应用于工业和科学研究领域,例如气体存储分离、光催化、海水清洁治理和纳米医药等。mof材料通常是由金属离子和其有机配体组成的高度多孔材料,因而为生物应用提供了很多机会。特别是以金属铁离子(fe
3+
)、铜离子(cu
2+
)为活性中心的mof材料,具有模拟天然酶催化中心配位环境,这些mof材料具有生物酶的特点,因而被称为纳米酶。更重要的是,在肿瘤治疗领域,这些纳米酶可以在肿瘤微酸性的环境下降解,非常有利于肿瘤治疗领域的纳米药物输运。而且,降解后的fe
3+
、cu
2+
离子,在肿瘤高的过氧化氢(h2o2)和谷胱甘肽(gsh)下参与氧化还原反应,产生活性氧等自由基,进一步杀伤肿瘤细胞。
3.研究表明,肿瘤细胞由于大量增殖、营养代谢过于旺盛、血管发育畸形等,导致肿瘤内部具有高压、还原性和缺乏氧气的特点。并且,肿瘤的乏氧条件进一步导致肿瘤对化疗、放疗及免疫治疗的耐受,影响肿瘤治疗效果。
4.因此,设计一种可以克服肿瘤乏氧微环境,并在肿瘤缺氧环境中发挥药效的药物是潜在需要解决的问题。
技术实现要素:
5.鉴于上述现有技术的不足,本发明的目的在于提供一种复合纳米药物,采用金属有机框架材料mil
‑
101(fe)为载体,负载生物还原类肿瘤增敏药物,并在mil
‑
101(fe)表面包覆磷脂
‑
聚乙二醇
‑
叶酸(dspe
‑
mpeg
‑
fa),旨在解决现有技术中因肿瘤微环境缺氧而对化疗、放疗及免疫治疗等其他治疗手段耐受的难题。
6.本发明的技术方案如下:
7.一种复合纳米药物的制备方法,其中,包括步骤:
8.制备mil
‑
101(fe)纳米材料;
9.将肿瘤增敏药物负载在所述mil
‑
101(fe)纳米材料上,制得mil
‑
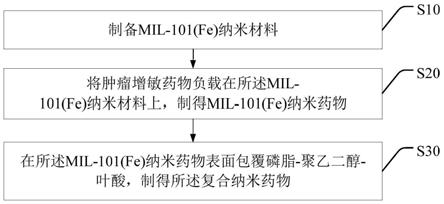
101(fe)纳米药物;
10.在所述mil
‑
101(fe)纳米药物表面包覆磷脂
‑
聚乙二醇
‑
叶酸,制得所述复合纳米药物。
11.所述的复合纳米药物的制备方法,其中,所述肿瘤增敏药物为aq4n。
12.所述的复合纳米药物的制备方法,其中,制备mil
‑
101(fe)纳米材料的步骤包括:
13.提供三氯化铁和对苯二甲酸;
14.将所述三氯化铁和对苯二甲酸溶于二甲基甲酰胺中;
15.经高压反应釜反应,制得所述mil
‑
101(fe)纳米材料。
16.所述的复合纳米药物的制备方法,其中,所述三氯化铁和对苯二甲酸的摩尔比为2:1。
17.所述的复合纳米药物的制备方法,其中,将肿瘤增敏药物负载在所述mil
‑
101(fe)纳米材料上,制得mil
‑
101(fe)纳米药物的步骤包括:
18.将肿瘤增敏药物加入到2
‑
(n吗啡啉)乙磺酸缓冲液中充分溶解,制得肿瘤增敏药物溶液;
19.向所述肿瘤增敏药物溶液中加入所述mil
‑
101(fe)纳米材料,避光搅拌10小时,制得所述mil
‑
101(fe)纳米药物。
20.所述的复合纳米药物的制备方法,其中,在所述mil
‑
101(fe)纳米药物表面包覆磷脂
‑
聚乙二醇
‑
叶酸,制得所述复合纳米药物的步骤包括:
21.提供磷脂
‑
聚乙二醇
‑
叶酸并溶解于水中,加入所述mil
‑
101(fe)纳米药物,避光搅拌反应24小时,之后将产物分散在磷酸盐缓冲溶液中,即制得所述复合纳米药物。
22.一种复合纳米药物,其中,包括肿瘤增敏药物、mil
‑
101(fe)纳米材料以及磷脂
‑
聚乙二醇
‑
叶酸,所述肿瘤增敏药物负载在mil
‑
101(fe)纳米材料载体上,所述mil
‑
101(fe)纳米材料载体表面包覆有磷脂
‑
聚乙二醇
‑
叶酸。
23.一种复合纳米药物,其中,所述复合纳米药物可在肿瘤微环境下降解。
24.一种复合纳米药物的应用,其中,将如上任一所述的复合纳米药物用于肿瘤治疗药物的制备。
25.一种复合纳米药物的应用,其中,所述肿瘤为乏氧微环境下的肿瘤。
26.有益效果:本发明提供的复合纳米药物,采用金属有机框架材料mil
‑
101(fe)为载体,负载生物还原类肿瘤增敏药物,并在mil
‑
101(fe)表面包覆磷脂
‑
聚乙二醇
‑
叶酸(dspe
‑
mpeg
‑
fa)。其中,所述复合纳米药物表面修饰的磷脂
‑
聚乙二醇
‑
叶酸配体,可以特异性的靶向叶酸,从而使所述复合纳米药物可靶向到叶酸受体丰富的肿瘤细胞表面,使其具有肿瘤靶向性。不仅如此,所述复合纳米药物表面修饰磷脂
‑
聚乙二醇
‑
叶酸配体还可以增加其生物相容性。所述复合纳米药物可在肿瘤乏氧环境中发挥药效,在肿瘤内部微酸性的环境下,所述复合纳米药物进行分解,分别释放出fe
3+
和生物还原类肿瘤增敏药物如aq4n,其中,所述肿瘤增敏药物在乏氧的、还原性的肿瘤微环境下发挥药物的毒性作用,杀死肿瘤细胞;而fe
3+
则与肿瘤细胞内的h2o2反应产生活性氧自由基,缓解肿瘤缺氧状况并进一步加速肿瘤细胞的凋亡。而且,所述复合纳米药物安全无毒,对生物友好,在肿瘤治疗中具有很高的潜在应用价值。
附图说明
27.图1为本发明实施例中一种复合纳米药物的制备方法的流程示意图;
28.图2为本发明实施例中一种复合纳米药物的构建示意图;
29.图3为本发明实施例中制备的mil
‑
101(fe)纳米材料的透射电镜照片;
30.图4为本发明实施例中制备的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的吸收光谱;
31.图5为本发明实施例中制备的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的药物释放曲线;
32.图6为本发明实施例中制备的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的细胞毒性评估;
33.图7为本发明实施例中制备的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物在缺氧环境的细胞共聚焦成像;
34.图8为本发明实施例中制备的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物对小鼠肿瘤乏氧状况的改善;
35.图9为本发明实施例中制备的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物对乏氧条件下肿瘤细胞的杀伤状况。
具体实施方式
36.本发明提供一种复合纳米药物及其制备方法和应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
37.第一方面,本发明实施例提供了一种复合纳米药物的制备方法,如图1所示,包括如下步骤:
38.s10、制备mil
‑
101(fe)纳米材料;
39.s20、将肿瘤增敏药物负载在所述mil
‑
101(fe)纳米材料上,制得mil
‑
101(fe)纳米药物;
40.s30、在所述mil
‑
101(fe)纳米药物表面包覆磷脂
‑
聚乙二醇
‑
叶酸,制得所述复合纳米药物。
41.在一些实施方式中,所述肿瘤增敏药物为aq4n,但不限于此,还可以为其他结构的生物还原类肿瘤增敏药物。近年来,研究人员发现,生物还原类肿瘤增敏药物aq4n具有在肿瘤乏氧条件下发挥药物毒性的作用,而对正常细胞或组织无害,因而具有在乏氧肿瘤治疗中应用的潜力。
42.图2为以aq4n为例构建复合纳米药物的示意图。由图可知,所述复合纳米药物采用金属有机框架材料mil
‑
101(fe)为载体,负载生物还原类肿瘤增敏药物如aq4n,并在mil
‑
101(fe)表面包覆磷脂
‑
聚乙二醇
‑
叶酸。
43.在一些实施方式中,上述步骤s10中制备mil
‑
101(fe)纳米材料的具体步骤包括:
44.s101、提供三氯化铁和对苯二甲酸;
45.s102、将所述三氯化铁和对苯二甲酸溶于二甲基甲酰胺中;
46.s103、经高压反应釜反应,制得所述mil
‑
101(fe)纳米材料。
47.具体的,称取适量的三氯化铁(fecl3·
6h2o)和对苯二甲酸(h2bdc)放入烧杯中,加入一定量的二甲基甲酰胺(dmf),搅拌使粉末充分溶解;然后将溶液倒入高压反应釜中,盖紧盖子,将反应釜放入120摄氏度条件下反应;之后冷却至室温,将产物用无水乙醇洗涤离心3次,真空干燥备用。
48.优选的,所述三氯化铁和对苯二甲酸的摩尔比为2:1。三氯化铁和对苯二甲酸的比例过高时,最终制备的mil
‑
101(fe)纳米材料不稳定,而比例过低时,制备的纳米材料的尺寸过大。
49.优选的,溶剂热的反应时间为10小时。
50.金属有机框架材料mil
‑
101(fe)载体采用溶剂热法进行制备,在高压反应釜中合成,制备过程相对简单,通用性较强,而且易于控制。制备的mil
‑
101(fe)纳米材料的透射电镜照片如图3所示。
51.在一些实施方式中,上述步骤s20中将肿瘤增敏药物负载在所述mil
‑
101(fe)纳米材料上的具体步骤包括:
52.s201、将肿瘤增敏药物加入到2
‑
(n吗啡啉)乙磺酸缓冲液中充分溶解,制得肿瘤增敏药物溶液;
53.s202、向所述肿瘤增敏药物溶液中加入所述mil
‑
101(fe)纳米材料,避光搅拌10小时,制得所述mil
‑
101(fe)纳米药物。
54.进一步的,避光搅拌10小时之后还包括步骤:将产物用无水乙醇洗涤离心3次,真空干燥备用。
55.其中,所述肿瘤增敏药物掺杂结合进有机框架里面,可以保证药物在到达靶标之后才进行分解,发挥药效。
56.在一些实施方式中,上述步骤s30中在所述mil
‑
101(fe)纳米药物表面包覆磷脂
‑
聚乙二醇
‑
叶酸的具体步骤包括:
57.提供磷脂
‑
聚乙二醇
‑
叶酸并溶解于水中,加入所述mil
‑
101(fe)纳米药物,避光搅拌反应24小时,之后将产物分散在磷酸盐缓冲溶液中,即制得所述复合纳米药物。
58.进一步的,将产物分散在磷酸盐缓冲溶液之前还包括步骤:将产物用去离子水洗涤离心3次。
59.第二方面,本发明实施例还提供了一种复合纳米药物,所述复合纳米药物采用金属有机框架材料mil
‑
101(fe)为载体,负载生物还原类肿瘤增敏药物,并在mil
‑
101(fe)表面包覆磷脂
‑
聚乙二醇
‑
叶酸(dspe
‑
mpeg
‑
fa)。
60.本实施例提供的复合纳米药物,在所述mil
‑
101(fe)纳米药物表面修饰磷脂
‑
聚乙二醇
‑
叶酸配体,可以特异性的靶向叶酸,从而使所述复合纳米药物可靶向到叶酸受体丰富的肿瘤细胞表面,使其具有肿瘤靶向性;尤其是乳腺癌细胞,其表面的叶酸受体高表达,因此会和叶酸配体修饰的复合纳米药物特异性的靶向结合。不仅如此,所述复合纳米药物表面修饰磷脂
‑
聚乙二醇
‑
叶酸配体还可以增加其的生物相容性。这是因为,磷脂
‑
聚乙二醇
‑
叶酸配体中的磷脂
‑
聚乙二醇部分,在所述复合纳米药物表面构成了一种长链亲水钝化层结构,该钝化结构大大降低了由于血液中的蛋白质及血小板在该钝化层的结合而导致的不良反应,增加了生物相容性。
61.在一些实施方式中,所述复合纳米药物可在肿瘤微环境下降解。这是因为,肿瘤微环境是弱酸性的,在酸性条件下,所述复合纳米药物中的金属有机框架会和酸性条件的氢离子(h
+
)发生化学反应逐渐降解掉。
62.在一些实施方式中,所述肿瘤增敏药物包括aq4n。在肿瘤内部微酸性的环境下,本实施例制备的所述复合纳米药物可进行分解,分别释放出aq4n和fe
3+
,其中,aq4n在乏氧的、还原性的肿瘤微环境下可发挥药物的毒性作用,杀死肿瘤细胞;而fe
3+
则与肿瘤细胞内的h2o2反应产生活性氧自由基,缓解肿瘤缺氧状况并进一步加速肿瘤细胞的凋亡。
63.第三方面,本实施例还提供一种复合纳米药物的应用,可将如上任一所述的复合纳米药物应用于肿瘤治疗药物的制备。
64.在一些实施方式中,所述肿瘤为乏氧微环境下的肿瘤。所述复合纳米药物包含生物还原性的乏氧药物aq4n,应用于肿瘤乏氧微环境时,可在乏氧的、还原性的肿瘤微环境下发挥药物的毒性作用,而对正常细胞或组织无害,因而可应用于乏氧肿瘤治疗。
65.下面通过具体实施例对本发明一种复合纳米药物及其制备方法和应用做进一步的解释说明:
66.实施例1
67.复合纳米药物的制备:
68.(1)mil
‑
101(fe)纳米材料的制备:称取1.35g三氯化铁(fecl3·
6h2o),0.412g对苯二甲酸(h2bdc)放入烧杯中,量取30ml二甲基甲酰胺(dmf)加入烧杯中,搅拌使粉末充分溶解;然后倒入高压反应釜中,盖紧盖子,将反应釜放入120摄氏度条件,反应10小时;之后,冷却降至室温,用无水乙醇洗涤离心3次,产物真空干燥备用。
69.(2)mil
‑
101(fe)纳米药物的制备:将5mg aq4n加入到2
‑
(n吗啡啉)乙磺酸缓冲液中充分溶解,然后加入10mg mil
‑
101(fe)纳米材料,在避光条件下搅拌,反应10小时,用无水乙醇洗涤离心3次,即制得mil
‑
101(fe)纳米药物,标记为aq4n@mil
‑
101(fe),之后真空干燥备用。
70.(3)复合纳米药物的制备:取20mg磷脂
‑
聚乙二醇
‑
叶酸(dspe
‑
mpeg
‑
fa)溶解在10ml水中,然后加入5mg aq4n@mil
‑
101(fe),避光充分搅拌反应24小时,然后产物用去离子水洗涤离心3次,分散在5ml磷酸盐缓冲溶液(pbs)中,即制得所述复合纳米药物,标记为aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa,之后避光放入4℃冰箱备用。
71.实施例2
72.对上述实施例1制备的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的性能测试:
73.(1)aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的吸收光谱测试
74.分别取2ml aq4n溶液、2ml aq4n@mil
‑
101(fe)溶液和2ml aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa溶液,测试其在400nm至800nm的吸收波长,结果如图4所示。
75.由图可知,经过掺杂aq4n的复合纳米药物在650nm左右有一个和自由aq4n溶液相似的吸收峰,说明aq4n已经成功装载进金属有机框架中。
76.(2)aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的释放曲线
77.分别取1mg/ml的aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物溶液,分散在不同ph值的pbs缓冲溶液中(ph=5.0,ph=6.5,ph=7.4),测试初始溶液的吸收波长,然后避光保存,前1小时每隔10min测试吸收波长,然后每隔30min测试吸收波长,测试时长为24小时,结果如图5所示。
78.由图可知,在aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物与不同ph值缓冲溶液孵育时,中性的ph值条件下,释放最慢;ph6.5,20h释放接近70%;而在ph5.5,孵育10h后,释放接近83%。这说明随着时间的增加,aq4n药物逐渐释放,并且随着酸性的增加,释放的越多,也说明aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物物是一种酸性敏感的复合纳米药物。
79.(3)aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的细胞毒性评估
80.首先在常氧条件下,在96孔板中培养4t1细胞,细胞在96孔板中贴壁良好。之后,将4t1细胞在缺氧环境(5%co2/1%o2/94%n2)中培养6h,然后将细胞与含有aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的新鲜培养基孵育,药物浓度分别为0、12.5、25、50、100μg/
ml。继续孵育48h后,取出细胞并重新更换新鲜培养基。之后用增强细胞计数试剂盒(cck8)测定细胞毒性。结果如图6所示,其中,细胞活力(%)=od450(样本)/od450(对照)
×
100%。
81.由图可知,当药物浓度达到200μg/ml时,细胞存活率仍然在90%以上,说明aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的生物毒性很低。
82.(4)aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物在缺氧环境的细胞共聚焦成像
83.在常氧环境(5%co2/21%o2/74%n2),将生长状态良好的4t1细胞用胰酶消化后接种在直径20mm玻璃底片的小培养皿中,培养24h后,将培养板放入缺氧环境(5%co2/1%o2/94%n2)继续培养6h,然后与分别含有100μg/ml的aq4n、aq4n@mil
‑
101(fe)和aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的新鲜培养基在缺氧条件继续孵育6h,之后分别加入细胞核探针hoechst 33342,再次孵育30min,最后用激光共聚焦显微镜进行细胞成像。
84.结果如图7所示,由图可知,复合纳米药物在乏氧条件下,在650nm的红色的荧光最强,说明所述复合纳米药物是一种在乏氧条件响应的纳米药物,并且在650nm红色荧光乏氧肿瘤的治疗中可以成像的引导治疗。
85.(5)aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物对小鼠肿瘤杀伤及乏氧状况改善
86.4t1荷瘤小鼠分别注射pbs或aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa(50μl,1mg/ml)。小鼠腹腔注射pimonidazole(60mg/kg)(乏氧探针试剂盒)。在给药90分钟后,将小鼠猝死,获取小鼠肿瘤组织。此时,低氧细胞中的乏氧探针pimonidazole被还原并被激活,被激活的中间体与蛋白质、多肽和氨基酸的巯基形成稳定的复合物。并且fitc
‑
mab1抗体与这些复合物结合,通过免疫化学检测。分别对缺氧区、血管和细胞核进行抗匹莫硝唑抗体、抗cd31抗体和dapi染色。
87.结果如图8所示,控制组注射pbs缓冲溶液的小鼠的肿瘤组织的绿色的荧光最强,说明肿瘤乏氧状况严重;而注射复合纳米药物的药物组的小鼠肿瘤组织的绿色荧光很弱,说明肿瘤组织的乏氧状况得到改善,也说明复合纳米药物中的铁离子发生芬顿反应产生o2,改善了乏氧状况。
88.(6)aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物对乏氧条件肿瘤细胞杀伤状况
89.在常氧气环境(5%co2/21%o2/74%n2),将生长状态良好的4t1细胞,用胰酶消化后种在96孔板中,培养24小时后,将培养板放入缺氧环境(5%co2/1%o2/94%n2)继续培养6h,然后与分别含有100μg/ml的aq4n,aq4n@mil
‑
101(fe)、aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物的新鲜培养基孵育6h后,更换新鲜的培养基继续培养48h。之后用增强细胞计数试剂盒(cck8)对细胞进行计数。其中,细胞活力(%)=od450(样本)/od450(对照)
×
100%。
90.结果如图9所示,由图可知,相比与正常氧条件,在乏氧条件下,细胞与复合纳米药物孵育后的细胞存活率降低75%,说明在乏氧条件下,释放的aq4n对细胞起到杀伤作用。
91.由上述结果可知,所述aq4n@mil
‑
101(fe)@dspe
‑
mpeg
‑
fa纳米药物是一种酸性敏感的复合纳米药物,其生物毒性很低。在乏氧条件下,所述复合纳米药物可以响应,并能够改善肿瘤组织的乏氧状况。而且,在乏氧条件下,所述复合纳米药物释放的aq4n对肿瘤细胞起到了有效的杀伤作用。
92.综上所述,本发明提供的复合纳米药物,采用金属有机框架材料mil
‑
101(fe)为载体,负载生物还原类肿瘤增敏药物,并在mil
‑
101(fe)表面包覆磷脂
‑
聚乙二醇
‑
叶酸(dspe
‑
mpeg
‑
fa)。其中,所述复合纳米药物表面修饰的磷脂
‑
聚乙二醇
‑
叶酸配体,可以特异性的靶
向叶酸,从而使所述复合纳米药物可靶向到叶酸丰富的肿瘤细胞表面,使其具有肿瘤靶向性;尤其是乳腺癌细胞,其表面的叶酸受体高表达,因此会和叶酸配体修饰的复合纳米药物特异性的靶向结合。不仅如此,所述复合纳米药物表面修饰磷脂
‑
聚乙二醇
‑
叶酸配体还可以增加其生物相容性。这是因为,磷脂
‑
聚乙二醇
‑
叶酸配体中的磷脂
‑
聚乙二醇部分,在所述复合纳米药物表面构成了一种长链亲水钝化层结构,该钝化结构大大降低了由于血液中的蛋白质及血小板在该钝化层的结合而导致的不良反应,增加了生物相容性。所述复合纳米药物是一种酸性敏感的复合纳米药物,在肿瘤内部微酸性的环境下,所述复合纳米药物进行分解,分别释放出fe
3+
和生物还原类肿瘤增敏药物如aq4n,其中,aq4n在乏氧的、还原性的肿瘤微环境下发挥药物的毒性作用,杀死肿瘤细胞;而fe
3+
则与肿瘤细胞内的h2o2反应产生活性氧自由基,缓解肿瘤缺氧状况并进一步加速肿瘤细胞的凋亡。而且,所述复合纳米药物安全无毒,对生物友好,在肿瘤治疗中具有很高的潜在应用价值。
93.应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1