一种自组装形成的纳米囊泡药物及其制备方法和应用与流程
1.本发明属于自组装纳米药物领域,具体是涉及一种自组装形成的纳米囊泡药物及其制备方法和应用。
背景技术:
2.癌症是全球第二大死亡原因,已成为威胁人类生存健康的主要原因之一,据世界卫生组织统计,2020年全球新发癌症病例1929万例,全球癌症死亡病例996万例。全球大约六分之一的死亡由癌症造成,近70%的癌症死亡发生在低收入和中等收入国家。由于中国是世界第一人口大国,2020年新发癌症人数和死亡人数都远超世界其他国家。因此治疗癌症、提高癌症病人的生存率和生活质量成为了一个世界性的难题。目前,癌症一般使用手术治疗、放射治疗、化学治疗以及最近几年新启的免疫治疗等治疗方式。但是这些治疗方式却存在着一定的弊端。它们都会在患者的身体中出现很多的副作用,让患者苦不堪言。化疗手段仍然是癌症治疗的主要方法之一。然而,大多数化疗药物,比如喜树碱(camptothecin)、紫杉醇(paclitaxel)等,在水中溶解度有限,稳定性差,而且对人体正常组织具有严重的副作用。因此,对化疗药物的改性以及设计有效的药物投递系统一直是药物控制释放领域的研究焦点。
3.纳米药物由于其特殊的纳米尺度效应和纳米结构效应等理化特性,具有较为特殊的生物学特性,被科学家们广泛的用于癌症研究和治疗。在体内可能通过被动靶向、主动靶向、物理靶向、化学靶向等方式高选择性分布于特定的器官、组织、细胞、细胞内结构,改变原形药物的药代动力学特征如体内组织分布,并进而影响其安全性和有效性。纳米药物可以有效提高抗癌药物在生理环境中的分散性和稳定性,延长纳米药物在血液中的循环时间,提高药物在肿瘤组织中的富集。相比较于传统的小分子化疗药物,纳米药物可以有效提高抗肿瘤活性,降低对正常组织的毒副作用。
4.在过去的几十年里,纳米医学的巨大发展也强调了自组装在为生物医学应用量身定做多样化的纳米材料方面的重要作用。小分子两亲性药物,一般由疏水性的化疗药物连接到亲水性小分子,例如低聚乙二醇,多肽序列,或另一种亲水性药物。与聚合物药物偶联物(polymer drug conjugates)相比,小分子两亲性前药可以比较容易地合成,具有特定的化学结构,和高的药物负载能力。然而,很多小分子两亲性前药利用喜树碱的内酯环上的羟基作为链接基团,并形成相当稳定的酯键,这导致极其缓慢的释放和显著减少对癌细胞的细胞毒性。此外,由于临界聚集浓度较高,药物两亲物可能不能在体内维持其纳米结构,进而不能受益于纳米尺寸载体的增强的渗透性和保留(epr)效应。由于生物屏障的存在,单分子(例如,治疗性药物)通常太小而不能有效地传递到感兴趣的目标,从而导致不良的治疗结果。与此形成对比的是,由多个分子自组装而来的大小合适的纳米材料是提高药物输送和利用效率的很有前途的平台。在各种纳米粒子构型(如胶束、纤维)中,具有泡状结构的脂质体在临床转化方面取得了最大的成功,包括美国食品和药物管理局(fda)最近批准的一种sirna纳米药物(即onpattro)。虽然成功的原因还不清楚,但脂质体纳米颗粒对细胞膜结
构的模拟结构可能起到重要作用。为此,过去几十年来,人们花了大量的努力来探索脂质体样囊泡结构作为纳米医学中的输送载体。因此,设计有效的纳米载药体系一直是药物控制释放领域的研究焦点。
5.喜树碱(camptothecin,cpt)是一种细胞毒性喹啉类生物碱,能抑制dna拓扑异构酶i(topo i),在临床前研究中具有显著的抗肿瘤活性。但由于其自身水溶性差,生理环境下易水解失活以及严重的毒副作用,喜树碱没能在临床试验中获得成功。通过对喜树碱改性,目前已有几个喜树碱类似物药物通过了美国食品和药物管理局(fda)批准用于结肠癌的治疗,如伊立替康(irinotecan)和拓扑替康(topotecan)。另一方面,这些药物中的内酯结构(lactone form)在血液循环过程中容易水解成羧基结构,从而导致药效急剧下降。因此非常有必要开发出一种具有肿瘤选择性释放的纳米药物来投递喜树碱。
6.紫杉醇(paclitaxel ptx)是一种新型抗微管药物,临床广泛用于卵巢癌、乳腺癌、肺癌、头颈部肿瘤、食管癌、胃癌及软组织肉瘤等。具有高度亲脂性,不溶于水,为了促进水溶性,taxol加入聚氧乙基代蓖麻油及无水乙醇助溶。聚氧乙基代蓖麻油可引起不同程度的过敏反应,也可加重紫杉醇的外周神经毒性,还影响药物分子向组织间扩散,影响抗肿瘤效应。有研究发现,聚氧乙基代蓖麻油可溶解pvc输液器中的二乙烯乙基邻苯二甲酸盐,引起严重的不良反应。
7.分子试剂可以通过不同的驱动力与纳米颗粒结合,例如范德华吸附和化学共轭。对于脂质纳米粒子,亲水性和疏水性分子都可以分别装载在囊泡的内部空间和膜上。然而,为了促进自组装,大多数脂质体囊泡的载药量(dlc)通常较低,约为或小于10%的重量(wt)。对于基于聚合物的药物偶联物,由于聚合物支架的重量贡献相对较大,dlc通常更低。因此,纳米医学中的这些赋形剂的很大一部分可能会给患者带来额外的负担,并在高剂量给药时导致全身毒性。因此,追求以最少赋形剂实现高载药量纳米药物的研究已经获得了巨大的动力,尤其是脂质体和脂质体样囊泡纳米药物。例如,沈等人(j.am.chem.soc.2010,132,4259
‑
4265)使用低聚物乙二醇共轭抗癌药物喜树碱(cpt)来模拟磷脂结构并组装纳米胶囊,使得cpt的dlc高达58wt%;梁等人(adv.mater.2017,29,1703135)制备了一种cpt
‑
氟尿苷共轭两亲物,它可以自组装成脂质体纳米药物,具有相当高的dlc。最近,据报道紫杉醇(ptx)作为最广泛使用的抗癌药物之一,可促进基于ptx的两亲物spheropax从胶束到细丝结构的自组装。因此,我们推测ptx可能作为介质促进与其他两亲物的共组装,从而获得具有增强型dlc的纳米医学。考虑到ptx的有效活性和联合治疗中潜在的协同效应,这一假设的成功可能为转化纳米医学提供重要的见解。已有研究在非小细胞肺癌中进行了ptx和cpt联合治疗的临床试验,试验结果显示了可观的药效活性和有利的生存数据。然而,使用所述的顺序给药方案对不同细胞系的联合研究报告了有争议的结果,这引起了人们对优化ptx和cpt联合治疗模型的极大兴趣。本发明人团队在先的研究(例如cn106946899a)获得了一种基于cpt的两亲性药物通过自组装与ptx形成的联合纳米制剂,该联合纳米制剂成功地实现了基于cpt的两亲性药物对ptx的物理包裹而非化学偶联,不仅具有很高的载药量,而且有效保存了ptx的药效,并通过体外实验被证实了对某些癌细胞的联合毒性。但是该联合纳米制剂是以纤维或胶束形态存在的,其胶束长度通常在数百纳米甚至达到微米级别,这种形态的纳米粒子无法以注射方式用于活体的给药治疗,在人或动物的体内实验和临床推广方面存在局限性。
技术实现要素:
8.鉴于上述技术背景和优化需求,本发明的首要目的在于:提供一种基于ptx和cpt联合用药的纳米囊泡式药物递送系统,具有比现有递送系统更适合临床应用的优势,同时具有高载药量和载药率,以满足临床肿瘤治疗的需要。
9.本发明的第二目的在于:提供制备所述纳米囊泡式药物递送系统的方法,不仅能使递送系统的载药量和载药率显著提升,而且具有更有利于工业化生产的优势。
10.本发明的第三目的在于:提供所述纳米囊泡式药物递送系统在抗肿瘤药物制备中的应用。
11.本发明的上述目的通过以下技术方案实现:
12.第一个方面,本发明提供一种纳米囊泡药物,含有与伊文思蓝偶联的喜树碱(eb
‑
cpt)和紫杉醇类;所述的纳米囊泡内部有空腔,其囊壁结构由所述eb
‑
cpt物理包裹所述紫杉醇类构成。
13.本发明所述的纳米囊泡药物是形状均匀、超高质量的新型纳米微囊,发明人将其简称为ecx nvs,其整体呈球形,任意截面直径不大于150nm,且三维尺寸中任意两个维度的尺寸比例不大于2:1,其囊壁厚度在2~20nm。本发明的纳米囊泡药物可以作为cpt和紫杉醇类抗肿瘤药物的联合递送体系。
14.本发明所述的纳米囊泡药物中,所述的eb
‑
cpt是由伊文思蓝(eb)和喜树碱(cpt)经连接结构(linker)偶联形成的两亲性药物分子;优选的所述两亲性药物分子eb
‑
cpt结构如下式(i)所示:
[0015][0016]
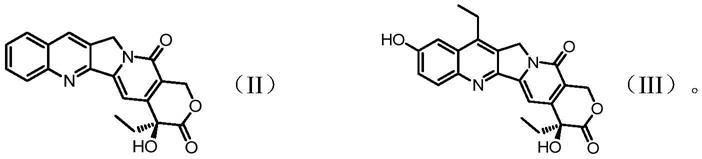
其中,r1是来自式(ii)或式(iii)所示结构的喜树碱或其衍生物基团;r2为
‑
ch2‑
,或者
‑
o
‑
中的一种;x为s或者
‑
ch2‑
中的一种;n1,n2为重复单元数,均为0
‑
10的整数;
[0017][0018]
本发明所述的纳米囊泡药物中,所述的紫杉醇类可以是现有技术中具有抗肿瘤活性的紫杉醇或其各种衍生物,优选式(iv)~式(vi)所示的紫杉醇(paclitaxel)、多西紫杉醇(docetaxel)或卡巴他赛(cabazitaxel)中的任意一种:
[0019]
[0020][0021]
或者
[0022][0023]
本发明优选的一种实施方式中,所述式(i)的x为s,n1和n2均为0
‑
5的整数;进一步优选0
‑
3的整数。
[0024]
本发明更优选的方案中,所述的两亲性药物分子eb
‑
cpt结构如下式(vii)所示:
[0025][0026]
本发明所述的纳米囊泡药物中,所述的eb
‑
cpt与紫杉醇类之间不形成化学键连接,而是由eb
‑
cpt通过物理包裹的方式将紫杉醇类装载于所述囊泡的囊壁内部(大体结构如图1所示,图1中通过剖视体现了本发明所述囊泡的结构,其囊壁中深色层代表eb结构,eb结构内部的浅色层代表cpt结构,cpt结构内部的球状分子代表紫杉醇类)。优选的方案中,所述的eb
‑
cpt与紫杉醇类在所述纳米囊泡中的重量比为1:n,其中n的取值大于0且小于或等于2.5,更优选大于或等于0.5且小于或等于2,进一步优选的n在1
‑
2之间,最优选1、1.5或2。
[0027]
第二个方面,本发明还提供制备所述纳米囊泡药物的方法,包括以下步骤:采用均相溶剂蒸发法,将含有下式(i)所示结构的eb
‑
cpt和紫杉醇类的混合物的有机溶剂滴加入去离子水中,使eb
‑
cpt在紫杉醇类的调控下进行自组装,同时蒸发脱除有机溶剂,直至得到清晰透明无沉淀的溶液;所述的有机溶剂中,eb
‑
cpt与所述的紫杉醇类的重量比为1:n,其中n的取值大于0且小于或等于2.5,更优选大于或等于0.5且小于或等于2,进一步优选的n在1
‑
2之间,最优选1、1.5或2;
[0028][0029]
其中,r1是来自式(ii)或式(iii)所示结构的喜树碱或其衍生物基团;r2为
‑
ch2‑
,或者
‑
o
‑
中的一种;x为s或者
‑
ch2‑
中的一种;n1,n2为重复单元数,均为0
‑
10的整数,优选0
‑
5的整数,更优选0
‑
3的整数
[0030][0031]
本发明优选的纳米囊泡药物制备方法中,所述的eb
‑
cpt结构如下式(vii)所示:
[0032][0033]
本发明优选的纳米囊泡药物制备方法中,所述的紫杉醇类优选式(iv)所示结构的紫杉醇
[0034][0035]
本发明优选的纳米囊泡药物制备方法中,所述的含有eb
‑
cpt和紫杉醇类的混合物的有机溶剂是由eb
‑
cpt溶于有机溶剂的第一溶液与紫杉醇类溶于有机溶剂的第二溶液混合得到。
[0036]
本发明进一步优选的纳米囊泡药物制备方法中,所述的第一溶液中eb
‑
cpt的浓度在1~10mg/ml;所述的第二溶液中的紫杉醇类的浓度在1~10mg/ml。
[0037]
本发明所述的纳米囊泡药物制备方法中,所述的有机溶剂可以选自甲醇、乙醇、水、四氢呋喃、氯仿、n,n
’‑
二甲基甲酰胺、二甲基亚砜、二氯甲烷、氯仿、丙酮、正丙醇、甲苯、1,4
‑
二氧六环、乙二醇或丙三醇等溶剂中的任意一种或者两种的混合物,优选甲醇。
[0038]
本发明所述的纳米囊泡药物制备方法中,所述的蒸发可以是主要通风柜中蒸发,并将残留的有机溶剂通过低压旋转蒸发进一步去除。
[0039]
第三方面,本发明还提供所述纳米囊泡药物在制备抗肿瘤药物中的应用。
[0040]
所述的抗肿瘤药物包括治疗结肠癌、直肠癌、胃癌、食管癌、贲门癌、原发性肝癌、乳腺癌、卵巢癌、部分头颈癌或肺癌等的药物。
[0041]
与现有技术相比,本发明的有益效果是:
[0042]
(1)适合制备成注射剂用于临床活体给药
[0043]
现有技术中,eb
‑
cpt与ptx共组装得到的纤维状联合纳米制剂虽然对人结肠癌细胞hct116具有抑制作用,但是其纤维长度大多在几百纳米甚至微米级别,很难制备成注射剂,无法用于人或动物等活体的抗肿瘤治疗。而本发明通过大量筛选实验,意外地发现某些特定结构的eb
‑
cpt在ptx的调控下可以自组装成为球状的纳米囊泡,不仅能够获得较高的
ptx载药量和载药率,而且尺寸均一,具有理想的化学稳定性、生物安全性和生物分布,比现有的纤维状的eb
‑
cpt与ptx联合纳米制剂更加适合临床应用,可以用于活体的注射治疗,为cpt和ptx在抗癌的联合用药方案提供了更加有效的药物递送系统。
[0044]
(2)具有显著的联合抗肿瘤效果
[0045]
与两种临床已被美国食品和药物管理局(fda)批准的基于cpt和ptx的抗癌纳米药物(onivyde和abraxane)及其组合相比,本发明的ecx nvs纳米药物表现出显著的联合抗肿瘤效果,可以在体内和体外实验中被多种肿瘤细胞有效摄取并杀死肿瘤细胞,达到“1+1>2”的效果,为抗癌药物开发和转化医学提供了新的思路。
附图说明
[0046]
图1是本发明所述纳米囊泡的剖视结构示意图。
[0047]
图2为实施例1所述的单独eb
‑
cpt的自组的tem图像。
[0048]
图3为实施例2所述的eb
‑
cpt:ptx(1:0.5,w/w)共组装纳米粒子的透射电镜图像。
[0049]
图4为实施例3所述的eb
‑
cpt与ptx重量比(w/w)为1:1的共组装获得的ecx nvs的tem图像。
[0050]
图5为实施例4所述的eb
‑
cpt与ptx重量比(w/w)为1:2的共组装ecx nv的tem图像。
[0051]
图6为实施例5所述的eb
‑
cpt与ptx重量比(w/w)为1:2.5的共组装ecx nv的tem图像。
[0052]
图7为对比例1所述的eb
‑
cpt与ptx重量比(w/w)为1:3的共组装ecx nv的tem图像。
[0053]
图8为eb
‑
cpt胶束溶液(紫红色溶液)和ecx nvs(蓝色)溶液(插图)的uv
‑
vis吸收光谱。
[0054]
图9体现了mtt法检测的eb
‑
cpt、cpt、onivyde、ptx和abraxane体外对hct116细胞的细胞毒性。
[0055]
图10体现了不同重量比的eb
‑
cpt和ptx共混合组对hct116细胞的细胞毒性。
[0056]
图11体现了不同重量比的eb
‑
cpt和ptx的ecx共组装组对hct116细胞的细胞毒性。
[0057]
图12体现了不同重量比的eb
‑
cpt和ptx的ecx纳米药物对hct116细胞50%的疗效。
[0058]
图13体现了实施例9的抗肿瘤研究中不同药物尾静脉注射处理小鼠体重的变化。
[0059]
图14体现了实施例9的抗肿瘤研究中不同药物尾静脉注射处理小鼠存活率的变化。
[0060]
图15体现了实施例9的抗肿瘤研究中不同药物尾静脉注射处理小鼠组肿瘤体积变化。
具体实施方式
[0061]
下面通过实施例对本发明进行具体描述,本实施例只用于对本发明作进一步的说明,不能理解为对本发明保护范围的限制,本领域的技术人员根据上述发明的内容做出的一些非本质的改进和调整,均属本发明保护范围。
[0062]
本发明所述的方案中,所述式(vii)结构的eb
‑
cpt可以通过以下方法制备:
[0063]
步骤i:喜树碱与羰基化试剂在有机溶剂中反应,后加入双(2
‑
羟乙基)硫化物生成中间体f;
[0064]
步骤ii:步骤i所得中间体f的羟基与氯甲酸
‑4‑
硝基苯酯发生酰化反应生成中间体g;
[0065]
步骤iii:邻连甲苯胺与n
‑
(叔丁氧羰基)
‑4‑
氨基丁酸在偶联试剂存在下发生酰胺键偶联缩合生产中间体d;
[0066]
步骤iv:中间体d与1
‑
氨基
‑8‑
萘酚
‑
2,4
‑
二磺酸单钠盐发生重氮化偶联反应生成中间体e;
[0067]
步骤v:步骤iv所得的中间体e脱除保护基得到中间体c;
[0068]
步骤vi:步骤v所得的中间体c与步骤ii得到的中间体g在有机溶剂中发生亲核取代反应生成eb
‑
ss
‑
cpt,即为式(vii)结构的eb
‑
cpt。
[0069]
所述制备方法的合成路线如下:
[0070][0071]
上述制备方法中,步骤i所述的羰基化试剂可以是光气、二光气、三光气或羰基二咪唑等羰基化试剂中的任意一种。
[0072]
上述制备方法中,步骤i所述的有机溶剂可以是二氯甲烷、三氯甲烷、四氢呋喃、乙酸乙酯、n,n
’‑
二甲基乙酰胺或1,2
‑
二氯乙烷中的任意一种。
[0073]
上述制备方法中,步骤iii所述的偶联试剂可以是2
‑
(7
‑
氮杂苯并三氮唑)
‑
n,n,n',n'
‑
四甲基脲六氟磷酸盐(hatu)、o
‑
苯并三氮唑
‑
四甲基脲六氟磷酸盐(hbtu)、6
‑
氯苯并三氮唑
‑
1,1,3,3
‑
四甲基脲六氟磷酸酯(hctu)、1
‑
(3
‑
二甲氨基丙基)
‑3‑
乙基碳二亚胺盐酸盐(edci)、六氟磷酸苯并三唑
‑1‑
氧基三(二甲氨基)磷(bop)或六氟磷酸苯并三唑
‑1‑
基
‑
氧基三吡咯烷基磷(pybop)中的任意一种。
[0074]
上述制备方法中,步骤v所述的脱除保护基可以使用以下溶剂处理中间体e:三氟乙酸、乙二硫醇和苯甲硫醚以(10
‑
100):(0
‑
90):(0
‑
90)的体积比混合得到的混合溶剂。
[0075]
上述制备方法中,步骤vi所述的有机溶剂可以是n,n
’‑
二甲基甲酰胺、n,n
’‑
二甲基乙酰胺或n
‑
甲基吡咯烷酮中的任意一种。
[0076]
本发明中用到的式(vii)以外的其他eb
‑
cpt,均可参考上述制备方法制得,例如在步骤i和/或步骤iii使用合适的原料替换双(2
‑
羟乙基)硫化物和n
‑
(叔丁氧羰基)
‑4‑
氨基丁酸,即可得到所述式(i)中x、n1和n2不同的其他eb
‑
cpt。
[0077]
以下各实施例中所用到的eb
‑
cpt均为按照上述方法制备的结构如式(vii)所示的eb
‑
ss
‑
cpt。
[0078]
实施例1:eb
‑
cpt单独的自组装。
[0079]
eb
‑
cpt的自组装过程相当简单。我们测试了eb
‑
cpt自组装成胶束的两种策略。第一种方法以前被描述为通过直接将eb
‑
cpt粉末悬浮在去离子水中的自发自组装(acs nano,2017,11,8838
‑
8848)。为了完成eb
‑
cpt和ptx的共组装过程并与之进行比较,我们还用溶剂蒸发的方法测试了eb
‑
cpt的自组装过程。在一个典型的程序中,将100μl 5mg/ml的eb
‑
cpt溶解在甲醇中,滴加到2ml去离子水的溶液中。让溶液敞开蒸发通风罩下的甲醇,并在低压下用旋转蒸发器进一步脱除残留的有机溶剂。得到清澈溶液,无明显沉淀。两种方法都能得到均匀的eb
‑
cpt胶束,而蒸发法的胶束直径略大于直接分散在水中的胶束直径(如图2,其中深色圆形区域为胶束截面投影)。透射电子显微镜(tem)照片显示,eb
‑
cpt胶束大小比较均匀,胶束横截面直径在110
‑
130nm左右。
[0080]
实施例2:eb
‑
cpt与ptx重量比(w/w)为1:0.5的共组装。
[0081]
将40μl含eb
‑
cpt(5.0mg/ml)的甲醇溶液和20μl含ptx(5.0mg/ml)的甲醇溶液混合,滴加到2ml去离子水中。有机溶剂甲醇主要在通风柜下蒸发,剩余的有机溶剂甲醇在低压下通过旋转蒸发器进一步脱除。所得溶液清澈,无明显沉淀,表明eb
‑
cpt与ptx共组装成功。本实施例溶液中共组装得到的纳米粒子记作“ecx(1:0.5)nvs”,其透射电镜图像如图3所示,可以看到,纳米粒子基本上形成了囊泡状,尽管囊泡尺寸存在一定差异,但各囊泡任意截面的直径基本上都在100nm以下。
[0082]
实施例3:eb
‑
cpt与ptx重量比(w/w)为1:1的共组装。
[0083]
将40μl含eb
‑
cpt(5.0mg/ml)的甲醇溶液和40μl含ptx(5.0mg/ml)的甲醇溶液混合,滴加到2ml去离子水中。有机溶剂甲醇主要在通风柜下蒸发,剩余的有机溶剂甲醇在低压下通过旋转蒸发器进一步脱除。所得溶液清澈,无明显沉淀,表明eb
‑
cpt与ptx共组装成功。溶液中共组装得到的纳米粒子ecx透射电镜图像如图4所示,可以看到,纳米粒子几乎全部形成了囊泡状,且囊泡尺寸较为均匀,各囊泡任意截面的直径基本上都在80nm以下,且各维度截面的直径比例均不超过2:1,整体上呈球形。
[0084]
本实施例中,eb
‑
cpt和ptx以质量比(w/w)1:1(摩尔比为1:1.38)共组装形成纳米
粒子,记作“ecx(1:1)nvs”,它的吸收光谱和eb
‑
cpt的吸收光谱分别为568和560nm(图8)。这一现象意味着eb
‑
cpt和ptx之间存在着弱的分子间相互作用,这可能介导了共组装过程。
[0085]
实施例4:eb
‑
cpt与ptx重量比(w/w)为1:2的共组装。
[0086]
将40μl含eb
‑
cpt的甲醇溶液(5.0mg/ml)和80μl含ptx(5.0mg/ml)的甲醇溶液混合,滴加到2ml去离子水中。有机溶剂甲醇主要在通风柜下蒸发,剩余的有机溶甲醇在低压下通过旋转蒸发器进一步脱除。所得溶液清澈,无明显沉淀,表明eb
‑
cpt与ptx共组装成功。本实施例溶液中共组装得到的纳米粒子记作“ecx(1:2)nvs”,其透射电镜图像如图5所示,可以看到,纳米药物完全形成了囊泡状,且囊泡尺寸较为均匀,各囊泡任意截面的直径基本上都在60nm
‑
100nm之间,且各维度截面的直径比例均不超过2:1,整体上呈球形。
[0087]
实施例5:eb
‑
cpt与ptx重量比(w/w)为1:2.5的共组装。
[0088]
将40μl含eb
‑
cpt的甲醇溶液(5.0mg/ml)和100μl含ptx(5.0mg/ml)的甲醇溶液混合,滴加到2ml去离子水中。有机溶剂甲醇主要在通风柜下蒸发,剩余的有机溶剂甲醇在低压下通过旋转蒸发器进一步脱除。所得溶液清澈,无明显沉淀,表明eb
‑
cpt与ptx共组装成功。本实施例溶液中共组装得到的纳米粒子记作“ecx(1:2.5)nvs”,其透射电镜图像如图6所示,可以看到,纳米药物大部分形成了囊泡状,各囊泡任意截面的直径基本上都在100nm以下,且各维度截面的直径比例均不超过2:1,整体上呈球形。
[0089]
对比例1:eb
‑
cpt与ptx重量比(w/w)为1:3的共组装。
[0090]
将40μl含eb
‑
cpt(5.0mg/ml)的甲醇溶液和120μl含ptx(5.0mg/ml)的甲醇溶液混合,滴加到2ml去离子水中。有机溶剂甲醇主要在通风柜下蒸发,剩余的有机溶剂甲醇在低压下通过旋转蒸发器进一步脱除。所得溶液清澈,无明显沉淀,表明eb
‑
cpt与ptx共组装成功。本对比例溶液中共组装得到的纳米粒子记作“ecx(1:3)nvs”,其透射电镜图像如图7所示,可以看到,此时纳米药物形成了短纤维状,其横截面直径大约在100nm,而其长度在1微米左右。
[0091]
对比例2:eb
‑
cpt与ptx重量比(w/w)为1:4的共组装。
[0092]
将40μl含eb
‑
cpt(5.0mg/ml)的甲醇溶液和160μl含ptx(5.0mg/ml)的甲醇溶液混合,滴加到2ml去离子水中。有机溶剂甲醇主要在通风柜下蒸发,剩余的有机溶剂甲醇在低压下通过旋转蒸发器进一步脱除。所得溶液中出现明显的沉淀,表明eb
‑
cpt与ptx共组装不成功。
[0093]
共组装投料比例与纳米粒子形态及载药效果的影响
[0094]
我们经过实验探索了eb
‑
cpt和ptx的共组装投料重量比对共组装行为的影响。在相同条件下,分别以不同的eb
‑
cpt和ptx的投料重量比进行共组装后,得到的纳米囊泡药物载药量及载药率见下表1。
[0095]
表1.以不同重量比共组装的eb
‑
cpt和ptx的ecx纳米药物的载药量(dlc)和载药率(dle)
[0096][0097]
由表1可知,当eb
‑
cpt:ptx的共组装投料重量比为1:0.5时,ecx纳米粒子的直径与eb
‑
cpt粒子的直径相似,但具有与eb
‑
cpt单独纳米粒子相似的显著非晶态结构(图3)。我们进一步发现,将eb
‑
cpt:ptx的共组装投料重量比增加到1:2也会导致形成均匀的ecxnv(图5)。当eb
‑
cpt与ptx的共组装投料重量比为1:2.5(w/w)时,ecx纳米粒子的尺寸增加到130nm左右(图6)。ecx(1:2.5)nvs透射电镜下可见纤维样结构(深色箭头)和囊泡(浅色箭头)融合。有趣的是,如对比例1所述,在相同的条件下,进一步增加这一比例到1:3,可以得到宽度约为70nm且长度约为1微米的管状或短纤维结构(图7)。因此,ptx的加入量可能会改变本发明中特定结构的两亲性eb
‑
cpt疏水单元之间形成氢键网络的动力学过程,从而引导分子重排和前体结构的生长形成不同的形貌。不幸的是,如对比例2所述,当eb
‑
cpt:ptx的共组装投料重量比进一步增加到1:4时,会有明显的沉淀。
[0098]
值得注意的是,实施例4所得的ecx(1:2)不仅形状规则、尺寸均匀,而且其中ptx的dlc高达65.7
±
0.5重量%;实施例5所得的ecx(1:2.5)中ptx的dlc更高,达到70.1%
±
0.8重量%,据我们所知,这是文献中报道的基于ptx的纳米药物的最高dlc值,但是实施例5的ecx(1:2.5)中形成了少量的胶束状纳米粒子,需要后续分离处理。此外,ecx(1:2)nvs中的另一组分eb
‑
cpt也负责谷胱甘肽激活cpt的释放,为cpt增加10.1wt%的dlc。通过高效液相色谱法测定,当eb
‑
cpt:ptx共组装的投料质量比(w/w)为1:0.5、1:1、1:2和1:2.5时,纳米粒子中ptx的载药率(dle)分别为99.7%
±
0.2%、99.6%
±
0.2%、99.4%
±
0.2%和99.1%
±
0.4%。
[0099]
另外还值得注意的是,本发明实施例2
‑
5得到的ecx nvs溶液在水中的ptx浓度可以达到0.3mg/ml,比单独使用ptx(<0.5μg/ml)高出600多倍。由于本发明所述的ecx nvs中没有化学偶联,因此对ptx的药效实现了最大程度的保留。
[0100]
以上数据揭示了本发明的纳米囊泡药物ecx nv可以成为ptx递送和癌症治疗的很有前途的平台。
[0101]
实施例8:体外细胞毒性试验。
[0102]
采用四甲基偶氮唑盐(3
‑
(4,5
‑
dimethylthiazol
‑2‑
yl)
‑
2,5diphenyltetrazolium)比色法测定来自实施例2
‑
5的不同纳米囊泡药物制剂对人结肠癌细胞株hct116、人脑胶质瘤细胞株u87 mg和人胰腺癌细胞株bxpc3的体外细胞毒性。细胞接种于dulbecco's改良eagle's培养基(dmem)或含10%胎牛血清的1640细胞培养液的96孔板中。这些平板在37℃的含5%的co2的潮湿气氛中孵化24小时。来自实施例2
‑
5的不同的纳米
囊泡药物稀释成不同浓度,然后加入每孔(在100μl细胞培养液中)。每种浓度的药物制剂平行重复三次。细胞在上述条件下孵育48h,用含0.5mg/ml mtt的100μl培养基代替。在去除细胞培养液之前,进一步孵育2小时。同时,在每孔中加入100μl二甲基亚砜溶解甲醛晶体,并将平板放入biotek synergy h4混合读取器中,在570nm处测量吸光度。每孔光密度值减去对照组光密度值,计算细胞存活率。用graphpad prism 8(v8.0.2)计算ic50值并进行统计学分析。50%药效水平下的联合指数(ci)由下式计算:ci_(50)=c1/ic_(50),eb
‑
cpt+c2/ic_(50),其中c1和c2分别为eb
‑
cpt和ptx的浓度,结果显示,eb
‑
cpt和ptx可达到50%的细胞杀伤效率。
[0103]
为了探索本发明ecx纳米药物的抗癌潜力,我们在hct116、bxpc3和u87 mg三种癌细胞模型上系统地评价了不同成分的体外细胞毒性。我们首次采用四甲基偶氮唑盐(3
‑
(4,5dimethylthiazol
‑2‑
yl)
‑
2,5
‑
diphenyltetrazolium)比色法研究了与本发明实施例1的eb
‑
cpt、cpt、onivyde、ptx和白蛋白结合型紫杉醇(abraxane)孵育48h后hct116细胞的存活情况(图9)。测得本发明实施例1的eb
‑
cpt、cpt、onivyde、ptx和abraxane的ic50值分别为0.3795、0.087、49.28、0.01165和0.009455μm。然后,我们研究了不同重量比的本发明实施例2
‑
5的经共组装得到的ecx纳米药物(记作“共组装组”)和相应的未经共组装而混合的药物(记作“共混合组”)的细胞毒性。由于eb
‑
cpt和ptx的抗癌效力相差30倍,因此我们在下文中会参考ptx的浓度来比较不同组之间的ic50值。在eb
‑
cpt和ptx的重量比分别为1:0.5、1:1、1:2、1:2.5和1:3的情况下,eb
‑
cpt和ptx共混合组药物对hct116细胞的ic_(50)值分别为0.06086、0.0981、0.001588、0.004522和0.002922μm(图10);而本发明实施例2
‑
5的共组装组ecx样品对hct116细胞的细胞毒性曲线获得的ic50值分别为0.1509、0.007749、0.006638、0.008919和0.0056μm(图11)。
[0104]
我们进一步研究了eb
‑
cpt与ptx的共混合组药物和共组装组的ecx纳米药物对hct116细胞在50%药效水平下的联合指数(ci)(图12)。结果显示,在eb
‑
cpt和ptx的重量比分别为1:0.5、1:1、1:2、1:2.5和1:3的情况下,共混合组的ci分别为6.26、9.25、0.14、0.41和0.26。相比之下,本发明共组装组的ecx纳米药物的ci值分别为1.55、0.73、0.59、0.79和0.5。与共混合组相比,本发明共组装组的纳米药物总体ci值更有利,可能是由于eb
‑
cpt和ptx的细胞摄取效率和释放动力学不同。有趣的是,eb
‑
cpt和ptx的组合在较高ptx含量(w/w比为1:1、1:2、1:2.5和1:3)时主要表现出协同(ci<1)效应,与共混合组和共组装组低ptx含量(w/w比为1:0.5)样品的拮抗(ci>1)效应相反。
[0105]
实施例9:小鼠异种移植瘤模型的抗肿瘤研究。
[0106]
在体外细胞毒性实验结果的鼓舞下,我们进一步开展了hct116移植瘤模型的抗肿瘤研究。
[0107]
通过对每只小鼠右后侧皮下注射含2
×
106个hct116肿瘤细胞的100μl pbs的方法建立肿瘤模型。
[0108]
与对比例1的ecx(1:3)nvs管状结构相比,实施例4的ecx(1:2)nvs具有良好的体外协同作用和良好的生物学尺寸,因此我们选择实施例4的ecx(1:2)nvs进行体内抗癌研究。
[0109]
小鼠肿瘤体积达到40~45mm3左右后,随机分为6组,每组5只。第0天分别给予onivydeo)、abraxane(a)、o+a(1:2w/w)、游离混合物(eb
‑
cpt:ptx=1:2w/w)、本发明实施例4的纳米囊泡ecx(1:2)nvs、生理盐水等不同剂型尾静脉注射处理。每组小鼠从第0~12天每
3天给药5次,按小鼠体重算,每次剂量为1mg/kg的eb
‑
cpt和2mg/kg的ptx,或相当于3mg/kg的药物组合物。从第0天到第18天每隔2天记录肿瘤大小和体重。当小鼠体重达到较开始时下降20%以上或肿瘤任何一个尺寸达到20mm时,终止治疗过程并处死。按公式v=宽度2
×
长度/2计算肿瘤体积,记录各组首次治疗后46天的存活率。
[0110]
结果显示,用游离混合物(eb
‑
cpt:ptx=1:2w/w)治疗的小鼠,由于游离药物成分不可避免的全身毒性,小鼠体重显著下降(如图13所示的星形折线)。根据体重下降20%以上的小鼠采用安乐死的标准,这组小鼠在第12天均被处死。相比之下,接受纳米药物成分治疗的小鼠体重变化相对较小,表明自组装纳米药物具有较低的副作用。结果显示,在46天的观察期内,实施例4的ecx(1:2)nvs处理组小鼠的存活率显著提高(如图14所示的正三角形图标折线)。另一方面,尽管如图14所示,onivyde、abraxane和o+a(1:2w/w)组小鼠的晚期存活率相对于游离混合物组有很大提高,但如图15所示,这些组第18天的肿瘤抑制率(分别为21.4%、42.6%和48.8%)并不令人满意。而本发明实施例4的ecx(1:2)nvs第18天的肿瘤抑制率可达74.9%,显著高于其他纳米药物治疗组。此外,o+a(1:2w/w)组的抑瘤率比单独的onivyde、abraxane组略有提高,这表明在我们的模型中onivyde、abraxane在体内的协同作用可以忽略不计。这一现象与体外细胞毒性研究的结论部分一致,这可能是由于两种药物在体内的时空分布不同步所致。这些结果进一步证明,本发明ecx nvs在体内的抑瘤效率和良好的低毒副作用可能是由于cpt和ptx抗癌药物整合的独特机制所致。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1