榆黄菇提取物及其在抗炎中的应用
1.本发明涉及生物技术领域中,榆黄菇提取物及其在抗炎中的应用。
背景技术:
2.榆黄菇(pleurotus citrinipileatus)又名金顶侧耳、黄金菇、榆黄蘑,隶属于担子菌亚门(basidiomycotina),层菌纲(hymenomycetes),伞菌目(agaricales),侧耳科(pleurotaceae),侧耳属(pleurotus),是较为珍贵的经济食用菌之一。野生榆黄菇子实体因呈浅黄色或黄色且腐生于榆木上而得名,主要分布于欧洲、中国东南亚、美洲等地,榆黄菇香味十分浓郁,形状为浅漏斗形,菌肉为白色,肉质脆嫩;柄为偏生,菇体成簇生长。榆黄菇是一种北方地区常见的食用菌,其因为外型喜人又是食药兼用的食用菌,现在各地都有栽培,其不仅增加了经济效益,还可以与其它作物连作,提升农业园区的利用率,开创新农业的综合发展。
3.随着人们对生活质量要求的提高,榆黄菇因其具高蛋白、低脂肪、低糖等特点,已经成为了人们餐桌上常见的美味佳肴。榆黄菇含有丰富的蛋白质、氨基酸、维生素、多糖、钠、钙、铁、钾、锌等丰富的营养物质,有关榆黄菇功能多糖的提取纯化研究比较少,且其功能研究多集中在护肝消脂、抗氧化和保湿方面。
技术实现要素:
4.本发明所要解决的技术问题是如何抑制炎症。
5.为解决上述技术问题,本发明首先提供了一种抗炎产品,其特征在于:所述产品的活性成分为psi或psii;
6.所述psi由包括下述步骤的方法制备:m1)制备名称为榆黄菇粗提物的榆黄菇提取物,所述榆黄菇粗提物的制备方法包括用乙醇沉淀榆黄菇子实体水提液,收集沉淀,得到名称为榆黄菇粗提物的榆黄菇提取物;所述榆黄菇子实体水提液是用水从榆黄菇子实体中提取出来的水溶性物质;m2)去除所述榆黄菇粗提物中的蛋白质,得到去除蛋白质的提取物;对所述去除蛋白质的提取物进行阴离子交换柱层析,收集洗脱峰,得到名称为d1的榆黄菇提取物;所述阴离子交换柱层析中所采用的阴离子交换基团是 deae,所采用的洗脱程序为一步洗脱,所述一步洗脱用ph为6.8
‑
7.5(如7)的磷酸缓冲溶液进行洗脱,所述磷酸缓冲溶液的溶质为nah2po4和na2hpo4,所述磷酸缓冲溶液中磷酸二氢根与磷酸氢根的总浓度为5
‑
15mm(如10mm);m3)利用superdex
‑
75 分子凝胶层析柱对名称为d1的榆黄菇提取物进行纯化,收集目标峰,得到名称为psi 的榆黄菇提取物;
7.所述psii由包括下述步骤的方法制备:m1)制备名称为榆黄菇粗提物的榆黄菇提取物,所述榆黄菇粗提物的制备方法包括用乙醇沉淀榆黄菇子实体水提液,收集沉淀,得到名称为榆黄菇粗提物的榆黄菇提取物;所述榆黄菇子实体水提液是用水从榆黄菇子实体中提取出来的水溶性物质;m2')去除所述榆黄菇粗提物中的蛋白质,得到去除蛋白质的提取物;对所述去除蛋白质的提取物进行阴离子交换柱层析,收集洗脱峰,得到名称为d2的榆黄
菇提取物;所述阴离子交换柱层析中所采用的阴离子交换基团是deae,所采用的洗脱程序为二步洗脱,第一步洗脱用ph为6.8
‑
7.5(如7)的磷酸缓冲溶液进行洗脱,所述磷酸缓冲溶液的溶质为nah2po4和na2hpo4,所述磷酸缓冲溶液中磷酸二氢根与磷酸氢根的总浓度为5
‑
15mm(如10mm);第二步洗脱用nacl 溶液洗脱,所述nacl溶液的溶质是0.2m nacl,溶剂是所述磷酸缓冲溶液;m3')利用superdex
‑
75分子凝胶层析柱对名称为d2的榆黄菇提取物进行纯化,收集目标峰,得到名称为psii的榆黄菇提取物。
8.所述磷酸缓冲溶液中磷酸二氢根与磷酸氢根的浓度分别可为3.9mm和6.1mm。
9.上述产品中,所述榆黄菇子实体水提液按照包括如下步骤的方法制备:用水浸泡粉碎后的榆黄菇子实体8
‑
12小时(如8小时),加热至90
‑
100℃(如90℃)保持3
‑
4 小时(如4小时),收集水溶性物质,该水溶性物质即为榆黄菇子实体水提液。
10.上述产品中,所述水可为去离子水。
11.上述产品中,所述榆黄菇可为新鲜的子实体也可为干燥的子实体。
12.上述干燥的子实体是将新鲜的榆黄菇子实体在常温(如20
‑
25℃)下干燥或冷冻干燥得到的。
13.上述产品中,所述收集水溶性物质可采用离心的方法进行,所述离心采用的离心力可为6000g
‑
15000g(如6000g),离心时间可为20
‑
30分钟(如30分钟)。
14.上述产品中,所述产品还可含有载体或赋形剂。所述载体材料包括但不限于水溶性载体材料(如聚乙二醇、聚乙烯吡咯烷酮、有机酸等)、难溶性载体材料(如乙基纤维素、胆固醇硬脂酸酯等)、肠溶性载体材料(如醋酸纤维素酞酸酯和羧甲基纤维素等)。
15.上述产品中,所述抗炎可为下述1)
‑
6)中的6种、5种、4种、3种、2种或1 种:
16.1)提高炎症细胞的存活率;
17.2)降低炎症巨噬细胞的吞噬能力;
18.3)降低炎症细胞的nos酶活性;
19.4)降低炎症细胞的il
‑
1β的释放量;
20.5)降低炎症细胞的il
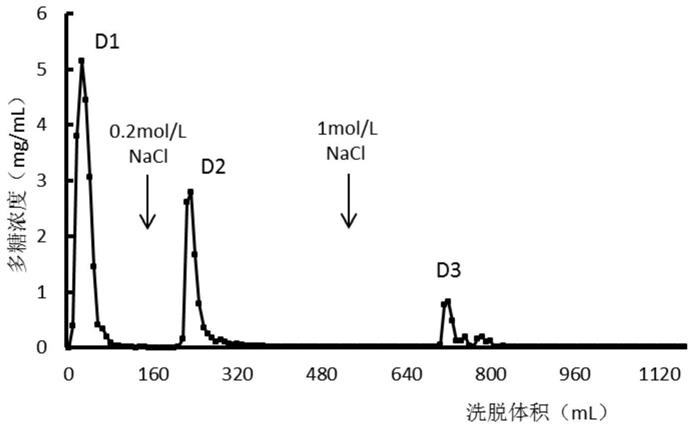
‑
6的释放量;
21.6)降低炎症细胞的tnf
‑
ɑ
的释放量。
22.上述产品中,所述炎症细胞可为炎症巨噬细胞。
23.所述psi或所述psii或所述名称为榆黄菇粗提物的榆黄菇提取物在制备抗炎产品中的应用,也属于本发明的保护范围。
24.上述应用中,所述抗炎可为下述1)
‑
6)中的6种、5种、4种、3种、2种或1 种:
25.1)提高炎症细胞的存活率;
26.2)降低炎症巨噬细胞的吞噬能力;
27.3)降低炎症细胞的nos酶活性;
28.4)降低炎症细胞的il
‑
1β的释放量;
29.5)降低炎症细胞的il
‑
6的释放量;
30.6)降低炎症细胞的tnf
‑
ɑ
的释放量。
31.上述应用中,所述炎症细胞可为炎症巨噬细胞。
32.本发明还提供了下述i或ii的方法:
33.i、名称为psi的榆黄菇提取物的制备方法,包括m1)、m2)和m3):
34.m1)制备名称为榆黄菇粗提物的榆黄菇提取物,所述榆黄菇粗提物的制备方法包括用乙醇沉淀榆黄菇子实体水提液,收集沉淀,得到名称为榆黄菇粗提物的榆黄菇提取物;所述榆黄菇子实体水提液是用水从榆黄菇子实体中提取出来的水溶性物质;
35.m2)去除所述榆黄菇粗提物中的蛋白质,得到去除蛋白质的提取物;对所述去除蛋白质的提取物进行阴离子交换柱层析,收集洗脱峰,得到名称为d1的榆黄菇提取物;所述阴离子交换柱层析中所采用的阴离子交换基团是deae,所采用的洗脱程序为一步洗脱,所述一步洗脱用ph为6.8
‑
7.5(如7)的磷酸缓冲溶液进行洗脱,所述磷酸缓冲溶液的溶质为nah2po4和na2hpo4,所述磷酸缓冲溶液中磷酸二氢根与磷酸氢根的总浓度为5
‑
15mm(如10mm);
36.m3)利用superdex
‑
75分子凝胶层析柱对名称为d1的榆黄菇提取物进行纯化,收集目标峰,得到名称为psi的榆黄菇提取物;
37.ii、名称为psii的榆黄菇提取物的制备方法,包括上述m1)和下述m2’)、m3'):
38.m2')去除所述榆黄菇粗提物中的蛋白质,得到去除蛋白质的提取物;对所述去除蛋白质的提取物进行阴离子交换柱层析,收集洗脱峰,得到名称为d2的榆黄菇提取物;所述阴离子交换柱层析中所采用的阴离子交换基团是deae,所采用的洗脱程序为二步洗脱,第一步洗脱用ph为6.8
‑
7.5(如7)的磷酸缓冲溶液进行洗脱,所述磷酸缓冲溶液的溶质为nah2po4和na2hpo4,所述磷酸缓冲溶液中磷酸二氢根与磷酸氢根的总浓度为5
‑
15mm(如10mm);第二步洗脱用nacl溶液洗脱,所述nacl溶液的溶质是0.2m nacl,溶剂是所述磷酸缓冲溶液;
39.m3')利用superdex
‑
75分子凝胶层析柱对名称为d2的榆黄菇提取物进行纯化,收集目标峰,得到名称为psii的榆黄菇提取物。
40.本发明还提供了下述任一方法:
41.x1、一种制备吞噬能力下降巨噬细胞模型的方法,包括:对炎症细胞施加权利要求1中所述psi或所述psii,得到吞噬能力下降巨噬细胞模型;
42.x2、一种制备nos酶活力下降巨噬细胞模型的方法,包括:对炎症细胞施加权利要求1中所述psi或所述psii,得到nos酶活力下降巨噬细胞模型;
43.x3、一种制备il
‑
1β分泌量下降巨噬细胞模型的方法,包括:对炎症细胞施加权利要求1中所述psi或所述psii,得到il
‑
1β分泌量下降巨噬细胞模型;
44.x4、一种制备il
‑
6分泌量下降巨噬细胞模型的方法,包括:对炎症细胞施加权利要求1中所述psi或所述psii,得到il
‑
6分泌量下降巨噬细胞模型;
45.x5、一种制备tnf
‑
α分泌量下降巨噬细胞模型的方法,包括:对炎症细胞施加权利要求1中所述psi或所述psii,得到tnf
‑
α分泌量下降巨噬细胞模型。
46.上述方法中,所述炎症细胞可为炎症巨噬细胞。
47.利用上述x1
‑
x5中任一所述方法得到的吞噬能力下降巨噬细胞模型、nos酶活力下降巨噬细胞模型、il
‑
1β分泌量下降巨噬细胞模型、il
‑
6分泌量下降巨噬细胞模型或tnf
‑
α分泌量下降巨噬细胞模型,也属于本发明的保护范围。
48.本发明中,psi的活性成分可为由阿拉伯糖、甘露糖、葡萄糖和半乳糖组成。psi 中阿拉伯糖、甘露糖、葡萄糖和半乳糖的摩尔配比可为1:6.2:6.3:67.2。
49.psii的活性成分可为由木糖、葡萄糖和半乳糖组成。psii中木糖、葡萄糖和半乳糖
的摩尔配比可为1:83.9:4.2。
50.本发明中,所述炎症巨噬细胞具体可为lps诱导巨噬细胞得到的炎症细胞模型。所述巨噬细胞可为小鼠单核巨噬细胞(如raw264.7细胞)。
51.本发明以榆黄菇为原料,得到了两个榆黄菇提取物——psi和psii,本发明的psi 和psii具有抗炎作用:psi和psii可以提高炎症细胞的活力,提高其存活率;psi和 psii具有降低炎症巨噬细胞吞噬能力的作用;psi和psii可以降低炎症细胞nos活性; psi和psii可以降低炎症细胞细胞因子(il
‑
1β、il
‑
6、tnf
‑
α)的分泌量。因此,本发明的psi和psii具有抗炎的效果,具有很好的实用价值。
附图说明
52.图1为榆黄菇粗多糖deae
‑
cellulose柱层析洗脱曲线。
53.图2为d1凝胶过滤洗脱曲线。
54.图3为d2凝胶过滤洗脱曲线。
55.图4为psi红外光谱分析图。
56.图5为psii红外光谱分析图。
57.图6为psi全水解还原乙酰化gc
‑
ms质谱图。
58.图7为psii全水解还原乙酰化gc
‑
ms质谱图。
59.图8为lps诱导巨噬细胞建立炎症模型。标有相同大写字母的数据间无显著差异 (p>0.01),标有不同大写字母的数据间有显著差异(p<0.01)。
60.图9为psi对炎症细胞raw264.7活力的影响。0+0表示空白组;5+0表示经过 5μg/ml lps处理的炎症组;5+2000表示经过5μg/ml lps处理和给药组2000μg/ml psi处理,5+1000表示经过5μg/ml lps处理和给药组1000μg/ml psi处理,5+500 表示经过5μg/ml lps处理和给药组500μg/ml psi处理,5+250表示经过5μg/ml lps 处理和给药组250μg/ml psi处理,5+125表示经过5μg/ml lps处理和给药组125 μg/ml psi处理。标有相同小写字母的数据间无显著差异(p>0.05),标有不同小写字母的数据间有显著差异(p<0.05)。
61.图10为psii对炎症细胞raw264.7活力的影响。0+0表示空白组;5+0表示经过 5μg/ml lps处理的炎症组;5+200表示经过5μg/ml lps处理和给药组200μg/ml psii处理,5+100表示经过5μg/ml lps处理和给药组100μg/ml psii处理,5+50 表示经过5μg/ml lps处理和给药组50μg/ml psii处理,5+25表示经过5μg/ml lps 处理和给药组25μg/ml psii处理,5+12.5表示经过5μg/ml lps处理和给药组12.5 μg/ml psii处理。标有相同小写字母的数据间无显著差异(p>0.05),标有不同小写字母的数据间有显著差异(p<0.05)。
62.图11为psi和psii对炎症细胞吞噬能力的影响。标有相同小写字母的数据间无显著差异(p>0.05),标有不同小写字母的数据间有显著差异(p<0.05)。
63.图12为psi和psii对炎症细胞nos酶活力的影响。标有相同小写字母的数据间无显著差异(p>0.05),标有不同小写字母的数据间有显著差异(p<0.05)。
64.图13为psi和psii对炎症细胞分泌il
‑
1β水平的影响。标有相同小写字母的数据间无显著差异(p>0.05),标有不同小写字母的数据间有显著差异(p<0.05)。
65.图14为psi和psii对炎症细胞分泌il
‑
6水平的影响。标有相同小写字母的数据间无显著差异(p>0.05),标有不同小写字母的数据间有显著差异(p<0.05)。
na2hpo4,溶剂为水)中透析12
‑
16小时,得到调节ph值后的榆黄菇粗多糖溶液。
81.利用10mm ph 7.0的磷酸缓冲溶液平衡deae
‑
cellulose层析柱(5
×
20cm,sigma 公司,d0909),将调节ph值后的榆黄菇粗多糖溶液上样进行阴离子交换柱层析,上样体积为80ml,利用nacl(溶剂为10mm ph 7.0的磷酸缓冲溶液)溶液进行梯度洗脱,洗脱流速为2.5ml/min,具体如下:
[0082]0‑
168ml(包括168ml)利用10mm ph 7.0的磷酸缓冲溶液洗脱;168
‑
632ml(不包括168ml,包括632ml)利用nacl浓度为0.2m的nacl溶液洗脱;632
‑
1120ml(不包括632ml)利用nacl浓度为1m的nacl溶液洗脱。
[0083]0‑
144ml洗脱得到流出液d1;208
‑
376ml洗脱得到流出液d2;656
‑
920ml洗脱得到流出液d3。
[0084]
分别收集不同时间段洗脱出的溶液(即流出液),测定各流出液的多糖浓度,收集到两个多糖含量较高的流出液d1和d2,d1和d2分别为在0和0.2m nacl溶液洗脱时获得的洗脱峰(图1)。
[0085]
将流出液d1和d2分别上样于superdex
‑
75分子凝胶层析柱(美国ge公司hiload 16/60),用超纯水进行洗脱,洗脱流速为0.5ml/min,d1和d2经过凝胶过滤分离后呈现出单峰(图2和图3),说明已获得提纯品,收集目标洗脱峰,冷冻干燥48h后获得多糖纯品,d1经superdex
‑
75分子凝胶层析得到的榆黄菇提取物多糖记为榆黄菇多糖psi,d2经superdex
‑
75分子凝胶层析得到的榆黄菇提取物多糖记为榆黄菇多糖 psii。
[0086]
对榆黄菇多糖psi与榆黄菇多糖psii进行多糖分子特性分析:
[0087]
分子量测定与红外光谱(ir)分析:利用凝胶渗透色谱技术(gpc)测定psi和psii 的相对分子质量(分子量分布)。样品溶解后进行过滤脱气处理,采用hplc凝胶色谱仪tsk gmpwxl色谱柱进行检测,流动相为水(0.1n硝酸钠+0.05%叠氮化钠),柱温控制在35℃,流速为0.6ml/min;分别取1~2mg的psi和psii样品,利用kbr压片法进行制片,采用傅里叶变换红外光谱仪nicolet is5进行检测分析。
[0088]
分别通过gpc方法测定psi和psii的分子量,结果显示psi重均分子量(mw)为 1.216
×
106da,mw/mn值为1.06;psii的重均分子量较低,为1.608
×
104da,mw/mn 值为1.478。多糖分子经过红外吸收光谱技术分析分子组成的特殊基团,吸收峰图谱如图4和图5所示。图谱显示psi和psii在3400cm
‑1附近存在一个宽峰,此位置是
ꢀ‑
oh的伸缩振动吸收峰,在2900cm
‑1附近的吸收峰是c
‑
h的吸收峰,这是糖类的特征峰,同时在1640cm
‑1附近的峰说明两个多糖都存在c=o键,956cm
‑1附近是吡喃环末端次甲基的横摇振动峰。通过分析发现,psi和psii的都具有糖类特征基团,其中 1400
‑
1100cm
‑1附近的吸收峰可能是c
‑
h的变形振动峰。
[0089]
单糖组成分析:利用多糖糖醇醋酸盐衍生物的方法对样品的单糖组成和摩尔比进行测定。以鼠李糖、葡萄糖、木糖、半乳糖、阿拉伯糖、甘露糖、岩藻糖、核糖、葡萄糖醛酸、半乳糖醛酸为标准样品进行标准曲线的制作,其后称取多糖样品5mg,以2mol/l的三氟乙酸(tfa)溶解,99℃水解5h,旋蒸除酸,加入4%的硼氢化钠溶液0.5ml,室温放置1.5h,滴加乙酸至无气泡产生,反复浓缩除酸。将浓缩至干的样品真空干燥,加吡啶及正丙胺各1ml,55℃水浴30min,真空干燥,加吡啶及乙酸酐各0.5ml,95℃水浴1h,氮气吹干,真空干燥后以氯仿溶解,进行gc
‑
ms分析[17]。gc
‑
ms分析条件如下所列,色谱柱:db
‑
5(30m
ꢀ×
0.25mm
×
0.25μ
m);检测器:质谱检测器;进样口温度:250℃;检测器温度:280℃;氦气流速:0.6ml/min;分流比:20:1;进样量:5μl;升温程序:200℃保持2min,以3℃/min的速率升至245℃,再以10℃/min的速率升至270℃,保持2min。
[0090]
psi和psii样品经过酸性水解后利用gc
‑
ms质谱图进行单糖分析,通过与标准样品的保留时间比对分析单糖种类,分析发现psi是由阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,通过每一种糖组分的峰值面积,计算各单糖的响应因子,根据摩尔数量比计算出摩尔配比为1:6.2:6.3:67.2,psi质谱图如图6所示;根据保留时间推断出, psii是由木糖、葡萄糖和半乳糖组成的杂多糖。采用面积归一化方法,根据平均百分含量和响应因子得出摩尔比为1:83.9:4.2。psii质谱结果见图7所示。
[0091]
2、榆黄菇多糖对raw264.7炎症细胞活力的影响
[0092]
2.1、细胞的培养
[0093]
将巨噬细胞raw246.7培养于含有10%胎牛血清、1%的10mg/ml(原液浓度)链霉素和10000u/ml(原液浓度)青霉素的rpmi高糖培养基中,放置于37℃、5%co2、 95%湿度的培养箱中培养,每隔一天用pbs清洗后再用含有0.02%edta和0.25%胰蛋白酶的细胞消化液(含0.02%edta和0.25%胰蛋白)进行传代培养。
[0094]
2.2、利用lps诱导巨噬细胞raw246.7建立炎症模型
[0095]
取对数生长期raw264.7细胞按照1
×
104个/孔的数目接种到96孔板中,放置于培养箱中37℃培养6h后用pbs清洗后,分别设置空白组和炎症模型组,炎症组加入不同浓度的lps溶液(溶剂为未添加血清的rpmi高糖培养基,溶质为lps),lps浓度分别为1、3、5、7、9μg/ml,每种浓度3个复孔,空白组(即lps浓度为0)则加入等体积的未添加血清的rpmi高糖培养基,3个复孔;而后将96孔板置于培养箱中 37℃24h后收集各孔的细胞上清液,利用tnf
‑
αelisa试剂盒测定tnf
‑
α浓度水平。
[0096]
tnf
‑
ɑ
是细胞产生炎症反应的始发因子,当一定浓度的lps刺激巨噬细胞 raw264.7后能使细胞过量且持续地产生tnf
‑
ɑ
引起炎症反应。由图8可知,raw264.7 巨噬细胞在lps的诱导下释放炎性因子tnf
‑
α的水平明显增高,lps浓度为5μg/ml 时,释放炎性因子tnf
‑
α的水平达到最高值,因此设定其为诱导炎症模型的最佳浓度,以该浓度进行后续实验。
[0097]
2.3、榆黄菇多糖对raw264.7炎症细胞活力的影响
[0098]
取对数生长期raw264.7细胞按照8
×
103个/孔的数目接种到96孔板中,放置于培养箱中37℃培养6h后用pbs清洗,分别设置空白组、炎症组和给药组,炎症组和给药组分别加入终浓度为5μg/ml的lps溶液37℃孵育24h诱导细胞形成炎症,空白组(即lps浓度为0)则加入等体积的未添加血清的rpmi高糖培养基同步实验。而后将步骤1得到的榆黄菇多糖psi加入培养板给药组中,其在培养板中的终浓度设置为125、250、500、1000、2000μg/ml,每种浓度3个复孔;炎症组、空白组不添加多糖,每组3个复孔;将96孔板放置于培养箱37℃培养24h,采用mtt法测定细胞存活率。
[0099]
按照上述方法,将“榆黄菇多糖psi”替换为“榆黄菇多糖psii”,榆黄菇多糖 psii的终浓度设置为12.5、25、50、100、200、250μg/ml,其他步骤均不变,检测榆黄菇多糖psii对raw264.7炎症细胞活力的影响。
[0100]
经不同浓度的psi作用于被lps刺激过的raw264.7细胞24h后,空白组、炎症组的细
胞存活率分别为100
±
8.32和191.59
±
5.32%,给药组psi终浓度为125、250、 500、1000、2000μg/ml时的细胞存活率分别为163.04
±
12.53、173.08
±
16.69、206.08
ꢀ±
9.20、172.21
±
3.07、177.32
±
9.61%,psi为500μg/ml的处理组细胞存活率与其它给药组达到显著性差异的程度(p<0.05)。其细胞存活率最大,为206.08%,图9。
[0101]
经不同浓度的psii作用于被lps刺激过的raw264.7细胞24h后,空白组、炎症组的细胞存活率分别为100
±
8.32和191.59
±
5.32%,给药组psii终浓度为12.5、25、 50、100、200、250μg/ml时的细胞存活率分别为139.30
±
5.87、153.18
±
3.14、 172.17
±
4.68、174.01
±
9.70、210.86
±
16.15、180.97
±
4.67%,给药组不同psii浓度间均有显著差异,且给药组psii浓度为200μg/ml时的细胞存活率显著高于炎症组,说明psii在浓度为200μg/ml时可以提高炎症raw264.7细胞的活力,图10。
[0102]
3、中性红试验观察榆黄菇多糖对raw264.7细胞吞噬活性的影响
[0103]
取对数生长期raw264.7细胞按照1
×
104个/孔的数目接种到96孔板中,放置于培养箱中37℃培养6h,用pbs清洗后,分别设置空白组、炎症组和给药组,炎症组和给药组分别加入终浓度为5μg/ml的lps溶液37℃孵育2小时诱导细胞形成炎症,空白组(即lps浓度为0)则加入等体积的未添加血清的rpmi高糖培养基同步实验。而后给药组加入用未添加血清的rpmi高糖培养基稀释的psi溶液或psii溶液200μl, psi与psii在培养孔中的终浓度分别为500μg/ml和200μg/ml,每处理设置3个重复孔,炎症组、空白组加入200μl的未添加血清的rpmi高糖培养基每组3个复孔;将96孔板置于培养箱中37℃培养24h后弃去培养液,用pbs清洗细胞,加入0.09%中性红溶液200μl置于培养箱中继续培养4h,吸弃培养液,用pbs清洗细胞,加入200μl细胞裂解液(冰醋酸:无水乙醇体积比为1:1)裂解10min后,用酶标仪在690nm波长处测定吸光度,检测细胞吞噬活性。
[0104]
吞噬活性=a690nm样品/a690nm空白
×
100%,其中a690样品为炎症组或给药组吸光值,a690空白为空白组组吸光值。
[0105]
由图11可知,与空白组相比较,空白组的吞噬率记为100%,作为参照,炎症组的细胞吞噬率增加了68.13%,由此可见巨噬细胞在受到lps的刺激后其吞噬能力显著性增加(p<0.05);psi处理后细胞吞噬率为143.07
±
2.19%,psii处理后细胞的吞噬率138.13
±
5.21%,多糖psi和psii都具有显著性减少细胞吞噬能力作用(p<0.05),说明psi和psii可以缓解lps对巨噬细胞的刺激作用。
[0106]
4、榆黄菇多糖对raw264.7一氧化氮合酶(nos)活性的影响
[0107]
取对数生长期raw264.7细胞按照3
×
106个/孔的数目接种到24孔板中,放置于培养箱中37℃培养6h,用pbs清洗后,分别设置空白组、炎症组和给药组,炎症组和给药组分别加入终浓度为5μg/ml的lps溶液37℃孵育2小时诱导细胞形成炎症,空白组(即lps浓度为0)则加入等体积的未添加血清的rpmi高糖培养基同步实验。而后给药组加入用未添加血清的rpmi高糖培养基稀释的psi溶液或psii溶液200μl, psi与psii在培养孔中的终浓度分别为500μg/ml和200μg/ml,每处理设置3个重复孔,炎症组、空白组加入200μl的未添加血清的rpmi高糖培养基,每组3个复孔;将96孔板置于培养箱中37℃培养24h后收集细胞,利用100μl超纯水反复冻融细胞3次,12000r/min离心10min,取上清液,利用bca蛋白定量试剂盒确定全细胞蛋白含量,利用一氧化氮合酶试剂盒按照说明书操作,测定吸光值并换算成nos酶活力值。
[0108][0109]
如图12所示,空白组、炎症组、psi给药组、psii给药组的nos酶活力分别为 7.16
±
0.43、9.53
±
0.45、5.39
±
0.28、4.50
±
0.21u/mgprot。与炎症组中nos酶活力相比较,多糖psi和psii对巨噬细胞nos的分泌水平抑制率分别43.44% ((9.53
‑
5.39)/9.53*100%)、52.78%((9.53
‑
4.5)/9.53*100%),即psi和psii处理后nos酶活力分别下降了43.44%、52.78%(p<0.05),说明多糖psi和psii能显著性降低nos水平。
[0110]
5、榆黄菇多糖对raw264.7细胞因子(il
‑
1β、il
‑
6、tnf
‑
α)的影响
[0111]
取对数生长期raw264.7细胞按照3
×
106个/孔的数目接种到6孔板中,放置于培养箱中37℃培养6h,用pbs清洗后,分别设置空白组、炎症组和给药组,炎症组和给药组分别加入终浓度为5μg/ml的lps溶液37℃孵育2小时诱导细胞形成炎症,空白组(即lps浓度为0)则加入等体积的未添加血清的rpmi高糖培养基同步实验。而后给药组加入用未添加血清的rpmi高糖培养基稀释的psi溶液或psii溶液200μl, psi与psii在培养孔中的终浓度分别为500μg/ml和200μg/ml,每处理设置3个重复孔,炎症组、空白组加入200μl的未添加血清的rpmi高糖培养基,每组3个复孔;将96孔板置于培养箱中37℃培养24h后收集培养液,分别利用mouse il
‑
1βelisa 检测试剂盒、mouse il
‑
6elisa检测试剂盒、mouse tnf
‑
αelisa试剂盒检测il
‑
1 β、il
‑
6、tnf
‑
α细胞因子的含量。
[0112]
由图13可知,利用psi和psii处理raw264.7炎症细胞24h后,空白组、炎症组、psi给药组、psii给药组的il
‑
1β的含量分别为33.32
±
0.66、58.28
±
1.79、 41.47
±
4.10、36.39
±
1.49pg/ml。与空白组相比,炎症组il
‑
1β的含量增加了74.91% ((58.28
‑
33.32)/33.32*100%),差异显著(p<0.05);与炎症组相比,psi给药组、 psii给药组的il
‑
1β的含量分别降低了28.84%((58.28
‑
41.47)/58.28*100%)和 37.56%((58.28
‑
36.39)/58.28*100%),差异达到显著水平(p<0.05)。
[0113]
由图14可知,利用psi和psii处理raw264.7炎症细胞24h后,空白组、炎症组、psi给药组、psii给药组的il
‑
6的含量分别为51.58
±
1.24、135.24
±
1.49、97.01
ꢀ±
5.19、92.84
±
9.06μg/ml。与空白组相比,炎症组il
‑
6的含量增加了162.19% ((135.24
‑
51.58)/51.58*100%),差异显著(p<0.05);与炎症组相比,psi给药组、 psii给药组的il
‑
6的含量分别降低了28.27%((135.24
‑
97.01)/135.24*100%)和 31.35%((135.24
‑
92.84)/135.24*100%),差异达到显著水平(p<0.05)。
[0114]
由图15可知,利用psi和psii处理raw264.7炎症细胞24h后,空白组、炎症组、psi给药组、psii给药组的tnf
‑
α的含量分别为425.21
±
14.17、793.29
±
13.30、 553.29
±
68.08、534.13
±
20.06μg/ml。与空白组相比,炎症组tnf
‑
α的含量增加了 86.54%((793.29
‑
425.21)/425.21*100%),差异显著(p<0.05);与炎症组相比,psi 给药组、psii给药组的tnf
‑
α的含量分别降低了30.25%((793.29
‑
553.29) /793.29*100%)、32.67%((793.29
‑
534.13)/793.29*100%),差异达到显著水平(p <0.05)。
[0115]
说明lps可以诱导raw246.7细胞的炎症,il
‑
1β、il
‑
6、tnf
‑
α分泌增加,而多糖psi和psii在一定程度上可以达到缓解炎症效果。
[0116]
综上所述,榆黄菇多糖具有抗炎的效果,通过活化细胞,控制巨噬细胞增殖、吞噬来发挥其抗炎的作用。
[0117]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1