一种3D打印尿道修复重建的支架及其制备方法与流程
一种3d打印尿道修复重建的支架及其制备方法
技术领域
1.本发明涉及尿道修复支架及制备方法,尤其是一种3d打印尿道修复重建的支架及其制备方法,属于医学修复和组织工程领域。
背景技术:
2.由于各种原因所导致的复杂性尿道疾病,历来是泌尿外科临床治疗中的一个难题。虽然多种自体组织作为替代材料已经在尿道修复重建中获得理想的效果,但相比而言组织工程技术没有前者“牺牲正常组织为代价,以手术创伤修复组织缺损”的固有缺陷,因而更可作为未来尿道重建发展的主要方向。近年来,组织工程的发展及干细胞的应用为尿道的修复与重建提供了新的思路和广阔的前景。但如何制备具有理想的稳定性、显著的力学性能和降解性能,并具有良好的生物相容性的尿道修复支架仍具有很大的挑战。
技术实现要素:
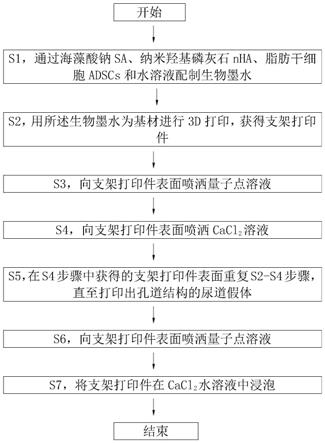
3.为克服上述缺点,本发明的目的在于提供一种3d打印的尿道修复重建支架的制备方法,包括以下步骤:
4.s1,利用海藻酸钠sa、纳米羟基磷灰石nha、脂肪干细胞adscs和水溶液配制生物墨水;
5.s2,以所述生物墨水为基材进行3d打印,获得支架打印件;
6.s3,向支架打印件表面喷洒量子点溶液,;
7.s4,向支架打印件上表面喷洒cacl2溶液;
8.s5,在s4步骤中获得的支架打印件上表面重复s2
‑
s4步骤,直至打印出孔道结构的尿道假体;
9.s6,向支架打印件表面喷洒量子点溶液;
10.s7,将支架打印件在cacl2水溶液中浸泡。
11.优选地,s1中,所述生物墨水包括如下质量百分比的组分:海藻酸钠sa是1~3%;纳米羟基磷灰石nha是5~15%;脂肪干细胞adscs是5*104~1.5*105个/ml。
12.优选地,s1中,所述生物墨水包括如下质量百分比的组分:海藻酸钠sa是2%;纳米羟基磷灰石nha是10%;脂肪干细胞adscs是105个/ml。
13.优选地,s3中,量子点溶液的制备方法为:
14.s3a,将3
‑
氨丙基三甲氧基硅烷、1,8
‑
萘酰亚胺、超纯水混合并搅拌,获得硅量子点前体溶液;
15.s3b,将步骤s3a的硅量子点前体溶液经过紫外光照射,获得硅量子点样品溶液;
16.s3c,将步骤s3b中的硅量子点样品溶液进行低速离心,收集上清液,并对上清液进行透析,收集截留液,将所述截留液用超纯水稀释后干燥,获得高荧光sinps;
17.s3d,将步骤s3c中的高荧光sinps用超纯水配置为量子点溶液。
18.优选地,s3中,喷洒量子点溶液的时间为2
‑
4s。
19.优选地,s4中,cacl2水溶液的浓度为1
‑
3%。
20.优选地,s6中,喷洒量子点溶液的时间为8
‑
12s。
21.优选地,s7中,支架打印件在cacl2水溶液中浸泡时长为8
‑
12s,cacl2水溶液的浓度为1
‑
3%。
22.本发明还提供了一种利用上述的方法制备的尿道修复重建支架。
23.本发明还提供了一种3d打印的尿道修复重建支架,包括海藻酸钠sa、纳米羟基磷灰石nha和脂肪干细胞adscs组分。
24.本发明的有益效果是:本发明制备的尿道修复支架,制备方法简便,成本低廉。在对其进行体内和体外的一系列测试后,证实该支架具有理想的稳定性、显著的力学性能和降解性能,并具有良好的生物相容性,适用于组织工程领域和尿道的临床修复的应用。
附图说明
25.图1为本发明实施例3中尿道修复重建支架制备方法的流程图;
26.图2为本发明实施例4中尿道修复重建支架的ros检测图;
27.图3为本发明实施例4中尿道修复重建支架的微观结构的扫描电子显微镜图;
28.图4为本发明实施例4中尿道修复重建支架的吸水性测试图;
29.图5为本发明实施例4中尿道修复重建支架的降解率测试图;
30.图6为本发明实施例4中尿道修复重建支架的拉伸性能测试图;
31.图7为本发明实施例4中细胞染色荧光显微镜图;
32.图8为本发明实施例5中新西兰兔4周和8周后的大体外观;
33.图9为本发明实施例5中新西兰兔4周和8周后h&e染色后病例检查图像;
34.图10为本发明实施例5中新西兰兔4周和8周后masson染色后病例检查图像;
35.图11为本发明实施例5中新西兰兔4周和8周后通过ae1/ae3免疫细胞化学双重染色法检查图像。
具体实施方式
36.为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图1
‑
11,对本发明进一步详细说明。
37.实施例1
38.本实施例提供的量子点溶液的制备方法,具体技术方案如下:
39.量子点溶液的制备方法,包括如下步骤:
40.s1,将100ml的3
‑
氨丙基三甲氧基硅烷(aps)加入至溶解了20g的1,8
‑
萘酰亚胺的900ml的超纯水中,搅拌10min,获得硅量子点前体溶液;
41.s2,将步骤s1的硅量子点前体溶液经过紫外光照射30min获得绿色荧光的硅量子点样品溶液,后冷却至30℃以下。
42.s3,将步骤s2中的硅量子点样品溶液进行6000rpm,15min的低速离心,低速离心的目的在于使1,8
‑
萘酰亚胺沉淀下来,硅量子点在这种低离心率下不会沉淀,因此所得硅量子点和aps保留在上清液中,收集上清液,并对上清液进行透析(mwco,1000,spectra/pro),aps由于分子量较小(<1kda)而被充分过滤,收集截留液,收集的sinps的分子量远大于
1kda,将截留液用超纯水稀释后干燥,称重获得10g高荧光sinps。
43.s4,将步骤s3中的高荧光sinps用超纯水配置为10%量子点溶液。以上操作均在超净台进行,全程保持无菌。
44.实施例2
45.本实施例提供的脂肪干细胞adscs原代培养方法,具体技术方案如下:
46.新西兰兔,6
‑
8个月,戊巴比妥全身麻醉后无菌切取腹股沟处10g脂肪组织,剔除肉眼可见筋膜及血管,0.25%氯霉素浸泡30分钟,pbs漂洗3遍,眼科剪尽量剪碎成肉沫状,加入0.1%i型胶原酶在37℃中消化1h,100目滤网过滤,300g离心5min,加入干细胞培养基重悬后接种于100mm细胞培养皿中继续培养,每2
‑
3天更换培养基。
47.脂肪干细胞培养基组成:450ml低糖dmem培养基+50ml胎牛血清+100u/ml青霉素+100mg/ml硫酸链霉素,0.22um滤网过滤除菌。
48.实施例3
49.3d打印的尿道修复重建支架的制备,包括以下步骤:
50.s1,通过海藻酸钠sa、纳米羟基磷灰石nha、脂肪干细胞adscs和水溶液配制生物墨水;所述生物墨水包括如下质量百分比的组分:海藻酸钠sa是2%;纳米羟基磷灰石nha是10%;脂肪干细胞adscs是105个/ml。
51.s2,用所述生物墨水为基材通过医用3d打印机进行3d打印,获得层状多孔支架打印件,3d打印条件为:挤出速度0.1ul/s,层高0.25mm,打印速度180mm/min;
52.s3,通过电动纳米喷雾器向支架打印件表面喷洒量子点溶液,喷洒时长为3s;
53.s4,通过电动纳米喷雾器向支架打印件表面喷洒cacl2溶液,喷洒时长为3s,所述cacl2溶液为浓度为2%的cacl2水溶液;
54.s5,在s4步骤中获得的支架打印件上表面重复s2
‑
s4步骤,直至打印出孔道结构的尿道假体;
55.s6,通过电动纳米喷雾器向支架打印件表面喷洒量子点溶液10s;
56.s7,将支架打印件在cacl2水溶液中浸泡10s,所述cacl2溶液为浓度为2%的cacl2水溶液。
57.实施例4
58.本实施例提供了3d打印的尿道修复重建支架,利用实施例3的方法制备的尿道修复重建支架。
59.如图2所示,通过esr检测ros发现新的材料在808nm近红外光照射下产生了单线态氧。如图3所示,在电子显微镜发现,本实施例中的尿道修复重建支架(sa+nha+qds)添加nha和qd后,结构明显得到加固。本实施例中的尿道修复重建支架(sa+nha+qds),如图4所示,通过静态接触角测试发现加入nha和qd后重建的支架的吸水率明显降低;降解率(图5所示)也明显降低,而拉伸性有很大的提高(图6所示)。如图7所示,对本实施例中的尿道修复重建支架(sa+nha+qd+c)、海藻酸钠(sa+c)、海藻酸钠和纳米羟基磷灰石混合物(sa+nha+c)通过calcein
‑
am、pi和merge染料进行安全性检测,细胞在尿道修复重建支架(sa+nha+qd+c)可以很好的存活,说明本实施例中的尿道修复重建支架对生物细胞具有具安全性。其中sa表示海藻酸钠,nha表述纳米羟基磷灰石,qds表示量子点溶液,qd表示量子点,c表示细胞。
60.实施例5
61.本实施例提供动物实验的过程和术后检测:
62.因为背侧尿道紧贴阴茎海绵体,损伤之后的修复效果评估不易受影响,而若选择腹侧修复,则常常容易造成尿道与皮下结缔组织粘连,影响修复效果评估,因此我们选择背侧尿道损伤作为模型。
63.手术过程:戊巴比妥钠麻醉,仰卧位,固定四肢。备皮,消毒铺巾。分离雄新西兰兔的阴茎和肛门,充分暴露阴茎部分。将包皮固定于腹部,充分暴露阴茎腹侧。沿中线切开包皮及皮下组织,暴露尿道。镊子闭合插入尿道后再打开,撑开尿道,可见尿道海绵体正中线。沿正中线剪开,暴露尿道背侧,用眼科剪剪出1.5*1cm损伤后,将支架材料覆盖于伤口上并用7
‑
0可吸收缝合线缝合固定。逐层关闭伤口,在大腿肌肉注射青霉素,术毕。
64.如图8、图9所示,通过新西兰兔在术后4周和8周后的尿道再生的大体外观、h&e染色后病例检查图像可以发现实验组几乎和正常一样;如图10所示,通过masson染色后病例检查图像发现前面4组都出现了不同程度的胶原沉积,暗示着增生性瘢痕的形成,最后一组实验组正常;如图11所示,通过ae1/ae3免疫细胞化学双重染色法检查图像说明了最后一组的上皮化进程得到了推进,比对照组效果好。通过本实施例说明本发明的支架材料具有良好的生物相容性,适用于组织工程领域和尿道的临床修复的应用。
65.以上实施方式只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明精神实质所做的等效变化或修饰,都应涵盖在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1