一种蟾雄膏的制作方法
1.本发明属于医药技术领域,尤其涉及一种蟾雄膏及其巴布膏剂。
背景技术:
2.疼痛作为恶性肿瘤中晚期的常见症状,医师对其治疗往往局限于使用止痛药以减少疼痛的体验。由此,止痛药的滥用现象普遍存在,更有甚者对止痛药的滥用达到了漠视的态度。
3.现有技术中,如ncaa指南强调“癌痛不仅是一种存在的组织损伤,更是一种不愉快的情感与感觉体验。”因此,对癌痛患者的干预,更多的应当是护理人员从人文关怀与健康相结合入手,方能取得一定的疗效。在临床中对于恶性肿瘤癌性疼痛的治疗,医师应引起足够重视,以积极、合理的方式寻求抑制癌痛的治疗,同时降低患者不愉快的情感与体验。
4.对于消化道癌性疼痛,中药局部外敷治疗已经取得一定的疗效。现代医师运用中药外敷于局部疼痛处,对于同时使用癌痛三阶梯给药患者,能够起到减少疼痛指数的效果。中药外敷不仅仅局限于肿瘤局部疼痛处,还可在经络循行与敏感穴位处进行穴位外敷,以起到更好的疗效。但是中药外敷,常常会有过敏性皮疹出现,影响临床治疗效果。
技术实现要素:
5.鉴于上述现有技术存在的缺陷,本发明的目的是提出一种蟾雄膏及其巴布膏剂,能够治疗多种癌性疼痛,减轻不良反应,提高患者生活质量,同时又能有效降低过敏性皮疹的出现。
6.本发明的目的通过如下技术方案得以实现:
7.一种蟾雄膏,以重量份计,包括如下原料组分:
8.蟾酥20
‑
40重量份,雄黄20
‑
40重量份,冰片20
‑
40重量份,铅丹20
‑
40重量份,芒硝20
‑
40重量份,乳香、没药合计50
‑
150重量份,龙血竭40
‑
60重量份,硇砂5
‑
20 重量份,麝香1重量份,大黄50
‑
150重量份,川乌、草乌合计50
‑
150重量份,莪术 20
‑
40重量份、细辛5
‑
20重量份。
9.优选的,上述的蟾雄膏中:以重量份计,其包括如下原料组分:
10.蟾酥30重量份,雄黄30重量份,冰片30重量份,铅丹30重量份,芒硝30重量份,乳香、没药合计100重量份,龙血竭50重量份,硇砂10重量份,麝香1重量份,大黄100重量份,川乌、草乌合计100重量份,莪术30重量份、细辛10重量份。
11.本发明还提供上述的蟾雄膏的制备方法,包括如下步骤:
12.将蟾酥粉碎后使用乙醇提取,得到蟾酥提取液;本步骤中,蟾酥粉碎成粗粉,可以根据实际需要进行粉末粒径的调整,常规的粒径已经能够满足需要。
13.将雄黄、硇砂、铅丹、冰片各自粉碎后混合,或者混合后粉碎,或者各自粉碎后单独放置,得到第一原料粉末;本步骤中,第一原料粉末为混合粉末或者为雄黄、硇砂、铅丹、冰片各自粉末的集合的统称。粉碎方法可以常规的粉碎方法,优选采用超音速气流粉碎法,雄
黄、冰片等可以粉碎成纳米级粉末。可以采用市售气流粉碎机。机内操作进气口以液氮作为空气冷却剂,控制粉碎机温度范围是
‑
50℃
‑
30℃。
14.对乳香、没药进行水蒸汽蒸馏提取,蒸馏得到的乳香、没药挥发油另存;蒸馏提取液减压浓缩后使用乙醇沉淀,过滤后得到滤液a;将经过蒸馏后的乳香、没药使用乙醇溶液进行提取,得到提取液b;将滤液a和提取液b合并,回收乙醇至相对密度 1.15
‑
1.40,得到乳香、没药提取液;
15.将大黄粉碎,使用β
‑
葡萄糖苷酶进行酶解,得到酶解大黄粉末;对酶解大黄粉末使用乙醇溶液进行提取,得到大黄提取液;本步骤中,对酶解大黄粉末使用乙醇溶液进行提取时,提取溶剂为60
‑
90%乙醇(优选70%乙醇)、料液比1∶10
‑
30(优选1∶ 20)、提取时间30
‑
90min(优选60min)、提取温度30
‑
60℃(优选50℃),提取方式采用超声提取,超声功率250w。
16.对龙血竭依次使用ph为2、7.5、8.3的缓冲液进行超声提取,合并提取液后浓缩,得到龙血竭浓缩液;对龙血竭浓缩液使用乙醇稀释,过滤,滤液回收乙醇后得到龙血竭提取液;
17.将麝香加热回流提取后得到麝香提取液;本步骤中,采用12倍药材量的95%乙醇加热回流提取3次,每次2h,提取液减压回收乙醇,得到麝香提取液。
18.将川乌、草乌使用乙醇提取得到川草乌提取液;本步骤中,将川乌、草乌与60
‑
80%浓度乙醇按照固液比1∶5
‑
15比例称量混合,置入超声波振荡提取器1
‑
3h后减压回收乙醇,得川乌提取液备用。
19.将细辛使用乙醇提取,提取液减压回收后蒸发至干燥粉末,得到细辛干膏粉;本步骤中,细辛与60
‑
90%乙醇按照1:3
‑
10得比例混合浸泡后进行回流提取,每次1
‑
3h,回流提取1
‑
3次后将乙醇减压回收,置于蒸发皿中干燥得到细辛干膏粉。
20.将莪术乙醇微波提取的得到莪术提取液;
21.将蟾酥提取液、乳香、没药提取液、大黄提取液、龙血竭提取液、麝香提取液、川草乌提取液、莪术提取液混合得到中药混合提取液;
22.将第一原料粉末、细辛干膏粉、芒硝混合得到中药混合粉末;
23.将中药混合提取液、中药混合粉末、乳香、没药挥发油混合即得到蟾雄膏。
24.上述的蟾雄膏的制备方法中,缓冲液可以为常规的缓冲液,优选的,所述缓冲液是将121克tris碱溶解于0.9l纯净水中,以浓hcl滴定调节ph值,最终用纯净水将溶液体积补充至1l制备得到的;调ph值以达到所需的数值。体积等可以等比例放大。
25.上述的蟾雄膏的制备方法中,优选的:
26.将蟾酥粉碎后使用乙醇提取的步骤中,乙醇的用量为蟾酥重量的10
‑
30倍,乙醇的浓度为40%
‑
60%。本步骤中,乙醇提取可以是多种常用的提取方法,优选的,可以采用回流提取法,提取2
‑
3次,每次30
‑
50分钟。
27.上述的蟾雄膏的制备方法中,优选的:
28.在对乳香、没药进行水蒸汽蒸馏提取,蒸馏得到的乳香、没药挥发油另存;蒸馏提取液减压浓缩后使用乙醇沉淀,过滤后得到滤液a;将经过蒸馏后的乳香、没药使用乙醇溶液进行提取,得到提取液b的步骤中,蒸馏提取液减压浓缩至相对密度 1.08
‑
1.12,使用1.5
‑
3倍重量95%乙醇沉淀,过滤后得到滤液a;将经过蒸馏后的乳香、没药使用12倍重量的70%
‑
95%的乙醇溶液进行回流提取,得到提取液b。
29.上述的蟾雄膏的制备方法中,优选的:在将大黄粉碎,使用β
‑
葡萄糖苷酶进行酶解,得到酶解大黄粉末的步骤中,酶解的条件为:温度40
‑
60℃,ph5.0
‑
6.0,底物浓度20
‑
40%,酶的用量为大黄重量的0.1
‑
0.3%,酶解时间为1
‑
3h。更优选的:在将大黄粉碎,使用β
‑
葡萄糖苷酶进行酶解,得到酶解大黄粉末的步骤中,酶解的条件为:温度50℃,ph5.0,底物浓度30%,酶的用量为大黄重量的0.2%,酶解时间为1.5h。
30.上述的蟾雄膏的制备方法中,优选的:在对龙血竭依次使用ph为2、7.5、8.3 的缓冲液进行超声提取的步骤中,龙血竭与缓冲液的料液比为1∶(60
‑
80)g
·
ml
‑1,超声提取的条件为:提取温度为40
‑
60℃、超声波时间60
‑
120min。更优选的:在对龙血竭依次使用ph为2、7.5、8.3的缓冲液进行超声提取的步骤中,龙血竭与缓冲液的料液比为1∶70g
·
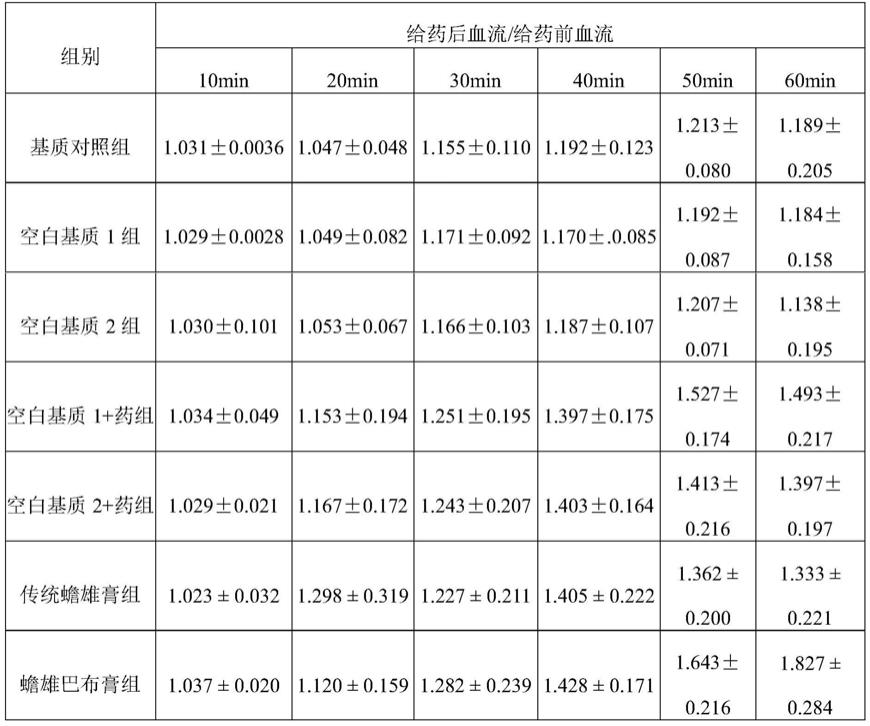
ml
‑1,超声提取的条件为:提取温度为50℃、超声波时间 90min。本步骤中,缓冲液可以为常规的现有技术的缓冲液。
31.上述的蟾雄膏的制备方法中,优选的:将莪术乙醇微波提取的得到莪术提取液的步骤中,微波提取的条件为:微波时间为5
‑
8min、微波功率为300w;乙醇的浓度为 60%,乙醇与莪术的液料比为20.6∶1ml/g。
32.本发明中,采用了多种特殊的组分:
33.蟾酥:味甘、辛,性温,有毒。蟾酥具有抗肿瘤作用、局部麻醉作用、止痛作用和杭炎免疫作用等。其止痛、局部麻醉作用机制与肌细胞的缓慢释放乙酞胆碱有关,蟾酥中的蟾毒灵局麻作用最强,其麻醉效果相当于可卡因的90倍;蟾酥有一定的中枢性镇痛作用,对横纹肌、子宫、输卵管有兴奋作用,能提高机体痛阈,起到止痛效果。
34.雄黄:味辛,性温。雄黄主要成分为硫化砷,其抗肿瘤机理是诱导细胞凋亡,作用于线粒体,改变胞内氧化还原状态,促进肿瘤细胞分化,抑制骨髓微血管生成等。外用可促进肉芽组织生长,促进血管新生,加快坏死组织脱落,有效治疗癌性破溃创面。
35.冰片:味辛、苦,性微寒,归心、脾、肺经,具有开窍醒神,清热止痛之效。其具有抗炎、止痛、镇静、抗菌、抗病毒、抗氧化及对中枢神经系统有双向调剂作用。冰片对其他药物有促进吸收、影响分布、抑制代谢的作用,有利于减少用药量,从而提高药物生物利用度。能够明显抑制因炎症导致小鼠腹腔毛细血管通透性的增加,可以显著提高小鼠痛阈值,明显减少小鼠扭体次数,表明冰片具有良好的抗炎、镇痛的药理作用。
36.芒硝:芒硝主要成分为含水硫酸钠,性味辛苦微咸温,外用有清热、消肿、止痛的功效。研究表明,芒硝外用后可使局部血管扩张,血流加快,改善微循环,从而调动机体抗病能力,使单核细胞吞噬能力增强,加快炎症吸收与消散,具有清热解毒、散结消肿的作用。
37.乳香:性温,味辛、苦,归心、肝、脾经,具有活血定痛,消肿生肌之效。药理学研究表明,乳香具有镇痛、抗炎、抗肿瘤、抗氧化、抗胃溃疡及抑制胆固醇等药理作用。
38.没药:味辛、苦,性平,归心、肝、脾经,具有散瘀定痛、消肿生肌的功效。没药具有抗肿瘤、抗炎、镇痛、凝血等药理作用,其中挥发油是没药发挥药效作用的物质基础。挥发油中含量较高的β-榄香烯和石竹烯等倍半萜类化合物,具有抑制血栓形成、镇痛、抗炎的药理作用。没药中的莪术烯和呋喃桉烷
‑
1,3
‑
二烯可与中枢神经系统的阿片受体发挥作用,起到镇痛作用。
39.龙血竭:性味甘、温、咸、平,归心、肝经,具活血散瘀、定痛止血、生肌敛疮的功效。龙血竭主要是通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、诱导dna损伤和细胞周期阻滞、
诱导肿瘤细胞衰老、诱导自噬、抑制肿瘤细胞转移和血管生成以及逆转肿瘤细胞多药耐药性等机制发挥抗肿瘤作用。有研究表明:龙血竭75%乙醇提取物能够通过上调促凋亡蛋白caspase8和parp的剪切水平及bak蛋白的表达,以及下调抗凋亡蛋白survivin的水平,进而触发细胞凋亡。
40.硇砂:硇砂性咸、苦、辛、温,有毒,有软坚消积、散瘀消肿的功能,
41.麝香:味辛,性温;归心、脾经。麝香是通过提高机体的非特异性免疫功能,抑制癌细胞的生长增殖。有研究表明,其可诱导肝癌细胞凋亡和自噬而发挥抗癌作用。
42.大黄:大黄的有效成分为蒽醌类衍生物,可降低毛细血管通透性,具有止血、收敛、活血等作用。大黄素是具有活血化瘀、通畅气机作用的中药大黄的主要成分之一。一些研究者发现,大黄素通过调节神经元凋亡及胶质细胞活性发挥抗炎作用。在糖氧剥夺时大黄素可通过激活素a/smads信号途径的活化下调caspase
‑
3表达来抑制神经元凋亡;而在脂多糖诱导的胶质细胞中,可激活ampk/nrf2通路,降低il
‑
6、 tnf
‑
α等炎症因子表达。已有的实验研究表明,大黄素能够显著改善神经病理性疼痛cci大鼠自发性疼痛及痛觉过敏表现,且50mg/kg为优效剂量,本发明中,大黄素能够显著上调cci模型实验大鼠脊髓组织mbp及mpz表达,促进髓鞘修复与再生,从而缓解疼痛。
43.川乌、草乌:归心、肝、脾经和毒烈窜散,功可祛风除湿、温经散寒及消肿止痛。研究表明:川乌草乌所含乌头碱能够抑制脊髓和背根神经节中的fkn、cx3cr1、 cd11b/c和nmdar的表达存,抑制痛觉的传导。同时抑制sk
‑
ov
‑
3细胞的增殖进而产生抗肿瘤作用。
44.莪术:性味属辛苦温,归属于肝脾两经。研究表明:莪术油能够明显抑制hec
‑1‑
b 细胞的增殖,诱导细胞凋亡,莪术总黄酮发挥抗肿瘤药效物质基础,该成分同时还可预防血栓、消炎、抑制肝纤维化以及镇痛等。
45.细辛:其味辛、性温,有小毒,归肺肾心经,其功效为温肺化饮、祛风散寒、通窍止痛。具有镇痛、麻醉、中枢抑制、镇静等诸多药效学作用,学者实验证明:灯盏细辛注射液能够改善恶性肿瘤患者的高凝状态。
46.本发明对院内制剂进行了改进,现有的院内制剂很容易引起皮疹,但是本技术使用了川乌草乌细辛莪术之后有效降低了过敏性皮疹的发生率。
47.本发明还提供一种蟾雄膏的巴布膏剂,其原料包括权利要求1或2所述的蟾雄膏,还包括波卡姆1.8重量份、聚乙烯醇1.2重量份、甘油45重量份、丙二醇3重量份、羧甲基纤维素钠4.8重量份、聚丙烯酸钠7.2重量份、月桂氮酮0.6重量份、氧化锌 0.6重量份、高岭土12重量份、水180重量份。
48.本发明还提供上述的蟾雄膏的巴布膏剂的制备方法,包括如下步骤:
49.将波卡姆、聚乙烯醇及部分水混匀得到相a;
50.将甘油与丙二醇混合,然后依次加入羧甲基纤维素钠、聚丙烯酸钠、月桂氮酮、氧化锌,混匀得到相b;
51.将高岭土溶解于水中得到混合液a;
52.将相a、相b、混合液混合得到巴布膏基质;
53.将蟾雄膏与巴布膏基质混合后加入涂布机中,涂布得到蟾雄膏的巴布膏剂。
54.本发明还提供上述的蟾雄膏,或上述的蟾雄膏的巴布膏剂在作为制备治疗肝癌、胰腺癌、肠癌、乳腺癌、肺癌中的一种或几种癌症的癌性疼痛的应用。
55.本发明的突出效果为:
56.本发明的蟾雄膏及其巴布膏剂,能够治疗多种癌性疼痛,阵痛效果明显,减轻不良反应,提高了患者生活质量,同时又能有效降低过敏性皮疹的出现。
附图说明
57.图1为传统蟾雄膏体外透皮实验观测指标累积量;
58.图2为本发明的蟾雄巴布膏体外透皮实验观测指标累积量;
59.图3为空白基质1+药外透皮实验观测指标累积量;
60.图4为空白基质2+药外透皮实验观测指标累积量。
具体实施方式
61.为了对本发明的技术特征、目的和有益效果有更加清楚的理解,现对发明的技术方案进行以下详细说明,但不能理解为对发明的可实施范围的限定。下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
62.缓冲液的制备:将121克tris碱溶解于0.9l纯净水中,以浓hcl滴定调节ph 值,最终用纯净水将溶液体积补充至1l。根据实际,通过hcl调整ph值至所需值。
63.实施例1
64.本实施例提供一种蟾雄膏,以重量份计,包括如下原料组分:
65.蟾酥20重量份,雄黄20重量份,冰片20重量份,铅丹20重量份,芒硝20重量份,乳香、没药合计50重量份,龙血竭40重量份,硇砂5重量份,麝香1重量份,大黄50重量份,川乌、草乌合计50重量份,莪术20重量份、细辛5重量份。
66.本实施例的蟾雄膏是这样制备得到的:
67.将蟾酥粉碎成常规的粒径粗粉,使用10倍重量的浓度为40%的乙醇回流提取,提取2次,每次30分钟,提取液合并后减压回收乙醇,得到蟾酥提取液。
68.将雄黄、硇砂、铅丹、冰片采用市售气流粉碎机各自粉碎成粉末后混合,得到第一原料粉末;机内操作进气口以液氮作为空气冷却剂,控制粉碎机温度范围是
‑
50℃
ꢀ‑
30℃。
69.对乳香、没药进行水蒸汽蒸馏提取,蒸馏得到的乳香、没药挥发油另存;蒸馏提取液减压浓缩至相对密度1.08
‑
1.12,使用1.5
‑
3倍重量95%乙醇沉淀,过滤后得到滤液a;将经过蒸馏后的乳香、没药使用12倍重量的70%%的乙醇溶液进行回流提取,得到提取液b;将滤液a和提取液b合并,回收乙醇至相对密度1.15
‑
1.40,得到乳香、没药提取液;
70.将大黄粉碎,使用β
‑
葡萄糖苷酶进行酶解,酶解的条件为:温度40℃,ph5.0,底物浓度20%,酶的用量为大黄重量的0.1%,酶解时间为1h,得到酶解大黄粉末;对酶解大黄粉末使用乙醇溶液进行提取,提取溶剂为60%乙醇、料液比1∶10、提取时间30min、提取温度30℃,提取方式采用超声提取,超声功率250w,得到大黄提取液。
71.对龙血竭依次使用ph为2、7.5、8.3的缓冲液进行超声提取,龙血竭与缓冲液的料液比为1∶60g
·
ml
‑
1,超声提取的条件为:提取温度为40℃、超声波时间60min,合并提取液后浓缩,得到龙血竭浓缩液;对龙血竭浓缩液使用70%乙醇稀释,过滤,滤液回收乙醇后得到龙血竭提取液;
72.采用12倍麝香药材重量的95%乙醇加热回流提取3次,每次2h,提取液减压回收乙醇,得到麝香提取液。
73.将川乌、草乌与60%浓度乙醇按照固液比1∶5比例称量混合,置入超声波振荡提取器1h后减压回收乙醇,得川草乌提取液备用。
74.将细辛与60%乙醇按照1:3得比例混合浸泡后进行回流提取,每次1h,回流提取1次后将乙醇减压回收,置于蒸发皿中干燥得到细辛干膏粉。
75.将莪术乙醇微波提取,微波提取的条件为:微波时间为5
‑
8min、微波功率为300w;乙醇的浓度为60%,乙醇与莪术的液料比为20.6∶1ml/g,得到莪术提取液;
76.将蟾酥提取液、乳香、没药提取液、大黄提取液、龙血竭提取液、麝香提取液、川草乌提取液、莪术提取液混合得到中药混合提取液;
77.将第一原料粉末、细辛干膏粉、芒硝混合得到中药混合粉末;
78.将中药混合提取液、中药混合粉末、乳香、没药挥发油混合即得到蟾雄膏
79.实施2
80.本实施例提供一种蟾雄膏,以重量份计,包括如下原料组分:
81.蟾酥40重量份,雄黄40重量份,冰片40重量份,铅丹40重量份,芒硝40重量份,乳香、没药合计150重量份,龙血竭60重量份,硇砂20重量份,麝香2重量份,大黄150重量份,川乌、草乌合计150重量份,莪术40重量份、细辛20重量份。
82.本实施例的蟾雄膏是这样制备得到的:
83.将蟾酥粉碎成常规的粒径粗粉,使用30倍重量的浓度为60%的乙醇回流提取,提取3次,每次50分钟,提取液合并后减压回收乙醇,得到蟾酥提取液。
84.将雄黄、硇砂、铅丹、冰片采用市售气流粉碎机各自粉碎成粉末后混合,得到第一原料粉末;机内操作进气口以液氮作为空气冷却剂,控制粉碎机温度范围是
‑
50℃
ꢀ‑
30℃。
85.对乳香、没药进行水蒸汽蒸馏提取,蒸馏得到的乳香、没药挥发油另存;蒸馏提取液减压浓缩至相对密度1.08
‑
1.12,使用3倍重量95%乙醇沉淀,过滤后得到滤液a;将经过蒸馏后的乳香、没药使用12倍重量的95%的乙醇溶液进行回流提取,得到提取液b;将滤液a和提取液b合并,回收乙醇至相对密度1.15
‑
1.40,得到乳香、没药提取液;
86.将大黄粉碎,使用β
‑
葡萄糖苷酶进行酶解,酶解的条件为:温度60℃,ph6.0,底物浓度40%,酶的用量为大黄重量的0.3%,酶解时间为3h,得到酶解大黄粉末;对酶解大黄粉末使用乙醇溶液进行提取,提取溶剂为90%乙醇、料液比1∶30、提取时间90min、提取温度60℃,提取方式采用超声提取,超声功率250w,得到大黄提取液。
87.对龙血竭依次使用ph为2、7.5、8.3的缓冲液进行超声提取,龙血竭与缓冲液的料液比为1∶80g
·
ml
‑
1,超声提取的条件为:提取温度为60℃、超声波时间120min,合并提取液后浓缩,得到龙血竭浓缩液;对龙血竭浓缩液使用70%乙醇稀释,过滤,滤液回收乙醇后得到龙血竭提取液;
88.采用12倍麝香药材重量的95%乙醇加热回流提取3次,每次2h,提取液减压回收乙醇,得到麝香提取液。
89.将川乌、草乌与80%浓度乙醇按照固液比1∶15比例称量混合,置入超声波振荡提取器3h后减压回收乙醇,得川草乌提取液备用。
90.将细辛与90%乙醇按照1:10得比例混合浸泡后进行回流提取,每次3h,回流提取3
次后将乙醇减压回收,置于蒸发皿中干燥得到细辛干膏粉。
91.将莪术乙醇微波提取,微波提取的条件为:微波时间为5
‑
8min、微波功率为300w;乙醇的浓度为60%,乙醇与莪术的液料比为20.6∶1ml/g,得到莪术提取液;
92.将蟾酥提取液、乳香、没药提取液、大黄提取液、龙血竭提取液、麝香提取液、川草乌提取液、莪术提取液混合得到中药混合提取液;
93.将第一原料粉末、细辛干膏粉、芒硝混合得到中药混合粉末;
94.将中药混合提取液、中药混合粉末、乳香、没药挥发油混合即得到蟾雄膏
95.实施例3
96.本实施例提供一种蟾雄膏,以重量份计,包括如下原料组分:
97.蟾酥30重量份,雄黄30重量份,冰片30重量份,铅丹30重量份,芒硝30重量份,乳香、没药合计100重量份,龙血竭50重量份,硇砂10重量份,麝香1重量份,大黄100重量份,川乌、草乌合计100重量份,莪术30重量份、细辛10重量份。
98.本实施例的蟾雄膏是这样制备得到的:
99.将蟾酥粉碎成常规的粒径粗粉,使用20倍重量的浓度为50%的乙醇回流提取,提取2次,每次30分钟,提取液合并后减压回收乙醇,得到蟾酥提取液。
100.将雄黄、硇砂、铅丹、冰片采用市售气流粉碎机各自粉碎成粉末后混合,得到第一原料粉末;机内操作进气口以液氮作为空气冷却剂,控制粉碎机温度范围是
‑
50℃
ꢀ‑
30℃。
101.对乳香、没药进行水蒸汽蒸馏提取,蒸馏得到的乳香、没药挥发油另存;蒸馏提取液减压浓缩至相对密度1.08
‑
1.12,使用2.5倍重量95%乙醇沉淀,过滤后得到滤液 a;将经过蒸馏后的乳香、没药使用12倍重量的70%
‑
95%的乙醇溶液进行回流提取,得到提取液b;将滤液a和提取液b合并,回收乙醇至相对密度1.15
‑
1.40,得到乳香、没药提取液;
102.将大黄粉碎,使用β
‑
葡萄糖苷酶进行酶解,酶解的条件为:温度50℃,ph5.0,底物浓度30%,酶的用量为大黄重量的0.2%,酶解时间为1.5h,得到酶解大黄粉末;对酶解大黄粉末使用乙醇溶液进行提取,提取溶剂为70%乙醇、料液比1∶20、提取时间60min、提取温度50℃,提取方式采用超声提取,超声功率250w,得到大黄提取液。
103.对龙血竭依次使用ph为2、7.5、8.3的缓冲液进行超声提取,龙血竭与缓冲液的料液比为1∶70g
·
ml
‑
1,超声提取的条件为:提取温度为50℃、超声波时间90min,合并提取液后浓缩,得到龙血竭浓缩液;对龙血竭浓缩液使用70%乙醇稀释,过滤,滤液回收乙醇后得到龙血竭提取液;
104.采用12倍麝香药材重量的95%乙醇加热回流提取3次,每次2h,提取液减压回收乙醇,得到麝香提取液。
105.将川乌、草乌与75%浓度乙醇按照固液比1∶10比例称量混合,置入超声波振荡提取器2h后减压回收乙醇,得川草乌提取液备用。
106.将细辛与75%乙醇按照1:6得比例混合浸泡后进行回流提取,每次2h,回流提取2次后将乙醇减压回收,置于蒸发皿中干燥得到细辛干膏粉。
107.将莪术乙醇微波提取,微波提取的条件为:微波时间为5
‑
8min、微波功率为300w;乙醇的浓度为60%,乙醇与莪术的液料比为20.6∶1ml/g,得到莪术提取液;
108.将蟾酥提取液、乳香、没药提取液、大黄提取液、龙血竭提取液、麝香提取液、川草乌提取液、莪术提取液混合得到中药混合提取液;
109.将第一原料粉末、细辛干膏粉、芒硝混合得到中药混合粉末;
110.将中药混合提取液、中药混合粉末、乳香、没药挥发油混合即得到蟾雄膏
111.实施例4
112.本实施例提供一种实施例1
‑
3的蟾雄膏的巴布膏剂,除实施例1
‑
3的蟾雄膏外,其原料还包括波卡姆1.8重量份、聚乙烯醇1.2重量份、甘油45重量份、丙二醇3 重量份、羧甲基纤维素钠4.8重量份、聚丙烯酸钠7.2重量份、月桂氮酮0.6重量份、氧化锌0.6重量份、高岭土12重量份、水180重量份。
113.本实施例的巴布膏剂是这样制备的:
114.电动搅拌器一边充分搅拌状态下(400r/min),使用滤筛在170重量份水中均匀撒入波卡姆,继续保持搅拌器搅拌的状态下(600r/min)使用滤筛均匀撒入聚乙烯醇。超声波水浴震荡30min,电动搅拌器充分搅拌(600r/min)20min,得到相a。常温置于负压箱,直至无气泡。
115.甘油与丙二醇混合,使用球磨搅拌器中速(500r/min)充分研磨3
‑
5min,于混合物按照羧甲基纤维素钠、聚丙烯酸钠、月桂氮酮、氧化锌的顺序依次加入搅拌后,使用球磨搅拌器低速(300r/min)充分研磨,得到相b。常温置于负压箱,直至无气泡。
116.以水10重量份充分搅拌溶解高岭土后,得到混合液a。
117.70℃水浴状态下,在搅拌机充分搅拌状态下(600r/min),在相a中加入混合液a 后调整搅拌器转速至800r/min,加入相b,搅拌5min即得巴布膏基质;
118.70℃水浴状态下于巴布膏基质中加入实施例1或2或3的蟾雄膏,搅拌器充分搅拌(800r/min)即成巴布膏膏体。
119.趁热将巴布膏膏膏体加入涂布机,设置膏体初厚度2mm,长度12cm。置入真空恒温恒湿箱,压力控制
‑
0.007mpa以下分离搅拌气泡,湿度55%、温度30℃,存放18h;再置于适度75%、温度20℃条件下,存放12h。
120.封装即得蟾雄膏的巴布膏剂。
121.对本实施例得到的蟾雄膏的巴布膏剂进行实验验证:
122.设立空白基质对照实验,查阅相关文献可以得到其他空白基质工艺如下:
123.①
空白基质1(按照质量称取卡波姆:去离子水:聚丙烯酸钠:丙三醇:高岭土:甘羟铝=2:45:5.5:20:2.5:0.75,将聚丙烯酸钠与丙三醇混匀后,与搅拌均匀的 2g山梨醇、0.5g二氧化钛、高岭土、甘羟铝混合,再与溶胀充分的得波卡拇均匀混合得到。)
124.②
空白基质2(按照羧甲基纤维素钠:氧化锌:甘油=2:2:5比例称取,甘油与羧甲基纤维素钠以及氧化锌加适量水充分溶胀,在约60℃水浴中搅拌均匀成巴布膏剂基质。)
125.将空白基质1、空白基质2按照改良处方分别加药入组实验进行析因分析比较。
126.1、血流量实验
127.将sd大鼠(上海中医药大学实验动物中心提供,合格证号:scxk沪
ꢀ‑
2020
‑
009n0.0002874,在恒温恒湿的动物室饲养1周后,无异常行为活动后进行实验)随机分为7组,每组5只,分别为基质对照组、空白基质1组、空白基质1+药组、空白基质2组、空白基质2+药、传统蟾雄膏组、蟾雄巴布膏组。大鼠腹腔注射 10%水合氯醛麻醉,电动剃毛器剔除耳局部毛发,并使大鼠适应恒温实验室内温度1h,使体表温度与室温平衡。恒温实验室的温度控制在29
‑
30℃,实验前后温度变化不超过1℃。实验前于背部脱毛的大鼠贴敷空白基质、传统
蟾雄膏、蟾雄巴布膏,面积为 3cm
×
3cm。
128.激光多普勒血流仪检测实验开始,受试大鼠取俯卧位,平伸并固定四肢,从表面寻找大鼠耳局部血管,固定激光多普勒血流检测探头于大鼠耳外侧,给药前后仪器示数均稳定5min后开始记录数据,给药前连续监测30min基础血流值。给药后每10min 记录1次,取平均值,共监测观察至60min处。保持给药前后检测位点不变。
129.用moorvms数据分析软件,分析大鼠耳局部的血流平均值,最后结果以给药后各时间点的血流值与给药前基础血流值之比即皮肤血流变化值表示。
130.结果如表1显示:(1)基质对照组、空白基质1组、空白基质2组对于大鼠耳廓局部皮肤血液运行均具有一定促进作用,经检验三者比较无明显统计学差异,p值均>0.05。(2)与传统蟾雄膏相比,空白基质1+药组、空白基质2+药组在50min能够使得大鼠血液流变达到更快的峰值,表明改良后中药配伍对于血液流动促进作用增强,经检验具有显著统计学差异,p值均<0.05。(3)相比于空白基质1+药组、空白基质2+药组,蟾雄巴布膏在50
‑
60min依旧可以将大鼠耳廓血流稳定在较高峰值无下降迹象,表明蟾雄巴布膏在局部给药促进吸收上更具有稳定性。
131.表1:不同时间下大鼠耳局部皮肤血流改变[x
±
s,n=6]
[0132][0133]
2、体外透皮实验
[0134]
小鼠(上海中医药大学实验动物中心提供,合格证号:scxk沪
ꢀ‑
2020
‑
012n0.0003682,在恒温恒湿的动物室饲养1周后,无异常行为活动后进行实验)颈椎脱臼处死,剥离取下腹部去毛后皮肤,小心除去皮下脂肪及粘连物,生理盐水漂洗至无浑浊,滤纸
吸干,置于锡箔纸上,
‑
20℃保存,于实验前1天取出,自然解冻,剪取合适的面积固定于改良franz扩散池(有效透过面积1.33cm2)上,角质层面向上,用于贴敷凝胶膏贴。设置莪术总黄酮、乌头碱、细辛脂素、大黄素、麝香酮、华蟾酥毒基、硫化砷为体外透皮实验主要观测指标。
[0135]
取传统蟾雄膏、蟾雄巴布膏、空白基质1+药、空白基质2+药剪成相同面积,分别紧贴小鼠皮肤角质层,向加有转子的扩散池中注入接收液乙醇
–
生理盐水(30∶ 70),排除气泡,置于透皮仪中,设置度(32
±
1)℃、转速350r/min进行试验。分别于2、4、6、8、12h从扩散池中取出2ml接收液,同时补加空白接收液,并排出扩散池内气泡。样品以0.45μm微孔滤膜滤过后进行hplc法测定其中大黄素、麝香酮、华蟾酥毒基、硫化砷的浓度,计算各时间店累积透过量(如图1、图2、图3、图4所示)。
[0136]
结果显示:由图可以看(1)相比于传统蟾雄膏,空白基质1+药、空白基质2+ 药外透皮实验观测地各类抗癌、止痛有效成分指标对于皮肤透过累积量更高。(2)相比于空白基质1+药、空白基质2+药,蟾雄巴布膏体外透皮实验累积透过各类抗癌、止痛有效成分量更多更稳定,表明本研究基质配比存在协同促进作用,使得中药透皮给药效率更高。
[0137]
3、皮肤刺激实验
[0138]
3.1单次给药大鼠皮肤刺激实验
[0139]
健康sd大鼠18只(上海中医药大学实验动物中心提供,合格证号:scxk沪
ꢀ‑
2020
‑
009n0.0002874,在恒温恒湿的动物室饲养1周后,无异常行为活动后进行实验),雌雄各半,实验前24h将其背部两侧对称脱毛,脱毛面积每侧为3cm
×
3cm。实验前检查去毛皮肤存在划伤,如有则不予参加本实验研究。
[0140]
将大鼠随机分为3组,每组6只,雌雄各半,第一组大鼠身体一侧皮肤上敷贴传统蟾雄膏,对侧皮肤贴相同面积的蟾雄巴布膏;第二组大鼠身体一侧皮肤敷贴空白基质1,对侧皮肤贴敷相同面积空白基质1+药;第三组大鼠身体一侧皮肤敷贴空白基质 2,对侧皮肤贴敷相同面积空白基质2+药。12h后去除药物,于去除药物后1、24、 48、72h观察皮肤刺激反应及恢复情况,与对侧比较,并按以下评分标准进行评价。皮肤刺激反应评分标准:红斑勉强可见为1分,中度红斑为2分,严重红斑为3分,紫色红斑并有焦痂形成为4分;水肿勉强可见为1分,皮肤隆起轮廓清楚为2分,隆起1mm为3分,隆起1mm以上并有扩大为4分。皮肤刺激强度评价标准:0.5<平均分值<3.0为轻度刺激性,3.0<平均分值<6.0为中度刺激性,平均分值>6.0为强刺激性。反应平均值=(红斑形成总分+水肿形成总分)/合计动物数。
[0141]
3.2多次给药大鼠皮肤刺激实验
[0142]
同批健康sd大鼠18只,雌雄各半,方法同上,每天给药12h,连续7天。末次给药去除后1周内,观察皮肤刺激反应并进行评估。
[0143]
结果显示:皮肤刺激实验对大鼠一般状况无明显影响,给贴敷膏药及恢复期间,无大鼠出现死亡情况,大鼠的行为、自主活动、摄食、饮水、粪便、尿液基本正常,眼、耳、鼻、口未见异常分泌物,毛发如常。捕捉时未见明显肌力异常。单次给药1、 24、48、72h后观察,第一组大鼠传统蟾雄膏给药侧皮肤均出现轻微地红斑、水肿等反应,反应平均值2.17,蟾雄巴布膏给药侧皮肤未出现红斑、水肿反应;第二组大鼠贴敷空白基质1侧皮肤未见明显皮肤反应,空白基质1+药侧皮肤出现中度红斑,反应平均值2.5;第三组大鼠贴敷空白基质2侧皮肤未见明显皮肤反应,空白基质2+药侧皮肤出现轻度水肿反应,反应平均值2.83。
[0144]
多次给药后连续观察1周,第一组大鼠传统蟾雄膏给药侧皮肤出现的红斑、水肿在
去除膏药1周后逐渐消退,蟾雄巴布膏给药侧皮肤未见明显反应。第二组大鼠空白基质1+药侧皮肤、第三组大鼠空白基质2+药侧皮肤出现的不良反应在均逐渐减轻,空白基质1侧皮肤、空白基质2侧皮肤未见明显副反应。
[0145]
4、长期毒性试验
[0146]
选健康大鼠72只,雌雄各半,随机数字表法分为12组,每组各6只(简称组 1
‑
12),于实验前一天将其背部脱毛,脱毛面积约3cm
×
3cm,组1、2背部敷贴传统蟾雄膏;组3、4大鼠背部敷贴蟾雄巴布膏,组5、6背部贴敷空白基质1;组7、8 背部贴敷空白基质1+药;组9、10背部贴敷空白基质2;组11、12背部贴敷空白基质2+药,每天给药12h,每天换药,连续45天后,将组1和组3大鼠进行心脏取血,测定血常规、血生化指标,并比较组间差异。组2和组4大鼠停止贴敷后观察15天后心脏取血,测定血常规、血生化指标比较组间差异。实验期间所有动物给予普通饲料,自由摄食饮水。每天观察动物的活动和生长情况,每周加食2次。记录动物体质量,观察动物外观体征,行为活动,腺体分泌,呼吸,饮食,排泄物等及其他中毒表现和死亡数。
[0147]
血常规、血生化指标包括:红细胞(rbc)、白细胞(wbc)、血小板(plt)、血红蛋白(hb)、单核细胞百分比(m%)、淋巴细胞百分比(l%)、中性粒细胞百分比(n%)以及天门冬氨基转移酶(ast)、丙氨酸转移酶(alt)、总蛋白(tp)、白蛋白(alb)、血糖(glu)、尿素氮(bun)、胆固醇(chol)。
[0148]
心脏取血方法:取血前12h大鼠禁食,先用10%水合氯醛以800mg
·
kg
‑1腹腔注射麻醉大鼠,然后快速打开胸腔暴露心脏,持10ml注射器经左心室插入抽取5
‑
8ml 血液标本。
[0149]
结果显示:长期毒性实验表明传统蟾雄膏、蟾雄巴布膏、空白基质1、空白基质 2、空白基质1+药、空白基质2+药对大鼠血常规与血生化均无明显影响,经检验,各组之间无统计学差异,p值均>0.05。(如表2、表3所示)
[0150]
表2:小鼠血常规
[0151][0152]
表3:小鼠血生化
[0153][0154][0155]
5、镇痛实验
[0156]
5.1小鼠扭体法
[0157]
小鼠56只,雌雄各半,采用分层随机法分为7组,每组6只(分别为基质对照组、传统蟾雄膏组、蟾雄巴布膏组、空白基质1组、空白基质2组、空白基质1+药组、空白基质2+药组),于实验前一天将其背部脱毛,脱毛面积约3cm
×
3cm。贴敷膏药1h后,每组先取3只小鼠观察小鼠扭体次数,贴敷膏药2h后,每组小鼠再取3 只观察扭体次数。
[0158]
扭体次数观察方法:每鼠腹腔注射0.6%冰醋酸0.1ml/10g,记录注射醋酸后20min 内各小鼠扭体次数,计算扭体反应抑制率,公式为:抑制率(%)=(对照组扭体均数-试药组扭体均数)/对照组扭体均数
×
100%,
[0159]
结果显示:(1)基质对照组、空白基质1组、空白基质2组对小鼠扭体次数无明显影响。(2)相比于传统蟾雄膏,空白基质1+药组、空白基质2+药组能够更多地减少小鼠扭体次数(p值均<0.05,具体显著统计学差异),表明蟾雄膏中药配伍处方改良后,止痛效果增加。(3)蟾雄巴布膏较传统蟾雄膏对于小鼠扭体抑制率显著提升,较空白基质1+药组、空白基质2+药组止痛效果更明显(p值均<0.05,具体显著统计学差异),表明蟾雄巴布膏基质对单纯的中药止痛存在协同促进作用。(如表4所示)
[0160]
表4:小鼠扭体反应
[0161]
[0162][0163]
5.2鼠热板法
[0164]
小鼠56只,雌雄各半,采用分层随机法分为7组,每组6只(分别为基质对照组、传统蟾雄膏组、蟾雄巴布膏组、空白基质1组、空白基质2组、空白基质1+药组、空白基质2+药组),于实验前一天将其背部脱毛,脱毛面积约3cm
×
3cm。
[0165]
贴敷膏药1h后,将热板仪温度调至55℃,每次一只放在热板上,用秒表记录小鼠自投入热板至出现舔后足的时间(s)作为该鼠的痛阈值。凡舔后足时间小于5s,或大于30s者弃之不用。记录每只小鼠痛阈值,超过60s者按60s计算。计算痛阈提高百分率,公式为:痛阈提高率(%)=(用药后平均痛阈值
‑
用药前平均痛阈值)/用药前平均痛阈值
×
100%
[0166]
结果显示:(1)基质对照组、空白基质1组、空白基质2组对小鼠痛阈提高无明显影响,经统计学检验p值均>0.05。(2)相比于传统蟾雄膏,空白基质1+药组、空白基质2+药组能够提高小鼠痛阈,延长小鼠舔足间隔时间,经检验p值均<0.05,表明蟾雄膏中药配伍处方改良后,优化了止痛疗效。(3)蟾雄巴布膏较传统蟾雄膏、空白基质1+药组、空白基质2+药组对小鼠痛阈均提高,经检验,差异显著p值均< 0.05,表明蟾雄巴布膏基质对单纯的中药止痛存在协同促进作用。(如表5所示)
[0167]
表5:小鼠热痛反应
[0168]
组别给药前痛阈/s给药后痛阈/s痛阈提高率%基质对照组16.43
±
1.1816.71
±
0.49
‑
传统蟾雄膏组17.31
±
1.1926.08
±
1.2350.66蟾雄巴布膏组16.90
±
1.1229.05
±
1.9771.89空白基质1组16.75
±
0.4817.08
±
0.40
‑
空白基质2组16.87
±
0.7817.04
±
0.83
‑
空白基质1+药组16.71
±
0.4026.78
±
0.3060.26空白基质2+药组17.21
±
0.8226.81
±
0.3555.78
[0169]
6.将本实施例得到的巴布膏剂与未改良药物组分蟾雄膏的研究
[0170]
本研究围绕本实施例得到的巴布膏剂与未改良药物组分蟾雄膏的镇痛效果与皮肤过敏性湿疹的发生情况进行展开(实验方式同皮肤刺激性实验、镇痛实验),分别设置未改良组、改良组、蟾雄巴布膏组。
[0171]
未改良组使用传统蟾雄膏的药物组分及配制方法;未改良组组分:蟾酥25重量份,雄黄31重量份,冰片28重量份,铅丹28重量份,芒硝30重量份,乳香50重量份、没药50重量份,龙血竭40重量份,硇砂5重量份,麝香1重量份,大黄80 重量份;配制方式采用传统的常规方法。
[0172]
改良组使用改良后的实施例1的药物组分但使用传统的常规配制方式;
[0173]
蟾雄巴布膏组使用本实施例工艺。
[0174]
6.1皮肤刺激实验
[0175]
将大鼠随机分为3组,每组6只,雌雄各半,第一组为未改良组大鼠身体皮肤上敷贴未改良蟾雄膏;第二组为改良组大鼠身体皮肤敷贴改良蟾雄膏;第三组为蟾雄巴布膏组大鼠身体皮肤敷贴蟾雄巴布膏,各组大鼠贴敷面积相同。
[0176]
结果显示:大鼠一般状况无明显影响,给贴敷膏药及恢复期间,无大鼠出现死亡情况,大鼠的行为、自主活动、摄食、饮水、粪便、尿液基本正常,眼、耳、鼻、口未见异常分泌物,毛发如常。捕捉时未见明显肌力异常。单次给药后,第一组大鼠皮肤均出现轻微地红斑、水肿等反应,反应平均值2.21;第二组大鼠仅有2只大鼠局部皮肤出现散在红疹,未连成片状红斑;第三组大鼠局部皮肤未见异常反应。表明改良药物组分能够减轻局部皮肤刺激反应,蟾雄巴布膏基质能够进一步减轻中药局部贴敷过敏性湿疹的发生。
[0177]
6.2镇痛实验(小鼠扭体法)
[0178]
小鼠18只,雌雄各半,采用分层随机法分为3组,每组6只,于实验前一天将其背部脱毛,脱毛面积约3cm
×
3cm。分别予敷贴未改良蟾雄膏、改良蟾雄膏、蟾雄巴布膏。以未改良蟾雄膏组作为对照,抑制率计算则表达意义为在未改良蟾雄膏基础上提升。
[0179]
结果显示:相比于未改良蟾雄膏组,改良组蟾雄膏小鼠扭体反应实验抑制率提升 29.22%,蟾雄巴布膏组小鼠扭体反应抑制率提升46.93%,均具有统计学差异(p均<0.05),表明改良药物组分能增加镇痛能力,蟾雄巴布膏基质对单纯的中药止痛存在协同促进作用。(如表6所示)
[0180]
表6:小鼠扭体反应
[0181][0182]
结论:通过对传统蟾雄膏的制作工艺改良,蟾雄巴布膏能够加速皮下血流量且能够持续稳定给药,促进止痛及抗癌成分的透皮吸收,减轻局部皮疹、水肿等不良反应,无明显肝肾功能损伤,提高对疼痛的耐受。相比于现有技术中的中药配伍,蟾雄巴布膏镇痛效果更明显,相比于普通巴布膏基质,蟾雄巴布膏的机制与中药之间存在协同促进作用,使得药物更好地透皮吸收,提高痛阈;同时过敏性皮疹的发生率也更低。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1