C3G在制备拮抗3-MCPD染毒造成的抗氧化系统破坏的拮抗剂中的应用
c3g在制备拮抗3
‑
mcpd染毒造成的抗氧化系统破坏的拮抗剂中的应用
1.本技术为申请日为2017.07.07,申请号为201710550506.3,名称为“矢车菊素
‑3‑
o
‑
葡萄糖苷在制备和/或预防3
‑
氯
‑
1,2
‑
丙二醇或3
‑
氯
‑
1,2
‑
丙二醇酯引发的生殖疾病药物中的应用”的分案申请。
技术领域
2.本发明属于生物医药技术领域,具体涉及c3g在制备拮抗3
‑
mcpd染毒造成的抗氧化系统破坏的拮抗剂中的应用。
背景技术:
[0003]3‑
氯
‑
1,2
‑
丙二醇(3
‑
mcpd)在食品中广泛存在且毒性较大,油脂中广泛存在的3
‑
氯
‑
1,2
‑
丙二醇酯在体内的代谢产物即为3
‑
氯
‑
1,2
‑
丙二醇,3
‑
mcpd在消化道内易吸收,在体液中广泛分布,并且可以穿过血睾屏障和血脑屏障到达睾丸和脑。药物代谢动力学表明:3
‑
mcpd可以通过胃肠道吸收后广泛分布到全身各处,在血液中的氯丙醇24h后绝大部分可以代谢出去,但是在脑部的蓄积可达到20%,睾丸中更是高达60%,从而造成睾丸损伤。
[0004]
矢车菊素
‑3‑
o
‑
葡萄糖苷(c3g)是常见水溶性花色苷中含量最丰富的花色苷之一,是黑豆皮中含量最高的花色苷(68.3%),具有很强抗氧化活性。
[0005]
目前研究中没有报道关于该花色苷对3
‑
mcpd生殖损伤保护作用,本研究希望为以后花色苷对3
‑
mcpd生殖毒性营养干预提供理论基础。
技术实现要素:
[0006]
本发明提供了c3g在制备拮抗3
‑
mcpd染毒造成的抗氧化系统破坏的拮抗剂中的应用。
[0007]
本发明采用动物实验,采用不同剂量的矢车菊素
‑3‑
o
‑
葡萄糖苷对3
‑
mcpd暴露引起的大鼠睾丸损伤的保护作用进行了研究,为矢车菊素
‑3‑
o
‑
葡萄糖苷对3
‑
mcpd生殖毒性营养干预提供理论基础。
[0008]
为了实现上述目的,本发明采用如下技术方案:
[0009]
矢车菊素
‑3‑
o
‑
葡萄糖苷在制备拮抗3
‑
氯
‑
1,2
‑
丙二醇染毒造成的抗氧化系统破坏的拮抗剂中的应用;所述矢车菊素
‑3‑
o
‑
葡萄糖苷的添加量为250~500mg/kg饲料或药物。
[0010]
优选的,所述拮抗包括通过抑制mapk信号通路激活调节支持细胞btb结构功能,减轻3
‑
氯
‑
1,2
‑
丙二醇造成的生精上皮损伤,维持生精微环境稳定并调节生精细胞分裂与分化,改善生精障碍。
[0011]
优选的,所述拮抗包括通过调节精子能量代谢相关酶,提高精子活性。
[0012]
与现有技术相比,本发明具有如下优点及有益效果:
[0013]
本发明发现,矢车菊素
‑3‑
o
‑
葡萄糖苷(c3g)可以改善3
‑
mcpd染毒造成的大鼠摄食
减少,生长迟缓状况;并且可以有效拮抗3
‑
mcpd染毒造成的大鼠抗氧化系统破坏,通过抑制mapk信号通路激活调节支持细胞btb结构功能,来减轻3
‑
mcpd造成的生精上皮损伤,维持生精微环境稳定并调节生精细胞分裂与分化,改善生精障碍。同时c3g可以通过调节精子能量代谢相关酶,提高精子活性。调节3
‑
mcpd染毒造成的大鼠性激素分泌紊乱,维持血清性激素与睾丸内环境中雄激素正常水平。在饲料或药物中添加250mg/kg的低剂量到500mg/kg的中剂量呈现了较好的保护作用,而更高的剂量(1000mg/kg)作用并不明显。
附图说明
[0014]
图1为c3g干预对大鼠体重变化的趋势;
[0015]
图2为c3g干预对大鼠摄食变化的趋势;
[0016]
图3为c3g干预前后对小鼠脏器系数变化;
[0017]
图4为c3g干预前后对睾丸的病理学分析;
[0018]
图5为c3g干预前后对附睾头的病理学分析;
[0019]
图6为c3g干预前后对附睾尾的病理学分析;
[0020]
图7为c3g干预前后对精子活率/活力测定结果;
[0021]
图8为c3g干预前后对精子动力学参数结果;
[0022]
图9为c3g干预前后对精子总数、畸形率测定结果;
[0023]
图10为c3g干预前后对精子形态影响;
[0024]
图11为c3g干预前后对睾丸ldh与ldh
‑
x活性变化;
[0025]
图12为c3g干预前后对睾丸内gsh与gssg含量变化;
[0026]
图13为c3g干预前后对睾丸内sod活性变化;
[0027]
图14为c3g干预前后对睾丸mda水平变化;
[0028]
图15为c3g干预前后对大鼠血清炎症因子水平变化;
[0029]
图16为c3g干预前后对生精细胞8
‑
0hdg免疫影响;
[0030]
图17为c3g干预前后对大鼠血清激素水平变化;
[0031]
图18为c3g干预前后对生精细胞tunel凋亡影响;
[0032]
图19为c3g干预前后对生精细胞凋亡指数的变化影响;
[0033]
图20为c3g干预前后对睾丸gapdh蛋白表达变化;
[0034]
图21为c3g干预前后对睾丸erk蛋白表达变化;
[0035]
图22为c3g干预前后对睾丸p38蛋白表达变化;
[0036]
图23为c3g干预前后对睾丸jnk蛋白表达变化;
[0037]
图24为c3g干预前后对睾丸凋亡相关蛋白表达变化。
具体实施方式
[0038]
以下结合具体实施例和附图进一步说明本发明,其实施例在附图中图示并在后面加以说明,给出了部分详细的实施方式和具体的操作过程。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
[0039]
实施例1
[0040]
1.1实验动物
[0041]
10周龄雄性wistar大鼠54只,购自于广东省实验动物中心。大鼠在暨南大学医学院spf级动物房饲养,昼夜12小时交替。温度维持在22℃
‑
26℃,相对湿度60%
‑
80%,自由摄食。
[0042]
1.2动物饲料及试剂
[0043]
普通ain93
‑
g饲料购自江苏美迪森,添加c3g的ain93
‑
g饲料购自江苏美迪森,其中,添加c3g的ain93
‑
g饲料配方如表1所示:
[0044]
表1添加c3g的ain93
‑
g饲料配方
[0045]
饲料种类c3g含量(mg/kg饲料)普通ain93
‑
g饲料0低剂量ain93
‑
g饲料250中剂量ain93
‑
g饲料500高剂量ain93
‑
g饲料1000
[0046]
饲料委托由江苏美迪森生物医药有限公司加工而成
[0047]
1.3 3
‑
mcpd溶液配制
[0048]
准确称取3
‑
mcpd 5g,溶于500ml生理盐水,搅拌均匀,4℃存放。每周重新配制一次。
[0049]
2、实验方法:采用纯度为92%的矢车菊素
‑3‑
o
‑
葡萄糖苷纯品。
[0050]
2.1动物分组及处理
[0051]
使用普通ain93
‑
g饲料将大鼠适应性喂养三周后,按体重分层法随机分为6组,每组9只,具体分组如下:
[0052]
表2动物分组
[0053]
大鼠组别饲料种类3
‑
mcpd正常对照ain93
‑
g饲料
‑3‑
氯
‑
1,2丙二醇ain93
‑
g饲料+高剂量花色苷干预高剂量ain93
‑
g饲料+中剂量花色苷干预中剂量ain93
‑
g饲料+低剂量花色苷干预低剂量ain93
‑
g饲料+花色苷对照中剂量c3gain93
‑
g饲料
‑
[0054]
采用灌胃方式每天对大鼠进行3
‑
mcpd给药,给药剂量20mg/kg.bw。3
‑
mcpd配制浓度5mg/ml,4℃存放。大鼠给药期间,自由摄食、饮水。每三天称量一次体重,调整给药剂量。每两天更换一次饲料,并记录摄食量。饲料存放于
‑
20℃,给动物投放饲料时需恢复至室温。
[0055]
2.2动物标本采集及测定
[0056]
2.2.1实验试剂配制
[0057]
睾丸固定液(mdf):质量百分比30%的甲醛(37%~40%),15%的无水乙醇,5%的冰乙酸和50%的蒸馏水。
[0058]
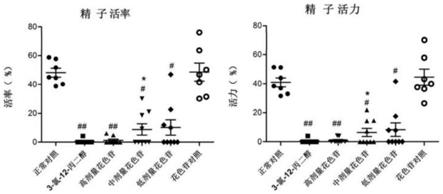
sds
‑
page胶(成分如表3所示)
[0059]
表3 sds
‑
page胶配方
[0060]
单位:ml
[0061][0062][0063]
电泳胶配制时按照成分表顺序依次加入,上表中为四块胶所需体积。30%丙烯酰胺,tris
‑
hcl,10%sds,10%过硫酸铵,temed来自试剂盒。
[0064]
蛋白电泳缓冲液(成分如表4所示)
[0065]
表4蛋白电泳液配方
[0066]
成分用量甘氨酸(gly)14.4gtris
‑
base3.03gsds1gddh2o1000ml
[0067]
蛋白转膜缓冲液(成分如表5所示)
[0068]
表5蛋白转膜液缓冲液配方
[0069]
成分用量甘氨酸(gly)14.4gtris
‑
base3.03gsds1g甲醇200mlddh2o800ml
[0070]
磁力搅拌混匀后,4℃存放。
[0071]
洗膜缓冲液(tbst)(成分如表6所示)
[0072]
表6洗膜缓冲液配方
[0073][0074][0075]
磁力搅拌混匀后,4℃存放。
[0076]
5%牛奶封闭液(成分如表7所示)
[0077]
表7 5%牛奶封闭液配方
[0078]
成分用量脱脂奶粉5gtbst100ml
[0079]
摇匀后4℃静置取上清。
[0080]
2.2.2免疫组化试剂
[0081]
(1)柠檬酸盐缓冲液(ph 6.0)
[0082]
称量柠檬酸钠1.47g,溶于500ml ddh2o中,4m hcl调节ph值至6.0,然后加入0.25ml tween
‑
20,混匀后4℃冷藏保存待用。
[0083]
(2)5%bsa封闭液
[0084]
称取2.5g bsa,溶解于50ml pbs中,混匀后冷藏保存待用。
[0085]
2.3具体实验方法
[0086]
2.3.1动物标本取材
[0087]
(1)麻醉及心脏取血
[0088]
大鼠连续给药四周,最后一次给药后24h内,禁食不禁水12h。以2%戊巴比妥钠麻醉大鼠。采用心脏取血方式收集血液,静置30min,4℃条件下3000rpm/min离心15min取血清,
‑
80℃保存待用。
[0089]
(2)生理盐水灌注
[0090]
配制1.5%edta
‑
2na生理盐水溶液,并于37℃水浴锅中提前预热,每只大鼠心脏灌注40ml。
[0091]
(3)取材
[0092]
灌注后迅速解剖,取右侧附睾尾进行精子测定。取睾丸、附睾、肾脏、肝脏以及脾脏,并称重、记录。取右侧睾丸、肾脏称重后迅速放入干冰中冷冻,转于
‑
80℃冰箱中保存,用于后续实验。左侧睾丸及附睾投入mdf固定液中固定。
[0093]
2.3.2精子活力测定
[0094]
(1)提前打开水浴锅调至37℃,预热dmem培养基。
[0095]
(2)打开精子分析仪,将精子计数板放于载物台进行预热。
[0096]
(3)取大鼠右侧附睾,剔去脂肪,剪下附睾尾并在预热过的生理盐水中清洗去除血迹。在附睾尾5~6个缺口,迅速放入提前预热的50ml dmem培养基中释放0.5h。精子释放期间轻轻摇匀培养基。
[0097]
(4)释放完成后,取10μl精子稀释液均匀打入精子计数板,进行精子活性以及动力学参数测定,每只大鼠统计1000个精子。动力学参数如下:
[0098]
vcl曲线速率(μm/s),精子头沿其实际曲线,即在显微镜下见到二维方式运动轨迹的时均速率,反应精子活动能力。
[0099]
vsl直线速率(μm/s),精子头在开始检测时的位置与最后所处位置之间的直线运动的时均速率。
[0100]
vap平均路径速率(μm/s),精子头沿其平均路径移动时的时均速率。
[0101]
alh精子头侧摆幅度(μm)精子头关于其平均路径的侧向位移幅度,以侧摆的平均
值表示。
[0102]
lin线性度,曲线轨迹的线性度,vsl/vcl。
[0103]
wob摆动性,实际的曲线路径关于平均路径的摆动值,vap/vcl。
[0104]
str前向性,平均路线的直线性,vsl/vap。
[0105]
bcf鞭打频率(hz),精子曲线路径跨越其平均路径的平均频率。
[0106]
mda平均角位移(度),精子头沿其曲线轨迹瞬时转折角度的时均绝对值。
[0107]
(5)精子形态拍照,并统计精子总数与畸形率,每只大鼠统计1000个精子。
[0108]
2.3.3组织固定及he染色
[0109]
2.3.3.1组织固定
[0110]
以1:9比例将睾丸放入mdf固定液中,固定24h以上。附睾头及附睾尾切分,并分别以1:9比例放入mdf固定液中固定24h以上。固定完成后进行石蜡包埋,并制作石蜡切片。
[0111]
2.3.3.2组织he染色及拍照
[0112]
(1)烤片
[0113]
切片放于75℃烘箱中烘烤2h。
[0114]
(2)脱蜡至水
[0115]
切片于二甲苯中脱蜡10min,换新鲜二甲苯继续脱蜡10min,依次浸入放入无水乙醇中5min,95%乙醇2min,90%乙醇2min,80%乙醇2min,70%乙醇2min,蒸馏水2min。
[0116]
(3)苏木精染色5~10min,流水冲洗干净。
[0117]
(4)1%盐酸酒精分色数秒钟,切片颜色褪至淡兰红色,流水冲洗干净。
[0118]
(5)伊红染色3~5min,流水冲洗干净。
[0119]
(6)脱水透明:将切片依次浸入70%乙醇2min,80%乙醇2min,90%乙醇2min,95%乙醇2min,无水乙醇中5min,二甲苯透明两次每次10min。
[0120]
(7)中性树胶封片。
[0121]
(8)40倍物镜下拍照。
[0122]
(9)依据makler评分标准评价睾丸组织,评分标准如下:
[0123]
表8睾丸组织评分标准
[0124][0125]
总分=d+m+p+s
[0126]
2.3.4睾丸组织相关酶测定
[0127]
2.3.4.1ldh/ldh
‑
x活性测定
[0128]
利用比色法原理,即乳酸代谢生成的丙酮酸与溶于酸的2,4
‑
二硝基苯肼作用生成丙酮酸
‑
二硝基苯腙,后者在酸性环境中呈草黄色,在碱性溶液中显棕红色,颜色的深浅与丙酮酸的浓度呈正比,与标准浓度的丙酮酸生成的苯肼进行比色,可推算出ldh的活力。
[0129]
本法规定37℃15min产生1μmol丙酮酸的酶活力为一个单位。
[0130]
(1)ldh活性测定
[0131]
1)10%组织上清液制备
[0132]
准确称取睾丸组织,以1:9质量/体积比加入生理盐水。匀浆至无肉眼可见组织块,3500rpm/min,4℃离心10min,取上清待用。所有样品操作均在冰浴中进行。
[0133]
2)配制试剂(参照试剂盒说明书)。
[0134]
辅酶1应用液配制:每只粉剂溶于1.3ml蒸馏水中,震荡混匀待用。
[0135]
0.2μmol/ml丙酮酸标准液:4mmol/ml丙酮酸标准液稀释10倍,现配现用。
[0136]
3)标准曲线制备
[0137]
丙酮酸标准液用超纯水依次稀释200倍,100倍,50倍,20倍,10倍,5倍,2倍。使用96孔板,设置空白孔与标准孔。空白孔一次加入超纯水25μl,基质缓冲液25μl混匀后37℃孵育15min,加入2,4
‑
二硝基苯肼25μl,混匀后37℃温浴15min,加入0.4mol/l氢氧化钠250μl,混匀后450nm处测定吸光值;标准孔分别加入5μl超纯水,不同浓度丙酮酸标准液各加20μl,基质缓冲液25μl,混匀后37℃温浴15min,加入2,4
‑
二硝基苯肼25μl,混匀后37℃温浴15min,加入0.4mol/l氢氧化钠250μl,混匀后450nm处测定吸光度值。以吸光值为纵坐标,相应标准浓度为横坐标,绘制标准曲线。
[0138]
4)预实验确定样品浓度
[0139]
5)根据标准曲线,选择预实验中组织样品浓度为0.1%时进行正式实验测定。设置空白孔、标准孔、测定孔、对照孔,加样顺序如下:
[0140]
表9 ldh活性测定加样顺序
[0141][0142][0143]
混匀后室温静止5min,450nm处测定吸光度值。以上试剂中0.2μmol/ml丙酮酸标准液,基质缓冲液,辅酶1,2,4
‑
二硝基苯肼,氢氧化钠溶液均来自试剂盒。
[0144]
6)bca法测定组织匀浆液中蛋白浓度:
①
使用生理盐水10%组织匀浆液稀释至浓
度2%用于蛋白定量;
②
使用超纯水将2mg/ml蛋白标准品分别稀释成1mg/ml,0.5mg/ml,0.25mg/ml,0.125mg/ml,0.0625mg/ml,0.03125mg/ml,0mg/ml;
③
配制bca工作液,将a、b工作液以50:1比例配制,现配现用;
④
96孔板中加入10μl标准品和待测样本,随后每孔加入200μl工作液,每个样品设置三个复孔,混匀后37℃孵育30min;
⑤
562nm处测定吸光度值,绘制标准曲线,并根据标准曲线计算组织样本蛋白浓度。
[0145]
7)根据以下公式计算组织ldh活性:
[0146][0147]
(2)ldh
‑
x活性测定
[0148]
ldh
‑
x具有热稳定性,取组织匀浆液于65℃中水浴30min。后续测定方法同上ldh活性测定。
[0149]
2.3.4.2gsh/gssg含量测定
[0150]
利用dntb的循环反应,测定睾丸组织中的总谷胱甘肽和氧化型谷胱甘肽的含量。
[0151]
(1)t
‑
gsh含量测定
[0152]
1)试剂配制:参照试剂盒说明书配制测定t
‑
gsh所需试剂。
[0153]
2)组织上清液制备:准确称取组织重量,以1:4质量/体积比加入匀浆液匀浆,3500rpm/min4℃离心10min,取上清低温保存待用。
[0154]
3)标准曲线制备
[0155]
将gsh标准品溶于超纯水中,配制成1mmol/l储备液,并稀释成以下浓度:0μmol/l,25μmol/l,50μmol/l,100μmol/l。参照试剂盒说明书依次加入试剂,混匀并准确计时,30s时405nm处读取吸光度值a1,室温静置10min,10min 30s时再次读取吸光度值a2。以δa(a1-a2)为纵坐标,浓度为横坐标制作标准曲线。
[0156]
4)预实验确定样品稀释浓度
[0157]
5)根据标准曲线,选择预实验中组织样品浓度为1.25%时进行正式实验测定,以50μmol/l的gsh标准品为标准对照,405nm处测定吸光值a1、a2,计算δa。
[0158]
6)根据以下公式计算t
‑
gsh含量:
[0159]
t
‑
gsh含量(μmol/l)=样品测定δa值/gsh标准品δa值
×
标准品浓度(50μmol/l)
×
样本测定前稀释倍数
[0160]
(2)gssg含量测定
[0161]
1)参照试剂盒说明书配制所需试剂。
[0162]
2)标准曲线制备
[0163]
超纯水溶解gssg,配制1mmol/l母液,并稀释成以下浓度:0μmol/l,25μmol/l,50μmol/l,100μmol/l。使用1.5ml ep管,加入标准品100μl后再参照说明书依次加入其他试剂后,涡旋1min,37℃孵育30min。取10μl进行测定,参照t
‑
gsh方法测定吸光值a1、a2,以δa为纵坐标,浓度为横坐标制作标准曲线。
[0164]
3)预实验确定样品稀释浓度
[0165]
4)根据标准曲线,选择预实验中组织样品浓度为1.25%时进行正式实验测定,以50μmol/l的gssg标准品为标准对照,测定吸光值a1、a2,计算δa。
[0166]
5)根据以下公式计算gssg含量:
[0167]
gssg含量(μmol/l)=样品测定δa值/gssg标准品δa值
×
标准品浓度(50μmol/l)
×
样本测定前稀释倍数
[0168]
(3)gsh含量计算
[0169]
根据以下公式计算gsh含量:
[0170]
gsh(μmol/l)=t
‑
gsh-2
×
gssg
[0171]
2.3.4.3sod活性测定
[0172]
采用wst
‑
1(2
‑
(4
‑
iodophenyl)
‑5‑
(2,4
‑
disulfophenyl)
‑
2h
‑
tetrazolium,monosodium salt)法即wst
‑
1可以和黄嘌呤氧化酶催化产生的超氧化物阴离子反应产生水溶性的甲臜染料,该反应步骤可以被sod所抑制。通过对wst
‑
1产物的比色分析即可计算sod的酶活力。
[0173]
sod活力定义:在本反应体系中s0d抑制率达50%时所消耗酶的量为一个活力单位(u)。
[0174]
(1)组织上清液制备。
[0175]
(2)bca法测定组织匀浆液中蛋白浓度。
[0176]
(3)试剂配制
[0177]
底物应用液:缓冲液和底物贮备液以200:1的比例进行配制,现配现用,低温保存。
[0178]
酶工作液:酶稀释液和酶贮备液以10:1比例进行配制,现配现用,低温保存。
[0179]
(4)预实验确定样品稀释浓度
[0180]
(5)选择预实验中抑制率为50%时组织匀浆浓度进行正式实验。经计算组织匀浆液浓度为0.2%时各组抑制率约50%。
[0181]
(6)用生理盐水将各组样本稀释到0.2%。使用96孔板并参照试剂盒说明书进行加样:对照孔加入超纯水20μl,酶工作液20μl;测定孔分别加入待测样本20μl,酶工作液20μl;对照空白孔加入超纯水20μl,酶稀释液20μl;测定空白孔加入待测样本(只做一个孔)20μl,酶稀释液20μl,随后各孔加入200μl底物应用液,混匀后37℃孵育20min,450nm处测定吸光度值。根据以下公式计算sod抑制率:
[0182]
sod抑制率%=((a对照-a对照空白)-(a测定-a测定空白))/(a对照-a对照空白)
×
100%
[0183]
sod活力按以下公式计算:
[0184]
sod活力(u/mgprot)=sod抑制率
÷
50%
×
12(反应体系稀释倍数)
÷
样本蛋白浓度(mgprot/ml)
[0185]
2.3.5睾丸mda水平测定
[0186]
(1)组织上清液制备。
[0187]
(2)bca法测定组织匀浆液中蛋白浓度。
[0188]
(3)加样
[0189]
按照试剂盒说明书配制试剂后,采用10ml ep管进行加样,设置空白管、标准管、样本测定管、样本对照管,其中空白、标准、样本对照各设置一管。空白管加入100μl无水乙醇,标准管加入10nmol/ml四乙氧基丙烷100μl,样本测定管与对照管分别加入待测样本100μl,参照试剂盒说明书加入已配制好的试剂,混匀后95℃水浴40min(试管口需用封口膜密封,
并在管盖上刺一小孔),取出后流水冷却,3500rpm/min离心10min。取上清于96孔板中532nm处测定吸光度值。
[0190]
(4)根据以下公式计算:
[0191][0192]
2.3.6血清激素水平测定
[0193]
大鼠血清中卵泡刺激素(fsh)和抑制素b(inh
‑
b)、睾酮(t)、双氢睾酮(dht)以及促黄体生成素(lh)采用elisa方法进行测定(试剂盒购于武汉华美生物有限公司)。
[0194]
2.3.7血清炎症因子测定
[0195]
大鼠血清炎症因子tnf
‑
α,il
‑
6,ifn
‑
γ采用elisa方法进行测定(elisa试剂盒购自欣博盛生物有限公司)。
[0196]
2.3.8tunel法检测组织凋亡
[0197]
(1)烤片。
[0198]
(2)脱蜡返水。
[0199]
(3)蛋白酶k处理打孔
[0200]
每个切片上滴加40μl,20μg/ml蛋白酶k(不含dnase),27℃作用20min,pbs洗涤3min
×
3次。
[0201]
(4)3%过氧化氢中低温孵育20min,灭活组织中内源性过氧化氢酶,pbs洗涤3min
×
3次。
[0202]
(5)配制生物素标记液:以比例tdt:biotin
‑
dutp=1:24配制,现配现用。每个切片滴加30μl生物素标记液,37℃湿盒内孵育1h。孵育后pbs洗涤一次。
[0203]
(6)滴加标记反应终止液,室温孵育10min,pbs洗涤3min
×
3次。
[0204]
(7)以比例streptavidin
‑
hrp:稀释液=1:49配制二抗工作液,混匀后每个切片滴加30μl,室温湿盒内孵育30min,pbs洗涤3min
×
3次。
[0205]
(8)dab显色。显色液a、b等比混合后,每切片滴加200μl,显微镜下观察,确定染色时间。染色后pbs冲洗干净。
[0206]
(9)苏木素染色。显微镜下观察,确定染色时间。染色后pbs冲洗干净。
[0207]
(10)脱水透明。
[0208]
(11)中性树胶封片,显微镜拍照观察。
[0209]
(12)每只大鼠统计400个生精细胞。
[0210]
2.3.9western blot分析相关蛋白
[0211]
2.3.9.1蛋白样品制备
[0212]
(1)组织蛋白提取:准确称取睾丸组织,以1:9比例加入ripa裂解液(ripa:cocktail:pmsf=100:1:1),匀浆至无肉眼可见固形物,3500rpm/min,4℃离心20min,取上清低温保存待用。
[0213]
(2)取组织匀浆液超纯水稀释10倍,采用bca法测定蛋白浓度。
[0214]
(3)蛋白样品制备:参考预实验结果,确定蛋白上样总量45μg,蛋白样品体积15μl。根据bca测定蛋白浓度,计算蛋白总量为40μg时所需组织匀浆液体积。每份样品中加体积为
入蛋白样品总体积1/5的loading buffer(5
×
),组织匀浆液体积与loading buffer总体积不足15μl时,加入超纯水补足15μl。
[0215]
(4)蛋白样品放入沸水中7min以上,使得蛋白变性,
‑
20℃保存。
[0216]
2.3.9.2蛋白电泳
[0217]
(1)sds
‑
page胶配制
[0218]
安装好配胶装置后,玻璃板中加满纯水进行装置验漏,5min内液面不下降即验漏成功。按照配方配制10%分离胶后,均匀加入玻璃板中至液面距离短玻璃板高度为2cm时停止,迅速加入无水乙醇,分离胶室温凝固30min,弃去上方无水乙醇,并用滤纸吸干,加入5%浓缩胶后,并迅速插入梳子,室温凝固40min。
[0219]
(2)拆卸玻璃胶板并安装放入电泳槽中,电泳内槽加满电泳缓冲液,外槽电泳液液面低于内槽,竖直拔出梳子,依次加入蛋白样品及protein ladder后开始恒压电泳,浓缩胶45v约45min,分离胶110v约70min。
[0220]
2.3.9.3转膜
[0221]
(1)提前配制转膜缓冲液并于4℃冰箱中预冷。
[0222]
(2)裁剪尺寸大小合适的pvdf膜浸于甲醇中活化10min。
[0223]
(3)打开转膜夹黑色阴极侧朝下,依次放入海绵、滤纸、胶、pvdf膜、滤纸、海绵,组成三明治结构。赶出胶块与pvdf膜之间气泡,夹紧转膜夹。全程在转膜缓冲液中操作。
[0224]
(4)将转膜夹装入转膜槽,槽中加满转膜液(为保证低温可在转膜槽中放入冰袋),打开电源,调节电流260ma,时间85min,开始恒流转膜。转膜全程在冰浴中进行。2.4.9.4牛奶封闭
[0225]
(1)小心取出pvdf膜放入孵育盒中,tbst缓冲液中洗涤3次
[0226]
(2)按照3.2.5中配方配制5%脱脂牛奶封闭液,加入孵育盒中,垂直摇床上室温封闭1.5h。
[0227]
2.3.9.5抗体孵育
[0228]
(1)一抗孵育
[0229]
1)弃去封闭液,tbst洗涤3次
[0230]
2)按照抗体说明书比例稀释一抗,加入孵育盒中,垂直摇床上4℃孵育过夜。
[0231]
(2)二抗孵育
[0232]
1)回收一抗,tbst洗膜,水平摇床上洗涤5次,每次7min。
[0233]
2)用5%脱脂牛奶稀释二抗,加入孵育盒中,垂直摇床上室温孵育1h。
[0234]
2.3.9.6ecl显影
[0235]
(1)弃去二抗,tbst洗膜,水平摇床上洗涤5次,每次7min。
[0236]
(2)按照1:1(ecl a液:ecl b液)比例配制ecl发光液,于自动显影曝光仪中显影。使用imagej图像分析软件分析目的蛋白条带灰度。
[0237]
(3)使用一抗、二抗去除液去除pvdf膜上印迹,继续孵育其他目的蛋白。
[0238]
2.4.10免疫组化检测相关蛋白及dna损伤
[0239]
使用免疫组化方法检测睾丸中claudin
‑
11,occludin,n
‑
cadherin,雄激素受体(androgen receptor,ar)以及8
‑
羟基脱氧鸟嘌呤(8
‑
hydroxy
‑
2'
‑
deoxyguanosine,8
‑
ohdg)。
[0240]
(1)烤片。(2)脱蜡至水。(3)抗原修复
[0241]
在微波炉中加热柠檬酸钠缓冲液至接近沸腾,将玻片放入柠檬酸钠缓冲液中加热20min。取出后流水冷却,用纯水清洗两次后pbs洗涤3min
×
2次。
[0242]
(4)3%过氧化氢中低温孵育20min,灭活组织中内源性过氧化氢酶,pbs洗涤3min
×
3次。
[0243]
(5)5%bsa封闭30min。
[0244]
(6)一抗孵育4℃过夜,pbs洗涤5min
×
3次。
[0245]
(7)室温孵育二抗2h,pbs洗涤5min
×
3次。
[0246]
(8)dab染色1min。
[0247]
(9)纯水浸泡1min。
[0248]
(10)脱水透明。参见2.4.3.2(6)
[0249]
(11)中性树胶封片,显微镜拍照观察。
[0250]
2.4统计分析
[0251]
实验数据结果采用graph pad prism6.0进行统计分析,数据结果均以mean
±
sem表示。组间比较采用单因素方差分析one
‑
way anove;大鼠体重及睾丸生精上皮损伤度评分采用mann
‑
whitney t
‑
test;精子活性指标分析采用kruskal
‑
wallis test。#p<0.05,##p<0.01,###p<0.001,*p<0.05,**p<0.01,***p<0.001为具有显著性差异性。
[0252]
实施例2:结果及分析:
[0253]
1、动物饲养期间行为表现
[0254]
大鼠给药期间,对照组生长状态良好、精力充沛,给药组老鼠精神状态低迷,各剂量c3g干预组大鼠精神状态良好、精力较充沛。给药两周内各组摄食量均稍有下降,第二周之后摄食量稳定,同时给药期间各组饮水量均有所下降。给药期间各组大鼠均未出现死亡现象。此外由于大鼠处理过程中出现血清溶血、精子测定失误等其他外界因素导致个别数据异常,故剔除,保留每组大鼠均≥6只。
[0255]
2、大鼠体重、摄食量变化
[0256]
2.1大鼠体重改变
[0257]
连续给药四周,期间control组与m
‑
c3g对照组生长状态良好,且两组之间没有显著性差异。3
‑
mcpd组体重增长缓慢与对照组相比有明显差异,不同剂量c3g干预后,其中中剂量与低剂量c3g干预组对3
‑
mcpd造成的大鼠体重增长缓慢具有明显改善作用,差异学分析具有显著性。高剂量c3g干预组对大鼠体重增长缓慢的改善作用并不明显,在给药第一周内大鼠体重增长速度正常,之后体重增长出现延缓(见图1)。
[0258]
大鼠干预前后体重变化量如表1所示,与control组相比3
‑
mcpd组体重变化量明显降低,低剂量组c3g干预组对大鼠体重变化量具有明显增加作用,基本恢复至control组水平。
[0259]
表10大鼠干预前后体重变化量
[0260]
单位:g
[0261]
组别干预前干预后变化量正常对照414.8
±
9.607466.9
±
9.8955.33
±
3.773
‑
氯
‑
1,2
‑
丙二醇4.5.4
±
5.409448.9
±
7.2442.83
±
3.07#
高剂量花色苷407.5
±
7.028453.2
±
8.53745.73
±
3.986中剂量花色苷427.7
±
3.428475.1
±
3.79847.37
±
1.15低剂量花色苷419.4
±
5.232476
±
6.30756.60
±
2.41*花色苷对照414.3
±
5.046475.2
±
7.60760.96
±
3.88*
[0262]
2.2大鼠摄食量改变
[0263]
给药期间各组大鼠摄食量均有所减少,随后保持稳定并有所增加。3
‑
mcpd组、高剂量c3g干预组、低剂量c3g干预组在给药后两周内摄食量减少较为明显,两周后3
‑
mcpd组和低剂量c3g干预组摄食量增加至control组水平,高剂量c3g干预组摄食量也有所增加,但增加较少。control组与m
‑
c3g组摄食量变化趋势一致,一定剂量范围内c3g对大鼠摄食量没有影响(见图2)。统计学分析各组大鼠摄食量并无相显著性差异。
[0264]
2.3大鼠脏器系数变化
[0265]
大鼠在给药第四周后处死,取器官并计算各器官湿重占体重比,即脏器系数。3
‑
mcpd组与control组相比睾丸脏器系数明显降低,中剂量与低剂量c3g干预组大鼠睾丸脏器系数与3
‑
mcpd组相比明显升高,统计学分析具有显著性。由此可见中剂量与低剂量c3g对3
‑
mcpd造成睾丸重量减轻,具有较好的改善作用。高剂量c3g对于3
‑
mcpd造成睾丸脏器系数降低有略微改善作用,但与3
‑
mcpd组相比统计学分析没有显著性。
[0266]
大鼠附睾重量在3
‑
mcpd染毒后明显减轻,附睾脏器系数与control组相比显著降低,采用不同剂量c3g干预后,低剂量c3g干预效果较为明显,附睾脏器系数接近control组水平。中剂量c3g组对附睾重量减轻也具有明显改善,但统计学分析并无显著差异性。与中剂量、低剂量c3g组相比,高剂量组c3g对于3
‑
mcpd造成脏器系数的下降并无改善作用。3
‑
mcpd及不同剂量c3g对肝脏、肾脏、脾脏脏器系数均没有影响(图3)。
[0267]
2.4睾丸、附睾组织病理学分析
[0268]
2.4.1睾丸组织he病理学分析
[0269]
大鼠睾丸固定后进行石蜡包埋并制作切片,he染色后显微镜下观察各组大鼠睾丸组织形态,并拍照分析(图4)。control组与m
‑
c3g对照组大鼠睾丸组织内生精小管排列整齐、紧密,生精上皮支持细胞结构完整,各级生精细胞清晰可见,生精小管管腔内充满精子。3
‑
mcpd组与control组相比,生精小管萎缩,导致小管直径明显减小,间质增宽,生精上皮几乎消失殆尽,仅基底层保留有少量精原细胞,生精上皮支持细胞间出现大小不等空泡(蓝色箭头所示),有多核巨大细胞形成(图中未显示),管腔内无成熟精子,几乎成为空腔。中剂量与低剂量c3g干预组对生精上皮损伤具有明显改善,生精小管萎缩程度减弱,内径基本正常,生精上皮支持细胞结构与3
‑
mcpd组相比结构更为紧密,空泡消失,生精细胞保留3层左右,低剂量c3g干预组大部分生精小管管腔内有成熟精子出现,个别管腔内有脱落的精母细胞(黑色箭头所示)。与其它剂量c3g相比,高剂量c3g对生精小管损伤现象并没有起到较好的改善作用。
[0270]
对睾丸组织进行makler评分,结果显示3
‑
mcpd组曲细精管出现萎缩,但在正常范围内,总体损伤度评分与control组相比具有显著性差异。不同剂量c3g干预后,中剂量与低剂量c3g对3
‑
mcpd造成生精上皮损伤具有明显改善,统计学分析具有显著性差异。
[0271]
表11大鼠睾丸组织makler评分
[0272]
分组dmpsd+m+p+s
正常对照555519.79
±
0.10203
‑
氯
‑
1,2
‑
丙二醇541211.49
±
0.4883###高剂量花色苷541212.61
±
0.6463###中剂量花色苷553315.81
±
1.050#**低剂量花色苷553417.58
±
0.7466#***花色苷对照545518.71
±
0.2625***
[0273]
2.4.2附睾组织he病理学观察
[0274]
如图5所示,光学显微镜下观察分析附睾头部组织结构,control组与m
‑
c3g组附睾管结构整齐,上皮基底细胞排列紧密,高柱状上皮细胞静纤毛清晰、游离缘整齐,管内可见大量成熟精子,个别出现脱落生精细胞。3
‑
mcpd组中明显看到附睾萎缩,附睾管间质增大,管壁增厚,管内几乎成为空腔,上皮细胞纤毛凌乱不规则。中剂量与低剂量c3g干预组中,附睾上皮有明显改善,部分附睾管腔内有成熟精子出现。
[0275]
如图6所示,附睾尾部组织病理学观察分析,control组与m
‑
c3g对照组附睾形态与附睾头部组织结构一致,主细胞结构整齐有序,高柱状上皮细胞高度降低,静纤毛变短,管腔内充满精子,个别出现脱落生精细胞。3
‑
mcpd组与高剂量c3g干预组附睾管形态变化与附睾头部一致,附睾管腔内无成熟精子,附睾管上皮变性,高柱状细胞高度增加,管腔内出现大片融合呈均质状物质,细胞出现空泡样变化(黑色箭头)。中剂量与低剂量c3g干预后附睾上皮细胞形态得到改善,基底细胞与高柱状细胞基本整齐,且排列紧密,部分管腔内有成熟精子。
[0276]
采用casa技术对附睾尾精子活性进行测定,各组精子活率与活力如图7所示,control组与m
‑
c3g组大鼠精子活率、活力较高。3
‑
mcpd干预后精子活力、活率几乎为零。采用不同剂量c3g进行干预,中剂量组和低剂量组c3g对精子活率、活力均有较好的恢复作用,两组各有4只大鼠活性得到较好改善,其中中剂量组c3g与3
‑
mcpd组相比具有显著性差异。
[0277]3‑
mcpd对精子动力学参数影响如图8所示,精子直线速率(vsl)、精子曲线速率(vcl)、精子路径速率(vap)、精子鞭打频率(bcf)以及精子平均角位移度(mad),在3
‑
mcpd染毒后各指标降低几乎为零。中剂量组、低剂量组c3g干预后精子运动略有改善,但统计学分析没有差异性。精子头侧摆幅度(alh),在3
‑
mcpd染毒后显著减小,各剂量c3g干预后没有改善这一现象。3
‑
mcpd对精子摆动性(wob)、线性度(lin)和向性(str)没有影响,说明3
‑
mcpd对精子运动方式未产生影响,具体数值未列出。
[0278]
c3g维持精子形态、密度
[0279]
取附睾尾精子测定精子密度并计算精子总数,统计精子畸形率。如图9(左)所示大鼠精子总数在3
‑
mcpd染毒后急剧减少,精子畸形率高达100%,如图10中所示3
‑
mcpd组中看不到正常精子,并且精子密度很低。中剂量组c3g干预后精子总数显著增加,与3
‑
mcpd组相比统计学分析具有差异性。低剂量组c3g也明显提高精子总数,但统计学分析没有差异性。中剂量与低剂量c3g干预组对大鼠畸形率均有降低作用,但统计学分析未见差异性。高剂量c3g干预组对大鼠精子总数、精子畸形率未见改善作用。
[0280]3‑
mcpd染毒后造成畸形精子多为头部畸形,精子无头或无勾(见图10红色箭头标注),此类精子没有活性。中剂量与低剂量c3g干预后,精子畸形率降低,正常形态精子增多(图10蓝色箭头所示)。
[0281]
c3g调节睾丸ldh/ldh
‑
x变化
[0282]
如图11所示,测定大鼠睾丸组织中ldh与ldh
‑
x变化,结果显示3
‑
mcpd干预后ldh酶活性显著升高,不同剂量c3g干预后,其中低剂量组与3
‑
mcpd组相比酶活性有下降,但统计学分析没有显著性。睾丸组织ldh
‑
x酶活性在3
‑
mcpd染毒后没有明显改变,中剂量c3g与低剂量c3g干预组以及c3g对照组可明显提高ldh
‑
x活性。比较各组ldh
‑
x与ldh比值发现,3
‑
mcpd染毒后ldh
‑
x与ldh比值明显降低,中剂量与低剂量c3g干预后明显提高ldh
‑
x与ldh比值,c3g对照组与control组相比ldh
‑
x与ldh比值明显升高。ldh
‑
x比例降低会造成大鼠精子成熟、精子活性受到抑制。c3g可以明显提高ldh
‑
x活性来维持精子发生、成熟。
[0283]
c3g保护睾丸抗氧化还原系统
[0284]
c3g提高睾丸中gsh、gssg表达
[0285]
如图12所示,测定大鼠睾丸中gsh、gssg含量,结果显示3
‑
mcpd染毒后大鼠睾丸中gsh与gssg表达均显著降低,对于gsh与gssg比例无明显影响。中剂量与低剂量c3g干预组以及c3g对照组显著增加了睾丸内gsh含量。对于睾丸内gssg表达,中剂量与低剂量c3g明显起到改善作用,c3g对照组与正常对照组相比gssg表达没有变化。gsh与gssg在体内可以相互转化,gsh清除过氧化物自身被氧化为gssh,机体又可将gssg还原为gsh。但是对于gsh/gssg,3
‑
mcpd染毒后对其没有显著影响,中剂量c3g干预组与control组相比显著提高了gsh/gssg比值。说明中剂量c3g可以显著提高机体抗氧化酶含量水平。
[0286]
c3g提高sod活性
[0287]
sod将机体过量超氧阴离子自由基催化为h2o2,gsh则进一步将h2o2还原成h2o。gsh与sod共同维持机体氧化还原平衡。测定睾丸中sod酶活性,结果显示3
‑
mcpd染毒后睾丸中sod酶活性明显降低,在不同剂量c3g进行干预后,sod酶活性显著升高。中剂量、低剂量c3g干预组与3
‑
mcpd组相比均有显著性差异,高剂量c3g干预组对sod酶活性也有增强作用,但统计学分析没有差异性。c3g可以有效改善3
‑
mcpd造成的大鼠sod酶活性降低,低剂量c3g组效果最好(见图13)。
[0288]
睾丸mda水平
[0289]
如图14所示,测定大鼠睾丸中mda水平,结果显示3
‑
mcpd染毒后并没有引起mda水平升高,各剂量c3g对mda水平变化也没有影响。说明3
‑
mcpd没有造成睾丸脂质过氧化损伤。
[0290]
c3g降低血清炎症因子水平
[0291]
如图15所示,elisa方法测定大鼠血清中炎症因子tnf
‑
α、ifn
‑
γ以及il
‑
6水平变化。结果显示3
‑
mcpd染毒后血清中tnf
‑
α、ifn
‑
γ水平升高,低剂量c3g干预组对于tnf
‑
α有明显改善作用。各剂量c3g干预后对大鼠血清ifn
‑
γ水平均具有改善作用,其中中剂量组c3g干预组效果较为显著。
[0292]
c3g减弱生精细胞dna损伤
[0293]
如图16所示,3
‑
mcpd造成睾丸氧化应激产生过量ros,损伤dna,而8
‑
ohdg是敏感的ros损伤dna的标志性产物。免疫组化方法检测睾丸组织中8
‑
ohdg表达,分析生精上皮细胞dna损伤情况。结果显示对照组中8
‑
ohdg表达较少,3
‑
mcpd染毒后睾丸组织中阳性表达增多,主要分布在精原细胞。c3g干预组大鼠睾丸组织中8
‑
ohdg阳性表达降低,尤其是精原细胞内8
‑
ohdg表达明显减少,但是在精子细胞还有8
‑
ohdg阳性表达,这说明c3g对精子细胞前期阶段得生精细胞具有保护作用,拮抗3
‑
mcpd造成的氧化应激对生精细胞dna的损伤作用。
三种剂量c3g均可有效减轻dna损伤情况。
[0294]
c3g调节性激素分泌如图17所示,elisa测定大鼠血清中fsh、lh、t、dht以及inh
‑
b含量变化,结果显示3
‑
mcpd可以抑制fsh与inh
‑
b分泌,对于t、dht、lh水平变化没有影响。低剂量组c3g对于fsh与inh
‑
b分泌减少具有明显改善作用。统计学分析具有差异性。
[0295]
c3g抑制3
‑
mcpd引起的生精细胞凋亡
[0296]
采用tunel法检测睾丸生精上皮中生精细胞凋亡情况,结果显示在3
‑
mcpd染毒后生精细胞凋亡情况加剧。中剂量与低剂量c3g干预后生精细胞凋亡情况明显改善(图18)。通过计算各组生精细胞凋亡指数,结果显示低剂量c3g抑制生精细胞凋亡效果最为明显,统计学分析具有显著性差异(图19)。
[0297]
3g调节睾丸相关蛋白变化
[0298]
c3g下调gapdh表达
[0299]3‑
mcpd染毒后大鼠生精细胞凋亡增多,western blot检测大鼠睾丸组织中gapdh蛋白变化,结果显示3
‑
mcpd染毒后gapdh表达明显上调,这可能是由于3
‑
mcpd造成氧化应激所致。c3g可以明显下调gapdh蛋白表达,其中中剂量与低剂量c3g对gapdh表达调节效果较好(图20)。
[0300]
c3g抑制mapk通路激活
[0301]
mapk信号通路不仅可以调节细胞生长、增殖、分化、凋亡,还可以调节睾丸生精上皮结构,在维持生精过程中发挥重要作用。3
‑
mcpd染毒后大鼠睾丸中erk1(44kda),p
‑
erk1(44kda)明显上调,erk2(42kda)表达没有明显变化,p
‑
erk2(42kda)表达上调,说明3
‑
mcpd主要激活erk1通路。c3g干预组大鼠睾丸内erk以及p
‑
erk水平恢复正常。p38与p
‑
p38在3
‑
mcpd染毒后表达均上调,c3g干预组大鼠p38与p
‑
p38均下调至正常水平。然而在jnk信号通路中3
‑
mcpd染毒后上调jnk1(46kda)与p
‑
jnk1(46kda),同时抑制jnk2(54kda)表达。c3g干预组大鼠jnk表达及活化恢复正常水平。在三个不同剂量c3g干预作用中,中剂量与低剂量组c3g干预效果较好。
[0302]
由于erk,jnk1蛋白的活化与上调,其下游通路中bax,bad以及p53蛋白表达在3
‑
mcpd染毒后均明显下调,而抗凋亡蛋白bcl
‑
2则明显上调。在睾丸中bax蛋白表达受到抑制会造成睾丸曲细精管萎缩、生精细胞凋亡以及多核巨细胞出现。p53蛋白参与调节精母细胞减数分裂,当此蛋白表达受到抑制时同样也会造成多核巨细胞出现,并引发生精细胞凋亡。c3g干预组大鼠睾丸bax,bad,bcl
‑
2以及p53蛋白表达恢复至正常水平(图21~24所示)。
[0303]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1