一种白蛋白载硫化锌纳米颗粒及其制备方法与应用
1.本发明属于生物纳米材料领域,涉及一种白蛋白载硫化锌纳米颗粒及其制备方法与应用。 具体地说,本发明涉及具有稳定性能,兼具优异的生物相容性和生物安全性,可以实现肿瘤 微环境响应和肿瘤部位富集的纳米治疗平台的制备和应用性能评价。
背景技术:
2.原发性肝癌是常见恶性肿瘤,肝细胞肝癌(hcc)占其中的75%
‑
85%。免疫疗法在hcc 中备受关注,但如何提高患者免疫治疗反应性是亟待解决的科学问题。纳米材料具有增强渗 透与保留效应,通过诱导肿瘤细胞免疫原性死亡、改善肿瘤微环境、激活外周免疫系统等途 径促进抗肿瘤免疫应答。进一步寻找新的肿瘤免疫调控机制并结合课题组的材料治疗平台构 建优势,可为开发肿瘤综合治疗纳米材料提供新思路。
3.固有免疫是宿主免疫应答的重要组成部分。cgas/sting信号通路可被游离dna激活, 触发固有免疫应答。激活cgas/sting信号已成为增敏肿瘤免疫疗法的新兴策略。另一方面, 过量的ros可以破坏线粒体,释放线粒体dna,从而激活cgas/sting信号,触发固有免 疫应答。ros导致线粒体损伤需要高量的ros产生,因此设计制备一种能高量产生ros从 而触发固有免疫应答的药物进行肿瘤靶向在实现肿瘤治疗中具有重要价值。
技术实现要素:
4.本发明的目的在于提供一种白蛋白载硫化锌纳米颗粒及其制备方法与应用。
5.所述白蛋白载硫化锌纳米颗粒的粒径为20
‑
200nm,该纳米颗粒性能稳定,尺度均一,分 散性能良好。具有肿瘤微环境响应和肿瘤部位靶向富集性能,具有高效的肿瘤治疗作用,提 高生存率。此外能够激活肿瘤免疫,避免肿瘤复发和转移。
6.本发明目的是通过以下技术方案来实现:
7.一种白蛋白载硫化锌纳米颗粒,所述白蛋白载硫化锌纳米颗粒的粒径为20
‑
200nm,其中, 硫化锌为无定形态。
8.一种上述的白蛋白载硫化锌纳米颗粒的制备方法,具体为:
9.将40
‑
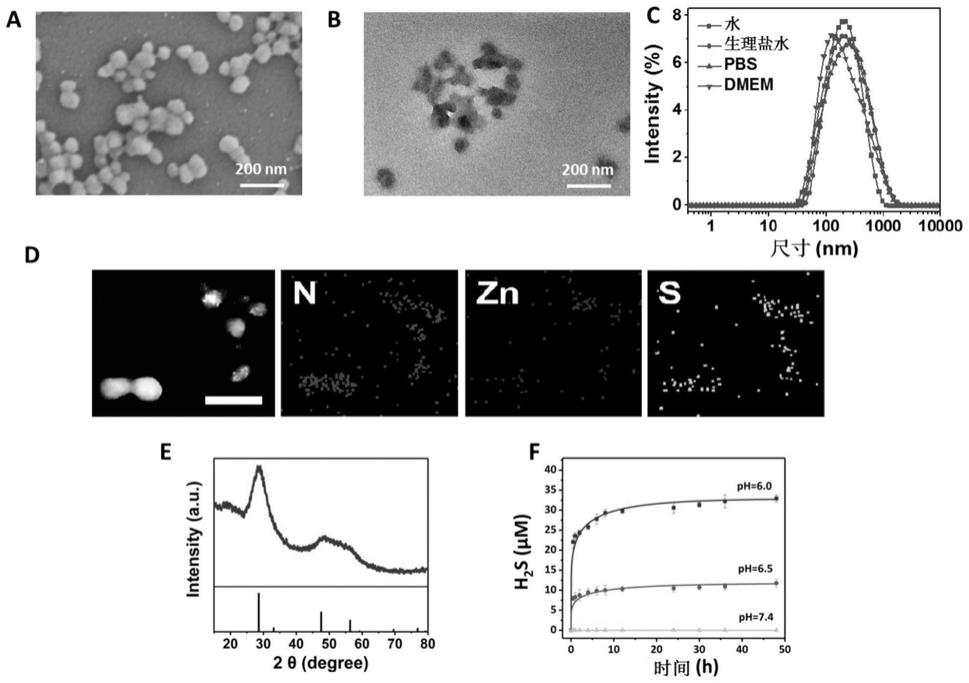
80mg牛血清白蛋白溶于5ml纯水中,并在搅拌中加入13.75
‑
27.5mg/ml的醋酸锌溶 液1.0ml,18.2
‑
36.4mg/ml的硫化钠溶液1.5ml,室温下搅拌反应4
‑
12小时,除杂后干燥获得 白蛋白载硫化锌纳米颗粒。
10.进一步地,具体为:将40mg牛血清白蛋白溶于5ml纯水中,并在搅拌中加入13.75mg/ml 的醋酸锌溶液1.0ml,18.2mg/ml的硫化钠溶液1.5ml,室温下搅拌反应4小时,除杂后干燥 获得白蛋白载硫化锌纳米颗粒。
11.进一步地,采用透析对反应后的溶液进行除杂,具体为:将反应后的溶液装入分子量为 8000
‑
14000的透析袋中,在4℃条件下,用去离子水透析12
‑
24小时,除去多余的醋酸锌、 硫化钠及其副产物。
12.进一步地,干燥方法为冷冻干燥。
13.一种上述的白蛋白载硫化锌纳米颗粒在制备肿瘤治疗及免疫治疗制剂中的应用。
14.进一步地,所述肿瘤治疗及免疫治疗包括:抑制肿瘤生长、肿瘤免疫激活并抑制肿瘤复 发转移等。
15.本发明的有益效果是:白蛋白载硫化锌纳米颗粒能够在肿瘤部位靶向富集,响应肿瘤酸 性微环境,产生h2s气体,释放锌离子。锌离子与h2s气体协同,导致胞内大量ros产生。 大量ros一方面能够杀伤肿瘤,另一方面可导致线粒体破坏,释放线粒体dna,激活 cgas/sting信号,引起下游ⅰ型干扰素和促炎因子释放,抑制肿瘤生长;同时改变肿瘤免 疫微环境,从而增强抗肿瘤免疫应答。胞内存在的锌离子则可进一步增强cgas/sting信号。 在这样的设计下,不仅实现高效的肿瘤治疗,而且能够激活肿瘤免疫从而抑制肿瘤复发转移, 在肿瘤治疗中具有重要意义。
16.另外,白蛋白无毒、低免疫原性、相容性好,在肿瘤诊疗领域具有广泛应用。白蛋白半 衰期长,适用于功能因子体内递送;可实现肿瘤细胞的胞吞作用,具有肿瘤靶向性;对金属 离子亲和力较强,可进行功能化改造。
17.本发明中,通过白蛋白载硫化锌纳米颗粒实现肿瘤微环境响应治疗平台,实现肿瘤部位 靶向富集,肿瘤高效治疗,激活肿瘤免疫避免肿瘤复发转移。本发明制备方法工艺简单,原 料成本低廉,兼具良好的生物相容性,安全可靠,并适合大规模生产。
附图说明
18.下面结合附图和实施例对本发明进一步说明;
19.图1白蛋白载硫化锌纳米颗粒纳米材料表征和性能图。(a)扫描电镜(sem)图,(b)透 射电镜(tem)图;(c)不同溶液中白蛋白载硫化锌纳米颗粒水动力半径结果图;(d)白蛋 白载硫化锌纳米颗粒元素种类分析结果图(比例尺为200nm),(e)x射线衍射图;(f)不同 ph值白蛋白载硫化锌纳米颗粒h2s气体释放曲线示意图。
20.图2白蛋白载硫化锌纳米颗粒在肿瘤细胞中的治疗应用结果图。白蛋白载硫化锌纳米颗 粒(a)对正常肝细胞aml12存活影响结果图,(b)对肝癌细胞hepa1
‑
6存活影响结果图,(c) 在ph值为6的酸性条件下对肝癌细胞hepa1
‑
6存活影响结果图,(d)在不同ph值条件下对肝癌 细胞hepa1
‑
6存活影响结果图;(e)在不同ph值条件肝癌细胞hepa1
‑
6内h2s气体生成情况结 果图;白蛋白载硫化锌纳米颗粒引起(f)肝癌细胞hepa1
‑
6内ros产生结果图,(g)肝癌细 胞hepa1
‑
6内线粒体膜电位改变结果图,(h)肝癌细胞hepa1
‑
6内线粒体dna含量结果图;(i) 冷冻电镜观察白蛋白载硫化锌纳米颗粒引起肝癌细胞hepa1
‑
6线粒体变化情况结果图。
21.图3白蛋白载硫化锌纳米颗粒在荷瘤动物中的治疗应用结果图。(a)白蛋白载硫化锌纳 米颗粒在动物体内各器官分布以及肿瘤靶向性结果图;不同组别小鼠(b)治疗后的肿瘤光 学图片(5个重复),治疗期间(c)体重变化和(d)肿瘤体积变化结果图,(e)治疗后的肿 瘤质量和(f)治疗后小鼠60日内生存曲线结果图。
22.图4白蛋白载硫化锌纳米颗粒在荷瘤动物中的治疗应用的生物安全性分析结果图。不同 组别小鼠治疗后(a
‑
c)血常规:红细胞,白细胞,血小板情况,(d
‑
f)肝功能:总胆红素, 谷草转氨酶,谷丙转氨酶情况,(g,h)肾功能:肌酐,尿素情况结果图;(i)白蛋白载硫化 锌纳米颗粒治疗后小鼠主要器官(心,肝,脾,肺,肾)he染色组织切片。
23.图5白蛋白载硫化锌纳米颗粒激活肿瘤免疫治疗结果图。qpcr检测肝癌细胞hepa1
‑
6在白 蛋白载硫化锌纳米颗粒作用后ifnb1(a)和isg56(b)的mrna水平结果图;(c)elisa检 测肝癌细胞hepa1
‑
6在白蛋白载硫化锌纳米颗粒作用后ifnβ和cxcl10的水平结果图;(d)免 疫印迹检测hepa1
‑
6细胞在白蛋白载硫化锌纳米颗粒作用后cgas/sting信号通路tbk1、 sting、p
‑
tbk1、p
‑
sting的表达结果图;不同治疗后肿瘤组织(e)ifnb1和isg56的mrna 水平,(f)ifnβ和cxcl10的水平,(g)tbk1、sting、p
‑
tbk1、p
‑
sting的表达结果图; (h)流式细胞仪检测肿瘤组织内杀伤型t细胞浸润情况及(i)其量化分析结果图。
24.图6白蛋白载硫化锌纳米颗粒在荷瘤动物中抑制肿瘤复发转移结果图。原发肿瘤经过不 同治疗后另一侧皮下二次成瘤,二次成瘤的(a)肿瘤光学照片;(b)肿瘤体积变化结果图; (c)肿瘤质量结果图;(d)肿瘤组织he染色、免疫荧光染色观察杀伤型t细胞结果图。
具体实施方式
25.以下结合附图和下述实施方式对本发明作进一步说明,应理解,附图及下述实施方式仅 用于说明本发明,而非限制本发明。
26.本发明提供的一种白蛋白载硫化锌纳米颗粒,具有肿瘤微环境响应性和肿瘤靶向富集性 能,显著抑制肿瘤生长,提高动物生存率,同时能够激活肿瘤免疫治疗,抑制肿瘤复发转移, 实现强大的肿瘤杀伤作用。
27.本发明的白蛋白载硫化锌纳米颗粒,具体制备方法是将醋酸锌和硫化钠溶液加入牛血清 白蛋白水溶液中反应,反应完成后在透析袋中,用去离子水进行透析,冷冻干燥后获得白蛋 白载硫化锌纳米颗粒。该制备方法简单,易于大规模制备。
28.下面通过实施例以详细说明本发明。应理解为以下实施例只用于对本发明进行进一步说 明,不能理解为对本发明保护范围的限制,本领域的技术人员根据本发明的上述内容作出的 一些非本质的改进和调整均属于本发明的保护范围。下述实施例具体的工艺参数等也仅是合 适范围中的一个示例,即本领域技术人员可以通过本文的说明做合适的范围内选择,而并非 要限定于下文示例的具体数值。
29.实施例1
30.称取40mg牛血清白蛋白溶于5ml纯水中,搅拌中加入13.75mg/ml的醋酸锌溶液1ml, 18.2mg/ml的硫化钠溶液1.5ml,室温下搅拌反应4小时。反应后的溶液在分子量为8000
‑
14000 的透析袋中,在4℃条件下,用去离子水透析12小时。透析后的样品冷冻干燥,获得白蛋白 载硫化锌纳米颗粒。
31.如图1所示,扫描电镜(图1a)和透射电镜(图1b)均显示该纳米颗粒大小约为100nm, 分散性能良好。检测粒径分布发现,在水、生理盐水、pbs、dmem培养基等各种不同液体 中尺度没有发生明显变化,尺度均一(图1c),说明在不同溶液中纳米颗粒性能稳定。利用 场发射扫描电镜进行元素分布和种类分析,表明锌、硫、氮三种元素共同存在(图1d)。如 图1e所示,位于28
°
,47
°
和56
°
的宽衍射峰与闪锌矿硫化锌的峰位匹配,但峰展宽,峰强低, 该纳米颗粒是无定形态。
32.另外,根据需要通过调整原料的配比、反应温度等制备参数,可以获得不同粒径的白蛋 白载硫化锌纳米颗粒,经实验验证,在牛血清白蛋白浓度为8
‑
16mg/ml,醋酸锌溶液浓度为 13.75
‑
27.5mg/ml,硫化钠溶液浓度为18.2
‑
36.4mg/ml的范围内,可以制备获得纳米
颗粒尺度 均一,分散性好,性能稳定的20
‑
200nm的白蛋白载硫化锌纳米颗粒,均可作为制备肿瘤治疗 及免疫治疗制剂。
33.实施例2
34.将实施例1制备获得的白蛋白载硫化锌纳米颗粒分散于ph分别为7.4、6.5和6.0的pbs 溶液中(1mg/ml),37℃下摇动。分别在0.5、1、2、4、6、8、12、24、30、36、48h取2ml 溶液,超滤去除未反应的白蛋白载硫化锌纳米颗粒,防止对h2s测量的干扰。超滤完的溶液 与醋酸锌/醋酸钠混合物(4:1质量比,1ml)混合。混合完后依次加入n,n
‑
二甲基
‑
对苯二胺盐 酸盐、fecl3反应生成亚甲基蓝。室温孵育15分钟后,665nm处检测吸光度。采用na2s标 准曲线测定h2s浓度。
35.如图1f所示,在正常中性的生理条件下,h2s气体几乎不释放,随着酸性条件的增加, h2s气体释放明显增加,说明该纳米颗粒具备在肿瘤酸性微环境中应用的潜能。
36.实施例3
37.细胞层面验证白蛋白载硫化锌纳米颗粒的生物相容性。将白蛋白载硫化锌纳米颗粒与正 常肝细胞aml12共同孵育24和48小时,如图2a所示,即使白蛋白载硫化锌纳米颗粒浓度高达 3.2mg/ml,细胞存活无明显影响,具有良好的细胞相容性。如图2b、c所示,在中性条件下 和ph为6的酸性条件下,随白蛋白载硫化锌纳米颗粒浓度增加,作用时间延长,对肝癌细胞 hepa1
‑
6的杀伤作用明显增加。同时发现酸性环境下该纳米颗粒对hepa1
‑
6的杀伤作用增强, 提示其酸性响应性杀伤肿瘤(图2d)。利用h2s气体荧光探针检测发现白蛋白载硫化锌纳米颗 粒能够引起hepa1
‑
6细胞内h2s气体生成,而且在酸性环境下hepa1
‑
6细胞内h2s气体明显增加, 反映出酸性响应性释放功能因子(图2e)。为了验证白蛋白载硫化锌纳米颗粒的功能因子作用, 相同条件下等量硫化钠和白蛋白载锌纳米颗粒(分别代表h2s气体和锌离子)分别作用于 hepa1
‑
6细胞。流式细胞仪检测发现,白蛋白载硫化锌纳米颗粒显著上调hepa1
‑
6的ros水平 (图2f)。进一步检测发现,白蛋白载硫化锌纳米颗粒能够明显破坏肝癌细胞线粒体膜电位(图 2g),导致肝癌细胞内线粒体dna释放到胞质中(图2h)。冷冻电镜观察发现,正常条件下 hepa1
‑
6细胞内线粒体形态完整,白蛋白载硫化锌纳米颗粒作用后,细胞内线粒体肿胀,线粒 体内嵴缩短、减少,嵴间腔扩张。部分线粒体呈现大泡状结构(图2i)。
38.实施例4
39.在本实施例中通过动物荷瘤模型来验证白蛋白载硫化锌纳米颗粒的治疗作用。选取6周的 雄性c57bl/6小鼠,皮下注射含有5
×
106hepa1
‑
6细胞的200μlpbs。当皮下肿瘤大小为 75
‑
100mm3时作为动物荷瘤模型进行干预。纳米颗粒通过静脉注射方式对荷瘤小鼠进行治疗。 动物分为以下4组:(1)对照组;(2)瘤内注射na2s组;(3)静脉注射白蛋白载锌纳米颗粒组; (4)静脉注射白蛋白载硫化锌纳米颗粒组。第0、3、6、9、12天进行注射治疗,注射剂量为 200μl白蛋白载硫化锌纳米颗粒(5mg/ml)。整个治疗周期为14天,治疗期间每两天测量一次 体重和肿瘤大小。此外,在荷瘤小鼠静脉注射白蛋白载硫化锌纳米颗粒后,第0、2、6、24、 48小时,取主要器官和肿瘤组织,测定锌含量从而观察器官组织分布以及肿瘤靶向性。如图 3a所示,该纳米颗粒主要在肝脏和脾脏分布较多,2小时到达最高值,后逐步下降。说明主 要通过肝脏代谢,同时脾脏分布较多,有利于激活肿瘤免疫。肿瘤部位2小时后的锌含量明显 高于0小时,随着时间的延长,含量缓慢减少,48小时后其锌含量依然高于0小时,
说明该纳 米颗粒具有肿瘤靶向富集性能。在整个治疗周期发现,各组之间小鼠体重差异不大,说明该 纳米颗粒体内生物相容性好(图3c)。如图3b、d、e所示,根据肿瘤照片、生长曲线、肿瘤 质量的结果,na2s与白蛋白载锌纳米颗粒均有一定抑制肿瘤生长效果,白蛋白载硫化锌纳米 颗粒展现出显著的肿瘤治疗效果。此外,在60天的观察期发现,经过白蛋白载硫化锌纳米颗 粒治疗,动物存活率达到90%,而其余组生存率均较低。动物实验说明白蛋白载硫化锌纳米 颗粒具有优异的肿瘤杀伤效果,在肿瘤治疗方面具有重大意义。
40.实施例5
41.白蛋白载硫化锌纳米颗粒治疗体内肿瘤时展现出优异的生物安全性。如图4a
‑
h所示,在 2周的治疗周期后,根据血常规指标(红细胞rbc、白细胞wbc、血小板plt),肝功能指标 (总胆红素tbil、谷草转氨酶ast、谷丙转氨酶alt),肾功能指标(肌酐cre、尿素urea) 观察,经过白蛋白载硫化锌纳米颗粒治疗的小鼠与对照组小鼠之间均无明显差异。根据主要 器官(心,肝,脾,肺,肾)he染色组织切片观察,经过白蛋白载硫化锌纳米颗粒治疗的小 鼠与对照组小鼠之间均无明显差异(图4i)。说明白蛋白载硫化锌纳米颗粒治疗体内肿瘤时展 现出优异的生物安全性。
42.实施例6
43.白蛋白载硫化锌纳米颗粒具有激活肿瘤免疫治疗作用。如图5a,b所示,肝癌细胞hepa1
‑
6 在白蛋白载硫化锌纳米颗粒(3.2mg/ml)作用4小时和8小时后,qpcr检测cgas/sting信号 通路下游靶基因ifnb1和isg56的mrna水平,随着该纳米颗粒作用时间的增加,ifnb1和isg56 的mrna水平显著提高。白蛋白载硫化锌纳米颗粒(3.2mg/ml)作用肝癌细胞12小时后,elisa 检测细胞因子,发现ifnβ和cxcl10也明显增加(图5c)。同时发现,白蛋白载硫化锌纳米颗 粒(3.2mg/ml)作用12小时后,cgas/sting信号通路的tbk1和sting磷酸化水平在增加最 显著(图5d)。对实施例4中经过各治疗分组治疗后的肿瘤组织进行检测,同样发现ifnb1和isg56 的mrna水平在该纳米颗粒作用下显著提高(图5e),细胞因子ifnβ和cxcl10明显增加(图 5f)。肿瘤组织水平检测tbk1和sting磷酸化水平,发现该纳米颗粒作用后,磷酸化水平同 样显著提高(图5g)。利用流式细胞仪对肿瘤组织进行杀伤型t细胞浸润检测,发现该纳米颗 粒作用下,肿瘤组织内杀伤型t细胞浸润程度明显增加(图5h、i)。说明白蛋白载硫化锌纳 米颗粒具有激活肿瘤cgas/sting信号通路的作用,从而激活肿瘤免疫治疗。
44.实施例7
45.白蛋白载硫化锌纳米颗粒能够激活肿瘤免疫抑制肿瘤复发转移。荷瘤小鼠(同实施例4) 分为以下4组:(1)对照组;(2)瘤内注射na2s组;(3)静脉注射白蛋白载锌纳米颗粒组;(4) 静脉注射白蛋白载硫化锌纳米颗粒组。对照组小鼠第0天手术切除皮下肿瘤,其余小鼠第0、3、6、9、12天进行注射治疗,注射剂量为200μl白蛋白载硫化锌纳米颗粒(5mg/ml)。14天治疗 后,第21天进行另一侧皮下成瘤(注射含有5
×
106hepa1
‑
6细胞的200μlpbs),用来表示肿瘤 的复发转移。二次成瘤观察3周。如图6a
‑
c所示,根据肿瘤照片,肿瘤生长曲线,肿瘤质量, 经过白蛋白载硫化锌纳米颗粒治疗后的二次成瘤的肿瘤生长明显被抑制。免疫组化对肿瘤组 织染色,绿色荧光代表cd3,红色荧光代表cd8,杀伤型t细胞cd3cd8双阳性,发现该纳米 颗粒治疗后肿瘤组织杀伤型t细胞明显浸润。肿瘤组织也有明显坏死(图6d)。说明白蛋白载 硫化锌纳米颗粒能够激活肿瘤免疫抑制肿瘤复发转移。
46.显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所 属领域的普通技术人员来说,在上述说明的基础上还可以做出其他不同形式的变化或变动。 这里无需也无法把所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处 于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1