一种电极及其制备方法和应用
1.本发明属于生物电极技术领域,具体涉及一种电极及其制备方法和应用。
背景技术:
2.随着老龄化人口的逐渐增加,越来越多的人正遭受神经系统性疾病的侵害。神经接口作为一种新兴的,诊断、治疗上述疾病的手段,受到了医生和研究人员的青睐,其正在神经学相关研究领域发挥着举足轻重的作用。神经电极是神经接口中直接与神经组织接触的部分,不仅可以记录神经元的电生理活动,将记录信号作为神经性疾病诊断的依据;也可以从外部,给神经组织施加一个特定幅值和频率的电信号,以用于刺激并激活神经元活动,从而改善神经的功能障碍。
3.目前,常用的金属电极可以分为金属微丝电极(如钨、铂铱电极等)以及硅基金属微电极阵列(如犹他电极和密歇根电极等)。这些电极虽然取得了一定的成功,但也存在一些问题:1、电极材料与神经组织之间机械性能不匹配,电极在长期植入神经组织后,会受到严重的组织反应而导致不能正常工作,需要二次手术将其取出,这增加了患者的身体和经济负担;2、信号灵敏度以及生物安全等有待提高;3、贵金属电极具有原料稀缺、成本较高、难以大规模制备及应用的特点;微电极阵列制备工艺繁琐、结构复杂。
4.综上,现有的神经接口用的电极,存在价格高昂、制备工艺复杂,且生物相容性差的问题。
技术实现要素:
5.本发明旨在至少解决上述现有技术中存在的技术问题之一。为此,本发明提出一种电极,以铝微丝替代其他贵金属微丝电极,降低了成本;将铝微丝与导电聚合物涂层相结合,提升了电极与生物体之间的相容性。
6.本发明还提出一种具有上述电极的制备方法。
7.本发明还提出一种包括上述电极或由上述制备方法制备所得的电极的神经检测装置。
8.根据本发明的一个方面,提出了一种电极,包括:
9.铝微丝,所述铝微丝,直径在25~127μm之间;
10.导电聚合物涂层,所述导电聚合物涂层包裹于所述铝微丝表面,组分包括聚吡咯和聚(3,4
‑
乙烯二氧噻吩)中的至少一种。
11.根据本发明的一种优选的实施方式,至少具有以下有益效果:
12.(1)相较于传统的贵金属微丝电极,本发明以铝微丝为主要基材,由于铝本身具有良好的韧性、延展性和导电性,因此可获得与贵金属微丝电极相当的电性能;同时,由于原料价格低廉,因此降低了电极的原料成本。
13.(2)相较于传统的微电极阵列,本发明提供的电极,结构简单,因此简化了制备工艺,提升了所得电极的良率。
14.(3)相较于裸露的金属电极(包括金属微丝电极和微电极阵列),本发明提供的电极,由于表面修饰了导电聚合物涂层,因此可实现电极在生物体内的长期植入并保持性能稳定,此外,导电聚合物涂层可有效提高电极与生物组织之间的机械匹配度、生物相容性与生理电化学性能。
15.(4)导电聚合物涂层可显著提升铝微丝的电荷存储能力、降低其阻抗,并显著提升其稳定性与生物相容性。
16.在本发明的一些实施方式中,所述电极,为生物电极。
17.在本发明的一些优选的实施方式中,所述生物电极,包括神经电极。
18.所述生物电极或神经电极,可用于sd大鼠大脑前额叶皮层的神经信号提取中。
19.在本发明的一些实施方式中,所述铝微丝,材质中铝的质量分数≥99.99%。
20.在本发明的一些实施方式中,所述导电聚合物涂层,组分包括聚吡咯。
21.在本发明的一些实施方式中,所述导电聚合物涂层,厚度为5~31μm。
22.在本发明的一些实施方式中,所述电极,还包括连接件,所述连接件的一端与所述铝微丝相连,另一端与外部设备相连。
23.在本发明的一些实施方式中,所述连接件,包括与所述外部设备直接相连的探针、与所述铝微丝直接相连的铜带,以及连接所述探针和所述铜带的导线。在本发明的一些实施方式中,所述探针,材质为铜。
24.在本发明的一些实施方式中,所述探针,直径为0.6
‑
1.6mm,全长为6
‑
16mm。
25.在本发明的一些优选的实施方式中,所述探针,直径约为1mm,全长约为10mm。
26.在本发明的一些优选的实施方式中,所述导线,材质为纯度≥99.99%的银。
27.在本发明的一些实施方式中,所述导线,由一至多股银丝缠绕而成。
28.在本发明的一些优选的实施方式中,所述导线,由2股银丝缠绕而成。
29.在本发明的一些实施方式中,所述银丝,直径为0.4
‑
0.9mm。
30.在本发明的一些优选的实施方式中,所述银丝,直径约为0.64mm。
31.由于铝微丝尺寸小,同时由其形成的电极需植入生物体,尺寸要求较为精细;因此需以所述铜带固定后,再与导线相连。
32.所述连接件中,由于铜(探针)和银(导线)的电导率较高,同时银具有耐腐蚀的特性,因此可提升所述电极的精度与使用寿命。
33.所述连接件中,所述探针、导线和铜带的尺寸与外部设备(电生理测量装置的夹具)相匹配。
34.根据本发明的再一个方面,提出了所述的电极的制备方法,包括以下步骤:
35.s1.将所述铝微丝进行表面处理;
36.s2.在步骤s1所得铝微丝表面沉积所述导电聚合物涂层。
37.根据本发明的一种优选的实施方式的制备方法,至少具有以下有益效果:
38.不同生物体,或同一生物体不同部位,对生物电极的尺寸等参数的要求均不相同;本发明提供的制备方法适用范围广,可以通过调整铝微丝原料的尺寸、调整步骤s2中的沉积工艺,即可获得具有不同直径铝微丝,和不同厚度、致密度导电聚合物涂层的电极,从而满足相应的植入方案。
39.在本发明的一些实施方式中,步骤s1中,所述铝微丝,经连接件与外部设备相连。
40.在本发明的一些实施方式中,步骤s1中,所述表面处理,方法为电化学法。
41.在本发明的一些实施方式中,所述电化学法,为恒电流法。
42.在本发明的一些实施方式中,所述恒电流法,电解液为第一混合水溶液,所述第一混合水溶液中,溶质包括硝酸和吡咯。
43.在本发明的一些实施方式中,所述第一混合水溶液中,硝酸的浓度为0.05
‑
0.15m,所述吡咯的浓度为0.05
‑
0.15m。
44.在本发明的一些优选的实施方式中,所述第一混合水溶液中,硝酸的浓度约为0.1m,所述吡咯的浓度约为0.1m。
45.述第一混合水溶液中,所述硝酸的作用是提供蚀刻铝丝表面所需的质子(氢离子),所述吡咯的作用是吸附在蚀刻的铝丝表面以在下一步的聚合沉积过程中充当聚合中心。
46.根据扫描电镜的观察,在步骤s1中没有形成明显的聚吡咯沉积。
47.在本发明的一些实施方式中,所述恒电流法,电流在50~500μa之间。
48.在本发明的一些实施方式中,所述恒电流法,处理时间为60~120s。
49.在本发明的一些优选的实施方式中,所述恒电流法,处理时间约为90s。
50.步骤s1中,所述表面处理,作用是使所述铝微丝形成粗糙表面,以便于步骤s2中导电聚合物的沉积。
51.在本发明的一些实施方式中,步骤s2中,所述导电聚合物涂层,沉积方法为电沉积。
52.在本发明的一些实施方式中,所述电沉积,方法为循环伏安法。
53.在本发明的一些实施方式中,所述循环伏安法,电解液为第二混合水溶液,所述第二混合水溶液中,溶质包括草酸和聚合物单体。
54.在本发明的一些实施方式中,所述聚合物单体包括吡咯和3,4
‑
乙烯二氧噻吩中的至少一种。
55.在本发明的一些实施方式中,所述第二混合水溶液中,所述草酸的浓度为0.05
‑
0.15m,所述单体的浓度为0.25
‑
0.75m。在本发明的一些优选的实施方式中,所述第二混合水溶液中,所述草酸的浓度约为0.1m,所述单体的浓度约为0.5m。
56.在本发明的一些实施方式中,所述循环伏安法,扫描电压的起始值约为
‑
0.1v,终止值在2.0~3.0v之间。
57.在本发明的一些实施方式中,所述循环伏安法,扫描电压的范围为
‑
1.0~2.0v;
‑
1.0~2.5v;
‑
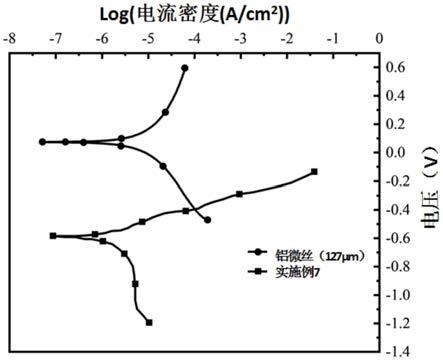
1.0~3.0v中的一种。
58.在本发明的一些实施方式中,所述循环伏安法,扫描速率在5~100mv/s之间。
59.在本发明的一些实施方式中,所述循环伏安法,扫描速率为5mv/s、25mv/s;50mv/s;100mv/s中的一种。
60.在本发明的一些实施方式中,所述循环伏安法,循环圈数在5~20圈之间。
61.在本发明的一些实施方式中,所述循环伏安法,循环圈数为5圈;10圈;20圈中的一种。
62.在本发明的一些实施方式中,所述电化学法和所述电沉积,均采用三电极体系进行。
63.在本发明的一些实施方式中,所述三电极体系,工作电极为所述铝微丝,对电极为铂丝电极,参比电极为ag/agcl。
64.根据本发明的再一个方面,提出了一种神经检测装置,所述神经检测装置包括所述电极或所述制备方法制备所得的电极。
65.在本发明的一些实施方式中,所述神经检测装置可以进行神经信号检测。
66.在本发明的一些实施方式中,所述神经检测装置也可以对所接触的神经给予信号刺激。
附图说明
67.下面结合附图和实施例对本发明做进一步的说明,其中:
68.图1为本发明实施例1步骤d1所得部件图;
69.图2为本发明实施例1~8所用铝微丝原料的sem图;
70.图3为本发明实施例1~3所得电极的sem图;
71.图4为本发明实施例3~5所得电极的sem图;
72.图5为本发明实施例3、6和8所得电极的sem图;
73.图6为本发明实施例9~18所用铝微丝原料的sem图;
74.图7为本发明实施例9~11所得电极的sem图;
75.图8为本发明实施例11~13所得电极的sem图;
76.图9为本发明实施例9、14~15所得电极的sem图;
77.图10为本发明实施例1~3所得电极的cv图和eis图谱;
78.图11为本发明实施例3~5所得电极的cv图和eis图谱;
79.图12为本发明实施例3、6~7所得电极的cv图和eis图谱;
80.图13为本发明实施例9~11所得电极的cv图和eis图谱;
81.图14为本发明实施例11~13所得电极的cv图和eis图谱;
82.图15为本发明实施例9、14~15所得电极的cv图和eis图谱;
83.图16为本发明实施例16所用铝微丝原料与所得电极的eis图;
84.图17为本发明对比例1所得电极的cv图;
85.图18为本发明实施例7所用铝微丝原料与所得电极的极化曲线;
86.图19为本发明实施例7所用铝微丝原料与所得电极的体外细胞毒性实验结果,(a)大鼠成纤维细胞3t3,(b)pc12细胞;
87.图20为本发明实施例7所用铝微丝原料与所得电极的与3t3细胞共培养24h后的活细胞/死细胞染色结果;
88.图21为本发明实施例7所用铝微丝原料与所得电极植入大鼠大脑皮层中所提取的神经信号,(a)铝微丝原料,(b)实例7所得电极;
89.附图标记:
90.100、导电聚合物涂层;200、铝微丝;300、铜带;400、导线;500、探针;600、焊点。
具体实施方式
91.以下将结合实施例对本发明的构思及产生的技术效果进行清楚、完整地描述,以
充分地理解本发明的目的、特征和效果。显然,所描述的实施例只是本发明的一部分实施例,而不是全部实施例,基于本发明的实施例,本领域的技术人员在不付出创造性劳动的前提下所获得的其他实施例,均属于本发明保护的范围。
92.在本发明的描述中,如果有描述到第一、第二只是用于区分技术特征为目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量或者隐含指明所指示的技术特征的先后关系。除非另有明确的限定,设置、安装、连接等词语应做广义理解,所属技术领域技术人员可以结合技术方案的具体内容合理确定上述词语在本发明中的具体含义。
93.实施例1
94.本实施例制备了一种电极,具体过程为:
95.d1.以铜带将直径为127μm的铝微丝200固定好,按照铜带300与银导线400连接,银导线与铜探针500通过锡焊形成的焊点600相接,铜探针500与外部设备相接;
96.d2.以步骤d1所得部件铝微丝一侧作为工作电极,铂丝电极作为对电极,ag/agcl作为参比电极,采用恒电流法,活化铝微丝;
97.其中恒电流法中,采用的电流为500μa;
98.活化时间为90s;
99.电解液为硝酸和吡咯形成的混合水溶液,其中硝酸浓度为0.1m,吡咯浓度为0.1m;
100.活化铝微丝后,以去离子水冲洗铝微丝(至少三次)并干燥;
101.d3.以步骤d2所得部件铝微丝一侧作为工作电极,铂丝电极作为对电极,ag/agcl作为参比电极,采用循环伏安法,在步骤d2所得铝微丝表面沉积导电聚合物涂层100;
102.其中循环伏安法中,扫描电压范围为
‑
1.0~2.0v;扫描速率为50mv/s;扫描圈数为10圈;
103.所用电解液为草酸和吡咯形成的混合水溶液,其中草酸的浓度为0.1m,吡咯的浓度为0.5m。
104.本实施例步骤d1所得部件如图1所示。
105.实施例2~实施例18分别制备了一种电极,具体与实施例1的区别为,各步骤的参数不同,具体参数如表1所示,其中(d1)表示该参数对应于步骤d1。
106.表1实施例1~16所用参数表
[0107][0108][0109]
对比例1
[0110]
本对比例制备了一种电极,具体过程与实施例1的区别为:
[0111]
t1.以铜带将直径为127μm的铝微丝固定好,按照铜带与银导线连接,银导线与铜探针通过锡焊形成的焊点相接,铜探针与外部设备相接;
[0112]
d2.以步骤d1所得部件铝微丝一侧作为工作电极,铂丝电极作为对电极,ag/agcl作为参比电极,在铝微丝表面沉积1μm的铝;其中电解液为0.1m氯化铝和0.1m甲酸的混合水溶液;
[0113]
d3.以步骤d2所得部件铝微丝一侧作为工作电极,铂丝电极作为对电极,ag/agcl作为参比电极,采用恒电压法,在步骤d2所得铝微丝表面沉积导电凝胶软界面;
[0114]
其中恒电压法中,电压为0.05v;沉积时间为5h;电解液选用2wt%的ppy:pss电解液。
[0115]
试验例1
[0116]
本试验例检测了实施例所用铝微丝原料和所得电极的形貌;形貌测试方法为扫描电镜法。
[0117]
实施例1~8所用铝微丝原料的形貌如图2所示;
[0118]
实施例9~16所用铝微丝原料的形貌如图6所示,图中信息显示,未经任何处理的铝微丝,有较为光滑形貌,表面无颗粒状涂层附着,与实施例所得电极的形貌对比可知,本发明提供的制备方法,确可将聚吡咯涂层附着于铝微丝表面。
[0119]
实施例1~3所得电极的形貌如图3所示(铝微丝直径127μm),实施例9~11所得电极的sem图如图7所示(铝微丝直径25μm);分别对应循环伏安法的不同终止电压;结果显示:通过循环伏安法制备的聚吡咯涂层表面呈类似菜花的微细结构,且较为粗糙,具有一定的微纳层级结构,随着循环伏安法终止扫描电压的提升,铝微丝表面的聚吡咯涂层厚度逐渐提升,同时,聚吡咯涂层的表面粗糙度提升,颗粒感增强。各实施例中聚吡咯涂层的平均厚度如下:实施例1中7.7μm、实施例2中8.0μm、实施例3中8.7μm、实施例9中5.5μm、实施例10中15.0μm、实施例11中15.5μm,
[0120]
实施例3~5所得电极的形貌如图4所示(铝微丝直径127μm),实施例11~13所得电极的sem图如图8所示(铝微丝直径25μm);分别对应循环伏安法的不同循环圈数;结果显示:图4中的形貌与图3中的形貌类似,随着循环伏安法循环圈数的提升,铝微丝表面的聚吡咯涂层厚度逐渐提升,同时,聚吡咯涂层的表面粗糙度提升,颗粒感增强。各实施例中,聚吡咯涂层的平均厚度如下:实施例4中5.6μm、实施例3中8.7μm、实施例5中9.0μm。
[0121]
实施例3、实施例6和实施例8所得电极的形貌如图5所示(铝微丝直径127μm),本发明实施例9、14~15所得电极的sem图如图9所示(铝微丝直径25μm);分别对应循环伏安法不同扫描速度;结果显示,图5中的形貌与图3中的形貌类似,随着循环伏安法扫描速度的提升,铝微丝表面的聚吡咯涂层厚度逐渐减小,同时,聚吡咯涂层的表面粗糙度下降,颗粒感减弱。各实施例中聚吡咯涂层的厚度为:实施例8中30.5μm、实施例3中8.7μm,实施例6中7.4μm。
[0122]
综上,通过控制cv的电压范围、扫描圈数和扫描速率等,可以轻松制备不同厚度的聚吡咯涂层。
[0123]
试验例2
[0124]
本试验例首先进行了实施例和对比例所得电极的cv(循环伏安)和和eis(交流阻抗)测试,具体的测试方法如下:
[0125]
cv测试,扫描电压为
‑
0.8~0.8v,扫描速率为100mv/s,扫描圈数为5圈;
[0126]
eis测试的频率范围为10~100000hz,电压为0v,振幅为10mv;
[0127]
cv和eis测试均采用三电极体系,实施例所制备的电极分别作为工作电极、铂丝电极作为对电极、ag/agcl电极作为参比电极,电解质溶液为模拟体液(pbs溶液(磷酸盐平衡生理盐水),ph=7.0)。
[0128]
具体结果如图10~17所示;结果显示,实施例所得电极的cv图谱均显示较为优异的生理电化学性能;但是对比例1所得的电极,在铝基微丝表面形成的导电凝胶软界面并不连续,肉眼可见银白色的裸露铝部分;cv图谱(图17)也可以看出,对比例1所得电极的循环伏安曲线的首尾不相接、而且在正负电压方向转换时产生了迟滞现象,表明此涂层的稳定性和电化学可逆性均较差。在测试结束时,发现位于工作电极的涂层铝基微丝存在断裂现象,也反映出由此工艺制备的电极的稳定性较差。
[0129]
然后,对于本发明制备所得的可植入神经电极来说,其生理电化学性能的好坏决
定了其对神经组织信号提取和刺激的能力,即神经电极应该具有更高的阴极电荷存储能力(csc
c
)以及更低的阻抗(ei)。试验结果显示,当cv电压范围为
‑
1.0~3.0v、扫描速率为25mv/s、扫描圈数为10圈时(实施例7和实施例11),各实施例所制备的电极具有最佳的生理电化学性能,如表2所示,其中,
[0130]
第二列中,q表示的含义是阴极电量与扫速的乘积,等号右边是该参数的计算公式;
[0131]
第三列中,q(c)表示的含义是阴极电量,单位是库伦(c),等号右边是该参数的计算公式;
[0132]
第四列中,a(cm2)表示的含义是工作电极的几何表面积,单位是cm2;
[0133]
最后一列中,ei at 1khz(ω)表示的含义是,当交流频率为1khz时,所得电极的阻抗,单位是ω,测试方法参照文献“m.r.abidian et al.,adv.mater.,2009,21,3764
‑
3770”,其中标准密歇根式神经电极的阻抗为841
±
7kω。
[0134]
csc
c
值可参考文献“s.f.cogan,annu.rev.biomed.eng.,2008,10,275
‑
309.”中公开的方法进行测试,其中标准tin、pt和溅射氧化铱电极的csc
c
分别为0.25、0.55、2.8mc cm
‑2。
[0135]
表2实施例所得电极的生理电化学性能结果
[0136][0137]
此外,图16所示结果还显示,在任何频率下,实施例16所得电极的阻抗值,均低于实施例16所用铝微丝原料的阻抗,这说明聚吡咯涂层不仅可以提高铝微丝的抗腐蚀能力同时还可有效提升其生理电化学性能。
[0138]
试验例3
[0139]
本试验例采用动态电压法对未涂层铝微丝(实施例7所用铝微丝原料)和实施例7所得电极进行极化曲线测试,以评价实施例7所得电极的抗腐蚀能力,测试方法包括下列步骤:
[0140]
采用三电极体系,实施例7所得电极作为工作电极,铂丝电极作为对电极,ag/agcl电极作为参比电极,电解质溶液为ph=6.5的人工脑脊液;动态电压范围为
‑
0.6~0.6v,扫描速率为5mv/s。
[0141]
从图18的极化曲线结果可以看到,由于聚吡咯涂层的存在,铝微丝在人工脑脊液中的腐蚀电流密度从5.01μa/cm2下降到了3.16μa/cm2,并计算得到腐蚀速率从5.46
×
10
‑2mm/year降到了3.44
×
10
‑2mm/year,这说明聚吡咯涂层可以有效减缓铝微丝的腐蚀速率,从而有利于增强铝微丝电极的植入稳定性。
[0142]
试验例4
[0143]
本试验例测试了实施例所得电极的生物相容性。具体为:
[0144]
首先将未涂层铝微丝(实施例7所用铝微丝原料)和实施例7所得电极,分别与3t3细胞或者pc12细胞体外共培养24h,以评价电极的生物相容性。具体评价方法包括以下步骤:
[0145]
1)将铝微丝和电极在去离子水中浸泡一周以去除材料表面的杂质和未反应的单体等;期间每天至少更换三次去离子水;最后将清洗干净的铝微丝和电极放置在30℃烘箱中过夜干燥;
[0146]
2)将干燥的铝微丝和电极裁剪成长为2mm的短棒,并在紫外光下灭菌12h;
[0147]
3)将3t3或者pc12细胞接种在96孔板中,并在37℃,5%co2的环境的培养箱中培养24h;
[0148]
4)将步骤3)所得的2mm长的铝微丝或电极加入到3t3细胞或者pc12细胞的孔板中共培养24h,采用cck
‑
8法得出测试结果并且对3t3细胞进行活细胞/死细胞染色以观察细胞的最终形态。
[0149]
体外细胞实验结果如图19所示,其中图a表示对大鼠成纤维细胞3t3的试验结果,图b表示对pc12细胞的试验结果;结果表明:与空白对照组相比,未涂层的铝微丝对3t3细胞和pc12细胞均显示出一定的毒性,但是引入聚吡咯涂层后的电极显著提高了铝微丝的细胞相容性,使得3t3和pc12的细胞存活率均在95%以上;
[0150]
图20是细胞染色试验结果,其中按行看,第一行是对照组,即单纯的细胞培养,未加铝微丝或电极,第二行中添加了2mm长的铝微丝,第三行添加了2mm长的电极;按列看,第一列是活细胞的染色结果,第二列是死细胞的染色结果,第三列是所有细胞的染色结果;
[0151]
图20中的细胞染色实验也证明了上述观点,与铝微丝原料相比,引入聚吡咯涂层的电极,与细胞共同培养后,细胞的存活数量更高,说明其与细胞的生物相容性更高,且未抑制其增值;其中图20中白色标尺的尺寸为100μm。
[0152]
之后,将实施例7所用铝微丝原料和所得电极分别植入到sd大鼠的大脑皮层进行神经信号的提取,所得信号结果如图21所示,结果表明,与铝微丝原料相比(图21a),当实施例7所得电极(图21b)用于sd大鼠神经信号的提取时,具有更高的清晰度和信噪比。
[0153]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于上述实施例,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下作出各种变化。此外,在不冲突的情况下,本发明的实施例及实施例中的特征可以相互组合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1